Method Article
多能性幹細胞からのヒト血管オルガノイドの作製
要約
このプロトコルは、ヒト多能性および人工多能性幹細胞からの自己組織化血管の生成を記載する。これらの血管ネットワークは、周皮細胞、平滑筋アクチン、および連続した基底膜に囲まれた広範で接続された内皮ネットワークを示します。
要約
オルガノイドは、対応するin vivo器官を模倣した操作された多細胞in vitro組織として定義され、組織培養皿でその器官の定義された側面を研究するために使用できます。ヒト多能性幹細胞(hPSC)由来のオルガノイド研究の幅と応用は、脳、網膜、涙管、心臓、肺、腸、膵臓、腎臓、血管など、いくつかの組織を含むように大幅に進歩しています。ヒト微小血管の生成方法の開発、特に、ヒト血管の発生と疾患のin vitroでのモデリング、およびSARS-CoV-2を含むウイルス感染における新薬または組織向性の試験と分析への道が開かれました。視覚的なガイダンスがない複雑で長いプロトコルは、多くの幹細胞由来オルガノイドの再現性を妨げます。さらに、オルガノイド形成プロセスと自己組織化の固有の確率性は、細胞運命の獲得とプログラミングの理解を進めるための光学プロトコルの生成を必要とします。ここでは、hPSCから操作された3Dヒト血管オルガノイド(BVO)を生成するための視覚誘導プロトコルが提示されています。連続した基底膜、血管内皮細胞、および壁細胞との組織化された関節を示すBVOは、ヒト微小血管系の機能的、形態学的、および分子的特徴を示します。BVO形成は、凝集体形成によって開始され、続いて中胚葉および血管誘導が続く。血管の成熟とネットワーク形成は、3Dコラーゲンと可溶化された基底膜マトリックスに凝集体を埋め込むことによって開始され、サポートされます。ヒト血管ネットワークは2〜3週間以内に形成され、スケーラブルな培養システムでさらに成長させることができます。重要なことに、免疫不全マウスに移植されたBVOは、内因性マウス循環で吻合し、機能的な動脈、静脈、および細動脈に特異的です。現在の視覚誘導プロトコルは、特に正常な発達、組織血管新生、および疾患における血管に関連して、ヒトオルガノイド研究を前進させます。
概要
血管機能障害および血管疾患は、臓器機能に著しい合併症を呈します。心血管疾患(CVD)は、世界の主要な死因であり1、米国の医療費の増加の主な要因でもあります。CVDの症例数は年々増加しており、これらの症例の数は若い年齢層(20〜45歳)で発生しています2。血管の発生と成熟、血管疾患、および内皮機能障害を調べるために、複数のin vivoモデルが開発されています3,4。現在、幹細胞に由来する、またはin vivoで成人組織から単離された単一および複数の系統で定義された細胞を組み合わせる方法は、ヒトの血管機能と解剖学的構造の側面を再現する血管ネットワークを作成することができます5,6。血管は、中胚葉からの発生中に最初の機能システムの1つとして出現し、「血管形成」と呼ばれる組み立てのプロセス、または「血管新生」と呼ばれる既存の血管からの拡張と分岐のいずれかによって組織化されます7。
発生生物学と自主的な組み立ての力を活用して、Wimmerらは、ヒト微小血管系の機能的、形態学的、および分子的特徴を示すhPSCからの最初の自己組織化3Dヒト血管オルガノイドを報告しました8。ヒト血管系9と同様に、これらのhBVOは、内皮、連続基底膜、および周囲の壁細胞とともに生成され、存在する8、10。hBVOはin vivoで移植し、内因性循環で吻合することができます。また、in vitroで成熟し、心血管疾患(糖尿病など)8やSARS-CoV-2などのウイルス感染における組織向性のモデルとしても機能します11。以前にプロトコル10を公開しましたが、この複雑な手法に使用できるビデオプロトコルはありません。
簡潔な段階的進行により、hBVO形成は、凝集体形成、WNTアゴニストであるカイロン(CHIR99021)および骨形態形成タンパク質-4(BMP4)12,13を使用した中胚葉誘導、血管内皮増殖因子A(VEGFA)およびフォルスコリン(Fors)12を介した血管誘導、およびカスタム発芽マトリックスへの埋め込みによって達成されます8,10.血管の成熟およびネットワーク形成は、発芽マトリックスへの凝集体の埋め込みに従う。これらのヒト血管ネットワークは2〜3週間以内に形成され、発芽マトリックスから除去され、スケーラブルな培養システムで最大6か月間さらに成長させることができます。ここでは、ヒト幹細胞由来血管系の形成および適用のための光学ガイド下手順が提供される。
プロトコル
本明細書において行う全ての実験は、市販のH9ヒトiPSC株を用いた。一般的な市販および非市販のヒト多能性幹細胞株(すなわち、H9、NC8)も、このプロトコルを使用してヒト血管オルガノイドの生成に有効であることがテストされ、証明されています。詳細については、以前に公開されたレポート8,10を参照してください。
1. ヒト血管オルガノイド作製のための培地および試薬製剤
- 凝集媒体を準備します。
- 40 mLのノックアウトDMEM / F12(ヒトESCおよびiPS細胞増殖用に最適化されたL-グルタミンまたはHEPESバッファーを含まない低浸透圧培地)、10 mLのノックアウト血清代替品(KOSR)、0.5 mLの200 mM L-アラニル-L-グルタミンジペプチドを0.85%NaClに、0.5 mLの非必須アミノ酸(NEAA)、35 μLのベータメルカプトエタノール(BME、10 mLの滅菌PBSに100 μLの2-メルカプトエタノール)を混合します。 Y-27632(プロテインキナーゼ[ROCK]14 [10 mM]を含むRho関連コイルドコイルの細胞透過性および選択的阻害剤)( 材料表を参照)。
- N2B27(N2およびB27補給基本培地)を準備します。
- 25 mLのDMEM/F12、25 mLの神経基底培地、1 mLのB27サプリメント、0.5 mLのN2サプリメント、250 μLの200 mM L-アラニル-L-グルタミンジペプチドを0.85%NaCl中、および35 μLのβ-メルカプトエタノールを混合します( 材料の表を参照)。
- 中胚葉誘導培地を調製する。
- N2B27培地にChiR(12 μM、中胚葉誘導を刺激するGSK3a/b阻害剤)およびBMP-4(30 ng/mL、中胚葉系譜を誘導するMSX2活性化因子)を補充します。
注: ストック (ChiR): 10 mM (1:833 または 1.2 μL/mL N2B27 を使用)。ストック(BMP-4):100 μg/mL(1:3333または0.3 μL/mL N2B27を使用)( 材料表参照)。
- N2B27培地にChiR(12 μM、中胚葉誘導を刺激するGSK3a/b阻害剤)およびBMP-4(30 ng/mL、中胚葉系譜を誘導するMSX2活性化因子)を補充します。
- 血管誘導培地を調製する。
- N2B27培地にVEGFA(100 ng/mL)およびフォルスコリン(2 μM)を補充します( 材料表参照)。
- 細胞外マトリックス(ECM)を準備します。
- 12ウェルプレートの1ウェルに1 mLのECMを使用します(30〜50個の凝集体を包埋するため)。各ウェルに使用した1 mLのECM溶液のうち、0.5 mLを使用してECMファンデーションとして機能する最下層「レイヤー1」を作成し、最上層「レイヤー2」に0.5 mLプラス凝集体を作成します。このアプローチを使用すると、ECMサスペンションを介して、人間の血管ネットワークがあらゆる方向に発芽するのに十分なスペースとサポートが提供されます。
注:全体として、1 mLのECMには、500 μLの精製ウシコラーゲンタイプI、250 μLのEngelbreth-Holm-Swarmマウス肉腫細胞によって分泌される可溶化基底膜マトリックス( 材料の表を参照)、および250 μLの基本マトリックス溶液(ステップ1.5.2)が含まれています。新鮮に準備し、使用する準備ができるまで氷の上に保管してください。 - 4つの12ウェルプレート(48ウェル)用の基本マトリックス溶液を調製するには、5.627 mLの0.1 N NaOH、2.498 mLの10x DMEM、473 μLのHEPES、368 μLの7.5%重炭酸ナトリウム、233 μLの200 mM L-アラニル-L-グルタミンジペプチドを0.85%NaCl中、および3.451 mLのHam's F-12と混合します( 材料の表を参照)。
注:残りの基本マトリックス溶液は、キャップ付きの50 mL高透明度ポリプロピレンコニカルチューブに入れ、4°Cで保存して最大2か月間使用できます。
- 12ウェルプレートの1ウェルに1 mLのECMを使用します(30〜50個の凝集体を包埋するため)。各ウェルに使用した1 mLのECM溶液のうち、0.5 mLを使用してECMファンデーションとして機能する最下層「レイヤー1」を作成し、最上層「レイヤー2」に0.5 mLプラス凝集体を作成します。このアプローチを使用すると、ECMサスペンションを介して、人間の血管ネットワークがあらゆる方向に発芽するのに十分なスペースとサポートが提供されます。
- 発芽培地を準備します。
- 具体的には、ヒト造血細胞の発生をサポートする50 mLのフレキシブル無血清培地(SFM)、1.3 mLの柔軟な無血清培地栄養補助食品、15%ウシ胎児血清(FBS)、250 μLのペニシリン-ストレプトマイシン、500 μLの200 mM L-アラニル-L-グルタミンジペプチドを0.85%NaCl、VEGFA(100 ng/mL)、およびFGF2(100 ng/mL)に配合します( 材料表を参照)。
- ブロッキング バッファーを準備します。
- ウシ血清アルブミン0.5 g、ウシ胎児血清1.5 mL、トゥイーン20250 μL、Triton X-100 250 μL、デオキシコール酸ナトリウム500 μL(1%wt/volストック)、および47.5 mLの1xリン酸緩衝生理食塩水を混合します( 材料の表を参照)。すべての成分が十分に組み込まれ、溶液が透明になるまで、上下にピペットで移動します。
2. ヒト多能性・人工多能性幹細胞の維持と培養
- 幹細胞培養培地でLDEVフリーの還元増殖因子基底膜マトリックス(1:50希釈)でコーティングされた6ウェル組織培養プレートを使用して細胞培養を行います( 材料表を参照)。
- 細胞が~70%コンフルエントに達したら、1 mLの哺乳類細胞解離酵素( 材料表を参照)を使用して37°Cで3〜4分間継代します。
注:細胞を1:6の比率で分割すると、細胞の生存率が向上し、ほとんどのヒト幹細胞株で2〜4日以内にコンフルエントが達成されます。細胞生存率を高めるために、ROCK阻害剤Y-27632を添加した(10 mM、1:1,000)培養培地を継代後24時間使用します。 - 70%のコンフルエントに達するまで、培養液を毎日交換します。
注:本研究では、70%コンフルエントで、6ウェル細胞培養プレートの1ウェルに約100万個のH9 hPSCが含まれています。
3. 0日目 - 単一細胞懸濁液からの多能性凝集体の生成
注:6ウェル培養プレートの2つのウェルで70%のコンフルエンシーを得ると、約175 hBVOが得られます。
- ピペットまたは真空システムのいずれかを使用して、培養液を吸引し、1 mLの細胞解離試薬( 材料表を参照)と交換し、37°Cで5分間インキュベートします。
- 細胞が細胞解離試薬の下にある間に、6ウェル超低付着培養プレートで、必要な数のウェルに必要な量の凝集培地(ステップ1.1)を必要に応じて15 mLコニカルチューブに調製します( 材料表を参照)。
- 1 mLの細胞解離試薬を吸引し、細胞を1 mLの凝集培地に懸濁する。サンプルをカウントする前に、穏やかなアップダウンピペッティングで単一細胞懸濁液を作成します。
注意:hPSCは機械的ストレスに非常に敏感であり、積極的なピペッティングには耐えられません。 - 顕微鏡下で自動細胞計数装置10 または標準化システムを用いて細胞を計数する。実験に必要な細胞数を計算します。
注:細胞株によっては、200,000細胞/ウェルから300,000細胞/ウェルが凝集体形成に理想的であると考えられています(すなわち、4ウェル= 合計で800,000〜1,200,000細胞)。 - 適切な量の細胞懸濁液を、15 mLの高透明度ポリプロピレンコニカルチューブ内の凝集培地に加えます。希釈した細胞懸濁液を上下に静かにピペットで移動して、均一な細胞分布を確保します。
- 希釈した細胞懸濁液3 mLを6ウェル超低付着培養プレートの各所望のウェルにピペットで入れる。
- プレートをインキュベーター(37°C、5%CO2、湿度>90%)に入れ、インキュベーターのドアをできるだけ開閉させないでください。
注意: この最初のステップは、夕方またはインキュベーターの交通量が少ないときに完了するのが最適です。わずかな振動でも骨材のサイズと形状に影響を与え、結果を損なう可能性があります。
4. 1日目 - 凝集体の中胚葉誘導
- 播種後24時間で、2〜10個の細胞を含む小さな凝集体が顕微鏡で見えるようにします。凝集体を収集し、培地を中胚葉誘導培地に変更する前にそれらを沈降させます(ステップ1.3)。
- 6ウェル超低接着培養プレートのウェルごとに15 mLの高透明度ポリプロピレンコニカルチューブを1本セットアップします。
- 円運動(すなわち、オービタルシェーカーのような)を使用して各ウェルの中央に凝集体を集め、1 mLピペットを使用して各ウェルから凝集体と周囲の培地を静かに収集し、対応する15 mLの高透明度ポリプロピレンコニカルチューブに入れ、凝集体を室温で沈降させます。
- 採取したら、この段階でほとんどの細胞株/凝集体が沈降するのに必要な時間である1時間のタイマーを設定します。
注意: 時間が1時間未満の場合、15 mLの円錐管の底に沈降していない可能性のある凝集体が失われる可能性があります。 - 1時間が経過したら、注意して、ピペットまたは高感度吸引ポンプで上清を吸引します。15 mLコニカルチューブの底に凝集体が乱されていないことを確認してください。
- 各15 mLコニカルチューブの凝集体を2 mLの中胚葉誘導培地に再懸濁し、6ウェル超低付着培養プレートのそれぞれのウェルに戻します。
- プレートをインキュベーター(37°C)に戻し、4日目まで放置します。
注:凝集体が付着して互いに成長する場合は、1 mLピペットを使用して、凝集体の各ウェルを1日1回上下にゆっくりとピペットで移動させ、凝集体のサイズを同じに保ちます。
5.4日目-血管誘導と凝集体のプライミング
- 凝集体を収集し、培地を血管誘導培地に交換する前にそれらを沈降させます(ステップ1.4)。
- 6ウェル超低付着培養プレートのウェルごとに15 mLコニカルチューブを1本設置します。
- 円運動(すなわち、オービタルシェーカーのような)を使用して各ウェルの中央に凝集体を集め、1 mLピペットを使用して各ウェルから凝集体と周囲の培地を静かに収集し、対応する15 mLの円錐管に入れます。
- 収集したら、タイマーを30分に設定して、骨材を沈降させます。
注:この段階では、ほとんどの細胞株で30分の時間が必要です。時間が30分未満の場合、15 mLコニカルチューブの底に沈降していない可能性のある凝集体を失うリスクがあります。 - 30分後、注意して、ピペットまたは高感度吸引ポンプで上清を吸引します。15 mLコニカルチューブの底に凝集体が乱されていないことを確認してください。
- 各15 mLコニカルチューブの凝集体を2 mLの血管誘導培地に再懸濁し、6ウェル超低付着培養プレートのそれぞれのウェルに戻します。
- プレートをインキュベーター(37°C)に戻し、6日目まで放置します。
注:1 mLピペットを使用して、凝集体の各ウェルを1日1回静かに上下にピペットで移動して、凝集体のサイズを同じに保ち、凝集体が互いに成長したり付着したりしないようにします。
6. 6日目 - 凝集包埋と血管芽誘導
- 氷上で作業しながら、ECMソリューションの目的の最終容量を準備します(ステップ1.5)。
注:以下は、12ウェルプレート(30〜50個の凝集体)の1ウェルのプロトコルであり、必要に応じて調整できます。- 12ウェルプレートの1ウェルに対して、最下層として0.5 mLのECMを塗布し、最上層に0.5 mLのECMと凝集体を使用します。これにより、効果的な3D骨材の発芽に必要なECMの「サンドイッチ」が作成されます。
- 500 μLのECMを12ウェルプレートの1ウェルにピペットで入れます。気泡が形成されておらず、ウェル底部と側面のメニスカスが完全にコーティングされていることを確認してください。これは、ECMサンドイッチのレイヤー1を構成します。
- プレートを37°Cで2時間戻します。
注:効果的な重合には2時間の時間が必要です。時間が短いと、ECMの完全性が損なわれるリスクがあります。 - レイヤー1重合の終わりに向かって、円運動を使用して各ウェルの中央に凝集体を集め、1 mLピペットを使用して各ウェルから凝集体と周囲の培地を静かに収集し、対応する15 mLコニカルチューブに入れます。
- 凝集体を10〜15分間沈降させ、上清を吸引します。
- 凝集体を氷上の15 mLコニカルチューブに5分間置きます。冷却しながら、重合層1が入った12ウェルプレートをインキュベーターから取り出します。
注意: 骨材を冷却すると、層2 ECMの早期重合を防ぐのに役立ちます。 - 気泡の形成を防ぐために迅速かつ慎重に作業し、凝集体を500 μLのECMに再懸濁し、すでに重合された層1の上にECM凝集体懸濁液をピペットで移します。層1に触れないように注意し、200 μLのピペットチップを使用して、層2と凝集体をウェルの周りに静かに分散させます。
- プレートを37°Cで2時間戻します。
注:効果的なECM重合には、2時間のインキュベーション時間が必要です。時間が短いと、ECMの完全性が損なわれるリスクがあり、層1と層2の間の強力な接着が妨げられる可能性があります。 - 予め温めた(37°C)発芽培地1 mLを加えて(ステップ1.6)、血管分化を誘導します。発芽船は、埋め込み後1日から3日後に出現する必要があります。3日後に培地を交換し、その後1日おきに培地を交換してください。
注意: 発芽培地は事前に温めておく必要があります。そうしないと、レイヤーのデタッチが発生し、ECMの整合性が影響を受ける可能性があります。
7. 11日目 - BVOの分離と成熟
- 無菌条件下で作業する場合は、滅菌スパチュラの丸みを帯びた端を使用して、血管網を含むECM発芽マトリックスを緩めます。この段階では、ゲルはフリーフローティングディスクに似ていなければなりません。
- 滅菌鉗子と滅菌ヘラの丸い端を使用して、ゲルディスク(血管網を含む)を10 cmの培養皿の蓋に慎重に移します。
- 所望の倍率および焦点に調整された実体顕微鏡の下に蓋とゲルを置き、滅菌針を使用して単一の血管網を切り取り、プロセスで得られる非血管新生ECMの量を制限しようとします。
注:細胞は時間の経過とともに周囲のECMを自然に分解します。ただし、各オルガノイドで切り出す量を減らすと、画質と自立型容器ネットワークの完全性が向上します。 - すべてのオルガノイドがゲルから単離されたら、3 mLの発芽培地を入れた超低接着6ウェルプレートの1ウェルに静かに戻します。この段階で、オルガノイドを一晩放置することも、すぐにステップ7.4に進むこともできます。
- 1 mLピペットを使用して、単一のオルガノイドを6ウェルプレートから超低アタッチメント96ウェルプレートのウェルに移します。移管後、予め温めた(37°C)発芽培地200 μLを96ウェルプレートの各ウェルに加えます。
注:12ウェルプレートからの血管オルガノイドの1ウェルは、96ウェルプレートの30〜40ウェルを満たす必要があります。 - 96ウェルプレートでの単離後4〜6日で、オルガノイドが丸くて健康な形態を持っていることを確認します。この段階で、オルガノイドを固定し、染色の準備が整います。
8. 15日目 - BVOの固定、ブロッキング、染色
- カットした1 mLチップを使用して、オルガノイドを1.5 mLマイクロ遠心チューブに移します。
- BVOの吸引を避けるように注意しながら、200 μLまたは1,000 μLのピペットを使用してマイクロ遠心チューブ内の残りの発芽培地を除去し、PBSに1 mLの4%PFAを1時間加えます。
注意: 室温でオービタルシェーカー(125 rpm)に固定することをお勧めします。最大60BVO /マイクロ遠心チューブが許容されます。これ以上のBVOは、固定と洗浄の有効性を損ないます。
注意: PFAは有害な化学物質です。ドラフト内では注意して使用し、使用方法および適切な廃棄方法については、製造元の指示に従ってください。 - 新しく固定したBVOを3%PBS-トゥイーンで毎回15分間0.25回洗浄します。
- オルガノイドの直径が1 mmを超える場合は、PBS中の1%Triton X-100で室温で30〜60分間BVOを透過処理します。
- 0.25% PBS-Tweenをすべて吸引し、1 mLのブロッキングバッファーを加えます(ステップ1.7)。
注:抗体に依存しますが、オービタルシェーカー(125 rpm)で室温で2時間、染色プロセス中の非特異的抗体結合を減らすのに十分です。オルガノイドは、4°Cのブロッキングバッファーに最大2週間放置できます。 - ブロッキングバッファーを除去し、1 mLのブロッキングバッファーで希釈した一次抗体(1:100)を追加します。オービタルシェーカー(12 rpm)で4°Cで一晩保持し、オルガノイドが一次抗体溶液に沈めたままであることを確認します。
注:一次抗体の一晩のインキュベーションは、この研究に使用された抗体に適しています。必要な一次抗体と二次抗体、およびそれぞれの希釈液は 、材料表に記載されています。 - 一次抗体を一晩インキュベートした後、一次抗体溶液を除去し、0.25%PBS-Tweenで毎回3回15分間洗浄します。
- 1 mLのブロッキングバッファーで希釈した二次抗体(1:250)とDAPI(1:1,000)を加え、室温または4°Cで一晩2時間インキュベートします。
注:サンプルが正しく調製されている場合(上記のように)、室温または4°Cで一晩2時間のインキュベーションが本研究で使用される抗体に適しています。 - インキュベーション後、二次抗体溶液を除去し、0.25% PBS-Tweenで毎回3回15分間洗浄します。
注:染色後、オルガノイドはPBSで最大2週間保持できます。
9. 血管オルガノイド(BVO)の装着
- 取り付けスペーサーを目的のイメージングカバースリップに接着します( 材料表を参照)。
- カットした1 mmピペットチップを使用し、1 mLピペットを使用して単一のオルガノイドをスペーサーウェルに移し、残りのPBSを吸引します。
- 75°Cに加熱した150〜200μLの透明溶液( 材料表を参照)をウェルに満たし、オルガノイドを完全に沈めます。
注意: サンプルは、温めた透明溶液にさらされてから1時間以内に透明になるはずです。- 1時間の透明化時間が不十分な場合は、オルガノイドを室温で6時間から一晩、暗所の蓋付き箱に入れて透明になるように放置します。.サンプルを一晩放置する場合は、乾燥しないように十分な透明溶液があることを確認してください。
- 透明化後、100〜200μLのピペットチップで透明化溶液を注意深く吸引します。オルガノイドをスペーサーウェルの中心まで静かに操作し、ウェルがいっぱいになるまで、取り付けゲル( 材料表を参照)の滴を追加します(制御された加熱ブロックで75°Cに温めます)。
- 2番目のカバースリップを取り付けスペーサーの上にそっと置き、下部カバースリップと上部カバースリップの間のスペースにサンプルを密封します。マウンティングゲルを暗所で4°Cで一晩硬化させます。
注:硬化後、トップコートマニキュアを使用して、マウントされたサンプルをさらにシールできます。
結果
このプロトコルに記載されているステップは、hPSCからヒト血管オルガノイドを生成するための制御された正確な方法を得るために特別に開発されました。hPSC培養物からの直径30〜100μmの凝集体の生成は、プロトコルの開始点を示しています(図1、図2B)。凝集体は、血管網形成に必要な包埋(6日目)の前に、中胚葉(1日目〜4日目)および血管系統(4日目〜6日目)に向かって段階的な誘導を介して導かれます(図2A-D)。ほぼ放射状に対称な血管の発芽は、d7またはd8(図2E)で見え、d10(図2F、G)まで続く必要があります。ECMから96ウェルの超低アタッチメントプレートにhBVOを移植することで、発芽ネットワークの脆弱性が軽減され、浮遊培養(図2H)条件で最大6か月間継続して維持できます。d15までに、hBVOは周皮細胞(PDGFR-ß+)と平滑筋アクチン(SMA+)に囲まれた広範で接続された内皮(CD31+)ネットワークを示します(図3A-D)。連続コラーゲンIV(ColIV+)基底膜が血管ネットワークを包み込みます(図3E)。内皮細胞(CD31+、VE-Cadherin+)および周皮細胞(PDGFR-ß+)は、オルガノイド細胞集団のそれぞれ約30%-35%および60%-65%を構成する8。血管の活発な発芽は、過剰なフィリポディア8,10などの典型的な先端細胞の形態を示す内因的に組織化された先端細胞(CD31+)集団の指示の下で起こります。内皮血管ネットワークを封入するPDGFR-ß+およびSMA+壁画細胞の提示は、オルガノイド成熟プロセスのd15によって見ることができます(図3A、C)。ECMから除去し、浮遊培養(すなわち、d15)で成熟した後、hBVOは、それぞれの分析またはマウス腎被膜下での移植に維持可能です。

図1:タイミングと段階的な進行を強調したhBVOプロトコルの概略図。一見均質なhPSCまたはhiPSC培養物から、Rhoキナーゼ阻害剤Y27632の存在下で凝集体形成が起こります。BMP4およびCHiRを添加した培地は、凝集体を中胚葉運命に向けて誘導するために使用される。中胚葉誘導培地は、VEGFAおよびフォルスコリン添加培地に置き換えられ、血管系譜に向かって凝集体を刺激する。コラーゲンIおよび可溶化基底膜マトリックスへの凝集体の埋め込み、およびVEGFAおよびFGF2含有培地への曝露によって達成される機械的および化学的キューは、凝集体からのほぼ放射状に対称な血管発芽をもたらす。生成された血管ネットワークは、コラーゲンIおよび可溶化された基底膜から除去され、さらなる成熟、分析、またはin vivoでの移植のために浮遊培養に入れることができる。この図の拡大版を表示するには、ここをクリックしてください。

図2:明視野下で捉えられたhBVO生成の段階的な進行。 (A)-1日目におけるhPSC(H9)コロニーの典型的な形態。(B)Y-27632の存在下での6ウェル超低接着プレート上でのhPSC凝集体の生成(0日目)。(C)BMP4およびChiR添加培地を用いた凝集体の中胚葉誘導(1日目)。凝集体の大きさや形状の微妙な変化も観察できます。(D)4日目の凝集体は、VEGFAおよびフォルスコリン添加培地を使用して血管系譜に向けてプライミングされた。(e)早期血管発芽7日目、凝集体を発芽マトリックスに包埋し、VEGFAおよびFGF2を添加した発芽培地に曝露した翌日(7日目)。(F)健康なオルガノイド形態と9日目の継続的な血管発芽。(G)10日目に発芽する後期血管。理想的には、オルガノイド中心の密な細胞構造はこの時までに消えています。(H)成熟(15日目)ヒト血管オルガノイドの典型的な形態。超低付着96ウェル培養プレートでの切断と成熟による周囲のマトリックスの除去は、容器ネットワークが内部に収容された状態で、オルガノイドを球状に成形します。スケールバー: (A、B、E、F) 250 μm;(C,D) 500 μm;(G,H) 200 μm. この図の拡大版を表示するには、ここをクリックしてください。
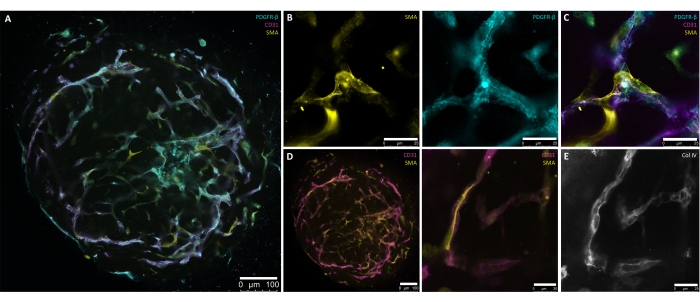
図3:成熟(15日目)ヒト血管オルガノイドの全マウント染色。 (A)自己組織化された内皮(CD31+、マゼンタ)ネットワークおよび周囲の周皮細胞(PDGFR-β+、シアン)およびアルファ平滑筋アクチン(SMA+、黄色)カバレッジを有する成熟(15日目)ヒト血管オルガノイドの提示。(B)血管網のSMA+(黄色)およびPDGFR-β+(シアン)発現を詳述するAのより高い倍率。(C)内皮(CD31+、マゼンタ)、周皮細胞(PDGFR-β+、シアン)、およびα平滑筋アクチン(SMA+、黄色)相互作用の詳細な提示。(D)血管内皮(CD31+、マゼンタ)-平滑筋(SMA+、黄色)の相互作用の断面(左)および成熟血管オルガノイドの高倍率(右)の全面染色。(E)壁細胞と内皮管の密接な関連による血管基底膜(Col IV+、グレースケール)の自己指向性形成。スケールバー: (A,D[左]) 100 μm;(B,D[右],E) 25 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
幹細胞由来のオルガノイド培養における最近のブレークスルーは、ヒト血管系のより高度で生理学的に関連するモデルのフレームワークを提供しました。ここで紹介したヒト血管オルガノイド(hBVO)モデルは、私たちの研究室で開発されました8,10は、ヒト血管形成のさらなる側面だけでなく、疾患モデリングと再生治療の新しい道を探求する強力な手段を提供します8,10,11。血管の発達と成熟、血管疾患、および内皮機能障害を調べるために、複数のin vivoモデルが採用されています3,4。さまざまなアプローチにより、幹細胞に由来する、またはin vivoで成人組織から分離された単一および複数の系統で定義された細胞を組み合わせて、複製可能なヒト血管ネットワークを作成します5,6。ここで紹介するプロトコルは、発生生物学と自己組織化の原理を活用して、本質的に単一のhPSC 8,10から生成できる史上初の多細胞系統のヒト血管ネットワークを生み出します。
各幹細胞株には独自の遺伝子構成があり、その調達、機能、および応答性の点で他の株とは異なります15。したがって、ヒト血管オルガノイド(hBVO)のプロトコルは、複数の(>12)異なるhPSC株との堅牢で再現性のあるプロトコル互換性を確保するために開発および最適化されました8、10。ここで説明する方法は、2週間にわたってhPSC由来の血管オルガノイドを生成します。しかしながら、hBVO生成における培地組成および/または技術の変更は、無効な血管ネットワークおよびオルガノイド生成をもたらし得る。個々の幹細胞株の増殖速度の違いは、幹細胞実験15、ひいてはオルガノイド培養の再現性にも著しく影響します。例えば、BVOを生成する際に、より多くの増殖性細胞またはより多くの大きな1日目凝集体は、本質的に異なる代謝環境ならびにガスおよび栄養素拡散パラメータを受ける。これにより、成長因子の曝露時間と効率、分化の程度と血管プライミング、そして最も重要なこととして、コラーゲン1と可溶化された基底膜マトリックスに凝集体を埋め込む際に血管ネットワークを形成する能力が変化します。
酸素の受動拡散と外部環境からの必須栄養素の投与は、in vitroでの3Dオルガノイドの長期細胞増殖および組織形態形成には理想的ではありません16。いくつかの要因(すなわち、組織代謝率、栄養素およびガスのバイオアベイラビリティ、静的または動的環境)に依存するが、生理学的に、ヒト組織は灌流された血管から150μm以内に生細胞の臍帯が存在することを考慮すると、一般に150μmO2および栄養素拡散限界がインビトロで培養された組織に対して確立されている17。70〜200μmの有効ガスおよび栄養素拡散距離も提案されているが18、19、20、21、構築物密度、温度、pH、および培地組成は拡散効率に大きく影響する。表面積の最適化と6日目の埋め込み後のインテグリン-β受容体通信により、直径250〜300μmの凝集体は、直径>500〜600μmの凝集体よりも優れた性能を発揮し、完全な血管発芽プロセスと最小凝縮のオルガノイドコアをもたらします。したがって、凝集体のサイズは重要であり、最初の播種中に使用される細胞の数と凝集体の形成に割り当てられた時間の両方によって影響を受ける可能性があります。凝集体のサイズと数22の制御を可能にするマイクロウェルプレートは、このプロトコルで超低アタッチメント6ウェルプレートを使用することから生じる確率的な凝集体形成技術の実行可能な代替手段です。hBVOプロトコルの最初の6日間のタイミングと凝集サイズの管理の一貫性は、真正な血管オルガノイドの開発を成功させるための最も重要な指標の1つです。
1日目(中胚葉誘導)および4日目(血管誘導)の培地変化は、凝集体の沈降と組み合わせて完了しなければならない。遠心分離は魅力的な代替手段ですが、弱く組み立てられた凝集物に加えられる追加の力は、望ましくない凝集、組み立て、およびせん断を引き起こす可能性があり、プロトコルの後期段階での分化、成熟、および発芽の有効性に悪影響を及ぼします。6日目の埋め込みプロセス中に氷上で作業することは、適切なECM重合と層形成を維持するために重要です。凝集体の埋め込みおよび発芽誘導中に、ECMを4°Cを超える温度および/または7.4以外のECM pHにさらすと、重合速度およびECM層の完全性だけでなく、埋め込まれた凝集体の発芽効率にも影響します。ECM発芽マトリックスの弾性特性により、12ウェル培養皿から滅菌切断面への取り外しと輸送が容易になります。マトリックスから除去され、超低接着96ウェルプレートに移された個々のオルガノイドは、残りの周囲のECMを消費し、連続した基底膜を有する自己組織化された壁状細胞被覆内皮微小血管ネットワークを保持します。
この提案ではカバーされていませんが、培地組成の変更は、hBVOの病理学的応答を引き起こす疾患を再現する可能性があります8,11。hBVOシステムを用いた疾患モデリングの境界はよく知られておらず、これは確かに調査が必要な領域です。以前に無血管オルガノイド構築物23の血管新生における我々の血管オルガノイド技術の適用もまた、大きな影響と関心を有する。
開示事項
著者の経済的利益と発表されている研究との間に関係はありません。血管オルガノイド技術は、ステムセルテクノロジーズにライセンス供与されています。J.M.P.は、血管移植療法として血管オルガノイドを開発するアンギオスバイオテックの創設者兼株主です。この作業に関連する特許出願は、特許No.US20200199541A1、ライナーA.ウィマー、ジョセフM.ペニンガー、ドンチョケルジャシュキを発明者としてリストしています。
謝辞
重要な意見と議論をしてくれた研究室のすべてのメンバーに感謝します。JMPは、T. von Zastrow財団、FWFウィトゲンシュタイン賞(Z 271-B19)、オーストリア科学アカデミー、助成金契約No 101005026に基づく革新的医薬品イニシアチブ2共同事業(JU)、心臓血管研究におけるルダック大西洋横断ネットワーク、アレン研究所特別研究者プログラム、カナダ150研究椅子プログラムF18-01336、カナダ健康研究所COVID-19助成金F20-02343およびF20-02015から資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
参考文献
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved