Method Article
Generación de organoides de vasos sanguíneos humanos a partir de células madre pluripotentes
En este artículo
Resumen
Este protocolo describe la generación de vasos sanguíneos autoorganizados a partir de células madre pluripotentes humanas y pluripotentes inducidas. Estas redes de vasos sanguíneos exhiben una red endotelial extensa y conectada rodeada de pericitos, actina del músculo liso y una membrana basal continua.
Resumen
Un organoide se define como un tejido in vitro multicelular diseñado que imita su órgano in vivo correspondiente, de modo que pueda usarse para estudiar aspectos definidos de ese órgano en una placa de cultivo de tejidos. La amplitud y la aplicación de la investigación de organoides derivados de células madre pluripotentes humanas (hPSC) han avanzado significativamente para incluir el cerebro, la retina, el conducto lagrimal, el corazón, los pulmones, el intestino, el páncreas, el riñón y los vasos sanguíneos, entre varios otros tejidos. El desarrollo de métodos para la generación de microvasos humanos, específicamente, ha abierto el camino para modelar el desarrollo de vasos sanguíneos humanos y la enfermedad in vitro y para la prueba y análisis de nuevos medicamentos o tropismo tisular en infecciones por virus, incluido el SARS-CoV-2. Los protocolos complejos y largos que carecen de orientación visual dificultan la reproducibilidad de muchos organoides derivados de células madre. Además, la estocasticidad inherente de los procesos de formación de organoides y la autoorganización requiere la generación de protocolos ópticos para avanzar en la comprensión de la adquisición y programación del destino celular. Aquí, se presenta un protocolo guiado visualmente para la generación de organoides de vasos sanguíneos humanos (BVO) 3D diseñados a partir de hPSC. Presentando una membrana basal continua, células endoteliales vasculares y articulación organizada con células murales, las BVO exhiben las características funcionales, morfológicas y moleculares de la microvasculatura humana. La formación de BVO se inicia a través de la formación de agregados, seguida de mesodermo e inducción vascular. La maduración vascular y la formación de redes se inician y apoyan mediante la incorporación de agregados en una matriz de membrana basal solubilizada y de colágeno 3D. Las redes de buques humanos se forman en 2-3 semanas y se pueden cultivar aún más en sistemas de cultivo escalables. Es importante destacar que los BVO trasplantados en ratones inmunocomprometidos se anastomosan con la circulación endógena del ratón y se especifican en arterias, venas y arteriolas funcionales. El presente protocolo guiado visualmente avanzará en la investigación de organoides humanos, particularmente en relación con los vasos sanguíneos en desarrollo normal, vascularización de tejidos y enfermedad.
Introducción
La disfunción vascular y las enfermedades de los vasos sanguíneos se presentan con complicaciones marcadas en las funciones de los órganos. La enfermedad cardiovascular (ECV) es la principal causa de muerte en todo el mundo1 y también es el principal factor que contribuye al aumento de los costos de atención médica en los Estados Unidos. El número de casos de ECV aumenta anualmente, y el número creciente de estos casos se produce en grupos de edad más jóvenes (20-45 años)2. Se han desarrollado múltiples modelos in vivo para explorar el desarrollo y la maduración de los vasos sanguíneos, la enfermedad vascular y la disfunción endotelial 3,4. Actualmente, los métodos que combinan células definidas por linaje único y múltiple, ya sea derivado de células madre o aisladas de tejidos adultos in vivo, pueden crear redes vasculares que replican aspectos de la función vascular humana y la anatomía 5,6. Los vasos sanguíneos han surgido como uno de los primeros sistemas funcionales durante el desarrollo del mesodermo, y se organizan ya sea a través de un proceso de ensamblaje llamado "vasculogénesis" o por expansión y ramificación de vasos preexistentes, lo que se denomina "angiogénesis"7.
Aprovechando el poder de la biología del desarrollo y el ensamblaje autodirigido, Wimmer et al. reportaron los primeros organoides de vasos sanguíneos humanos 3D autoorganizados a partir de hPSCs que exhiben las características funcionales, morfológicas y moleculares de la microvasculatura humana8. Similar a la vasculatura humana9, estos hBVOs son generados y se presentan con un endotelio, una membrana basal continua y células murales circundantes 8,10. Los hBVOs pueden ser trasplantados in vivo y anastomosados con la circulación endógena. También pueden madurar in vitro y servir como modelos para enfermedades cardiovasculares (es decir, diabetes)8 o tropismo tisular en infecciones virales como el SARS-CoV-211. Si bien anteriormente publicamos un protocolo escrito10, no existe un protocolo de video disponible para esta técnica compleja.
A través de una progresión concisa y gradual, la formación de hBVO se logra a través de la formación de agregados, la inducción del mesodermo utilizando un agonista WNT, quirón (CHIR99021) y proteína morfogénica ósea - 4 (BMP4)12,13, la inducción vascular a través del factor de crecimiento endotelial vascular A (VEGFA) y la forskoline (Fors)12, y la incrustación en una matriz de germinación personalizada 8,10. La maduración vascular y la formación de redes siguen la incrustación de los agregados en la matriz de brotación. Estas redes de vasos humanos se forman en 2-3 semanas y pueden eliminarse de la matriz de germinación y crecer aún más en sistemas de cultivo escalables durante un máximo de 6 meses. Aquí, se proporcionan procedimientos guiados ópticamente para la formación y aplicación de vasculatura derivada de células madre humanas.
Protocolo
Todos los experimentos realizados en este documento utilizaron la línea H9 humana iPSC disponible comercialmente. Las líneas comunes de células madre pluripotentes humanas disponibles comercialmente y no comercialmente (es decir, H9, NC8) también se han probado y demostrado su eficacia para la generación de organoides de vasos sanguíneos humanos utilizando este protocolo. Para más detalles, consulte nuestros informes publicados anteriormente 8,10.
1. Formulación de medios y reactivos para la generación de organoides de vasos sanguíneos humanos
- Prepare el medio de agregación.
- Mezclar 40 ml de DMEM/F12 knock-out (medio de baja osmolalidad sin L-glutamina o tampón HEPES optimizado para el crecimiento humano de ESC e iPSC), 10 ml de sustituto sérico knock-out (KOSR), 0,5 ml de 200 mM de dipéptido L-alanil-L-glutamina en NaCl al 0,85%, 0,5 ml de aminoácidos no esenciales (NEAA), 35 μL de beta-mercaptoetanol (BME, 100 μL de 2-mercaptoetanol en 10 ml de PBS estéril), y Y-27632 (inhibidor selectivo y permeable a las células de la proteína quinasa que contiene bobina enrollada asociada a Rho [ROCK]14 [10 mM] a 1:200) (ver Tabla de materiales).
- Preparar N2B27 (medio básico suplementado con N2 y B27).
- Mezclar 25 ml de DMEM/F12, 25 ml de medios neurobasales, 1 ml de suplemento B27, 0,5 ml de suplemento N2, 250 μL de 200 mM de L-alanil-L-glutamina dipéptido en NaCl al 0,85% y 35 μL de beta-mercaptoetanol (ver Tabla de materiales).
- Preparar el medio de inducción del mesodermo.
- Suplemento N2B27 medio con ChiR (12 μM, inhibidor de GSK3a/b estimulando la inducción del mesodermo) y BMP-4 (30 ng/mL, activador MSX2 inductor de mesodermo linaje).
NOTA: Material (ChiR): 10 mM (use 1:833, o 1.2 μL/mL N2B27). Material (BMP-4): 100 μg/ml (usar 1:3333 o 0,3 μL/ml N2B27) (ver Tabla de materiales).
- Suplemento N2B27 medio con ChiR (12 μM, inhibidor de GSK3a/b estimulando la inducción del mesodermo) y BMP-4 (30 ng/mL, activador MSX2 inductor de mesodermo linaje).
- Preparar el medio de inducción vascular.
- Complementar N2B27 medio con VEGFA (100 ng/ml) y forskoline (2 μM) (ver Tabla de materiales).
- Preparar la matriz extracelular (ECM).
- Use 1 ml de ECM para un pocillo de una placa de 12 pocillos (para incrustar 30-50 agregados). De 1 ml de solución de ECM utilizada para cada pozo, use 0.5 mL para crear una capa inferior, "capa 1", que servirá como base de ECM, y 0.5 mL más agregados para la capa superior, "capa 2". El uso de este enfoque proporciona, a través de la suspensión ECM, suficiente espacio y soporte para que las redes de vasos sanguíneos humanos broten en todas las direcciones.
NOTA: En total, 1 ml de ECM contiene 500 μL de colágeno bovino purificado tipo I, 250 μL de matriz de membrana basal solubilizada secretada por células de sarcoma de ratón Engelbreth-Holm-Swarm (ver Tabla de materiales) y 250 μL de solución de matriz básica (paso 1.5.2). Prepárelo fresco y manténgalo en hielo hasta que esté listo para usar. - Para preparar la solución de matriz básica para cuatro placas de 12 pocillos (48 pocillos), mezclar 5.627 mL de NaOH 0.1 N, 2.498 mL de DMEM 10x, 473 μL de HEPES, 368 μL de bicarbonato de sodio al 7.5%, 233 μL de dipéptido L-alanil-glutamina de 200 mM en NaCl al 0.85% y 3.451 mL de F-12 de Ham (ver Tabla de Materiales).
NOTA: La solución de matriz básica sobrante puede colocarse en un tubo cónico de polipropileno de alta claridad de 50 ml tapado y almacenarse a 4 °C para su uso durante un máximo de 2 meses.
- Use 1 ml de ECM para un pocillo de una placa de 12 pocillos (para incrustar 30-50 agregados). De 1 ml de solución de ECM utilizada para cada pozo, use 0.5 mL para crear una capa inferior, "capa 1", que servirá como base de ECM, y 0.5 mL más agregados para la capa superior, "capa 2". El uso de este enfoque proporciona, a través de la suspensión ECM, suficiente espacio y soporte para que las redes de vasos sanguíneos humanos broten en todas las direcciones.
- Prepare el medio de brotación.
- Formular específicamente 50 ml de medio flexible libre de suero (SFM) para apoyar el desarrollo de células hematopoyéticas humanas, una alícuota de 1,3 ml del suplemento nutritivo medio libre de suero flexible, 15% de suero bovino fetal (FBS), 250 μL de penicilina-estreptomicina, 500 μL de 200 mM de L-alanil-L-glutamina dipéptido en 0,85% de NaCl, VEGFA (100 ng/ml) y FGF2 (100 ng/ml) (ver Tabla de materiales).
- Prepare el búfer de bloqueo.
- Mezclar 0,5 g de albúmina sérica bovina, 1,5 ml de suero fetal bovino, 250 μL de Tween 20, 250 μL de Triton X-100, 500 μL de desoxicolato de sodio (1% pt/vol) y 47,5 ml de solución salina tamponada con fosfato 1x (ver Tabla de materiales). Pipetear hacia arriba y hacia abajo hasta que todos los componentes estén bien incorporados y la solución esté clara.
2. Mantenimiento y cultivo de células madre pluripotentes humanas y pluripotentes inducidas
- Realizar el cultivo celular utilizando placas de cultivo de tejido de 6 pocillos recubiertas con matriz de membrana basal de factor de crecimiento reducido libre de LDEV (dilución 1:50) con medio de cultivo de células madre (ver Tabla de materiales).
- Una vez que las células alcancen ~70% de confluencia, pasarlas usando 1 ml de enzima disociadora de células de mamíferos (ver Tabla de materiales) durante 3-4 min a 37 °C.
NOTA: La división de las células en una proporción de 1: 6 mejora la viabilidad celular y logra la confluencia dentro de 2-4 días para la mayoría de las líneas de células madre humanas. Para aumentar la viabilidad celular, se utiliza un medio de cultivo suplementado con ROCK Y-27632 (10 mM, 1:1.000) durante 24 h después de la muerte. - Cambiar el medio de cultivo diariamente hasta alcanzar una confluencia del 70%.
NOTA: Para el presente estudio, al 70% de confluencia, un pocillo de una placa de cultivo celular de 6 pocillos contiene alrededor de 1 millón de hPSCs H9.
3. Día 0 - Generación de agregados pluripotentes a partir de una suspensión unicelular
NOTA: Una confluencia del 70% en dos pocillos de una placa de cultivo de 6 pocillos producirá aproximadamente 175 hBVOs.
- Con una pipeta o un sistema de vacío, aspirar el medio de cultivo, sustituirlo por 1 ml de reactivo de disociación celular (ver Tabla de materiales) e incubar durante 5 min a 37 °C.
- Mientras las células estén bajo el reactivo de disociación celular, prepare el volumen necesario de medio de agregación (paso 1.1) en un tubo cónico de 15 ml según sea necesario para el número deseado de pocillos en una placa de cultivo de unión ultra baja de 6 pocillos (consulte la Tabla de materiales).
- Aspirar 1 ml de reactivo de disociación celular y suspender las células en 1 ml de medio de agregación. Cree una suspensión de una sola celda con un suave pipeteo de arriba hacia abajo antes de contar las muestras.
PRECAUCIÓN: Las hPSC son muy sensibles al estrés mecánico y no pueden tolerar el pipeteo agresivo. - Cuente las células utilizando un dispositivo automatizado de conteo de células10 o un sistema estandarizado bajo un microscopio. Calcule el número de celda necesario para el experimento.
NOTA: Dependiendo de la línea celular, 200,000 células / pocillo a 300,000 células / pocillo se considera ideal para la formación de agregados (es decir, 4 pocillos = 800,000 a 1,200,000 células en total). - Agregue el volumen apropiado de la suspensión celular al medio de agregación en el tubo cónico de polipropileno de alta claridad de 15 ml. Pipetear suavemente la suspensión celular diluida hacia arriba y hacia abajo para asegurar una distribución homogénea de la célula.
- Pipetear 3 ml de la suspensión celular diluida en cada pocillo deseado de la placa de cultivo de fijación ultra baja de 6 pocillos.
- Coloque la placa en la incubadora (37 °C, 5% CO2, >90% de humedad) y evite abrir y cerrar las puertas de la incubadora tanto como sea posible.
NOTA: Este paso inicial se completa mejor por las noches o durante el tráfico bajo de la incubadora. Incluso las vibraciones leves pueden afectar el tamaño y la forma de los agregados, lo que puede perjudicar los resultados.
4. Día 1 - Inducción del mesodermo de agregados
- Asegúrese de que 24 horas después de la siembra, los agregados pequeños que comprenden 2-10 células sean visibles bajo el microscopio. Recoja los agregados y déjelos sedimentar antes de cambiar el medio al medio de inducción del mesodermo (paso 1.3).
- Instale un tubo cónico de polipropileno de alta claridad de 15 ml por pocillo de la placa de cultivo de fijación ultrabaja de 6 pocillos.
- Use un movimiento circular (es decir, como un agitador orbital) para reunir los agregados en el centro de cada pozo, use una pipeta de 1 ml para recolectar suavemente los agregados y el medio circundante de cada pozo, colóquelos en sus correspondientes tubos cónicos de polipropileno de alta claridad de 15 ml y permita que los agregados sedimenten a temperatura ambiente.
- Una vez recolectado, establezca un temporizador para 1 h, que es el tiempo requerido para que la mayoría de las líneas celulares / agregados sedimenten en esta etapa.
NOTA: Si el tiempo es inferior a 1 h, uno podría perder cualquier agregado que no se haya asentado en el fondo del tubo cónico de 15 ml. - Una vez pasada la hora, aspire con precaución el sobrenadante con una pipeta o una bomba aspiradora de alta sensibilidad. Asegúrese de que los agregados permanezcan intactos en la parte inferior del tubo cónico de 15 ml.
- Resuspender los agregados de cada tubo cónico de 15 ml en 2 ml de medio de inducción del mesodermo y volver a colocarlos en sus respectivos pocillos de la placa de cultivo de unión ultra baja de 6 pocillos.
- Vuelva a colocar la placa en la incubadora (37 °C) y déjela hasta el día 4.
NOTA: Si los agregados se adhieren y crecen uno sobre el otro, usando una pipeta de 1 ml, pipetear suavemente cada pocillo de agregados hacia arriba y hacia abajo una vez al día para mantener los agregados similares en tamaño.
5. Día 4 - Inducción vascular y cebado de los agregados
- Recoger los agregados y dejar que se asienten antes de cambiar el medio al medio de inducción vascular (paso 1.4).
- Coloque un tubo cónico de 15 ml por pocillo de la placa de cultivo de fijación ultra baja de 6 pocillos.
- Use un movimiento circular (es decir, como un agitador orbital) para reunir los agregados en el centro de cada pozo, use una pipeta de 1 ml para recolectar suavemente los agregados y el medio circundante de cada pozo, y colóquelos en sus correspondientes tubos cónicos de 15 ml.
- Una vez recolectado, configure un temporizador de 30 minutos para permitir que los agregados sedimenten.
NOTA: Se requiere un tiempo de 30 minutos para la mayoría de las líneas celulares en esta etapa. Si el tiempo es inferior a 30 minutos, existe el riesgo de perder cualquier agregado que no se haya asentado en el fondo del tubo cónico de 15 ml. - Después de 30 minutos, con precaución, aspire el sobrenadante con una pipeta o una bomba de aspiración de alta sensibilidad. Asegúrese de que los agregados permanezcan intactos en la parte inferior del tubo cónico de 15 ml.
- Resuspender los agregados de cada tubo cónico de 15 ml en 2 ml de medio de inducción vascular y volver a colocarlos en sus respectivos pocillos de la placa de cultivo de unión ultra baja de 6 pocillos.
- Vuelva a colocar la placa en la incubadora (37 °C) y déjela hasta el día 6.
NOTA: Usando una pipeta de 1 ml, pipetear suavemente cada pocillo de agregados hacia arriba y hacia abajo una vez al día para mantener los agregados similares en tamaño y evitar que crezcan o se adhieran entre sí.
6. Día 6 - Incrustación de agregados e inducción de brotes de recipientes
- Mientras trabaja en hielo, prepare el volumen final deseado de la solución ECM (paso 1.5).
NOTA: El siguiente es el protocolo para un pozo de una placa de 12 pocillos (30-50 agregados), que se puede ajustar según sea necesario.- Para un pocillo de una placa de 12 pocillos, aplique 0.5 ml de ECM como capa inferior y use 0.5 ml de ECM más agregados en la capa superior. Esto crea el "sándwich" ECM necesario para la brotación efectiva de agregados 3D.
- Pipetear 500 μL de ECM en un pocillo de una placa de 12 pocillos. Asegúrese de que no se formen burbujas y que el menisco inferior y lateral del pozo estén completamente recubiertos. Esto comprende la capa 1 del sándwich ECM.
- Volver a colocar la placa a 37 °C durante 2 h.
NOTA: Es necesario un tiempo de 2 h para una polimerización efectiva. Cualquier tiempo más corto corre el riesgo de comprometer la integridad de ECM. - Hacia el final de la polimerización de la capa 1, use un movimiento circular para reunir los agregados en el centro de cada pozo, use una pipeta de 1 ml para recolectar suavemente los agregados y el medio circundante de cada pozo, y colóquelos en sus tubos cónicos correspondientes de 15 ml.
- Deje que los agregados se asienten durante 10-15 minutos y aspire el sobrenadante.
- Coloque los agregados en el tubo cónico de 15 ml sobre hielo durante 5 minutos. Mientras se enfría, saque la placa de 12 pocillos con la capa 1 ahora polimerizada de la incubadora.
NOTA: El enfriamiento de los agregados ayuda a prevenir la polimerización temprana de la ECM de capa 2. - Trabajando rápida y cuidadosamente para evitar la formación de burbujas, resuspenda los agregados en 500 μL de ECM y pipetee la suspensión de agregados ECM sobre la capa 1 ya polimerizada. Tenga cuidado de no tocar la capa 1, use una punta de pipeta de 200 μL para distribuir suavemente la capa 2 y los agregados alrededor del pozo.
- Volver a colocar la placa a 37 °C durante 2 h.
NOTA: Es necesario un tiempo de incubación de 2 h para una polimerización ECM efectiva. Cualquier tiempo más corto corre el riesgo de comprometer la integridad de ECM y puede evitar una fuerte adhesión entre la capa 1 y la capa 2. - Añadir 1 ml de medio germinado precalentado (37 °C) (paso 1.6) para inducir la diferenciación de los vasos sanguíneos. Los buques con brotes deben aparecer de 1 día a 3 días después de la incrustación. Cambie el medio después de 3 días y luego cada dos días.
NOTA: El medio de germinación debe ser precalentado; de lo contrario, puede producirse un desprendimiento de capas y la integridad de ECM puede verse afectada.
7. Día 11 - Aislamiento y maduración de los BVOs
- Trabajando en condiciones estériles, use el extremo redondeado de una espátula estéril para aflojar la matriz de germinación de ECM que contiene las redes vasculares. En esta etapa, el gel debe parecerse a un disco flotante.
- Usando fórceps estériles y el extremo redondeado de una espátula estéril, transfiera cuidadosamente el disco de gel (incluidas las redes vasculares) a la tapa de una placa de cultivo de 10 cm.
- Coloque la tapa más gel bajo un microscopio estereoscópico ajustado al aumento y enfoque deseados, y use agujas estériles para cortar las redes de vasos sanguíneos individuales, tratando de limitar la cantidad de ECM no vascularizada obtenida en el proceso.
NOTA: Las células degradan naturalmente la ECM circundante con el tiempo; Sin embargo, reducir la cantidad cortada con cada organoide aumenta la calidad de imagen y la integridad de la red de recipientes independientes. - Una vez que todos los organoides hayan sido aislados del gel, transfiéralos suavemente de nuevo a un pocillo de una placa de 6 pocillos de fijación ultra baja con 3 ml de medio de brotación. En esta etapa, los organoides se pueden dejar durante la noche, o uno puede continuar inmediatamente hasta el paso 7.4.
- Utilice una pipeta de 1 ml para transferir organoides individuales de la placa de 6 pocillos a los pocillos de una placa de 96 pocillos de fijación ultrabaja. Una vez transferido, añadir 200 μL de medio de germinación precalentado (37 °C) a cada pocillo de la placa de 96 pocillos.
NOTA: Un pocillo de organoides vasculares de una placa de 12 pocillos debe llenar 30-40 pocillos de una placa de 96 pocillos. - A los 4-6 días después del aislamiento en las placas de 96 pocillos, asegúrese de que los organoides posean una morfología redonda y saludable. En esta etapa, los organoides están listos para ser fijados y preparados para la tinción.
8. Día 15 - Fijación, bloqueo y tinción de los BVOs
- Con una punta cortada de 1 ml, transfiera los organoides a un tubo de microcentrífuga de 1,5 ml.
- Teniendo cuidado de evitar la aspiración de cualquier BVO, use una pipeta de 200 μL o 1,000 μL para eliminar el medio de germinación restante en el tubo de microcentrífuga, y luego agregue 1 ml de PFA al 4% en PBS durante 1 h.
NOTA: Se recomienda la fijación en un agitador orbital (125 rpm) a temperatura ambiente. Se acepta un máximo de 60 BVOs/tubo de microcentrífuga. Cualquier otro BVO perjudicará la fijación y la eficacia del lavado.
PRECAUCIÓN: PFA es un producto químico dañino. Úselo con precaución en una campana extractora de humos y siga las instrucciones de uso del fabricante y los métodos de eliminación apropiados. - Lave los BVO recién arreglados 3 veces durante 15 minutos cada vez con 0.25% PBS-Tween.
- Si los organoides tienen más de 1 mm de diámetro, permeabilizar los BVO con 1% Triton X-100 en PBS durante 30-60 min a temperatura ambiente.
- Aspire todo el PBS-Tween al 0,25% y agregue 1 ml de tampón de bloqueo (paso 1.7).
NOTA: Aunque depende de anticuerpos, 2 h a temperatura ambiente en un agitador orbital (125 rpm) es suficiente para reducir la unión de anticuerpos no específicos durante el proceso de tinción. Los organoides pueden dejarse en el tampón de bloqueo a 4 °C durante un máximo de 2 semanas. - Retire el tampón de bloqueo y agregue el anticuerpo primario (1:100) diluido en 1 ml del tampón de bloqueo. Mantener durante la noche a 4 °C en un agitador orbital (12 rpm), asegurándose de que los organoides permanezcan sumergidos en la solución de anticuerpos primarios.
NOTA: La incubación de anticuerpos primarios durante la noche es adecuada para los anticuerpos utilizados para este estudio. Los anticuerpos primarios y secundarios necesarios y sus respectivas diluciones se proporcionan en la Tabla de materiales. - Después de la incubación de anticuerpos primarios durante la noche, retire la solución de anticuerpos primarios y lave 3 veces durante 15 minutos cada vez con PBS-Tween al 0,25%.
- Añadir el anticuerpo secundario (1:250) más DAPI (1:1.000) diluido en 1 ml de tampón de bloqueo, e incubar durante 2 h a temperatura ambiente o a 4 °C durante la noche.
NOTA: Si las muestras se preparan correctamente (como se describió anteriormente), la incubación durante 2 h a temperatura ambiente o a 4 °C durante la noche es adecuada para los anticuerpos utilizados en el presente estudio. - Después de la incubación, retire la solución de anticuerpos secundarios y lave 3 veces durante 15 minutos cada vez con PBS-Tween al 0,25%.
NOTA: Después de la tinción, los organoides se pueden mantener en PBS hasta por 2 semanas.
9. Montaje de los organoides de los vasos sanguíneos (BVOs)
- Pegue los espaciadores de montaje en los cubreobjetos de imagen deseados (consulte la Tabla de materiales).
- Usando una punta de pipeta cortada de 1 mm, use una pipeta de 1 ml para transferir organoides individuales a los pocillos espaciadores y aspire el PBS restante.
- Llenar el pocillo con 150-200 μL de solución de limpieza (ver Tabla de materiales) calentada a 75 °C, sumergiendo completamente el organoide.
NOTA: Las muestras deben quedar claras dentro de 1 h de exposición a la solución de limpieza calentada.- Deje que los organoides queden limpios en una caja cubierta en la oscuridad a temperatura ambiente durante 6 h hasta toda la noche si el tiempo de limpieza de 1 h es insuficiente. Si deja la muestra durante la noche, asegúrese de que tenga suficiente solución de limpieza para evitar que se seque.
- Después de limpiar, aspire cuidadosamente la solución de aclaramiento con una punta de pipeta de 100-200 μL. Maniobra suavemente el organoide hacia el centro del pozo espaciador y agrega gotas de gel de montaje (ver Tabla de materiales) (calentado a 75 °C en un bloque de calentamiento controlado) hasta que el pozo esté lleno.
- Coloque suavemente el segundo cubreobjetos en la parte superior del espaciador de montaje para sellar las muestras en el espacio entre los cubreobjetos inferior y superior. Deje que el gel de montaje se cure en la oscuridad a 4 °C durante la noche.
NOTA: Después del curado, se puede usar esmalte de uñas de capa superior para sellar aún más las muestras montadas.
Resultados
Los pasos descritos en este protocolo se desarrollaron específicamente para producir un método controlado y preciso para la generación de organoides de vasos sanguíneos humanos a partir de hPSC. La generación de agregados de 30-100 μm de diámetro a partir de cultivos de hPSC marca el punto de partida del protocolo (Figura 1, Figura 2B). Los agregados se conducen a través de inducciones escalonadas hacia el mesodermo (día 1-día 4) y linajes vasculares (día 4-día 6) antes de la incrustación (día 6) (Figura 2A-D), que es necesaria para la formación de la red de vasos. La brotación de vasos casi radialmente simétricos debe ser visible por d7 o d8 (Figura 2E) y continuar hasta d10 (Figura 2F, G). La explantación de los hBVO de la ECM a las placas de fijación ultra bajas de 96 pocillos reduce la fragilidad de las redes de germinación y permite un mantenimiento continuo en condiciones de cultivo en suspensión (Figura 2H) durante un máximo de 6 meses. Para d15, los hBVO exhiben una red endotelial extensa y conectada (CD31+) rodeada de pericitos (PDGFR-ß+) y actina del músculo liso (SMA+) (Figura 3A-D). Una membrana basal continua de colágeno IV (ColIV+) envuelve las redes de vasos (Figura 3E). Las células endoteliales (CD31+, VE-Cadherin+) y los pericitos (PDGFR-ß+) comprenden aproximadamente el 30%-35% y el 60%-65% de las poblaciones de células organoides, respectivamente8. La brotación activa de los vasos ocurre bajo la dirección de una población de células de punta endógenamente organizadas (CD31+) que se presenta con una morfología típica de células de punta, como filipodios excesivos 8,10. La presentación de las células murales PDGFR-ß+ y SMA+ que encapsulan las redes de vasos endoteliales se puede ver en d15 del proceso de maduración de organoides (Figura 3A,C). Después de la extracción de la ECM y la maduración en cultivo en suspensión (es decir, d15), los hBVO son sostenibles para los respectivos análisis o trasplante bajo la cápsula renal de ratón.

Figura 1: Esquema del protocolo hBVO destacando el tiempo y la progresión paso a paso. A partir de cultivos hPSC o hiPSC aparentemente homogéneos, la formación de agregados se produce en presencia del inhibidor de la Rho-quinasa Y27632. El medio suplementado con BMP4 y CHiR se utiliza para instruir a los agregados hacia el destino mesodérmico. El medio de inducción del mesodermo es reemplazado por VEGFA y medio suplementado con forskolina para estimular los agregados hacia un linaje vascular. Las colas mecánicas y químicas logradas a través de la incrustación de los agregados en una matriz de membrana basal solubilizada y de colágeno I y la exposición al medio que contiene VEGFA y FGF2 dan como resultado un brote vascular casi radialmente simétrico del cuerpo agregado. Las redes de vasos generados pueden eliminarse del colágeno I y la membrana basal solubilizada y colocarse en cultivo en suspensión para su posterior maduración, análisis o trasplante in vivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Progresión gradual de la generación hBVO capturada bajo campo claro. (A) Morfología típica de las colonias de hPSC (H9) en el día −1. (B) Generación de agregados hPSC (día 0) en placas de fijación ultra bajas de 6 pocillos en presencia de Y-27632. (C) La inducción mesodérmica de agregados utilizando BMP4 y medio suplementado con ChiR (día 1). También se pueden observar cambios sutiles en el tamaño y la forma del agregado. (D) Agregados del día 4 preparados hacia un linaje vascular utilizando VEGFA y medio suplementado con forskolina. (E) Germinación temprana del vaso el día 7, un día después de incrustar los agregados en la matriz de germinación y exposición al medio de germinación suplementado con VEGFA y FGF2 (día 7). (F) Morfología organoide saludable y brotación continua de los vasos el día 9. (G) Brote de buques en etapa tardía en el día 10. Idealmente, las estructuras celulares densas en el centro organoide han desaparecido en este momento. (H) Morfología típica de organoides de vasos sanguíneos humanos maduros (día 15). La eliminación de la matriz circundante mediante corte y maduración en placas de cultivo de 96 pocillos de fijación ultra baja da forma a los organoides esféricamente, con las redes de vasos alojadas internamente. Barras de escala: (A,B,E,F) 250 μm; (C,D) 500 μm; (G,H) 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
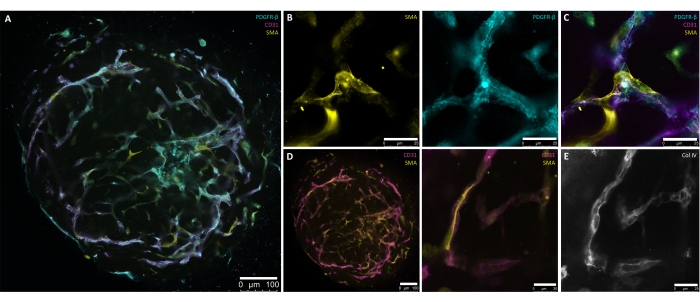
Figura 3: Tinción de montaje completo de organoides de vasos sanguíneos humanos maduros (día 15). (A) Presentación de organoides de vasos sanguíneos humanos maduros (día 15) con redes endoteliales autoorganizadas (CD31+, magenta) y pericito circundante (PDGFR-β+, cian) y cobertura de actina del músculo liso alfa (SMA+, amarillo). (B) Mayor aumento de A detallando la expresión SMA+ (amarillo) y PDGFR-β+ (cian) de las redes de buques. (C) Presentación detallada de la interacción endotelial (CD31+, magenta), pericito (PDGFR-β+, cian) y actina del músculo liso alfa (SMA+, amarillo). (D) Tinción de montaje completo de la interacción vaso-músculo liso endotelial (CD31+, magenta)-músculo liso (SMA+, amarillo) en una sección transversal (izquierda) y un mayor aumento (derecha) de organoides de vasos sanguíneos maduros. (E) Formación autodirigida de una membrana basal vascular (Col IV+, escala de grises) a través de la estrecha asociación de las células murales y los tubos endoteliales. Barras de escala: (A,D[izquierda]) 100 μm; (B,D[derecha],E) 25 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los avances recientes en cultivos de organoides derivados de células madre han proporcionado el marco para modelos más avanzados y fisiológicamente relevantes de vasculatura humana. El modelo de organoide de vasos sanguíneos humanos (hBVO) presentado aquí, desarrollado en nuestro laboratorio 8,10, proporciona un medio poderoso para explorar no solo otros aspectos de la vasculogénesis humana, sino también nuevas vías de modelado de enfermedades y terapia regenerativa 8,10,11. Se han empleado múltiples modelos in vivo para explorar el desarrollo y la maduración de los vasos sanguíneos, la enfermedad vascular y la disfunción endotelial 3,4. Diversos enfoques combinan células definidas por linaje único y múltiple, ya sea derivadas de células madre o aisladas de tejidos adultos in vivo para crear redes vasculares humanas replicativas 5,6. El protocolo presentado aquí aprovecha el principio de la biología del desarrollo y la autoorganización para producir las primeras redes de vasos sanguíneos humanos de linaje multicelular que se pueden generar, en esencia, a partir de un solo hPSC 8,10.
Cada línea de células madre tiene una composición genética única y difiere de otras en términos de su origen, función y capacidad de respuesta15. Por lo tanto, el protocolo para organoides de vasos sanguíneos humanos (hBVO) se desarrolló y optimizó para garantizar una compatibilidad de protocolo robusta y reproducible con múltiples (>12) líneas diferentes de hPSC 8,10. El método descrito aquí genera organoides de vasos sanguíneos derivados de hPSC durante 2 semanas. Sin embargo, los cambios en la composición de los medios y/o las técnicas en la generación de hBVO pueden conducir a una red de vasos y generación de organoides ineficaces. Las diferentes tasas de proliferación de líneas individuales de células madre también afectan notablemente la reproducibilidad de la experimentación con células madre15 y, por lo tanto, de los cultivos de organoides. Por ejemplo, al generar los BVO, las células más proliferativas o un mayor número de agregados grandes del día 1 están inherentemente sujetos a diferentes entornos metabólicos y parámetros de difusión de gases y nutrientes. Esto, a su vez, cambia los tiempos de exposición y las eficiencias del factor de crecimiento, el grado de diferenciación y cebado vascular y, lo más importante, la capacidad de formar redes de vasos al incrustar los agregados en el colágeno 1 y la matriz de membrana basal solubilizada.
La difusión pasiva de oxígeno y la administración de nutrientes esenciales de un ambiente externo no es ideal para el crecimiento celular a largo plazo de organoides 3D y la morfogénesis tisular in vitro16. Aunque depende de varios factores (es decir, la tasa metabólica tisular, la biodisponibilidad de nutrientes y gases, un ambiente estático o dinámico), se ha establecido un límite general de 150 μm O2 y difusión de nutrientes para tejidos cultivados in vitro, considerando que, fisiológicamente, los tejidos humanos presentan cordones de células vivas dentro de los 150 μm de los vasos sanguíneos perfundidos17. Aunque también se han propuesto distancias efectivas de difusión de gases y nutrientes de 70-200 μm18,19,20,21, la densidad de constructo, la temperatura, el pH y la composición del medio afectan significativamente la eficacia de la difusión. Debido a la optimización del área superficial y la comunicación del receptor de integrina-beta después de la incrustación del día 6, los agregados de 250-300 μm de diámetro funcionan mejor que los de >500-600 μm de diámetro, lo que resulta en un proceso completo de brotación del vaso y un núcleo organoide mínimamente condensado. Por lo tanto, el tamaño del agregado es crucial y puede verse afectado tanto por el número de celdas utilizadas durante la siembra inicial como por el tiempo asignado para la formación del agregado. Las placas de micropocillos que permiten el control sobre el tamaño del agregado y el número22 son una alternativa viable a la técnica de formación de agregados estocástica resultante del uso de placas de 6 pocillos de unión ultra baja en este protocolo. La consistencia en el tiempo y la gestión de los tamaños agregados durante los primeros 6 días del protocolo hBVO es uno de, si no el más, indicadores cruciales para desarrollar con éxito organoides de vasos sanguíneos de buena fe.
Los cambios medios en el día 1 (inducción del mesodermo) y el día 4 (inducción vascular) deben completarse en combinación con la sedimentación de los agregados. Aunque la centrifugación es una alternativa tentadora, las fuerzas adicionales aplicadas a los aggerados débilmente ensamblados pueden causar aglutinación, ensamblaje y cizallamiento no deseados, lo que afecta negativamente la diferenciación, la maduración y la eficacia de la brotación en las etapas posteriores del protocolo. Trabajar en hielo durante el proceso de incrustación del día 6 es fundamental para preservar la polimerización adecuada de ECM y la formación de capas. Durante la inducción de incrustación y germinación de agregados, la exposición de la ECM a temperaturas superiores a 4 °C y/o un pH de la ECM distinto de 7,4 afectará no solo a las tasas de polimerización y la integridad de la capa de ECM, sino también a la eficiencia de la brotación de los agregados incorporados. La naturaleza elástica de la matriz de germinación ECM permite un fácil desprendimiento y transporte desde la placa de cultivo de 12 pocillos hasta la superficie de corte estéril. Los organoides individuales retirados de la matriz y transferidos a placas de 96 pocillos de fijación ultra baja consumirán la ECM circundante restante y retendrán redes de microvasos endoteliales recubiertos de células murales autoorganizadas con una membrana basal continua.
Aunque no cubiertas en esta propuesta, las alteraciones en las composiciones de los medios pueden replicar enfermedades que, a su vez, provocan respuestas patológicas en hBVOs 8,11. Los límites del modelado de enfermedades utilizando el sistema hBVO están lejos de ser bien conocidos, y esta es ciertamente un área que necesita exploración. La aplicación de nuestra tecnología de organoides de vasos sanguíneos en la vascularización de construcciones de organoides previamente avasculares23 también es de gran impacto e interés.
Divulgaciones
No existe relación entre los intereses financieros de los autores y la investigación presentada. La tecnología de organoides de vasos sanguíneos ha sido licenciada a Stemcell Technologies. J.M.P. es fundador y accionista de Angios Biotech que desarrolla organoides de vasos sanguíneos como terapia de trasplante vascular. Se ha presentado una solicitud de patente relacionada con este trabajo bajo el número de Pat. US20200199541A1, enumerando a Reiner A. Wimmer, Josef M. Penninger y Dontscho Kerjaschki como inventores.
Agradecimientos
Agradecemos a todos los miembros de nuestros laboratorios por sus aportes y discusiones críticas. JMP recibió fondos de la fundación T. von Zastrow, el premio FWF Wittgenstein (Z 271-B19), la Academia Austriaca de Ciencias, la Empresa Común (JU) de la Iniciativa de Medicamentos Innovadores 2 (JU) en virtud del acuerdo de subvención No 101005026, Leducq Transatlantic Networks of Excellence in Cardiovascular Research, Allen Institute Distinguished Investigator Program y Canada 150 Research Chairs Program F18-01336, así como las subvenciones COVID-19 de los Institutos Canadienses de Investigación en Salud F20-02343 y F20-02015.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
Referencias
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados