Method Article
从多能干细胞生成人体血管类器官
摘要
该协议描述了从人类多能和诱导多能干细胞产生自组织血管。这些血管网络表现出广泛且连接的内皮网络,周围环绕着周细胞、平滑肌肌动蛋白和连续的基底膜。
摘要
类器官被定义为模拟其相应的体内器官的工程多细胞体外组织,因此可用于研究组织培养皿中该器官的定义方面。人类多能干细胞(hPSC)衍生类器官研究的广度和应用已经取得了显着进展,包括大脑,视网膜,泪管,心脏,肺,肠,胰腺,肾脏和血管以及其他几种组织。特别是人类微血管生成方法的发展,为体外模拟人体血管发育和疾病以及测试和分析病毒感染(包括SARS-CoV-2)中的新药或组织嗜性开辟了道路。缺乏视觉指导的复杂而冗长的方案阻碍了许多干细胞衍生类器官的可重复性。此外,类器官形成过程和自组织的固有随机性需要生成光学协议,以促进对细胞命运获取和编程的理解。在这里,提出了一个视觉引导的方案,用于生成由hPSCs工程化的3D人血管类器官(BVO)。BVO呈连续基底膜,血管内皮细胞,并与壁细胞有组织的关节,表现出人类微脉管系统的功能,形态和分子特征。BVO的形成是通过聚集体形成开始的,然后是中胚层和血管诱导。通过将聚集体嵌入 3D 胶原蛋白和溶解的基底膜基质中来启动和支持血管成熟和网络形成。人类血管网络在2-3周内形成,并且可以在可扩展的培养系统中进一步生长。重要的是,BVO移植到免疫功能低下的小鼠体内,与内源性小鼠循环吻合,并指定进入功能性动脉,静脉和小动脉。目前的视觉引导方案将推进人类类器官研究,特别是与正常发育、组织血管化和疾病的血管有关的研究。
引言
血管功能障碍和血管疾病表现为器官功能显著并发症。心血管疾病 (CVD) 是全球死亡的主要原因1,也是美国医疗费用增加的主要因素。心血管疾病病例数逐年增加,其中较年轻的年龄组(20-45岁)病例数也在增加2。已经开发了多种体内模型来探索血管的发育和成熟、血管疾病和内皮功能障碍3,4。目前,结合来自干细胞或体内从成人组织中分离的单个和多个谱系定义细胞的方法可以创建复制人体血管功能和解剖学方面的血管网络5,6。血管在从中胚层发育过程中已成为首批功能系统之一,它们通过称为"血管生成"的组装过程或通过先前存在的血管的扩张和分支来组织,这被称为"血管生成"7。
利用发育生物学和自我导向组装的力量,Wimmer等人报告了来自hPSC的首个自组织3D人血管类器官,其表现出人类微脉管系统的功能,形态和分子特征8。与人脉管系统9类似,这些hBVO产生并存在内皮,连续的基底膜和周围的壁细胞8,10。hBVO可以在 体内 移植并与内源性循环吻合。它们还可以在 体外 成熟,并作为心血管疾病(即糖尿病)8 或SARS-CoV-211等病毒感染中的组织嗜性的模型。虽然我们之前发布了书面协议10,但对于这种复杂的技术,没有可用的视频协议。
通过简洁的逐步进展,hBVO 的形成是通过聚集体形成、使用 WNT 激动剂 Chiron (CHIR99021) 和骨形态发生蛋白 - 4 (BMP4)12,13 诱导中胚层、通过血管内皮生长因子 A (VEGFA) 和佛司可林 (Fors)12 进行血管诱导,并嵌入定制发芽基质8,10 .血管成熟和网络形成遵循聚集体嵌入发芽基质。这些人类血管网络在2-3周内形成,可以从发芽基质中去除,并在可扩展的培养系统中进一步生长长达6个月。在这里,为人类干细胞来源的脉管系统的形成和应用提供了光学引导的程序。
研究方案
本文进行的所有实验均使用市售的H9人iPSC系。常见的商业和非商业上可获得的人多能干细胞系(即H9,NC8)也已经过测试,并证明使用该协议可有效生成人血管类器官。有关详细信息,请参阅我们之前发布的报告8,10。
1. 用于生成人体血管类器官的培养基和试剂制剂
- 准备聚合介质。
- 将 40 mL 敲除 DMEM/F12(不含 L-谷氨酰胺或针对人 ESC 和 iPSC 生长优化的 HEPES 缓冲液的低渗透压培养基)、10 mL 敲除血清替代品 (KOSR)、0.5 mL 200 mM L-丙氨酰-L-谷氨酰胺二肽与 0.85% NaCl、0.5 mL 非必需氨基酸 (NEAA)、35 μL β-巯基乙醇(BME、100 μL 2-巯基乙醇在 10 mL 无菌 PBS 中), 和Y-27632(Rho相关,含有蛋白激酶[ROCK]14 [10mM]的Rho相关线圈的细胞渗透性和选择性抑制剂,在1:200)(见 材料表)。
- 准备N2B27(N2和B27补充的碱性培养基)。
- 将 25 mL DMEM/F12、25 mL 神经基础培养基、1 mL B27 补充剂、0.5 mL N2 补充剂、250 μL 200 mM L-丙氨酰-L-谷氨酰胺二肽在 0.85% NaCl 中和 35 μL β-巯基乙醇混合(参见 材料表)。
- 准备中胚层诱导培养基。
- 用 ChiR(12 μM,GSK3a/b 抑制剂刺激中胚层诱导)和 BMP-4(30 ng/mL,MSX2 激活剂诱导中胚层谱系)补充 N2B27 培养基。
注意:库存 (ChiR):10 mM(使用 1:833 或 1.2 μL/mL N2B27)。储备液 (BMP-4):100 μg/mL(使用 1:3333,或 0.3 μL/mL N2B27)(参见 材料表)。
- 用 ChiR(12 μM,GSK3a/b 抑制剂刺激中胚层诱导)和 BMP-4(30 ng/mL,MSX2 激活剂诱导中胚层谱系)补充 N2B27 培养基。
- 准备血管诱导培养基。
- 用VEGFA(100ng / mL)和毛喉素(2μM)补充N2B27培养基(见 材料表)。
- 准备细胞外基质(ECM)。
- 将 1 mL ECM 用于 12 孔板的一个孔(用于包埋 30-50 个聚集体)。在用于每个孔的 1 mL ECM 溶液中,使用 0.5 mL 创建底层"第 1 层",用作 ECM 基础,并使用 0.5 mL 加聚集体用于顶层"第 2 层"。使用这种方法,通过ECM悬浮液,为人体血管网络向各个方向发芽提供了足够的空间和支持。
注意:总体而言,1 mL ECM 含有 500 μL 纯化牛胶原蛋白 I 型、250 μL 由 Engelbreth-Holm-Swarm 小鼠肉瘤细胞分泌的可溶基底膜基质(参见 材料表)和 250 μL 碱性基质溶液(步骤 1.5.2)。新鲜准备并放在冰上直到准备使用。 - 要制备四个 12 孔板(48 孔)的基本基质溶液,混合 5.627 mL 的 0.1 N NaOH、2.498 mL 的 10x DMEM、473 μL HEPES、368 μL 7.5% 碳酸氢钠、233 μL 200 mM L-丙氨酰-L-谷氨酰胺二肽的 0.85% NaCl 溶液和 3.451 mL Ham's F-12(参见 材料表)。
注意:剩余的碱性基质溶液可以放置在带盖的50 mL高透明度聚丙烯锥形管中,并在4°C下储存长达2个月。
- 将 1 mL ECM 用于 12 孔板的一个孔(用于包埋 30-50 个聚集体)。在用于每个孔的 1 mL ECM 溶液中,使用 0.5 mL 创建底层"第 1 层",用作 ECM 基础,并使用 0.5 mL 加聚集体用于顶层"第 2 层"。使用这种方法,通过ECM悬浮液,为人体血管网络向各个方向发芽提供了足够的空间和支持。
- 准备发芽培养基。
- 专门配制 50 mL 无血清柔性培养基 (SFM) 以支持人造血细胞的发育、1.3 mL 等分试样的无血清柔性培养基营养补充剂、15% 胎牛血清 (FBS)、250 μL 青霉素-链霉素、500 μL 200 mM L-丙氨酰-L-谷氨酰胺二肽,含 0.85% NaCl、VEGFA (100 ng/mL) 和 FGF2 (100 ng/mL)(参见 材料表)。
- 准备阻塞缓冲区。
- 混合 0.5 g 牛血清白蛋白、1.5 mL 胎牛血清、250 μL 吐温 20、250 μL Triton X-100、500 μL 脱氧胆酸钠(1% wt/vol 原液)和 47.5 mL 1x 磷酸盐缓冲盐水(参见 材料表)。上下移液,直到所有组件都充分结合并且溶液澄清。
2. 人多能和诱导多能干细胞的维持与培养
- 使用不含LDEV的低生长因子基底膜基质(1:50稀释)包被的6孔组织培养板和干细胞培养基进行细胞培养(参见 材料表)。
- 一旦细胞达到~70%汇合度,使用1mL哺乳动物细胞解离酶(参见 材料表)在37°C下传代3-4分钟。
注意:以1:6的比例分裂细胞可增强细胞活力,并在大多数人类干细胞系的2-4天内实现汇合。为了提高细胞活力,使用ROCK抑制剂Y-27632补充(10mM,1:1,000)培养基进行传代后24小时。 - 每天更换培养基,直到达到70%的汇合度。
注意:对于本研究,在70%汇合度下,6孔细胞培养板的一个孔含有约100万个H9 hPSC。
3. 第 0 天 - 从单细胞悬液生成多能聚集体
注意:在 6 孔培养板的两个孔中汇合度为 70% 将产生大约 175 hBBO。
- 使用移液器或真空系统吸出培养基,用1mL细胞解离试剂替换(参见 材料表),并在37°C下孵育5分钟。
- 当细胞在细胞解离试剂下时,根据需要在 15 mL 锥形管中制备必要体积的聚集培养基(步骤 1.1),以满足 6 孔超低附着培养板中所需孔数的需要(参见 材料表)。
- 吸出 1 mL 细胞解离试剂,并将细胞悬浮在 1 mL 聚集培养基中。在计数样品之前,使用轻柔的上下移液创建单细胞悬液。
注意:hPSC对机械应力非常敏感,不能耐受剧烈移液。 - 使用自动细胞计数装置10 或显微镜下的标准化系统对细胞进行计数。计算实验所需的细胞数。
注意:根据细胞系的不同,200,000 个细胞/孔到 300,000 个细胞/孔被认为是聚集体形成的理想选择(即,4 孔 = 总共 800,000 至 1,200,000 个细胞)。 - 将适当体积的细胞悬液添加到 15 mL 高透明度聚丙烯锥形管中的聚集培养基中。轻轻上下移液稀释的细胞悬液,以确保均匀的细胞分布。
- 将 3 mL 稀释的细胞悬液移液到 6 孔超低附着培养板的每个所需孔中。
- 将板放入培养箱(37°C,5%CO2,>90%湿度),并尽可能避免打开和关闭培养箱门。
注意:此初始步骤最好在晚上或孵化器流量低时完成。即使是轻微的振动也会影响骨料的大小和形状,从而影响结果。
4. 第 1 天 - 聚集体的中胚层诱导
- 确保接种后24小时,在显微镜下可以看到包含2-10个细胞的小聚集体。收集聚集体,并在将培养基更换为中胚层诱导培养基之前让它们沉降(步骤1.3)。
- 在 6 孔超低附着培养板的每个孔中设置一个 15 mL 高透明度聚丙烯锥形管。
- 使用圆周运动(即像轨道摇床一样)将聚集体聚集在每个孔的中心,使用 1 mL 移液器从每个孔中轻轻收集聚集体和周围培养基,将它们放入相应的 15 mL 高透明度聚丙烯锥形管中,并让聚集体在室温下沉淀。
- 收集后,将计时器设置为1小时,这是大多数细胞系/聚集体在此阶段沉淀所需的时间。
注意:如果时间小于 1 小时,则可能会丢失任何可能未沉降到 15 mL 锥形管底部的聚集体。 - 一小时过去后,请谨慎用移液管或高灵敏度吸液泵吸出上清液。确保聚集体在 15 mL 锥形管底部保持不受干扰。
- 将每个 15 mL 锥形管的聚集体重悬于 2 mL 中胚层诱导培养基中,并将它们放回 6 孔超低附着培养板的相应孔中。
- 将板放回培养箱(37°C),并将其放置至第4天。
注意:如果聚集体相互附着或生长,请使用 1 mL 移液器,每天轻轻上下移取每个聚集体孔一次,以保持聚集体大小相似。
5. 第 4 天 - 血管诱导和聚集体启动
- 收集聚集体,并在将培养基更换为血管诱导培养基之前让它们沉降(步骤1.4)。
- 在 6 孔超低附着培养板的每个孔中设置一个 15 mL 锥形管。
- 使用圆周运动(即,像轨道摇床一样)将聚集体聚集在每个孔的中心,使用 1 mL 移液器轻轻收集每个孔中的聚集体和周围培养基,并将它们放入相应的 15 mL 锥形管中。
- 收集后,将计时器设置为30分钟,以使聚集体沉积。
注意:在此阶段,大多数细胞系需要30分钟的时间。如果时间少于 30 分钟,则存在丢失任何可能未沉降到 15 mL 锥形管底部的聚集体的风险。 - 30分钟后,小心用移液管或高灵敏度吸气泵吸出上清液。确保聚集体在 15 mL 锥形管底部保持不受干扰。
- 将每个 15 mL 锥形管的聚集体重悬于 2 mL 血管诱导培养基中,并将它们放回 6 孔超低附着培养板的相应孔中。
- 将板放回培养箱(37°C),并将其放置至第6天。
注意:使用1 mL移液器,每天轻轻上下移液每个聚集体孔一次,以保持聚集体的大小相似,并防止它们相互生长或附着。
6. 第 6 天 - 骨料包埋和血管发芽诱导
- 在冰上工作时,准备所需的ECM溶液的最终体积(步骤1.5)。
注意:以下是12孔板(30-50个聚集体)的一个孔的协议,可以根据需要进行调整。- 对于 12 孔板的一个孔,涂上 0.5 mL ECM 作为底层,并在顶层使用 0.5 mL ECM 加聚集体。这创造了有效的3D骨料发芽所必需的ECM"三明治"。
- 将 500 μL ECM 移液到 12 孔板的一个孔中。确保没有形成气泡,并且井底和侧面弯月面完全覆盖。这包括ECM三明治的第1层。
- 将板放回37°C下2小时。
注意:有效聚合需要2小时的时间。任何较短的时间都有可能损害 ECM 的完整性。 - 在第 1 层聚合结束时,使用圆周运动将聚集体聚集在每个孔的中心,使用 1 mL 移液器轻轻收集每个孔中的聚集体和周围培养基,并将它们放入相应的 15 mL 锥形管中。
- 让聚集体沉淀10-15分钟,并吸出上清液。
- 将聚集体放入冰上的 15 mL 锥形管中 5 分钟。冷却时,将带有现已聚合的第 1 层的 12 孔板从培养箱中取出。
注意:冷却聚集体有助于防止第 2 层 ECM 的早期聚合。 - 快速小心地工作以防止气泡形成,将聚集体重悬于 500 μL ECM 中,并将 ECM 聚集体悬浮液移液到已经聚合的第 1 层上。注意不要接触第 1 层,请使用 200 μL 移液器吸头轻轻分布第 2 层和孔周围的聚集体。
- 将板放回37°C下2小时。
注意:有效的ECM聚合需要2小时的孵育时间。任何较短的时间都有可能损害 ECM 完整性,并可能阻止第 1 层和第 2 层之间的强粘附。 - 加入 1 mL 预热 (37 °C) 发芽培养基(步骤 1.6)以诱导血管分化。发芽血管必须在包埋后 1 天至 3 天出现。3天后更换培养基,然后每隔一天更换一次。
注意:发芽介质必须预热;否则,可能会发生层分离,并且可能会影响 ECM 完整性。
7. 第11天 - BVO的分离和成熟
- 在无菌条件下工作,使用无菌刮刀的圆形端松开包含血管网络的ECM发芽基质。在这个阶段,凝胶必须类似于一个自由漂浮的圆盘。
- 使用无菌镊子和无菌刮刀的圆形端,小心地将凝胶盘(包括血管网络)转移到10厘米培养皿的盖子上。
- 将盖子加凝胶置于调节到所需放大倍数和焦点的立体显微镜下,并使用无菌针头切出单血管网络,试图限制在此过程中获得的非血管化ECM的量。
注意:随着时间的推移,细胞会自然降解周围的ECM;然而,减少每个类器官的切口量可以提高图像质量和独立式容器网络的完整性。 - 从凝胶中分离出所有类器官后,将它们轻轻地转移回带有 3 mL 发芽培养基的超低附着 6 孔板的一个孔中。在此阶段,类器官可以放置过夜,或者可以立即继续步骤7.4。
- 使用 1 mL 移液器将单个类器官从 6 孔板转移到超低附着 96 孔板的孔中。转移后,向 96 孔板的每个孔中加入 200 μL 预热 (37 °C) 发芽培养基。
注意:来自 12 孔板的一孔血管类器官必须填充 96 孔板的 30-40 孔。 - 在96孔板中分离后4-6天,确保类器官具有圆形和健康的形态。在此阶段,类器官已准备好固定并准备染色。
8. 第 15 天 - BVO 的固定、封闭和染色
- 使用切开的 1 mL 吸头,将类器官转移到 1.5 mL 微量离心管中。
- 小心避免吸入任何 BVO,使用 200 μL 或 1,000 μL 移液器去除微量离心管中剩余的发芽培养基,然后在 PBS 中加入 1 mL 的 4% PFA 1 小时。
注意:建议在室温下固定在轨道振荡器(125 rpm)上。最多可以接受 60 个 BVO/微量离心管。任何更多的BVO都会损害固定和洗涤效果。
注意:PFA是一种有害化学物质。在通风橱中谨慎使用,并遵循制造商的使用说明和适当的处置方法。 - 每次用0.25%PBS-吐温洗涤新固定的BVO3次15分钟。
- 如果类器官直径大于1mm,则在室温下用PBS中的1%Triton X-100透化BVO30-60分钟。
- 吸出所有 0.25% PBS-吐温,并加入 1 mL 封闭缓冲液(步骤 1.7)。
注意:虽然抗体依赖性,但在室温下在轨道摇床(125rpm)上2小时足以减少染色过程中的非特异性抗体结合。类器官可以在4°C的封闭缓冲液中保留长达2周。 - 取出封闭缓冲液,加入在 1 mL 封闭缓冲液中稀释的一抗 (1:100)。在轨道摇床(12rpm)上在4°C下保持过夜,确保类器官保持浸没在一抗溶液中。
注意:过夜一抗孵育适用于本研究中使用的抗体。材料 表中提供了必要的一抗和二抗及其各自的稀释度。 - 一抗孵育过夜后,取出一抗溶液,每次用0.25%PBS-吐温洗涤3次15分钟。
- 加入二抗(1:250)加在1mL封闭缓冲液中稀释的DAPI(1:1,000),并在室温或4°C孵育2小时过夜。
注意:如果样品制备正确(如上所述),则在室温或4°C孵育2小时过夜适用于本研究中使用的抗体。 - 孵育后,除去二抗溶液,每次用0.25%PBS-吐温洗涤3次15分钟。
注意:染色后,类器官可以在PBS中保存长达2周。
9. 血管类器官(BVO)的安装
- 将安装垫片粘在所需的成像盖玻片上(见 材料表)。
- 使用切开的 1 mm 移液器吸头,使用 1 mL 移液器将单个类器官转移到间隔孔中,并吸出剩余的 PBS。
- 用加热至75°C的150-200μL透明溶液(参见 材料表)填充孔,完全浸没类器官。
注意:样品应在暴露于加热的澄清溶液后1小时内变得透明。- 如果1小时清除时间不足,则将类器官在室温下在黑暗的有盖盒子中透明6小时至过夜。如果将样品放置过夜,请确保其有足够的清除溶液以避免变干。
- 清除后,用 100-200 μL 移液器吸头小心吸出澄清溶液。轻轻地将类器官移动到间隔孔的中心,并加入几滴安装凝胶(参见 材料表)(在受控加热块中加热至75°C),直到孔充满。
- 轻轻地将第二张盖玻片放在安装垫片的顶部,将样品密封在底部和顶部盖玻片之间的空间中。让封片凝胶在4°C的黑暗中固化过夜。
注意:固化后,可以使用面漆指甲油进一步密封已安装的样品。
结果
本协议中描述的步骤是专门为产生从hPSC生成人血管类器官的受控和精确方法而开发的。从hPSC培养物中产生直径为30-100μm的聚集体标志着该方案的起点(图1,图2B)。在包埋(第6天)之前,通过逐步诱导聚集体走向中胚层(第1天-第4天)和血管谱系(第4天-第6天)(图2A-D),这对于血管网络的形成是必需的。近径向对称的血管发芽必须通过d7或d8可见(图2E),并持续到d10(图2F,G)。将hBVO从ECM植入96孔超低附着板可降低发芽网络的脆弱性,并允许在悬浮培养条件下持续维持长达6个月(图2H)。到d15时,hBVO表现出广泛且连接的内皮(CD31 +)网络,周围环绕着周细胞(PDGFR-ß+)和平滑肌肌动蛋白(SMA+)(图3A-D)。连续的胶原蛋白IV(ColIV +)基底膜包裹着血管网络(图3E)。内皮细胞(CD31+,VE-钙粘蛋白+)和周细胞(PDGFR-ß+)分别占类器官细胞群的约30%-35%和60%-65%8。血管的活跃萌发发生在内源性组织的尖端细胞(CD31+)群体的指导下,该群体表现出典型的尖端细胞形态,例如过多的丝状伪足8,10。通过类器官成熟过程的d15可以看到封装内皮血管网络的PDGFR-β+和SMA+壁细胞的表现(图3A,C)。从ECM中取出并在悬浮培养物(即d15)中成熟后,hBVO可用于小鼠肾囊下的相应分析或移植。

图 1:hBVO 协议示意图,突出显示了时间和逐步进展。 从看似同质的hPSC或hiPSC培养物中,聚集体形成是在Rho激酶抑制剂Y27632存在下发生的。BMP4和CHiR补充培养基用于指导聚集体走向中胚层命运。中胚层诱导培养基被 VEGFA 和毛喉素补充培养基取代,以刺激聚集体向血管谱系发展。通过将聚集体嵌入胶原蛋白I和可溶的基底膜基质中以及暴露于含VEGFA和FGF2的培养基中,实现机械和化学队列,导致聚集体近径向对称的血管萌发。产生的血管网络可以从胶原I和溶解的基底膜中去除,并置于悬浮培养物中,以便在 体内进一步成熟,分析或移植。 请点击此处查看此图的大图。

图2:在明场下捕获的hBVO一代的逐步进展 。 (A)日−1时hPSC(H9)集落的典型形态。(B) 在 Y-27632 存在下,在 6 孔超低附着板上生成 hPSC 聚集体(第 0 天)。(C)使用BMP4和补充ChiR的培养基诱导聚集体的中胚层(第1天)。还可以观察到骨料大小和形状的细微变化。(D) 第 4 天聚集体使用 VEGFA 和毛喉素补充培养基向血管谱系启动。(E)第7天早期血管发芽,将聚集体嵌入发芽基质并暴露于VEGFA和FGF2补充的发芽培养基(第7天)后。(F)健康的类器官形态和第9天的持续血管发芽。(G) 第10天后期容器发芽。理想情况下,此时类器官中心的致密细胞结构已经消失。(H)成熟(第15天)人血管类器官的典型形态。通过在超低附着96孔培养板中切割和成熟来去除周围的基质,使类器官呈球形,容器网络位于内部。比例尺: (A,B,E,F) 250 μm;(C,D) 500 微米;(G,H) 200 μm。 请点击此处查看此图的大图。
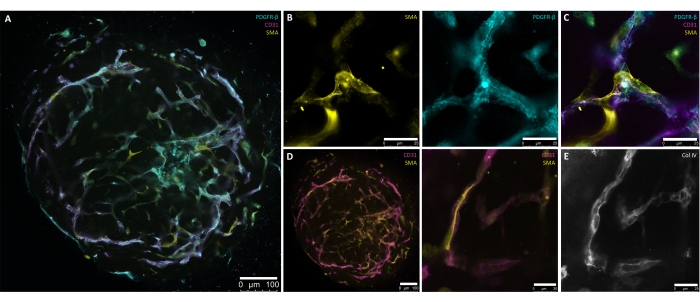
图 3:成熟(第 15 天)人血管类器官的全安装染色。 (A)成熟(第15天)人血管类器官的呈现,具有自组织内皮(CD31+,洋红色)网络和周围周细胞(PDGFR-β+,青色)和α-平滑肌肌动蛋白(SMA+,黄色)覆盖。(B)A的放大倍率更高,详细说明了血管网络的SMA+(黄色)和PDGFR-β+(青色)表达。(C)内皮(CD31+,洋红色),周细胞(PDGFR-β+,青色)和α-平滑肌肌动蛋白(SMA+,黄色)相互作用的详细表现。(D) 血管内皮(CD31+,洋红色)-平滑肌(SMA+,黄色)相互作用的全安装染色(左)和成熟血管类器官的更高放大倍率(右)。(E)通过壁细胞和内皮管的紧密结合,自我定向形成血管基底膜(Col IV+,灰度)。比例尺:(A,D[左])100微米;(B,D[右],E) 25 μm. 请点击此处查看此图的大图。
讨论
干细胞衍生类器官培养物的最新突破为更先进和生理相关的人类脉管系统模型提供了框架。这里介绍的人类血管类器官(hBVO)模型在我们的实验室8,10中开发,提供了一种强大的手段,不仅可以探索人类血管生成的更多方面,还可以探索疾病建模和再生疗法的新途径8,10,11。多种体内模型已被用于探索血管的发育和成熟、血管疾病和内皮功能障碍3,4。不同的方法结合了单个和多个谱系定义的细胞,这些细胞要么来源于干细胞,要么从体内的成人组织中分离出来,以创建可复制的人类血管网络5,6。这里介绍的方案利用发育生物学和自组织的原理产生了有史以来第一个多细胞谱系人类血管网络,本质上可以从单个hPSC8,10产生。
每个干细胞系都有独特的基因组成,在来源、功能和反应性方面与其他干细胞系不同15。因此,开发并优化了人血管类器官(hBVO)方案,以确保与多个(>12)不同hPSC系8,10的稳健且可重现的方案兼容性。此处描述的方法在2周内产生hPSC来源的血管类器官。然而,hBVO生成中培养基组成和/或技术的变化可能导致无效的血管网络和类器官生成。单个干细胞系的不同增殖速率也显着影响干细胞实验15 的可重复性,从而影响类器官培养物的可重复性。例如,在产生BVO时,更多的增殖细胞或更多的大第1天聚集体固有地受到不同的代谢环境以及气体和营养物质扩散参数的影响。这反过来又改变了生长因子暴露时间和效率、分化程度和血管启动,最重要的是,改变了将聚集体嵌入胶原蛋白 1 和溶解的基底膜基质时形成血管网络的能力。
氧气的被动扩散和来自外部环境的必需营养素的施用对于体外3D类器官的长期细胞生长和组织形态发生并不理想16。尽管取决于几个因素(即组织代谢率、营养和气体生物利用度、静态或动态环境),但考虑到在生理学上,人体组织在灌注血管的150μm范围内存在活细胞的脐带,已经为体外培养的组织建立了一般的150μm O2和营养扩散极限17。虽然也有人提出70-200 μm的有效气体和营养物扩散距离18,19,20,21,但构建密度,温度,pH和介质组成显着影响扩散效率。由于第 6 天包埋后的表面积优化和整合素-β 受体通讯,直径为 250-300 μm 的聚集体比直径 >500-600 μm 的聚集体表现更好,从而产生完整的血管发芽过程和最小冷凝的类器官核心。因此,聚集体大小至关重要,并且可能受到初始接种期间使用的细胞数量和分配给聚集体形成的时间的影响。允许控制聚集体尺寸和数量22的微孔板是本协议中使用超低附着6孔板产生的随机聚集体形成技术的可行替代方案。在hBVO方案的前6天内,时间和聚集体大小的一致性是成功开发真正的血管类器官的关键指标之一,如果不是最重要的的话。
第 1 天(中胚层诱导)和第 4 天(血管诱导)的培养基变化必须结合聚集体的沉降完成。尽管离心是一种诱人的替代方案,但施加在弱组装的聚集物上的额外力会导致不必要的结块、组装和剪切,从而对方案后期阶段的分化、成熟和发芽效果产生负面影响。在第 6 天包埋过程中在冰上工作对于保持适当的 ECM 聚合和层形成至关重要。在骨料包埋和发芽诱导过程中,将ECM暴露在高于4°C的温度和/或ECM pH值不是7.4的条件下不仅会影响聚合速率和ECM层完整性,还会影响嵌入骨料的发芽效率。ECM发芽基质的弹性允许从12孔培养皿轻松分离和运输到无菌切割表面。从基质中取出并转移到超低附着 96 孔板中的单个类器官将消耗剩余的周围 ECM,并保留具有连续基底膜的自组织壁细胞包被的内皮微血管网络。
虽然本提案未涵盖,但对培养基成分的改变可以复制疾病,进而引起hBVOs8,11的病理反应。使用hBVO系统进行疾病建模的边界远非众所周知,这当然是一个需要探索的领域。我们的血管类器官技术在先前无血管类器官构建体23 的血管化中的应用也具有重大影响和兴趣。
披露声明
作者的经济利益与所提出的研究之间没有关系。血管类器官技术已授权给干细胞技术公司。J.M.P.是Angios Biotech的创始人和股东,该公司开发血管类器官作为血管移植疗法。与这项工作相关的专利申请已根据专利号提交。US20200199541A1,将Reiner A. Wimmer,Josef M. Penninger和Dontscho Kerjaschki列为发明人。
致谢
我们感谢实验室的所有成员提供的重要意见和讨论。JMP获得了T. von Zastrow基金会、FWF维特根斯坦奖(Z 271-B19)、奥地利科学院、创新药物倡议2联合事业(JU)的资助,该资助协议编号为101005026,Leducq跨大西洋心血管研究卓越网络,艾伦研究所杰出研究员计划和加拿大150个研究主席计划F18-01336以及加拿大卫生研究院COVID-19赠款F20-02343和F20-02015。
材料
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
参考文献
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。