Method Article
Geração de Organoides de Vasos Sanguíneos Humanos a partir de Células-Tronco Pluripotentes
Neste Artigo
Resumo
Este protocolo descreve a geração de vasos sanguíneos auto-organizadores a partir de células-tronco pluripotentes e pluripotentes induzidas humanas. Essas redes vasculares exibem uma extensa e conectada rede endotelial circundada por pericitos, actina de músculo liso e membrana basal contínua.
Resumo
Um organoide é definido como um tecido multicelular projetado in vitro que imita seu órgão correspondente in vivo de tal forma que pode ser usado para estudar aspectos definidos desse órgão em uma placa de cultura de tecidos. A amplitude e a aplicação da pesquisa organoide derivada de células-tronco pluripotentes humanas (hPSC) avançaram significativamente para incluir o cérebro, retina, ducto lacrimal, coração, pulmão, intestino, pâncreas, rim e vasos sanguíneos, entre vários outros tecidos. O desenvolvimento de métodos para a geração de microvasos humanos, especificamente, abriu caminho para a modelagem do desenvolvimento de vasos sanguíneos humanos e doenças in vitro e para o teste e análise de novas drogas ou tropismo tecidual em infecções por vírus, incluindo o SARS-CoV-2. Protocolos complexos e demorados, sem orientação visual, dificultam a reprodutibilidade de muitos organoides derivados de células-tronco. Além disso, a estocástico inerente aos processos de formação de organoides e auto-organização requer a geração de protocolos ópticos para avançar na compreensão da aquisição e programação do destino celular. Aqui, um protocolo visualmente guiado é apresentado para a geração de organoides de vasos sanguíneos humanos (BVOs) 3D projetados a partir de hPSCs. Apresentando membrana basal contínua, células endoteliais vasculares e articulação organizada com células murais, as BVOs exibem as características funcionais, morfológicas e moleculares da microvasculatura humana. A formação de BVO é iniciada através da formação de agregados, seguida de mesoderma e indução vascular. A maturação vascular e a formação de redes são iniciadas e suportadas pela incorporação de agregados em uma matriz 3D de colágeno e membrana basal solubilizada. As redes de vasos humanos se formam dentro de 2-3 semanas e podem ser cultivadas em sistemas de cultura escaláveis. É importante ressaltar que os BVOs transplantados em camundongos imunocomprometidos se anastomosam com a circulação endógena de camundongos e especificam em artérias, veias e arteríolas funcionais. O presente protocolo visualmente guiado fará avançar a pesquisa em organoides humanos, particularmente em relação a vasos sanguíneos em desenvolvimento normal, vascularização tecidual e doença.
Introdução
A disfunção vascular e as doenças dos vasos sanguíneos apresentam complicações marcantes nas funções dos órgãos. A doença cardiovascular (DCV) é a principal causa de morte nomundo1 e também o principal fator que contribui para o aumento dos custos de saúde nos Estados Unidos. O número de casos de DCV vem aumentando anualmente, e o aumento desses casos está ocorrendo em faixas etárias mais jovens (20-45 anos)2. Múltiplos modelos in vivo têm sido desenvolvidos para explorar o desenvolvimento e a maturação dos vasos sanguíneos, a doença vascular e a disfunção endotelial 3,4. Atualmente, métodos que combinam células definidas por linhagens únicas e múltiplas, derivadas de células-tronco ou isoladas de tecidos adultos in vivo, podem criar redes vasculares que replicam aspectos da anatomia e função vascular humana 5,6. Os vasos sanguíneos surgiram como um dos primeiros sistemas funcionais durante o desenvolvimento a partir do mesoderma, e se organizam por meio de um processo de montagem denominado "vasculogênese" ou por expansão e ramificação a partir de vasos pré-existentes, o que é denominado "angiogênese"7.
Wimmer e col. relataram os primeiros organoides de vasos sanguíneos humanos 3D auto-organizáveis a partir de hPSCs que exibem as características funcionais, morfológicas e moleculares da microvasculatura humana8. Assim como a vasculaturahumana9, esses hBVOs são gerados e apresentam endotélio, membrana basal contínua e células muraisadjacentes8,10. Os hBVOs podem ser transplantados in vivo e anastomosados com a circulação endógena. Eles também podem sofrer maturação in vitro e servir como modelos para doenças cardiovasculares (ou seja, diabetes)8 ou tropismo tecidual em infecções virais como o SARS-CoV-211. Embora tenhamos publicado anteriormente um protocolo escrito10, não existe nenhum protocolo de vídeo disponível para esta técnica complexa.
Através de uma progressão concisa stepwise, a formação de hBVO é realizada através da formação de agregados, indução do mesoderma usando um agonista WNT, Chiron (CHIR99021), e proteína morfogênica óssea - 4 (BMP4)12,13, indução vascular via fator de crescimento endotelial vascular A (VEGFA) e Forskolina (Fors)12, e incorporação em uma matriz de brotamento personalizada 8,10. A maturação vascular e a formação de redes seguem a incorporação dos agregados na matriz de brotamento. Essas redes de vasos humanos se formam dentro de 2-3 semanas e podem ser removidas da matriz de brotação e cultivadas em sistemas de cultura escaláveis por até 6 meses. Aqui, procedimentos opticamente guiados são fornecidos para a formação e aplicação de vasculatura derivada de células-tronco humanas.
Protocolo
Todos os experimentos aqui realizados utilizaram a linhagem humana iPSC H9 disponível comercialmente. Linhagens de células-tronco pluripotentes humanas comuns comercialmente e não comercialmente disponíveis (i.e., H9, NC8) também foram testadas e comprovadamente eficazes para a geração de organoides de vasos sanguíneos humanos usando este protocolo. Para mais detalhes, consulte nossos relatórios publicados anteriormente 8,10.
1. Formulação de meios e reagentes para a geração de organoides de vasos sanguíneos humanos
- Prepare o meio de agregação.
- Misturar 40 mL de DMEM/F12 knock-out (meio de baixa osmolalidade sem L-glutamina ou tampão HEPES otimizado para crescimento humano de CTE e iPSC), 10 mL de substituto de soro knock-out (KOSR), 0,5 mL de dipeptídeo L-alanil-L-glutamina 200 mM em NaCl a 0,85%, 0,5 mL de aminoácidos não essenciais (NEAA), 35 μL de beta-mercaptoetanol (BME, 100 μL de 2-mercaptoetanol em 10 mL de PBS estéril), e Y-27632 (inibidor seletivo e permeável a células de Rho associado à bobina contendo proteína quinase [ROCK]14 [10 mM] em 1:200) (ver Tabela de Materiais).
- Preparar N2B27 (N2 e B27 meio básico suplementado).
- Misturar 25 ml de DMEM/F12, 25 ml de meio neurobasal, 1 ml de suplemento B27, 0,5 ml de suplemento N2, 250 μL de 200 mM de dipeptídeo L-alanil-L-glutamina em NaCl a 0,85% e 35 μL de beta-mercaptoetanol (ver Tabela de Materiais).
- Preparar o meio de indução do mesoderma.
- Suplemento em meio N2B27 com ChiR (12 μM, inibidor da GSK3a/b estimulando a indução do mesoderma) e BMP-4 (30 ng/mL, ativador MSX2 induzindo a linhagem do mesoderma).
NOTA: Estoque (ChiR): 10 mM (use 1:833, ou 1,2 μL/mL N2B27). Estoque (BMP-4): 100 μg/mL (use 1:3333, ou 0,3 μL/mL N2B27) (ver Tabela de Materiais).
- Suplemento em meio N2B27 com ChiR (12 μM, inibidor da GSK3a/b estimulando a indução do mesoderma) e BMP-4 (30 ng/mL, ativador MSX2 induzindo a linhagem do mesoderma).
- Preparar meio de indução vascular.
- Suplemento em meio N2B27 com VEGFA (100 ng/mL) e forskolina (2 μM) (ver Tabela de Materiais).
- Preparar a matriz extracelular (MEC).
- Use 1 mL de ECM para um poço de uma placa de 12 poços (para incorporar 30-50 agregados). Do 1 mL de solução de MEC utilizado para cada poço, utilizar 0,5 mL para criar uma camada inferior, "camada 1", que servirá como base da MEC, e 0,5 mL mais agregados para a camada superior, "camada 2". O uso dessa abordagem fornece, através da suspensão da MEC, espaço e suporte suficientes para que as redes de vasos sanguíneos humanos brotem em todas as direções.
NOTA: Globalmente, 1 ml de MEC contém 500 μL de colagénio bovino purificado tipo I, 250 μL de matriz de membrana basal solubilizada secretada por células de sarcoma de ratinho Engelbreth-Holm-Swarm (ver Tabela de Materiais) e 250 μL de solução de matriz básica (passo 1.5.2). Prepare fresco e mantenha no gelo até estar pronto para usar. - Para preparar a solução básica da matriz para quatro placas de 12 poços (48 poços), misturar 5,627 mL de NaOH 0,1 N, 2,498 mL de 10x DMEM, 473 μL de HEPES, 368 μL de bicarbonato de sódio a 7,5%, 233 μL de dipeptídeo L-alanil-L-glutamina 200 mM em NaCl 0,85% e 3,451 mL de F-12 de Ham.
NOTA: A solução de matriz básica que sobrou pode ser colocada em um tubo cônico de polipropileno de alta claridade tampado de 50 mL e armazenada a 4 °C para uso por até 2 meses.
- Use 1 mL de ECM para um poço de uma placa de 12 poços (para incorporar 30-50 agregados). Do 1 mL de solução de MEC utilizado para cada poço, utilizar 0,5 mL para criar uma camada inferior, "camada 1", que servirá como base da MEC, e 0,5 mL mais agregados para a camada superior, "camada 2". O uso dessa abordagem fornece, através da suspensão da MEC, espaço e suporte suficientes para que as redes de vasos sanguíneos humanos brotem em todas as direções.
- Prepare o meio de brotação.
- Formular especificamente 50 mL de meio flexível livre de soro (SFM) para apoiar o desenvolvimento de células hematopoéticas humanas, uma alíquota de 1,3 mL do suplemento de nutrientes do meio livre de soro flexível, 15% de soro fetal bovino (FBS), 250 μL de penicilina-estreptomicina, 500 μL de 200 mM de dipeptídeo L-alanil-L-glutamina em NaCl 0,85%, VEGFA (100 ng/mL) e FGF2 (100 ng/mL) (ver Tabela de Materiais).
- Prepare o buffer de bloqueio.
- Misturar 0,5 g de albumina de soro bovino, 1,5 ml de soro fetal bovino, 250 μL de Tween 20, 250 μL de Triton X-100, 500 μL de desoxicolato de sódio (1% em peso/vol) e 47,5 ml de solução salina tamponada com fosfato 1x (ver Tabela de Materiais). Pipetar para cima e para baixo até que todos os componentes estejam bem incorporados e a solução esteja clara.
2. Manutenção e cultivo de células-tronco pluripotentes humanas e pluripotentes induzidas
- Realizar cultura celular usando placas de cultura de tecido de 6 poços revestidas com matriz de membrana basal sem fator de crescimento reduzido sem LDEV (diluição 1:50) com meio de cultura de células-tronco (consulte Tabela de Materiais).
- Quando as células atingirem ~70% de confluência, passe-as usando 1 mL de enzima dissociadora de células de mamíferos (ver Tabela de Materiais) por 3-4 min a 37 °C.
NOTA: Dividir as células em uma proporção de 1:6 aumenta a viabilidade celular e atinge a confluência dentro de 2-4 dias para a maioria das linhagens de células-tronco humanas. Para aumentar a viabilidade celular, o meio de cultura suplementado com inibidor de ROCK Y-27632 (10 mM, 1:1.000) é usado por 24 h após a passagem. - Trocar o meio de cultura diariamente até atingir uma confluência de 70%.
NOTA: Para o presente estudo, com 70% de confluência, um poço de uma placa de cultura celular de 6 poços contém cerca de 1 milhão de hPSCs H9.
3. Dia 0 - Geração de agregados pluripotentes a partir de uma suspensão unicelular
NOTA: Uma confluência de 70% em dois poços de uma placa de cultura de 6 poços produzirá aproximadamente 175 hBVOs.
- Usando uma pipeta ou um sistema de vácuo, aspirar o meio de cultura, substituí-lo por 1 mL de reagente de dissociação celular (ver Tabela de Materiais) e incubar por 5 min a 37 °C.
- Enquanto as células estiverem sob o reagente de dissociação celular, prepare o volume necessário de meio de agregação (passo 1.1) em um tubo cônico de 15 mL, conforme necessário para o número desejado de poços em uma placa de cultura de inserção ultrabaixa de 6 poços (ver Tabela de Materiais).
- Aspirar 1 mL de reagente de dissociação celular e suspender as células em 1 mL de meio de agregação. Crie uma suspensão de célula única com pipetagem suave ascendente antes de contar as amostras.
CUIDADO: hPSCs são bastante sensíveis ao estresse mecânico e não toleram pipetagem agressiva. - Conte as células usando um dispositivo automatizado de contagem de células10 ou um sistema padronizado sob um microscópio. Calcule o número de células necessário para o experimento.
NOTA: Dependendo da linhagem celular, 200.000 células/poço a 300.000 células/poço é considerado ideal para a formação de agregados (ou seja, 4 poços = 800.000 a 1.200.000 células no total). - Adicionar o volume adequado da suspensão celular ao meio de agregação no tubo cônico de polipropileno de alta claridade de 15 mL. Pipetar suavemente a suspensão de células diluídas para cima e para baixo para garantir uma distribuição celular homogênea.
- Pipetar 3 mL da suspensão de células diluídas em cada poço desejado da placa de cultura de ultrabaixa fixação de 6 poços.
- Coloque a placa na incubadora (37 °C, 5% CO2, >90% de umidade) e evite ao máximo abrir e fechar as portas da incubadora.
NOTA: Esta etapa inicial é melhor concluída à noite ou durante o baixo tráfego da incubadora. Mesmo pequenas vibrações podem afetar o tamanho e a forma dos agregados, o que pode prejudicar os resultados.
4. Dia 1 - Indução de agregados pelo mesoderma
- Certifique-se de que 24 h após a semeadura, pequenos agregados compreendendo 2-10 células são visíveis sob o microscópio. Recolher os agregados e deixá-los assentar antes de mudar o meio para o meio de indução do mesoderma (passo 1.3).
- Configure um tubo cônico de polipropileno de alta claridade de 15 mL por poço da placa de cultura de fixação ultrabaixa de 6 poços.
- Use um movimento circular (ou seja, como um agitador orbital) para reunir os agregados no centro de cada poço, use uma pipeta de 1 mL para coletar suavemente os agregados e o meio circundante de cada poço, coloque-os em seus tubos cônicos de polipropileno de alta claridade correspondentes de 15 mL e permita que os agregados sedimentem à temperatura ambiente.
- Uma vez coletado, ajuste um temporizador para 1 h, que é o tempo necessário para que a maioria das linhagens/agregados celulares sedimentem nesta fase.
NOTA: Se o tempo for inferior a 1 h, pode-se perder quaisquer agregados que possam não ter se acomodado no fundo do tubo cônico de 15 mL. - Passada a hora, com cautela, aspirar o sobrenadante com uma pipeta ou uma bomba aspiradora de alta sensibilidade. Certifique-se de que os agregados permaneçam inalterados no fundo do tubo cônico de 15 mL.
- Ressuspender os agregados de cada tubo cônico de 15 mL em 2 mL de meio de indução do mesoderma e colocá-los novamente em seus respectivos poços da placa de cultura de ultra-baixa fixação de 6 poços.
- Coloque a placa de volta na incubadora (37 °C) e deixe-a até o dia 4.
NOTA: Se os agregados se fixarem e crescerem uns sobre os outros, usando uma pipeta de 1 mL, pipetar suavemente cada poço de agregados para cima e para baixo uma vez por dia para manter os agregados de tamanho semelhante.
5. Dia 4 - Indução vascular e condicionamento dos agregados
- Recolher os agregados e deixá-los assentar antes de mudar o meio para o meio de indução vascular (passo 1.4).
- Configure um tubo cônico de 15 mL por poço da placa de cultura de fixação ultrabaixa de 6 poços.
- Use um movimento circular (ou seja, como um agitador orbital) para reunir os agregados no centro de cada poço, use uma pipeta de 1 mL para coletar suavemente os agregados e o meio circundante de cada poço e coloque-os em seus tubos cônicos correspondentes de 15 mL.
- Uma vez coletados, ajuste um temporizador por 30 min para permitir que os agregados sedimentem.
Observação : um tempo de 30 min é necessário para a maioria das linhas de célula neste estágio. Se o tempo for inferior a 30 min, corre-se o risco de perda de quaisquer agregados que possam não ter se acomodado no fundo do tubo cônico de 15 mL. - Após 30 min, com cautela, aspirar o sobrenadante com uma pipeta ou uma bomba aspiradora de alta sensibilidade. Certifique-se de que os agregados permaneçam inalterados no fundo do tubo cônico de 15 mL.
- Ressuspender os agregados de cada tubo cônico de 15 mL em 2 mL de meio de indução vascular e colocá-los novamente em seus respectivos poços da placa de cultura de ultrabaixa fixação de 6 poços.
- Coloque a placa de volta na incubadora (37 °C) e deixe-a até o dia 6.
NOTA: Usando uma pipeta de 1 mL, pipetar suavemente cada poço de agregados para cima e para baixo uma vez por dia para manter os agregados de tamanho semelhante e evitar que eles cresçam ou se fixem uns aos outros.
6. Dia 6 - Incorporação de agregados e indução de brotações de vasos
- Enquanto trabalha no gelo, prepare o volume final desejado da solução de ECM (passo 1.5).
NOTA: A seguir está o protocolo para um poço de uma placa de 12 poços (30-50 agregados), que pode ser ajustado conforme necessário.- Para um poço de uma placa de 12 poços, aplicar 0,5 mL de MEC como camada inferior e usar 0,5 mL de MEC mais agregados na camada superior. Isso cria o "sanduíche" de ECM necessário para a brotação eficaz de agregados 3D.
- Pipetar 500 μL de ECM em um poço de uma placa de 12 poços. Certifique-se de que não se formem bolhas e que o fundo do poço e o menisco lateral estejam completamente revestidos. Isso compreende a camada 1 do sanduíche ECM.
- Colocar a placa novamente a 37 °C durante 2 horas.
NOTA: Um tempo de 2 h é necessário para uma polimerização eficaz. Qualquer tempo mais curto corre o risco de comprometer a integridade do ECM. - No final da polimerização da camada 1, use um movimento circular para reunir os agregados no centro de cada poço, use uma pipeta de 1 mL para coletar suavemente os agregados e o meio circundante de cada poço e coloque-os em seus tubos cônicos correspondentes de 15 mL.
- Deixe os agregados assentarem por 10-15 min, e aspirar o sobrenadante.
- Colocar os agregados no tubo cônico de 15 mL sobre gelo por 5 min. Durante o resfriamento, retire a placa de 12 poços com a camada 1 agora polimerizada da incubadora.
NOTA: O resfriamento dos agregados ajuda a evitar a polimerização precoce da camada 2 ECM. - Trabalhando de forma rápida e cuidadosa para evitar a formação de bolhas, ressuspenda os agregados em 500 μL de ECM e pipete a suspensão de agregados ECM sobre a camada 1 já polimerizada. Sendo cauteloso para não tocar na camada 1, use uma ponta de pipeta de 200 μL para distribuir suavemente a camada 2 e os agregados ao redor do poço.
- Colocar a placa novamente a 37 °C durante 2 horas.
NOTA: Um tempo de incubação de 2 h é necessário para a polimerização eficaz da ECM. Qualquer tempo mais curto corre o risco de comprometer a integridade da MEC e pode impedir uma forte adesão entre a camada 1 e a camada 2. - Adicionar 1 ml de meio de brotação pré-aquecido (37 °C) (passo 1.6) para induzir a diferenciação dos vasos sanguíneos. Os navios que brotam devem aparecer de 1 dia a 3 dias após a incorporação. Troque o meio após 3 dias e depois a cada dois dias.
NOTA: O meio de brotação deve ser pré-aquecido; caso contrário, o descolamento da camada pode ocorrer e a integridade do ECM pode ser afetada.
7. Dia 11 - Isolamento e maturação dos BVOs
- Trabalhando em condições estéreis, use a extremidade arredondada de uma espátula estéril para soltar a matriz de brotamento da MEC que contém as redes vasculares. Nesta fase, o gel deve assemelhar-se a um disco flutuante.
- Usando pinças estéreis e a extremidade arredondada de uma espátula estéril, transfira cuidadosamente o disco de gel (incluindo as redes vasculares) para a tampa de uma placa de cultura de 10 cm.
- Coloque a tampa mais gel sob um estereomicroscópio ajustado para a ampliação e foco desejados e use agulhas estéreis para cortar as redes de vasos sanguíneos únicos, tentando limitar a quantidade de MEC não vascularizada obtida no processo.
NOTA: As células degradam naturalmente a ECM circundante ao longo do tempo; no entanto, reduzir a quantidade recortada com cada organoide aumenta a qualidade da imagem e a integridade da rede de vasos independentes. - Uma vez que todos os organoides tenham sido isolados do gel, transfira-os suavemente de volta para um poço de uma placa de 6 poços de fixação ultrabaixa com 3 mL de meio de brotação. Nesta fase, os organoides podem ser deixados durante a noite, ou pode-se continuar imediatamente a passo 7.4.
- Use uma pipeta de 1 mL para transferir organoides únicos da placa de 6 poços para os poços de uma placa de 96 poços de fixação ultrabaixa. Uma vez transferido, adicionar 200 μL de meio de brotação pré-aquecido (37 °C) a cada poço da placa de 96 poços.
NOTA: Um poço de organoides vasculares de uma placa de 12 poços deve preencher 30-40 poços de uma placa de 96 poços. - Aos 4-6 dias após o isolamento nas placas de 96 poços, certifique-se de que os organoides possuam uma morfologia redonda e saudável. Nesta fase, os organoides estão prontos para serem fixados e preparados para coloração.
8. Dia 15 - Fixação, bloqueio e coloração dos BVOs
- Usando uma ponta de corte de 1 mL, transfira os organoides para um tubo de microcentrífuga de 1,5 mL.
- Tendo o cuidado de evitar a aspiração de quaisquer BVOs, use uma pipeta de 200 μL ou 1.000 μL para remover o meio de brotação restante no tubo de microcentrífuga e, em seguida, adicione 1 mL de PFA a 4% em PBS por 1 h.
NOTA: Recomenda-se a fixação num agitador orbital (125 rpm) à temperatura ambiente. Um máximo de 60 BVOs/tubo de microcentrífuga é aceitável. Qualquer outro BVOs prejudicará a fixação e a eficácia da lavagem.
CUIDADO: O PFA é um produto químico nocivo. Use-o com cautela em um exaustor de fumaça e siga as instruções de uso do fabricante e os métodos de descarte apropriados. - Lave os BVOs recém-fixados 3x por 15 min cada vez com PBS-Tween a 0,25%.
- Se os organoides forem maiores que 1 mm de diâmetro, permeabilizar os BVOs com Triton X-100 a 1% em PBS por 30-60 min à temperatura ambiente.
- Aspirar todo o PBS-Tween a 0,25% e adicionar 1 ml de tampão de bloqueio (passo 1.7).
NOTA: Embora dependente de anticorpos, 2 h à temperatura ambiente em um agitador orbital (125 rpm) é suficiente para reduzir a ligação de anticorpos inespecíficos durante o processo de coloração. Os organoides podem ser deixados no tampão de bloqueio a 4 °C por até 2 semanas. - Remova o tampão de bloqueio e adicione o anticorpo primário (1:100) diluído em 1 mL do tampão de bloqueio. Manter durante a noite a 4 °C em um agitador orbital (12 rpm), garantindo que o(s) organoide(s) permaneça(m) submerso(s) na solução primária de anticorpos.
NOTA: A incubação de anticorpos primários durante a noite é adequada para os anticorpos usados para este estudo. Os anticorpos primários e secundários necessários e suas respectivas diluições são fornecidos na Tabela de Materiais. - Após a incubação noturna do anticorpo primário, remova a solução de anticorpos primários e lave 3x por 15 minutos cada vez com PBS-Tween a 0,25%.
- Adicionar o anticorpo secundário (1:250) mais DAPI (1:1.000) diluído em 1 mL de tampão de bloqueio e incubar por 2 h à temperatura ambiente ou a 4 °C durante a noite.
NOTA: Se as amostras forem preparadas correctamente (como descrito acima), a incubação durante 2 h à temperatura ambiente ou a 4 °C durante a noite é adequada para os anticorpos utilizados no presente estudo. - Após a incubação, remova a solução de anticorpos secundários e lave 3x por 15 minutos cada vez com PBS-Tween a 0,25%.
NOTA: Após a coloração, os organoides podem ser mantidos em PBS por até 2 semanas.
9. Montagem dos organoides dos vasos sanguíneos (BVOs)
- Cole os espaçadores de montagem nas lamínulas de imagem desejadas (consulte a Tabela de Materiais).
- Usando uma ponta de pipeta cortada de 1 mm, use uma pipeta de 1 mL para transferir organoides individuais para os poços espaçadores e aspirar o PBS restante.
- Encher o poço com 150-200 μL de solução de compensação (ver Tabela de Materiais) aquecido a 75 °C, submergindo totalmente o organoide.
NOTA: As amostras devem tornar-se límpidas no prazo de 1 h após a exposição à solução de limpeza aquecida.- Deixe os organoides para ficar claro em uma caixa coberta no escuro à temperatura ambiente por 6 h para durante a noite se o tempo de limpeza de 1 h for insuficiente. Se deixar a amostra durante a noite, certifique-se de que tem solução de limpeza suficiente para evitar a secagem.
- Após a limpeza, aspirar cuidadosamente a solução de limpeza com uma ponta de pipeta de 100-200 μL. Manobrar suavemente o organoide até ao centro do espaçador e adicionar gotas de gel de montagem (ver Tabela de Materiais) (aquecido a 75 °C num bloco de aquecimento controlado) até que o poço esteja cheio.
- Coloque delicadamente a segunda tampa na parte superior do espaçador de montagem para selar as amostras no espaço entre as lamínulas inferior e superior. Deixe o gel de montagem curar no escuro a 4 °C durante a noite.
NOTA: Após a cura, o esmalte topcoat pode ser usado para selar ainda mais as amostras montadas.
Resultados
As etapas descritas neste protocolo foram desenvolvidas especificamente para produzir um método controlado e preciso para a geração de organoides de vasos sanguíneos humanos a partir de hPSCs. A geração de agregados de 30-100 μm de diâmetro a partir de culturas hPSC marca o ponto de partida do protocolo (Figura 1, Figura 2B). Os agregados são conduzidos através de induções passo a passo em direção ao mesoderma (dia 1 dia 4) e linhagens vasculares (dia 4 dia 6) antes da incorporação (dia 6) (Figura 2A-D), o que é necessário para a formação da rede vascular. O brotamento quase radialmente simétrico dos vasos deve ser visível por d7 ou d8 (Figura 2E) e continuar até d10 (Figura 2F,G). O explante dos hBVOs do ECM para as placas de fixação ultrabaixas de 96 poços reduz a fragilidade das redes de brotação e permite a manutenção contínua em condições de cultura de suspensão (Figura 2H) por até 6 meses. Em d15, os hBVOs exibem uma extensa e conectada rede endotelial (CD31+) circundada por pericitos (PDGFR-ß+) e actina de músculo liso (SMA+) (Figura 3A-D). Uma membrana basal contínua de colágeno IV (ColIV+) envolve as redes vasculares (Figura 3E). As células endoteliais (CD31+, VE-Caderina+) e pericitos (PDGFR-ß+) compreendem aproximadamente 30%-35% e 60%-65% das populações de células organoides, respectivamente8. O brotamento ativo dos vasos ocorre sob a direção de uma população de células pontais (CD31+) organizadas endogenamente que apresenta morfologia típica das células da ponta, como o excesso de filípodes 8,10. A apresentação das células murais PDGFR-ß+ e SMA+ encapsulando as redes vasculares endoteliais pode ser vista por d15 do processo de maturação organoide (Figura 3A,C). Após a remoção da MEC e maturação em cultura de suspensão (i.e., d15), os hBVOs são sustentáveis para as respectivas análises ou transplante sob a cápsula renal de camundongo.

Figura 1: Esquema do protocolo hBVO destacando o tempo e a progressão gradual. A partir de culturas aparentemente homogêneas de hPSC ou hiPSC, a formação de agregados ocorre na presença do inibidor de Rho-quinase Y27632. O meio BMP4 e CHiR-suplementado é usado para instruir os agregados em direção ao destino mesodérmico. O meio de indução do mesoderma é substituído por VEGFA e meio suplementado com forskolin para estimular os agregados em direção a uma linhagem vascular. Filas mecânicas e químicas obtidas através da incorporação dos agregados em uma matriz de membrana basal solubilizada e colágeno I e exposição a meio contendo VEGFA e FGF2 resultam em brotamento vascular quase radialmente simétrico do corpo agregado. As redes vasculares geradas podem ser removidas do colágeno I e da membrana basal solubilizada e colocadas em cultura de suspensão para posterior maturação, análise ou transplante in vivo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Progressão gradual da geração de hBVO capturada sob campo claro. (A) Morfologia típica de colônias hPSC (H9) no dia −1. (B) Geração de agregados hPSC (dia 0) em placas de fixação ultrabaixa de 6 poços na presença de Y-27632. (C) A indução mesodérmica de agregados utilizando BMP4 e meio ChiR suplementado (dia 1). Mudanças sutis no tamanho e na forma dos agregados também podem ser observadas. (D) Agregados do dia 4 preparados para uma linhagem vascular usando VEGFA e meio suplementado com forskolina. (E) Brotação precoce do vaso no dia 7, um dia após a incorporação dos agregados na matriz de brotação e exposição ao meio de brotação suplementado com VEGFA e FGF2 (dia 7). (F) Morfologia organoide saudável e brotação contínua do vaso no 9º dia. (G) Navio em fase avançada brotando no dia 10. Idealmente, as estruturas celulares densas no centro organoide desapareceram por esta altura. (H) Morfologia típica de organoides de vasos sanguíneos humanos maduros (dia 15). A remoção da matriz circundante por corte e maturação em placas de cultura de 96 poços de fixação ultrabaixa molda os organoides esfericamente, com as redes de vasos alojadas internamente. Barras de escala: (A,B,E,F) 250 μm; (C,D) 500 μm; (G,H) 200 μm. Clique aqui para ver uma versão maior desta figura.
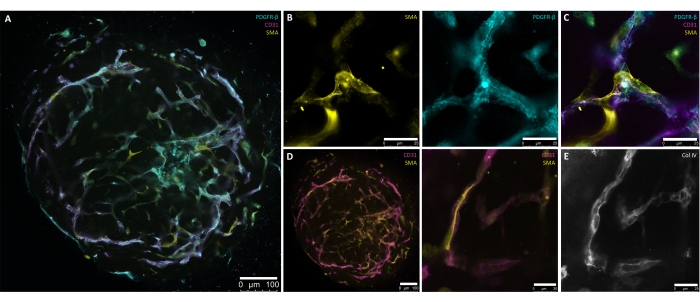
Figura 3: Coloração de montagem total de organoides de vasos sanguíneos humanos maduros (dia 15). (A) Apresentação de organoides de vasos sanguíneos humanos maduros (dia 15) com redes endoteliais auto-organizadas (CD31+, magenta) e cobertura pericitária (PDGFR-β+, ciano) e actina de músculo liso alfa (SMA+, amarelo). (B) Maior ampliação de A detalhando a expressão SMA+ (amarelo) e PDGFR-β+ (ciano) das redes de vasos. (C) Apresentação detalhada da interação endotelial (CD31+, magenta), pericito (PDGFR-β+, ciano) e alfa-actina de músculo liso (SMA+, amarelo). (D) Coloração de montagem total da interação endotelial (CD31+, magenta)-músculo liso (SMA+, amarelo) do vaso em um corte transversal (esquerda) e uma maior ampliação (direita) de organoides de vasos sanguíneos maduros. (E) Formação autodirigida de uma membrana basal vascular (Col IV+, escala de cinza) através da estreita associação das células murais e tubos endoteliais. Barras de escala: (A,D[esquerda]) 100 μm; (B,D[direita],E) 25 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Avanços recentes em culturas de organoides derivados de células-tronco forneceram a estrutura para modelos mais avançados e fisiologicamente relevantes de vasculatura humana. O modelo organoide de vasos sanguíneos humanos (hBVO) aqui apresentado, desenvolvido em nosso laboratório 8,10, fornece um poderoso meio de explorar não apenas outros aspectos da vasculogênese humana, mas também novos caminhos de modelagem de doenças e terapia regenerativa 8,10,11. Múltiplos modelos in vivo têm sido empregados para explorar o desenvolvimento e a maturação dos vasos sanguíneos, a doença vascular e a disfunção endotelial 3,4. Diferentes abordagens combinam células definidas por linhagens únicas e múltiplas, derivadas de células-tronco ou isoladas de tecidos adultos in vivo, para criar redes vasculares humanas replicativas 5,6. O protocolo aqui apresentado aproveita o princípio da biologia do desenvolvimento e da auto-organização para produzir a primeira rede de vasos sanguíneos humanos de linhagem multicelular que pode ser gerada, em essência, a partir de uma única hPSC 8,10.
Cada linhagem de células-tronco tem uma composição genética única e difere das outras em termos de origem, função e capacidade de resposta15. Portanto, o protocolo para organoides de vasos sanguíneos humanos (hBVOs) foi desenvolvido e otimizado para garantir uma compatibilidade de protocolo robusta e reprodutível com múltiplas (>12) diferentes linhagens de hPSC 8,10. O método descrito aqui gera organoides de vasos sanguíneos derivados de hPSC ao longo de 2 semanas. No entanto, alterações na composição do meio e/ou nas técnicas de geração de hBVO podem levar a uma rede de vasos e geração organoide ineficazes. As diferentes taxas de proliferação de linhagens individuais de células-tronco também impactam marcadamente a reprodutibilidade da experimentação com células-tronco15 e, portanto, das culturas de organoides. Por exemplo, na geração dos BVOs, células mais proliferativas ou um número maior de grandes agregados do dia 1 estão inerentemente sujeitos a diferentes ambientes metabólicos e parâmetros de difusão de gases e nutrientes. Isso, por sua vez, altera os tempos de exposição e eficiências dos fatores de crescimento, o grau de diferenciação e priming vascular e, mais importante, a capacidade de formar redes vasculares ao incorporar os agregados na matriz de colágeno 1 e membrana basal solubilizada.
A difusão passiva de oxigênio e a administração de nutrientes essenciais a partir de um ambiente externo não é ideal para o crescimento celular a longo prazo de organoides 3D e morfogênese tecidual in vitro16. Embora dependente de vários fatores (i.e., taxa metabólica tecidual, biodisponibilidade de nutrientes e gases, ambiente estático ou dinâmico), um limite geral de difusão de 150 μm O2 e nutrientes foi estabelecido para tecidos cultivados in vitro, considerando que, fisiologicamente, os tecidos humanos apresentam cordões de células vivas dentro de 150 μm de vasos sanguíneos perfundidos17. Embora distâncias efetivas de difusão de gases e nutrientes de 70-200 μm também tenham sido propostas18,19,20,21, a densidade de construto, temperatura, pH e composição do meio impactam significativamente a eficácia da difusão. Devido à otimização da área de superfície e à comunicação do receptor integrina-beta após a incorporação no dia 6, agregados de 250-300 μm de diâmetro apresentam melhor desempenho do que aqueles >500-600 μm de diâmetro, resultando em um processo completo de brotação do vaso e um núcleo organoide minimamente condensado. Assim, o tamanho do agregado é crucial e pode ser afetado tanto pelo número de células utilizadas durante a semeadura inicial quanto pelo tempo alocado para a formação do agregado. As placas de micropoços que permitem o controle do tamanho e do número22 do agregado são uma alternativa viável à técnica de formação de agregados estocásticos resultante do uso de placas de 6 poços de fixação ultrabaixa neste protocolo. A consistência no tempo e no gerenciamento dos tamanhos agregados durante os primeiros 6 dias do protocolo hBVO é um dos, se não o mais, indicadores cruciais do desenvolvimento bem-sucedido de organoides de vasos sanguíneos de boa-fé.
As mudanças de meio no dia 1 (indução do mesoderma) e no dia 4 (indução vascular) devem ser completadas em combinação com a sedimentação dos agregados. Embora a centrifugação seja uma alternativa tentadora, as forças adicionais aplicadas aos aggerates fracamente montados podem causar aglomeração, montagem e cisalhamento indesejados, o que afeta negativamente a diferenciação, maturação e eficácia de brotação nos estágios posteriores do protocolo. Trabalhar no gelo durante o processo de incorporação do dia 6 é fundamental para preservar a polimerização adequada do ECM e a formação da camada. Durante a incorporação de agregados e a indução de brotamento, a exposição do MEC a temperaturas acima de 4°C e/ou a um pH do MEC diferente de 7,4 afetará não apenas as taxas de polimerização e a integridade da camada de MEC, mas também a eficiência de brotação dos agregados incorporados. A natureza elástica da matriz de germinação da MEC permite fácil desprendimento e transporte da placa de cultura de 12 poços para a superfície de corte estéril. Organoides individuais removidos da matriz e transferidos para placas de 96 poços de fixação ultrabaixa consumirão o restante da MEC circundante e reterão redes de microvasos endoteliais revestidas por células murais auto-organizadas com uma membrana basal contínua.
Embora não contempladas nesta proposta, alterações nas composições dos meios podem replicar doenças que, por sua vez, provocam respostas patológicas em hBVOs 8,11. Os limites da modelagem de doenças usando o sistema hBVO estão longe de ser bem conhecidos, e esta é certamente uma área que precisa ser explorada. A aplicação da tecnologia organoide de nossos vasos sanguíneos na vascularização de construções organoides previamenteavasculares23 também é de significativo impacto e interesse.
Divulgações
Não há relação entre os interesses financeiros dos autores e a pesquisa apresentada. A tecnologia de organoides de vasos sanguíneos foi licenciada para a Stemcell Technologies. J.M.P. é fundador e acionista da Angios Biotech, que desenvolve organoides de vasos sanguíneos como terapia de transplante vascular. Um pedido de patente relacionado a este trabalho foi depositado sob o número Pat. US20200199541A1, listando Reiner A. Wimmer, Josef M. Penninger e Dontscho Kerjaschki como inventores.
Agradecimentos
Agradecemos a todos os membros de nossos laboratórios pela contribuição crítica e discussões. A JMP recebeu financiamento da fundação T. von Zastrow, do prêmio FWF Wittgenstein (Z 271-B19), da Academia Austríaca de Ciências, da Empresa Comum Iniciativa de Medicamentos Inovadores 2 (JU) sob o acordo de subvenção nº 101005026, das Redes Transatlânticas de Excelência em Pesquisa Cardiovascular da Leducq, do Programa de Pesquisadores Distintos do Instituto Allen e do Programa de Cátedras de Pesquisa do Canadá 150 F18-01336, bem como dos subsídios F20-02343 e F20-02015 dos Institutos Canadenses de Pesquisa em Saúde COVID-19.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
Referências
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados