Method Article
만능줄기세포(Pluripotent Stem Cells)에서 인간 혈관 오가노이드(Human Blood Vessel Organoids)의 생성
요약
이 프로토콜은 인간 만능 및 유도 만능 줄기 세포로부터 자가 조직화 혈관의 생성을 설명합니다. 이러한 혈관 네트워크는 혈관주위세포, 평활근 액틴 및 연속적인 기저막으로 둘러싸인 광범위하고 연결된 내피 네트워크를 나타냅니다.
초록
오가노이드는 조직 배양 접시에서 해당 장기의 정의된 측면을 연구하는 데 사용할 수 있도록 해당 생체 내 기관을 모방하는 조작된 다세포 시험관 내 조직으로 정의됩니다. 인간 만능 줄기 세포(hPSC) 유래 오가노이드 연구의 폭과 적용은 뇌, 망막, 누관, 심장, 폐, 장, 췌장, 신장 및 혈관을 비롯한 여러 조직을 포함하도록 크게 발전했습니다. 특히 인간 미세혈관 생성 방법의 개발은 시험관 내에서 인간 혈관 발달 및 질병을 모델링하고 SARS-CoV-2를 포함한 바이러스 감염에서 신약 또는 조직 친화성을 테스트 및 분석하는 길을 열었습니다. 시각적 안내가 부족한 복잡하고 긴 프로토콜은 많은 줄기 세포 유래 오가노이드의 재현성을 방해합니다. 또한, 오가노이드 형성 과정과 자기 조직화의 고유한 확률성은 세포 운명 획득 및 프로그래밍에 대한 이해를 향상시키기 위해 광학 프로토콜의 생성을 필요로 합니다. 여기에서는 hPSC로 엔지니어링된 3D 인간 혈관 오가노이드(BVO) 생성을 위한 시각적 유도 프로토콜이 제시됩니다. 연속적인 기저막, 혈관 내피 세포 및 벽화 세포와의 조직화된 관절을 나타내는 BVO는 인간 미세혈관 구조의 기능적, 형태학적, 분자적 특징을 나타냅니다. BVO 형성은 응집체 형성을 통해 시작되고 중배엽 및 혈관 유도가 뒤 따른다. 혈관 성숙 및 네트워크 형성은 3D 콜라겐 및 가용화된 기저막 매트릭스에 응집체를 내장함으로써 시작되고 지원됩니다. 인간 혈관 네트워크는 2-3주 이내에 형성되며 확장 가능한 배양 시스템에서 추가로 성장할 수 있습니다. 중요한 것은 면역이 저하된 마우스에 이식된 BVO가 내인성 마우스 순환과 문합되어 기능성 동맥, 정맥 및 세동맥으로 지정된다는 것입니다. 현재의 시각 유도 프로토콜은 특히 정상적인 발달의 혈관, 조직 혈관 형성 및 질병과 관련하여 인간 오가노이드 연구를 발전시킬 것입니다.
서문
혈관 기능 장애 및 혈관 질환은 장기 기능에 현저한 합병증을 동반합니다. 심혈관 질환(CVD)은 전 세계적으로 주요 사망 원인이며1 미국에서 의료 비용을 증가시키는 주요 원인이기도 합니다. CVD 사례 수는 매년 증가하고 있으며 이러한 사례의 증가는 젊은 연령 그룹(20-45세)에서 발생하고 있습니다2. 혈관, 혈관 질환 및 내피 기능 장애의 발달 및 성숙을 탐색하기 위해 여러 생체 내 모델이 개발되었습니다 3,4. 현재, 줄기 세포에서 유래하거나 생체 내에서 성인 조직에서 분리된 단일 및 다중 계통 정의 세포를 결합하는 방법은 인간 혈관 기능 및 해부학적 측면을 복제하는 혈관 네트워크를 생성할 수 있습니다 5,6. 혈관은 중배엽에서 발달하는 동안 최초의 기능 시스템 중 하나로 등장했으며, "혈관 신생"이라고 불리는 조립 과정을 통해 또는 "혈관 신생"이라고 불리는 기존 혈관의 확장 및 분지에 의해 조직됩니다.7.
Wimmer 등은 발달 생물학과 자기 주도적 조립의 힘을 활용하여 인간 미세혈관 구조의 기능적, 형태학적, 분자적 특성을 나타내는 hPSC의 첫 번째 자기 조직화 3D 인간 혈관 오가노이드를 보고했다8. 인간 혈관구조(human vasculastructure)9와 유사하게, 이들 hBVO는 생성되어 내피(endothelium), 연속적인 기저막(concertment membrane) 및 주변 벽화 세포(mural cell)8,10와 함께 존재한다. hBVO는 생체 내에서 이식될 수 있고 내인성 순환과 문합될 수 있습니다. 또한 시험관 내에서 성숙을 거쳐 심혈관 질환(즉, 당뇨병)8 또는 SARS-CoV-2와 같은 바이러스 감염에서 조직 친화성에 대한 모델 역할을 할 수 있다11. 이전에 서면 프로토콜(10)을 발표했지만, 이 복잡한 기술에 사용할 수 있는 비디오 프로토콜은 존재하지 않습니다.
간결한 단계적 진행을 통해 hBVO 형성은 응집체 형성, WNT 작용제인 Chiron(CHIR99021) 및 골 형태 형성 단백질-4(BMP4)12,13, 혈관 내피 성장 인자 A(VEGFA) 및 포스콜린(Fors)12을 통한 혈관 유도, 맞춤형 발아 매트릭스 8,10에 임베딩을 통해 이루어집니다.. 혈관 성숙 및 네트워크 형성은 발아 매트릭스에 응집체가 매립되는 것을 따릅니다. 이러한 인간 혈관 네트워크는 2-3주 이내에 형성되며 발아 매트릭스에서 제거하고 최대 6개월 동안 확장 가능한 배양 시스템에서 추가로 성장할 수 있습니다. 여기서, 인간 줄기 세포 유래 혈관 구조의 형성 및 적용을 위한 광학 유도 절차가 제공된다.
프로토콜
본원에서 수행된 모든 실험은 상업적으로 입수가능한 H9 인간 iPSC 라인을 사용하였다. 일반적인 상업적으로 및 비상업적으로 이용 가능한 인간 만능 줄기 세포주(즉, H9, NC8)도 이 프로토콜을 사용하여 인간 혈관 오가노이드의 생성에 대해 테스트되고 효과적인 것으로 입증되었습니다. 자세한 내용은 이전에 발표된 보고서 8,10을 참조하십시오.
1. 인간 혈관 오가노이드 생성을 위한 배지 및 시약 제형
- 집계 매체를 준비합니다.
- 녹아웃 DMEM/F12 40mL(인간 ESC 및 iPSC 성장에 최적화된 L-글루타민 또는 HEPES 완충액이 없는 저삼투압 배지), 녹아웃 혈청 대체물(KOSR) 10mL, 0.85% NaCl 중 200mM L-알라닐-L-글루타민 디펩타이드 0.5mL, 비필수 아미노산(NEAA) 0.5mL, 베타-메르캅토에탄올 35μL(BME, 멸균 PBS 10mL에 2-메르캅토에탄올 100μL), 및 Y-27632 (1:200에서 Rho-관련된, 코일 코일 함유 단백질 키나아제[ROCK]14 [10 mM]의 세포-투과성 및 선택적 억제제) ( 재료 표 참조).
- N2B27(N2 및 B27 보충 염기성 배지)을 준비합니다.
- DMEM/F12 25mL, 신경기저 배지 25mL, B27 보충제 1mL, N2 보충제 0.5mL, 0.85% NaCl 중 200mM L-알라닐-L-글루타민 디펩타이드 250μL, 베타메르캅토에탄올 35μL를 혼합합니다( 재료 표 참조).
- 중배엽 유도 배지를 준비합니다.
- N2B27 배지에 ChiR(12μM, 중배엽 유도를 자극하는 GSK3a/b 억제제) 및 BMP-4(30ng/mL, 중배엽 계통을 유도하는 MSX2 활성제)를 보충합니다.
참고: 스톡(ChiR): 10mM(1:833 또는 1.2μL/mL N2B27 사용). 스톡 (BMP-4) : 100 μg / mL (1 : 3333 또는 0.3 μL / mL N2B27 사용) ( 재료 표 참조).
- N2B27 배지에 ChiR(12μM, 중배엽 유도를 자극하는 GSK3a/b 억제제) 및 BMP-4(30ng/mL, 중배엽 계통을 유도하는 MSX2 활성제)를 보충합니다.
- 혈관 유도 배지를 준비하십시오.
- N2B27 배지에 VEGFA(100ng/mL) 및 포스콜린(2μM)을 보충합니다( 재료 표 참조).
- 세포외 기질(ECM)을 준비합니다.
- 12웰 플레이트의 웰 1개에 ECM 1mL를 사용합니다(30-50개의 응집체 매립용). 각 웰에 사용된 ECM 용액 1mL 중 0.5mL를 사용하여 ECM 기초 역할을 할 하단 층 "층 1"을 만들고 최상층 "층 2"에 0.5mL와 응집체를 더합니다. 이 접근법을 사용하면 ECM 현탁액을 통해 인간 혈관 네트워크가 모든 방향으로 싹을 틔울 수 있는 충분한 공간과 지지를 제공합니다.
참고: 전체적으로 ECM 1mL에는 정제된 소 콜라겐 유형 I 500μL, Engelbreth-Holm-Swarm 마우스 육종 세포에서 분비되는 가용화된 기저막 기질 250μL( 재료 표 참조) 및 염기성 기질 용액 250μL(단계 1.5.2). 신선하게 준비하고 사용할 준비가 될 때까지 얼음에 보관하십시오. - 4개의 12-웰 플레이트(48웰)에 대한 염기성 매트릭스 용액을 제조하기 위해, 5.627 mL의 0.1 N NaOH, 2.498 mL의 10x DMEM, 473 μL의 HEPES, 368 μL의 7.5% 중탄산나트륨, 233 μL의 0.85% NaCl 중 200 mM L-알라닐-L-글루타민 디펩타이드, 및 3.451 mL의 Ham's F-12를 혼합한다( 재료 표 참조).
알림: 남은 염기성 매트릭스 용액은 뚜껑이 있는 50mL 고투명 폴리프로필렌 원뿔형 튜브에 넣고 4°C에서 보관하여 최대 2개월 동안 사용할 수 있습니다.
- 12웰 플레이트의 웰 1개에 ECM 1mL를 사용합니다(30-50개의 응집체 매립용). 각 웰에 사용된 ECM 용액 1mL 중 0.5mL를 사용하여 ECM 기초 역할을 할 하단 층 "층 1"을 만들고 최상층 "층 2"에 0.5mL와 응집체를 더합니다. 이 접근법을 사용하면 ECM 현탁액을 통해 인간 혈관 네트워크가 모든 방향으로 싹을 틔울 수 있는 충분한 공간과 지지를 제공합니다.
- 발아 매체를 준비하십시오.
- 구체적으로 인간 조혈 세포의 발달을 지원하기 위해 50mL의 유연한 무혈청 배지(SFM), 1.3mL의 유연 무혈청 배지 영양 보충제, 15% 소 태아 혈청(FBS), 페니실린-스트렙토마이신 250μL, 0.85% NaCl 중 200mM L-알라닐-L-글루타민 디펩타이드 500μL, VEGFA(100ng/mL) 및 FGF2(100ng/mL)를 공식화합니다( 재료 표 참조).
- 차단 버퍼를 준비합니다.
- 소 혈청 알부민 0.5g, 소 태아 혈청 1.5mL, 트윈 20 250μL, 트리톤 X-100 250μL, 데옥시콜산나트륨(1% wt/vol stock) 500μL, 1x 인산염 완충 식염수 47.5mL를 섞습니다( 재료 표 참조). 모든 구성 요소가 잘 통합되고 용액이 깨끗해질 때까지 위아래로 피펫을 사용합니다.
2. 인간 만능줄기세포 및 유도만능줄기세포의 유지 및 배양
- 줄기 세포 배양 배지와 함께 LDEV 없는 환원 성장 인자 기저막 매트릭스(1:50 희석)로 코팅된 6웰 조직 배양 플레이트를 사용하여 세포 배양을 수행합니다( 재료 표 참조).
- 세포가 ~70% 밀도에 도달하면 1mL의 포유류 세포 해리 효소( 재료 표 참조)를 사용하여 37°C에서 3-4분 동안 계대시킵니다.
참고: 1:6의 비율로 세포를 분할하면 세포 생존율이 향상되고 대부분의 인간 줄기 세포주에서 2-4일 이내에 합류성을 달성합니다. 세포 생존율을 증가시키기 위해, ROCK 억제제 Y-27632-보충된(10 mM, 1:1,000) 배양 배지를 계대 후 24시간 동안 사용한다. - 70%의 밀도에 도달할 때까지 매일 배양 배지를 교체하십시오.
참고: 현재 연구의 경우 70% 밀도에서 6웰 세포 배양 플레이트의 한 웰에는 약 100만 개의 H9 hPSC가 포함되어 있습니다.
3. Day 0 - 단세포 현탁액에서 만능 응집체 생성
참고: 6웰 배양 플레이트의 두 웰에서 70%의 밀도는 약 175hBVO를 생성합니다.
- 피펫 또는 진공 시스템을 사용하여 배양 배지를 흡인하고 1mL의 세포 해리 시약( 재료 표 참조)으로 교체하고 37°C에서 5분 동안 배양합니다.
- 세포가 세포 해리 시약 아래에 있는 동안 6웰 초저부착 배양 플레이트에서 원하는 웰 수에 필요한 15mL 원뿔형 튜브에 필요한 부피의 응집 배지(단계 1.1)를 준비합니다( 재료 표 참조).
- 1 mL의 세포 해리 시약을 흡인하고, 1 mL의 응집 배지에 세포를 현탁시킨다. 샘플을 계수하기 전에 부드러운 업-다운 피펫팅으로 단일 세포 현탁액을 만듭니다.
주의: hPSC는 기계적 응력에 매우 민감하며 공격적인 피펫팅을 견딜 수 없습니다. - 현미경 하에서 자동화된 세포 계수 장치(10 ) 또는 표준화된 시스템을 사용하여 세포를 계수한다. 실험에 필요한 셀 번호를 계산합니다.
참고: 세포주에 따라 200,000 세포/웰에서 300,000 세포/웰이 응집체 형성에 이상적인 것으로 간주됩니다(즉, 4웰 = 총 800,000 - 1,200,000 세포). - 적절한 부피의 세포 현탁액을 15mL 고투명 폴리프로필렌 원뿔형 튜브의 응집 배지에 추가합니다. 균질한 세포 분포를 보장하기 위해 희석된 세포 현탁액을 위아래로 부드럽게 피펫팅합니다.
- 희석된 세포 현탁액 3 mL를 6-웰 초저부착 배양 플레이트의 각 원하는 웰에 피펫팅한다.
- 플레이트를 인큐베이터(37°C, 5%CO2, >90% 습도)에 넣고 가능한 한 인큐베이터 도어를 열고 닫지 마십시오.
알림: 이 초기 단계는 저녁이나 인큐베이터 교통량이 적을 때 완료하는 것이 가장 좋습니다. 약간의 진동도 응집체의 크기와 모양에 영향을 미쳐 결과를 손상시킬 수 있습니다.
4. 1일차 - 응집체의 중배엽 유도
- 파종 후 24시간 후에 2-10개의 세포로 구성된 작은 응집체가 현미경으로 보이는지 확인합니다. 응집체를 수집하고, 배지를 중배엽 유도 배지로 변경하기 전에 이들이 침전되도록 한다(단계 1.3).
- 6웰 초저부착 배양 플레이트의 웰당 15mL 고투명 폴리프로필렌 원뿔형 튜브 1개를 설정합니다.
- 원형 운동(예: 오비탈 셰이커)을 사용하여 각 웰의 중앙에 응집체를 모으고, 1mL 피펫을 사용하여 각 웰에서 응집체와 주변 배지를 부드럽게 수집하고, 해당 15mL 고투명 폴리프로필렌 원뿔형 튜브에 넣고, 응집체가 실온에서 침전되도록 합니다.
- 수집이 완료되면 타이머를 1시간으로 설정하는데, 이는 대부분의 세포주/응집체가 이 단계에서 침전되는 데 필요한 시간입니다.
알림: 시간이 1시간 미만이면 15mL 원뿔형 튜브의 바닥에 가라앉지 않았을 수 있는 응집체가 손실될 수 있습니다. - 한 시간이 지나면 조심스럽게 피펫 또는 고감도 흡인 펌프로 상청액을 흡인하십시오. 응집체가 15mL 원뿔형 튜브의 바닥에서 방해받지 않고 유지되는지 확인합니다.
- 각 15mL 원뿔형 튜브의 응집체를 2mL의 중배엽 유도 배지에 재현탁하고 6웰 초저부착 배양 플레이트의 해당 웰에 다시 넣습니다.
- 플레이트를 다시 인큐베이터(37°C)에 넣고 4일까지 방치합니다.
알림: 응집체가 서로 부착되어 성장하는 경우 1mL 피펫을 사용하여 하루에 한 번 응집체의 각 웰을 위아래로 부드럽게 피펫하여 응집체의 크기를 비슷하게 유지합니다.
5. 4일차 - 응집체의 혈관 유도 및 프라이밍
- 응집체를 수집하고, 배지를 혈관 유도 배지로 변경하기 전에 이들이 침전되도록 한다(단계 1.4).
- 6-웰 초저부착 배양 플레이트의 웰당 1개의 15mL 원뿔형 튜브를 설정합니다.
- 원형 운동(예: 오비탈 셰이커)을 사용하여 각 웰의 중앙에 응집체를 모으고, 1mL 피펫을 사용하여 각 웰에서 응집체와 주변 배지를 부드럽게 수집하고, 해당 15mL 원뿔형 튜브에 넣습니다.
- 수집이 완료되면 응집체가 침전될 수 있도록 타이머를 30분으로 설정합니다.
참고: 이 단계에서 대부분의 세포주에는 30분의 시간이 필요합니다. 시간이 30분 미만이면 15mL 코니컬 튜브의 바닥에 가라앉지 않았을 수 있는 응집체가 손실될 위험이 있습니다. - 30분 후 조심스럽게 피펫 또는 고감도 흡인 펌프로 상층액을 흡인합니다. 응집체가 15mL 원뿔형 튜브의 바닥에서 방해받지 않고 유지되는지 확인합니다.
- 각 15mL 원뿔형 튜브의 응집체를 2mL의 혈관 유도 배지에 재현탁하고 6웰 초저부착 배양 플레이트의 해당 웰에 다시 넣습니다.
- 플레이트를 다시 인큐베이터(37°C)에 넣고 6일까지 그대로 두십시오.
참고: 1mL 피펫을 사용하여 하루에 한 번 각 응집체 웰을 위아래로 부드럽게 피펫팅하여 응집체의 크기를 비슷하게 유지하고 서로 자라거나 부착되는 것을 방지합니다.
6. 6일차 - 골재 포매 및 혈관 새싹 유도
- 얼음 위에서 작업하는 동안 ECM 용액의 원하는 최종 부피를 준비합니다(단계 1.5).
참고: 다음은 12웰 플레이트(30-50 응집체)의 한 웰에 대한 프로토콜이며 필요에 따라 조정할 수 있습니다.- 12웰 플레이트 중 하나의 웰에 대해 0.5mL의 ECM을 하단 레이어로 적용하고 0.5mL의 ECM과 응집체를 상단 레이어에 사용합니다. 이것은 효과적인 3D 골재 발아에 필요한 ECM "샌드위치"를 생성합니다.
- 500 μL의 ECM을 12-웰 플레이트의 한 웰에 피펫팅합니다. 기포가 형성되지 않고 우물 바닥과 측면 메니스커스가 완전히 코팅되었는지 확인하십시오. 이것은 ECM 샌드위치의 레이어 1을 포함합니다.
- 플레이트를 37°C에서 2시간 동안 다시 놓습니다.
참고: 효과적인 중합을 위해서는 2시간의 시간이 필요합니다. 시간이 짧아지면 ECM 무결성이 손상될 위험이 있습니다. - 층 1 중합이 끝날 무렵, 원을 그리며 각 웰의 중앙에 응집체를 모으고, 1mL 피펫을 사용하여 각 웰에서 응집체와 주변 배지를 부드럽게 수집하고, 해당 15mL 원뿔형 튜브에 넣습니다.
- 응집체가 10-15분 동안 침전되도록 하고 상층액을 흡인합니다.
- 15mL 원뿔형 튜브에 응집체를 얼음 위에 5분 동안 놓습니다. 냉각하는 동안, 현재 중합 된 층 1을 갖는 12 웰 플레이트를 인큐베이터로부터 꺼낸다.
참고: 응집체를 냉각하면 층 2 ECM의 조기 중합을 방지하는 데 도움이 됩니다. - 기포 형성을 방지하기 위해 신속하고 신중하게 작업하고, 500μL의 ECM에 응집체를 재현탁하고, 이미 중합된 층 1 위에 ECM 응집체 현탁액을 피펫팅합니다. 층 1을 만지지 않도록 주의하면서 200μL 피펫 팁을 사용하여 층 2와 응집체를 웰 주위에 부드럽게 분배합니다.
- 플레이트를 37°C에서 2시간 동안 다시 놓습니다.
참고: 효과적인 ECM 중합을 위해서는 2시간의 배양 시간이 필요합니다. 시간이 짧을수록 ECM 무결성이 손상될 위험이 있으며 레이어 1과 레이어 2 사이의 강한 접착을 방지할 수 있습니다. - 혈관 분화를 유도하기 위해 미리 가온된(37°C) 발아 배지 1mL(단계 1.6)를 추가합니다. 발아 혈관은 매립 후 1일에서 3일 사이에 나타나야 합니다. 3 일 후에 배지를 교체 한 다음 격일로 교체하십시오.
알림: 발아 매체는 미리 예열되어야 합니다. 그렇지 않으면 레이어 분리가 발생할 수 있으며 ECM 무결성에 영향을 줄 수 있습니다.
7. 11일차 - BVO의 분리 및 성숙
- 무균 상태에서 작업하려면 무균 주걱의 둥근 끝을 사용하여 혈관 네트워크를 포함하는 ECM 발아 매트릭스를 풉니다. 이 단계에서 젤은 자유 부동 디스크와 유사해야합니다.
- 멸균 집게와 멸균 주걱의 둥근 끝을 사용하여 젤 디스크 (혈관 네트워크 포함)를 10cm 배양 접시의 뚜껑으로 조심스럽게 옮깁니다.
- 원하는 배율과 초점으로 조정된 실체현미경 아래에 뚜껑과 젤을 놓고 멸균 바늘을 사용하여 단일 혈관 네트워크를 절단하여 이 과정에서 얻은 혈관화되지 않은 ECM의 양을 제한합니다.
참고: 세포는 시간이 지남에 따라 주변 ECM을 자연적으로 분해합니다. 그러나 각 오가노이드로 절단되는 양을 줄이면 이미지 품질과 독립형 혈관 네트워크 무결성이 향상됩니다. - 모든 오가노이드가 겔에서 분리되면 3mL의 발아 배지가 있는 초저부착 6웰 플레이트의 한 웰로 부드럽게 다시 옮깁니다. 이 단계에서 오가노이드는 밤새 방치하거나 즉시 7.4단계로 진행할 수 있습니다.
- 1mL 피펫을 사용하여 단일 오가노이드를 6웰 플레이트에서 초저 부착 96웰 플레이트의 웰로 옮깁니다. 일단 옮겨지면, 200 μL의 미리 데워진(37°C) 발아 배지를 96-웰 플레이트의 각 웰에 추가한다.
참고: 12웰 플레이트의 혈관 오가노이드 웰 1웰은 96웰 플레이트의 30-40웰을 채워야 합니다. - 96웰 플레이트에서 분리한 후 4-6일이 지나면 오가노이드가 둥글고 건강한 형태를 갖는지 확인합니다. 이 단계에서 오가노이드는 고정될 준비가 되어 염색을 위해 준비됩니다.
8. 15일차 - BVO의 고정, 차단 및 염색
- 절단된 1mL 팁을 사용하여 오가노이드를 1.5mL 미세원심분리기 튜브에 옮깁니다.
- BVO의 흡인을 피하기 위해 200μL 또는 1,000μL 피펫을 사용하여 미세원심분리기 튜브에 남아 있는 발아 배지를 제거한 다음 PBS에 4% PFA 1mL를 1시간 동안 추가합니다.
알림: 실온에서 오비탈 셰이커(125rpm)에 고정하는 것이 좋습니다. 최대 60개의 BVO/미세 원심분리기 튜브가 허용됩니다. 더 이상 BVO는 고정 및 세척 효능을 손상시킵니다.
주의 : PFA는 유해한 화학 물질입니다. 흄 후드에서 주의해서 사용하고 제조업체의 사용 지침과 적절한 폐기 방법을 따르십시오. - 새로 고정된 BVO를 0.25% PBS-트윈으로 매번 15분 동안 3회 세척합니다.
- 오가노이드의 직경이 1mm보다 큰 경우 실온에서 30-60분 동안 PBS에서 1% Triton X-100으로 BVO를 투과시킵니다.
- 모든 0.25% PBS-트윈을 흡인하고, 1 mL의 블로킹 완충액을 첨가한다 (단계 1.7).
참고: 항체에 의존적이기는 하지만 오비탈 셰이커(125rpm)에서 실온에서 2시간 동안 염색 과정에서 비특이적 항체 결합을 감소시키기에 충분합니다. 오가노이드는 4°C의 블로킹 완충액에 최대 2주 동안 보관할 수 있습니다. - 블로킹 완충액을 제거하고, 블로킹 버퍼 1mL에 희석된 1차 항체(1:100)를 첨가한다. 오비탈 셰이커(12rpm)에서 4°C에서 밤새 유지하여 오가노이드가 1차 항체 용액에 잠긴 상태를 유지하도록 합니다.
참고: 하룻밤 1차 항체 배양은 이 연구에 사용된 항체에 적합합니다. 필요한 1차 및 2차 항체 및 이들의 각각의 희석액은 물질 표에 제공된다. - 하룻밤 동안 1차 항체 인큐베이션에 이어, 1차 항체 용액을 제거하고 0.25% PBS-트윈으로 매번 15분 동안 3x 세척하였다.
- 블로킹 완충액 1mL에 희석된 2차 항체(1:250)와 DAPI(1:1,000)를 첨가하고 실온 또는 4°C에서 밤새 2시간 동안 배양합니다.
참고: 샘플이 올바르게 준비되면(위에서 설명한 대로) 실온에서 2시간 동안 또는 4°C에서 밤새 배양하는 것이 본 연구에 사용된 항체에 적합합니다. - 인큐베이션 후, 2차 항체 용액을 제거하고, 0.25% PBS-Tween으로 매회 15분 동안 3x 세척하였다.
참고: 염색 후 오가노이드는 최대 2주 동안 PBS에 보관할 수 있습니다.
9. 혈관 오가노이드(BVO)의 장착
- 마운팅 스페이서를 원하는 이미징 커버슬립에 붙입니다( 재료 표 참조).
- 절단된 1mm 피펫 팁을 사용하여 1mL 피펫을 사용하여 단일 오가노이드를 스페이서 웰로 옮기고 나머지 PBS를 흡인합니다.
- 75°C로 가열된 150-200μL의 투명 용액( 재료 표 참조)으로 웰을 채우고 오가노이드를 완전히 잠급니다.
알림: samples는 따뜻해진 청소 용액에 노출된 후 1시간 이내에 투명해져야 합니다.- 오가노이드가 투명해지도록 덮개를 씌운 상자에 넣어 실온에서 6시간 내지 하룻밤 동안 실온에 두어 1시간 청소 시간이 충분하지 않은 경우 하룻밤 동안 두십시오. 샘플을 밤새 방치하는 경우 건조를 방지하기 위해 충분한 세척 용액이 있는지 확인하십시오.
- 세척 후 100-200 μL 피펫 팁으로 세척 용액을 조심스럽게 흡입합니다. 오가노이드를 스페이서 웰의 중앙으로 부드럽게 움직이고 웰이 가득 찰 때까지 마운팅 젤 방울( 재료 표 참조)을 추가합니다(제어된 가열 블록에서 75°C로 예열).
- 두 번째 커버슬립을 마운팅 스페이서 위에 부드럽게 놓아 s를 밀봉합니다.amp하단과 상단 커버슬립 사이의 공간에 s. 마운팅 젤을 4°C의 어두운 곳에서 밤새 경화시킵니다.
알림: 경화 후 탑코트 매니큐어를 사용하여 장착된 샘플을 추가로 밀봉할 수 있습니다.
결과
이 프로토콜에 설명된 단계는 hPSC에서 인간 혈관 오가노이드를 생성하기 위한 제어되고 정확한 방법을 산출하기 위해 특별히 개발되었습니다. hPSC 배양에서 직경 30-100μm의 응집체 생성은 프로토콜의 시작점을 표시합니다(그림 1, 그림 2B). 응집체는 혈관 네트워크 형성에 필요한 임베딩(6일) 전에 중배엽(1일-4일) 및 혈관 계통(4일-6일)으로의 단계적 유도를 통해 유도됩니다(그림 2A-D). 방사상 대칭에 가까운 혈관 발아는 d7 또는 d8(그림 2E)에서 볼 수 있어야 하며 d10(그림 2F,G)까지 계속되어야 합니다. ECM에서 96웰 초저 부착 플레이트로 hBVO를 이식하면 발아 네트워크의 취약성이 줄어들고 최대 6개월 동안 현탁 배양(그림 2H) 조건에서 지속적인 유지 관리가 가능합니다. d15까지 hBVO는 혈관주위세포(PDGFR-ß+) 및 평활근 액틴(SMA+)으로 둘러싸인 광범위하고 연결된 내피(CD31+) 네트워크를 나타냅니다(그림 3A-D). 연속 콜라겐 IV(ColIV+) 기저막이 혈관 네트워크를 둘러싸고 있습니다(그림 3E). 내피 세포(CD31+, VE-Cadherin+)와 혈관주위세포(PDGFR-ß+)는 각각 오가노이드 세포 집단의 약 30%-35% 및 60%-65%를 차지한다8. 혈관의 활성 발아는 과도한 필리포디아 8,10과 같은 전형적인 팁 세포 형태를 나타내는 내인성으로 조직된 팁 세포(CD31+) 집단의 지시에 따라 발생합니다. 내피 혈관 네트워크를 캡슐화하는 PDGFR-ß+ 및 SMA+ 벽화 세포의 발현은 오가노이드 성숙 과정의 d15에서 볼 수 있습니다(그림 3A,C). ECM에서 제거하고 현탁 배양(즉, d15)에서 성숙한 후, hBVO는 마우스 신장 캡슐 아래에서 각각의 분석 또는 이식을 위해 유지될 수 있습니다.

그림 1: 타이밍 및 단계적 진행을 강조하는 hBVO 프로토콜의 개략도. 겉보기에 균질한 hPSC 또는 hiPSC 배양물로부터, 응집체 형성은 Rho-키나제 억제제 Y27632의 존재 하에서 일어난다. BMP4 및 CHiR 보충 배지는 응집체가 중배엽 운명을 향하도록 지시하는 데 사용됩니다. 중배엽 유도 배지는 VEGFA 및 포스콜린 보충 배지로 대체되어 혈관 계통을 향한 응집체를 자극합니다. 콜라겐 I 및 가용화된 기저막 매트릭스에 응집체를 매립하고 VEGFA 및 FGF2 함유 배지에 노출시킴으로써 달성된 기계적 및 화학적 대기열은 응집체로부터 거의 방사상 대칭적인 혈관 발아를 초래한다. 생성된 혈관 네트워크는 콜라겐 I 및 가용화된 기저막으로부터 제거될 수 있고, 추가의 성숙, 분석, 또는 생체내 이식을 위해 현탁 배양물에 배치될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 명시야에서 캡처된 hBVO 생성의 단계적 진행. (A) -1일째 hPSC(H9) 콜로니의 전형적인 형태. (B) Y-27632의 존재 하에 6-웰 초저 부착 플레이트에서 hPSC 응집체(0일)의 생성. (C) BMP4 및 ChiR 보충 배지를 사용한 응집체의 중배엽 유도(1일차). 응집체 크기와 모양의 미묘한 변화도 관찰할 수 있습니다. (D) VEGFA 및 포스콜린 보충 배지를 사용하여 혈관 계통을 향해 프라이밍된 4일차 응집체. (E) 응집체를 발아 매트릭스에 포매하고 VEGFA 및 FGF2 보충 발아 배지에 노출시킨 지 1일째 되는 날(7일째)에 초기 혈관 발아. (F) 건강한 오가노이드 형태 및 9일째에 지속적인 혈관 발아. (G) 10일째에 싹이 트는 후기 단계 혈관. 이상적으로는 오가노이드 중심의 조밀한 세포 구조가 이때까지 사라졌습니다. (H) 성숙한(15일) 인간 혈관 오가노이드의 전형적인 형태. 초저부착 96웰 배양 플레이트에서 절단 및 성숙을 통해 주변 매트릭스를 제거하면 내부에 수용된 혈관 네트워크와 함께 오가노이드가 구형으로 형성됩니다. 스케일 바: (A,B,E,F) 250 μm; (C,D) 500 마이크로미터; (G,H) 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
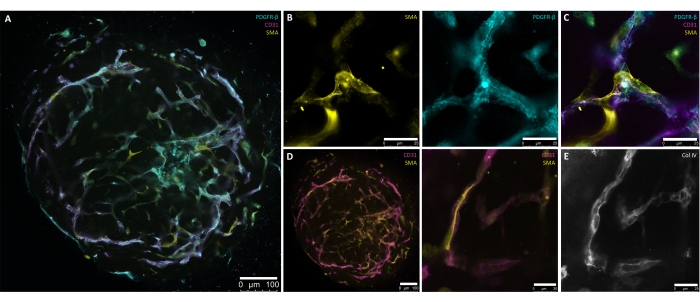
그림 3: 성숙한(15일) 인간 혈관 오가노이드의 전체 마운트 염색. (A) 자가 조직화된 내피(CD31+, 자홍색) 네트워크 및 주변 혈관주위세포(PDGFR-β+, 청록색) 및 알파 평활근 액틴(SMA+, 노란색) 커버리지를 가진 성숙한(15일) 인간 혈관 오가노이드의 제시. (B) 혈관 네트워크의 SMA+(노란색) 및 PDGFR-β+(청록색) 표현을 자세히 설명하는 A의 고배율. (C) 내피(CD31+, 자홍색), 혈관주위세포(PDGFR-β+, 청록색) 및 알파-평활근 액틴(SMA+, 노란색) 상호작용의 상세한 표현. (D) 성숙한 혈관 오가노이드의 단면(왼쪽) 및 고배율(오른쪽)에서 혈관 내피(CD31+, 자홍색)-평활근(SMA+, 노란색) 상호 작용의 전체 마운트 염색. (E) 벽화 세포와 내피관의 긴밀한 결합을 통한 혈관 기저막(Col IV+, 그레이스케일)의 자기 주도적 형성. 스케일 바: (A,D[왼쪽]) 100 μm; (B,D[오른쪽],E) 25μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
줄기 세포 유래 오가노이드 배양의 최근 돌파구는 인간 혈관 구조의 보다 발전되고 생리학적으로 관련된 모델을 위한 프레임워크를 제공했습니다. 여기에 제시된 인간 혈관 오가노이드(hBVO) 모델은 우리 실험실(8,10)에서 개발되었으며, 인간 혈관 형성의 추가 측면뿐만 아니라 질병 모델링 및 재생 요법(8,10,11)의 새로운 방법을 탐색하는 강력한 수단을 제공합니다. 혈관, 혈관 질환 및 내피 기능 장애의 발달 및 성숙을 탐색하기 위해 여러 생체 내 모델이 사용되었습니다 3,4. 다양한 접근법은 줄기 세포에서 유래하거나 생체 내 성인 조직에서 분리된 단일 및 다중 계통 정의 세포를 결합하여 복제성 인간 혈관 네트워크를 생성합니다 5,6. 여기에 제시된 프로토콜은 발달 생물학 및 자기 조직화의 원리를 활용하여 본질적으로 단일 hPSC 8,10에서 생성될 수 있는 최초의 다세포 계통 인간 혈관 네트워크를 생성합니다.
각 줄기세포주는 고유한 유전적 구성을 가지고 있으며 소싱, 기능 및 반응성 측면에서 다른 세포주와 다릅니다15. 따라서, 인간 혈관 오가노이드(hBVO)에 대한 프로토콜은 다수(>12)의 서로 다른 hPSC 라인(8,10)과의 강력하고 재현 가능한 프로토콜 호환성을 보장하기 위해 개발 및 최적화되었습니다. 여기에 설명된 방법은 2주에 걸쳐 hPSC 유래 혈관 오가노이드를 생성합니다. 그러나, 배지 조성 및/또는 hBVO 생성 기술의 변경은 비효율적인 혈관 네트워크 및 오가노이드 생성으로 이어질 수 있다. 개별 줄기 세포주의 다양한 증식 속도는 줄기 세포 실험15 및 오가노이드 배양의 재현성에도 현저한 영향을 미친다. 예를 들어, BVO를 생성할 때, 더 많은 증식 세포 또는 더 많은 수의 큰 1일차 응집체는 본질적으로 상이한 대사 환경 및 가스 및 영양소 확산 파라미터의 영향을 받습니다. 이것은 차례로 성장 인자 노출 시간 및 효율, 분화 및 혈관 프라이밍 정도, 그리고 가장 중요한 것은 콜라겐 1 및 가용화된 기저막 매트릭스에 응집체를 매립할 때 혈관 네트워크를 형성하는 능력을 변화시킵니다.
외부 환경으로부터 산소의 수동적 확산과 필수 영양소의 투여는 시험관 내에서 3D 오가노이드의 장기 세포 성장과 조직 형태 형성에 이상적이지 않다 16. 비록 몇몇 요인들(즉, 조직 대사율, 영양소 및 기체 생체이용률, 정적 또는 동적 환경)에 의존하지만, 생리학적으로 인간 조직은 관류된 혈관으로부터 150 μm 이내에 살아있는 세포의 탯줄을 존재한다는 것을 고려하여, 시험관 내에서 배양된 조직에 대해 일반적인 150 μmO2 및 영양소 확산 한계가 확립되었다17. 70-200 μm의 유효 기체 및 영양소 확산 거리도 18,19,20,21로 제안되었지만, 작제물 밀도, 온도, pH 및 배지 조성은 확산 효능에 상당한 영향을 미친다. 6일차 포매 후 표면적 최적화 및 인테그린-베타 수용체 통신으로 인해 직경 250-300μm의 응집체가 직경 >500-600μm의 응집체보다 더 나은 성능을 발휘하여 완전한 혈관 발아 과정과 최소 응축 오가노이드 코어를 생성합니다. 따라서 응집체 크기는 매우 중요하며 초기 파종 중에 사용된 세포 수와 응집체 형성에 할당된 시간 모두에 의해 영향을 받을 수 있습니다. 응집체 크기 및수 22를 제어할 수 있는 마이크로웰 플레이트는 이 프로토콜에서 초저 부착 6웰 플레이트의 사용으로 인한 확률론적 응집체 형성 기술에 대한 실행 가능한 대안입니다. hBVO 프로토콜의 처음 6일 동안 타이밍의 일관성과 응집체 크기 관리는 선의의 혈관 오가노이드를 성공적으로 개발하는 데 가장 중요한 지표 중 하나입니다.
1일차(중배엽 유도) 및 4일차(혈관 유도)의 배지 변화는 응집체의 침강과 함께 완료되어야 합니다. 원심분리가 매력적인 대안이지만, 약하게 조립된 응집체에 가해지는 추가 힘은 원치 않는 응집, 조립 및 전단을 유발할 수 있으며, 이는 프로토콜의 후반 단계에서 분화, 성숙 및 발아 효능에 부정적인 영향을 미칩니다. 6일차 임베딩 공정 동안 얼음 위에서 작업하는 것은 적절한 ECM 중합 및 층 형성을 보존하는 데 중요합니다. 골재 포매 및 발아 유도 중에 ECM을 4°C 이상의 온도 및/또는 7.4 이외의 ECM pH에 노출시키면 중합 속도 및 ECM 층 무결성뿐만 아니라 포매된 골재의 발아 효율에도 영향을 미칩니다. ECM 발아 매트릭스의 탄성 특성으로 인해 12웰 배양 접시에서 멸균 절단 표면으로 쉽게 분리 및 운반할 수 있습니다. 매트릭스에서 제거되고 초저 부착 96웰 플레이트로 옮겨진 개별 오가노이드는 나머지 주변 ECM을 소비하고 연속적인 기저막으로 자체 조직화된 벽화 세포 코팅 내피 미세혈관 네트워크를 유지합니다.
이 제안에서 다루지는 않았지만, 배지 구성의 변경은 hBVO에서 병리학적 반응을 유발하는 질병을 복제할 수 있습니다 8,11. hBVO 시스템을 사용한 질병 모델링의 경계는 잘 알려져 있지 않으며 이것은 확실히 탐구가 필요한 영역입니다. 이전에 무혈성 오가노이드 구조체(23)의 혈관화에 우리의 혈관 오가노이드 기술을 적용하는 것 또한 상당한 영향과 관심을 끌고 있다.
공개
저자의 재정적 이익과 제시된 연구 사이에는 아무런 관계가 없습니다. 혈관 오가노이드 기술은 Stemcell Technologies에 라이선스가 부여되었습니다. JMP는 혈관 이식 요법으로 혈관 오가노이드를 개발하는 Angios Biotech의 설립자이자 주주입니다. 이 저작물과 관련된 특허 출원은 특허 번호로 제출되었습니다. US20200199541A1, Reiner A. Wimmer, Josef M. Penninger 및 Dontscho Kerjaschki를 발명가로 나열했습니다.
감사의 말
중요한 의견과 토론을 해주신 모든 실험실 구성원에게 감사드립니다. JMP는 T. von Zastrow 재단, FWF 비트겐슈타인 상(Z 271-B19), 오스트리아 과학 아카데미, 보조금 계약 No 101005026에 따른 Innovative Medicines Initiative 2 Joint Undertaking (JU), Leducq Transatlantic Networks of Excellence in Cardiovascular Research, Allen Institute Distinguished Investigator Program, Canada 150 Research Chairs Program F18-01336, 캐나다 보건원 COVID-19 보조금 F20-02343 및 F20-02015로부터 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
참고문헌
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유