Method Article
Generazione di organoidi dei vasi sanguigni umani da cellule staminali pluripotenti
In questo articolo
Riepilogo
Questo protocollo descrive la generazione di vasi sanguigni auto-organizzanti da cellule staminali pluripotenti e pluripotenti indotte umane. Queste reti di vasi sanguigni mostrano una rete endoteliale estesa e connessa circondata da periciti, actina muscolare liscia e una membrana basale continua.
Abstract
Un organoide è definito come un tessuto multicellulare in vitro ingegnerizzato che imita il suo corrispondente organo in vivo in modo tale che possa essere utilizzato per studiare aspetti definiti di quell'organo in un piatto di coltura tissutale. L'ampiezza e l'applicazione della ricerca sugli organoidi derivati dalle cellule staminali pluripotenti umane (hPSC) sono avanzate in modo significativo per includere il cervello, la retina, il dotto lacrimale, il cuore, il polmone, l'intestino, il pancreas, i reni e i vasi sanguigni, tra molti altri tessuti. Lo sviluppo di metodi per la generazione di microvasi umani, in particolare, ha aperto la strada alla modellazione dello sviluppo e della malattia dei vasi sanguigni umani in vitro e per la sperimentazione e l'analisi di nuovi farmaci o trofismo tissutale nelle infezioni virali, incluso SARS-CoV-2. Protocolli complessi e lunghi privi di guida visiva ostacolano la riproducibilità di molti organoidi derivati da cellule staminali. Inoltre, la stocasticità intrinseca dei processi di formazione degli organoidi e l'auto-organizzazione richiede la generazione di protocolli ottici per far progredire la comprensione dell'acquisizione e della programmazione del destino cellulare. Qui, viene presentato un protocollo visivamente guidato per la generazione di organoidi 3D dei vasi sanguigni umani (BVO) progettati da hPSC. Presentando una membrana basale continua, cellule endoteliali vascolari e articolazione organizzata con cellule murali, i BVO mostrano le caratteristiche funzionali, morfologiche e molecolari della microvascolarizzazione umana. La formazione di BVO viene avviata attraverso la formazione di aggregati, seguita da mesoderma e induzione vascolare. La maturazione vascolare e la formazione della rete sono iniziate e supportate incorporando aggregati in una matrice di membrana basale 3D e collagene solubilizzata. Le reti di vasi umani si formano entro 2-3 settimane e possono essere ulteriormente coltivate in sistemi di coltura scalabili. È importante sottolineare che i BVO trapiantati in topi immunocompromessi si anastomizzano con la circolazione endogena del topo e si specificano in arterie, vene e arteriole funzionali. L'attuale protocollo a guida visiva farà progredire la ricerca sugli organoidi umani, in particolare in relazione ai vasi sanguigni nel normale sviluppo, alla vascolarizzazione dei tessuti e alle malattie.
Introduzione
La disfunzione vascolare e le malattie dei vasi sanguigni presentano marcate complicanze nelle funzioni degli organi. Le malattie cardiovascolari (CVD) sono la principale causa di morte in tutto il mondo1 ed è anche il principale fattore che contribuisce all'aumento dei costi sanitari negli Stati Uniti. Il numero di casi di CVD aumenta ogni anno e un numero crescente di questi casi si verifica nei gruppi di età più giovani (20-45 anni)2. Sono stati sviluppati diversi modelli in vivo per esplorare lo sviluppo e la maturazione dei vasi sanguigni, la malattia vascolare e la disfunzione endoteliale 3,4. Attualmente, i metodi che combinano cellule singole e multiple definite dal lignaggio derivate da cellule staminali o isolate da tessuti adulti in vivo possono creare reti vascolari che replicano aspetti della funzione vascolare umana e dell'anatomia 5,6. I vasi sanguigni sono emersi come uno dei primi sistemi funzionali durante lo sviluppo dal mesoderma e si organizzano attraverso un processo di assemblaggio chiamato "vasculogenesi" o per espansione e ramificazione da vasi preesistenti, che è chiamato "angiogenesi"7.
Sfruttando il potere della biologia dello sviluppo e dell'assemblaggio auto-diretto, Wimmer et al. hanno riportato i primi organoidi 3D di vasi sanguigni umani auto-organizzanti da hPSC che mostrano le caratteristiche funzionali, morfologiche e molecolari della microvascolarizzazione umana8. Simili alla vascolarizzazione umana9, queste hBVO sono generate e presenti con un endotelio, una membrana basale continua e cellule murali circostanti 8,10. Le hBVO possono essere trapiantate in vivo e anastomoizzate con la circolazione endogena. Possono anche subire una maturazione in vitro e servire come modelli per le malattie cardiovascolari (cioè il diabete)8 o il trofismo tissutale nelle infezioni virali come SARS-CoV-211. Mentre in precedenza abbiamo pubblicato un protocollo scritto10, non esiste un protocollo video disponibile per questa tecnica altrimenti complessa.
Attraverso una concisa progressione graduale, la formazione di hBVO si realizza attraverso la formazione di aggregati, l'induzione del mesoderma utilizzando un agonista WNT, Chirone (CHIR99021) e la proteina morfogenetica ossea - 4 (BMP4)12,13, l'induzione vascolare tramite il fattore di crescita endoteliale vascolare A (VEGFA) e Forskolin (Fors)12 e l'incorporazione in una matrice di germinazione personalizzata 8,10. La maturazione vascolare e la formazione della rete seguono l'incorporazione degli aggregati nella matrice di germinazione. Queste reti di vasi umani si formano entro 2-3 settimane e possono essere rimosse dalla matrice di germinazione e ulteriormente coltivate in sistemi di coltura scalabili per un massimo di 6 mesi. Qui vengono fornite procedure otticamente guidate per la formazione e l'applicazione di vascolarizzazione derivata da cellule staminali umane.
Protocollo
Tutti gli esperimenti qui eseguiti hanno utilizzato la linea H9 human iPSC disponibile in commercio. Anche le comuni linee di cellule staminali pluripotenti umane disponibili in commercio e non in commercio (cioè H9, NC8) sono state testate e si sono dimostrate efficaci per la generazione di organoidi dei vasi sanguigni umani utilizzando questo protocollo. Per i dettagli, si prega di fare riferimento ai nostri rapporti precedentemente pubblicati 8,10.
1. Formulazione di terreni e reagenti per la generazione di organoidi dei vasi sanguigni umani
- Preparare il mezzo di aggregazione.
- Miscelare 40 mL di DMEM/F12 knock-out (mezzo a bassa osmolalità senza L-glutammina o tampone HEPES ottimizzato per la crescita umana di ESC e iPSC), 10 mL di sostituto sierico knock-out (KOSR), 0,5 mL di 200 mM di L-alanil-L-glutammina dipeptide in 0,85% NaCl, 0,5 mL di aminoacidi non essenziali (NEAA), 35 μL di beta-mercaptoetanolo (BME, 100 μL di 2-mercaptoetanolo in 10 mL di PBS sterile), e Y-27632 (inibitore selettivo e permeabile alle cellule della proteina chinasi Rho-associata, a spirale contenente proteina chinasi [ROCK]14 [10 mM] a 1:200) (vedi Tabella dei materiali).
- Preparare N2B27 (N2 e B27 integrato terreno di base).
- Mescolare 25 mL di DMEM/F12, 25 mL di mezzi neurobasali, 1 mL di integratore B27, 0,5 mL di integratore di N2, 250 μL di 200 mM di L-alanil-L-glutammina dipeptide in 0,85% NaCl e 35 μL di beta-mercaptoetanolo (vedere Tabella dei materiali).
- Preparare il mezzo di induzione del mesoderma.
- Integratore N2B27 con ChiR (12 μM, induzione del mesoderma stimolante l'inibitore GSK3a/b) e BMP-4 (30 ng/mL, linea mesoderma induttore dell'attivatore MSX2).
NOTA: Stock (ChiR): 10 mM (utilizzare 1:833 o 1,2 μL/mL N2B27). Stock (BMP-4): 100 μg/mL (utilizzare 1:3333, o 0,3 μL/mL N2B27) (vedere Tabella dei materiali).
- Integratore N2B27 con ChiR (12 μM, induzione del mesoderma stimolante l'inibitore GSK3a/b) e BMP-4 (30 ng/mL, linea mesoderma induttore dell'attivatore MSX2).
- Preparare il mezzo di induzione vascolare.
- Integrare il terreno N2B27 con VEGFA (100 ng/ml) e forskolina (2 μM) (vedere Tabella dei materiali).
- Preparare la matrice extracellulare (ECM).
- Utilizzare 1 mL di ECM per un pozzetto di una piastra a 12 pozzetti (per incorporare 30-50 aggregati). Di 1 mL di soluzione ECM utilizzata per ciascun pozzetto, utilizzare 0,5 mL per creare uno strato inferiore, "layer 1", che fungerà da base ECM, e 0,5 mL più aggregati per lo strato superiore, "layer 2". L'utilizzo di questo approccio fornisce, attraverso la sospensione ECM, spazio e supporto sufficienti affinché le reti dei vasi sanguigni umani germoglino in tutte le direzioni.
NOTA: Complessivamente, 1 mL di ECM contiene 500 μL di collagene bovino purificato tipo I, 250 μL di matrice di membrana basale solubilizzata secreta da cellule di sarcoma di topo Engelbreth-Holm-Swarm (vedere Tabella dei materiali) e 250 μL di soluzione di matrice basica (fase 1.5.2). Preparatelo fresco e conservatelo in ghiaccio fino al momento dell'uso. - Per preparare la soluzione di matrice di base per quattro piastre da 12 pozzetti (48 pozzetti), mescolare 5,627 ml di 0,1 N NaOH, 2,498 ml di 10x DMEM, 473 μL di HEPES, 368 μL di bicarbonato di sodio al 7,5%, 233 μL di 200 mM di L-alanil-L-glutammina dipeptide in 0,85% NaCl e 3,451 mL di F-12 di prosciutto (vedi Tabella dei materiali).
NOTA: La soluzione di matrice di base rimanente può essere collocata in un tubo conico di polipropilene ad alta trasparenza da 50 mL e conservata a 4 °C per un uso fino a 2 mesi.
- Utilizzare 1 mL di ECM per un pozzetto di una piastra a 12 pozzetti (per incorporare 30-50 aggregati). Di 1 mL di soluzione ECM utilizzata per ciascun pozzetto, utilizzare 0,5 mL per creare uno strato inferiore, "layer 1", che fungerà da base ECM, e 0,5 mL più aggregati per lo strato superiore, "layer 2". L'utilizzo di questo approccio fornisce, attraverso la sospensione ECM, spazio e supporto sufficienti affinché le reti dei vasi sanguigni umani germoglino in tutte le direzioni.
- Preparare il mezzo di germinazione.
- In particolare, formulare 50 mL di terreno flessibile privo di siero (SFM) per supportare lo sviluppo di cellule ematopoietiche umane, un'aliquota di 1,3 mL dell'integratore nutritivo flessibile senza siero, siero bovino fetale (FBS) al 15%, 250 μL di penicillina-streptomicina, 500 μL di 200 mM di L-alanil-L-glutammina dipeptide in 0,85% NaCl, VEGFA (100 ng/mL) e FGF2 (100 ng/mL) (vedi Tabella dei materiali).
- Preparare il buffer di blocco.
- Mescolare 0,5 g di albumina sierica bovina, 1,5 mL di siero bovino fetale, 250 μL di Tween 20, 250 μL di Triton X-100, 500 μL di desossicolato di sodio (1% p.c/vol di stock) e 47,5 mL di soluzione salina tamponata con fosfato 1x (vedere Tabella dei materiali). Pipettare su e giù fino a quando tutti i componenti sono ben incorporati e la soluzione è limpida.
2. Mantenimento e coltura di cellule staminali pluripotenti e pluripotenti umane
- Eseguire la coltura cellulare utilizzando piastre di coltura tissutale a 6 pozzetti rivestite con matrice basale a fattore di crescita ridotto privo di LDEV (diluizione 1:50) con terreno di coltura di cellule staminali (vedere Tabella dei materiali).
- Una volta che le cellule raggiungono ~ 70% di confluenza, passarle usando 1 ml di enzima dissociante delle cellule di mammifero (vedi Tabella dei materiali) per 3-4 minuti a 37 ° C.
NOTA: La divisione delle cellule in un rapporto di 1:6 migliora la vitalità cellulare e raggiunge la confluenza entro 2-4 giorni per la maggior parte delle linee di cellule staminali umane. Per aumentare la vitalità cellulare, il terreno di coltura integrato con ROCK Y-27632 (10 mM, 1:1.000) viene utilizzato per 24 ore dopo il passaggio. - Cambiare il terreno di coltura ogni giorno fino a raggiungere una confluenza del 70%.
NOTA: Per il presente studio, al 70% di confluenza, un pozzetto di una piastra di coltura cellulare a 6 pozzetti contiene circa 1 milione di H9 hPSC.
3. Giorno 0 - Generazione di aggregati pluripotenti da una sospensione monocellulare
NOTA: Una confluenza del 70% in due pozzetti di una piastra di coltura a 6 pozzetti produrrà circa 175 hBVO.
- Utilizzando una pipetta o un sistema a vuoto, aspirare il terreno di coltura, sostituirlo con 1 mL di reagente di dissociazione cellulare (vedere Tabella dei materiali) e incubare per 5 minuti a 37 °C.
- Mentre le cellule sono sotto il reagente di dissociazione cellulare, preparare il volume necessario di mezzo di aggregazione (fase 1.1) in un tubo conico da 15 mL secondo necessità per il numero desiderato di pozzetti in una piastra di coltura a 6 pozzetti a bassissimo attacco (vedere Tabella dei materiali).
- Aspirare 1 mL di reagente di dissociazione cellulare e sospendere le cellule in 1 mL di mezzo di aggregazione. Creare una sospensione a cella singola con un delicato pipettaggio verso l'alto e verso il basso prima di contare i campioni.
ATTENZIONE: le hPSC sono abbastanza sensibili alle sollecitazioni meccaniche e non tollerano il pipettaggio aggressivo. - Contare le cellule utilizzando un dispositivo automatico di conteggio delle cellule10 o un sistema standardizzato al microscopio. Calcolare il numero di cella necessario per l'esperimento.
NOTA: A seconda della linea cellulare, da 200.000 cellule / pozzetto a 300.000 cellule / pozzetto è considerato ideale per la formazione di aggregati (cioè 4 pozzetti = da 800.000 a 1.200.000 cellule in totale). - Aggiungere il volume appropriato della sospensione cellulare al mezzo di aggregazione nel tubo conico in polipropilene ad alta trasparenza da 15 ml. Pipettare delicatamente la sospensione cellulare diluita su e giù per garantire una distribuzione cellulare omogenea.
- Pipettare 3 ml della sospensione cellulare diluita in ciascun pozzetto desiderato della piastra di coltura a bassissimo attacco a 6 pozzetti.
- Posizionare la piastra nell'incubatore (37 °C, 5% CO2, >90% di umidità) ed evitare il più possibile di aprire e chiudere le porte dell'incubatore.
NOTA: Questo passaggio iniziale è meglio completato la sera o durante il basso traffico dell'incubatore. Anche lievi vibrazioni possono influenzare le dimensioni e la forma degli aggregati, che possono compromettere i risultati.
4. Giorno 1 - Induzione di aggregati del mesoderma
- Assicurarsi che 24 ore dopo la semina, piccoli aggregati comprendenti 2-10 cellule siano visibili al microscopio. Raccogliere gli aggregati e lasciarli sedimentare prima di cambiare il mezzo nel mezzo di induzione del mesoderma (fase 1.3).
- Installare un tubo conico in polipropilene ad alta trasparenza da 15 ml per pozzetto della piastra di coltura a 6 pozzetti a bassissimo attacco.
- Utilizzare un movimento circolare (cioè come uno shaker orbitale) per raccogliere gli aggregati al centro di ciascun pozzetto, utilizzare una pipetta da 1 mL per raccogliere delicatamente gli aggregati e il mezzo circostante da ciascun pozzetto, posizionarli nei corrispondenti tubi conici in polipropilene ad alta chiarezza da 15 ml e consentire agli aggregati di sedimentare a temperatura ambiente.
- Una volta raccolti, impostare un timer per 1 ora, che è il tempo necessario per la maggior parte delle linee cellulari / aggregati per sedimentare in questa fase.
NOTA: Se il tempo è inferiore a 1 ora, si potrebbero perdere tutti gli aggregati che potrebbero non essersi depositati sul fondo del tubo conico da 15 ml. - Una volta trascorsa l'ora, con cautela, aspirare il surnatante con una pipetta o una pompa di aspirazione ad alta sensibilità. Assicurarsi che gli aggregati rimangano indisturbati sul fondo del tubo conico da 15 ml.
- Risospendere gli aggregati di ciascun tubo conico da 15 mL in 2 mL di mezzo di induzione del mesoderma e rimetterli nei rispettivi pozzetti della piastra di coltura a 6 pozzetti di attacco ultra-basso.
- Riporre la piastra nell'incubatrice (37 °C) e lasciarla fino al giorno 4.
NOTA: se gli aggregati si attaccano e crescono l'uno sull'altro, utilizzando una pipetta da 1 ml, pipettare delicatamente ogni pozzetto di aggregati su e giù una volta al giorno per mantenere gli aggregati di dimensioni simili.
5. Giorno 4 - Induzione vascolare e priming degli aggregati
- Raccogliere gli aggregati e lasciarli sedimentare prima di cambiare il mezzo nel mezzo di induzione vascolare (fase 1.4).
- Installare un tubo conico da 15 mL per pozzetto della piastra di coltura a 6 pozzetti a bassissimo attacco.
- Utilizzare un movimento circolare (cioè come uno scuotitore orbitale) per raccogliere gli aggregati al centro di ciascun pozzetto, utilizzare una pipetta da 1 mL per raccogliere delicatamente gli aggregati e il mezzo circostante da ciascun pozzetto e posizionarli nei corrispondenti tubi conici da 15 ml.
- Una volta raccolti, impostare un timer per 30 minuti per consentire agli aggregati di sedimentarsi.
NOTA: è necessario un tempo di 30 minuti per la maggior parte delle linee cellulari in questa fase. Se il tempo è inferiore a 30 minuti, c'è il rischio di perdere eventuali aggregati che potrebbero non essersi depositati sul fondo del tubo conico da 15 ml. - Dopo 30 minuti, con cautela, aspirare il surnatante con una pipetta o una pompa di aspirazione ad alta sensibilità. Assicurarsi che gli aggregati rimangano indisturbati sul fondo del tubo conico da 15 ml.
- Risospendere gli aggregati di ciascun tubo conico da 15 mL in 2 mL di mezzo di induzione vascolare e rimetterli nei rispettivi pozzetti della piastra di coltura a 6 pozzetti a bassissimo attacco.
- Riporre la piastra nell'incubatrice (37 °C) e lasciarla fino al giorno 6.
NOTA: Utilizzando una pipetta da 1 ml, pipettare delicatamente ogni pozzetto di aggregati su e giù una volta al giorno per mantenere gli aggregati di dimensioni simili ed evitare che crescano o si attacchino l'uno all'altro.
6. Giorno 6 - Incorporazione di aggregati e induzione di germogli di vaso
- Mentre si lavora su ghiaccio, preparare il volume finale desiderato della soluzione ECM (fase 1.5).
NOTA: Di seguito è riportato il protocollo per un pozzetto di una piastra a 12 pozzetti (30-50 aggregati), che può essere regolato secondo necessità.- Per un pozzetto di una piastra a 12 pozzetti, applicare 0,5 ml di ECM come strato inferiore e utilizzare 0,5 ml di ECM più aggregati sullo strato superiore. Questo crea il "sandwich" ECM necessario per un'efficace germinazione di aggregati 3D.
- Pipettare 500 μL di ECM in un pozzetto di una piastra da 12 pozzetti. Assicurarsi che non si formino bolle e che il fondo del pozzo e il menisco laterale siano completamente rivestiti. Questo comprende lo strato 1 del sandwich ECM.
- Riporre la piastra a 37 °C per 2 ore.
NOTA: Un tempo di 2 h è necessario per una polimerizzazione efficace. Qualsiasi tempo più breve rischia di compromettere l'integrità dell'ECM. - Verso la fine della polimerizzazione dello strato 1, utilizzare un movimento circolare per raccogliere gli aggregati al centro di ciascun pozzetto, utilizzare una pipetta da 1 mL per raccogliere delicatamente gli aggregati e il mezzo circostante da ciascun pozzetto e posizionarli nei corrispondenti tubi conici da 15 ml.
- Lasciare sedimentare gli aggregati per 10-15 minuti e aspirare il surnatante.
- Posizionare gli aggregati nel tubo conico da 15 mL su ghiaccio per 5 minuti. Durante il raffreddamento, estrarre la piastra a 12 pozzetti con lo strato 1 ora polimerizzato dall'incubatore.
NOTA: Il raffreddamento degli aggregati aiuta a prevenire la polimerizzazione precoce dello strato 2 ECM. - Lavorare rapidamente e con attenzione per prevenire la formazione di bolle, risospendere gli aggregati in 500 μL di ECM e pipettare la sospensione di aggregati ECM sopra lo strato 1 già polimerizzato. Facendo attenzione a non toccare lo strato 1, utilizzare una punta di pipetta da 200 μL per distribuire delicatamente lo strato 2 e gli aggregati attorno al pozzetto.
- Riporre la piastra a 37 °C per 2 ore.
NOTA: Un tempo di incubazione di 2 ore è necessario per un'efficace polimerizzazione ECM. Qualsiasi tempo più breve rischia di compromettere l'integrità dell'ECM e può impedire una forte adesione tra lo strato 1 e lo strato 2. - Aggiungere 1 mL di terreno di germinazione preriscaldato (37 °C) (fase 1.6) per indurre la differenziazione dei vasi sanguigni. I vasi germoglianti devono apparire da 1 a 3 giorni dopo l'incorporazione. Cambia il mezzo dopo 3 giorni e poi a giorni alterni.
NOTA: Il mezzo di germinazione deve essere preriscaldato; in caso contrario, potrebbe verificarsi un distacco dello strato e l'integrità dell'ECM potrebbe essere influenzata.
7. Giorno 11 - Isolamento e maturazione delle BVO
- Lavorando in condizioni sterili, utilizzare l'estremità arrotondata di una spatola sterile per allentare la matrice di germinazione ECM contenente le reti vascolari. In questa fase, il gel deve assomigliare a un disco fluttuante.
- Utilizzando una pinza sterile e l'estremità arrotondata di una spatola sterile, trasferire con attenzione il disco di gel (comprese le reti vascolari) sul coperchio di un piatto di coltura di 10 cm.
- Posizionare il coperchio più il gel sotto uno stereomicroscopio regolato per l'ingrandimento e la messa a fuoco desiderati e utilizzare aghi sterili per tagliare le reti di singoli vasi sanguigni, cercando di limitare la quantità di ECM non vascolarizzata ottenuta nel processo.
NOTA: Le cellule degradano naturalmente l'ECM circostante nel tempo; Tuttavia, la riduzione della quantità tagliata con ciascun organoide aumenta la qualità dell'immagine e l'integrità della rete di navi indipendenti. - Una volta che tutti gli organoidi sono stati isolati dal gel, trasferirli delicatamente in un pozzetto di una piastra a 6 pozzetti di attacco ultra-bassa con 3 ml di terreno di germinazione. In questa fase, gli organoidi possono essere lasciati durante la notte, oppure si può immediatamente continuare al punto 7.4.
- Utilizzare una pipetta da 1 mL per trasferire singoli organoidi dalla piastra a 6 pozzetti ai pozzetti di una piastra ultra-bassa da 96 pozzetti. Una volta trasferito, aggiungere 200 μL di mezzo di germinazione preriscaldato (37 °C) a ciascun pozzetto della piastra a 96 pozzetti.
NOTA: Un pozzetto di organoidi vascolari da una piastra a 12 pozzetti deve riempire 30-40 pozzetti di una piastra da 96 pozzetti. - A 4-6 giorni dopo l'isolamento nelle piastre a 96 pozzetti, assicurarsi che gli organoidi possiedano una morfologia rotonda e sana. In questa fase, gli organoidi sono pronti per essere fissati e preparati per la colorazione.
8. Giorno 15 - Fissazione, blocco e colorazione dei BVO
- Utilizzando una punta tagliata da 1 ml, trasferire gli organoidi in una provetta da microcentrifuga da 1,5 ml.
- Facendo attenzione a evitare l'aspirazione di qualsiasi BVO, utilizzare una pipetta da 200 μL o 1.000 μL per rimuovere il mezzo di germinazione rimanente nel tubo della microcentrifuga, quindi aggiungere 1 mL di PFA al 4% in PBS per 1 ora.
NOTA: Si consiglia il fissaggio su uno shaker orbitale (125 rpm) a temperatura ambiente. È accettabile un massimo di 60 BVO/tubo di microcentrifuga. Eventuali ulteriori BVO comprometteranno la fissazione e l'efficacia del lavaggio.
ATTENZIONE: Il PFA è una sostanza chimica dannosa. Usarlo con cautela in una cappa aspirante e seguire le istruzioni del produttore per l'uso e i metodi di smaltimento appropriati. - Lavare i BVO appena fissati 3 volte per 15 minuti ogni volta con PBS-Tween allo 0,25%.
- Se gli organoidi hanno un diametro superiore a 1 mm, permeabilizzare i BVO con Triton X-100 all'1% in PBS per 30-60 minuti a temperatura ambiente.
- Aspirare tutto il PBS-Tween allo 0,25% e aggiungere 1 mL di tampone bloccante (passaggio 1.7).
NOTA: Sebbene anticorpi-dipendenti, 2 ore a temperatura ambiente su uno shaker orbitale (125 rpm) sono sufficienti per ridurre il legame anticorpale non specifico durante il processo di colorazione. Gli organoidi possono essere lasciati nel tampone bloccante a 4 °C per un massimo di 2 settimane. - Rimuovere il tampone bloccante e aggiungere l'anticorpo primario (1:100) diluito in 1 mL del tampone bloccante. Conservare per una notte a 4 °C su uno shaker orbitale (12 rpm), assicurandosi che l'organoide o gli organoidi rimangano immersi nella soluzione anticorpale primaria.
NOTA: L'incubazione di anticorpi primari durante la notte è adatta per gli anticorpi utilizzati per questo studio. Gli anticorpi primari e secondari necessari e le rispettive diluizioni sono forniti nella tabella dei materiali. - Dopo l'incubazione notturna dell'anticorpo primario, rimuovere la soluzione anticorpale primaria e lavare 3 volte per 15 minuti ogni volta con PBS-Tween allo 0,25%.
- Aggiungere l'anticorpo secondario (1:250) più DAPI (1:1.000) diluito in 1 mL di tampone bloccante e incubare per 2 ore a temperatura ambiente o a 4 °C durante la notte.
NOTA: Se i campioni sono preparati correttamente (come descritto sopra), l'incubazione per 2 ore a temperatura ambiente o a 4 °C durante la notte è adatta per gli anticorpi utilizzati nel presente studio. - Dopo l'incubazione, rimuovere la soluzione anticorpale secondaria e lavare 3 volte per 15 minuti con PBS-Tween allo 0,25%.
NOTA: Dopo la colorazione, gli organoidi possono essere conservati in PBS per un massimo di 2 settimane.
9. Montaggio degli organoidi dei vasi sanguigni (BVO)
- Incollare i distanziali di montaggio sui vetrini di copertura di imaging desiderati (vedere Tabella dei materiali).
- Utilizzando una punta di pipetta tagliata da 1 mm, utilizzare una pipetta da 1 mL per trasferire singoli organoidi nei pozzetti distanziatori e aspirare il PBS rimanente.
- Riempire il pozzetto con 150-200 μL di soluzione limpida (vedi Tabella dei materiali) riscaldata a 75 °C, immergendo completamente l'organoide.
NOTA: I campioni devono diventare chiari entro 1 ora dall'esposizione alla soluzione di clearing riscaldata.- Lasciare che gli organoidi diventino chiari in una scatola coperta al buio a temperatura ambiente per 6 ore fino a notte se il tempo di pulizia di 1 ora è insufficiente. Se si lascia il campione durante la notte, assicurarsi che abbia una soluzione di pulizia sufficiente per evitare l'essiccazione.
- Dopo la pulizia, aspirare accuratamente la soluzione di pulizia con una punta per pipetta da 100-200 μL. Manovrare delicatamente l'organoide al centro del pozzetto distanziatore e aggiungere gocce di gel di montaggio (vedi Tabella dei materiali) (riscaldato a 75 °C in un blocco riscaldante controllato) fino a quando il pozzetto è pieno.
- Posizionare delicatamente il secondo coprivetrino sopra il distanziatore di montaggio per sigillare i campioni nello spazio tra i coperchi inferiore e superiore. Lasciare che il gel di montaggio polimerizzi al buio a 4 °C durante la notte.
NOTA: Dopo la polimerizzazione, è possibile utilizzare lo smalto per unghie per sigillare ulteriormente i campioni montati.
Risultati
Le fasi descritte in questo protocollo sono state sviluppate specificamente per produrre un metodo controllato e preciso per la generazione di organoidi dei vasi sanguigni umani da hPSC. La generazione di aggregati di 30-100 μm di diametro da colture hPSC segna il punto di partenza del protocollo (Figura 1, Figura 2B). Gli aggregati sono guidati attraverso induzioni graduali verso il mesoderma (giorno 1-giorno 4) e le linee vascolari (giorno 4-giorno 6) prima dell'incorporazione (giorno 6) (Figura 2A-D), che è necessaria per la formazione della rete vascolare. La germinazione dei vasi quasi radialmente simmetrica deve essere visibile da d7 o d8 (figura 2E) e continuare attraverso d10 (figura 2F,G). L'espianto degli hBVO dall'ECM alle piastre di attacco ultra-basse a 96 pozzetti riduce la fragilità delle reti di germinazione e consente una manutenzione continua in condizioni di coltura in sospensione (Figura 2H) fino a 6 mesi. Con d15, le hBVO mostrano una rete endoteliale estesa e connessa (CD31+) circondata da periciti (PDGFR-ß+) e actina della muscolatura liscia (SMA+) (Figura 3A-D). Una membrana basale continua di collagene IV (ColIV+) avvolge le reti vascolari (Figura 3E). Le cellule endoteliali (CD31+, VE-Cadherin+) e i periciti (PDGFR-ß+) comprendono rispettivamente circa il 30%-35% e il 60%-65% delle popolazioni di cellule organoidi. La germinazione attiva dei vasi avviene sotto la direzione di una popolazione di cellule della punta organizzata endogenamente (CD31+) che si presenta con la tipica morfologia delle cellule della punta, come l'eccessiva filipodia 8,10. La presentazione delle cellule murali PDGFR-ß+ e SMA+ che incapsulano le reti dei vasi endoteliali può essere vista da d15 del processo di maturazione organoide (Figura 3A,C). Dopo la rimozione dalla ECM e la maturazione in coltura in sospensione (cioè d15), le hBVO sono utilizzabili per le rispettive analisi o trapianto sotto la capsula renale del topo.

Figura 1: Schema del protocollo hBVO evidenziando la tempistica e la progressione graduale. Da colture hPSC o hiPSC apparentemente omogenee, la formazione di aggregati avviene in presenza dell'inibitore della Rho-chinasi Y27632. BMP4 e CHiR-integrato mezzo è usato per istruire gli aggregati verso il destino mesodermico. Il mezzo di induzione del mesoderma viene sostituito da VEGFA e mezzo integrato con forskolina per stimolare gli aggregati verso una linea vascolare. Le code meccaniche e chimiche ottenute attraverso l'incorporazione degli aggregati in una matrice di membrana basale solubilizzata e il collagene I e l'esposizione al mezzo contenente VEGFA e FGF2 si traduce in una germinazione vascolare quasi radialmente simmetrica dal corpo aggregato. Le reti di vasi generate possono essere rimosse dal collagene I e dalla membrana basale solubilizzata e collocate in coltura in sospensione per un'ulteriore maturazione, analisi o trapianto in vivo. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Progressione graduale della generazione di hBVO catturata in campo chiaro. (A) Morfologia tipica delle colonie di hPSC (H9) al giorno −1. (B) Generazione di aggregati hPSC (giorno 0) su piastre di attacco ultra-basse a 6 pozzetti in presenza di Y-27632. (C) L'induzione mesodermica di aggregati utilizzando BMP4 e terreno integrato con ChiR (giorno 1). Si possono anche osservare sottili cambiamenti nella dimensione e nella forma dell'aggregato. (D) Aggregati del giorno 4 innescati verso una linea vascolare utilizzando VEGFA e terreno integrato con forskolina. (E) germinazione precoce dei vasi il giorno 7, un giorno dopo l'incorporazione degli aggregati nella matrice di germinazione e l'esposizione al terreno di germinazione integrato con VEGFA e FGF2 (giorno 7). (F) Morfologia organoide sana e germogliamento continuo dei vasi il giorno 9. (G) Nave in fase avanzata che germoglia al giorno 10. Idealmente, le strutture cellulari dense al centro organoide sono scomparse a questo punto. (H) Morfologia tipica degli organoidi maturi (giorno 15) dei vasi sanguigni umani. La rimozione della matrice circostante mediante taglio e maturazione in piastre di coltura a 96 pozzetti a bassissimo attacco modella gli organoidi sfericamente, con le reti di vasi alloggiate internamente. Barre scala: (A,B,E,F) 250 μm; (C,D) 500 μm; (G,H) 200 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
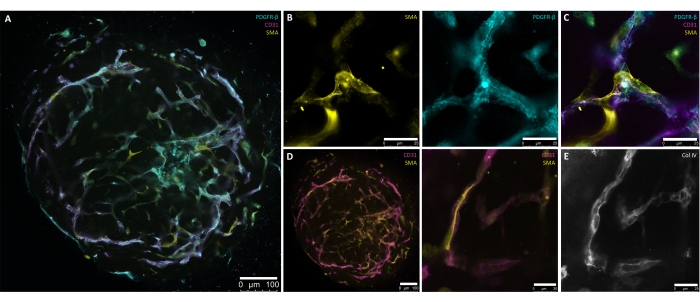
Figura 3: Colorazione a montaggio intero di organoidi di vasi sanguigni umani maturi (giorno 15). (A) Presentazione di organoidi di vasi sanguigni umani maturi (giorno 15) con reti endoteliali auto-organizzate (CD31+, magenta) e periciti circostanti (PDGFR-β+, ciano) e actina del muscolo liscio alfa (SMA+, giallo). (B) Maggiore ingrandimento di A che dettaglia l'espressione SMA+ (gialla) e PDGFR-β+ (ciano) delle reti di vasi. (C) Presentazione dettagliata dell'interazione endoteliale (CD31+, magenta), pericitario (PDGFR-β+, ciano) e actina della muscolatura liscia alfa (SMA+, giallo). (D) Colorazione a montaggio intero dell'interazione vaso endoteliale (CD31+, magenta)-muscolo liscio (SMA+, giallo) in una sezione trasversale (a sinistra) e un maggiore ingrandimento (a destra) degli organoidi dei vasi sanguigni maturi. (E) Formazione autodiretta di una membrana basale vascolare (Col IV+, scala di grigi) attraverso la stretta associazione delle cellule murali e dei tubi endoteliali. Barre di scala: (A,D[sinistra]) 100 μm; (B,D[destra],E) 25 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Le recenti scoperte nelle colture organoidi derivate da cellule staminali hanno fornito il quadro per modelli più avanzati e fisiologicamente rilevanti di vascolarizzazione umana. Il modello di organoide dei vasi sanguigni umani (hBVO) qui presentato, sviluppato nel nostro laboratorio 8,10, fornisce un potente mezzo per esplorare non solo ulteriori aspetti della vasculogenesi umana, ma anche nuove strade di modellazione della malattia e terapia rigenerativa 8,10,11. Sono stati impiegati diversi modelli in vivo per esplorare lo sviluppo e la maturazione dei vasi sanguigni, la malattia vascolare e la disfunzione endoteliale 3,4. Approcci diversi combinano cellule definite da linee singole e multiple derivate da cellule staminali o isolate da tessuti adulti in vivo per creare reti vascolari umane replicative 5,6. Il protocollo qui presentato sfrutta il principio della biologia dello sviluppo e dell'auto-organizzazione per produrre le prime reti di vasi sanguigni umani multicellulari che possono essere generate, in sostanza, da un singolo hPSC 8,10.
Ogni linea di cellule staminali ha un corredo genetico unico e differisce dalle altre in termini di approvvigionamento, funzione e reattività15. Pertanto, il protocollo per gli organoidi dei vasi sanguigni umani (hBVO) è stato sviluppato e ottimizzato per garantire una compatibilità di protocollo robusta e riproducibile con più (>12) diverse linee hPSC 8,10. Il metodo qui descritto genera organoidi dei vasi sanguigni derivati da hPSC nell'arco di 2 settimane. Tuttavia, le modifiche alla composizione del mezzo e/o alle tecniche di generazione di hBVO possono portare a una rete di vasi e a una generazione di organoidi inefficaci. I diversi tassi di proliferazione delle singole linee di cellule staminali influiscono notevolmente anche sulla riproducibilità della sperimentazione sulle cellule staminali15 e, quindi, sulle colture organoidi. Ad esempio, nel generare i BVO, più cellule proliferative o un numero maggiore di grandi aggregati del giorno 1 sono intrinsecamente soggetti a diversi ambienti metabolici e parametri di diffusione di gas e nutrienti. Questo, a sua volta, cambia i tempi di esposizione e le efficienze del fattore di crescita, il grado di differenziazione e priming vascolare e, soprattutto, la capacità di formare reti di vasi dopo aver incorporato gli aggregati nel collagene 1 e nella matrice della membrana basale solubilizzata.
La diffusione passiva di ossigeno e la somministrazione di nutrienti essenziali da un ambiente esterno non è ideale per la crescita cellulare a lungo termine di organoidi 3D e morfogenesi tissutale in vitro16. Sebbene dipenda da diversi fattori (ad esempio, il tasso metabolico tissutale, la biodisponibilità dei nutrienti e dei gas, un ambiente statico o dinamico), è stato stabilito un limite generale di 150 μm O2 e di diffusione dei nutrienti per i tessuti coltivati in vitro, considerando che, fisiologicamente, i tessuti umani presentano cordoni di cellule viventi entro 150 μm dai vasi sanguigni perfusi17. Sebbene siano state proposte distanze di diffusione efficaci di gas e nutrienti di 70-200 μm anche18,19,20,21, la densità del costrutto, la temperatura, il pH e la composizione dei mezzi influenzano significativamente l'efficacia della diffusione. Grazie all'ottimizzazione dell'area superficiale e alla comunicazione del recettore integrina-beta dopo l'incorporazione del giorno 6, gli aggregati di 250-300 μm di diametro hanno prestazioni migliori rispetto a quelli >500-600 μm di diametro, risultando in un processo completo di germinazione dei vasi e in un nucleo organoide minimamente condensato. Pertanto, la dimensione dell'aggregato è cruciale e può essere influenzata sia dal numero di celle utilizzate durante la semina iniziale che dal tempo assegnato per la formazione degli aggregati. Le piastre a micropozzetti che consentono il controllo della dimensione dell'aggregato e del numero22 sono una valida alternativa alla tecnica di formazione di aggregati altrimenti stocastica risultante dall'uso di piastre a 6 pozzetti di attacco ultra-basse in questo protocollo. La coerenza nella tempistica e nella gestione delle dimensioni degli aggregati durante i primi 6 giorni del protocollo hBVO è uno dei, se non il più importante, indicatore dello sviluppo di organoidi di vasi sanguigni in buona fede.
Le variazioni del mezzo il giorno 1 (induzione del mesoderma) e il giorno 4 (induzione vascolare) devono essere completate in combinazione con la sedimentazione degli aggregati. Sebbene la centrifugazione sia un'alternativa allettante, le forze aggiuntive applicate alle aggerate debolmente assemblate possono causare aggregazione, assemblaggio e taglio indesiderati, che influiscono negativamente sulla differenziazione, sulla maturazione e sull'efficacia della germinazione nelle fasi successive del protocollo. Lavorare sul ghiaccio durante il processo di incorporazione del giorno 6 è fondamentale per preservare la corretta polimerizzazione ECM e la formazione degli strati. Durante l'induzione dell'incorporazione e della germinazione degli aggregati, l'esposizione dell'ECM a temperature superiori a 4 °C e/o a un pH ECM diverso da 7,4 influenzerà non solo i tassi di polimerizzazione e l'integrità dello strato ECM, ma anche l'efficienza di germinazione degli aggregati incorporati. La natura elastica della matrice di germinazione ECM consente un facile distacco e trasporto dal piatto di coltura a 12 pozzetti alla superficie di taglio sterile. I singoli organoidi rimossi dalla matrice e trasferiti a piastre ultra-basse da 96 pozzetti consumeranno la rimanente ECM circostante e manterranno reti di microvasi endoteliali rivestiti di cellule murali auto-organizzate con una membrana basale continua.
Sebbene non contemplate in questa proposta, le alterazioni delle composizioni dei media possono replicare malattie che, a loro volta, provocano risposte patologiche nelle hBVO 8,11. I confini della modellazione delle malattie utilizzando il sistema hBVO sono tutt'altro che ben noti, e questa è certamente un'area che ha bisogno di essere esplorata. Anche l'applicazione della nostra tecnologia organoide dei vasi sanguigni nella vascolarizzazione di costrutti organoidi precedentemente avascolari23 è di impatto e interesse significativi.
Divulgazioni
Non vi è alcuna relazione tra gli interessi finanziari degli autori e la ricerca presentata. La tecnologia degli organoidi dei vasi sanguigni è stata concessa in licenza a Stemcell Technologies. J.M.P. è fondatore e azionista di Angios Biotech che sviluppa organoidi dei vasi sanguigni come terapia di trapianto vascolare. Una domanda di brevetto relativa a questo lavoro è stata depositata sotto Pat. No. US20200199541A1, elencando Reiner A. Wimmer, Josef M. Penninger e Dontscho Kerjaschki come inventori.
Riconoscimenti
Ringraziamo tutti i membri dei nostri laboratori per il contributo critico e le discussioni. JMP ha ricevuto finanziamenti dalla fondazione T. von Zastrow, dal premio FWF Wittgenstein (Z 271-B19), dall'Accademia austriaca delle scienze, dall'Impresa comune (JU) Innovative Medicines Initiative 2 nell'ambito dell'accordo di sovvenzione n. 101005026, dalle reti transatlantiche di eccellenza Leducq nella ricerca cardiovascolare, dal programma Distinguished Investigator dell'Allen Institute e dal programma di cattedre di ricerca Canada 150 F18-01336, nonché dalle sovvenzioni COVID-19 del Canadian Institutes of Health Research F20-02343 e F20-02015.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 M HEPES | Gibco | 15630080 | |
| 2-Mercaptoethanol | Millipore | 60-24-2 | |
| 7.5% sodium bicarbonate | Gibco | 5080094 | |
| Accutase | Gibco | A1110501 | cell dissociation reagent |
| Albumin fraction V (BSA) | AppliChem | A1391, 0100 | |
| Alexa Fluor 488–anti-rabbit IgG (Fab′)2 fragment | — | Jackson Immuno Research | 711-546-152 |
| Alexa Fluor 488–anti-sheep IgG | — | Life Technologies | A11015 |
| Alexa Fluor 647–anti-goat IgG (Fab′)2 fragment | — | Jackson Immuno Research | 705-606-147 |
| Automated cell counter | Invitrogen | Countess II | |
| B27 supplement | Gibco | 12587010 | |
| Biological safety cabinet | Faster | SafeFAST Premium 212 | |
| BMP4 | Miltenyi BioTec | 130-111-165 | |
| CD31 | Endothelial cell | DAKO | M0823 |
| CD31 | Endothelial cell | R&D | AF806 |
| Cellulose wipes | |||
| Centrifuge | Heraeus | Multifuge 4 KR | |
| CHIR99021 | Tocris Bioscience | 4423 | |
| Clear nail polish (essence, the gel, 01 absolute pure) | |||
| CO2 incubator | New Brunswick | Galaxy 170S | |
| Collagen type IV | Basement membrane | Millipore | AB769 |
| Confocal microscope (10x, 20x, 63x objectives) | Leica | SP8 | |
| Counting chamber slides- including 0.1% Trypan blue | Invitrogen | C10283 | |
| Coverslips (22 x 50 mm) | |||
| Cy3–anti-mouse IgG (Fab′)2 fragment | — | Jackson Immuno Research | 715-166-150 |
| DAPI | Sigma | D9542 | |
| DMEM/F12 | Gibco | 11330-032 | |
| Dulbecco's Modefied Eagle's Medium (DMEM) | Sigma | D5648-10L | |
| Eppendorf tubes | |||
| Falcon tubes | Fisher Scientific | 14-432-22 | |
| Fetal Bovien Serum (FBS) | Gibco | 10270-106 | |
| FGF2 | Miltenyi BioTec | 130-093-841 | |
| Fine forceps | FST | 11254-20 | |
| Fisherbrand Superfrost Clipped Corner Slides | Fisher Scientific | 12-550-016 | |
| Forskolin | Sigma | F3917 | |
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Fisher Scientific | A1413302 | |
| Glutamax | Gibco | 35050061 | |
| Ham's F12 | Gibco | 11765054 | |
| Horizontal laminar flow station, if stereomicroscope cannot fit in BSC | Thermo Scientific | Heraguard | |
| Inverted contrasting tissue culture microscope | Zeiss | Vert.A1 | |
| iSpacer | SunJinLab | IS009 | |
| KnockOut DMEM/F12 | Gibco | 12660012 | |
| KnockOut Serum Replacement | Gibco | 10828028 | |
| N2 supplement | Gibco | 17502048 | |
| Neurobasal medium | Gibco | 21103049 | |
| non-essential amino acids (NEAAs) | Gibco | 11140035 | |
| Orbital shaker | |||
| Parafilm | |||
| Paraformaldehyde (4%) in PBS | Boston BioProducts | BM-155 | |
| PDGFR-β | Pericyte | R&D | AF385 |
| PDGFR-β | Pericyte | Cell Signaling | 3169S |
| Penicillin-streptomycin | Gibco | 15140122 | |
| pH indicator strips (6.5-10) | Mquant, Millipore | 109543 | |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Pipettes (P1000, P200 and P20) | Gilson, Integra Pipetboy | ||
| Prime Surface-U 96-well plates | Sumilon | MS9096-U | |
| PurCol | Advanced BioMatrix | 5005 | |
| RapiClear CS gel | SunJinLab | RCCS005 | |
| RapiClear CS mounting solution | SunJinLab | RCCS002 | |
| Serological pipettes (5, 10 and 25 mL) | Falcon | 357529, 357530, 357515 | |
| SMA | vSMC/Pericyte | Sigma | 2547 |
| Sodium deoxycholate | Sigma | D6750 | |
| Sodium hydroxide solution (NaOH, 1.0 N) | Sigma | S2770 | |
| Solubilized Basement Membrane Matrix (i.e., Matrigel) | Corning | 356231 | |
| Stainless steel micro spatula (rounded end) | Fisher Scientific | 21-401-5 | |
| Stainless steel spoon (double-ended) | Fisher Scientific | BelArt H367290018 | |
| Stemflex medium | Thermo Scientific | A3349401 | stem cell culture medium |
| StemPro-34 SFM | Gibco | 10639011 | flexible serum-free medium |
| Stereomicroscope | Zeiss | Stemi 2000 | |
| Sterile filter pipette tips (1,000, 300 and 20 μL) | Biozym, Surphob | VT0270, VT0250, VT0220 | |
| Tissue culture–treated 12-well plates TC | BD Falcon | 353043 | |
| Tissue culture–treated 6-well plates | Eppendorf | 30720113 | |
| Triton X-100 | Sigma | 93420 | |
| Tryple Express Enzyme (1x), Phenol Red | Thermo Scientific | 12605010 | mammalian cell dissociating enzyme |
| Tween 20 | Sigma | P7949 | |
| Ultra-low-attachment 6-well plates | Corning | 3471 | |
| VEGFA | Peprotech | 100-20 | |
| Water bath (37 °C) | Fisher Scientific | Isotemp 210 | |
| Y-27632 | Calbiochem | 688000 |
Riferimenti
- Okwuosa, I. S., Lewsey, S. C., Adesiyun, T., Blumenthal, R. S., Yancy, C. W. Worldwide disparities in cardiovascular disease: Challenges and solutions. International Journal of Cardiology. 202, 433-440 (2016).
- Page, R. L., Ghushchyan, V., Nair, K. A call to action: Responding to the future forecasting of cardiovascular disease in America. American Health & Drug Benefits. 4 (5), 280-288 (2011).
- Ferrara, N., Davis-Smyth, T. The biology of vascular endothelial growth factor. Endocrine Reviews. 18 (1), 4-25 (1997).
- Ishitobi, H., et al. Flk1-GFP BAC Tg mice: An animal model for the study of blood vessel development. Experimental Animals. 59 (5), 615-622 (2010).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Xu, Y., et al. A novel strategy for creating tissue-engineered biomimetic blood vessels using 3D bioprinting technology. Materials. 11 (9), 1581 (2018).
- Risau, W. Mechanisms of angiogenesis. Nature. 386 (6626), 671-674 (1997).
- Wimmer, R. A., et al. Human blood vessel organoids as a model of diabetic vasculopathy. Nature. 565 (7740), 505-510 (2019).
- Fleischer, S., Tavakol, D. N., Vunjak-Novakovic, G. From arteries to capillaries: Approaches to engineering human vasculature. Advanced Functional Materials. 30 (37), 1910811 (2020).
- Wimmer, R. A., Leopoldi, A., Aichinger, M., Kerjaschki, D., Penninger, J. M. Generation of blood vessel organoids from human pluripotent stem cells. Nature Protocols. 14 (11), 3082-3100 (2019).
- Monteil, V., et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 181 (4), 905-913 (2020).
- Patsch, C., et al. generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nature Cell Biology. 17 (8), 994-1003 (2015).
- Bruveris, F. F., Ng, E. S., Stanley, E. G., Elefanty, A. G. VEGF, FGF2, and BMP4 regulate transitions of mesoderm to endothelium and blood cells in a human model of yolk sac hematopoiesis. Experimental Hematology. 103, 30-39 (2021).
- Julian, L., Olson, M. F. Rho-associated coiled-coil containing kinases (ROCK): Structure, regulation, and functions. Small GTPases. 5, 29846 (2014).
- Anitua, E., Prado, R. Addressing reproducibility in stem cell and PRP therapies. Trends in Biotechnology. 37 (4), 340-344 (2019).
- McMurtrey, R. J. Analytic models of oxygen and nutrient diffusion, metabolism dynamics, and architecture optimization in three-dimensional tissue constructs with applications and insights in cerebral organoids. Tissue Engineering Part C: Methods. 22 (3), 221-249 (2016).
- McKeown, S. R. Defining normoxia, physoxia and hypoxia in tumours-Implications for treatment response. The British Journal of Radiology. 87 (1035), 20130676 (2014).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. British Journal of Cancer. 9 (4), 539-549 (1955).
- Olive, P. L., Vikse, C., Trotter, M. J. Measurement of oxygen diffusion distance in tumor cubes using a fluorescent hypoxia probe. International Journal of Radiation Oncology. 22 (3), 397-402 (1992).
- Torres Filho, I. P., Leunig, M., Yuan, F., Intaglietta, M., Jain, R. K. Noninvasive measurement of microvascular and interstitial oxygen profiles in a human tumor in SCID mice. Proceedings of the National Academy of Sciences of the United States of America. 91 (6), 2081-2085 (1994).
- Lanzen, J., et al. Direct demonstration of instabilities in oxygen concentrations within the extravascular compartment of an experimental tumor. Cancer Research. 66 (4), 2219-2223 (2006).
- Ungrin, M. D., Joshi, C., Nica, A., Bauwens, C., Zandstra, P. W. Reproducible, ultra high-throughput formation of multicellular organization from single cell suspension-derived human embryonic stem cell aggregates. PLoS One. 3 (2), 1565 (2008).
- Sun, X. Y., et al. generation of vascularized brain organoids to study neurovascular interactions. eLife. 11, 76707 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon