Method Article
تحليل صورة التشفير الشريطي المتعدد للتنميط المناعي وتوصيف الخرائط المكانية في تحليل الخلية الواحدة لعينات أنسجة البارافين
In This Article
Summary
أدى تحليل صور الترميز الشريطي المتعدد مؤخرا إلى تحسين توصيف البيئة المكروية للورم ، مما سمح بإجراء دراسات شاملة لتكوين الخلية والحالة الوظيفية والتفاعلات بين الخلايا والخلايا. هنا ، نصف بروتوكول التلوين والتصوير باستخدام الترميز الشريطي للأجسام المضادة المقترنة قليل النوكليوتيد والتصوير الدائري ، والذي يسمح باستخدام تقنية تحليل الصور عالية الأبعاد.
Abstract
تعد تقنية التصوير متعددة الإرسال باستخدام الترميز الشريطي للأجسام المضادة مع قليل النوكليوتيدات ، والتي تكتشف بالتتابع حوائط متعددة في نفس قسم الأنسجة ، منهجية فعالة لتقييم الورم تعمل على تحسين فهم البيئة المكروية للورم. يتم تحقيق تصور تعبير البروتين في الأنسجة المثبتة بالفورمالين والمضمنة في البارافين عندما يتم تلدين فلوروفور معين إلى رمز شريطي مرتبط بالأجسام المضادة عبر oligonucleotides التكميلية ثم يتم إجراء تصوير العينة. في الواقع ، تسمح هذه الطريقة باستخدام لوحات قابلة للتخصيص لأكثر من 40 جسما مضادا في تفاعل تلطيخ واحد للأنسجة. تتوافق هذه الطريقة مع الأنسجة المجمدة الطازجة ، والأنسجة المثبتة بالفورمالين ، والأنسجة المضمنة بالبارافين ، والخلايا المستزرعة ، وخلايا الدم أحادية النواة المحيطية ، مما يعني أنه يمكن للباحثين استخدام هذه التقنية لعرض مجموعة متنوعة من أنواع العينات بدقة خلية واحدة. تبدأ هذه الطريقة ببروتوكول تلطيخ وتثبيت يدوي ، ويتم تطبيق جميع الرموز الشريطية للأجسام المضادة باستخدام كوكتيل الأجسام المضادة. أداة سوائل التلوين مؤتمتة بالكامل وتؤدي دورات تكرارية لوضع العلامات والتصوير وإزالة الفلوروفورات المتميزة طيفيا حتى يتم تصوير جميع المؤشرات الحيوية باستخدام مجهر مضان قياسي. ثم يتم جمع الصور وتجميعها عبر جميع دورات التصوير لتحقيق دقة خلية واحدة لجميع العلامات. لا يسمح التلوين أحادي الخطوة وإزالة الفلوروفور اللطيفة بتحليل العلامات الحيوية المتعددة للغاية فحسب ، بل يحافظ أيضا على العينة لإجراء تحليل إضافي في اتجاه مجرى النهر إذا رغبت في ذلك (على سبيل المثال ، تلطيخ الهيماتوكسيلين والإيوزين). علاوة على ذلك ، يتيح برنامج تحليل الصور معالجة الصور - تعويض الانجراف ، وطرح الخلفية ، وتجزئة الخلايا ، والتجميع - بالإضافة إلى تصور وتحليل الصور والأنماط الظاهرية للخلايا لإنشاء خرائط الشبكة المكانية. باختصار ، تستخدم هذه التقنية نظام الموائع الدقيقة المحوسب والمجهر الفلوري للتهجين المتكرر ، وتصوير ، وتجريد مجسات الحمض النووي ذات العلامات الفلورية المكملة للأجسام المضادة المرتبطة بالأنسجة قليلة النوكليوتيدات.
Introduction
البيئة المكروية للورم (TME) غير متجانسة للغاية ، وتتكون من الخلايا السرطانية ، والخلايا اللحمية السرطانية ، والخلايا المناعية ، والمكونات غير الخلوية للمصفوفة خارج الخلية ، والعديد من الجزيئات الوفيرة التي تنتجها وتطلقها الخلايا السرطانية واللحميةوالمناعية 1,2. توضح الأدلة المتراكمة أن TME له دور محوري في إعادة برمجة تمايز الورم والنمو والغزو والورم الخبيث والاستجابة للعلاجات3.
يعد فهم كيفية تفاعل أنواع الخلايا المختلفة في TME والتواصل مع بعضها البعض من خلال شبكات الإشارات أمرا ضروريا لتحسين تشخيص السرطان وتحسين العلاج المناعي وتطوير علاجات جديدة4. تم استخدام تقنيات الفحص المجهري التقليدي للأنسجة ، بما في ذلك الكيمياء الهيستولوجية المناعية (IHC) والتألق المناعي (IF) ، لعقود لدراسة أنواع الخلايا ووفرتها واتصالاتها في عينات الورم. لسوء الحظ ، يمكن لهذه التقنيات عادة تقييم علامة بروتين واحدة أو اثنتين فقط في قسم الأنسجة ولا يمكنها الكشف عن العلاقات المكانية والهيكلية المعقدة بين هذه الخلايا5،8،7.
على مدى العقدين الماضيين ، تم إنشاء العديد من تقنيات التصوير متعددةالإرسال 8. توفر هذه التقنيات وجهات نظر محسنة كثيرا لتكوين الخلايا المناعية ووظيفتها وموقعها داخل TME ، مما يؤدي إلى تقدم سريع في القدرة على تحديد TMEs المعقدة وتوصيفها مكانيا على مستوىالخلية الواحدة 9,10. العلاقات المكانية والهيكلية لمختلف الخلايا السرطانية والمناعية في TME هي الآن في طليعة الدراسات البيولوجية والسريرية باستخدام تقنيات التصوير المتعددة هذه11,12.
تعد تقنية التصوير متعددة الإرسال التي تم تطويرها مؤخرا باستخدام الترميز الشريطي للأجسام المضادة المترافقة قليل النوكليوتيد عبارة عن منصة أبحاث بيولوجية أحادية الخلية مؤثرة تعتمد على اكتشاف الأجسام المضادة المقترنة قليل النوكليوتيد في عينات ثابتة بالفورمالين ومدمجة بالبارافين (FFPE)13,14. حاليا ، تسمح تقنية التصوير المتعدد هذه بالتصوير المتزامن لأكثر من 100 علامة في قسم نسيج واحد15 ، مما زاد من عدد أنواع الخلايا التي يمكن تمييزها في الموقع. يتيح ذلك مستوى من التحليل المكاني للورم والخلايا المناعية غير ممكن باستخدام مناهج التنميط المناعي التقليدية16.
هنا ، نصف بروتوكولا محسنا لاقتران الأجسام المضادة النقية بقليل النوكليوتيدات والتحقق من صحة هذا الاقتران باستخدام منصة التصوير متعددة الإرسال وإجراء تصوير متعدد الدورات مع أنسجة FFPE. بالإضافة إلى ذلك ، نصف إجراءات معالجة الصور وتحليل البيانات الأساسية المستخدمة مع هذه التقنية.
Protocol
تمت الموافقة على هذه الدراسة بأثر رجعي من قبل مجلس المراجعة المؤسسية لمركز إم دي أندرسون للسرطان بجامعة تكساس. تم جمع عينات أنسجة FFPE من المرضى في MD Anderson كجزء من الرعاية القياسية الروتينية. لم يتم إجراء أي تدخلات تشخيصية أو علاجية. تم الحصول على موافقة مستنيرة من المرضى لاستخدام العينات التي تم جمعها للبحث والنشر.
1. مصادر الأجسام المضادة المستخدمة لتصميم لوحة الأجسام المضادة
- قم بإنشاء لوحة أجسام مضادة للتصوير المتعدد بعد التفكير بعناية في جودة الأنسجة والبروتينات ذات الأهمية. يتم النظر في ثلاثة مصادر للأجسام المضادة لتصميم لوحة الأجسام المضادة: 1) الأجسام المضادة التي تم التحقق من صحتها تجاريا بالكامل ، 2) الأجسام المضادة التي تم فحصها بتقنية التصوير المتعدد ، و 3) الأجسام المضادة المشتركة بين المستخدم النهائي.
ملاحظة: ثبت أن الأجسام المضادة التي تم فحصها بتقنية التصوير المتعدد تعمل وهي متاحة من البائعين. يمكن تطبيق هذه الأجسام المضادة التي تم فحصها على تلطيخ الصور المتعددة بعد اقتران قليل النوكليوتيد من قبل المستخدم. - إذا تعذر العثور على بروتين مهم في المصادر المذكورة أعلاه ، فاستخدم مستنسخات الأجسام المضادة المعروفة بأنها تعمل مع IHC. بالإضافة إلى ذلك ، يوصى باستخدام الأنماط المتماثلة IgG بدلا من استنساخ IgM لتقنية التصوير المتعددة هذه نظرا لارتفاع معدل الفشل مع IgM مقارنة باستنساخ IgG.
2. قبل اقتران الأجسام المضادة
- عند تحديد استنساخ الأجسام المضادة للاقتران باستخدام الرموز الشريطية للتصوير المتعدد ، ضع في اعتبارك شراء أجسام مضادة خالية من الناقل في محلول ملحي مخزن بالفوسفات (PBS) أو مخزن مؤقت مماثل. من المعروف أن البروتينات الحاملة ، بما في ذلك BSA والغلوتين والجلسرين والمواد المضافة الأخرى للبروتين ، تقلل من قدرة الاقتران.
- حدد استنساخ الأجسام المضادة الأنسب ، وقم دائما بتحسين ظروف التلوين (أي استرجاع المستضد ومعايرته) قبل الاقتران. قم بذلك عن طريق تطبيق استنساخ جسم مضاد غير مقترن على الأنسجة الموجبة والسالبة لهذا الجسم المضاد باستخدام IF أو IHC القياسي.
ملاحظة: إذا لم يكن الجسم المضاد المنقى متاحا تجاريا ، فيجب إجراء عملية تنقية الأجسام المضادة قبل الاقتران. لم تتم مناقشة إجراء التنقية المستخدم مع مجموعات تنقية الأجسام المضادة هنا.
3. اقتران الأجسام المضادة
- الحصول على كواشف اقتران الأجسام المضادة. تحتوي مجموعات الاقتران المتاحة تجاريا على محلول مانع للمرشح ، ومحلول اختزال 2 ، ومحلول اقتران ، ومحلول تنقية ، ومحلول تخزين الأجسام المضادة (جميعها مخزنة عند 4 درجات مئوية) ، ومحلول اختزال 1 (مخزن عند -20 درجة مئوية).
- الاقتران
ملاحظة: يتم التعامل مع الجسم المضاد المنقى بعامل اختزال ، مما يسمح للأجزاء المخفضة من الجسم المضاد بالتفاعل مع الباركود متعدد الإرسال للتصوير المستخدم مع هذه التقنية ، وبالتالي تشكيل رابطة تساهمية. تستغرق هذه العملية حوالي 4.5 ساعة وينتج عنها ما يقرب من 120 ميكرولتر من الأجسام المضادة المترافقة ، والتي تكون قابلة للحياة لمدة عام واحد. يتم إجراء كل الدوران لأسفل في درجة حرارة الغرفة (RT) ، ويتم التخلص من التدفق من خلاله باستثناء الخطوة الأخيرة (3.2.9) ، حيث يحتوي أنبوب التجميع على الجسم المضاد المقترن.- قم بنضح وتطبيق 500 ميكرولتر من محلول حجب المرشح باستخدام ماصة على أعمدة مرشح قطع الوزن الجزيئي 50 كيلو دالتون ، وقم بالدوران لأسفل عند 12000 × جم لمدة 2 دقيقة لمنع ارتباط الأجسام المضادة غير المحددة.
ملاحظة: إذا كان المحلول المتبقي في الجزء العلوي من العمود ملحوظا ، فقم بعكس المرشح في أنبوب التجميع ، وقم بتدويره لأسفل بسرعة 3000 × جم لمدة 2 دقيقة. - ماصة 50 ميكروغرام من الجسم المضاد في حجم 100 ميكرولتر من المحلول إلى عمود المرشح ، وتدور لأسفل عند 12000 × جم لمدة 8 دقائق.
ملاحظة: استخدم مقياس الطيف الضوئي لقياس تركيز الجسم المضاد المنقى ولحساب حجم المحلول المقابل ل 50 ميكروغرام من الجسم المضاد. إذا كان حجم محلول الجسم المضاد أقل من 100 ميكرولتر ، فاضبط مستوى الصوت على 100 ميكرولتر بإضافة 1x PBS. احتفظ ب 1 ميكروغرام من الجسم المضاد غير المقترن لتأكيد الاقتران (الخطوة 4.4). - ماصة 260 ميكرولتر من المزيج الرئيسي للاختزال (20 ميكرولتر من محلول الاختزال 1 ممزوجا ب 825 ميكرولتر من محلول الاختزال 2 ، وهو ما يكفي لثلاثة تفاعلات اقتران الأجسام المضادة) لكل عمود مرشح. دوامة بلطف المزيج الرئيسي لمدة 2-3 ثوان ، أو ماصة لأعلى ولأسفل لخلط المحلول مع الجسم المضاد. احتضان في RT لمدة 30 دقيقة.
- بعد الحضانة ، قم بتدوير أعمدة المرشح لأسفل عند 12000 × جم لمدة 8 دقائق. أضف 450 ميكرولتر من محلول الاقتران إلى أعمدة المرشح ، وقم بتدويرها لأسفل عند 12000 × جم لمدة 8 دقائق.
- أعد تعليق الرمز الشريطي المطلوب في 10 ميكرولتر من الماء الخالي من النيوكلياز و 210 ميكرولتر من محلول الاقتران.
ملاحظة: قم بإعداد علامة الأجسام المضادة مباشرة قبل استخدامها للتلطيخ. لا تعيد استخدام حصص الباركود للأجسام المضادة. - بعد الانتهاء من الدوران لأسفل في الخطوة 3.2.4 ، أضف علامة الجسم المضاد المعاد تعليقها (حوالي 220 ميكرولتر) إلى كل عمود مرشح مقابل. ماصة الخليط لأعلى ولأسفل بلطف لخلط الكواشف. أغلق أغطية عمود المرشح ، واحتضن تفاعل الاقتران في RT لمدة 2 ساعة. بعد 2 ساعة ، قم بتدوير أعمدة المرشح لأسفل عند 12000 × جم لمدة 8 دقائق.
ملاحظة: يوصى بتخصيص 5 ميكرولتر من المحلول المترافق في أنبوب تفاعل البوليميراز المتسلسل وتخزينه عند 4 درجات مئوية لبروتوكول التأكيد (انظر أدناه). - ماصة 450 ميكرولتر من محلول التنقية في كل عمود مرشح ، وتدور لأسفل عند 12000 × جم لمدة 8 دقائق. كرر ثلاث مرات.
- ماصة 100 ميكرولتر من محلول التخزين في أعمدة المرشح. ماصة بلطف الخليط صعودا وهبوطا أكثر من 10 مرات ، وغسل بعناية جوانب المرشحات في العمود.
ملاحظة: قم بإذابة 50 ميكروغرام من الجسم المضاد في 100 ميكرولتر من محلول التخزين. إذا بدأ تفاعل الاقتران بأكثر من 50 ميكروغرام من الجسم المضاد ، أضف المزيد من محلول التخزين بهذه النسبة. - اقلب أعمدة المرشح في أنبوب تجميع جديد. تدور لأسفل في 3000 × غرام لمدة 2 دقيقة في RT. الحفاظ على الحل الذي تم جمعه. ماصة محلول الأجسام المضادة المترافق في أنابيب لولبية معقمة ، وتخزينها لمدة تصل إلى 1 سنة عند 4 °C.
ملاحظة: يجب اختبار الجسم المضاد المترافق باستخدام تقنية التصوير المتعدد بعد أيام 2. قد يؤدي الاختبار قبل ذلك إلى تلطيخ نووي عالي الخلفية.
- قم بنضح وتطبيق 500 ميكرولتر من محلول حجب المرشح باستخدام ماصة على أعمدة مرشح قطع الوزن الجزيئي 50 كيلو دالتون ، وقم بالدوران لأسفل عند 12000 × جم لمدة 2 دقيقة لمنع ارتباط الأجسام المضادة غير المحددة.
4. تأكيد الاقتران
ملاحظة: قبل إجراء تجارب التلوين باستخدام جسم مضاد مقترن من قبل المستخدم باستخدام تقنية التصوير المتعدد ، يجب تأكيد الاقتران باستخدام الرحلان الكهربائي الهلامي مع 5 ميكرولتر من الجسم المضاد المترافق (انظر الخطوة 3.2.6) جنبا إلى جنب مع 1 ميكروغرام من الجسم المضاد غير المقترن (عادة في 2 ميكرولتر من الخليط) كعنصر تحكم. سيتم إثبات اقتران الأجسام المضادة الناجح من خلال زيادة الوزن الجزيئي للجسم المضاد. ومع ذلك ، فإن بروتوكول التأكيد هذا يقيم فقط نجاح التفاعل الكيميائي للاقتران ولا يعالج التحقق من صحة الأجسام المضادة المستخدمة في التصوير المتعدد.
- ماصة 8 ميكرولتر و 11 ميكرولتر من الماء الخالي من النيوكلياز في الجسم المضاد المترافق المحجوز والتحكم في الجسم المضاد غير المقترن ، على التوالي ، للحصول على حجم نهائي قدره 13 ميكرولتر.
- ماصة 5 ميكرولتر من LDS (أو نظام كهربائي آخر لكبريتات دوديسيل بولي أكريلاميد هلام) و 2 ميكرولتر من عامل اختزال العينات في كل عينة من الجسم المضاد المترافق المحجوز ، وتشويه العينات في حمام جاف 95 درجة مئوية لمدة 10 دقائق.
- أثناء تغيير طبيعة العينات ، قم بتخفيف 40 مل من مخزن MOPS SDS في 760 مل من الماء عالي النقاء ، ضع مادة هلامية في خزان نظام الرحلان الكهربائي ، واسكب المخزن المؤقت المخفف فوق الجل.
- بمجرد اكتمال فترة التمسخ البالغة 10 دقائق ، قم بتحميل بئر واحد من الجل بمعيار بروتين ملطخ مسبقا ، وواحد بالجسم المضاد غير المقترن (من الخطوة 3.2.2) ، والآبار المتبقية بعينات الأجسام المضادة المترافقة. بعد ذلك ، قم بتشغيل الجل عند 150 فولت حتى يظهر معيار البروتين في نهاية الجل.
ملاحظة: يلتصق الجل بسهولة بحاويات آمنة للاستخدام في الميكروويف ، وبالتالي قد يتمزق ، لذلك يجب التعامل مع الجل بحذر في الخطوات التالية. - بعد اكتمال الجري ، انقل الجل إلى حاوية آمنة للاستخدام في الميكروويف مملوءة مسبقا بماء عالي النقاء ، وقم بتسخينه في الميكروويف حتى يتم تصور الفقاعة الأولى في الماء.
ملاحظة: يختلف وقت تكوين الفقاعات اختلافا كبيرا حسب الميكروويف المستخدم. - صفي الماء من الحاوية ، واسكب حوالي 250 مل من بقعة Coomassie G-250 فوق الجل ، وقم بتسخين الجل في الميكروويف حتى يتم تصور الفقاعة الأولى. بعد ذلك ، قم بإزالة الحاوية مع الجل وبقعة Coomassie G-250 من الميكروويف ، وضعها على شاكر لمدة 10 دقائق.
- بعد الهز ، قم بتصريف البقعة بعناية ، واستبدلها بحوالي 200 مل من الماء عالي النقاء ، ثم ضع الحاوية على شاكر لغسل الجل.
- قم بتصريف المياه فائقة النقاء ، واستبدلها بماء جديد فائق النقاء خمس مرات أو حتى لا تظهر بقايا البقعة في الحمام المائي. اترك الجل ليغسل طوال الليل على الخلاط حتى تظهر الأربطة ، إذا لزم الأمر ، قبل تصوير الجل (الشكل 1).
ملاحظة: يجب أن يكون للأجسام المضادة المستخدمة في التصوير متعدد الإرسال أنماط تلطيخ مماثلة لتلك الموجودة في الأجسام المضادة المقترنة بالصبغة. يمكن تلطيخ أقسام الأنسجة ذات المستضدات المعروفة الموجبة للأجسام المضادة المقترنة بالأجسام المضادة المقترنة قليل النوكليوتيد والصبغة. في هذا العمل ، في كل حالة ، كانت أشكال الأنسجة لكلا النوعين من الأجسام المضادة متكافئة ومنسقة مع بعضها البعض ، بالإضافة إلى توزيع الخلايا المتوقع ، بناء على بيولوجيا البروتينات ذات الأهمية وعينات أنسجة الاختبار. توضح هذه النتيجة فعالية استخدام أجزاء الأجسام المضادة المترافقة قليل النوكليوتيد للنهج القائمة على تلطيخ الأنسجة باستخدام أنسجة FFPE.
5. تلطيخ الأجسام المضادة المترافقة قليل النوكليوتيد
- إعداد أغطية لوضع الأنسجة.
- انقع أغطية الغطاء في محلول بولي-إل-ليسين بنسبة 0.1٪ لمدة 24 ساعة في RT لتحسين التصاق الأنسجة.
- بعد النقع ، قم بتصريف محلول poly-L-lysine ، واغسل أغطية الغطاء بماء عالي النقاء لمدة 30 ثانية. كرر الغسيل أربع إلى ست مرات. قم بإزالة أغطية الغطاء من الماء عالي النقاء المستخدم في الغسيل ، وضعها على منشفة خالية من النسالة لتجف طوال الليل.
ملاحظة: يجب على أخصائي الأنسجة قطع الأنسجة المختارة إلى أقسام بسمك 5 ميكرومتر ، ووضعها في وسط غطاء مشحون بولي L-lysine ، والسماح لها بالجفاف طوال الليل. بعد التجفيف ، يجب تخزين أغطية الأغطية مع أقسام الأنسجة عند 4 درجات مئوية لمدة لا تزيد عن 6 أشهر. احتوت لوحة التلوين في هذا البروتوكول على 26 علامة. كان النسيج المستخدم في هذا البروتوكول هو نسيج اللوزتين البشري الطبيعي. يجب ألا يتجاوز وقت نقع الغطاء 1 أسبوع. يمكن تخزين أغطية Poly-L-lysine المطلية في RT ويجب استخدامها في غضون 2 أشهر من التحضير.
- في اليوم السابق للتلطيخ ، ضع حامل غطاء الانزلاق في فرن 60 درجة مئوية طوال الليل.
- في اليوم التالي ، ضع عينة غطاء الانزلاق في حامل غطاء مسخن مسبقا في فرن 60 درجة مئوية. بعد الخبز لمدة 30 دقيقة ، تحقق للتأكد من ذوبان البارافين بعيدا عن المنديل.
- ضع حامل / عينة غطاء الغطاء بسرعة في سلسلة الحلول التالية: جولتان من عامل إزالة الشمع لمدة 6 دقائق لكل منهما ؛ جولتان من الإيثانول بنسبة 100٪ لمدة 5 دقائق لكل منهما ؛ جولة واحدة من الإيثانول 90 ٪ لمدة 5 دقائق ؛ جولة واحدة من الإيثانول بنسبة 70٪ لمدة 5 دقائق ؛ جولة واحدة من الإيثانول 50 ٪ لمدة 5 دقائق ؛ جولة واحدة من الإيثانول 30 ٪ لمدة 5 دقائق ؛ وجولتين من المياه عالية النقاء المعالجة بثنائي إيثيل بيروكربونات (DEPC) لمدة 5 دقائق لكل منهما.
ملاحظة: يتم تحضير جميع تخفيفات الإيثانول بمياه فائقة النقاء معالجة ب DEPC. إذا تم استخدام الزيلين لإزالة الشمع ، فيجب استخدامه في غطاء محرك السيارة. - أثناء إخضاع حامل قسيمة الغطاء/العينة لسلسلة المحاليل، قم بما يلي:
- قم بإعداد غرفة الرطوبة عن طريق وضع صندوق طرف ماصة فارغ مع منشفة ورقية مبللة بالماء في الأسفل.
- املأ قدر الضغط بما يكفي من الماء لتغطية دورق سعة 50 مل في منتصف الطريق.
- ضع 5 مل من الميثانول لكل عينة في الدورق عند 4 درجات مئوية.
- تمييع المخزن المؤقت AR9 بالمياه فائقة النقاء المعالجة ب DEPC إلى 1x ؛ هناك حاجة إلى حوالي 50 مل من المخزن المؤقت المخفف لكل حامل غطاء منزلق.
- بعد اكتمال سلسلة المحلول ، املأ دورقا زجاجيا سعة 50 مل بحوالي 40 مل من المخزن المؤقت 1x AR9 ، واغمر حامل / عينة غطاء الغطاء في الدورق ، وقم بتغطية الدورق / حامل غطاء الغطاء بالكامل بورق الألمنيوم.
- ضع الدورق / حامل غطاء الألمنيوم المغطى بورق الألمنيوم في قدر الضغط المملوء بالماء ، واطهيه على ضغط عال (حوالي 15 رطل / بوصة مربعة) لمدة 20 دقيقة.
- بعد الطهي ، قم بإزالة الدورق / حامل الغطاء ، وفك غلاف ورق الألمنيوم بعناية ، واترك الدورق / حامل الغطاء يبرد في RT لمدة 10 دقائق تقريبا.
- قم بإزالة حامل / عينة غطاء الغطاء من المخزن المؤقت 1x AR9 ، واغمرها في جولتين من المياه فائقة النقاء المعالجة ب DEPC ، مع إجراء حضانة للعينات في كلتا الجولتين لمدة 2 دقيقة لكل منهما.
- أثناء الحضانة ، استرجع المخزن المؤقت للترطيب ، والحجب N ، والحجب G ، وحجب J ، وحجب محاليل S ، ومخفف / كتلة الجسم المضاد من مجموعة تلطيخ التصوير المتعدد. بالنسبة لعينتين من أغطية الانزلاق ، قم بتسمية لوحات 6 آبار للحلول باستخدام التكوينات الموضحة في الشكل 2.
- ضع عينة غطاء الغطاء في جولتين سعة كل منهما 5 مل من محلول الترطيب لمدة 2 دقيقة لكل منهما.
- بعد كلتا الجولتين من التنسيب في المخزن المؤقت للإماهة ، ضع عينة الغطاء في 5 مل من مخفف / كتلة الأجسام المضادة للتصوير المتعدد ، واحتضانها لمدة 20-30 دقيقة في RT (لا تتجاوز 30 دقيقة).
- أثناء الحضانة ، قم بإعداد كوكتيل الأجسام المضادة عن طريق عمل مزيج رئيسي 200 ميكرولتر من مخفف / كتلة الأجسام المضادة للتصوير المتعدد ، ومانع N ، ومانع G ، ومانع J ، وحلول حاصرات S.
ملاحظة: احسب إجمالي كمية الأجسام المضادة بناء على عدد العلامات والمعايرة التي تم التحقق من صحتها لكل علامة، واطرح إجمالي كمية الأجسام المضادة من المزيج الرئيسي. على سبيل المثال ، بالنسبة لست علامات ، لكل منها معايرة 1: 200 ، ستكون المعادلة 200 ميكرولتر من المزيج الرئيسي - 6 ميكرولتر من كوكتيل الأجسام المضادة = 194 ميكرولتر من المزيج الرئيسي.
- بعد الحضانة في مخفف / كتلة الأجسام المضادة للتصوير المتعدد ، ضع عينة غطاء الانزلاق في غرفة الرطوبة المحضرة في الخطوة 5.5.1 ، ماصة 190 ميكرولتر من كوكتيل الجسم المضاد على عينة الغطاء ، واحتضان عينة غطاء الانزلاق في RT لمدة 3 ساعات.
- بعد الحضانة ، اغسل عينة الغطاء في جولتين باستخدام 5 مل من مخفف / كتلة الأجسام المضادة للتصوير المتعدد لمدة 2 دقيقة لكل منهما.
- لإصلاح الأجسام المضادة المرتبطة بالأنسجة الموجودة على الغطاء ، قم بتنفيذ الخطوات 5.7.3-5.7.5 في غرفة الرطوبة.
- احتضن أغطية الغطاء لمدة 10 دقائق مع تخفيف 16٪ من الفورمالديهايد إلى 1.6٪ بمحلول التخزين ، ثم اغسل أغطية الغطاء ثلاث مرات باستخدام 1x PBS.
- احتضن أغطية الغطاء لمدة 5 دقائق باستخدام 4 درجات مئوية من الميثانول ، ثم اغسل أغطية الغطاء ثلاث مرات باستخدام 1x PBS.
- احتضن أغطية الغطاء لمدة 20 دقيقة مع 5 مل من الكاشف المثبت المخفف ب 1x PBS ، ثم اغسل أغطية الغطاء ثلاث مرات باستخدام 1x PBS.
- قم بتخزين عينات الغطاء الملطخة في المخزن المؤقت للتخزين عند 4 درجات مئوية لمدة تصل إلى 2 أسابيع
6. لوحة مراسل التصوير متعددة الإرسال
ملاحظة: يتم إعداد صفيحة من 96 بئرا ، يشار إليها باسم لوحة المراسل ، تحتوي على فلوروفورات مشفرة في الآبار الفردية وفقا لتجارب التصوير متعددة الإرسال المصممة خصيصا وترتبط بكل عينة غطاء ملطخة. الخطوات التالية هي لإعداد لوحة المراسل.
- قم بإعداد مزيج رئيسي للمراسل من خلال الجمع بين 4880 ميكرولتر من الماء الخالي من النيوكلياز ، و 600 ميكرولتر من مخزن التصوير متعدد الإرسال 10x ، و 500 ميكرولتر من كاشف الفحص ، و 20 ميكرولتر من محلول البقع النووية. سيكون هذا كافيا لمدة 20 دورة من جميع الآبار.
- في كل دورة من تجربة التصوير متعددة الإرسال المصممة خصيصا ، املأ بئرا ب 245 ميكرولتر من محلول يحتوي على مزيج المراسل الرئيسي والفلوروفورات المشفرة المحددة لتلك الدورة.
ملاحظة: انظر الشكل 3 لمعرفة تكوين لوحة المراسل المستخدمة في هذا البروتوكول للوحة السرطان. - لحماية الفلوروفورات المشفرة بالباركود ، قم بلصق غطاء لوحة رقائق معدنية فوق لوحة المراسل ، وضع اللوحة داخل أداة التصوير متعددة الإرسال.
- قم بتخزين لوحة المراسل في صندوق مظلم عند 4 درجات مئوية لمدة تصل إلى 2 أسابيع.
7. معايرة وتشغيل آلة التصوير متعددة الإرسال
ملاحظة: يلتقط مجهر التصوير الفلوري عالي الدقة أربع قنوات مضان مختلفة في كل دورة تصوير متعددة الإرسال عند 20x ، وضوء إثارة بنسبة 100٪ ، وبتبييض ضوئي منخفض.
- قم بمعايرة تركيز التصوير باستخدام قناة DAPI عن طريق وضع غطاء عينة على مرحلة المجهر ، وسحب 700 ميكرولتر يدويا من معايرة 1: 1500 من محلول البقع النووية على الأنسجة.
ملاحظة: يتم الاحتفاظ بغطاء الغطاء على مرحلة المجهر أثناء غسل العينة والتصوير. - لتحضير أداة التصوير متعددة الإرسال ، قم بتخفيف المخزن المؤقت للتصوير المتعدد 10x إلى 1x باستخدام الماء عالي النقاء المعالج بواسطة DEPC ، واملأ زجاجات الكاشف بالمحاليل / المذيبات المناسبة ، بما في ذلك المخزن المؤقت للتصوير المتعدد المخفف 1x ، والمياه فائقة النقاء المعالجة ب DEPC ، وثنائي ميثيل سلفوكسيد (DMSO).
- بمجرد ملء زجاجات الكاشف بشكل مناسب ، أدخل التصميم التجريبي في برنامج مدير أدوات التصوير المتعدد ؛ تعيين الدورة الصحيحة ، وأرقام الآبار ، وأماكن مكدس z ، واسم العلامة ، والفئة ، ووقت التعرض لكل دورة (الشكل 4) ؛ تعيين جميع المعلمات المجهر. وحدد مناطق الاهتمام على نموذج قسيمة الغلاف المراد تصويرها.
- انقر فوق الزر "تجربة " في برنامج التحكم (الشكل 4 أ). في نافذة إعداد التجربة وإدارتها ، انقر فوق الزر "قالب جديد " (الشكل 4 ب).
- اكتب اسم المشروع في المساحة المجاورة لزر المشروع (الشكل 4C). اكتب أو حدد العدد الإجمالي للدورات (الشكل 4D).
- انقر فوق الزر " تعيين القناة " ، واكتب المعلومات الخاصة بكل دورة في الأعمدة (الشكل 4E) ، وانقر فوق الزر "حفظ القالب ". ابدأ التجربة بالنقر فوق الزر بدء التجربة .
ملاحظة: أثناء تجربة التصوير المتعدد ، تقوم الأداة باسترداد الفلوروفورات المشفرة من بئر واحد من لوحة المراسل (بحد أقصى أربعة فلوروفورات لكل بئر ، بما في ذلك DAPI) ، وتوزعها مباشرة على قسيمة غطاء العينة ، وتصور المناطق المهمة لكل قناة مضانة. بعد كل التصوير لتلك الدورة ، تغسل الأداة الفلوروفورات المشفرة وتوزع الدورة التالية من المراسلين (من البئر التالي على لوحة المراسل). يستمر التصوير حتى يتم الانتهاء من جميع الدورات باستخدام 26 علامة.
8. جمع الصور
ملاحظة: يمكن جمع الصور متعددة الإرسال باستخدام أي مجهر مضان مقلوب مكيف مكون بأربع قنوات مضان (DAPI و Cy3 و Cy5 و Cy7) ومجهز بعدسة Plan Fluor 20x. يتم إجراء تصوير وغسل عينات غطاء الغطاء تلقائيا باستخدام إعداد السوائل المطور خصيصا. يتم الحصول على الصور باستخدام برنامج المعالج (الإصدار 1.8.0.7) بتنسيق QPTIFF.
- في نافذة المعالج ، انقر فوق الزر "إدخال " ، وحدد اسم التجربة.
- في قسم خيارات المعالجة ، حدد وتحقق من طرح الخلفية وإلغاء الالتفاف وعمق المجال الممتد وتصحيح التظليل. انقر فوق الزر "ابدأ ".
9. تحليل الصور
ملاحظة: يمكن تحميل الصور التي تم الحصول عليها إلى برنامج تحليل الصور الآلي الحاصل على براءة اختراع أو برنامج مفتوح المصدر (الشكل 5) للتحليل النهائي.
- انقر فوق رمز QuPath على الكمبيوتر ، وافتح البرنامج. اسحب ملف QPTIFF إلى نافذة العارض .
- انقر فوق الزر "السطوع والتباين" ، والذي سيفتح نافذة السطوع والتباين. حدد العلامة أو قم بإلغاء تحديدها في العمود المحدد لإظهار إشارة العلامة أو إغلاقها.
- انقر فوق الزر تكبير للملاءمة لتكبير أو تصغير منطقة الاهتمام.
ملاحظة: يوفر تصور بيانات الصور المتعددة للمستخدم نظرة عميقة على البيئة المكروية للأنسجة. يمكن تصور العلامات الفردية في عينات FFPE بتنسيق مضان (الشكل 6 والشكل 7) أو في عرض علم الأمراض. يمكن استخدام العديد من المنصات الحسابية لمعالجة الصور المركبة وتحليل بيانات صورة الأنسجة المتعددة. باستخدام هذا البرنامج ، يمكن تحقيق التنميط الظاهري المكاني ، بالإضافة إلى اكتشاف الخلايا النادرة وحساب جوار الخلية ، من خلال صور الشرائح الكاملة للأنسجة متعددة الإرسال فائقة الارتفاع الناتجة عن تقنية التصوير المتعدد. انظر الشكل 6 للحصول على 26 جسما مضادا في لوحة السرطان وعينة اللوزتين (الشكل التكميلي 1).
النتائج
استخدمنا عينات اللوزتين FFPE لتطوير لوحة الأورام المناعية المكونة من 26 علامة لتوضيح الحالة المناعية لأنسجة FFPE باستخدام نظام تحليل صور الترميز الشريطي. بشكل عام ، يتم استخدام 19 جسما مضادا حاليا في دراسات التصوير المتعددة الأخرى في مختبرنا. تم اختبار جميع العلامات باستخدام أنسجة FFPE مع IHC كروموجيني. تم اقتران جميع الأجسام المضادة مع oligonucleotides الحمض النووي الفريدة. عند إعداد قسائم الغلاف باستخدام مدير الأدوات المستند إلى الويب (الشكل 4) لتقنية تحليل صور التشفير الشريطي هذه ، تجدر الإشارة إلى أن الدورتين الأولى والأخيرة دائما ما تكون "فارغة" (الشكل 2 والشكل 4) ، والتي توفر إشارات مضان الخلفية ليتم طرحها من الإشارات المحددة من الأجسام المضادة. بعد جمع الصور بتنسيق QPTIFF باستخدام المجهر الفلوري ، يمكن تصورها باستخدام العديد من برامج تحليل الصور الآلية الحاصلة على براءة اختراع أو البرامج مفتوحة المصدر. يمكن أن تظهر الصور المركبة جميع العلامات أو العلامات المحددة للحصول على رؤية أفضل للإشارات (الشكل 5). علاوة على ذلك ، يمكن تقييم كل جسم مضاد بصريا للتوطين النووي أو السيتوبلازمي أو الغشائي. يمكن التعرف بسهولة على الخلايا المناعية والورم والخلايا اللحمية. بعد ذلك ، يمكن أن يوفر تحليل الصور معلومات عن شدة الإشارة والنطاق الديناميكي والتوزيع المكاني لجميع العلامات (الشكل 6). سمحت لنا هذه التقنية بتحليل جميع العلامات ال 26 على المستوى تحت الخلوي في قسم نسيج واحد (الشكل 7). من خلال تحليل التموضع المشترك للعلامات ، يمكننا تحديد الأنماط الظاهرية الخلوية ، وتحديد موضع الخلية المكانية ، وحساب المسافة بين الخلايا ، وإيجاد توزيع الخلايا. يتمثل التأثير الحاسم لهذه التقنية في تقديم لوحة قوية مكونة من 26 علامة تركز على الحالة المناعية للبيئة المكروية للأنسجة.
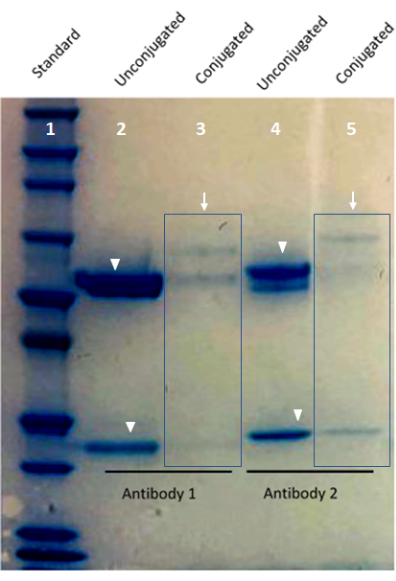
الشكل 1: صورة للتحقق من صحة الأجسام المضادة المقترنة حسب الطلب باستخدام هلام بروتين بيس تريس. يظهر الممر 1 من الجل معيار البروتين. يظهر الحارة 2 والحارة 4 أجساما مضادة مقترنة بالباركود (أسهم). يظهر الحارة 3 والحارة 5 أشرطة السلسلة الثقيلة والخفيفة من جسم مضاد غير مقترن (رؤوس الأسهم). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
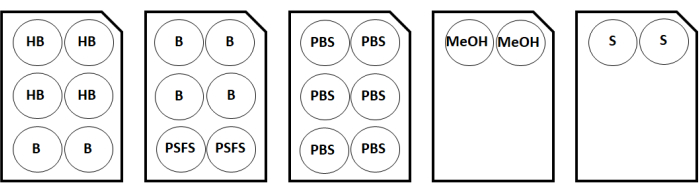
الشكل 2: خريطة تكوين لوحة تلطيخ لعينتين من الغطاء. الاختصارات: HB = مخزن مؤقت للترطيب ؛ B = مخفف / كتلة الأجسام المضادة ؛ PSFS = محلول مثبت بعد التلوين ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ MeOH = الميثانول. S = حل التخزين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تكوين لوحة المراسل. يحتوي كل جسم مضاد مقترن على رمز شريطي مكمل لمراسل معين. لإعداد لوحة المراسل ، يجب إدراج كل جسم مضاد مقترن ومراسله المقابل. بعد ذلك ، يتم تعيين رقم دورة لكل جسم مضاد. يستخدم أداء دورتين فارغتين (C1 و C18) لتقييم مستوى التألق الذاتي في قنوات التألق الثلاث ولطرح الخلفية بعد التصوير باستخدام برنامج التحكم في الحصول على الصور. سيقوم معالج البرامج بفحص الجهاز في هذه المرحلة للتأكد من صحة جميع الإعدادات (الشكل 4). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
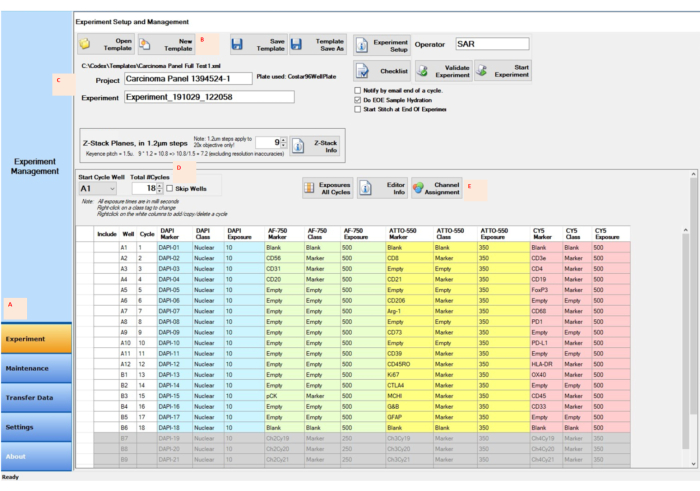
الشكل 4: الحصول على الصور باستخدام برنامج التحكم لإعداد التجربة . (أ) حدد علامة التبويب التجربة في الزاوية السفلية اليسرى من برنامج التحكم لإعداد الإعداد وبدء تشغيله. (ب، ج) حدد قالب جديد لإدخال الإعدادات التجريبية بمشروع جديد واسم تجربة. (د) تغيير دورة البداية بشكل جيد وعدد الدورات لتعكس موقع المراسل في لوحة المراسل المكونة من 96 بئرا. (ه) تعيين قنوات مضان مناسبة للقنوات الأربع المخصصة للتشغيل التجريبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تصور الصورة باستخدام البرامج المستندة إلى الويب (QuPath). تعرض نافذة العارض 26 علامة في قسم FFPE لأنسجة اللوزتين الملطخة. تعرض نافذة السطوع والتباين العلامات مع علامات الاختيار. أخيرا ، تعرض نافذة العارض عينة FFPE مع العلامات المحددة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
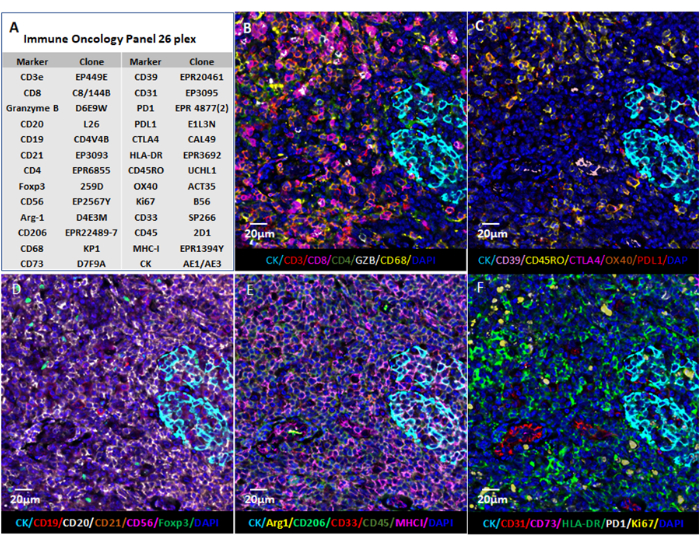
الشكل 6: تصور الصورة باستخدام البرامج المستندة إلى الويب. (أ) تم تلطيخ أقسام أنسجة اللوزتين للعلامات ال 26 ، وتم تصوير صور الأقسام بتنسيق QPTIFF باستخدام برنامج عارض الشرائح الرقمي التجاري أو برنامج مفتوح المصدر (QuPath) للتعليق والاستعراض. (ب-و) تم عرض ست علامات في نفس التعليق التوضيحي للحصول على رؤية أفضل للإشارات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
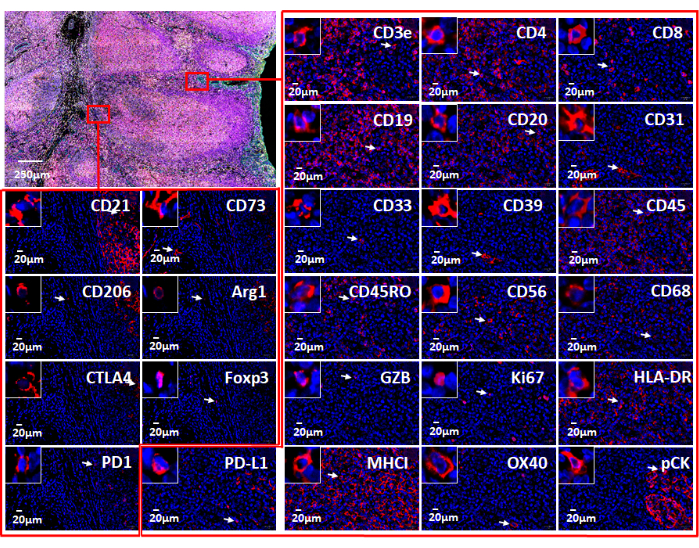
الشكل 7: مناظر للعلامات الفردية ال 26 المستخدمة مع البرامج المستندة إلى الويب. يظهر تعبير العلامة في أنسجة اللوزتين عن طريق تلطيخ التألق المناعي بلوحة الأورام المناعية (أعلى اليسار). يتم عرض علامات فردية في منطقتين صغيرتين (مستطيلات حمراء). يظهر الإدراج المكبر الخلايا الموجبة لهذه العلامات (الأسهم البيضاء). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
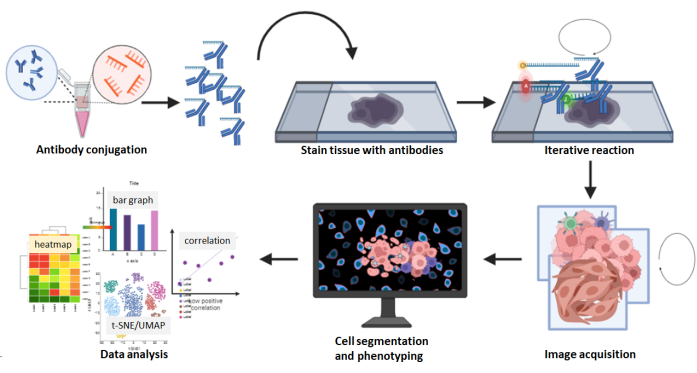
الشكل 8: ملخص سير عمل الحصول على الصور المتعددة. تم تلطيخ أقسام أنسجة FFPE باستخدام لوحة الأجسام المضادة 26 متبوعة بتفاعل متعدد الدورات. تمت معالجة الصور الخام للأقسام الملطخة حسابيا ، وتم إجراء كثافة الخلية والتحليل المكاني باستخدام الصور المركبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: التحقق من صحة IHC في أنسجة اللوزتين. تم تلطيخ أقسام أنسجة FFPE باستخدام جسم مضاد فردي. يظهر تعبير العلامة في نسيج اللوزتين عند تكبير منخفض ، ويظهر الإدراج المكبر الخلايا الموجبة للعلامة (المستطيلات الحمراء). الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يلعب TME دورا أساسيا في تطور السرطان وتطوره واستجابات العلاج. بالإضافة إلى ذلك ، يمكن أن تكون كثافة مجموعات فرعية محددة من الخلايا الليمفاوية المتسللة للورم في TME بمثابة علامة حيوية تنبؤية لأنواع معينة من السرطان. بشكل ملحوظ ، بالإضافة إلى التركيب الخلوي ل TME ، يمكن أن توفر الخصائص المكانية للورم مخططا تفصيليا لفهم بيولوجيا الورم وتحديد المؤشرات الحيوية المحتملةللتنبؤ 12,17.
نظرا لأن العديد من مجموعات الخلايا المناعية تشارك في استجابات السرطان أو المضادة للسرطان ، فإن الفهم الأفضل لهذه الخلايا وعلاقاتها المكانية مع بعضها البعض ومع الخلايا السرطانية سيساعد في توجيه تحديد استراتيجيات العلاج المناعي الجديدة. قامت الدراسات السابقة بتقسيم الموقع والتوزيع المكاني لخلايا TME بناء على بنية الأنسجة في المناطق داخل الورم وحول الورم والهوامش الغازية للخلايا السرطانية18,19. على مدى السنوات ال 15 الماضية ، جعلت التطورات التكنولوجية تحليل النمط الظاهري للخلايا الفردية بناء على تشتتها المكاني أداة جديدة ومؤثرة لدراسة TME وتصنيف المؤشرات الحيوية المحتملة للعلاج المناعي للورم. يمكن للكيمياء النسيجية Multiplex IF تقدير علامات بيولوجية متعددة في نفس الوقت20.
على غرار استراتيجية الأجسام المضادة المترافقة قليل النوكليوتيد ، يتم استخدام أربعة أنواع من منصات تعدد الإرسال القائمة على البروتين لدراسة TME: أنظمة الكشف عن الأجسام المضادة ذات العلامات الكروموجينية ، والتألق ، والباركود DNA ، والنظائر المعدنية. تتيح منصات IHC الكروموجينية الفعالة من حيث التكلفة تصور الشريحة الكاملة والتقييم المرضي باستخدام الفحص المجهري التقليدي للمجال الساطع. في IF و IHC المتعددين ، يتم استخدام الأجسام المضادة المترافقة مع الفلوروفور. تكتشف منصة IF / IHC متعددة الإرسال الأجسام المضادة ذات الخصوصية العالية ويمكنها تحديد الأجسام المضادة المستهدفة حتى على المستوى تحت الخلوي 6,21. بالإضافة إلى ذلك ، نظرا لطبيعة الكروموجينات والفلوروفورات ، فإن استخدام لوحة واحدة من الأجسام المضادة يمكن أن يلتقط تعبير ما يصل إلى 10 مؤشرات حيوية على شريحة واحدة. على المنصات القائمة على النظائر المعدنية ، تستخدم الأجسام المضادة الموسومة بالمعادن لإجراء تصوير متعدد الإرسال بدقة خلية واحدة ومكانية ، وحساسية عالية لأقسام الأنسجة الفردية22. من الناحية النظرية ، تتيح مناهج الأجسام المضادة المقترنة بالمعادن الكشف المتزامن عن أكثر من 100 مؤشر حيوي في قسم نسيج واحد. ويتمثل أحد التحديات التي تواجه تقنية وضع العلامات على النظائر في التداخل متساوي الضغط، الذي يمنع الوصول إلى درجة نقاء التخصيب بنسبة100 في المائة 23. علاوة على ذلك ، يزداد التداخل مع زيادة عدد العلامات. تتعرف منصات الكشف عن الأجسام المضادة المقترنة بالحمض النووي على الأجسام المضادة الموسومة برموز شريطية فريدة من نوعها للحمض النووي. يمكن التقاط أكثر من 40 مؤشرا حيويا في وقت واحد بدقة عالية على هذه المنصات6.
التصوير المتعدد هو منصة للكشف عن الأجسام المضادة ذات الرمز الشريطي للحمض النووي المتاحة تجاريا لتطبيق الأجسام المضادة المقترنة بالحمض النووي على شريحة نسيج واحدة في خطوة واحدة (الشكل 8). بالنسبة لمرحلة تحضير الأنسجة ، على عكس منصة التصوير بالحزمة الأيونية المتعددة ، والتي تتطلب استخدام شرائح مطلية بالذهب تم الحصول عليها من الشركات المصنعة ، تتطلب منصة التصوير متعددة الإرسال فقط أغطية عادية أو شرائح مغلفة بنسبة 0.1٪ بولي-L-lysine لمساعدة الأنسجة على الالتصاق بها والحفاظ على الأنسجة سليمة أثناء عملية التلوين والتصوير. يوصى باستخدام أقسام الأنسجة على أغطية الغطاء في غضون 4 أسابيع بعد التقسيم ، حيث يؤدي التخزين المطول للشرائح غير الملوثة إلى تقليل المستضد. يمكن الاحتفاظ بعينة غطاء ملطخة في مخزن مؤقت عند 4 درجات مئوية لمدة تصل إلى 2 أسابيع دون أن تفقد إشارة تلطيخها. لا توجد معدات خاصة مطلوبة لتخزين عينات الغطاء. تمت ترقية نظام التصوير متعدد الإرسال لاستخدام الشرائح العادية بدلا من أغطية الغطاء ، مما يتيح تلطيخ الأنسجة الكبيرة وسهولة التعامل معها. عند استخدام محلول اختزال لاقتران الأجسام المضادة (الخطوة 3.2.3) ، يجب أن يقتصر التفاعل على ما لا يزيد عن 30 دقيقة لمنع تلف الأجسام المضادة. يجب إعداد مخازن الحظر المؤقتة في الخطوة 5.6.6 حديثا ، ويجب عدم إعادة استخدام المخازن المؤقتة للحظر.
بالمقارنة مع منصات الكشف عن الأجسام المضادة متعددة الإرسال التي تحمل علامات الكروموجين والتألق والنظائر المعدنية ، فإن تقنية التصوير المتعدد لها مزايا معينة. على سبيل المثال ، يتوفر تجاريا أكثر من 60 لوحة من الأجسام المضادة المصممة مسبقا للتصوير متعدد الإرسال ، مما يساعد على توفير الوقت والتكاليف في اقتران الأجسام المضادة والتحقق من صحتها ، ويتزايد عدد لوحات الأجسام المضادة المصممة مسبقا. هذه الأجسام المضادة ، والتي تشمل علامة السرطان عموم السيتوكيراتين ، وعلامة سرطان الجلد SOX10 ، وعلامة الأوعية الدموية CD31 ، وعلامة اللحمية SMA ، والعديد من علامات الخلايا المناعية ، تم التحقق من صحتها وجاهزة للتجربة. بالنسبة للأجسام المضادة غير المصممة مسبقا ، فإن مجموعة الاقتران المتاحة تجاريا والمصممة للاستخدام مع التصوير متعدد الإرسال واضحة وسهلة الاستخدام. الأجسام المضادة المترافقة مع العملاء جيدة لمدة 1 سنة عند تخزينها في 4 °C. بالإضافة إلى ذلك ، لا يلزم إحماء الجهاز لالتقاط الصور. في تقنية التصوير متعددة الإرسال هذه ، نادرا ما تؤدي خطوات الغسيل والتهجين والتجريد التكرارية في الحصول على الصورة إلى انخفاض كثافة العلامة أو تدهور مورفولوجيا الأنسجة5،24،25. علاوة على ذلك ، يتم التقاط الصور المركبة بتنسيق QPTIFF باستخدام مجهر مضان بسيط ثلاثي الألوان ويمكن تحميلها وتحليلها باستخدام برنامج تحليل رقمي تابع لجهة خارجية. يمكن تصور علامات التلوين بدقة خلية واحدة ، ويمكن تمييز الأنماط الظاهرية للخلية من خلال التوطين المشترك للعلامات (الشكل 6 والشكل 7). يكشف التحليل الشامل للصورة متعددة الإرسال عن مقصورات الأنسجة ، والقياس الكمي لعلامة الخلية الواحدة ، وأقرب بيانات الجار والقرب (الشكل 8).
التحدي في تحليل الصور متعددة الإرسال هو تحديد نوع الخلية. عادة ، عندما يتم تطبيق المزيد من مصنفات الكائن الواحد على صورة ما ، سيتم تعليق المزيد من الأنماط الظاهرية غير الشائعة. لذلك ، يوصى باستخدام علامات معروفة لم يتم التعبير عنها بشكل مشترك في نفس المصنف وتطبيق المصنف المرتبط بالنمط الظاهري فقط على التعليق التوضيحي للخلايا المفردة. ستؤدي الاختلافات في التعليقات التوضيحية لنوع الخلية إلى نتائج مكانية مختلفة اختلافا جوهريا ، مثل الاختلافات في التوزيع المكاني للخلية وتحليل الجوار الخلوي26,27.
أثبت تحليل الصور المتعددة نجاحه في تلطيخ وتصوير العديد من أنواع العينات ، بما في ذلك أنسجة FFPE والأنسجة المجمدة الطازجة والشرائح الكاملة المؤرشفة والمصفوفات الدقيقة للأنسجة. يمكن الحصول على صور متعددة الإرسال لأقسام الثدي والدماغ والرئة والطحال والكلى والعقدة الليمفاوية وأنسجة الجلد باستخدام بيانات التنميط الظاهري المكاني العميق أحادي الخلية5،16،25،28.
في المستقبل ، من المتوقع المزيد من الأجسام المضادة المصممة مسبقا للتصوير متعدد الإرسال. بالإضافة إلى ذلك ، هناك حاجة ماسة إلى تطوير برامج محددة لتحليل الصور المتعددة. حاليا ، توجد العديد من البرامج المتاحة تجاريا ومفتوحة المصدر لتحليل الصورHi-Plex 29 ، لكن العلماء ما زالوا بحاجة إلى المساعدة في إنشاء سير عمل قياسي لهذه التحليلات30,31. على الرغم من أن الصور المركبة الملتقطة باستخدام هذا البروتوكول متوافقة مع برامج الجهات الخارجية ، فقد يؤدي ذلك إلى تكاليف إضافية للمستخدم. عيب آخر لتقنية التصوير المتعدد هو انخفاض الإشارة في الكشف عن البروتين النووي بعد الغسيل التكراري والتهجين والتجريد بألواح كبيرة من الأجسام المضادة. لحسن الحظ ، يمكن تقليل ذلك عن طريق استرداد الفلوروفورات المشفرة في الدورات المبكرة عند تصميم لوحات المراسل. في الآونة الأخيرة ، تمت ترقية هذه المنصة بنظام مسح ضوئي جديد عالي السرعة ، مما قلل بشكل كبير من الوقت اللازم للحصول على الصور المركبة32. بالإضافة إلى ذلك ، تم الإبلاغ عن استراتيجية جديدة تستخدم الرموز الشريطية المقترنة بالتيراميد لتعزيز التصوير القائم على ترميز الأجسام المضادة المترافقة قليل النوكليوتيد. تهدف هذه التقنية إلى تضخيم إشارات التلوين التي يصعب الحصول على الأجسام المضادة المقترنة بالباركود33.
Disclosures
ليس لدى المؤلفين أي تعارضات للكشف عنها.
Acknowledgements
يشكر المؤلفون دونالد آر نوروود من خدمات التحرير ، المكتبة الطبية البحثية في MD Anderson لتحرير هذه المقالة ومختبر تحليل الصور و IF المتعدد في قسم علم الأمراض الجزيئي الانتقالي في MD Anderson. تم دعم هذا المشروع جزئيا من قبل منصة Moonshots لمختبر علم الأمراض الجزيئي الانتقالي - التنميط المناعي (TMP-IL) في قسم علم الأمراض الجزيئي الانتقالي ، ومركز إم دي أندرسون للسرطان بجامعة تكساس ، واتفاقية التعاون NCI U24CA224285 (إلى مركز إم دي أندرسون للسرطان CIMAC).
Materials
| Name | Company | Catalog Number | Comments |
| 10x AR9 Buffer | Akoya Biosciences | AR900250ML | |
| 10x Buffer | Akoya Biosciences | 7000001 | |
| 16% paraformaldehyde | Thermo Fisher Scientific | 28906 | |
| 1X Antibody Diluent/Block | Akoya Biosciences | ARD1001EA | |
| Antibody Conjugation Kit | Akoya Biosciences | 7000009 | Contains Filter Blocking Solution, Antibody Reduction Solution 1, Antibody Reduction Solution 2, Conjugation Solution, Purification Solution, Antibody Storage Solution |
| Assay Reagent | Akoya Biosciences | 7000002 | |
| Diethyl pyrocarbonate | Sigma-Aldrich | 40718-25ML | |
| Dimethyl sulfoxide | Avantor/VWR | BDH1115-4LP | |
| Ethanol, 200 proof | |||
| G Blocker V2 | Akoya Biosciences | 240199 | |
| Histoclear | Thermo Fisher Scientific | 50-329-50 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| Milli-Q Integral 10 | Millipore | ZRXQ010WW | |
| Niknon Fluorescence microscope | Keyence Corp. of America | BZ-X810 | |
| Nuclear Stain | Akoya Biosciences | 7000003 | |
| Nuclease-free water | Thermo Fisher Scientific | AM9938 | |
| NuPAGE | Thermo Fisher Scientific | NP0008 | |
| PBS | Thermo Fisher Scientific | 14190136 | |
| PhenoCycler Barcodes/Reporters Combination | Akoya Biosciences | 5450004 (BX025/RX025) | |
| 5450003 (BX022/RX022) | |||
| 5450023 (BX002/RX002) | |||
| 5250002 (BX020/RX020) | |||
| 2520003 (BX023/RX023) | |||
| 5250005 (BX029/RX029) | |||
| 5250007 (BX035/RX035) | |||
| 5250012 (BX052/RX052) | |||
| 5550012 (BX030/RX030) | |||
| 5550015 (BX042/RX042) | |||
| 5550014 (BX036/RX036) | |||
| QuPath | Open-Source | https://qupath.github.io/ | |
| SimplyBlue SafeStain | Thermo Fisher Scientific | LC6065 | |
| Staining Kit | (Akoya Biosciences | 7000008 | Contains Hydration Buffer, N Blocker, J Blocker, S Blocker, Fixative Reagent, Storage Buffer |
References
- Hanahan, D., Coussens, L. M. Accessories to the crime: Functions of cells recruited to the tumor microenvironment. Cancer Cell. 21 (3), 309-322 (2012).
- Labani-Motlagh, A., Ashja-Mahdavi, M., Loskog, A. The tumor microenvironment: A milieu hindering and obstructing antitumor immune responses. Frontiers in Immunology. 11, 940 (2020).
- Jin, M. Z., Jin, W. L. The updated landscape of tumor microenvironment and drug repurposing. Signal Transduction and Targeted Therapy. 5 (1), 166 (2020).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nature Reviews Immunology. 20 (11), 651-668 (2020).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Communications. 40 (4), 135-153 (2020).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455-33465 (2020).
- Allam, M., Cai, S., Coskun, A. F. Multiplex bioimaging of single-cell spatial profiles for precision cancer diagnostics and therapeutics. NPJ Precision Oncology. 4, 11 (2020).
- Eng, J., et al. A framework for multiplex imaging optimization and reproducible analysis. Communications Biology. 5 (1), 438 (2022).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. Journal for Immunotherapy of Cancer. 9 (7), e002197 (2021).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Heindl, A., Nawaz, S., Yuan, Y. Mapping spatial heterogeneity in the tumor microenvironment: A new era for digital pathology. Laboratory Investigation. 95 (4), 377-384 (2015).
- Kuswanto, W., Nolan, G., Lu, G. Highly multiplexed spatial profiling with CODEX: bioinformatic analysis and application in human disease. Seminars in Immunopathology. 45 (1), 145-157 (2022).
- Phillips, D., et al. Immune cell topography predicts response to PD-1 blockade in cutaneous T cell lymphoma. Nature Communications. 12 (1), 6726 (2021).
- Jhaveri, N., et al. Deep ultrahigh-plex spatial phenotyping of human cancer tissues. Cancer Research. 82, 3877 (2022).
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Yuan, Y. Spatial heterogeneity in the tumor microenvironment. Cold Spring Harbor Perspectives in Medicine. 6 (8), a026583 (2016).
- Bruck, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Modern Pathology. 34 (12), 2229-2241 (2021).
- Tsujikawa, T., et al. Prognostic significance of spatial immune profiles in human solid cancers. Cancer Science. 111 (10), 3426-3434 (2020).
- Hoyt, C. C. Multiplex immunofluorescence and multispectral imaging: forming the basis of a clinical test platform for immuno-oncology. Frontiers in Molecular Biosciences. 8, 674747 (2021).
- Parra, E. R., et al. Identification of distinct immune landscapes using an automated nine-color multiplex immunofluorescence staining panel and image analysis in paraffin tumor tissues. Scientific Reports. 11 (1), 4530 (2021).
- Elaldi, R., et al. High dimensional imaging mass cytometry panel to visualize the tumor immune microenvironment contexture. Frontiers in Immunology. 12, 666233 (2021).
- Campos Clemente, L., Shi, O., Rojas, F., Parra, E. R. Expanding the comprehension of the tumor microenvironment using mass spectrometry imaging of formalin-fixed and paraffin-embedded tissue samples. Journal of Visualized Experiments. (184), e64015 (2022).
- Schurch, C. M., et al. Coordinated cellular neighborhoods orchestrate antitumoral immunity at the colorectal cancer invasive front. Cell. 182 (5), 1341-1359 (2020).
- Phillips, D., et al. Highly multiplexed phenotyping of immunoregulatory proteins in the tumor microenvironment by CODEX tissue imaging. Frontiers in Immunology. 12, 687673 (2021).
- Hickey, J. W., Tan, Y., Nolan, G. P., Goltsev, Y. Strategies for accurate cell type identification in CODEX multiplexed imaging data. Frontiers in Immunology. 12, 727626 (2021).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- Tzoras, E., et al. Dissecting tumor-immune microenvironment in breast cancer at a spatial and multiplex resolution. Cancers. 14 (8), 1999 (2022).
- Francisco-Cruz, A., Parra, E. R., Tetzlaff, M. T. Wistuba, II. Multiplex immunofluorescence assays. Methods in Molecular Biology. 2055, 467-495 (2020).
- Shakya, R., Nguyen, T. H., Waterhouse, N., Khanna, R. Immune contexture analysis in immuno-oncology: applications and challenges of multiplex fluorescent immunohistochemistry. Clinical and Translational Immunology. 9 (10), e1183 (2020).
- Wilson, C. M., et al. Challenges and opportunities in the statistical analysis of multiplex immunofluorescence data. Cancers. 13 (12), 3031 (2021).
- DeRosa, J. Setting a new standard for spatial omics: An integrated multiomics approach: every single cell, two different analytes, one unbiased picture. Genetic Engineering & Biotechnology News. 42, 26-28 (2022).
- Simonson, P. D., Valencia, I., Patel, S. S. Tyramide-conjugated DNA barcodes enable signal amplification for multiparametric CODEX imaging. Communications Biology. 5 (1), 627 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved