Method Article
Мультиплексный анализ изображений штрих-кодирования для иммунопрофилирования и пространственного картирования при одноклеточном анализе образцов парафиновой ткани
В этой статье
Резюме
Мультиплексный анализ изображений штрих-кодирования в последнее время улучшил характеристику микроокружения опухоли, позволив проводить всесторонние исследования клеточного состава, функционального состояния и межклеточных взаимодействий. Здесь мы описываем протокол окрашивания и визуализации с использованием штрих-кодирования олигонуклеотид-конъюгированных антител и циклической визуализации, что позволяет использовать метод анализа изображений с высокой размерностью.
Аннотация
Технология мультиплексной визуализации с использованием штрих-кодирования антител олигонуклеотидами, которая последовательно обнаруживает несколько эпитопов в одном и том же участке ткани, является эффективной методологией оценки опухоли, которая улучшает понимание микроокружения опухоли. Визуализация экспрессии белка в фиксированных формалином и залитых парафином тканях достигается, когда специфический флуорофор отжигают до связанного с антителом штрих-кода с помощью комплементарных олигонуклеотидов, а затем выполняют визуализацию образца; Действительно, этот метод позволяет использовать настраиваемые панели из более чем 40 антител в одной реакции окрашивания ткани. Этот метод совместим со свежезамороженными тканями, фиксированными формалином, залитыми парафином тканями, культивируемыми клетками и мононуклеарными клетками периферической крови, а это означает, что исследователи могут использовать эту технологию для просмотра различных типов образцов с разрешением одной клетки. Этот метод начинается с ручного протокола окрашивания и фиксации, и все штрих-коды антител наносятся с помощью коктейля антител. Прибор для окрашивания флюидов полностью автоматизирован и выполняет итеративные циклы маркировки, визуализации и удаления спектрально различных флуорофоров до тех пор, пока все биомаркеры не будут отображены с помощью стандартного флуоресцентного микроскопа. Затем изображения собираются и компилируются по всем циклам визуализации для достижения разрешения одной ячейки для всех маркеров. Одноступенчатое окрашивание и щадящее удаление флуорофора не только позволяют проводить высокомультиплексный анализ биомаркеров, но и сохраняют образец для дополнительного последующего анализа, если это необходимо (например, окрашивание гематоксилином и эозином). Кроме того, программное обеспечение для анализа изображений позволяет обрабатывать изображения - компенсацию дрейфа, вычитание фона, сегментацию клеток и кластеризацию, а также визуализировать и анализировать изображения и фенотипы клеток для создания карт пространственной сети. Таким образом, эта технология использует компьютеризированную систему микрофлюидики и флуоресцентный микроскоп для итеративной гибридизации, изображения и удаления флуоресцентно меченных ДНК-зондов, которые комплементарны связанным с тканью олигонуклеотид-конъюгированным антителам.
Введение
Микроокружение опухоли (TME) чрезвычайно неоднородно и состоит из опухолевых клеток, опухолевых стромальных клеток, иммунных клеток, неклеточных компонентов внеклеточного матрикса и многочисленных обильных молекул, продуцируемых и высвобождаемых опухолевыми, стромальными и иммунными клетками 1,2. Накопленные данные свидетельствуют о том, что TME играет ключевую роль в перепрограммировании дифференцировки опухоли, роста, инвазии, метастазирования и ответа на терапию3.
Понимание того, как различные типы клеток в TME взаимодействуют и взаимодействуют друг с другом через сигнальные сети, имеет важное значение для улучшения диагностики рака, оптимизации иммунотерапии и разработки новых методов лечения4. Традиционные методы тканевой микроскопии, включая иммуногистохимию (ИГХ) и иммунофлуоресценцию (ИФ), десятилетиями использовались для изучения типов клеток, их численности и коммуникаций в образцах опухолей. К сожалению, эти методы обычно позволяют оценить только один или два белковых маркера в срезе ткани и не могут выявить сложные пространственные и структурные отношения между этими клетками 5,8,7.
За последние два десятилетия было создано несколько технологий мультиплексной визуализации8. Эти технологии обеспечивают значительно улучшенное представление о составе, функции и расположении иммунных клеток в TME, что приводит к быстрому прогрессу в способности идентифицировать и пространственно профилировать сложные TME на уровне отдельных клеток 9,10. Пространственные и структурные взаимосвязи различных опухолевых и иммунных клеток в TME в настоящее время находятся на переднем крае биологических и клинических исследований с использованием этих технологий мультиплексной визуализации11,12.
Недавно разработанная технология мультиплексной визуализации с использованием штрих-кодирования олигонуклеотидно-конъюгированных антител является влиятельной одноклеточной биологической исследовательской платформой, основанной на обнаружении олигонуклеотид-конъюгированных антител в образцах, фиксированных формалином и встроенных в парафин (FFPE)образцах 13,14. В настоящее время эта технология мультиплексной визуализации позволяет одновременно визуализировать более 100 маркеров в одном срезеткани 15, что увеличило количество типов клеток, различимых in situ. Это позволяет проводить пространственный анализ опухолевых и иммунных клеток, который невозможен при использовании традиционных подходов к иммунофенотипированию16.
Здесь мы описываем оптимизированный протокол для конъюгации очищенных антител к олигонуклеотидам и валидации этой конъюгации с использованием платформы мультиплексной визуализации и многоцикловой процедуры визуализации с тканью FFPE. Кроме того, мы описываем основные процедуры обработки изображений и анализа данных, используемые с этой технологией.
протокол
Это ретроспективное исследование было одобрено Институциональным наблюдательным советом Онкологического центра им. М. Д. Андерсона Техасского университета. Образцы тканей FFPE были собраны у пациентов в MD Anderson в рамках рутинного стандартного ухода. Никаких диагностических или терапевтических вмешательств не проводилось. От пациентов было получено информированное согласие на использование собранных образцов для исследования и публикации.
1. Источники антител, используемые для дизайна панели антител
- Создайте панель антител для мультиплексной визуализации после тщательного рассмотрения качества интересующих тканей и белков. Для дизайна панели антител рассматриваются три источника антител: 1) полностью коммерчески проверенные антитела, 2) антитела, проверенные технологией мультиплексной визуализации, и 3) антитела, совместно используемые конечным пользователем.
ПРИМЕЧАНИЕ: Было показано, что антитела, проверенные с помощью технологии мультиплексной визуализации, работают и доступны у поставщиков. Эти скрининговые антитела могут быть применены к мультиплексному окрашиванию изображения после конъюгации олигонуклеотидов пользователем. - Если интересующий белок не может быть найден в источниках, упомянутых выше, используйте клоны антител, которые, как известно, работают с IHC. Кроме того, для этой технологии мультиплексной визуализации рекомендуются изотипы IgG, а не клоны IgM, из-за более высокой частоты отказов с IgM, чем с клонами IgG.
2. Перед конъюгацией антител
- При идентификации клонов антител для конъюгации с использованием мультиплексных штрих-кодов визуализации рассмотрите возможность покупки антител без носителей в фосфатно-буферном физиологическом растворе (PBS) или аналогичном буфере. Известно, что белки-носители, включая BSA, глютен, глицерин и другие белковые добавки, снижают конъюгационную способность.
- Выберите наиболее подходящий клон антитела и всегда оптимизируйте условия окрашивания (т.е. извлечение антигена и титрование) перед конъюгацией. Сделайте это, применив неконъюгированный клон антитела к положительной и отрицательной ткани для этого антитела, используя стандартные IF или IHC.
ПРИМЕЧАНИЕ: Если очищенное антитело не является коммерчески доступным, перед конъюгацией необходимо выполнить процесс очистки антител. Процедура очистки, используемая с наборами для очистки антител, здесь не обсуждается.
3. Конъюгация антител
- Получают реагенты для конъюгации антител. Коммерчески доступные конъюгационные наборы содержат фильтрующий раствор, восстановительный раствор 2, конъюгационный раствор, раствор для очистки, раствор для хранения антител (все хранятся при 4 ° C) и восстановительный раствор 1 (хранятся при -20 ° C).
- Спряжение
ПРИМЕЧАНИЕ: Очищенное антитело обрабатывают восстановителем, позволяя восстановленным фрагментам антитела реагировать с мультиплексным штрих-кодом изображения, используемым с этой технологией, и, таким образом, образовывать ковалентную связь. Этот процесс занимает около 4,5 часов и приводит к получению примерно 120 мкл конъюгированного антитела, которое жизнеспособно в течение 1 года. Весь отжим проводится при комнатной температуре (RT), и проточный поток отбрасывается, за исключением самого последнего этапа (3.2.9), на котором пробирка для сбора содержит конъюгированное антитело.- Аспирируют и наносят 500 мкл фильтрующего раствора с помощью пипетки на отсечные фильтрующие колонки с молекулярной массой 50 кДа и вращают при 12 000 x g в течение 2 мин, чтобы блокировать неспецифическое связывание антител.
ПРИМЕЧАНИЕ: Если в верхней части колонны виден остаточный раствор, переверните фильтр в сборной трубке и открутите вниз при 3,000 x g в течение 2 мин. - Пипетку 50 мкг антитела в объеме 100 мкл раствора помещают в фильтрующую колонку и вращают при 12 000 x g в течение 8 мин.
ПРИМЕЧАНИЕ: Используйте спектрофотометр для измерения концентрации очищенного антитела и расчета объема раствора, соответствующего 50 мкг антитела. Если объем раствора антител меньше 100 мкл, отрегулируйте объем до 100 мкл, добавив 1x PBS. Сохраняют 1 мкг неконъюгированного антитела для подтверждения конъюгации (этап 4.4). - Пипетка 260 мкл восстановительной мастер-смеси (20 мкл восстановительного раствора 1 в смеси с 825 мкл восстановительного раствора 2, что достаточно для трех реакций конъюгации антител) в каждую фильтрующую колонку. Осторожно встряхните основную смесь в течение 2-3 с или пипеткой вверх и вниз, чтобы смешать раствор с антителом. Инкубировать при РТ в течение 30 мин.
- После инкубации открутите фильтрующие колонны до 12 000 x g в течение 8 минут. Добавьте 450 мкл конъюгационного раствора в фильтрующие колонки и отжимайте при 12 000 x g в течение 8 мин.
- Ресуспендируйте желаемый штрих-код в 10 мкл воды, не содержащей нуклеаз, и 210 мкл конъюгационного раствора.
ПРИМЕЧАНИЕ: Подготовьте метку антител непосредственно перед использованием для окрашивания. Не используйте повторно аликвоты штрих-кода антител. - После завершения отжима на шаге 3.2.4 добавьте ресуспендированную метку антитела (приблизительно 220 мкл) в каждую соответствующую фильтрующую колонку. Аккуратно нанесите смесь пипеткой вверх и вниз, чтобы перемешать реагенты. Закройте крышки фильтрующих колонок и инкубируйте реакцию конъюгации при RT в течение 2 ч. Через 2 часа опустите фильтрующие колонки до 12 000 x g в течение 8 мин.
ПРИМЕЧАНИЕ: Для протокола подтверждения рекомендуется отложить 5 мкл конъюгированного раствора в пробирке полимеразной цепной реакции и хранить его при температуре 4 °C (см. Ниже). - Пипеткой 450 мкл очистительного раствора в каждую фильтрующую колонну и отжим при 12 000 x g в течение 8 мин. Повторите три раза.
- Пипеткой 100 мкл раствора для хранения в фильтрующие колонны. Аккуратно проведите пипеткой смесь вверх и вниз более 10 раз и тщательно промойте стенки фильтров в колонне.
ПРИМЕЧАНИЕ: Растворите 50 мкг антитела в 100 мкл раствора для хранения. Если реакцию конъюгации запускают с более чем 50 мкг антитела, добавьте больше раствора для хранения в этом соотношении. - Переверните фильтрующие колонны в трубку для сбора свежих материалов. Отжимайте при 3,000 x g в течение 2 мин при RT. Храните собранный раствор. Пипеткой раствор конъюгированного антитела помещают в стерильные пробирки с завинчивающейся крышкой и хранят до 1 года при температуре 4 °C.
ПРИМЕЧАНИЕ: Конъюгированное антитело должно быть протестировано с помощью технологии мультиплексной визуализации через 2 дня. Предварительное тестирование может привести к высокофоновому ядерному окрашиванию.
- Аспирируют и наносят 500 мкл фильтрующего раствора с помощью пипетки на отсечные фильтрующие колонки с молекулярной массой 50 кДа и вращают при 12 000 x g в течение 2 мин, чтобы блокировать неспецифическое связывание антител.
4. Подтверждение спряжения
ПРИМЕЧАНИЕ: Перед проведением экспериментов по окрашиванию конъюгированного пользователем антитела с использованием технологии мультиплексной визуализации конъюгацию следует подтвердить с помощью гель-электрофореза с 5 мкл конъюгированного антитела (см. этап 3.2.6) вместе с 1 мкг неконъюгированного антитела (обычно в 2 мкл смеси) в качестве контроля. Успешная конъюгация антител будет продемонстрирована увеличением молекулярной массы антитела. Однако этот протокол подтверждения только оценивает успех химической реакции для конъюгации и не рассматривает валидацию антител, используемую для мультиплексной визуализации.
- Пипеткой 8 мкл и 11 мкл безнуклеазной воды в зарезервированное конъюгированное антитело и контрольное неконъюгированное антитело соответственно для получения конечного объема 13 мкл.
- Пипетку 5 мкл буфера для образца LDS (или другой системы электрофореза в виде додецилсульфата натрия и полиакриламидного геля) и 2 мкл восстановителя образца в каждый образец зарезервированного конъюгированного антитела и денатурируйте образцы в сухой ванне с температурой 95 °C в течение 10 минут.
- Во время денатурации образцов разведите 40 мл рабочего буфера MOPS SDS в 760 мл сверхчистой воды, поместите гель в резервуар системы электрофореза и вылейте разбавленный проточный буфер на гель.
- После завершения 10-минутного периода денатурации загрузите одну лунку геля предварительно окрашенным стандартом белка, одну — неконъюгированным антителом (из этапа 3.2.2), а остальные лунки — образцами конъюгированных антител. Затем запустите гель при 150 В до тех пор, пока в конце геля не появится стандарт белка.
ПРИМЕЧАНИЕ: Гель легко прилипает к контейнерам, пригодным для использования в микроволновой печи, и, таким образом, может порваться, поэтому с гелем следует обращаться с осторожностью на следующих этапах. - После завершения прогона переложите гель в контейнер, пригодный для использования в микроволновой печи, предварительно заполненный сверхчистой водой, и нагрейте его в микроволновой печи до тех пор, пока не будет визуализирован первый пузырь в воде.
ПРИМЕЧАНИЕ: Время образования пузырьков сильно варьируется в зависимости от используемой микроволновой печи. - Слейте воду из контейнера, налейте на гель около 250 мл пятна Coomassie G-250 и нагрейте гель в микроволновой печи, пока не появится первый пузырь. После этого выньте контейнер с гелем и пятном Coomassie G-250 из микроволновой печи и поместите его в шейкер на 10 минут.
- После встряхивания осторожно слейте пятно, замените его примерно 200 мл сверхчистой воды, а затем поместите емкость на шейкер для смывания геля.
- Слейте сверхчистую воду и замените ее новой сверхчистой водой пять раз или до тех пор, пока остатки пятна не станут видны на водяной бане. Оставьте гель смывать на ночь на шейкере до тех пор, пока не станут видны полосы, если это необходимо, прежде чем фотографировать гель (рис. 1).
ПРИМЕЧАНИЕ: Антитела, используемые в мультиплексной визуализации, должны иметь окраску, сравнимую с окраской антител, конъюгированных с красителем. Срезы ткани с известными антигенами, положительными для конъюгированных антител, могут быть окрашены олигонуклеотид-конъюгированными и краситель-конъюгированными антителами. В этой работе в каждом случае морфология тканей для обоих типов антител была эквивалентна и гармонизирована друг с другом, а также ожидаемое распределение клеток на основе биологии интересующих белков и образцов тестовой ткани. Этот результат демонстрирует эффективность использования фрагментов олигонуклеотид-конъюгированных антител для подходов, основанных на окрашивании тканей, с использованием ткани FFPE.
5. Окрашивание олигонуклеотид-конъюгированных антител
- Подготовьте покровные стекла для размещения ткани.
- Замочите покровные стекла в 0,1% растворе поли-L-лизина в течение 24 ч при RT, чтобы улучшить адгезию тканей.
- После замачивания слейте раствор поли-L-лизина и промойте покровные стекла сверхчистой водой в течение 30 с. Повторите стирку четыре-шесть раз. Выньте покровные стекла из сверхчистой воды, используемой для стирки, и положите их на безворсовое полотенце, чтобы они высохли в течение ночи.
ПРИМЕЧАНИЕ: Гистолог должен разрезать выбранную ткань на участки толщиной 5 мкм, поместить их в центр заряженного поли-L-лизином покровного стекла и дать им высохнуть в течение ночи. После высыхания покровные стекла с тканевыми срезами необходимо хранить при температуре 4 °C не более 6 месяцев. Панель окрашивания в этом протоколе содержала 26 маркеров. Ткань, используемая в этом протоколе, была нормальной тканью миндалин человека. Время замачивания покровного стекла не должно превышать 1 недели. Покровные стекла с поли-L-лизиновым покрытием можно хранить в RT и использовать в течение 2 месяцев после приготовления.
- За день до окрашивания поместите держатель покровного стекла в духовку при температуре 60 °C на ночь.
- На следующий день поместите образец покровного стекла в предварительно разогретый держатель покровного стекла в духовке при температуре 60 °C. После запекания в течение 30 минут проверьте, не растаял ли парафин от ткани.
- Быстро поместите держатель/образец покровного стекла в следующую серию растворов: два раунда депарафинизирующего агента по 6 минут каждый; два раунда 100% этанола по 5 мин каждый; один раунд 90% этанола в течение 5 мин; один раунд 70% этанола в течение 5 мин; один раунд 50% этанола в течение 5 мин; один раунд 30% этанола в течение 5 мин; и два раунда сверхчистой воды, обработанной диэтилпирокарбонатом (DEPC), в течение 5 минут каждый.
ПРИМЕЧАНИЕ: Все разбавления этанола готовятся сверхчистой водой, обработанной DEPC. Если для депарафинизации используется ксилол, его следует использовать в вытяжке. - Подвергая держатель/образец покровного стекла серии растворов, выполните следующие действия:
- Подготовьте камеру влажности, поместив внизу пустую коробку для наконечников пипетки с пропитанным водой бумажным полотенцем.
- Наполните скороварку достаточным количеством воды, чтобы наполовину покрыть стакан объемом 50 мл.
- Поместите 5 мл метанола на образец в стакан при температуре 4 °C.
- Разбавьте буфер AR9 сверхчистой водой, обработанной DEPC, до 1x; На один держатель покровного стекла требуется около 50 мл разбавленного буфера.
- После того, как серия растворов будет завершена, заполните стеклянный стакан объемом 50 мл примерно 40 мл 1x буфера AR9, погрузите держатель покровного стекла / образец в стакан и полностью накройте стакан / держатель покровного стекла алюминиевой фольгой.
- Поместите покрытый алюминиевой фольгой стакан / держатель защитного стекла в скороварку, наполненную водой, и готовьте при высоком давлении (около 15 фунтов на квадратный дюйм) в течение 20 минут.
- После приготовления извлеките стакан / держатель покровного стекла, осторожно разверните алюминиевую фольгу и дайте стакану / держателю защитного стекла остыть при RT в течение примерно 10 минут.
- Извлеките держатель покровного стекла / образец из буфера 1x AR9 и погрузите его в два раунда сверхчистой воды, обработанной DEPC, выполняя инкубацию образцов в обоих раундах в течение 2 минут каждый.
- Во время инкубации извлеките гидратационный буфер, блокирующие N, блокирующие G, блокирующие J и блокирующие растворы S, а также разбавитель/блок антител из мультиплексного набора для окрашивания изображений. Для двух образцов покровного стекла наклейте этикетки на 6-луночные пластины для растворов, используя конфигурации, показанные на рисунке 2.
- Поместите образец покровного стекла в два раунда по 5 мл гидратационного буфера на 2 минуты каждый.
- После обоих раундов помещения в гидратационный буфер поместите образец покровного стекла в 5 мл мультиплексного разбавителя/блока антител для визуализации и инкубируйте в течение 20-30 мин при ЛТ (не более 30 мин).
- Во время инкубации приготовьте коктейль антител, сделав 200 мкл основной смеси мультиплексных разбавителей/блоков антител для визуализации, N-блокаторов, G-блокаторов, J-блокаторов и S-блокаторов.
ПРИМЕЧАНИЕ: Рассчитайте общее количество антител на основе количества маркеров и подтвержденного титрования каждого маркера и вычтите общее количество антител из основной смеси. Например, для шести маркеров, каждый из которых имеет титрование 1:200, уравнение будет таким: 200 мкл основной смеси − 6 мкл коктейля антител = 194 мкл основной смеси.
- После инкубации в мультиплексированном разбавителе/блоке антител для визуализации помещают образец покровного стекла в камеру влажности, приготовленную на этапе 5.5.1, пипетку 190 мкл коктейля антител на образец покровного стекла и инкубируют образец покровного стекла в RT в течение 3 часов.
- После инкубации промойте образец покровного стекла в два раунда 5 мл мультиплексированного разбавителя/блока антител для визуализации в течение 2 мин каждый.
- Чтобы зафиксировать связанные антитела к ткани на покровном стекле, выполните действия 5.7.3-5.7.5 в камере влажности.
- Инкубируйте покровные стекла в течение 10 мин с 16% формальдегидом, разбавленным до 1,6% раствором для хранения, а затем трижды промойте покровные стекла 1x PBS.
- Инкубируйте покровные стекла в течение 5 минут с метанолом 4 °C, а затем трижды промойте покровные стекла 1x PBS.
- Инкубируйте покровные стекла в течение 20 мин с 5 мл фиксирующего реагента, разбавленного 1x PBS, а затем трижды промойте покровные стекла 1x PBS.
- Храните окрашенные образцы покровного стекла в буфере для хранения при температуре 4 °C до 2 недель
6. Мультиплексированная репортерная пластина изображения
ПРИМЕЧАНИЕ: 96-луночная пластина, называемая репортерной пластиной, содержащая флуорофоры со штрих-кодом в отдельных лунках, готовится в соответствии с специально разработанными экспериментами по мультиплексной визуализации и коррелирует с каждым окрашенным образцом покровного стекла. Следующие шаги предназначены для подготовки репортерной пластины.
- Приготовьте репортерную мастер-смесь, смешав 4,880 мкл воды, не содержащей нуклеазы, 600 мкл 10-кратного мультиплексированного буфера для визуализации, 500 мкл анализирующего реагента и 20 мкл раствора ядерного красителя. Этого хватит на 20 циклов всех скважин.
- В каждом цикле специально разработанного эксперимента по мультиплексной визуализации заполняйте лунку 245 мкл раствора, содержащего репортерную мастер-смесь и специальные флуорофоры со штрих-кодом для этого цикла.
ПРИМЕЧАНИЕ: На рисунке 3 показана конфигурация репортерной пластины, используемая в этом протоколе для панели карциномы. - Чтобы защитить флуорофоры со штрих-кодом, наклейте крышку пластины из фольги на пластину репортера и поместите пластину в мультиплексный прибор визуализации.
- Храните репортерную пластину в темной коробке при температуре 4 °C до 2 недель.
7. Калибровка и запуск мультиплексного аппарата визуализации
ПРИМЕЧАНИЕ: Флуоресцентный микроскоп высокого разрешения захватывает четыре различных флуоресцентных канала в каждом цикле мультиплексной визуализации при 20-кратном, 100% возбуждающем свете и с низким фотообесцвечиванием.
- Откалибруйте фокус изображения с помощью канала DAPI, поместив покровное стекло образца на столик микроскопа, вручную пипетируя 700 мкл титрования раствора ядерного красителя в соотношении 1:1,500 на ткань.
ПРИМЕЧАНИЕ: Покровное стекло сохраняется на предметном столике микроскопа во время промывки образца и визуализации. - Чтобы подготовить мультиплексный прибор для визуализации, разбавьте 10-кратный мультиплексный буфер визуализации до 1-кратного использования сверхчистой воды, обработанной DEPC, и наполните флаконы с реагентами соответствующими растворами/растворителями, включая разбавленный 1x мультиплексный буфер изображения, сверхчистую воду, обработанную DEPC, и диметилсульфоксид (ДМСО).
- После того, как флаконы с реагентами будут заполнены соответствующим образом, введите план эксперимента в программное обеспечение для управления мультиплексными приборами визуализации; обозначить правильный цикл, номера скважин, места Z-стека, название маркера, класс и время экспозиции для каждого цикла (рис. 4); установить все параметры микроскопа; и выберите интересующие области на образце покровного листа для изображения.
- Нажмите кнопку «Эксперимент» в управляющем программном обеспечении (рис. 4A). В окне Experiment Setup and Management (Настройка и управление экспериментом) нажмите кнопку New Template (рисунок 4B).
- Введите название проекта в поле рядом с кнопкой Project (рисунок 4C). Введите или выберите общее количество циклов (рис. 4D).
- Нажмите на кнопку Channel Assignment , введите информацию для каждого цикла в столбцы (рис. 4E) и нажмите кнопку Save Template . Запустите эксперимент, нажав кнопку « Начать эксперимент ».
ПРИМЕЧАНИЕ: Во время эксперимента с мультиплексной визуализацией прибор извлекает флуорофоры со штрих-кодом из одной лунки репортерной пластины (максимум четыре флуорофора на лунку, включая DAPI), распределяет их непосредственно на покровное стекло образца и отображает интересующие области для каждого канала флуоресценции. После всех изображений для этого цикла прибор смывает флуорофоры со штрих-кодом и выдает следующий цикл репортеров (из следующей скважины на репортерной пластине). Визуализация продолжается до тех пор, пока не будут завершены все циклы с использованием 26 маркеров.
8. Коллекция изображений
ПРИМЕЧАНИЕ: Мультиплексные изображения могут быть получены с помощью любого адаптированного инвертированного флуоресцентного микроскопа, сконфигурированного с четырьмя каналами флуоресценции (DAPI, Cy3, Cy5 и Cy7) и оснащенного линзой Plan Fluor 20x. Визуализация и промывка образцов покровного стекла итеративно выполняются автоматически с использованием специально разработанной установки флюидики. Изображения получены с помощью программного обеспечения процессора (v1.8.0.7) в формате QPTIFF.
- В окне процессора нажмите кнопку «Ввод » и выберите название эксперимента.
- В разделе « Параметры обработки » установите и установите флажки « Вычитание фона», « Деконволюция», «Увеличенная глубина резкости» и « Коррекция затенения». Нажмите на кнопку «Пуск ».
9. Анализ изображений
ПРИМЕЧАНИЕ: Полученные изображения могут быть загружены в запатентованное программное обеспечение для автоматического анализа изображений или программное обеспечение с открытым исходным кодом (рис. 5) для последующего анализа.
- Щелкните значок QuPath на компьютере и откройте программное обеспечение. Перетащите файл QPTIFF в окно просмотра .
- Нажмите кнопку «Яркость и контрастность», чтобы открыть окно «Яркость и контрастность». Установите или снимите флажок маркера в столбце «Выбранные», чтобы отобразить или закрыть сигнал маркера.
- Нажмите кнопку «Увеличить по размеру», чтобы увеличить или уменьшить масштаб интересующей области.
ПРИМЕЧАНИЕ: Мультиплексированная визуализация данных изображения дает пользователю возможность глубоко заглянуть в микроокружение тканей. Отдельные маркеры в образцах FFPE могут быть визуализированы в формате флуоресценции (рис. 6 и рис. 7) или в виде патологии . Несколько вычислительных платформ могут быть использованы для обработки составных изображений и анализа данных мультиплексированных изображений тканей. Используя это программное обеспечение, пространственное фенотипирование, а также обнаружение редких клеток и вычисление клеточного соседства могут быть выполнены с помощью цельных слайдовых изображений сверхвысокой мультиплексированной ткани, полученных с помощью технологии мультиплексной визуализации. На рисунке 6 показаны 26 антител в панели карциномы и образце миндалин (дополнительный рисунок 1).
Результаты
Мы использовали образцы миндалин FFPE для разработки 26-маркерной панели иммунной онкологии, чтобы проиллюстрировать иммунный статус ткани FFPE с использованием системы анализа изображений штрих-кодирования. В целом, 19 антител в настоящее время используются в других мультиплексных исследованиях визуализации в нашей лаборатории. Все маркеры были протестированы с использованием ткани FFPE с хромогенным ИГХ. Все антитела были конъюгированы с уникальными олигонуклеотидами ДНК. При настройке покровных листов с помощью веб-менеджера приборов (рис. 4) для этой технологии анализа изображений штрих-кодирования следует отметить, что первый и последний циклы всегда «пусты» (рис. 2 и рис. 4), что обеспечивает фоновые флуоресцентные сигналы, которые должны быть вычтены из специфических сигналов от антител. После того, как изображения в формате QPTIFF были собраны с помощью флуоресцентного микроскопа, их можно визуализировать с помощью нескольких запатентованных программ для автоматического анализа изображений или программ с открытым исходным кодом. Составные изображения могут отображать все маркеры или выбранные маркеры для лучшего просмотра сигналов (рис. 5). Кроме того, каждое антитело может быть визуально оценено на предмет ядерной, цитоплазматической или мембранозной локализации. Иммунные, опухолевые и стромальные клетки могут быть легко идентифицированы. Впоследствии анализ изображений может предоставить информацию об интенсивности сигнала, динамическом диапазоне и пространственном распределении всех маркеров (рис. 6). Эта методика позволила проанализировать все 26 маркеров на субклеточном уровне в одном срезе ткани (рис. 7). Анализируя колокализацию маркеров, мы смогли идентифицировать клеточные фенотипы, локализовать пространственное положение клеток, вычислить расстояние между клетками и найти распределение клеток. Решающее влияние этой технологии заключается в представлении надежной панели из 26 маркеров, ориентированной на иммунный статус микроокружения ткани.
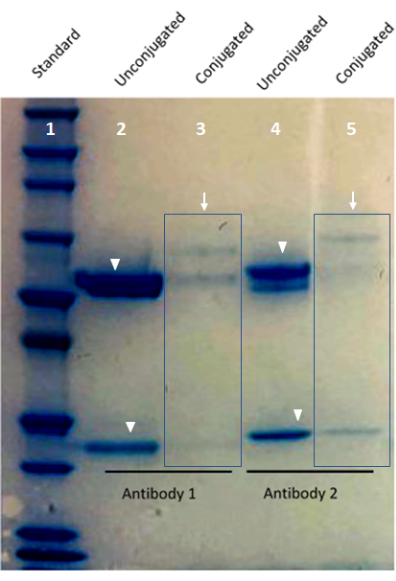
Рисунок 1: Изображение валидации специально конъюгированных антител с использованием белкового геля Bis-Tris. Полоса 1 геля показывает стандарт белка. Полоса 2 и полоса 4 показывают конъюгированные со штрих-кодом антитела (стрелки). Полоса 3 и полоса 5 показывают полосы тяжелой и легкой цепи из неконъюгированного антитела (наконечники стрелок). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
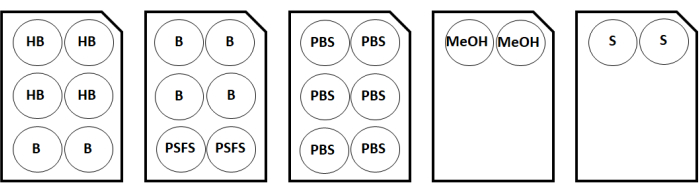
Рисунок 2: Карта конфигурации окрашивающей пластины для двух образцов покровного стекла. Сокращения: HB = гидратационный буфер; B = разбавитель/блок антител; PSFS = фиксирующий раствор после окрашивания; PBS = фосфатно-буферный физиологический раствор; MeOH = метанол; S = решение для хранения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Конфигурация репортерной пластины. Каждое конъюгированное антитело имеет штрих-код, который дополняет конкретного репортера. Чтобы установить репортерную пластину, необходимо перечислить каждое конъюгированное антитело и соответствующий ему репортер. Далее каждому антителу присваивается номер цикла. Производительность двух холостых циклов (C1 и C18) используется для оценки уровня автофлуоресценции в трех каналах флуоресценции и для вычитания фона после визуализации с использованием программного обеспечения для управления получением изображений. На этом этапе мастер программного обеспечения проверит прибор, чтобы убедиться, что все настройки верны (рисунок 4). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
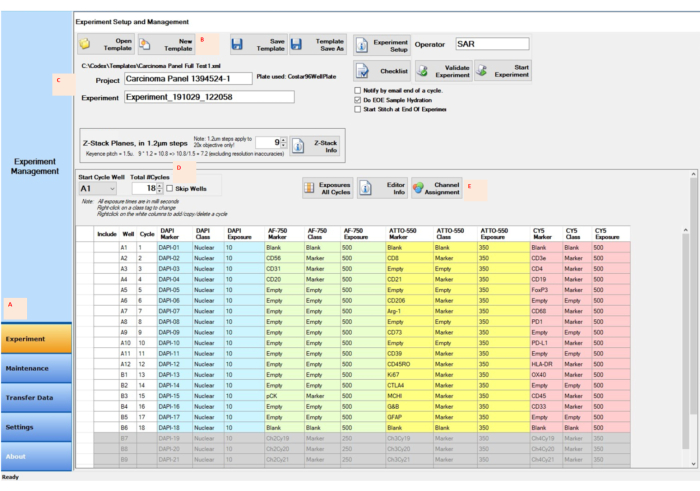
Рисунок 4: Получение изображения с помощью управляющего программного обеспечения для установки эксперимента. (A) Выберите вкладку «Эксперимент» в левом нижнем углу управляющего программного обеспечения, чтобы подготовить и начать настройку. (В,В) Выберите Создать шаблон, чтобы ввести экспериментальные параметры с новым проектом и именем эксперимента. D) Изменить колодец начального цикла и число циклов, с тем чтобы отразить местоположение репортера на репортерной табличке с 96 лунками. (E) Назначьте соответствующие флуоресцентные каналы четырем каналам, предназначенным для экспериментального запуска. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Визуализация изображения с помощью веб-программного обеспечения (QuPath). В окне просмотра отображаются 26 маркеров в разрезе окрашенной ткани миндалин FFPE. В окне «Яркость и контрастность » отображаются маркеры с галочками. Наконец, в окне просмотра отображается образец FFPE с выбранными маркерами. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
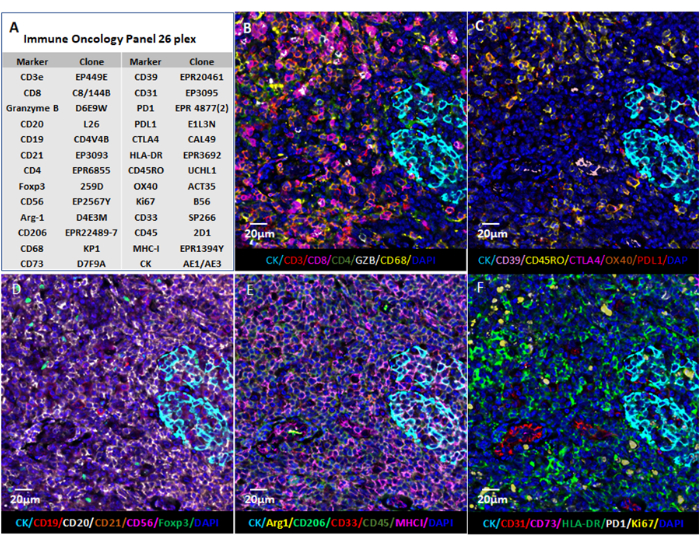
Рисунок 6: Визуализация изображения с помощью веб-программного обеспечения. (A) Срезы тканей миндалин были окрашены для 26 маркеров, а изображения срезов в формате QPTIFF были визуализированы с использованием коммерческого программного обеспечения для просмотра цифровых слайдов или программного обеспечения с открытым исходным кодом (QuPath) для аннотации и обзора. (Б-Ж) Шесть маркеров были отображены в одной аннотации для лучшего просмотра сигналов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
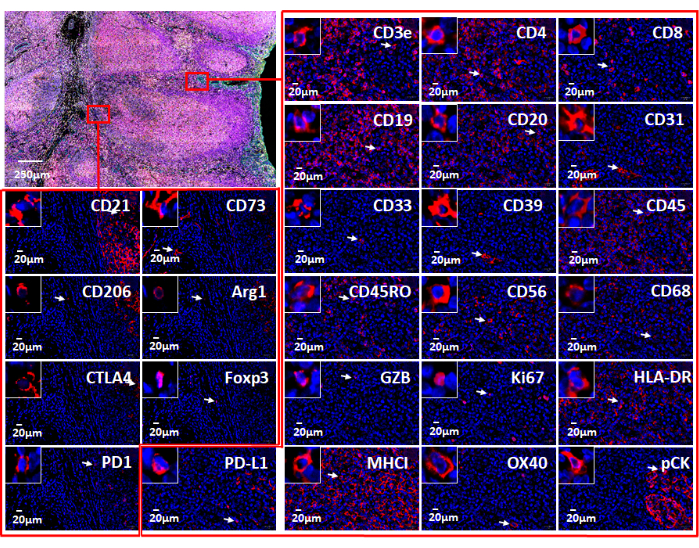
Рисунок 7: Виды 26 отдельных маркеров, используемых с веб-программным обеспечением. Экспрессия маркеров в ткани миндалин показана с помощью иммунофлуоресцентного окрашивания с помощью панели иммунной онкологии (вверху слева). Показаны отдельные маркеры в двух небольших областях (красные прямоугольники). Увеличенная вставка показывает ячейки, положительные для этих маркеров (белые стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
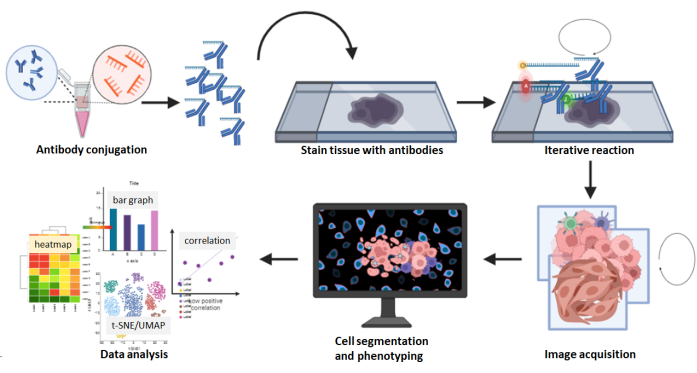
Рисунок 8: Краткое описание рабочего процесса получения мультиплексированного изображения. Срезы тканей FFPE окрашивали с помощью панели из 26 антител с последующей многоцикловой реакцией. Необработанные изображения окрашенных срезов были обработаны вычислительно, а плотность ячеек и пространственный анализ были выполнены с использованием составных изображений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Валидация ИГХ в ткани миндалин. Срезы тканей FFPE окрашивали с помощью индивидуального антитела. Экспрессия маркера в ткани миндалин показана при малом увеличении, а увеличенная вставка показывает клетки, положительные для маркера (красные прямоугольники). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
TME играет важную роль в развитии, прогрессировании и лечении рака. Кроме того, плотность специфических субмножеств лимфоцитов, инфильтрирующих опухоль, в TME может служить прогностическим биомаркером для определенных типов рака. Примечательно, что в дополнение к клеточному составу TME пространственные характеристики опухоли могут дать представление о биологии опухоли и выявлении потенциальных прогностических биомаркеров12,17.
Поскольку многочисленные популяции иммунных клеток участвуют в прораковых или противоопухолевых реакциях, лучшее понимание этих клеток и их пространственных отношений друг с другом и с раковыми клетками поможет определить новые иммунотерапевтические стратегии. Предыдущие исследования стратифицировали расположение и пространственное распределение клеток TME на основе структуры ткани во внутриопухолевой и перитуморальной областях и инвазивных границ опухолевых клеток18,19. За последние 15 лет технический прогресс сделал фенотипический анализ отдельных клеток, основанный на их пространственном рассеивании, новым, влиятельным инструментом для изучения TME и категоризации потенциальных биомаркеров для иммунотерапии опухолей. Мультиплексная гистохимия ПЧ может одновременно оценить несколько биологических маркеров20.
Подобно стратегии олигонуклеотидно-конъюгированных антител, для изучения TME используются четыре типа мультиплексных платформ на основе белков: системы обнаружения хромогенов, флуоресценции, штрих-кода ДНК и меток изотопов металлов. Экономичные хромогенные платформы ИГХ позволяют визуализировать весь слайд и оценивать патологоанатомию с помощью обычной светлопольной микроскопии. В мультиплексных ИФ и ИГХ используют антитела, конъюгированные с флуорофорами. Мультиплексная платформа IF/IHC обнаруживает антитела с высокой специфичностью и может количественно определять целевые антитела даже на субклеточном уровне 6,21. Кроме того, из-за природы хромогенов и флуорофоров использование одной панели антител может фиксировать экспрессию до 10 биомаркеров на одном предметном стекле. На платформах на основе изотопов металлов антитела, меченные металлами, используются для выполнения мультиплексной визуализации с одноклеточным и пространственным разрешением и высокой чувствительностью для отдельных срезов тканей22. Теоретически эти подходы к конъюгированным с металлом антителам позволяют одновременно обнаруживать более 100 биомаркеров на одном участке ткани. Одной из проблем метода изотопной маркировки является изобарическая интерференция, которая препятствует достижению 100% чистоты обогащения23. Более того, интерференция увеличивается по мере увеличения количества маркеров. Платформы обнаружения антител, конъюгированных с ДНК, распознают антитела, помеченные уникальными штрих-кодами ДНК. На этих платформах может быть одновременно захвачено более 40 биомаркеров с высокой специфичностью6.
Мультиплексная визуализация представляет собой коммерчески доступную платформу обнаружения антител, меченную штрих-кодом ДНК, для нанесения ДНК-конъюгированных антител на одно предметное стекло ткани за один этап (рис. 8). Для стадии подготовки ткани, в отличие от мультиплексной платформы визуализации ионного пучка, которая требует использования предметных стекол с золотым покрытием, полученных от производителей, для мультиплексной платформы визуализации требуются только обычные покровные стекла или предметные стекла, покрытые 0,1% поли-L-лизином, чтобы помочь ткани прилипнуть к ней и сохранить ткань неповрежденной во время процесса окрашивания и визуализации. Рекомендуется использовать срезы тканей на покровных стеклах в течение 4 недель после секции, так как длительное хранение неокрашенных предметных стекол приводит к снижению антигенности. Окрашенный образец покровного стекла можно хранить в буфере для хранения при температуре 4 °C до 2 недель без потери сигнала окрашивания. Для хранения образцов покровного стекла не требуется специального оборудования. Мультиплексная система визуализации была модернизирована для использования обычных предметных стекол вместо покровных стекол, что позволяет окрашивать более крупные ткани и легко с ними обращаться. При использовании восстановительного раствора для конъюгации антител (этап 3.2.3) реакцию следует ограничить не более чем 30 мин, чтобы предотвратить повреждение антител. Блокирующие буферы на шаге 5.6.6 должны быть заново подготовлены, и блокирующие буферы не должны использоваться повторно.
По сравнению с платформами мультиплексного обнаружения антител, меченных хромогенами, флуоресценцией и изотопами металлов, технология мультиплексной визуализации имеет определенные преимущества. Например, коммерчески доступно более 60 предварительно разработанных панелей антител для мультиплексной визуализации, что помогает сэкономить время и затраты на конъюгацию и валидацию антител, а количество предварительно разработанных панелей антител растет. Эти антитела, которые включают маркер карциномы пан-цитокератин, маркер меланомы SOX10, сосудистый маркер CD31, стромальный маркер SMA и многочисленные маркеры иммунных клеток, проверены и готовы к экспериментам. Для антител, которые не были предварительно разработаны, коммерчески доступный набор для конъюгации, предназначенный для использования с мультиплексной визуализацией, прост и удобен для пользователя. Конъюгированные с клиентом антитела годны в течение 1 года при хранении при температуре 4 °C. Кроме того, для получения изображений не требуется прогрев машины. В этой технологии мультиплексной визуализации итеративные этапы промывки, гибридизации и зачистки при получении изображения редко приводят к снижению интенсивности маркеров или ухудшению морфологии тканей 5,24,25. Кроме того, составные изображения захватываются в формате QPTIFF с помощью простого трехцветного флуоресцентного микроскопа и могут быть загружены и проанализированы с помощью стороннего программного обеспечения для цифрового анализа. Окрашивающие маркеры могут быть визуализированы с разрешением одной клетки, а клеточные фенотипы могут быть охарактеризованы путем совместной локализации маркеров (рис. 6 и рис. 7). Всесторонний анализ мультиплексированного изображения дополнительно выявляет тканевые компартменты, количественную оценку одноклеточных маркеров, а также данные о ближайших соседях и близости (рис. 8).
Проблемой в мультиплексном анализе изображений является идентификация типа клеток. Обычно, когда к изображению применяется больше однообъектных классификаторов, аннотируются более редкие фенотипы. Поэтому рекомендуется использовать известные маркеры, которые не экспрессируются в одном и том же классификаторе, и применять только классификатор, связанный с фенотипом, к аннотации отдельных клеток. Вариации аннотации клеточного типа приведут к существенно различным пространственным результатам, таким как различия в пространственном распределении клеток и анализе клеточного соседства26,27.
Мультиплексный анализ изображений оказался успешным при окрашивании и визуализации многих типов образцов, включая ткани FFPE, свежезамороженные ткани, архивные цельные слайды и тканевые микрочипы. Мультиплексные изображения срезов молочной железы, мозга, легких, селезенки, почек, лимфатических узлов и тканей кожи могут быть получены с помощью данных глубокого пространственного фенотипирования отдельных клеток 5,16,25,28.
В будущем ожидается появление большего количества предварительно разработанных антител для мультиплексной визуализации. Кроме того, крайне необходима разработка специального программного обеспечения для мультиплексного анализа изображений. В настоящее время существует множество коммерчески доступных программ с открытым исходным кодом для анализа изображений Hi-Plex29, но ученым по-прежнему нужна помощь в создании стандартного рабочего процесса для этих анализов30,31. Хотя составные изображения, снятые с помощью этого протокола, совместимы со сторонним программным обеспечением, это может привести к дополнительным затратам для пользователя. Еще одним недостатком технологии мультиплексной визуализации является снижение сигнала при обнаружении ядерного белка после итеративной промывки, гибридизации и стриппинга большими панелями антител. К счастью, это можно свести к минимуму, извлекая флуорофоры со штрих-кодом в ранних циклах при проектировании репортерных пластин. Недавно эта платформа была модернизирована новой высокоскоростной системой сканирования, которая значительно сократила время получениясоставных изображений 32. Кроме того, сообщалось, что новая стратегия с использованием штрих-кодов, конъюгированных с тирамидом, улучшает визуализацию на основе штрих-кодирования олигонуклеотид-конъюгированных антител. Эта технология направлена на усиление окрашивающих сигналов, для которых трудно получить антитела, конъюгированные со штрих-кодом33.
Раскрытие информации
У авторов нет конфликтов для раскрытия.
Благодарности
Авторы благодарят Дональда Р. Норвуда из Службы редактирования, Исследовательской медицинской библиотеки в MD Anderson за редактирование этой статьи и лаборатории мультиплексной IF и анализа изображений в отделении трансляционной молекулярной патологии в MD Anderson. Этот проект был частично поддержан лабораторией трансляционной молекулярной патологии и иммунопрофилирования (TMP-IL) Moonshots Platform на кафедре трансляционной молекулярной патологии, Онкологическим центром им. М. Д. Андерсона Техасского университета и Соглашением о сотрудничестве NCI U24CA224285 (Онкологическому центру им. М. Д. Андерсона CIMAC).
Материалы
| Name | Company | Catalog Number | Comments |
| 10x AR9 Buffer | Akoya Biosciences | AR900250ML | |
| 10x Buffer | Akoya Biosciences | 7000001 | |
| 16% paraformaldehyde | Thermo Fisher Scientific | 28906 | |
| 1X Antibody Diluent/Block | Akoya Biosciences | ARD1001EA | |
| Antibody Conjugation Kit | Akoya Biosciences | 7000009 | Contains Filter Blocking Solution, Antibody Reduction Solution 1, Antibody Reduction Solution 2, Conjugation Solution, Purification Solution, Antibody Storage Solution |
| Assay Reagent | Akoya Biosciences | 7000002 | |
| Diethyl pyrocarbonate | Sigma-Aldrich | 40718-25ML | |
| Dimethyl sulfoxide | Avantor/VWR | BDH1115-4LP | |
| Ethanol, 200 proof | |||
| G Blocker V2 | Akoya Biosciences | 240199 | |
| Histoclear | Thermo Fisher Scientific | 50-329-50 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| Milli-Q Integral 10 | Millipore | ZRXQ010WW | |
| Niknon Fluorescence microscope | Keyence Corp. of America | BZ-X810 | |
| Nuclear Stain | Akoya Biosciences | 7000003 | |
| Nuclease-free water | Thermo Fisher Scientific | AM9938 | |
| NuPAGE | Thermo Fisher Scientific | NP0008 | |
| PBS | Thermo Fisher Scientific | 14190136 | |
| PhenoCycler Barcodes/Reporters Combination | Akoya Biosciences | 5450004 (BX025/RX025) | |
| 5450003 (BX022/RX022) | |||
| 5450023 (BX002/RX002) | |||
| 5250002 (BX020/RX020) | |||
| 2520003 (BX023/RX023) | |||
| 5250005 (BX029/RX029) | |||
| 5250007 (BX035/RX035) | |||
| 5250012 (BX052/RX052) | |||
| 5550012 (BX030/RX030) | |||
| 5550015 (BX042/RX042) | |||
| 5550014 (BX036/RX036) | |||
| QuPath | Open-Source | https://qupath.github.io/ | |
| SimplyBlue SafeStain | Thermo Fisher Scientific | LC6065 | |
| Staining Kit | (Akoya Biosciences | 7000008 | Contains Hydration Buffer, N Blocker, J Blocker, S Blocker, Fixative Reagent, Storage Buffer |
Ссылки
- Hanahan, D., Coussens, L. M. Accessories to the crime: Functions of cells recruited to the tumor microenvironment. Cancer Cell. 21 (3), 309-322 (2012).
- Labani-Motlagh, A., Ashja-Mahdavi, M., Loskog, A. The tumor microenvironment: A milieu hindering and obstructing antitumor immune responses. Frontiers in Immunology. 11, 940 (2020).
- Jin, M. Z., Jin, W. L. The updated landscape of tumor microenvironment and drug repurposing. Signal Transduction and Targeted Therapy. 5 (1), 166 (2020).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nature Reviews Immunology. 20 (11), 651-668 (2020).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Communications. 40 (4), 135-153 (2020).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455-33465 (2020).
- Allam, M., Cai, S., Coskun, A. F. Multiplex bioimaging of single-cell spatial profiles for precision cancer diagnostics and therapeutics. NPJ Precision Oncology. 4, 11 (2020).
- Eng, J., et al. A framework for multiplex imaging optimization and reproducible analysis. Communications Biology. 5 (1), 438 (2022).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. Journal for Immunotherapy of Cancer. 9 (7), e002197 (2021).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Heindl, A., Nawaz, S., Yuan, Y. Mapping spatial heterogeneity in the tumor microenvironment: A new era for digital pathology. Laboratory Investigation. 95 (4), 377-384 (2015).
- Kuswanto, W., Nolan, G., Lu, G. Highly multiplexed spatial profiling with CODEX: bioinformatic analysis and application in human disease. Seminars in Immunopathology. 45 (1), 145-157 (2022).
- Phillips, D., et al. Immune cell topography predicts response to PD-1 blockade in cutaneous T cell lymphoma. Nature Communications. 12 (1), 6726 (2021).
- Jhaveri, N., et al. Deep ultrahigh-plex spatial phenotyping of human cancer tissues. Cancer Research. 82, 3877 (2022).
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Yuan, Y. Spatial heterogeneity in the tumor microenvironment. Cold Spring Harbor Perspectives in Medicine. 6 (8), a026583 (2016).
- Bruck, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Modern Pathology. 34 (12), 2229-2241 (2021).
- Tsujikawa, T., et al. Prognostic significance of spatial immune profiles in human solid cancers. Cancer Science. 111 (10), 3426-3434 (2020).
- Hoyt, C. C. Multiplex immunofluorescence and multispectral imaging: forming the basis of a clinical test platform for immuno-oncology. Frontiers in Molecular Biosciences. 8, 674747 (2021).
- Parra, E. R., et al. Identification of distinct immune landscapes using an automated nine-color multiplex immunofluorescence staining panel and image analysis in paraffin tumor tissues. Scientific Reports. 11 (1), 4530 (2021).
- Elaldi, R., et al. High dimensional imaging mass cytometry panel to visualize the tumor immune microenvironment contexture. Frontiers in Immunology. 12, 666233 (2021).
- Campos Clemente, L., Shi, O., Rojas, F., Parra, E. R. Expanding the comprehension of the tumor microenvironment using mass spectrometry imaging of formalin-fixed and paraffin-embedded tissue samples. Journal of Visualized Experiments. (184), e64015 (2022).
- Schurch, C. M., et al. Coordinated cellular neighborhoods orchestrate antitumoral immunity at the colorectal cancer invasive front. Cell. 182 (5), 1341-1359 (2020).
- Phillips, D., et al. Highly multiplexed phenotyping of immunoregulatory proteins in the tumor microenvironment by CODEX tissue imaging. Frontiers in Immunology. 12, 687673 (2021).
- Hickey, J. W., Tan, Y., Nolan, G. P., Goltsev, Y. Strategies for accurate cell type identification in CODEX multiplexed imaging data. Frontiers in Immunology. 12, 727626 (2021).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- Tzoras, E., et al. Dissecting tumor-immune microenvironment in breast cancer at a spatial and multiplex resolution. Cancers. 14 (8), 1999 (2022).
- Francisco-Cruz, A., Parra, E. R., Tetzlaff, M. T. Wistuba, II. Multiplex immunofluorescence assays. Methods in Molecular Biology. 2055, 467-495 (2020).
- Shakya, R., Nguyen, T. H., Waterhouse, N., Khanna, R. Immune contexture analysis in immuno-oncology: applications and challenges of multiplex fluorescent immunohistochemistry. Clinical and Translational Immunology. 9 (10), e1183 (2020).
- Wilson, C. M., et al. Challenges and opportunities in the statistical analysis of multiplex immunofluorescence data. Cancers. 13 (12), 3031 (2021).
- DeRosa, J. Setting a new standard for spatial omics: An integrated multiomics approach: every single cell, two different analytes, one unbiased picture. Genetic Engineering & Biotechnology News. 42, 26-28 (2022).
- Simonson, P. D., Valencia, I., Patel, S. S. Tyramide-conjugated DNA barcodes enable signal amplification for multiparametric CODEX imaging. Communications Biology. 5 (1), 627 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены