Method Article
パラフィン組織サンプルの単一細胞分析における免疫プロファイリングと空間マッピングの特性評価のための多重バーコード画像解析(英語)
要約
多重バーコード画像解析により、最近、腫瘍微小環境の特性評価が改善され、細胞組成、機能状態、および細胞間相互作用の包括的な研究が可能になりました。本明細書では、高次元画像解析技術の使用を可能にする、オリゴヌクレオチド結合抗体およびサイクルイメージングのバーコードを用いた染色およびイメージングプロトコルについて説明する。
要約
同一組織切片内の複数のエピトープを順次検出するオリゴヌクレオチドを用いた抗体バーコーディングを用いたマルチプレックスイメージング技術は、腫瘍微小環境の理解を向上させる腫瘍評価に有効な方法論です。ホルマリン固定パラフィン包埋組織におけるタンパク質発現の可視化は、特定の蛍光色素を相補的なオリゴヌクレオチド を介して 抗体結合バーコードにアニーリングし、サンプルイメージングを行うことで実現されます。実際、この方法では、1回の組織染色反応で40を超える抗体のカスタマイズ可能なパネルを使用できます。この方法は、新鮮な凍結組織、ホルマリン固定、パラフィン包埋組織、培養細胞、および末梢血単核細胞と互換性があるため、研究者はこの技術を使用して、さまざまなサンプルタイプを単一細胞の解像度で表示できます。この方法は、手動の染色および固定プロトコルから始まり、すべての抗体バーコードは抗体カクテルを使用して適用されます。染色流路計測器は完全に自動化されており、標準的な蛍光顕微鏡を使用してすべてのバイオマーカーがイメージングされるまで、スペクトル的に異なる蛍光色素の標識、イメージング、除去の反復サイクルを実行します。次に、画像を収集し、すべてのイメージングサイクルにわたってコンパイルして、すべてのマーカーの単一セル解像度を実現します。シングルステップ染色と穏やかな蛍光色素除去により、高度にマルチプレックス化されたバイオマーカー分析が可能になるだけでなく、必要に応じて追加の下流分析(ヘマトキシリンやエオジン染色など)のためにサンプルを保存することもできます。さらに、画像解析ソフトウェアは、画像処理(ドリフト補正、バックグラウンド減算、細胞セグメンテーション、クラスタリング)を可能にし、空間ネットワークマップを生成するための画像と細胞表現型の視覚化と分析を可能にします。要約すると、この技術は、コンピューター化されたマイクロ流体システムと蛍光顕微鏡を使用して、組織結合したオリゴヌクレオチド結合抗体に相補的な蛍光標識DNAプローブを反復的にハイブリダイズ、画像化、およびストリップします。
概要
腫瘍微小環境(TME)は極めて不均一であり、腫瘍細胞、腫瘍間質細胞、免疫細胞、細胞外マトリックスの非細胞成分、および腫瘍細胞、間質細胞、免疫細胞によって産生および放出される多数の豊富な分子で構成されています1,2。証拠の蓄積は、TMEが腫瘍の分化、成長、浸潤、転移、および治療への反応を再プログラミングする上で極めて重要な役割を果たすことを示しています3。
TMEの異なる細胞タイプがシグナル伝達ネットワークを介してどのように相互作用し、互いに通信するかを理解することは、がん診断の改善、免疫療法の最適化、および新しい治療法の開発に不可欠です4。免疫組織化学(IHC)や免疫蛍光(IF)などの従来の組織顕微鏡技術は、腫瘍サンプル中の細胞の種類、存在量、およびコミュニケーションを研究するために何十年も使用されてきました。残念なことに、これらの技術は通常、組織切片における1つまたは2つのタンパク質マーカーのみを評価することができ、これらの細胞間の複雑な空間的および構造的関係を明らかにすることはできない5、8、7。
過去20年間で、いくつかの多重化イメージング技術が確立されてきました8。これらの技術は、TME内の免疫細胞の組成、機能、および位置のビューを大幅に改善し、単一細胞レベルで複雑なTMEを識別し、空間的にプロファイリングする能力の急速な進歩につながります9,10。TMEにおけるさまざまな腫瘍細胞と免疫細胞の空間的および構造的関係は、現在、これらの多重イメージング技術を使用した生物学的および臨床的研究の最前線にあります11,12。
最近開発されたオリゴヌクレオチド結合抗体バーコーディングを用いたマルチプレックスイメージング技術は、ホルマリン固定パラフィン包埋(FFPE)サンプル中のオリゴヌクレオチド結合抗体の検出に基づく影響力のある単一細胞生物学的研究プラットフォームです13,14。現在、この多重化された画像化技術は、単一の組織切片15における100を超えるマーカーの同時画像化を可能にし、これにより、その場で区別可能な細胞型の数が増加している。これにより、従来のイムノフェノタイピングアプローチでは不可能なレベルの腫瘍および免疫細胞の空間分析が可能になります16。
ここでは、精製された抗体をオリゴヌクレオチドに結合させ、マルチプレックスイメージングプラットフォームとFFPE組織を用いたマルチサイクルイメージング手順を使用してこの結合を検証するための最適化されたプロトコルについて説明します。さらに、この技術で使用される基本的な画像処理とデータ解析の手順について説明します。
プロトコル
この後ろ向き研究は、テキサス大学MDアンダーソンがんセンターの治験審査委員会によって承認されました。FFPE組織サンプルは、日常的な標準治療の一環としてMDアンダーソンの患者から収集されました。診断的または治療的介入は行われなかった。研究および出版のために収集されたサンプルを使用することについて、患者からインフォームドコンセントが得られました。
1. 抗体パネル設計に使用する抗体源
- マルチプレックスイメージング用の抗体パネルは、目的の組織やタンパク質の品質を慎重に検討した上で作成します。抗体パネルの設計では、1)完全に商業的に検証された抗体、2)マルチプレックスイメージング技術でスクリーニングされた抗体、および3)エンドユーザー共有抗体の3つの抗体源が考慮されます。
注:マルチプレックスイメージング技術でスクリーニングされた抗体は機能することが示されており、ベンダーから入手できます。これらのスクリーニングされた抗体は、ユーザによるオリゴヌクレオチド結合後のマルチプレックス画像染色に適用することができる。 - 目的のタンパク質が上記のソースに見つからない場合は、IHCで機能することがわかっている抗体クローンを使用してください。さらに、このマルチプレックスイメージング技術では、IgGクローンよりもIgMの方が故障率が高いため、IgMクローンではなくIgGアイソタイプが推奨されます。
2. 抗体結合前
- マルチプレックスイメージングバーコードを使用して結合用の抗体クローンを同定する場合は、リン酸緩衝生理食塩水(PBS)または同様のバッファーでキャリアフリー抗体を購入することを検討してください。BSA、グルテン、グリセロール、およびその他のタンパク質添加物を含むキャリアタンパク質は、結合能力を低下させることが知られています。
- 最適な抗体クローンを選択し、結合前に常に染色条件(抗原賦活化と滴定)を最適化します。これを行うには、標準IFまたはIHCを使用して、この抗体の陽性組織と陰性組織に非結合抗体クローンを適用します。
注:精製された抗体が市販されていない場合は、結合前に抗体精製プロセスを実行する必要があります。抗体精製キットと共に使用される精製手順は、本明細書では論じない。
3. 抗体結合
- 抗体結合試薬を入手します。市販のコンジュゲーションキットには、フィルターブロッキング溶液、還元溶液2、コンジュゲーション溶液、精製溶液、抗体保存溶液(いずれも4°Cで保存)、還元溶液1(-20°Cで保存)が含まれています。
- 活用
注:精製された抗体は還元剤で処理され、抗体の還元部分がこの技術で使用されるマルチプレックスイメージングバーコードと反応し、共有結合を形成できるようにします。このプロセスには約4.5時間かかり、約120 μLの標識抗体が得られ、1年間生存可能です。すべてのスピンダウンは室温(RT)で行われ、回収チューブに結合抗体が入っている最後のステップ(3.2.9)を除いて、フロースルーは廃棄されます。- 50 kDaの分子量カットオフフィルターカラムにピペットを使用して500 μLのフィルターブロッキング溶液を吸引して塗布し、12,000 x g で2分間スピンダウンして非特異的抗体結合をブロックします。
注:カラム上部の残留溶液が目立つ場合は、回収チューブ内のフィルターを反転させ、3,000 x g で2分間スピンダウンします。 - 100 μL容量の溶液に50 μgの抗体をフィルターカラムにピペットで入れ、12,000 x g で8分間スピンダウンします。
注:分光光度計を使用して精製抗体の濃度を測定し、抗体の50 μgに相当する溶液の量を計算します。抗体溶液の容量が100 μL未満の場合は、PBSを1倍添加して容量を100 μLに調整します。結合確認のために1 μgの非結合抗体を保持します(ステップ4.4)。 - 260 μLの還元マスターミックス(20 μLの還元溶液1と825 μLの還元溶液2を混合したもので、3つの抗体結合反応に十分)を各フィルターカラムにピペットで移します。マスターミックスを2〜3秒間静かにボルテックスするか、上下にピペットで溶液と抗体を混合します。RTで30分間インキュベートします。
- インキュベーション後、フィルターカラムを12,000 x g で8分間スピンダウンします。450 μLのコンジュゲーション溶液をフィルターカラムに加え、12,000 x g で8分間スピンダウンします。
- 目的のバーコードをヌクレアーゼフリー水10 μLとコンジュゲーション溶液210 μLに再懸濁します。
注:染色に使用する直前に抗体タグを準備してください。抗体バーコードアリコートを再利用しないでください。 - ステップ3.2.4のスピンダウンが完了したら、再懸濁した抗体タグ(約220 μL)を対応する各フィルターカラムに追加します。混合物を穏やかに上下にピペットで移動して、試薬を混合します。フィルターカラムの蓋を閉じ、結合反応をRTで2時間インキュベートします。2時間後、フィルターカラムを12,000 x g で8分間スピンダウンします。
注:確認プロトコルでは、5 μLのコンジュゲート溶液をポリメラーゼ連鎖反応チューブに入れて4°Cで保存することをお勧めします(以下を参照)。 - 450 μLの精製溶液を各フィルターカラムにピペットで入れ、12,000 x g で8分間スピンダウンします。3回繰り返します。
- 100 μLの保存溶液をフィルターカラムにピペットで入れます。混合物を静かに上下に10回以上ピペットで移動し、カラム内のフィルターの側面を注意深く洗浄します。
注:50 μgの抗体を100 μLの保存溶液に溶解します。50 μgを超える抗体で結合反応を開始する場合は、この比率で保存液を追加します。 - 新しい収集チューブでフィルターカラムを反転させます。RTで3,000 x g で2分間スピンダウンします。 収集した溶液を保管してください。結合した抗体溶液を滅菌スクリュートップチューブにピペットで入れ、4°Cで最大1年間保存します。
注:標識抗体は、2日後にマルチプレックスイメージング技術でテストする必要があります。これに先立ってテストすると、バックグラウンドの高い核染色が発生する可能性があります。
- 50 kDaの分子量カットオフフィルターカラムにピペットを使用して500 μLのフィルターブロッキング溶液を吸引して塗布し、12,000 x g で2分間スピンダウンして非特異的抗体結合をブロックします。
4. 活用の確認
注:マルチプレックスイメージング技術を使用してユーザー結合抗体で染色実験を行う前に、5 μLの結合抗体(ステップ3.2.6を参照)と1 μgの非結合抗体(通常は2 μLの混合物中)を対照としてゲル電気泳動を使用して結合を確認する必要があります。抗体結合の成功は、抗体の分子量の増加によって実証されます。ただし、この確認プロトコルは、結合のための化学反応の成功を評価するのみであり、マルチプレックスイメージングに使用される抗体の検証には対応していません。
- ヌクレアーゼフリー水8 μLおよび11 μLをそれぞれ予約済みコンジュゲート抗体およびコントロール非コンジュゲート抗体にピペットで入れ、最終容量13 μLを得た。
- 5 μLのLDS(または他のドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動システム)サンプルバッファーと2 μLのサンプル還元剤を予約済み結合抗体の各サンプルにピペットで入れ、95°Cのドライバスで10分間サンプルを変性させます。
- サンプルが変性している間に、40 mLのMOPS SDSランニングバッファーを760 mLの超純水で希釈し、電気泳動システムのタンクにゲルを入れ、希釈したランニングバッファーをゲルに注ぎます。
- 10分間の変性期間が完了したら、ゲルの1つのウェルに事前に染色されたタンパク質標準をロードし、1つに非結合抗体(ステップ3.2.2から)、残りのウェルに結合抗体サンプルをロードします。次に、タンパク質標準がゲルの最後に現れるまで、ゲルを150 Vで流します。
注意: ゲルは電子レンジで安全な容器に簡単に付着するため、破れる可能性があるため、次の手順ではゲルの取り扱いに注意する必要があります。 - 実行が完了したら、ゲルを超純水で事前に満たされた電子レンジ対応の容器に移し、水中の最初の泡が視覚化されるまで電子レンジで加熱します。
注意: 気泡が発生する時間は、使用する電子レンジによって大きく異なります。 - 容器から水を抜き、約250 mLのクマシーG-250ステインをゲルの上に注ぎ、最初の泡が視覚化されるまでマイクロ波でゲルを加熱します。その後、ゲルとクマシーG-250ステインの入った容器を電子レンジから取り出し、シェーカーに10分間置きます。
- 振とう後、汚れを丁寧に排出し、約200mLの超純水に交換し、容器を振とう機に乗せてゲルを洗浄します。
- 超純水を排出し、新しい超純水と5回交換するか、水浴中に汚れの残りが見えなくなるまで交換します。ゲルを撮影する前に、必要に応じてバンドが見えるまでゲルをシェーカーで一晩洗ったままにします(図1)。
注:マルチプレックスイメージングで使用される抗体は、色素結合抗体の染色パターンと同等の染色パターンを持つ必要があります。標識抗体陽性の既知の抗原を有する組織切片は、オリゴヌクレオチド標識抗体および色素標識抗体で染色することができる。この研究では、いずれの場合も、両方の抗体タイプの組織形態が同等であり、互いに調和しており、目的のタンパク質と試験組織サンプルの生物学に基づいて予想される細胞分布も一致していました。この結果は、FFPE組織を用いた組織染色ベースのアプローチにオリゴヌクレオチド結合抗体部分を使用することの有効性を示しています。
5. オリゴヌクレオチド結合抗体染色
- 組織を配置するためのカバーガラスを準備します。
- カバーガラスを0.1%ポリ-L-リジン溶液にRTで24時間浸し、組織の接着を改善します。
- 浸した後、ポリ-L-リジン溶液を排出し、カバーガラスを超純水で30秒間洗浄します。洗浄を4〜6回繰り返します。洗濯に使用した超純水からカバーガラスを取り出し、糸くずの出ないタオルの上に置いて一晩乾かします。
注:組織学者は、選択した組織を厚さ5μmの切片に切断し、ポリ-L-リジンを充填したカバーガラスの中央に置き、一晩乾燥させる必要があります。乾燥後、組織切片付きのカバーガラスは4°Cで6か月以内に保管する必要があります。このプロトコルの染色パネルには26個のマーカーが含まれていました。このプロトコルで使用された組織は、正常なヒト扁桃腺組織でした。カバーガラスの浸漬時間は1週間を超えてはなりません。ポリ-L-リジンでコーティングされたカバースリップはRTで保管することができ、調製から2ヶ月以内に使用する必要があります。
- 染色の前日に、カバーガラスホルダーを60°Cのオーブンに一晩置きます。
- 翌日、カバーガラスサンプルを60°Cのオーブンで予熱したカバーガラスホルダーに入れます。30分間焼いた後、パラフィンが組織から溶けたことを確認します。
- カバーガラスホルダー/サンプルを次の溶液シリーズにすばやく配置します:それぞれ6分間の2ラウンドの脱ろう剤。100%エタノールをそれぞれ5分間2回。90%エタノールを1回5分間。70%エタノールを1回5分間。50%エタノールを1ラウンド5分間。30%エタノールを1回5分間。ピロ炭酸ジエチル(DEPC)処理した超純水を2回ずつ5分間ずつ入れた。
注:エタノールの希釈液はすべて、DEPC処理された超純水で調製されます。キシレンを脱ろうに使用する場合は、フードに使用する必要があります。 - カバーガラスホルダー/サンプルを溶液シリーズにかけるときに、次の操作を行います。
- 底に水に浸したペーパータオルを入れた空のピペットチップボックスを置いて、湿度チャンバーを準備します。
- 圧力鍋に50mLビーカーの半分を覆うのに十分な水を入れます。
- サンプルあたり5 mLのメタノールを4°Cのビーカーに入れます。
- AR9バッファーをDEPC処理した超純水で1倍に希釈します。カバーガラスホルダーあたり約50 mLの希釈バッファーが必要です。
- 溶液シリーズが完了したら、50 mLのガラスビーカーに約40 mLの1x AR9バッファーを充填し、カバーガラスホルダー/サンプルをビーカーに浸し、ビーカー/カバースリップホルダーをアルミホイルで完全に覆います。
- アルミホイルで覆われたビーカー/カバースリップホルダーを水で満たされた圧力鍋に入れ、高圧(約15psi)で20分間調理します。
- 調理後、ビーカー/カバースリップホルダーを取り外し、アルミホイルを注意深く開梱し、ビーカー/カバースリップホルダーをRTで約10分間冷まします。
- カバーガラスホルダー/サンプルを1x AR9バッファーから取り出し、2ラウンドのDEPC処理超純水に浸し、両方のラウンドでサンプルをそれぞれ2分間インキュベートします。
- インキュベーション中に、マルチプレックスイメージング染色キットから、水和バッファー、ブロッキングN、ブロッキングG、ブロッキングJ、ブロッキングS溶液、および抗体希釈剤/ブロックを取り出します。2つのカバーガラスサンプルの場合、 図2に示す構成を使用して、溶液の6ウェルプレートにラベルを付けます。
- カバーガラスサンプルを5 mLの水和バッファーを2回に分けて、それぞれ2分間入れます。
- 水和バッファーに2回入れた後、カバーガラスサンプルを5 mLのマルチプレックスイメージング抗体希釈液/ブロックに入れ、RTで20〜30分間インキュベートします(30分を超えないようにしてください)。
- インキュベーション中に、マルチプレックスイメージング抗体希釈液/ブロック、Nブロッカー、Gブロッカー、Jブロッカー、およびSブロッカー溶液の200 μLマスターミックスを作製して抗体カクテルを調製します。
注:マーカーの数と各マーカーの検証済み滴定に基づいて総抗体量を計算し、マスターミックスから総抗体量を差し引きます。例えば、それぞれ1:200の滴定を持つ6つのマーカーの場合、式は200 μLのマスターミックス - 6 μLの抗体カクテル = 194 μLのマスターミックスになります。
- マルチプレックスイメージング抗体希釈液/ブロックでインキュベートした後、カバースリップサンプルをステップ5.5.1で調製した湿度チャンバーに入れ、抗体カクテル190 μLをカバースリップサンプルにピペットで移し、カバースリップサンプルをRTで3時間インキュベートします。
- インキュベーション後、カバーガラスサンプルを5 mLのマルチプレックスイメージング抗体希釈液/ブロックで2回に分けて2分間洗浄します。
- カバーガラス上の組織に結合した抗体を固定するには、湿度チャンバーで手順5.7.3〜5.7.5を実行します。
- カバーガラスを保存液で1.6%に希釈した16%ホルムアルデヒドで10分間インキュベートしてから、カバーガラスを1x PBSで3回洗浄します。
- カバーガラスを4°Cのメタノールで5分間インキュベートした後、カバーガラスを1x PBSで3回洗浄します。
- カバーガラスを1x PBSで希釈した5 mLの固定試薬で20分間インキュベートし、カバーガラスを1x PBSで3回洗浄します。
- 染色したカバーガラスサンプルを4°Cの保存バッファーに最大2週間保存
6. 多重イメージングレポータープレート
注:個々のウェルにバーコード化された蛍光色素を含む96ウェルプレート(レポータープレートと呼ばれる)は、カスタム設計のマルチプレックスイメージング実験に従って調製され、染色された各カバーガラスサンプルと相関します。以下の工程は、レポータープレートの調製のためのものである。
- 4,880 μLのヌクレアーゼフリー水、600 μLの10xマルチプレックスイメージングバッファー、500 μLのアッセイ試薬、および20 μLの核染色液を組み合わせて、レポーターマスターミックスを調製します。これはすべての井戸の20サイクルに十分でしょう。
- カスタム設計のマルチプレックスイメージング実験の各サイクルで、レポーターマスターミックスとそのサイクルの特定のバーコード化蛍光色素を含む245 μLの溶液をウェルに充填します。
注:このプロトコルで使用される癌パネルのレポータープレート構成については、 図3 を参照してください。 - バーコード化された蛍光色素を保護するには、レポータープレートの上にホイルプレートカバーを接着し、プレートをマルチプレックスイメージング装置内に配置します。
- レポータープレートを4°Cのダークボックスに最大2週間保管します。
7.多重化されたイメージングマシンのキャリブレーションと実行
注:高解像度イメージング蛍光顕微鏡は、20倍、100%励起光、低光退色で、マルチプレックスされた各イメージングサイクルで4つの異なる蛍光チャンネルをキャプチャします。
- 顕微鏡ステージにサンプルカバーガラスを置き、700 μLの1:1,500滴定の核染色液を組織に手動でピペッティングすることにより、DAPIチャネルを使用してイメージングの焦点を校正します。
注:カバーガラスは、サンプルの洗浄およびイメージング中に顕微鏡ステージに保持されます。 - マルチプレックスイメージング装置を調製するには、DEPC処理超純水を使用して10倍マルチプレックスイメージングバッファーを1倍に希釈し、希釈した1倍マルチプレックスイメージングバッファー、DEPC処理超純水、ジメチルスルホキシド(DMSO)などの適切な溶液/溶媒を試薬ボトルに充填します。
- 試薬ボトルが適切に充填されたら、実験計画を多重化されたイメージング機器マネージャーソフトウェアに入力します。各サイクルの正しいサイクル、井戸番号、zスタックの場所、マーカー名、クラス、および露光時間を指定します(図4)。すべての顕微鏡パラメータを設定します。をクリックし、画像化するサンプルカバーガラス上の関心領域を選択します。
- 制御ソフトウェアの 実験 ボタンをクリックします(図4A)。 [実験のセットアップと管理 ]ウィンドウで、[ 新しいテンプレート ]ボタンをクリックします(図4B)。
- [ プロジェクト ] ボタンの横のスペースにプロジェクト名を入力します (図 4C)。サイクルの合計数を入力または選択します(図4D)。
- [ チャネル割り当て ]ボタンをクリックし、各サイクルの情報を列に入力し(図4E)、[ テンプレートの保存] ボタンをクリックします。[ 実験の開始] ボタンをクリックして実験を開始します。
注:マルチプレックスイメージング実験中、装置はレポータープレートの1つのウェルからバーコード化された蛍光色素を取り出し(DAPIを含めてウェルあたり最大4つの蛍光色素)、サンプルカバーガラスに直接分注し、各蛍光チャンネルの関心領域を画像化します。そのサイクルのすべてのイメージングに続いて、装置はバーコード化された蛍光色素を洗い流し、次のサイクルのレポーターを分注します(レポータープレート上の次のウェルから)。イメージングは、26個のマーカーを使用したすべてのサイクルが完了するまで続行されます。
8.画像収集
注:多重化画像は、4つの蛍光チャンネル(DAPI、Cy3、Cy5、およびCy7)で構成され、Plan Fluor 20xレンズを装備した任意の適合倒立蛍光顕微鏡を使用して収集できます。カバーガラスサンプルのイメージングと洗浄は、特別に開発された流路系セットアップを使用して自動的に繰り返し実行されます。イメージは、プロセッサ ソフトウェア (v1.8.0.7) を使用して QPTIFF 形式で取得されます。
- プロセッサ ウィンドウで、[ 入力 ] ボタンをクリックし、実験名を選択します。
- [ 処理オプション ]セクションで、[ 背景減算]、[ デコンボリューション]、[ 被写界深度の拡張]、および [シェーディング補正]を選択してオンにします。[ スタート ]ボタンをクリックします。
9. 画像解析
注:取得した画像は、特許取得済みの自動画像解析ソフトウェアまたはオープンソースソフトウェアプログラム(図5)にアップロードして、ダウンストリーム解析を行うことができます。
- コンピューターの QuPath アイコンをクリックし、ソフトウェアを開きます。QPTIFF ファイルを ビューア ウィンドウにドラッグします。
- 明るさとコントラストボタンをクリックすると、明るさとコントラストウィンドウが開きます。[選択済み] 列のマーカーをオンまたはオフにして、マーカー信号を表示または閉じます。
- [ ズームして合わせ る] ボタンをクリックして、対象エリアを拡大または縮小します。
注:多重化された画像データの視覚化により、ユーザーは組織の微小環境を深く見ることができます。FFPEサンプル中の個々のマーカーは、蛍光フォーマット(図6 および 図7)または病理学ビューで視覚化することができます。いくつかの計算プラットフォームを使用して、合成画像を処理し、多重化された組織画像データを分析できます。このソフトウェアを使用すると、空間表現型、希少細胞発見、細胞近傍計算を、多重化イメージング技術 を介して 生成された超高多重組織の全スライド画像で実現できます。癌パネルおよび扁桃腺サンプル中の26抗体については、図 6 を参照してください(補足図1)。
結果
FFPE扁桃腺サンプルを用いて26マーカー免疫腫瘍学パネルを開発し、バーコード画像解析システムを用いてFFPE組織の免疫状態を図示した。全体として、19の抗体が現在、私たちの研究室の他のマルチプレックスイメージング研究で使用されています。すべてのマーカーは、発色性IHCを有するFFPE組織を用いて試験されている。全ての抗体を固有のDNAオリゴヌクレオチドに結合させた。このバーコード画像解析技術にウェブベースの機器マネージャ(図4)を使用してカバーガラスを設定する場合、最初と最後のサイクルは常に「空白」(図2および図4)であり、抗体からの特定のシグナルから差し引かれるバックグラウンド蛍光シグナルを提供することに注意してください。QPTIFF形式の画像を蛍光顕微鏡で収集した後、特許取得済みの自動画像解析ソフトウェアまたはオープンソースソフトウェアプログラムを使用して視覚化できます。コンポジット画像では、すべてのマーカーまたは選択したマーカーを表示して、信号を見やすくすることができます(図5)。さらに、各抗体は、核、細胞質、または膜状の局在について視覚的に評価することができる。免疫細胞、腫瘍細胞、間質細胞を簡単に識別できます。その後、画像解析により、すべてのマーカーの信号強度、ダイナミックレンジ、および空間分布に関する情報を提供できます(図6)。この技術により、26のマーカーすべてを細胞内レベルで1つの組織切片で分析することができました(図7)。マーカーの共局在を分析することで、細胞の表現型を特定し、空間的な細胞の位置を特定し、細胞間の距離を計算し、細胞の分布を見つけることができました。この技術の重要な影響は、組織の微小環境の免疫状態に焦点を当てた堅牢な26マーカーパネルの提示です。
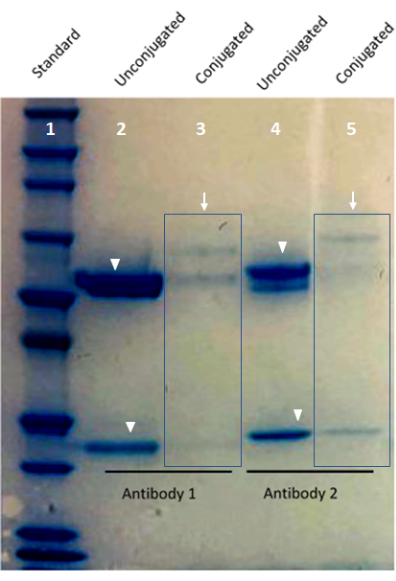
図1:Bis-Trisタンパク質ゲルを用いたカスタムコンジュゲート抗体バリデーションの画像。 ゲルのレーン1はタンパク質標準を示す。レーン2およびレーン4は、バーコード結合抗体(矢印)を示す。レーン3およびレーン5は、非結合抗体由来の重鎖バンドおよび軽鎖バンドを示す(矢印)。 この図の拡大版を表示するには、ここをクリックしてください。
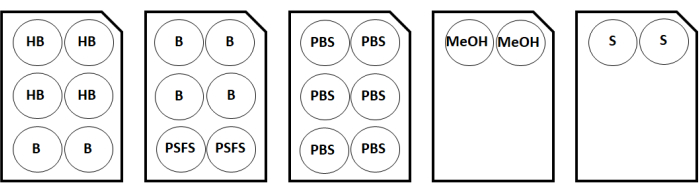
図2:2つのカバーガラスサンプルの染色プレート構成マップ。略語:HB =水和緩衝液;B =抗体希釈剤/ブロック;PSFS = 染色後の固定液;PBS = リン酸緩衝生理食塩水;MeOH =メタノール;S =ストレージソリューション。この図の拡大版を表示するには、ここをクリックしてください。

図3:レポータープレートの構成。 各結合抗体には、特定のレポーターと相補的なバーコードがあります。レポータープレートをセットアップするには、すべての標識抗体とそれに対応するレポーターをリストする必要があります。次に、各抗体にサイクル番号を割り当てます。2つのブランクサイクル(C1とC18)の性能は、3つの蛍光チャネルにおける自家蛍光のレベルを評価し、画像取得制御ソフトウェアを使用してイメージング後のバックグラウンド減算に使用されます。この段階でソフトウェアウィザードが機器をチェックして、すべての設定が正しいことを確認します(図4)。 この図の拡大版を表示するには、ここをクリックしてください。
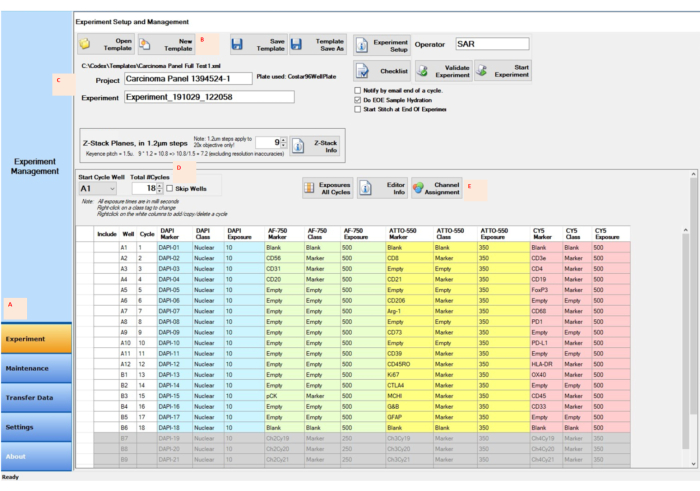
図4:実験セットアップ用の制御ソフトウェアを使用した画像取得。 (A)制御ソフトウェアの左下隅にある[実験]タブを選択して、セットアップを準備して開始します。(B,C)[新しいテンプレート] を選択して、新しいプロジェクトと実験名を使用して実験の設定を入力します。(D)開始サイクルウェルとサイクル数を、96ウェルレポータープレート内のレポーター位置を反映するように変更します。(E)実験用に指定された4つのチャンネルに適切な蛍光チャンネルを割り当てます。この図の拡大版を表示するには、ここをクリックしてください。

図5:ウェブベースのソフトウェア(QuPath)を使用した画像の可視化。 ビューアウィンドウには、染色された扁桃腺組織FFPEセクションに26個のマーカーが表示されます。 明るさとコントラスト ウィンドウには、チェックマークの付いたマーカーが表示されます。最後に、ビューアー ウィンドウに、選択したマーカーを含む FFPE サンプルが表示されます。 この図の拡大版を表示するには、ここをクリックしてください。
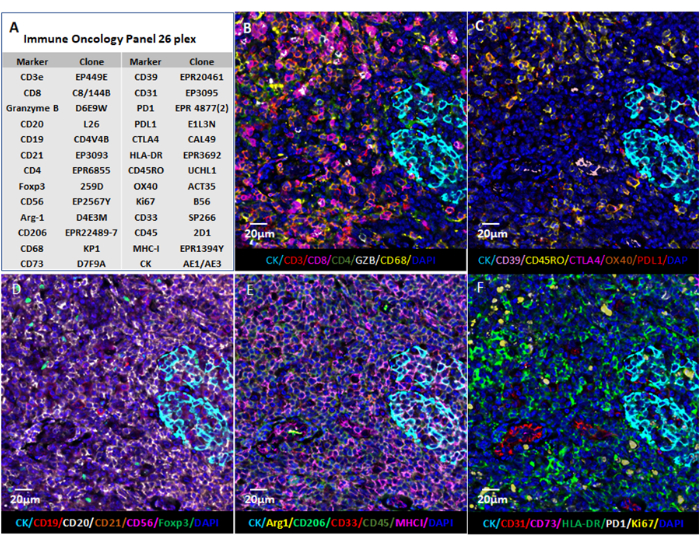
図6:Webベースのソフトウェアを使用した画像の視覚化。 (A)26個のマーカーについて扁桃腺組織切片を染色し、QPTIFF形式の切片の画像を、注釈とレビューのために市販のデジタルスライドビューアソフトウェアまたはオープンソースソフトウェア(QuPath)を使用して視覚化しました。(B-F)信号を見やすくするために、同じ注釈に6つのマーカーが表示されました。この図の拡大版を表示するには、ここをクリックしてください。
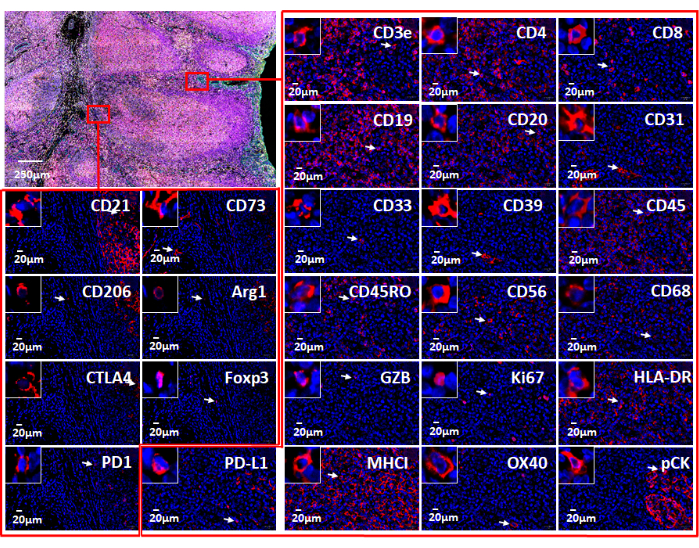
図7:Webベースのソフトウェアで使用される26の個別のマーカーのビュー。 扁桃腺組織におけるマーカー発現は、免疫腫瘍学パネル(左上)による免疫蛍光染色 によって 示されています。2 つの小さな領域 (赤い四角形) に個々のマーカーが表示されます。拡大インサートには、これらのマーカーに対して陽性のセルが表示されます(白い矢印)。 この図の拡大版を表示するには、ここをクリックしてください。
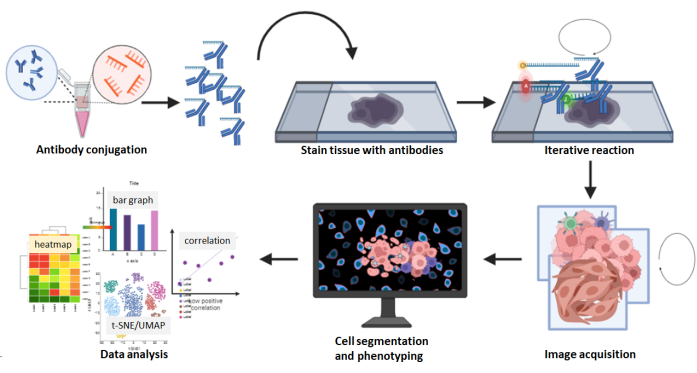
図8:多重化された画像取得ワークフローの概要。 FFPE組織切片を26抗体パネルを用いて染色し、続いてマルチサイクル反応を行った。染色切片の生画像を計算処理し、合成画像を用いて細胞密度および空間解析を行った。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:扁桃腺組織におけるIHC検証。 FFPE組織切片は、個々の抗体を用いて染色した。扁桃腺組織におけるマーカー発現は低倍率で示され、ズームインインサートはマーカーに対して陽性の細胞(赤い長方形)を示す。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
TMEは、がんの発生、進行、および治療反応に不可欠な役割を果たします。さらに、TMEにおける特定の腫瘍浸潤リンパ球サブセットの密度は、特定の種類の癌の予後バイオマーカーとして役立つ可能性があります。驚くべきことに、TMEの細胞組成に加えて、腫瘍の空間的特徴は、腫瘍の生物学を理解し、潜在的な予後バイオマーカーを特定するためのアウトラインを提供することができます12,17。
多くの免疫細胞集団が前がんまたは抗がん反応に関与しているため、これらの細胞と、それらの相互およびがん細胞との空間的関係をよりよく理解することは、新しい免疫療法戦略の特定に役立ちます。以前の研究では、腫瘍内および腫瘍周囲領域の組織構造と腫瘍細胞の浸潤性辺縁に基づいて、TME細胞の位置と空間分布を層別化しています18,19。過去15年間、技術の進歩により、空間分散に基づく個々の細胞の表現型解析は、TMEを研究し、腫瘍免疫療法の潜在的なバイオマーカーを分類するための新しい影響力のあるツールになりました。多重IF組織化学は、複数の生物学的マーカー20を同時に推定することができる。
オリゴヌクレオチド結合抗体戦略と同様に、TMEの研究には、色原体、蛍光、DNAバーコード、および金属同位体標識抗体検出システムの4種類のタンパク質ベースのマルチプレックスプラットフォームが使用されます。費用対効果の高い発色IHCプラットフォームは、従来の明視野顕微鏡を使用して、スライド全体の視覚化と病理学的評価を可能にします。マルチプレックスIFおよびIHCでは、蛍光色素と結合させた抗体が使用されます。マルチプレックスIF/IHCプラットフォームは、高い特異性で抗体を検出し、細胞内レベルでも標的抗体を定量することができます6,21。さらに、発色体と蛍光色素の性質上、1枚の抗体パネルを使用することで、1枚のスライドで最大10個のバイオマーカーの発現を捉えることができます。金属同位体ベースのプラットフォーム上では、金属タグ付き抗体を使用して、単一細胞および空間分解能で多重化イメージングを実行し、個々の組織切片22に対して高感度を実行する。理論的には、これらの金属結合抗体アプローチにより、単一の組織切片で100を超えるバイオマーカーを同時に検出できます。同位体標識技術の課題の1つは、100%の純度の濃縮が23に達するのを妨げる同重体干渉です。さらに、マーカーの数が増えると干渉が増加します。DNA結合抗体検出プラットフォームは、固有のDNAバーコードで標識された抗体を認識します。これらのプラットフォームでは、40を超えるバイオマーカーを高い特異性で同時に捕捉できます6。
マルチプレックスイメージングは、DNA結合抗体を1つの組織スライドにワンステップで適用するための市販のDNAバーコード標識抗体検出プラットフォームです(図8)。組織調製段階では、メーカーから入手した金コーティングされたスライドを使用する必要があるマルチプレックスイオンビームイメージングプラットフォームとは異なり、マルチプレックスイメージングプラットフォームでは、通常のカバーガラスまたは0.1%ポリ-L-リジンでコーティングされたスライドのみを使用して、組織が接着し、染色およびイメージングプロセス中に組織を無傷に保つのに役立ちます。染色されていないスライドを長期間保存すると抗原性が低下するため、切片作成後4週間以内にカバーガラスに組織切片を使用することをお勧めします。染色されたカバーガラスサンプルは、染色シグナルを失うことなく、4°Cの保存バッファーで最大2週間維持できます。カバーガラスサンプルの保管に特別な装置は必要ありません。マルチプレックスイメージングシステムは、カバーガラスの代わりに通常のスライドを使用するようにアップグレードされ、より大きな組織の染色と簡単な取り扱いが可能になりました。抗体結合に還元溶液を使用する場合(ステップ3.2.3)、抗体の損傷を防ぐために、反応を30分以内に制限する必要があります。手順 5.6.6 のブロッキングバッファは新しく準備する必要があり、ブロッキングバッファは再利用しないでください。
色原体、蛍光、および金属同位体標識マルチプレックス抗体検出プラットフォームと比較して、マルチプレックスイメージング技術には特定の利点があります。例えば、マルチプレックスイメージング用に60を超える設計済み抗体パネルが市販されており、抗体結合および検証の時間とコストを節約するのに役立ち、事前に設計された抗体パネルの数は増加しています。これらの抗体には、がんマーカーの汎サイトケラチン、黒色腫マーカーSOX10、血管マーカーCD31、間質マーカーSMA、および多数の免疫細胞マーカーが含まれ、検証済みで実験の準備ができています。事前に設計されていない抗体の場合、マルチプレックスイメージングで使用するために設計された市販のコンジュゲーションキットは簡単でユーザーフレンドリーです。顧客結合抗体は、4°Cで保存した場合、1年間有効です。 さらに、画像をキャプチャするために機械のウォームアップは必要ありません。このマルチプレックスイメージング技術では、画像取得における反復洗浄、ハイブリダイゼーション、およびストリッピングステップが、マーカー強度の低下または組織形態の劣化をもたらすことはめったにありません5、24、25。さらに、合成画像は、シンプルな3色蛍光顕微鏡でQPTIFF形式でキャプチャされ、サードパーティのデジタル分析ソフトウェアを使用してアップロードおよび分析できます。染色マーカーは単一細胞の解像度で視覚化でき、細胞の表現型はマーカーの共局在によって特徴付けることができます(図6および図7)。多重化された画像を包括的に解析することで、組織コンパートメント、単一細胞マーカーの定量化、最近傍および近接データをさらに明らかにします(図8)。
多重画像解析における課題は、細胞型の同定です。通常、より多くの単一オブジェクト分類器が画像に適用されると、より一般的でない表現型に注釈が付けられます。したがって、同じ分類器で共発現していない既知のマーカーを使用し、表現型関連の分類器のみを単一細胞のアノテーションに適用することが推奨されます。細胞タイプのアノテーションのばらつきは、細胞の空間分布や細胞近傍解析の違いなど、実質的に異なる空間結果をもたらします26,27。
マルチプレックス画像解析は、FFPE組織、新鮮な凍結組織、アーカイブされたスライド全体、組織マイクロアレイなど、多くのサンプルタイプの染色とイメージングに成功することが証明されています。乳房、脳、肺、脾臓、腎臓、リンパ節、および皮膚組織切片の多重化された画像は、深い単一細胞空間表現型データ5、16、25、28を用いて取得することができる。
将来的には、マルチプレックスイメージング用に事前に設計された抗体が増えることが期待されています。さらに、多重化された画像解析のための特定のソフトウェアの開発が大いに必要とされています。現在、Hi-Plex画像解析用の市販のオープンソースソフトウェアプログラムは数多く存在しますが29、科学者はこれらの分析の標準ワークフローを作成する際に依然として支援を必要としています30,31。このプロトコルを使用してキャプチャされた合成画像はサードパーティのソフトウェアと互換性がありますが、これによりユーザーに余分なコストがかかる可能性があります。マルチプレックスイメージング技術の別の欠点は、反復洗浄、ハイブリダイゼーション、および抗体の大きなパネルによるストリッピング後の核タンパク質検出におけるシグナルの減少です。幸いなことに、レポータープレートを設計する際の早いサイクルでバーコード化された蛍光色素を取得することで、これを最小限に抑えることができます。最近、このプラットフォームは、新しい高速スキャンシステムでアップグレードされ、合成画像32を取得する時間を劇的に短縮した。さらに、チラミド結合バーコードを用いた新しい戦略が、オリゴヌクレオチド結合抗体のバーコードベースのイメージングを強化することが報告されています。この技術は、バーコード結合抗体では入手が困難な染色シグナルを増幅することを目的としています33。
開示事項
著者は開示すべき矛盾はありません。
謝辞
著者らは、この記事を編集してくれたMDアンダーソンの研究医学図書館の編集サービスのドナルドR.ノーウッドと、MDアンダーソンのトランスレーショナル分子病理学部門のマルチプレックスIFおよび画像分析研究所に感謝します。このプロジェクトの一部は、テキサス大学MDアンダーソンがんセンター、トランスレーショナル分子病理学科のトランスレーショナル分子病理学-免疫プロファイリング研究所(TMP-IL)ムーンショットプラットフォーム、およびNCI協力協定U24CA224285(MDアンダーソンがんセンターCIMACへ)によってサポートされました。
資料
| Name | Company | Catalog Number | Comments |
| 10x AR9 Buffer | Akoya Biosciences | AR900250ML | |
| 10x Buffer | Akoya Biosciences | 7000001 | |
| 16% paraformaldehyde | Thermo Fisher Scientific | 28906 | |
| 1X Antibody Diluent/Block | Akoya Biosciences | ARD1001EA | |
| Antibody Conjugation Kit | Akoya Biosciences | 7000009 | Contains Filter Blocking Solution, Antibody Reduction Solution 1, Antibody Reduction Solution 2, Conjugation Solution, Purification Solution, Antibody Storage Solution |
| Assay Reagent | Akoya Biosciences | 7000002 | |
| Diethyl pyrocarbonate | Sigma-Aldrich | 40718-25ML | |
| Dimethyl sulfoxide | Avantor/VWR | BDH1115-4LP | |
| Ethanol, 200 proof | |||
| G Blocker V2 | Akoya Biosciences | 240199 | |
| Histoclear | Thermo Fisher Scientific | 50-329-50 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| Milli-Q Integral 10 | Millipore | ZRXQ010WW | |
| Niknon Fluorescence microscope | Keyence Corp. of America | BZ-X810 | |
| Nuclear Stain | Akoya Biosciences | 7000003 | |
| Nuclease-free water | Thermo Fisher Scientific | AM9938 | |
| NuPAGE | Thermo Fisher Scientific | NP0008 | |
| PBS | Thermo Fisher Scientific | 14190136 | |
| PhenoCycler Barcodes/Reporters Combination | Akoya Biosciences | 5450004 (BX025/RX025) | |
| 5450003 (BX022/RX022) | |||
| 5450023 (BX002/RX002) | |||
| 5250002 (BX020/RX020) | |||
| 2520003 (BX023/RX023) | |||
| 5250005 (BX029/RX029) | |||
| 5250007 (BX035/RX035) | |||
| 5250012 (BX052/RX052) | |||
| 5550012 (BX030/RX030) | |||
| 5550015 (BX042/RX042) | |||
| 5550014 (BX036/RX036) | |||
| QuPath | Open-Source | https://qupath.github.io/ | |
| SimplyBlue SafeStain | Thermo Fisher Scientific | LC6065 | |
| Staining Kit | (Akoya Biosciences | 7000008 | Contains Hydration Buffer, N Blocker, J Blocker, S Blocker, Fixative Reagent, Storage Buffer |
参考文献
- Hanahan, D., Coussens, L. M. Accessories to the crime: Functions of cells recruited to the tumor microenvironment. Cancer Cell. 21 (3), 309-322 (2012).
- Labani-Motlagh, A., Ashja-Mahdavi, M., Loskog, A. The tumor microenvironment: A milieu hindering and obstructing antitumor immune responses. Frontiers in Immunology. 11, 940 (2020).
- Jin, M. Z., Jin, W. L. The updated landscape of tumor microenvironment and drug repurposing. Signal Transduction and Targeted Therapy. 5 (1), 166 (2020).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nature Reviews Immunology. 20 (11), 651-668 (2020).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Communications. 40 (4), 135-153 (2020).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455-33465 (2020).
- Allam, M., Cai, S., Coskun, A. F. Multiplex bioimaging of single-cell spatial profiles for precision cancer diagnostics and therapeutics. NPJ Precision Oncology. 4, 11 (2020).
- Eng, J., et al. A framework for multiplex imaging optimization and reproducible analysis. Communications Biology. 5 (1), 438 (2022).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. Journal for Immunotherapy of Cancer. 9 (7), e002197 (2021).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Heindl, A., Nawaz, S., Yuan, Y. Mapping spatial heterogeneity in the tumor microenvironment: A new era for digital pathology. Laboratory Investigation. 95 (4), 377-384 (2015).
- Kuswanto, W., Nolan, G., Lu, G. Highly multiplexed spatial profiling with CODEX: bioinformatic analysis and application in human disease. Seminars in Immunopathology. 45 (1), 145-157 (2022).
- Phillips, D., et al. Immune cell topography predicts response to PD-1 blockade in cutaneous T cell lymphoma. Nature Communications. 12 (1), 6726 (2021).
- Jhaveri, N., et al. Deep ultrahigh-plex spatial phenotyping of human cancer tissues. Cancer Research. 82, 3877 (2022).
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Yuan, Y. Spatial heterogeneity in the tumor microenvironment. Cold Spring Harbor Perspectives in Medicine. 6 (8), a026583 (2016).
- Bruck, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Modern Pathology. 34 (12), 2229-2241 (2021).
- Tsujikawa, T., et al. Prognostic significance of spatial immune profiles in human solid cancers. Cancer Science. 111 (10), 3426-3434 (2020).
- Hoyt, C. C. Multiplex immunofluorescence and multispectral imaging: forming the basis of a clinical test platform for immuno-oncology. Frontiers in Molecular Biosciences. 8, 674747 (2021).
- Parra, E. R., et al. Identification of distinct immune landscapes using an automated nine-color multiplex immunofluorescence staining panel and image analysis in paraffin tumor tissues. Scientific Reports. 11 (1), 4530 (2021).
- Elaldi, R., et al. High dimensional imaging mass cytometry panel to visualize the tumor immune microenvironment contexture. Frontiers in Immunology. 12, 666233 (2021).
- Campos Clemente, L., Shi, O., Rojas, F., Parra, E. R. Expanding the comprehension of the tumor microenvironment using mass spectrometry imaging of formalin-fixed and paraffin-embedded tissue samples. Journal of Visualized Experiments. (184), e64015 (2022).
- Schurch, C. M., et al. Coordinated cellular neighborhoods orchestrate antitumoral immunity at the colorectal cancer invasive front. Cell. 182 (5), 1341-1359 (2020).
- Phillips, D., et al. Highly multiplexed phenotyping of immunoregulatory proteins in the tumor microenvironment by CODEX tissue imaging. Frontiers in Immunology. 12, 687673 (2021).
- Hickey, J. W., Tan, Y., Nolan, G. P., Goltsev, Y. Strategies for accurate cell type identification in CODEX multiplexed imaging data. Frontiers in Immunology. 12, 727626 (2021).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- Tzoras, E., et al. Dissecting tumor-immune microenvironment in breast cancer at a spatial and multiplex resolution. Cancers. 14 (8), 1999 (2022).
- Francisco-Cruz, A., Parra, E. R., Tetzlaff, M. T. Wistuba, II. Multiplex immunofluorescence assays. Methods in Molecular Biology. 2055, 467-495 (2020).
- Shakya, R., Nguyen, T. H., Waterhouse, N., Khanna, R. Immune contexture analysis in immuno-oncology: applications and challenges of multiplex fluorescent immunohistochemistry. Clinical and Translational Immunology. 9 (10), e1183 (2020).
- Wilson, C. M., et al. Challenges and opportunities in the statistical analysis of multiplex immunofluorescence data. Cancers. 13 (12), 3031 (2021).
- DeRosa, J. Setting a new standard for spatial omics: An integrated multiomics approach: every single cell, two different analytes, one unbiased picture. Genetic Engineering & Biotechnology News. 42, 26-28 (2022).
- Simonson, P. D., Valencia, I., Patel, S. S. Tyramide-conjugated DNA barcodes enable signal amplification for multiparametric CODEX imaging. Communications Biology. 5 (1), 627 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved