Method Article
多重条形码图像分析,用于石蜡组织样品单细胞分析中的免疫分析和空间映射表征
摘要
多路复用条形码图像分析最近改进了肿瘤微环境的表征,允许对细胞组成、功能状态和细胞间相互作用进行全面研究。在此,我们描述了使用寡核苷酸偶联抗体的条形码和循环成像的染色和成像方案,其允许使用高维图像分析技术。
摘要
使用抗体条形码和寡核苷酸的多重成像技术,可依次检测同一组织切片中的多个表位,是一种有效的肿瘤评估方法,可提高对肿瘤微环境的理解。当特定的荧光团通过互补寡核苷酸 退 火到抗体结合的条形码上,然后进行样品成像时,可以实现福尔马林固定石蜡包埋组织中蛋白质表达的可视化;实际上,该方法允许在单个组织染色反应中使用40多种抗体的可定制组合。该方法与新鲜冷冻组织、福尔马林固定、石蜡包埋组织、培养细胞和外周血单核细胞兼容,这意味着研究人员可以使用该技术以单细胞分辨率查看各种样品类型。该方法从手动染色和固定方案开始,并使用抗体混合物应用所有抗体条形码。染色流体仪器是全自动的,可执行标记、成像和去除光谱不同的荧光团的迭代循环,直到使用标准荧光显微镜对所有生物标志物进行成像。然后在所有成像周期中收集和编译图像,以实现所有标记物的单细胞分辨率。一步染色和温和的荧光团去除不仅允许高度多重的生物标志物分析,而且如果需要,还可以保存样品以进行额外的下游分析(例如,苏木精和伊红染色)。此外,图像分析软件支持图像处理漂移补偿、背景减法、细胞分割和聚类,以及图像和细胞表型的可视化和分析,以生成空间网络图。总之,该技术采用计算机化的微流体系统和荧光显微镜来迭代杂交、成像和剥离荧光标记的DNA探针,这些探针与组织结合的寡核苷酸偶联抗体互补。
引言
肿瘤微环境(TME)具有极强的异质性,由肿瘤细胞、肿瘤基质细胞、免疫细胞、细胞外基质的非细胞成分以及肿瘤、基质和免疫细胞产生和释放的众多丰富分子组成1,2。越来越多的证据表明,TME在重新编程肿瘤分化、生长、侵袭、转移和对治疗的反应中具有关键作用3。
了解TME中不同细胞类型如何通过信号网络相互作用和相互通信对于改善癌症诊断,优化免疫疗法和开发新疗法至关重要4。传统的组织显微镜技术,包括免疫组织化学(IHC)和免疫荧光(IF),几十年来一直用于研究肿瘤样本中的细胞类型、丰度和通讯。不幸的是,这些技术通常只能评估组织切片中的一个或两个蛋白质标记物,并且不能揭示这些细胞之间复杂的空间和结构关系5,8,7。
在过去的二十年中,已经建立了几种多路复用成像技术8。这些技术大大改善了TME中免疫细胞的组成,功能和位置,从而在单细胞水平上识别和空间分析复杂TME的能力迅速提高9,10。TME中各种肿瘤和免疫细胞的空间和结构关系现在处于使用这些多重成像技术的生物学和临床研究的最前沿11,12。
最近开发的使用寡核苷酸偶联抗体条形码的多重成像技术是一个有影响力的单细胞生物学研究平台,基于福尔马林固定石蜡包埋(FFPE)样品中寡核苷酸偶联抗体的检测13,14。目前,这种多重成像技术允许在单个组织切片15中同时对100多个标记物进行成像,这增加了原位可区分的细胞类型的数量。这使得使用传统的免疫表型方法无法对肿瘤和免疫细胞进行一定程度的空间分析16。
在本文中,我们描述了一种优化的方案,用于将纯化的抗体偶联到寡核苷酸,并使用多重成像平台和FFPE组织的多周期成像程序验证该偶联。此外,我们还描述了该技术使用的基本图像处理和数据分析程序。
研究方案
这项回顾性研究得到了德克萨斯大学MD安德森癌症中心机构审查委员会的批准。FFPE组织样本是从MD安德森的患者身上收集的,作为常规标准护理的一部分。没有进行诊断或治疗干预。获得患者的知情同意,将收集的样本用于研究和发表。
1. 用于抗体组合设计的抗体源
- 在仔细考虑目标组织和蛋白质的质量后,创建用于多重成像的抗体组合。抗体组合设计考虑了三种抗体来源:1)完全经过商业验证的抗体,2)多重成像技术筛选的抗体,以及3)最终用户共享的抗体。
注意:多重成像技术筛选的抗体已被证明有效,可从供应商处获得。这些筛选出的抗体可用于用户寡核苷酸偶联后的多重图像染色。 - 如果在上述来源中找不到感兴趣的蛋白质,请使用已知与IHC起作用的抗体克隆。此外,建议使用IgG同种型而不是IgM克隆用于这种多重成像技术,因为IgM的失败率高于IgG克隆。
2. 抗体偶联前
- 使用多重成像条形码鉴定用于偶联的抗体克隆时,请考虑购买磷酸盐缓冲盐水 (PBS) 或类似缓冲液中的无载体抗体。已知载体蛋白,包括BSA,麸质,甘油和其他蛋白质添加剂,会降低偶联能力。
- 选择最合适的抗体克隆,并在偶联前始终优化染色条件(即抗原修复和滴定)。通过使用标准IF或IHC将该抗体的阳性和阴性组织应用于该抗体的阳性和阴性组织来做到这一点。
注意:如果纯化的抗体不是市售的,则必须在偶联前进行抗体纯化过程。本文不讨论与抗体纯化试剂盒一起使用的纯化程序。
3. 抗体偶联
- 获取抗体偶联试剂。市售偶联试剂盒包含过滤器封闭溶液、还原溶液 2、偶联溶液、纯化溶液、抗体储存溶液(均储存在 4 °C )和还原溶液 1(储存在 −20 °C)。
- 共轭
注意:纯化的抗体用还原剂处理,允许抗体的还原部分与该技术使用的多重成像条形码反应,从而形成共价键。这个过程大约需要 4.5 小时,产生大约 120 μL 的偶联抗体,该抗体可存活 1 年。所有离心均在室温(RT)下进行,除最后一步(3.2.9)外,流出物被丢弃,其中收集管包含偶联抗体。- 使用移液管吸出 500 μL 过滤器封闭溶液并施加到 50 kDa 截止滤柱上,并以 12,000 x g 离心 2 分钟以阻断非特异性抗体结合。
注意:如果柱子顶部的残留溶液很明显,请倒置收集管中的过滤器,并以3,000× g 旋转2分钟。 - 将 50 μg 抗体移液到 100 μL 体积的溶液中到过滤柱中,并以 12,000 x g 旋转 8 分钟。
注意:使用分光光度计测量纯化抗体的浓度并计算对应于50μg抗体的溶液体积。如果抗体溶液的体积小于 100 μL,则通过添加 1x PBS 将体积调节至 100 μL。保留1μg未偶联的抗体用于偶联确认(步骤4.4)。 - 将 260 μL 还原预混液(20 μL 还原溶液 1 与 825 μL 还原溶液 2 混合,足以进行三次抗体偶联反应)移液到每个过滤柱中。轻轻涡旋预混液2-3秒,或上下移液以将溶液与抗体混合。在室温下孵育30分钟。
- 孵育后,以12,000× g 旋转过滤柱8分钟。向过滤柱中加入 450 μL 偶联溶液,并以 12,000 x g 离心 8 分钟。
- 将所需条形码重悬于 10 μL 无核酸酶水和 210 μL 偶联溶液中。
注意:在使用染色前立即准备抗体标签。不要重复使用抗体条形码等分试样。 - 在步骤3.2.4中完成旋转后,将重悬的抗体标签(约220μL)添加到每个相应的过滤柱中。轻轻上下移液混合物以混合试剂。关闭滤柱盖,并在室温下孵育共轭反应2小时。2小时后,以12,000× g 离心过滤柱8分钟。
注意:建议在聚合酶链反应管中留出5μL偶联溶液并将其储存在4°C下进行确认(见下文)。 - 将 450 μL 纯化溶液移液到每个过滤柱中,并以 12,000 x g 离心 8 分钟。重复三次。
- 将 100 μL 储存溶液移液到过滤柱中。轻轻地上下移液混合物10次以上,并仔细清洗色谱柱中过滤器的侧面。
注意:将 50 μg 抗体溶解在 100 μL 储存溶液中。如果用超过50μg的抗体开始偶联反应,则以该比例添加更多的储存溶液。 - 在新的收集管中倒置过滤柱。在室温下以 3,000 x g 旋转 2 分钟。 保留收集的溶液。将偶联抗体溶液移液到无菌螺旋盖管中,并在4°C下储存长达1年。
注意:偶联抗体应在 2 天后使用多重成像技术进行测试。在此之前的测试可能会导致高背景核染色。
- 使用移液管吸出 500 μL 过滤器封闭溶液并施加到 50 kDa 截止滤柱上,并以 12,000 x g 离心 2 分钟以阻断非特异性抗体结合。
4. 共轭确认
注意:在使用多重成像技术对用户偶联抗体进行染色实验之前,应使用凝胶电泳与5μL偶联抗体(参见步骤3.2.6)和1μg未偶联抗体(通常在2μL混合物中)作为对照来确认偶联。成功的抗体偶联将通过抗体分子量的增加来证明。然而,该确认方案仅评估化学反应是否成功进行偶联,而不涉及用于多重成像的抗体验证。
- 将 8 μL 和 11 μL 无核酸酶水分别移液到保留的偶联抗体和对照未偶联抗体中,以获得 13 μL 的最终体积。
- 将 5 μL LDS(或其他十二烷基硫酸钠-聚丙烯酰胺凝胶电泳系统)样品缓冲液和 2 μL 样品还原剂移液到保留的偶联抗体的每个样品中,并在 95 °C 干浴中使样品变性 10 分钟。
- 样品变性时,将 40 mL MOPS SDS 电泳缓冲液稀释在 760 mL 超纯水中,将凝胶放入电泳系统的电泳槽中,然后将稀释的电泳缓冲液倒在凝胶上。
- 10分钟变性期完成后,用预染色的蛋白质标准品加载凝胶的一个孔,用未偶联的抗体(来自步骤3.2.2)加载一个,其余的孔加载偶联的抗体样品。接下来,在150 V下运行凝胶,直到蛋白质标准品出现在凝胶末端。
注意:凝胶很容易粘附在微波安全的容器上,因此可能会撕裂,因此在以下步骤中必须小心处理凝胶。 - 运行完成后,将凝胶转移到预先装满超纯水的微波安全容器中,并在微波炉中加热,直到看到水中的第一个气泡。
注意:气泡形成的时间因使用的微波炉而异。 - 从容器中排出水,将约250mL考马斯G-250染色剂倒在凝胶上,并在微波炉中加热凝胶,直到第一个气泡可见。之后,从微波炉中取出装有凝胶和考马斯G-250染色剂的容器,并将其放在摇床上10分钟。
- 摇匀后,小心地沥干污渍,用约200mL超纯水替换,然后将容器放在摇床上洗涤凝胶。
- 沥干超纯水,然后用新的超纯水替换五次,或直到污渍的残留物在水浴中不明显。将凝胶在摇床上洗涤过夜,直到可见条带(如果需要),然后再拍摄凝胶(图1)。
注意:多重成像中使用的抗体应具有与染料偶联抗体相当的染色模式。已知偶联抗体抗原阳性的组织切片可以用寡核苷酸偶联抗体和染料偶联抗体染色。在这项工作中,在每种情况下,两种抗体类型的组织形态都是等效的,并且基于目标蛋白质和测试组织样品的生物学,以及预期的细胞分布。该结果表明了使用寡核苷酸偶联的抗体部分进行基于FFPE组织的组织染色方法的有效性。
5. 寡核苷酸偶联抗体染色
- 准备用于放置组织的盖玻片。
- 将盖玻片在室温下浸泡在0.1%聚-L-赖氨酸溶液中24小时,以提高组织粘附性。
- 浸泡后,沥干聚-L-赖氨酸溶液,用超纯水洗涤盖玻片30秒。重复洗涤四到六次。从用于洗涤的超纯水中取出盖玻片,然后将它们放在不起毛的毛巾上晾干过夜。
注意:组织学家必须将选定的组织切成5μm厚的切片,将它们放在带聚-L-赖氨酸的盖玻片的中心,并让它们干燥过夜。干燥后,带有组织切片的盖玻片必须在4°C下储存不超过6个月。该方案中的染色面板包含26个标记物。本协议中使用的组织是正常的人扁桃体组织。盖玻片浸泡时间不应超过1周。聚-L-赖氨酸包衣盖玻片可以储存在室温下,必须在制备后 2 个月内使用。
- 染色前一天,将盖玻片支架放入60°C烘箱中过夜。
- 第二天,将盖玻片样品放入60°C烘箱中的预热盖玻片支架中。烘烤 30 分钟后,检查以确保石蜡已从组织中融化。
- 快速将盖玻片支架/样品置于以下溶液系列中:两轮脱蜡剂,每轮6分钟;两轮100%乙醇,每轮5分钟;一轮90%乙醇5分钟;一轮70%乙醇5分钟;一轮50%乙醇5分钟;一轮30%乙醇5分钟;和两轮焦碳酸二乙酯 (DEPC) 处理的超纯水,每次 5 分钟。
注意:乙醇的所有稀释液均用DEPC处理的超纯水制备。如果使用二甲苯进行脱蜡,则应将其用于引擎盖中。 - 在将盖玻片支架/样品置于溶液系列中时,请执行以下操作:
- 通过在底部放置一个空的移液器吸头盒和浸水的纸巾来准备湿度室。
- 在高压锅中装满足够的水,以覆盖 50 mL 烧杯的一半。
- 将每个样品的5mL甲醇置于4°C的烧杯中。
- 用DEPC处理的超纯水将AR9缓冲液稀释至1倍;每个盖玻片支架需要约50 mL的稀释缓冲液。
- 溶液系列完成后,用约 40 mL 的 1x AR9 缓冲液填充 50 mL 玻璃烧杯,将盖玻片支架/样品浸入烧杯中,并用铝箔完全覆盖烧杯/盖玻片支架。
- 将铝箔覆盖的烧杯/盖玻片支架放入充满水的压力锅中,并在高压(约 15 psi)下烹饪 20 分钟。
- 烹饪后,取下烧杯/盖玻片支架,小心地打开铝箔,让烧杯/盖玻片支架在室温下冷却约 10 分钟。
- 从1x AR9缓冲液中取出盖玻片支架/样品,并将其浸入两轮DEPC处理的超纯水中,在两轮中孵育样品,每轮孵育2分钟。
- 在孵育过程中,从多重成像染色试剂盒中取出水合缓冲液、封闭N、封闭G、封闭J和封闭S溶液以及抗体稀释剂/封闭剂。对于两个盖玻片样品,使用 图2所示的配置标记溶液的6孔板。
- 将盖玻片样品置于两轮 5 mL 的水合缓冲液中,每轮 2 分钟。
- 在水合缓冲液中放置两轮后,将盖玻片样品置于5mL的多重成像抗体稀释剂/阻组中,并在室温下孵育20-30分钟(不要超过30分钟)。
- 在孵育期间,通过制作多重成像抗体稀释剂/封闭剂、N 阻断剂、G 阻断剂、J 受体阻断剂和 S 阻断剂溶液的 200 μL 预混液来制备抗体混合物。
注意:根据标记物的数量和每个标记物的验证滴定计算总抗体量,并从预混液中减去总抗体量。例如,对于六个标记物,每个标记物的滴定率为1:200,公式为200 μL预混液−6 μL抗体混合物= 194 μL预混液。
- 在多重成像抗体稀释剂/阻组中孵育后,将盖玻片样品置于步骤5.5.1制备的湿度室中,将190μL抗体混合物移液到盖玻片样品上,并将盖玻片样品在室温下孵育3小时。
- 孵育后,用 5 mL 多重成像抗体稀释剂/块分两轮洗涤盖玻片样品,每次 2 分钟。
- 要将结合的抗体固定在盖玻片上,请在湿度室中执行步骤5.7.3-5.7.5。
- 将盖玻片与16%甲醛用储存溶液稀释至1.6%孵育10分钟,然后用1x PBS洗涤盖玻片三次。
- 用4°C甲醇孵育盖玻片5分钟,然后用1x PBS洗涤盖玻片三次。
- 用 5 mL 用 1x PBS 稀释的固定试剂孵育盖玻片 20 分钟,然后用 1x PBS 洗涤盖玻片 3 次。
- 将染色的盖玻片样品储存在4°C的储存缓冲液中长达2周
6. 多路复用成像报告板
注意:根据定制设计的多重成像实验制备96孔板,称为报告板,在单个孔中包含条形码荧光团,并与每个染色的盖玻片样品相关联。以下步骤用于准备报告板。
- 通过混合 4,880 μL 无核酸酶水、600 μL 10x 多重成像缓冲液、500 μL 检测试剂和 20 μL 核染色液制备报告预混液。这对于所有井的 20 个循环来说已经足够了。
- 在定制设计的多重成像实验的每个循环中,用 245 μL 含有报告预混液和该循环的特定条形码荧光团的溶液填充孔。
注意:有关此协议中用于癌面板的报告板配置,请参见 图3 。 - 为了保护条形码荧光团,请在报告板上粘上箔板盖,并将板放在多重成像仪器内。
- 将报告板储存在4°C的暗盒中长达2周。
7. 校准和运行多路复用成像机
注意:高分辨率成像荧光显微镜在每个多重成像周期中以20倍,100%激发光和低光漂白捕获四个不同的荧光通道。
- 通过将样品盖玻片放在显微镜载物台上,手动将 700 μL 滴定的 1:1,500 核染色溶液移液到组织上,使用 DAPI 通道校准成像焦点。
注意:在样品洗涤和成像期间,盖玻片保留在显微镜载物台上。 - 要制备多重成像仪器,请使用DEPC处理的超纯水将10x多重成像缓冲液稀释至1x,并用适当的溶液/溶剂填充试剂瓶,包括稀释的1x多重成像缓冲液,DEPC处理的超纯水和二甲基亚砜(DMSO)。
- 试剂瓶适当填充后,将实验设计输入多路复用成像仪器管理器软件;为每个循环指定正确的循环、孔号、z-stack位置、标记名称、类别和曝光时间(图4);设置所有显微镜参数;并在样品盖玻片上选择要成像的感兴趣区域。
- 单击控制软件中的 "实验 "按钮(图4A)。在 "实验设置和管理 "窗口中,单击" 新建模板 "按钮(图 4B)。
- 在"项目"按钮旁边的空白处键入 项目 名称(图 4C)。键入或选择循环总数(图 4D)。
- 单击 "通道分配 "按钮,在列中键入每个周期的信息(图 4E),然后单击" 保存模板 "按钮。通过单击"开始实验"按钮 开始实验 。
注意:在多重成像实验期间,仪器从报告板的一个孔中检索条形码荧光团(每孔最多四个荧光团,包括DAPI),将它们直接分配到样品盖玻片上,并对每个荧光通道的感兴趣区域进行成像。在该循环的所有成像之后,仪器洗掉条形码荧光团并分配下一个周期的报告基因(从报告板上的下一个孔)。成像一直持续到使用26个标记物的所有循环完成。
8. 图片采集
注意:可以使用任何配置有四个荧光通道(DAPI、Cy3、Cy5和Cy7)并配备计划福陆20x镜头的适配倒置荧光显微镜收集多路复用图像。盖玻片样品的成像和清洗使用专门开发的流体装置自动迭代执行。图像使用处理器软件(v1.8.0.7)以QPTIFF格式采集。
- 在处理器窗口中,单击" 输入 "按钮,然后选择实验名称。
- 在" 处理选项" 部分中,选择并选中" 背景减法"、" 反卷积"、" 扩展景深"和 "阴影校正"。单击 "开始" 按钮。
9. 图像分析
注意:采集的图像可以上传到获得专利的自动图像分析软件或开源软件程序(图5)进行下游分析。
- 单击计算机上的 QuPath 图标,然后打开软件。将 QPTIFF 文件拖到 查看器 窗口。
- 单击"亮度和对比度"按钮,这将打开"亮度和对比度"窗口。 选中或取消选中"已选择"列中的标记以显示或关闭标记信号。
- 单击 缩放以适合 按钮以放大或缩小感兴趣区域。
注意:多路复用图像数据可视化使用户能够深入了解组织微环境。FFPE样品中的单个标记物可以以荧光形式(图6 和 图7)或病理学视图可视化。可以使用多种计算平台来处理合成图像并分析多路复用的组织图像数据。使用该软件,空间表型以及稀有细胞发现和细胞邻域计算可以通过多重成像技术 生成的 超高多重组织的全玻片图像来完成。有关癌面板和扁桃体样本中的26种抗体,请参见图 6 (补充图1)。
结果
我们使用FFPE扁桃体样本开发26个标志物的免疫肿瘤学组合,以使用条形码图像分析系统说明FFPE组织的免疫状态。总体而言,目前有19种抗体用于我们实验室的其他多重成像研究。所有标志物均已使用具有显色IHC的FFPE组织进行了测试。所有抗体均与独特的DNA寡核苷酸偶联。当使用基于网络的仪器管理器(图4)为这种条形码图像分析技术设置盖玻片时,应该注意的是,第一个和最后一个循环总是"空白"的(图2和图4),它提供了要从抗体的特定信号中减去的背景荧光信号。使用荧光显微镜收集QPIFF格式的图像后,可以使用几个获得专利的自动图像分析软件或开源软件程序对其进行可视化。合成图像可以显示所有标记或选定的标记,以便更好地查看信号(图 5)。此外,可以目视评估每种抗体的核、细胞质或膜定位。免疫细胞、肿瘤细胞和基质细胞很容易识别。随后,图像分析可以提供有关所有标记的信号强度、动态范围和空间分布的信息(图 6)。该技术使我们能够在单个组织切片中分析亚细胞水平的所有26个标记物(图7)。通过分析标记物的共定位,我们可以识别细胞表型,定位空间细胞位置,计算细胞之间的距离,并找到细胞的分布。该技术的关键影响是展示了一个强大的26标记面板,专注于组织微环境的免疫状态。
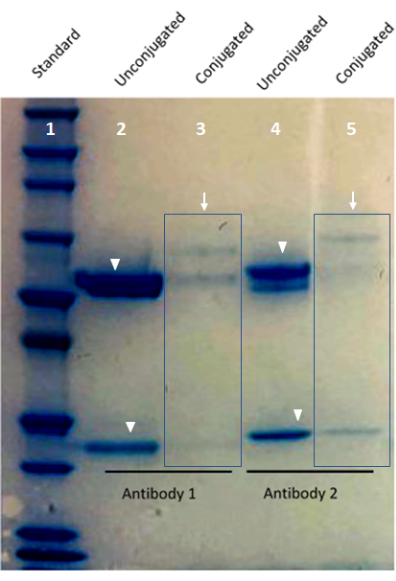
图 1:使用 Bis-Tris 蛋白凝胶进行定制偶联抗体验证的图像。 凝胶泳道1显示了蛋白质标准品。泳道 2 和泳道 4 显示条形码偶联抗体(箭头)。泳道 3 和泳道 5 显示了来自非偶联抗体(箭头)的重链条带和轻链条带。 请点击此处查看此图的大图。
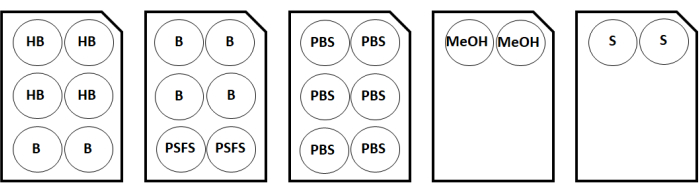
图 2:两个盖玻片样品的染色板配置图。缩写:HB = 水合缓冲液;B = 抗体稀释剂/阻断;PSFS = 染色后固定液;PBS = 磷酸盐缓冲盐水;甲醇 = 甲醇;S = 存储解决方案。请点击此处查看此图的大图。

图 3:报告板配置。 每个偶联抗体都有一个与特定报告基因互补的条形码。要设置报告板,应列出每个偶联抗体及其相应的报告基因。接下来,为每个抗体分配一个循环编号。两个空白周期(C1和C18)的性能用于评估三个荧光通道中的自发荧光水平,并使用图像采集控制软件进行成像后背景减去。软件向导将在此阶段检查仪器,以确保所有设置正确(图 4)。 请点击此处查看此图的大图。
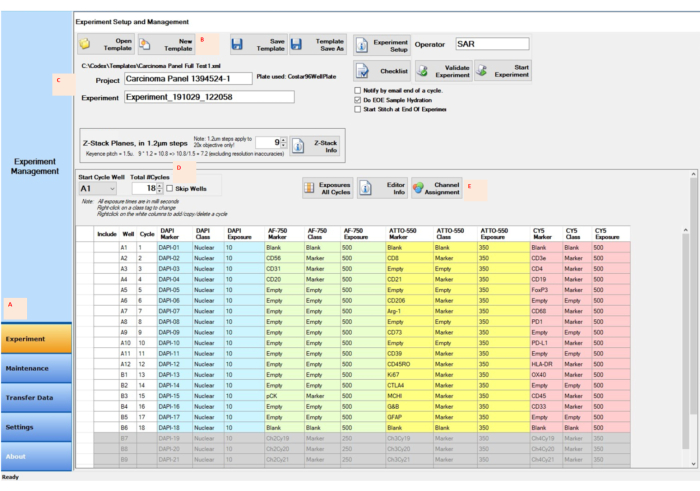
图 4:使用控制软件进行实验 设置的图像采集。 (A) 选择控制软件左下角的 "实验 "选项卡以准备并开始设置。(乙,丙)选择 "新建模板 ",使用新项目和试验名称输入实验设置。(D)改变起始循环孔和循环次数,以反映报告器在96孔报告板中的位置。(E)为实验运行的四个通道分配适当的荧光通道。 请点击此处查看此图的大图。

图 5:使用基于 Web 的软件 (QuPath) 进行图像可视化。 查看器窗口在染色的扁桃体组织FFPE切片中显示26个标记物。 "亮度和对比度" 窗口显示带有复选标记的标记。最后,查看器窗口显示带有所选标记的 FFPE 样本。 请点击此处查看此图的大图。
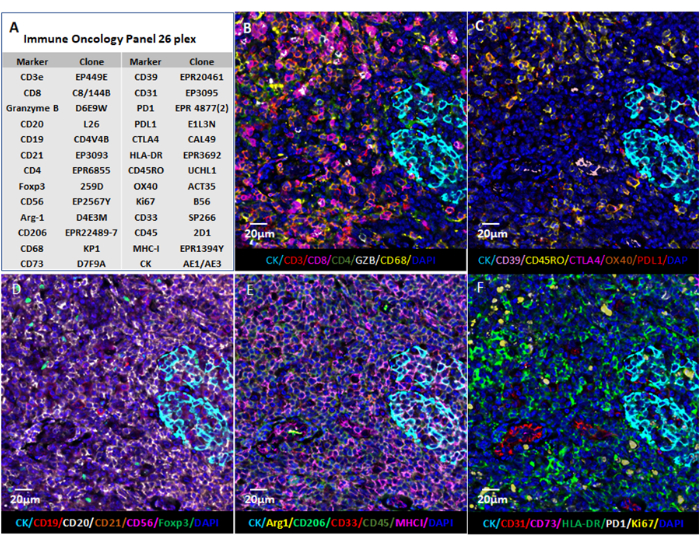
图 6:使用基于 Web 的软件进行图像可视化。 (A)对26个标记物的扁桃体组织切片进行染色,并使用商业数字载玻片查看器软件或开源软件(QuPath)对QPTIFF格式的切片图像进行可视化,以进行注释和审查。(B-F)六个标记显示在相同的注释中,以便更好地查看信号。请点击此处查看此图的大图。
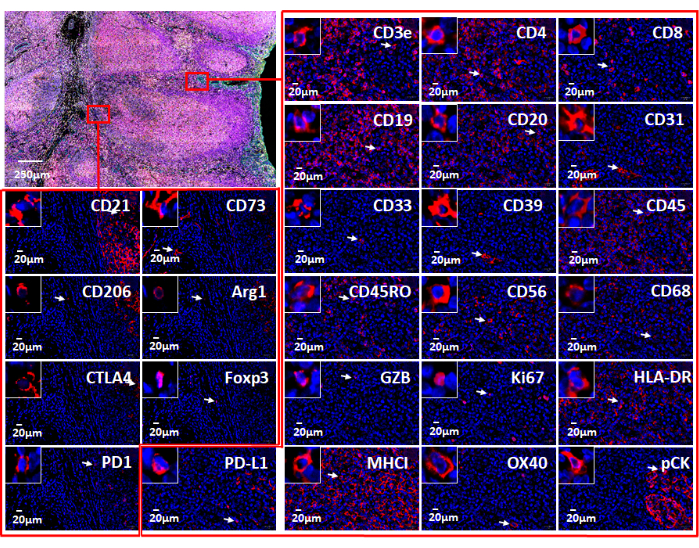
图 7:与基于 Web 的软件一起使用的 26 个单独标记的视图。 扁桃体组织中的标志物表达通过免疫肿瘤学组合(左上)的免疫荧光染色 显示 。显示了两个小区域(红色矩形)中的单个标记。放大的插入显示这些标记的阳性单元格(白色箭头)。 请点击此处查看此图的大图。
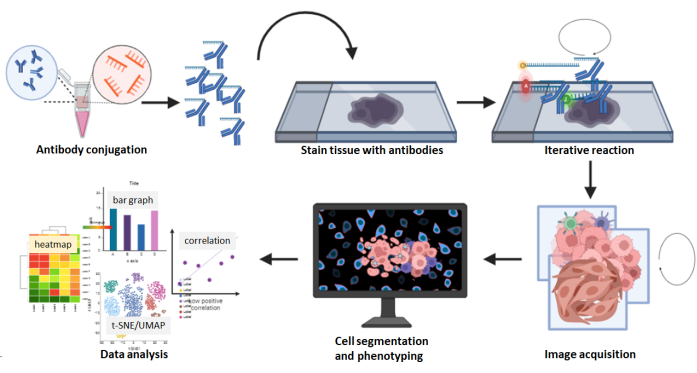
图 8:多路复用图像采集工作流程摘要。 使用26抗体组合对FFPE组织切片进行染色,然后进行多环反应。对染色切片的原始图像进行计算处理,并使用合成图像进行细胞密度和空间分析。 请点击此处查看此图的大图。
补充图1:扁桃体组织中的IHC验证。 使用单个抗体对FFPE组织切片进行染色。扁桃体组织中的标记物表达以低放大倍率显示,放大的插入页显示标记物阳性的细胞(红色矩形)。 请点击此处下载此文件。
讨论
TME在癌症的发展、进展和治疗反应中起着至关重要的作用。此外,TME中特定肿瘤浸润淋巴细胞亚群的密度可以作为某些类型癌症的预后生物标志物。值得注意的是,除了TME的细胞组成外,肿瘤的空间特征还可以为理解肿瘤的生物学和识别潜在的预后生物标志物提供轮廓12,17。
由于许多免疫细胞群参与前癌或抗癌反应,更好地了解这些细胞及其彼此之间以及与癌细胞的空间关系将有助于指导新的免疫治疗策略的鉴定。以前的研究已经根据肿瘤内和肿瘤周围区域的组织结构以及肿瘤细胞的侵袭性边缘对TME细胞的位置和空间分布进行了分层18,19。在过去的15年中,技术进步使基于空间扩散的单个细胞的表型分析成为研究TME和对肿瘤免疫治疗的潜在生物标志物进行分类的新颖而有影响力的工具。多重IF组织化学可以同时估计多个生物标志物20。
与寡核苷酸偶联抗体策略类似,四种基于蛋白质的多重平台用于研究TME:显色原、荧光、DNA条形码和金属同位素标记的抗体检测系统。具有成本效益的显色IHC平台通过使用传统的明场显微镜实现全玻片可视化和病理评估。在多重IF和IHC中,使用与荧光团偶联的抗体。多重IF/IHC平台可检测具有高特异性的抗体,甚至可以在亚细胞水平上定量靶向抗体6,21。此外,由于显色原和荧光团的性质,使用一个抗体组合可以在一张载玻片上捕获多达10个生物标志物的表达。在基于金属同位素的平台上,金属标记抗体用于执行具有单细胞和空间分辨率的多重成像,以及对单个组织切片的高灵敏度22。从理论上讲,这些金属偶联抗体方法能够在单个组织切片上同时检测100多个生物标志物。同位素标记技术的一个挑战是同量异位干扰,它阻止了达到100%的富集纯度23。此外,干扰随着标记数量的增加而增加。DNA偶联抗体检测平台可识别用唯一DNA条形码标记的抗体。在这些平台上可以同时捕获40多种高特异性的生物标志物6。
多重成像是一种市售的 DNA 条形码标记抗体检测平台,用于一步将 DNA 偶联抗体应用于单个组织载玻片(图 8)。对于组织制备阶段,与需要使用从制造商处获得的镀金玻片的多重离子束成像平台不同,多重成像平台只需要常规的盖玻片或涂有0.1%聚-L-赖氨酸的载玻片,以帮助组织粘附在其上并在染色和成像过程中保持组织完整。建议在切片后 4 周内在盖玻片上使用组织切片,因为长期存放未染色的载玻片会导致抗原性降低。染色的盖玻片样品可以在4°C的储存缓冲液中保持长达2周,而不会丢失其染色信号。无需特殊设备即可储存盖玻片样品。多重成像系统已升级为使用常规载玻片代替盖玻片,从而可以对较大的组织进行染色并易于处理。当使用还原溶液进行抗体偶联(步骤3.2.3)时,反应应限制在不超过30分钟,以防止对抗体的损害。步骤5.6.6中的封闭缓冲液应新鲜制备,封闭缓冲液不得重复使用。
与显色、荧光和金属同位素标记的多重抗体检测平台相比,多重成像技术具有一定的优势。例如,市场上有60多种用于多重成像的预设计抗体组合,这有助于节省抗体偶联和验证的时间和成本,并且预先设计的抗体组合的数量正在增长。这些抗体包括癌标志物全细胞角蛋白、黑色素瘤标志物SOX10、血管标志物CD31、基质标志物SMA和许多免疫细胞标志物,已经过验证并做好实验准备。对于未预先设计的抗体,设计用于多重成像的市售偶联试剂盒简单易用。客户偶联的抗体在4°C下储存时可保存1年。 此外,捕获图像不需要机器预热。在这种多重成像技术中,图像采集中的迭代洗涤、杂交和剥离步骤很少导致标记物强度降低或组织形态退化5,24,25。此外,使用简单的三色荧光显微镜以QPTIFF格式捕获合成图像,并可以使用第三方数字分析软件上传和分析。染色标记物可以在单细胞分辨率下可视化,并且可以通过标记物的共定位来表征细胞表型(图6和图7)。对多路复用图像的综合分析进一步揭示了组织区室、单细胞标志物定量以及最近邻和邻近数据(图 8)。
多重图像分析的一个挑战是细胞类型鉴定。通常,当将更多单对象分类器应用于图像时,将注释更多不常见的表型。因此,建议使用不在同一分类器中共表达的已知标记,并仅将表型相关分类器应用于单个细胞的注释。细胞类型注释的变化将导致实质性不同的空间结果,例如细胞空间分布和细胞邻域分析的差异26,27。
多重图像分析已被证明可成功对多种样品类型进行染色和成像,包括FFPE组织、新鲜冷冻组织、存档的全玻片和组织微阵列。可以使用深度单细胞空间表型数据获取乳房、脑、肺、脾脏、肾脏、淋巴结和皮肤组织切片的多路复用图像 5,16,25,28。
未来,预计会有更多用于多重成像的预设计抗体。此外,非常需要开发用于多路复用图像分析的特定软件。目前,存在许多用于Hi-Plex图像分析的商用开源软件程序29,但科学家仍然需要帮助为这些分析创建标准工作流程30,31。尽管使用此协议捕获的合成图像与第三方软件兼容,但这可能会导致用户产生额外费用。多重成像技术的另一个缺点是,在用大抗体组合进行迭代洗涤、杂交和剥离后,核蛋白检测中的信号减少。幸运的是,在设计报告板时,通过在早期周期中检索条形码荧光团,可以最大限度地减少这种情况。最近,该平台升级了一个新的高速扫描系统,大大减少了获取合成图像的时间32。此外,据报道,一种使用酪胺偶联条形码的新策略可以增强寡核苷酸偶联抗体条形码的成像。该技术旨在放大难以获得条形码偶联抗体的染色信号33。
披露声明
作者没有需要披露的冲突。
致谢
作者感谢MD安德森研究医学图书馆编辑服务的Donald R. Norwood编辑本文以及MD安德森转化分子病理学系的多重IF和图像分析实验室。该项目得到了德克萨斯大学MD安德森癌症中心转化分子病理学系的转化分子病理学-免疫分析实验室(TMP-IL)登月平台和NCI合作协议U24CA224285(MD安德森癌症中心CIMAC)的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| 10x AR9 Buffer | Akoya Biosciences | AR900250ML | |
| 10x Buffer | Akoya Biosciences | 7000001 | |
| 16% paraformaldehyde | Thermo Fisher Scientific | 28906 | |
| 1X Antibody Diluent/Block | Akoya Biosciences | ARD1001EA | |
| Antibody Conjugation Kit | Akoya Biosciences | 7000009 | Contains Filter Blocking Solution, Antibody Reduction Solution 1, Antibody Reduction Solution 2, Conjugation Solution, Purification Solution, Antibody Storage Solution |
| Assay Reagent | Akoya Biosciences | 7000002 | |
| Diethyl pyrocarbonate | Sigma-Aldrich | 40718-25ML | |
| Dimethyl sulfoxide | Avantor/VWR | BDH1115-4LP | |
| Ethanol, 200 proof | |||
| G Blocker V2 | Akoya Biosciences | 240199 | |
| Histoclear | Thermo Fisher Scientific | 50-329-50 | |
| Methanol | Sigma-Aldrich | 34860-1L-R | |
| Milli-Q Integral 10 | Millipore | ZRXQ010WW | |
| Niknon Fluorescence microscope | Keyence Corp. of America | BZ-X810 | |
| Nuclear Stain | Akoya Biosciences | 7000003 | |
| Nuclease-free water | Thermo Fisher Scientific | AM9938 | |
| NuPAGE | Thermo Fisher Scientific | NP0008 | |
| PBS | Thermo Fisher Scientific | 14190136 | |
| PhenoCycler Barcodes/Reporters Combination | Akoya Biosciences | 5450004 (BX025/RX025) | |
| 5450003 (BX022/RX022) | |||
| 5450023 (BX002/RX002) | |||
| 5250002 (BX020/RX020) | |||
| 2520003 (BX023/RX023) | |||
| 5250005 (BX029/RX029) | |||
| 5250007 (BX035/RX035) | |||
| 5250012 (BX052/RX052) | |||
| 5550012 (BX030/RX030) | |||
| 5550015 (BX042/RX042) | |||
| 5550014 (BX036/RX036) | |||
| QuPath | Open-Source | https://qupath.github.io/ | |
| SimplyBlue SafeStain | Thermo Fisher Scientific | LC6065 | |
| Staining Kit | (Akoya Biosciences | 7000008 | Contains Hydration Buffer, N Blocker, J Blocker, S Blocker, Fixative Reagent, Storage Buffer |
参考文献
- Hanahan, D., Coussens, L. M. Accessories to the crime: Functions of cells recruited to the tumor microenvironment. Cancer Cell. 21 (3), 309-322 (2012).
- Labani-Motlagh, A., Ashja-Mahdavi, M., Loskog, A. The tumor microenvironment: A milieu hindering and obstructing antitumor immune responses. Frontiers in Immunology. 11, 940 (2020).
- Jin, M. Z., Jin, W. L. The updated landscape of tumor microenvironment and drug repurposing. Signal Transduction and Targeted Therapy. 5 (1), 166 (2020).
- Waldman, A. D., Fritz, J. M., Lenardo, M. J. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nature Reviews Immunology. 20 (11), 651-668 (2020).
- Black, S., et al. CODEX multiplexed tissue imaging with DNA-conjugated antibodies. Nature Protocols. 16 (8), 3802-3835 (2021).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Communications. 40 (4), 135-153 (2020).
- Radtke, A. J., et al. IBEX: A versatile multiplex optical imaging approach for deep phenotyping and spatial analysis of cells in complex tissues. Proceedings of the National Academy of Sciences of the United States of America. 117 (52), 33455-33465 (2020).
- Allam, M., Cai, S., Coskun, A. F. Multiplex bioimaging of single-cell spatial profiles for precision cancer diagnostics and therapeutics. NPJ Precision Oncology. 4, 11 (2020).
- Eng, J., et al. A framework for multiplex imaging optimization and reproducible analysis. Communications Biology. 5 (1), 438 (2022).
- Taube, J. M., et al. Multi-institutional TSA-amplified multiplexed immunofluorescence reproducibility evaluation (MITRE) study. Journal for Immunotherapy of Cancer. 9 (7), e002197 (2021).
- Binnewies, M., et al. Understanding the tumor immune microenvironment (TIME) for effective therapy. Nature Medicine. 24 (5), 541-550 (2018).
- Heindl, A., Nawaz, S., Yuan, Y. Mapping spatial heterogeneity in the tumor microenvironment: A new era for digital pathology. Laboratory Investigation. 95 (4), 377-384 (2015).
- Kuswanto, W., Nolan, G., Lu, G. Highly multiplexed spatial profiling with CODEX: bioinformatic analysis and application in human disease. Seminars in Immunopathology. 45 (1), 145-157 (2022).
- Phillips, D., et al. Immune cell topography predicts response to PD-1 blockade in cutaneous T cell lymphoma. Nature Communications. 12 (1), 6726 (2021).
- Jhaveri, N., et al. Deep ultrahigh-plex spatial phenotyping of human cancer tissues. Cancer Research. 82, 3877 (2022).
- Goltsev, Y., et al. Deep profiling of mouse splenic architecture with CODEX multiplexed imaging. Cell. 174 (4), 968-981 (2018).
- Yuan, Y. Spatial heterogeneity in the tumor microenvironment. Cold Spring Harbor Perspectives in Medicine. 6 (8), a026583 (2016).
- Bruck, O., et al. Spatial immunoprofiling of the intratumoral and peritumoral tissue of renal cell carcinoma patients. Modern Pathology. 34 (12), 2229-2241 (2021).
- Tsujikawa, T., et al. Prognostic significance of spatial immune profiles in human solid cancers. Cancer Science. 111 (10), 3426-3434 (2020).
- Hoyt, C. C. Multiplex immunofluorescence and multispectral imaging: forming the basis of a clinical test platform for immuno-oncology. Frontiers in Molecular Biosciences. 8, 674747 (2021).
- Parra, E. R., et al. Identification of distinct immune landscapes using an automated nine-color multiplex immunofluorescence staining panel and image analysis in paraffin tumor tissues. Scientific Reports. 11 (1), 4530 (2021).
- Elaldi, R., et al. High dimensional imaging mass cytometry panel to visualize the tumor immune microenvironment contexture. Frontiers in Immunology. 12, 666233 (2021).
- Campos Clemente, L., Shi, O., Rojas, F., Parra, E. R. Expanding the comprehension of the tumor microenvironment using mass spectrometry imaging of formalin-fixed and paraffin-embedded tissue samples. Journal of Visualized Experiments. (184), e64015 (2022).
- Schurch, C. M., et al. Coordinated cellular neighborhoods orchestrate antitumoral immunity at the colorectal cancer invasive front. Cell. 182 (5), 1341-1359 (2020).
- Phillips, D., et al. Highly multiplexed phenotyping of immunoregulatory proteins in the tumor microenvironment by CODEX tissue imaging. Frontiers in Immunology. 12, 687673 (2021).
- Hickey, J. W., Tan, Y., Nolan, G. P., Goltsev, Y. Strategies for accurate cell type identification in CODEX multiplexed imaging data. Frontiers in Immunology. 12, 727626 (2021).
- Parra, E. R. Methods to determine and analyze the cellular spatial distribution extracted from multiplex immunofluorescence data to understand the tumor microenvironment. Frontiers in Molecular Biosciences. 8, 668340 (2021).
- Tzoras, E., et al. Dissecting tumor-immune microenvironment in breast cancer at a spatial and multiplex resolution. Cancers. 14 (8), 1999 (2022).
- Francisco-Cruz, A., Parra, E. R., Tetzlaff, M. T. Wistuba, II. Multiplex immunofluorescence assays. Methods in Molecular Biology. 2055, 467-495 (2020).
- Shakya, R., Nguyen, T. H., Waterhouse, N., Khanna, R. Immune contexture analysis in immuno-oncology: applications and challenges of multiplex fluorescent immunohistochemistry. Clinical and Translational Immunology. 9 (10), e1183 (2020).
- Wilson, C. M., et al. Challenges and opportunities in the statistical analysis of multiplex immunofluorescence data. Cancers. 13 (12), 3031 (2021).
- DeRosa, J. Setting a new standard for spatial omics: An integrated multiomics approach: every single cell, two different analytes, one unbiased picture. Genetic Engineering & Biotechnology News. 42, 26-28 (2022).
- Simonson, P. D., Valencia, I., Patel, S. S. Tyramide-conjugated DNA barcodes enable signal amplification for multiparametric CODEX imaging. Communications Biology. 5 (1), 627 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。