A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف القائم على التلوين المناعي للتغيرات الديناميكية في بروتينات خلايا الدم الحمراء
In This Article
Summary
يشكل التقاط التغيرات الديناميكية في تنشيط البروتين لخلايا الدم الحمراء المنزوعة النواة تحديات منهجية ، مثل الحفاظ على التغييرات الديناميكية للمنبهات الحادة لتقييمها لاحقا. يصف البروتوكول المقدم تقنيات تحضير العينات وتلطيخها التي تمكن من حفظ وتحليل تغيرات البروتين ذات الصلة والكشف اللاحق.
Abstract
يعد وضع علامات الأجسام المضادة لبروتينات خلايا الدم الحمراء (RBC) طريقة شبه كمية شائعة الاستخدام للكشف عن التغيرات في محتوى البروتين الكلي أو التغيرات الحادة في حالات تنشيط البروتين. يسهل تقييم علاجات كرات الدم الحمراء ، وتوصيف الاختلافات في حالات مرضية معينة ، ووصف التماسك الخلوي. يتطلب الكشف عن تنشيط البروتين المتغير بشكل حاد (على سبيل المثال ، من خلال النقل الميكانيكي) إعدادا كافيا للعينة للحفاظ على تعديلات البروتين المؤقتة. يتضمن المبدأ الأساسي شل حركة مواقع الربط المستهدفة لبروتينات كرات الدم الحمراء المرغوبة لتمكين الارتباط الأولي لأجسام مضادة أولية محددة. تتم معالجة العينة أيضا لضمان الظروف المثلى لربط الجسم المضاد الثانوي بالجسم المضاد الأولي المقابل. يتطلب اختيار الأجسام المضادة الثانوية غير الفلورية علاجا إضافيا ، بما في ذلك اقتران البيوتين-أفيدين وتطبيق 3،3-ديامينوبنزيدين رباعي هيدروكلوريد (DAB) لتطوير التلوين ، والذي يجب التحكم فيه في الوقت الفعلي تحت المجهر من أجل وقف الأكسدة ، وبالتالي شدة التلوين ، في الوقت المحدد. للكشف عن شدة التلوين ، يتم التقاط الصور باستخدام مجهر ضوئي قياسي. في تعديل هذا البروتوكول ، يمكن تطبيق جسم مضاد ثانوي مقترن بالفلوريسئين بدلا من ذلك ، والذي يتميز بعدم الحاجة إلى مزيد من خطوات التطوير. ومع ذلك ، يتطلب هذا الإجراء هدفا مضانا متصلا بالمجهر للكشف عن التلطيخ. نظرا للطبيعة شبه الكمية لهذه الطرق ، من الضروري توفير العديد من بقع التحكم لحساب تفاعلات الأجسام المضادة غير المحددة وإشارات الخلفية. هنا ، نقدم كل من بروتوكولات التلوين والعمليات التحليلية المقابلة لمقارنة ومناقشة النتائج والمزايا الخاصة بتقنيات التلوين المختلفة.
Introduction
تجتاز خلايا الدم الحمراء (كرات الدم الحمراء) نظام القلب والأوعية الدموية لمدة 70 إلى 140 يوما ، بمتوسط عمر كرات الدم الحمراء حوالي 115 يوما 1,2. تتم إزالة كرات الدم الحمراء الهرمة أو التالفة من الدورة الدموية عن طريق كثرة البلعمة الحمراء ، وهي عملية تطهير فعالة مدفوعة بالبلاعم3. العمر المحدد مسبقا لهذه الخلايا هو أحد نتائج تسليم عضيات الخلية ، بما في ذلك النواة والميتوكوندريا والريبوسومات ، أثناء التمايز والنضج4. وبالتالي ، فإن كرات الدم الحمراء المتداولة خالية من آلية متعدية ، مما يحول دون تخليق بروتينات جديدة3. ويترتب على ذلك أن التعديلات الديناميكية اللاحقة للترجمة على البروتينات الموجودة تمثل الآلية الوحيدة القابلة للتطبيق للتنظيم الكيميائي الحيوي الحاد استجابة للضغوط خارج الخلية وداخل الخلايا التي تعمل على كرات الدمالحمراء 5.
يبدو أن القوى الميكانيكية هي إشارات رئيسية خارج الخلية تسبب تنشيط أو تعديل المسارات الكيميائية الحيوية داخل كرات الدم الحمراء. ألهم اكتشاف البروتين الحساس ميكانيكيا ، Piezo1 ، في أغشية كرات الدمالحمراء 6 عدة خطوط من الأبحاث التي تبحث في الإشارات التي يتم تنشيطها ميكانيكيا في هذه الخلايا7. على سبيل المثال ، أظهرت التطورات الحديثة أن الخصائص الفيزيائية لكرات الدم الحمراء يتم تنظيمها بنشاط من خلال التغيرات الحادة والديناميكية للبروتينات8 ، والتي تشمل الفسفرة بعد الترجمة والوجود في كل مكان9. نظرا لأن هذه التعديلات الطبيعية تختلف في بعض الأمراض9،10،11 ، يبدو أنه من الأهمية العلمية والسريرية تحديد حالة تنشيط بروتينات كرات الدم الحمراء ، وتحديدا فيما يتعلق بالعمليات الميكانيكية البيولوجية.
يطرح تحديد التغيرات الحادة في حالات تنشيط بروتين كرات الدم الحمراء بعض التحديات المنهجية. على سبيل المثال ، يتطلب تخزين عينات كرات الدم الحمراء لتحليلها لاحقا الحفاظ على بروتينات كرات الدم الحمراء المعدلة ، حيث أن التعديلات اللاحقة للترجمة غير دائمة. علاوة على ذلك ، من المعروف أن طرق الكشف عن البروتين الكلاسيكية (على سبيل المثال ، النشاف الغربي) يصعب توحيدها في كرات الدم الحمراء بسبب انخفاض وفرة البروتينات بالنسبة للهيموجلوبين ، والذي يمثل ~ 98٪ من محتوى البروتين في هذه الخلايا12. وبالتالي ، كان التلوين القائم على الأجسام المضادة لكرات الدم الحمراء المحفوظة كيميائيا هو الطريقة المفضلة عند التحقيق في التعديلات الحادة لبروتينات كرات الدم الحمراء المهمة ، مثل الشكل المتماثل الخاص بكرات الدم الحمراء لسينسيز أكسيد النيتريك (RBC-NOS)13,14. لقد ثبت أن RBC-NOS ينتج أكسيد النيتريك (NO) إنزيميا ، والذي يبدو أنه لا غنى عنه لخصائص كرات الدم الحمراء الأساسية ، بما في ذلك تشوه كرات الدم الحمراء15،16،17. تنظم التعديلات اللاحقة للترجمة ل RBC-NOS نشاط الإنزيم التحفيزي ، مع وصف فسفرة بقايا سيرين 1177 لزيادة نشاط الإنزيم ، بينما تم ربط فسفرة بقايا سيرين 114 أو ثريونين 495 بانخفاض نشاط كرات الدم الحمراء18,19.
بشكل جماعي ، تساهم التعديلات المؤقتة لبروتينات كرات الدم الحمراء في وظيفة خلوية مهمة ، والبروتوكولات الموحدة التي تمكن من اكتشاف هذه البروتينات المعدلة ذات قيمة عالية. هنا ، نقدم بروتوكولين متميزين يستغلان أجساما مضادة محددة لتسهيل الكشف عن تنشيط بروتين RBC-NOS ، ونناقش توصيات لتحليل البيانات وتفسيرها.
تم تقييم أداء البروتوكولات الموصوفة من خلال قياس الزيادة المبلغ عنها جيدا في فسفرة كرات الدم الحمراء - NOS في بقايا سيرين 1177 استجابة للقوى الميكانيكية العاكسة لتلك التي تحدث داخل الأوعية الدموية البشرية (5 باسكال).
Protocol
تتوافق البروتوكولات الموضحة هنا مع إعلان هلسنكي وتمت الموافقة عليها من قبل لجان الأخلاقيات في جامعة كولونيا الرياضية الألمانية (9/16/2013) وجامعة جريفيث (2019/808). تم فحص المتطوعين للتأكد من عدم وجود أمراض ذات صلة وقدموا موافقة خطية مستنيرة.
1. تلطيخ بروتينات كرات الدم الحمراء باستخدام بروتوكولات الكيمياء الهيستولوجية المناعية
ملاحظة: ترد قائمة مفصلة بالمواد الكيميائية والمواد المطلوبة في جدول المواد. تصف الأقسام التالية إعداد الحلول المطلوبة ، متبوعة بوصف تفصيلي لبروتوكول الكيمياء الهيستولوجية المناعية (الشكل 1).
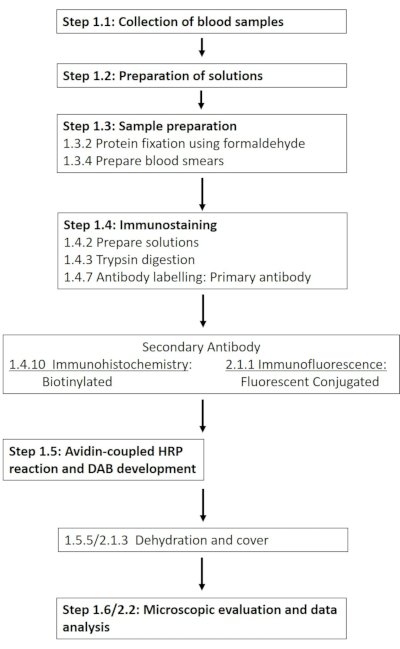
الشكل 1: رسم تخطيطي للخطوات الفردية المطلوبة للتلطيخ المناعي الكيميائي والتألق المناعي ل RBC-NOS في موقع الفسفرة 1177. يتم تقديم سير عمل نموذجي للبروتوكولات المقدمة يمتد من إعداد المحلول وأخذ عينات الدم إلى الكشف والتصور القائم على الأجسام المضادة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- جمع عينة الدم
- الحصول على عينات الدم (10 مل من الدم الكامل) من سبعة ذكور أصحاء. كان المتطوعون أفرادا أصحاء يقال إنهم خاليون من أمراض القلب والأوعية الدموية أو أمراض الدم أو الأعصاب أو الغدد الصماء أو التمثيل الغذائي. وكان المتطوعون أيضا من غير المدخنين.
- جمع الدم باستخدام إبرة معقمة وحقنة من الوريد البارز في المنطقة الأمامية للساعد ، ونقلها على الفور إلى أنابيب مغلفة بأحد مضادات التخثر التالية: هيبارين الصوديوم (للكيمياء المناعية) أو حمض الإيثيلين ديامينيترايتيك (EDTA ؛ لوضع العلامات الفلورية).
- تعريض عينات الدم المضادة للتخثر لقوى ميكانيكية يتم التحكم فيها بدقة باستخدام نظام قص من نوع Couette ، كما هو موضح قبل7،20.
- يتكون جهاز القص من كوب قابل للدوران وبوب ثابت ، مفصول بفجوة 300 ميكرومتر. انقل عينة الدم إلى الفجوة ، مما يتسبب في سرعة دوران الكوب التي يمكن التحكم فيها بدقة لممارسة قوى ميكانيكية يتم التحكم فيها جيدا على العينة. تم إنتاج البيانات التمثيلية المقدمة هنا من خلال تطبيق قوى ميكانيكية تعكس تلك التي تحدث داخل الأوعية الدموية البشرية (5 باسكال) لفترات طويلة (300 ثانية).
- إعداد الحلول اللازمة للتلطيخ المناعي
- قم بإعداد الحلول كما في الجدول 1. يمكن تحضير المحاليل قبل إجراء التلوين المناعي وتخزينها في درجة حرارة معينة لحين الحاجة.
ملاحظة: قد تختلف مدة التخزين بين المواد الكيميائية. تحقق من ورقة بيانات سلامة المواد.
- قم بإعداد الحلول كما في الجدول 1. يمكن تحضير المحاليل قبل إجراء التلوين المناعي وتخزينها في درجة حرارة معينة لحين الحاجة.
- إعداد العينة
- معالجة الدم الكامل مباشرة بعد الانسحاب أو العلاج التجريبي (عند الاقتضاء ؛ على سبيل المثال ، التحفيز الميكانيكي في عيناتنا ؛ انظر الخطوة 1.1.3) لتكون قادرا على اكتشاف الآثار قصيرة العمر ، على سبيل المثال بعد تطبيق إجهاد القص ، وممارسة الرياضة ، والتعرض لنقص الأكسجة قصير المدة ، إلخ.
- قم بإجراء تثبيت بروتين كرات الدم الحمراء باستخدام الفورمالديهايد على النحو التالي: تمييع الدم الكامل بنسبة 1: 2 في محلول بارافورمالدهايد 4٪ لمدة 20 دقيقة في درجة حرارة الغرفة (RT). أجهزة الطرد المركزي العينة في 132 × غرام لمدة 3 دقائق في RT وإزالة بعناية طاف عن طريق ماصة.
- أعد تعليق حبيبات كرات الدم الحمراء في مجلدين من محلول ملحي مخزن بالفوسفات 0.1 مول / لتر (PBS) (تخفيف 1: 3) واحتضانه لمدة 5 دقائق في RT. كرر الطرد المركزي كما هو موضح أعلاه وقم بإزالة المادة الطافية ، والتي يجب أن تكون واضحة ، عن طريق الماصة. أعد تعليق حبيبات كرات الدم الحمراء في حجم واحد من 0.1 مول / لتر PBS (تخفيف 1: 2).
- تحضير مسحات الدم على النحو التالي: قم بتسمية شريحة مجهر بمعرف العينة ، والجسم المضاد المطبق ، وما إلى ذلك باستخدام قلم مقاوم للكحول (على سبيل المثال ، قلم رصاص). ثم أضف 10 ميكرولتر من محلول كرات الدم الحمراء المحضر أعلى حقل الملصق مباشرة.
- ضع شريحة ثانية على العينة بزاوية 45 درجة تقريبا وقم بتفريق العينة بالتساوي على طول الشريحة. ثبت الشريحة بالحرارة فوق موقد بنسن عن طريق تحريك العينة فوق الموقد بحركة مستمرة لمدة 5-7 ثوان.
ملاحظة: يوصى بتجفيف العينات بالهواء قبل التثبيت الحراري. يمكن تخزين العينات في RT حتى تلطيخ (الشكل 2).
- تلطيخ الكيمياء المناعية
- ضع علامة على منطقتين على كل شريحة: منطقة اختبار يتم فيها تحضين كرات الدم الحمراء بالجسم المضاد الأولي والثانوي المعني ، ومنطقة تحكم يتم فيها استبدال الجسم المضاد الأساسي بمحلول تحكم. تعمل هذه المنطقة كعنصر تحكم داخل الفحص لتحديد إشارة الخلفية لكرات الدم الحمراء.
- قم بإعداد الحلول قبل أو أثناء الإجراء ، وفقا للجدول 2. هناك حاجة إلى حجم 300 ميكرولتر لكل منطقة اختبار و 200 ميكرولتر لكل منطقة تحكم.
ملاحظة: من المهم ملاحظة أن إجراءات التلوين القائمة على الأجسام المضادة هذه تنتج بيانات شبه كمية وليست كمية. وبالتالي ، لضمان إمكانية استخلاص استنتاجات ذات مغزى من البيانات المنتجة ، هناك حاجة ماسة إلى عينات مراقبة مناسبة (أي لتوفير نقطة مرجعية للتغيرات النسبية المقدرة في تنشيط البروتين). - لهضم التربسين ، قم بإذابة 0.1٪ من التربسين وتوازن مع RT. حدد منطقتين في كل شريحة باستخدام قلم شحم: منطقة اختبار (2/3 من الشريحة) ومنطقة تحكم (1/3 من الشريحة). ضع محلول ملحي مخزن (TBS) بعناية باستخدام ماصات النقل لغسل مناطق العينة. دع TBS يجلس لمدة 30 ثانية ثم اسكبه. كرر خطوة الغسيل.
ملاحظة: أضف الحلول التالية إلى كل من عنصر التحكم ومنطقة الاختبار، ما لم يتم وصف خلاف ذلك. يجب تغطية المناطق بشكل كاف بالحل المعني. قم بتطبيق الحلول باستخدام ماصات نقل يمكن التخلص منها ، وقم بتبديل الماصات بعد كل محلول. - أضف 0.1٪ من التربسين ، وقم بتغطية الشرائح باستخدام غرفة حضانة مصممة لهذا الغرض إما بغطاء أو ورق ألومنيوم ، واحتضانها لمدة 30 دقيقة عند 37 درجة مئوية في حاضنة. بعد الحضانة ، أوقف تفاعل الإنزيم بإضافة ماء الصنبور. اسكب الحل. اغسل كلتا المنطقتين 3x باستخدام TBS ، كما هو موضح أعلاه.
- لمنع تنشيط البيروكسيديز ، أضف محلول الميثانول واحتضانه لمدة 30 دقيقة في RT. قم بتغطية الشرائح خلال ذلك الوقت. اسكب الحل.
ملاحظة: للكشف عن التألق المناعي (القسم 2) ، قد يتم حذف هذه الخطوة ، نظرا لأن حجب البيروكسيديز الداخلي يعمل على منع الإشارة الاصطناعية الناتجة عن الكشف باستخدام بيروكسيديز الفجل (HRP) و 3،3′-ديامينوبنزيدين هيدرات (DAB). - اغسل كلتا المنطقتين 3x باستخدام TBS ، كما هو موضح في الخطوة 1.4.3. أضف 3٪ من محلول الحليب الخالي من الدسم واحتضنه لمدة 30 دقيقة في RT للحظر. اسكب الحل. لا تغسل بعد ذلك.
- أضف الجسم المضاد الأولي (AB) فقط إلى منطقة الاختبار. أضف حل التحكم AB (انظر الجدول 2) إلى منطقة التحكم. احتضان العينات عند 4 درجات مئوية طوال الليل. قم بتغطية الشرائح خلال ذلك الوقت لمنع الجفاف.
ملاحظة: تجنب نقل الحلول من الاختبار إلى منطقة التحكم ، حيث سيؤثر ذلك على قيم التحكم. - اسكب محلول الأجسام المضادة. اغسل كلتا المنطقتين 3x باستخدام TBS ، كما هو موضح في الخطوة 1.4.3.
- قم بتنفيذ خطوة حظر لمنع الربط غير المحدد. أضف 3٪ مصل الماعز العادي واحتضانه لمدة 30 دقيقة في RT. اسكب المحلول.
- أضف محلول الأجسام المضادة الثانوي واحتضانه لمدة 30 دقيقة في RT. اسكب محلول الأجسام المضادة. اغسل المناطق 3x باستخدام TBS ، كما هو موضح في الخطوة 1.4.3.
- تطوير تلطيخ والغطاء
- نفذ تفاعل HRP المقترن بالأفيدين (انظر التخفيف في الجدول 2) عن طريق إضافة محلول أفيدين بيروكسيديز المخفف والحضانة لمدة 30 دقيقة في RT. اسكب المحلول.
- تحضير خليط DAB لتطوير التلوين المناعي قبل الاستخدام ، كما هو موضح في الجدول 3.
تنبيه: DAB خطير. ضع في اعتبارك عبارات الخطر H341 (يشتبه في تسببها في عيوب وراثية) و H350 (قد يسبب السرطان). ضع في اعتبارك البيانات التحذيرية التالية: P201 و P202 و P280 و P308 + P313 و P405 و P501. - قم بإجراء تلطيخ التحكم في DAB على النحو التالي: اجمع محلول HRP من الخطوة 1.5.1 من شريحة واخلطه بحجم صغير (على سبيل المثال ، 1 مل) من محلول DAB المحضر في أنبوب طرد مركزي منفصل قبل التلطيخ. يجب أن يتطور الخليط إلى اللون البني / الرمادي.
- ضع الشرائح تحت المجهر (تكبير 200x على الأقل) وأضف حل DAB إلى كلا المنطقتين. راقب تلطيخ كرات الدم الحمراء بشكل مستمر وأوقف تلطيخها عن طريق إزالة محلول DAB باستخدام ماصة يمكن التخلص منها قبل أن تبدأ الخلفية في التلوين. بالنسبة لتلطيخ RBC-NOS serine 1177 ، يكون وقت حضانة DAB حوالي 17 دقيقة.
- أداء عينة الجفاف. ضع الشرائح في رف زجاجي وانغمس لمدة 5 ثوان في محاليل الإيثانول ذات التخفيفات المختلفة ، بدءا من 70٪ ، تليها 96٪ ، ثم 100٪ ، وأخيرا في زيلول. قم بإزالة الشرائح من الرف وضعها على منديل ، مع كرات الدم الحمراء في الأعلى لامتصاص السائل الزائد.
- أضف قطرتين أو ثلاث قطرات من وسيط التثبيت في جميع أنحاء الشريحة. قم بتغطية الشريحة باستخدام قسيمة غطاء. تجنب إدراج فقاعات الهواء ، لأن هذا يعيق التقييم المجهري. جفف العينات طوال الليل على الأقل في غطاء الدخان.
- إجراء التقييم المجهري
- للتصور والتصوير ، ضع الشرائح في مجهر الضوء المرسل بتكبير لا يقل عن 200x. تأكد من أن المجهر مقترن بكاميرا لالتقاط صور لكرات الدم الحمراء الملطخة.
- قم بتشغيل مصدر ضوء المجهر. قم بتشغيل الكاميرا المرفقة بالمجهر وابدأ تشغيل برنامج التحكم في المجهر. استخدم مجهر برايت فيلد لتحديد التركيز المناسب عن طريق تدوير مقابض ضبط التركيز البؤري الخشنة والدقيقة وإيجاد مستوى التركيز حيث تكون كرات الدم الحمراء مرئية.
- قم بتعيين قيم الخلفية للصور إلى 220 ± 5 قيم رمادية ، تم قياسها على ثلاث مناطق خالية من الخلايا في الشريحة. للقيام بذلك ، افتح الصورة الأولى باستخدام برنامج ImageJ المتاح مجانا. حدد الخيار يعني القيم الرمادية باستخدام اللوحة ضبط القياسات. استخدم الأيقونة البيضاوية لقياس القيمة الرمادية باستخدام أمر القياس . إذا كانت القيم المقاسة خارج النطاق ، فاضبط ضوء الخلفية عند المجهر وفقا لذلك. كرر هذه الخطوات حتى تصبح قيم الخلفية صحيحة.
ملاحظة: يجب أن تكون قيم الخلفية هذه ضمن النطاق المحدد لجميع الصور التي تم التقاطها. خلاف ذلك ، البيانات غير قابلة للمقارنة. - لتحليل القيمة الرمادية RBC ، حدد حافة كل RBC باستخدام أداة التحديد البيضاوي داخل برنامج ImageJ. حدد القيم الرمادية لكرات الدم الحمراء الفردية باستخدام أمر القياس . قم بقياس القيم الرمادية لما لا يقل عن 50 كرات الدم الحمراء من الاختبار وما لا يقل عن 10 كرات الدم الحمراء من منطقة التحكم.
ملاحظة: يمكن تعديل العدد الإجمالي لكرات الدم الحمراء التي تم تحليلها بشكل فردي. كلما زاد تحليل كرات الدم الحمراء ، زادت أهمية النتيجة. ومع ذلك ، يجب أن يكون العدد الإجمالي لكرات الدم الحمراء التي تم تحليلها قابلا للمقارنة لكل حالة أو موضوع أو ما إلى ذلك في تجربة معينة.- تجنب تحليل كرات الدم الحمراء بالقرب من قلم الشحوم ، لأن التلوين قد يكون غير مكتمل في هذه المنطقة. تجنب تحليل كرات الدم الحمراء المتداخلة ، لأن هذا يؤثر على شدة التلطيخ. استخدم فقط كرات الدم الحمراء المنفصلة عن كرات الدم الحمراء الأخرى. قم بتحليل خمس صور على الأقل من الاختبار وصورتين على الأقل من منطقة التحكم لتقييم كرات الدم الحمراء 50/10. قم بتضمين كرات الدم الحمراء من كل صورة في التحليل النهائي.
- لحساب شدة التلوين ، احسب الإشارات النهائية على النحو التالي:
(منطقة الاختبار الفردية RBC - متوسط خلفية منطقة الاختبار) - (منطقة التحكم الفردية RBC - متوسط خلفية منطقة التحكم)

الشكل 2: تصوير عملية التثبيت وتوليد لطاخة الدم. (تم إنشاء المخطط باستخدام BioRender.com.) يتم تثبيت عينات الدم المخففة كيميائيا في بارافورمالدهيد ، ثم يتم طردها وغسلها بمحلول ملحي مخزن بالفوسفات. أخيرا ، يتم تلطيخ الدم المعاد تعليقه على شريحة زجاجية ويتم تثبيته حراريا عن طريق التحليق فوق لهب موقد بنسن. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: ظروف التحضير والتخزين للحلول اللازمة للتلطيخ المناعي الكيميائي. يمكن تحضير الحل قبل البروتوكول. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 2: وصف محاليل الأجسام المضادة للاستخدام الفوري. الرجاء الضغط هنا لتنزيل هذا الجدول.
الجدول 3: المكونات والبروتوكول لإعداد حل DAB للاستخدام الفوري. الرجاء الضغط هنا لتنزيل هذا الجدول.
2. وضع العلامات الفلورية لبروتينات كرات الدم الحمراء
ملاحظة: يوضح القسم التالي تكييف البروتوكول الكيميائي المناعي ، الذي تم تطويره بهدف تمكين استخدام الأجسام المضادة مع اتحادات الفلورسنت (الشكل 1).
يتطابق تحضير عينة الدم لبروتوكول التألق المناعي مع ما هو موضح في القسم 1 ، لذلك يبدأ القسم التالي من تلطيخ العينات.
- تلطيخ المناعي
- احتضان الجسم المضاد الفلوري المترافق الثانوي (للحجم ، انظر الخطوة 1.4.2) لمدة 30 دقيقة في RT محمي من الضوء ، باستخدام إما غرفة حضانة مصممة لهذا الغرض أو رقائق الألومنيوم.
- اسكب محلول الأجسام المضادة الثانوي واغسل العينات 3x باستخدام TBS. اترك الغسيل النهائي على العينات لمنعها من الجفاف.
- اسكب TBS وقم بإزالة العينات من رف العينات واحدة تلو الأخرى لمنع التعرض للضوء لفترة طويلة. لتجفيف العينات ، قم بتعريض الشرائح لمحاليل الإيثانول المختلفة ل ~ 5 s لكل منها ، بدءا من 70٪ ، تليها 90٪ ، وأخيرا 100٪. قم بتعريض الشرائح لمحلول زيلول / زيلين لمدة 5 ثوان.
- قم بإعداد قسيمة غطاء مع قطرتين أو ثلاث قطرات من وسيط التثبيت ثم قم بتركيب الشريحة باستخدام غطاء الغطاء. تأكد من التوزيع المتساوي لوسط التثبيت عن طريق تطبيق ضغط خفيف باستخدام ملاقط أو أداة معدنية معقمة مماثلة. تخلص من فقاعات الهواء ، التي قد تتداخل مع التصوير ، بنفس الأداة. اترك العينات لتجف طوال الليل في مكان مظلم وجاف.
- التقييم المجهري
- للتصور والتصوير ، ضع الشريحة على مرحلة المجهر بتكبير إجمالي لا يقل عن 400x. قم بتشغيل مصدر ضوء المجهر ومصدر ضوء الفلورسنت ، مما يضمن ضبط مصدر ضوء الفلورسنت على أقصى شدة.
- قم بتشغيل الكاميرا المرفقة بالمجهر وابدأ تشغيل برنامج التحكم في المجهر. استخدم مجهر برايت فيلد لتحديد التركيز المناسب عن طريق تدوير مقابض ضبط التركيز البؤري الخشنة والدقيقة ، وإيجاد مستوى التركيز حيث تكون كرات الدم الحمراء مرئية.
ملاحظة: قد يؤدي التعرض المفرط للضوء إلى التبييض الضوئي لاتحادات الفلورسنت. يمكن للمرء استخدام شريحة من تجربة سابقة لهذا الغرض ، لتقليل التعرض للضوء للشرائح التي لم يتم تحليلها بعد. - تحديد كثافة الليزر المثلى عن طريق فحص كرات الدم الحمراء في منطقة التحكم. تأكد من أن الكثافة عالية بما يكفي بحيث تكون كرات الدم الحمراء مرئية ، مع عدم إنتاج إشارة خلفية كبيرة. حافظ على اتساق الكثافة ووقت التعرض بين المناطق والعينات لضمان إمكانية المقارنة.
- التقط صورا ساطعة وفلورية في ثلاث مناطق متميزة على الأقل من منطقة اختبار الشريحة ، تم اختيارها عشوائيا. لتحديد منطقة، قم بالتحريك بعيدا عن حواف الشريحة التي تم تمييزها بواسطة قلم الدهون، باستخدام عناصر التحكم في مرحلة المجهر. حدد مساحة تعرض توزيعا موحدا لطبقة RBC مفردة.
- اضبط وقت التعرض على 1 ثانية لصور الفلورسنت والتقط صورة باستخدام عناصر التحكم في البرنامج الخاصة ببرنامج التحكم في المجهر. قم بالتبديل إلى وضع برايتفيلد ، واضبط وقت التعرض على "تلقائي" ، والتقط صورة برايت فيلد المقابلة.
- التقط صورا ساطعة وفلورية في منطقتين متميزتين على الأقل تم اختيارهما عشوائيا من منطقة التحكم في الشريحة بتكرار الخطوة 2.2.3.
- احفظ الصور بتنسيق .tif للحفاظ على القيم الرمادية الأصلية للبكسل ، ومنع الضغط ، وحمل البيانات الوصفية للاكتساب.
- قم بقياس القيم الرمادية لكرات الدم الحمراء الملتقطة. افتح ImageJ (أو FIJI21 ؛ انظر الملف التكميلي 1). تحديد القيم الرمادية لكرات الدم الحمراء الفردية. تحقيقا لهذه الغاية ، قم بتمييز كل خلية على حدة باستخدام أداة التحديد البيضاوي ، وقم بالتحليل باستخدام أمر القياس .
ملاحظة: لا ينبغي تحليل كرات الدم الحمراء إذا تداخلت مع خلايا أخرى ، لأن هذا قد يزيد من الإشارة الناتجة. - قم بتمييز ما بين ثلاث وخمس مناطق خالية من كرات الدم الحمراء وحدد القيم الرمادية لتوفير مقياس لإشارة الخلفية. قم بتحليل ما لا يقل عن 150 كرات الدم الحمراء من ثلاث صور مميزة على الأقل لكل منطقة اختبار ، وما لا يقل عن 50 كرات الدم الحمراء من صورتين متميزتين على الأقل لكل منطقة تحكم.
ملاحظة: قد ينصح بتحليل المزيد من الخلايا / المناطق لتقليل التباين. بالنظر إلى أن مجموعة كرات الدم الحمراء غير متجانسة بطبيعتها ، فقد يكون تباين الخلايا الخلوية في الإشارة كبيرا ، اعتمادا على البروتين محل الاهتمام. - إجراء تحليل بيانات بديل للصور الملتقطة باستخدام أمر الماكرو. قم بإنشاء / تثبيت أمر ماكرو من خلال إصدار FIJI من ImageJ للتحديد التلقائي وتصحيح الخلفية وتحليل القيمة الرمادية لصورة معينة.
ملاحظة: يستخدم هذا الروتين عتبة تلقائية للكشف عن الخلايا الموجودة في صورة معينة باستخدام نسخة من الصورة الأصلية ، مما ينتج تراكبا مفروضا على الصورة الأصلية لاستخراج القيم الرمادية لكرات الدم الحمراء الفلورية. يتم إيداع الماكرو كملف .ijm ، كملف ترميز تكميلي 1. - افتح ملف الصورة بتنسيق .tif جاهز للتحليل في فيجي. افتح ماكرو RBC fluorescence.ijm (ملف الترميز التكميلي 1) وانقر فوق تشغيل.
ملاحظة: تم إعداد الماكرو للصور التي تم الحصول عليها بتكبير 600x ونسبة إشارة إلى ضوضاء كبيرة. يجب مراجعة الاختيار التلقائي للخلايا من قبل المحقق.
- احسب الإشارات النهائية على النحو التالي:
(منطقة الاختبار RBC - خلفية منطقة الاختبار) - (منطقة التحكم RBC - خلفية منطقة التحكم) للتحليل اليدوي ؛
(منطقة الاختبار - منطقة التحكم) للتحليل الآلي.
النتائج
تم اختبار البروتوكول المقدم ، الذي يصف الطرق التي تسهل الكشف عن التغيرات الحادة في بروتينات كرات الدم الحمراء ، على تغيير بروتين حساس ميكانيكيا معروف: فسفرة RBC-NOS في بقايا سيرين 1177. تم الحصول على الدم الكامل من متطوعين أصحاء ثم تم تقسيمه لاحقا إلى حصتين منفصلتين. تعرضت عينة دم معينة لإجهاد ا...
Discussion
تشير الأدبيات الحديثة بشدة إلى أن بروتين RBC-NOS له أهمية حاسمة لتنظيم تشوه كرات الدم الحمراء15،22،23 ، والذي بدوره يسهل مرورها عبر الشعيرات الدمويةالضيقة 24. يعتمد نشاط البروتين بشكل كبير على تعديلات البروتين بعد الترجمة ، وخاصة ?...
Disclosures
كشف جميع المؤلفين أنه لا يوجد تضارب في المصالح.
Acknowledgements
تقر LK بدعم منحة برنامج التدريب البحثي للحكومة الأسترالية.
Materials
| Name | Company | Catalog Number | Comments |
| 3,3′-Diaminobenzidin -tetrahydrochloride Hydrate | Sigma/Merck | D5637 | DAB |
| Ammoniumchloride | Merck /Millipore | 101145 | NH4Cl |
| Centrifuge 5427 R | Eppendorf | 5409000010 | |
| Coverslips | VWR | 631-0147 | |
| di-sodium Hydrogen Phosphate Dihydrate | Merck /Millipore | 106580 | Na2HPO4. 2 H2O |
| Disposable transfer pipettes | VWR | 612-6803 | |
| Entellan | Merck /Millipore | 107961 | rapid mounting medium for microscopy |
| Ethanol denaturated using 1 % methyl ethyl ketone (MEK) | Hofmann | 642 | |
| Glucose-Oxidase | Sigma/Merck | G2133 | |
| Grease pencil | Dako | S 2002 | |
| Horse-radish peroxidase/ExtrAvidin−Peroxidase | Sigma/Merck | E-2886 | HRP |
| Hydrochloric acid | Merck /Millipore | 109057 | HCl |
| Hydrogen peroxide, 30% | Merck /Millipore | 107203 | H2O2 |
| ImageJ Software | Freeware | ||
| Laser-assisted optical rotational cell analyser (LORCA) | RR Mechatronics | Ektacytometer instrument used for shearing | |
| Methanol | Merck /Millipore | 106009 | |
| Microscope slides | VWR | 630-1985 | |
| Nickel(II)-sulfate Hexahydrate | Sigma/Merck | N4882 | NiSO4.6H2O |
| Normal Goat serum | Agilent/DAKO | X0907 | NGS |
| Paraformaldehyde | Merck /Millipore | 818715 | PFA |
| Pipettes Eppendorf Reference 2 | VWR | 613-5836/ 613-5839 | |
| Rabbit Anti-phospho eNOS Antibody (Ser1177) | Merck/Millipore | 07-428-I | Primary Antibody |
| Reaction tubes, 2ml | Eppendorf | 30120094 | |
| Secondary Antibody goat anti rabbit | Agilent/DAKO | E0432 | Secondary Antibody |
| Skim milk powder | Bio-Rad | 170-6404 | |
| Sodium chloride | Merck /Millipore | 106404 | NaCl |
| Sodium Dihydrogen Phosphate Monohydrate | Merck /Millipore | 106346 | NaH2PO4.H2O |
| Sodium hydroxide, 1 M | Merck /Millipore | 150706 | NaOH |
| Tris(hydroxymethyl)-aminomethane | Merck /Millipore | 108382 | Tris |
| Trypsin | Sigma/Merck | T7409 | |
| Tween20 | Merck /Millipore | 822184 | |
| Whatman Glas microfiber filter, quality GF/F | Merck /Millipore | WHA1825047 | |
| Xylol | VWR Chemicals | 2,89,73,465 | |
| ß-D-Glucose monohydrate | Merck /Millipore | 14431-43-7 |
References
- Cohen, R. M., et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood. 112 (10), 4284-4291 (2008).
- Mock, D. M., et al. Red blood cell (RBC) survival determined in humans using RBCs labeled at multiple biotin densities. Transfusion. 51 (5), 1047-1057 (2011).
- Thiagarajan, P., Parker, C. J., Prchal, J. T. How do red blood cells die?. Frontiers in Physiology. 12, 655393 (2021).
- Moras, M., Lefevre, S. D., Ostuni, M. A. From erythroblasts to mature red blood cells: organelle clearance in mammals. Frontiers in Physiology. 8, 1076 (2017).
- Pretini, V., et al. Red blood cells: chasing interactions. Frontiers in Physiology. 10, 945 (2019).
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Kuck, L., Peart, J. N., Simmonds, M. J. Piezo1 regulates shear-dependent nitric oxide production in human erythrocytes. American Journal of Physiology. Heart and Circulatory Physiology. 323 (1), H24-H37 (2022).
- Kuck, L., Peart, J. N., Simmonds, M. J. Active modulation of human erythrocyte mechanics. American Journal of Physiology. Cell Physiology. 319 (2), C250-C257 (2020).
- Strader, M. B., et al. Post-translational modification as a response to cellular stress induced by hemoglobin oxidation in sickle cell disease. Scientific Reports. 10 (1), 14218 (2020).
- Pecankova, K., Majek, P., Cermak, J., Dyr, J. E. Posttranslational modifications of red blood cell ghost proteins as "signatures" for distinguishing between low- and high-risk myelodysplastic syndrome patients. Turkish Journal of Haematology. 34 (1), 111-113 (2017).
- Grau, M., et al. High red blood cell nitric oxide synthase activation is not associated with improved vascular function and red blood cell deformability in sickle cell anaemia. British Journal of Haematology. 168 (5), 728-736 (2015).
- Sae-Lee, W., et al. The protein organization of a red blood cell. Cell Reports. 40 (3), 111103 (2022).
- Suhr, F., et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982 (2012).
- Kuck, L., Grau, M., Bloch, W., Simmonds, M. J. Shear stress ameliorates superoxide impairment to erythrocyte deformability with concurrent nitric oxide synthase activation. Frontiers in Physiology. 10, 36 (2019).
- Grau, M., et al. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759 (2013).
- Simmonds, M. J., Detterich, J. A., Connes, P. Nitric oxide, vasodilation and the red blood cell. Biorheology. 51 (2-3), 121-134 (2014).
- Bor-Kucukatay, M., Wenby, R. B., Meiselman, H. J., Baskurt, O. K. Effects of nitric oxide on red blood cell deformability. American Journal of Physiology. Heart and Circulatory Physiology. 284 (5), H1577-H1584 (2003).
- Suhr, F., et al. Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes. Nitric Oxide: Biology and Chemistry. 20 (2), 95-103 (2009).
- Grau, M., et al. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clinical Hemorheology and Microcirculation. 63 (3), 199-215 (2016).
- Grau, M., Kuck, L., Dietz, T., Bloch, W., Simmonds, M. J. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology. 10 (1), 47 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ozüyaman, B., Grau, M., Kelm, M., Merx, M. W., Kleinbongard, P. RBC NOS: regulatory mechanisms and therapeutic aspects. Trends in Molecular Medicine. 14 (7), 314-322 (2008).
- Kleinbongard, P., et al. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943-2951 (2006).
- McMahon, T. J. Red blood cell deformability, vasoactive mediators, and adhesion. Frontiers in Physiology. 10, 1417 (2019).
- Bizjak, D. A., Brinkmann, C., Bloch, W., Grau, M. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: a study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS One. 10 (4), 0125206 (2015).
- Di Pietro, N., et al. Nitric oxide synthetic pathway and cGMP levels are altered in red blood cells from end-stage renal disease patients. Molecular and Cellular Biochemistry. 417 (1-2), 155-167 (2016).
- Grau, M., et al. Even patients with mild COVID-19 symptoms after SARS-CoV-2 infection show prolonged altered red blood cell morphology and rheological parameters. Journal of Cellular and Molecular Medicine. 26 (10), 3022-3030 (2022).
- Mozar, A., et al. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clinical Hemorheology and Microcirculation. 64 (1), 47-53 (2016).
- Ulker, P., Gunduz, F., Meiselman, H. J., Baskurt, O. K. Nitric oxide generated by red blood cells following exposure to shear stress dilates isolated small mesenteric arteries under hypoxic conditions. Clinical Hemorheology and Microcirculation. 54 (4), 357-369 (2013).
- Nader, E., et al. Hydroxyurea therapy modulates sickle cell anemia red blood cell physiology: Impact on RBC deformability, oxidative stress, nitrite levels and nitric oxide synthase signalling pathway. Nitric Oxide: Biology and Chemistry. 81, 28-35 (2018).
- Fischer, U. M., Schindler, R., Brixius, K., Mehlhorn, U., Bloch, W. Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes. The Annals of Thoracic Surgery. 84 (6), 2000-2003 (2007).
- Horobin, J. T., Sabapathy, S., Kuck, L., Simmonds, M. J. Shear stress and RBC-NOS Serine1177 Phosphorylation in humans: a dose response. Life. 11 (1), 36 (2021).
- Kuck, L., Grau, M., Simmonds, M. J. Recovery time course of erythrocyte deformability following exposure to shear is dependent upon conditioning shear stress. Biorheology. 54 (5-6), 141-152 (2018).
- Grau, M., et al. Effect of acute exercise on RBC deformability and RBC nitric oxide synthase signalling pathway in young sickle cell anaemia patients. Scientific Reports. 9 (1), 11813 (2019).
- Feelisch, M. . Methods in Nitric Oxide Research. , (1998).
- Cortese-Krott, M. M., et al. Human red blood cells at work: identification and visualization of erythrocytic eNOS activity in health and disease. Blood>. 120 (20), 4229-4237 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved