A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי מבוסס חיסונים של שינויים דינמיים בחלבוני תאי דם אדומים
In This Article
Summary
לכידת שינויים דינמיים בהפעלת החלבונים של תאי דם אדומים מעוררים אתגרים מתודולוגיים, כמו שימור שינויים דינמיים לגירויים חריפים לצורך הערכה מאוחרת יותר. הפרוטוקול המוצג מתאר טכניקות הכנת דגימה וצביעה המאפשרות שימור וניתוח של שינויי חלבון רלוונטיים וזיהוי לאחר מכן.
Abstract
תיוג נוגדנים של חלבוני תאי דם אדומים (RBC) הוא שיטה נפוצה, כמותית למחצה, לזיהוי שינויים בתכולת החלבון הכוללת או שינויים חריפים במצבי הפעלת חלבון. זה מאפשר הערכה של טיפולי RBC, אפיון של הבדלים במצבי מחלה מסוימים, ותיאור של קוהרנטיות תאית. זיהוי של הפעלת חלבון שהשתנתה בחריפות (למשל, באמצעות מכנוטרנסדוקציה) דורש הכנת דגימה נאותה כדי לשמר שינויים זמניים בחלבון. העיקרון הבסיסי כולל השתקה של אתרי קשירת המטרה של חלבוני RBC הרצויים כדי לאפשר קשירה ראשונית של נוגדנים ראשוניים ספציפיים. הדגימה מעובדת עוד יותר כדי להבטיח תנאים אופטימליים לקשירת הנוגדן המשני לנוגדן הראשוני המתאים. בחירת נוגדנים משניים שאינם פלואורסצנטיים דורשת טיפול נוסף, כולל צימוד ביוטין-אבידין ויישום של 3,3-diaminobenzidine-tetrahydrochloride (DAB) כדי לפתח את הצביעה, אשר צריך להיות נשלט בזמן אמת תחת מיקרוסקופ על מנת לעצור את החמצון, ובכך את עוצמת הצביעה, בזמן. לזיהוי עוצמת הצביעה, התמונות מצולמות באמצעות מיקרוסקופ אור סטנדרטי. בשינוי של פרוטוקול זה, נוגדן משני מצומד פלואורסצאין יכול להיות מיושם במקום, אשר יש את היתרון כי אין צורך בשלב פיתוח נוסף. הליך זה, לעומת זאת, דורש מטרת פלואורסצנטיות המחוברת למיקרוסקופ לזיהוי כתמים. בהתחשב באופי הכמותי למחצה של שיטות אלה, הכרחי לספק מספר כתמי בקרה כדי להסביר תגובות נוגדנים לא ספציפיות ואותות רקע. כאן, אנו מציגים הן פרוטוקולי צביעה והן את התהליכים האנליטיים המתאימים כדי להשוות ולדון בתוצאות וביתרונות בהתאמה של טכניקות הצביעה השונות.
Introduction
תאי דם אדומים (RBCs) חוצים את מערכת הלב וכלי הדם במשך 70 עד 140 ימים, עם גיל RBC ממוצע של כ -115 ימים 1,2. RBCs מזדקנים או פגומים מוסרים ממחזור הדם על ידי אריתרופאגוציטוזה, תהליך ניקוי יעיל המונע על ידי מקרופאגים3. תוחלת החיים שנקבעה מראש של תאים אלה היא אחת התוצאות של ויתור על אברוני התא, כולל הגרעין, המיטוכונדריה והריבוזומים, במהלך התמיינות והבשלה4. לפיכך, RBCs במחזור נטולי מנגנון תרגומי, המונע סינתזה של חלבונים חדשים3. מכאן נובע כי שינויים דינמיים לאחר תרגום חלבונים קיימים מייצגים את המנגנון המעשי היחיד של ויסות ביוכימי חריף בתגובה לגורמי עקה חוץ-תאיים ותוך-תאיים הפועלים על RBCs5.
נראה כי כוחות מכניים הם רמזים חוץ-תאיים עיקריים הגורמים להפעלה או אפנון של מסלולים ביוכימיים בתוך RBCs. גילוי החלבון הרגיש למכנו, Piezo1, בקרומי RBC6 נתן השראה למספר קווי מחקר שחקרו איתות המופעל מכנית בתאים אלה7. לדוגמה, ההתקדמות האחרונה הראתה כי התכונות הפיזיקליות של RBCs מווסתות באופן פעיל על ידי שינויים חריפים ודינמיים של חלבונים8, הכולל זרחן לאחר תרגום ויוביקוויטינציה9. מכיוון ששינויים נורמליים אלה שונים במחלות מסוימות 9,10,11, נראה שיש עניין מדעי וקליני לקבוע את מצב ההפעלה של חלבוני RBC, במיוחד ביחס לתהליכים מכנוביולוגיים.
קביעת שינויים חריפים במצבי הפעלת חלבון RBC מציבה כמה אתגרים מתודולוגיים. לדוגמה, אחסון דגימות RBC לניתוח מאוחר יותר דורש שימור של חלבוני RBC שעברו שינוי, מכיוון ששינויים לאחר תרגום אינם עמידים. יתר על כן, שיטות קלאסיות לזיהוי חלבונים (למשל, כתם מערבי) ידועות לשמצה כקשות לסטנדרטיזציה ב- RBCs בשל השפע הנמוך של חלבונים ביחס להמוגלובין, המהווה ~98% מתכולת החלבון בתאים אלה12. לפיכך, צביעה מבוססת נוגדנים של RBCs שהשתמרו כימית הייתה השיטה המועדפת בעת חקירת שינויים חריפים של חלבוני RBC חשובים, כגון איזופורם ספציפי ל-RBC של סינתאז תחמוצת החנקן (RBC-NOS)13,14. הוכח כי RBC-NOS מייצר באופן אנזימטי תחמוצת החנקן (NO), שנראה חיוני לתכונות RBC חיוניות, כולל עיוות RBC15,16,17. שינויים לאחר תרגום של RBC-NOS מווסתים את פעילות האנזים הקטליטי, כאשר זרחן של שאריות סרין 1177 מתואר כמגביר את פעילות האנזים, בעוד זרחן של שאריות סרין 114 או תראונין 495 נקשרו לירידה בפעילות RBC-NOS18,19.
באופן קולקטיבי, שינויים זמניים של חלבוני RBC תורמים לתפקוד תאי חשוב, ופרוטוקולים סטנדרטיים המאפשרים זיהוי של חלבונים מהונדסים אלה הם בעלי ערך גבוה. כאן, אנו מציגים שני פרוטוקולים נפרדים המנצלים נוגדנים ספציפיים כדי להקל על זיהוי הפעלת חלבון RBC-NOS, ודנים בהמלצות לניתוח נתונים ופענוח.
הביצועים של הפרוטוקולים המתוארים הוערכו על ידי מדידת העלייה המדווחת היטב בזרחון של RBC-NOS בשאריות סרין 1177 בתגובה לכוחות מכניים המשקפים את אלה המתרחשים בתוך כלי הדם האנושיים (5 Pa).
Protocol
הפרוטוקולים המתוארים כאן עולים בקנה אחד עם הצהרת הלסינקי ואושרו על ידי ועדות האתיקה של אוניברסיטת הספורט הגרמנית קלן (16/9/2013) ואוניברסיטת גריפית (2019/808). המתנדבים נבדקו כדי לוודא היעדר פתולוגיות רלוונטיות וסיפקו הסכמה מדעת בכתב.
1. צביעת חלבוני RBC באמצעות פרוטוקולים אימונוהיסטוכימיים
הערה: רשימה מפורטת של הכימיקלים והחומרים הדרושים מופיעה בטבלת החומרים. הסעיפים הבאים מתארים את הכנת התמיסות הנדרשות, ולאחר מכן תיאור מפורט של פרוטוקול האימונוהיסטוכימיה (איור 1).
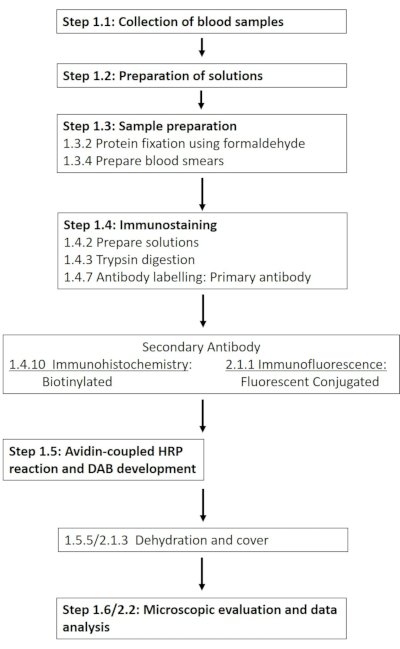
איור 1: סכמטיות של הצעדים הבודדים הדרושים לצביעה אימונוהיסטוכימית ואימונופלואורסצנטית של RBC-NOS באתר זרחן 1177. זרימת עבודה טיפוסית של הפרוטוקולים המוצגים נמתחת מהכנת תמיסה ודגימת דם לזיהוי והדמיה מבוססי נוגדנים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- איסוף דגימת דם
- קבל דגימות דם (10 מ"ל של דם שלם) משבעה גברים בריאים. המתנדבים היו אנשים בריאים שדווח כי הם נקיים ממחלות לב וכלי דם, המטולוגיות, נוירולוגיות, אנדוקריניות או מטבוליות. המתנדבים היו גם לא מעשנים.
- לאסוף דם באמצעות מחט סטרילית מזרק מווריד בולט באזור antecubital של האמה, ומיד להעביר לתוך צינורות מצופים באחד נוגדי הקרישה הבאים: הפרין נתרן (עבור immunohistochemistry) או חומצה ethylenediaminetetraacetic (EDTA; עבור תיוג פלואורסצנטי).
- חשוף את דגימות הדם נוגדות הקרישה לכוחות מכניים מבוקרים במדויק באמצעות מערכת גזירה מסוג Couette, כמתואר לעיל 7,20.
- מנגנון הגזירה מורכב מכוס מסתובבת ובוב נייח, המופרדים על ידי מרווח של 300 מיקרומטר. העבירו את דגימת הדם לתוך הפער, מה שגורם למהירות הסיבוב הנשלטת במדויק של הכוס להפעיל כוחות מכניים מבוקרים היטב על הדגימה. הנתונים המייצגים המוצגים כאן הופקו על ידי הפעלת כוחות מכניים המשקפים את אלה המתרחשים בתוך כלי הדם האנושיים (5 Pa) לפרקי זמן ממושכים (300 שניות).
- הכנת פתרונות הדרושים עבור immunostaining
- הכינו את הפתרונות כמו בטבלה 1. ניתן להכין את התמיסות לפני ביצוע הליך ההדבקה החיסונית ולאחסן אותן בטמפרטורה נתונה עד לצורך.
הערה: משך האחסון עשוי להשתנות בין הכימיקלים. בדוק את גיליון נתוני בטיחות החומרים.
- הכינו את הפתרונות כמו בטבלה 1. ניתן להכין את התמיסות לפני ביצוע הליך ההדבקה החיסונית ולאחסן אותן בטמפרטורה נתונה עד לצורך.
- הכנת דוגמאות
- לעבד דם שלם מיד לאחר הגמילה או טיפול ניסיוני (היכן שרלוונטי; למשל, גירוי מכני בדגימות שלנו; ראה שלב 1.1.3) כדי להיות מסוגל לזהות השפעות קצרות מועד, למשל לאחר הפעלת לחץ גזירה, פעילות גופנית, חשיפה להיפוקסיה קצרת טווח וכו '.
- בצע קיבוע חלבון RBC באמצעות פורמלדהיד באופן הבא: לדלל דם שלם ביחס של 1:2 בתמיסת פרפורמלדהיד 4% למשך 20 דקות בטמפרטורת החדר (RT). צנטריפוגה את הדגימה ב 132 x גרם במשך 3 דקות ב RT בזהירות להסיר את supernatant על ידי pipetting.
- השהה מחדש את גלולת RBC בשני כרכים של 0.1 mol/L פוספט חוצץ מלוחים (PBS) (דילול 1:3) ודגרה במשך 5 דקות ב- RT. חזור על הצנטריפוגה כמתואר לעיל והסר את הסופרנטנט, שאמור להיות ברור, על ידי פיפטינג. השהה מחדש את גלולת RBC בנפח אחד של 0.1 mol/L PBS (דילול 1:2).
- הכינו מריחות דם באופן הבא: תייגו שקופית מיקרוסקופ עם מזהה הדגימה, הנוגדנים שהוחלו וכו' באמצעות עט עמיד לאלכוהול (למשל, עיפרון). לאחר מכן, הוסף 10 μL של פתרון RBC מוכן ממש מעל שדה התווית.
- מקם שקופית שנייה על הדגימה בזווית של כ- 45° ומפזר את הדגימה באופן שווה לאורך השקופית. תקן בחום את המגלשה מעל מבער Bunsen על ידי ריחוף הדגימה מעל המבער עם תנועה קבועה במשך 5-7 שניות.
הערה: מומלץ לייבש את הדגימות באוויר לפני קיבוע החום. ניתן לאחסן את הדגימות ב-RT עד להכתמה (איור 2).
- צביעת אימונוהיסטוכימיה
- סמן שני אזורים בכל שקופית: אזור בדיקה שבו מודגרים על RBCs עם הנוגדן הראשוני והמשני בהתאמה, ואזור בקרה שבו הנוגדן הראשוני מוחלף בתמיסת בקרה. אזור זה משמש כבקרת בדיקה פנימית כדי לקבוע את אות הרקע של RBCs.
- הכינו פתרונות לפני ההליך או במהלכו, לפי טבלה 2. יש צורך בנפח של 300 μL לכל אזור בדיקה ו-200 μL לכל אזור בקרה.
הערה: חשוב לציין כי הליכי צביעה מבוססי נוגדנים אלה מניבים נתונים כמותיים למחצה, ולא כמותיים. לפיכך, כדי להבטיח שניתן יהיה להסיק מסקנות משמעותיות מהנתונים המיוצרים, דגימות בקרה מתאימות (כלומר, לספק נקודת התייחסות לשינויים היחסיים המוערכים בהפעלת החלבון) נדרשות בהחלט. - לעיכול טריפסין, יש להפשיר 0.1% טריפסין ולאזן ל-RT. סמן שני אזורים בכל שקופית באמצעות עיפרון שומן: אזור בדיקה (2/3 מהשקופית) ואזור בקרה (1/3 מהשקופית). יש למרוח בזהירות מי מלח חוצצים (TBS) באמצעות פיפטות העברה כדי לשטוף את אזורי הדגימה. תנו ל-TBS לשבת במשך 30 שניות ואז שפכו אותו. חזרו על שלב הכביסה.
הערה: הוסף את הפתרונות הבאים הן לפקד והן לאזור הבדיקה, אלא אם כן תואר אחרת. האזורים צריכים להיות מכוסים מספיק עם הפתרון המתאים. יישמו את התמיסות באמצעות פיפטות העברה חד פעמיות, והחליפו פיפטות לאחר כל פתרון. - הוסיפו 0.1% טריפסין, כסו את המגלשות באמצעות תא דגירה ייעודי עם מכסה או רדיד אלומיניום, ודגרו במשך 30 דקות בטמפרטורה של 37°C באינקובטור. לאחר הדגירה, עצרו את תגובת האנזים על ידי הוספת מי ברז. שפכו את הפתרון. שטפו את שני האזורים 3x עם TBS, כמתואר לעיל.
- לחסימת הפעלת peroxidase, להוסיף תמיסת מתנול לדגור במשך 30 דקות ב RT. לכסות את שקופיות במהלך זמן זה. שפכו את הפתרון.
הערה: עבור זיהוי immunofluorescence (סעיף 2), שלב זה עשוי להיות מושמט, בהתחשב בכך חסימת peroxidases אנדוגניים משמש למניעת אות מלאכותי הנגרם על ידי זיהוי עם חזרת peroxidase (HRP) ו 3,3′-Diaminobenzidine hydrate (DAB). - שטפו את שני האזורים 3x באמצעות TBS, כמתואר בשלב 1.4.3. מוסיפים תמיסת חלב רזה 3% ודגרים במשך 30 דקות ב-RT כדי לחסום. שפכו את הפתרון. אין לשטוף לאחר מכן.
- הוסף נוגדן ראשוני (AB) רק לאזור הבדיקה. הוסף פתרון בקרת AB (ראה טבלה 2) לאזור הבקרה. דגרו דגימות בטמפרטורה של 4°C למשך הלילה. כסו את המגלשות במהלך פרק זמן זה כדי למנוע התייבשות.
הערה: הימנע מהעברת הפתרונות מהבדיקה לאזור הבקרה, מכיוון שהדבר ישפיע על ערכי הבקרה. - יוצקים את תמיסת הנוגדנים. שטפו את שני האזורים 3x באמצעות TBS, כמתואר בשלב 1.4.3.
- בצע שלב חסימה כדי למנוע קשירה לא ספציפית. מוסיפים 3% סרום עיזים רגיל ודגרים במשך 30 דקות ב-RT. יוצקים את התמיסה.
- מוסיפים את תמיסת הנוגדנים המשנית ודגרים במשך 30 דקות ב- RT. יוצקים את תמיסת הנוגדנים. שטפו את האזורים פי 3 באמצעות TBS, כמתואר בשלב 1.4.3.
- התפתחות כתמים וכיסוי
- בצע את תגובת HRP מצומדת לאבידין (ראה דילול בטבלה 2) על ידי הוספת תמיסת אבידין-פרוקסידאז מדוללת ודגירה למשך 30 דקות ב- RT. שפכו את התמיסה.
- הכינו את תערובת DAB לפיתוח הכתמים החיסוניים לפני השימוש, לפי טבלה 3.
זהירות: DAB מסוכן. שקול הצהרות סיכון H341 (חשוד בגרימת פגמים גנטיים) ו- H350 (עלול לגרום לסרטן). שקול את הצהרות הזהירות הבאות: P201, P202, P280, P308+P313, P405 ו- P501. - בצע צביעת בקרת DAB באופן הבא: אסוף את פתרון HRP משלב 1.5.1 משקופית וערבב עם נפח קטן (למשל, 1 מ"ל) של תמיסת DAB מוכנה בצינור צנטריפוגה נפרד לפני הצביעה. התערובת צריכה לפתח צבע חום/אפור.
- מקם את השקופיות תחת מיקרוסקופ (הגדלה של לפחות 200x) והוסף פתרון DAB לשני האזורים. עקוב אחר הצביעה של RBCs ברציפות ועצור את הצביעה על ידי הסרת תמיסת DAB עם פיפטה חד פעמית לפני שהרקע מתחיל לצבוע. עבור צביעת RBC-NOS serine 1177, זמן הדגירה של DAB הוא כ-17 דקות.
- בצע התייבשות דגימה. הניחו את המגלשות במדף זכוכית וטבלו במשך 5 שניות כל אחת בתמיסות אתנול בדילולים שונים, החל מ-70%, לאחר מכן 96%, ואז 100%, ולבסוף בקסילול. הסר את המגלשות מהמדף והנח על טישו, עם RBCs בחלק העליון כדי לספוג נוזלים עודפים.
- הוסף שתיים או שלוש טיפות של אמצעי הרכבה לאורך השקופית. כסה את השקופית באמצעות תלוש כיסוי. הימנע הכללה של בועות אוויר, כמו זה מעכב הערכה מיקרוסקופית. יבשו את הדגימות לפחות למשך הלילה במכסה אדים.
- ביצוע הערכה מיקרוסקופית
- לצורך הדמיה והדמיה, מקם שקופיות במיקרוסקופ אור משודר עם הגדלה של לפחות פי 200. ודא כי המיקרוסקופ מחובר למצלמה כדי לצלם את RBCs מוכתמים.
- הפעל את מקור האור במיקרוסקופ. הפעל את המצלמה המחוברת למיקרוסקופ והפעל את תוכנת בקרת המיקרוסקופ. השתמש במיקרוסקופ שדה בהיר כדי לקבוע את המיקוד המתאים על ידי סיבוב ידיות התאמת המיקוד הגסות והעדינות ומציאת רמת המיקוד שבה RBCs גלויים.
- הגדר את ערכי הרקע של התמונות ל- 220 ± 5 ערכי אפור, הנמדדים בשלושה אזורים נטולי תאים בשקופית. לשם כך, פתח את התמונה הראשונה באמצעות התוכנה הזמינה בחינם ImageJ. בחר באפשרות ממוצע ערכי אפור בחלונית Set Measurements. השתמש בסמל הסגלגל כדי למדוד את הערך האפור באמצעות הפקודה מדידה . אם הערכים הנמדדים נמצאים מחוץ לטווח, התאימו את תאורת הרקע במיקרוסקופ. חזור על שלבים אלה עד שערכי הרקע יהיו נכונים.
הערה: ערכי רקע אלה צריכים להיות בטווח הנתון עבור כל התמונות שצולמו. אחרת, הנתונים אינם ברי השוואה. - לניתוח ערך אפור של RBC, סמן את הקצה של כל RBC באמצעות כלי הבחירה הסגלגל בתוכנת ImageJ. קבע את ערכי האפור של RBCs בודדים באמצעות הפקודה מדידה . מדוד את הערכים האפורים של לפחות 50 RBCs מהבדיקה ולפחות 10 RBCs מאזור הבקרה.
הערה: ניתן להתאים את המספר הכולל של RBCs מנותחים בנפרד. ככל שניתחו יותר RBCs, כך התוצאה משמעותית יותר. עם זאת, המספר הכולל של RBCs מנותחים צריך להיות דומה עבור כל מצב, נושא, וכו 'בתוך ניסוי נתון.- הימנע מניתוח של RBCs ליד עיפרון שומן, כמו כתמים עשויים להיות לא שלמים באזור זה. הימנע מניתוח של RBCs חופפים, שכן זה משפיע על עוצמת הצביעה. השתמש רק ב- RBCs המופרדים מ- RBCs אחרים. נתח לפחות חמש תמונות מהבדיקה ולפחות שתי תמונות מאזור הבקרה להערכה של 50/10 RBCs. כלול RBCs מכל תמונה בניתוח הסופי.
- כדי לחשב את עוצמת הצביעה, חשב את האותות הסופיים כ:
(אזור בדיקה בודד RBC - רקע אזור בדיקה ממוצע) - (אזור בקרה בודד RBC - רקע אזור בקרה ממוצע)

איור 2: תיאור תהליך הקיבוע ויצירת מריחת הדם. (סכימה שנוצרה באמצעות BioRender.com.) דגימות דם מדוללות מקובעות כימית בפרפורמלדהיד, ואז צנטריפוגות ונשטפות במי מלח חוצצים פוספט. לבסוף, דם מרחף מחדש על מגלשת זכוכית ומקובע תרמית באמצעות ריחוף מעל להבת מבער בונזן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: תנאי הכנה ואחסון לתמיסות הדרושות לצביעה אימונוהיסטוכימית. ניתן להכין את הפתרון לפני הפרוטוקול. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: תיאור תמיסות נוגדנים לשימוש מיידי. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: רכיבים ופרוטוקול להכנת פתרון DAB לשימוש מיידי. אנא לחץ כאן כדי להוריד טבלה זו.
2. תיוג פלואורסצנטי של חלבוני RBC
הערה: החלק הבא מתאר התאמה של הפרוטוקול האימונוהיסטוכימי, שפותח במטרה לאפשר שימוש בנוגדנים עם מצומדים פלואורסצנטיים (איור 1).
הכנת דגימות דם לפרוטוקול אימונופלואורסנציה זהה לזו המתוארת בסעיף 1, ולכן הסעיף הבא מתחיל מצביעת דגימות.
- צביעה אימונופלואורסצנטית
- יש לדגור עם נוגדן מצומד פלואורסצנטי משני (לנפח, ראה שלב 1.4.2) למשך 30 דקות ב-RT מוגן מפני אור, באמצעות תא דגירה ייעודי או רדיד אלומיניום.
- שפכו את תמיסת הנוגדנים המשנית ושטפו את הדגימות 3x עם TBS. השאירו את השטיפה הסופית על הדגימות כדי למנוע מהן להתייבש.
- שפכו את ה-TBS והוציאו את הדגימות ממדף הדגימות אחת בכל פעם כדי למנוע חשיפה ממושכת לאור. כדי לייבש את הדגימות, חשוף את השקפים לתמיסות אתנול שונות עבור ~ 5 s כל אחת, החל מ 70%, לאחר מכן 90%, ולבסוף 100%. חשוף את השקופיות לתמיסת קסילול/קסילן למשך 5 שניות.
- הכינו תלוש כיסוי עם שתיים או שלוש טיפות של אמצעי הרכבה ולאחר מכן הרכיבו את המגלשה עם הכיסוי. ודא פיזור אחיד של אמצעי ההרכבה על ידי הפעלת לחץ קל עם פינצטה או מכשיר מתכת סטרילי דומה. סלק בועות אוויר, שעלולות להפריע להדמיה, באמצעות אותו מכשיר. השאירו את הדגימות להתייבש למשך הלילה בחלל חשוך ויבש.
- הערכה מיקרוסקופית
- לצורך הדמיה והדמיה, מקם את השקופית על במת המיקרוסקופ בהגדלה כוללת של לפחות 400x. הפעל את מקור האור במיקרוסקופ ואת מקור האור הפלואורסצנטי, וודא שמקור האור הפלואורסצנטי מותאם לעוצמה מרבית.
- הפעל את המצלמה המחוברת למיקרוסקופ והפעל את תוכנת בקרת המיקרוסקופ. השתמש במיקרוסקופ שדה בהיר כדי לקבוע את המיקוד המתאים על-ידי סיבוב ידיות התאמת המיקוד הגסות והעדינות, ומציאת רמת המיקוד במקום שבו RBCs גלויים.
הערה: חשיפה מוגזמת לאור עלולה לגרום להלבנה של המצומדים הפלואורסצנטיים. ניתן להשתמש בשקופית מניסוי קודם למטרה זו, כדי למזער את חשיפת האור של השקפים שעדיין לא נותחו. - קבע עוצמת לייזר אופטימלית על ידי בדיקת RBCs באזור הבקרה. ודא שהעוצמה גבוהה מספיק כדי ש- RBCs יהיו גלויים, מבלי להפיק אות רקע גדול. שמור על אינטנסיביות וזמן חשיפה עקביים בין אזורים ודגימות כדי להבטיח השוואה.
- צלם תמונות שדה בהיר ותמונות פלואורסצנטיות בשלושה אזורים נפרדים לפחות באזור הבדיקה של השקופית, שנבחרו באופן אקראי. לבחירת אזור, התרחק מהקצוות של השקופית המסומנים בעט השומנים, באמצעות פקדי שלב המיקרוסקופ. בחרו אזור המציג פיזור אחיד של שכבת RBC יחידה.
- הגדר את זמן החשיפה ל- 1 s עבור תמונות פלואורסצנטיות וצלם תמונה באמצעות פקדי התוכנה של תוכנת בקרת המיקרוסקופ. עבור למצב brightfield, הגדר את זמן החשיפה ל'אוטומטי' וצלם את תמונת שדה הבהירות המתאימה.
- לכוד תמונות שדה בהיר ותמונות פלואורסצנטיות בשני אזורים נפרדים שנבחרו באופן אקראי באזור הבקרה של השקופית על-ידי חזרה על שלב 2.2.3.
- שמרו את התמונות בתבנית .tif כדי לשמור על ערכי האפור המקוריים של פיקסלים, למנוע דחיסה ולשאת מטא-נתונים של הרכישה.
- מדוד את הערכים האפורים של RBCs שנלכדו. פתח את ImageJ (או FIJI21; ראה קובץ משלים 1). קבע את הערכים האפורים של RBCs בודדים. לשם כך, סמן כל תא בודד בכלי הבחירה הסגלגל ונתח באמצעות הפקודה מדידה .
הערה: אין לנתח RBCs אם הם חופפים לתאים אחרים, מכיוון שהדבר עלול להגביר את האות המתקבל. - סמן בין שלושה לחמישה אזורים ללא RBC וקבע את הערכים האפורים כדי לספק מידה של אות רקע. נתח לפחות 150 RBCs משלוש תמונות נפרדות לפחות עבור כל אזור בדיקה, ולפחות 50 RBCs מלפחות שתי תמונות נפרדות עבור כל אזור בקרה.
הערה: ניתוח של תאים/אזורים נוספים עשוי להיות מומלץ כדי למזער את השונות. בהתחשב בכך שאוכלוסיית RBC היא הטרוגנית מטבעה, השתנות התא באות עשויה להיות משמעותית, בהתאם לחלבון המעניין. - בצע ניתוח נתונים חלופי של תמונות שצולמו באמצעות פקודת מאקרו. צור/התקן פקודת מאקרו באמצעות מהדורת FIJI של ImageJ לבחירה אוטומטית, תיקון רקע וניתוח ערך אפור של תמונה נתונה.
הערה: שגרה זו משתמשת בערכי סף אוטומטיים כדי לזהות את התאים הקיימים בתמונה נתונה באמצעות עותק של התמונה המקורית, ויוצרת שכבת-על שנכפתה על התמונה המקורית כדי לחלץ ערכים אפורים של RBCs פלואורסצנטיים. המאקרו מופקד כקובץ .ijm, כקובץ קידוד משלים 1. - פתח את קובץ התמונה בפורמט .tif מוכן לניתוח בפיג'י. פתח את המאקרו RBC fluorescence.ijm (Supplementary Coding File 1) ולחץ על הפעל.
הערה: המאקרו מוגדר עבור תמונות המתקבלות עם הגדלה של 600x ויחס אות לרעש גדול. בחירה אוטומטית של תאים צריכה להיבדק על ידי החוקר.
- חשב את האותות הסופיים כ:
(אזור בדיקה RBC - רקע אזור בדיקה) - (אזור בקרה RBC - רקע אזור בקרה) לניתוח ידני;
(אזור בדיקה - אזור בקרה) לניתוח אוטומטי.
תוצאות
הפרוטוקול המוצג, המתאר שיטות המאפשרות זיהוי שינויים חריפים בחלבוני RBC, נבדק על שינוי חלבון ידוע ורגיש מכנית: זרחן של RBC-NOS בשאריות סרין 1177. דם מלא נלקח ממתנדבים בריאים ולאחר מכן פוצל לשני אליציטוטים נפרדים. דגימת דם נתונה נחשפה ללחץ גזירה מכני בסדר גודל פיזיולוגי (5 Pa) במשך 300 שניות, אשר הוכח ב?...
Discussion
ספרות עדכנית מצביעה על כך שלחלבון RBC-NOS יש חשיבות מכרעת לוויסות עיוות RBC 15,22,23, שבתורו מקל על המעבר שלהם דרך נימים צרים 24. פעילות החלבונים תלויה מאוד בשינויים חלבוניים לאחר התרגום, במיוחד הזרחן של שאריות מסוימות18. ?...
Disclosures
כל המחברים גילו כי אין ניגודי אינטרסים.
Acknowledgements
LK מודה בתמיכתה של מלגת תוכנית הכשרת המחקר של ממשלת אוסטרליה.
Materials
| Name | Company | Catalog Number | Comments |
| 3,3′-Diaminobenzidin -tetrahydrochloride Hydrate | Sigma/Merck | D5637 | DAB |
| Ammoniumchloride | Merck /Millipore | 101145 | NH4Cl |
| Centrifuge 5427 R | Eppendorf | 5409000010 | |
| Coverslips | VWR | 631-0147 | |
| di-sodium Hydrogen Phosphate Dihydrate | Merck /Millipore | 106580 | Na2HPO4. 2 H2O |
| Disposable transfer pipettes | VWR | 612-6803 | |
| Entellan | Merck /Millipore | 107961 | rapid mounting medium for microscopy |
| Ethanol denaturated using 1 % methyl ethyl ketone (MEK) | Hofmann | 642 | |
| Glucose-Oxidase | Sigma/Merck | G2133 | |
| Grease pencil | Dako | S 2002 | |
| Horse-radish peroxidase/ExtrAvidin−Peroxidase | Sigma/Merck | E-2886 | HRP |
| Hydrochloric acid | Merck /Millipore | 109057 | HCl |
| Hydrogen peroxide, 30% | Merck /Millipore | 107203 | H2O2 |
| ImageJ Software | Freeware | ||
| Laser-assisted optical rotational cell analyser (LORCA) | RR Mechatronics | Ektacytometer instrument used for shearing | |
| Methanol | Merck /Millipore | 106009 | |
| Microscope slides | VWR | 630-1985 | |
| Nickel(II)-sulfate Hexahydrate | Sigma/Merck | N4882 | NiSO4.6H2O |
| Normal Goat serum | Agilent/DAKO | X0907 | NGS |
| Paraformaldehyde | Merck /Millipore | 818715 | PFA |
| Pipettes Eppendorf Reference 2 | VWR | 613-5836/ 613-5839 | |
| Rabbit Anti-phospho eNOS Antibody (Ser1177) | Merck/Millipore | 07-428-I | Primary Antibody |
| Reaction tubes, 2ml | Eppendorf | 30120094 | |
| Secondary Antibody goat anti rabbit | Agilent/DAKO | E0432 | Secondary Antibody |
| Skim milk powder | Bio-Rad | 170-6404 | |
| Sodium chloride | Merck /Millipore | 106404 | NaCl |
| Sodium Dihydrogen Phosphate Monohydrate | Merck /Millipore | 106346 | NaH2PO4.H2O |
| Sodium hydroxide, 1 M | Merck /Millipore | 150706 | NaOH |
| Tris(hydroxymethyl)-aminomethane | Merck /Millipore | 108382 | Tris |
| Trypsin | Sigma/Merck | T7409 | |
| Tween20 | Merck /Millipore | 822184 | |
| Whatman Glas microfiber filter, quality GF/F | Merck /Millipore | WHA1825047 | |
| Xylol | VWR Chemicals | 2,89,73,465 | |
| ß-D-Glucose monohydrate | Merck /Millipore | 14431-43-7 |
References
- Cohen, R. M., et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood. 112 (10), 4284-4291 (2008).
- Mock, D. M., et al. Red blood cell (RBC) survival determined in humans using RBCs labeled at multiple biotin densities. Transfusion. 51 (5), 1047-1057 (2011).
- Thiagarajan, P., Parker, C. J., Prchal, J. T. How do red blood cells die?. Frontiers in Physiology. 12, 655393 (2021).
- Moras, M., Lefevre, S. D., Ostuni, M. A. From erythroblasts to mature red blood cells: organelle clearance in mammals. Frontiers in Physiology. 8, 1076 (2017).
- Pretini, V., et al. Red blood cells: chasing interactions. Frontiers in Physiology. 10, 945 (2019).
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Kuck, L., Peart, J. N., Simmonds, M. J. Piezo1 regulates shear-dependent nitric oxide production in human erythrocytes. American Journal of Physiology. Heart and Circulatory Physiology. 323 (1), H24-H37 (2022).
- Kuck, L., Peart, J. N., Simmonds, M. J. Active modulation of human erythrocyte mechanics. American Journal of Physiology. Cell Physiology. 319 (2), C250-C257 (2020).
- Strader, M. B., et al. Post-translational modification as a response to cellular stress induced by hemoglobin oxidation in sickle cell disease. Scientific Reports. 10 (1), 14218 (2020).
- Pecankova, K., Majek, P., Cermak, J., Dyr, J. E. Posttranslational modifications of red blood cell ghost proteins as "signatures" for distinguishing between low- and high-risk myelodysplastic syndrome patients. Turkish Journal of Haematology. 34 (1), 111-113 (2017).
- Grau, M., et al. High red blood cell nitric oxide synthase activation is not associated with improved vascular function and red blood cell deformability in sickle cell anaemia. British Journal of Haematology. 168 (5), 728-736 (2015).
- Sae-Lee, W., et al. The protein organization of a red blood cell. Cell Reports. 40 (3), 111103 (2022).
- Suhr, F., et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982 (2012).
- Kuck, L., Grau, M., Bloch, W., Simmonds, M. J. Shear stress ameliorates superoxide impairment to erythrocyte deformability with concurrent nitric oxide synthase activation. Frontiers in Physiology. 10, 36 (2019).
- Grau, M., et al. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759 (2013).
- Simmonds, M. J., Detterich, J. A., Connes, P. Nitric oxide, vasodilation and the red blood cell. Biorheology. 51 (2-3), 121-134 (2014).
- Bor-Kucukatay, M., Wenby, R. B., Meiselman, H. J., Baskurt, O. K. Effects of nitric oxide on red blood cell deformability. American Journal of Physiology. Heart and Circulatory Physiology. 284 (5), H1577-H1584 (2003).
- Suhr, F., et al. Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes. Nitric Oxide: Biology and Chemistry. 20 (2), 95-103 (2009).
- Grau, M., et al. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clinical Hemorheology and Microcirculation. 63 (3), 199-215 (2016).
- Grau, M., Kuck, L., Dietz, T., Bloch, W., Simmonds, M. J. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology. 10 (1), 47 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ozüyaman, B., Grau, M., Kelm, M., Merx, M. W., Kleinbongard, P. RBC NOS: regulatory mechanisms and therapeutic aspects. Trends in Molecular Medicine. 14 (7), 314-322 (2008).
- Kleinbongard, P., et al. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943-2951 (2006).
- McMahon, T. J. Red blood cell deformability, vasoactive mediators, and adhesion. Frontiers in Physiology. 10, 1417 (2019).
- Bizjak, D. A., Brinkmann, C., Bloch, W., Grau, M. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: a study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS One. 10 (4), 0125206 (2015).
- Di Pietro, N., et al. Nitric oxide synthetic pathway and cGMP levels are altered in red blood cells from end-stage renal disease patients. Molecular and Cellular Biochemistry. 417 (1-2), 155-167 (2016).
- Grau, M., et al. Even patients with mild COVID-19 symptoms after SARS-CoV-2 infection show prolonged altered red blood cell morphology and rheological parameters. Journal of Cellular and Molecular Medicine. 26 (10), 3022-3030 (2022).
- Mozar, A., et al. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clinical Hemorheology and Microcirculation. 64 (1), 47-53 (2016).
- Ulker, P., Gunduz, F., Meiselman, H. J., Baskurt, O. K. Nitric oxide generated by red blood cells following exposure to shear stress dilates isolated small mesenteric arteries under hypoxic conditions. Clinical Hemorheology and Microcirculation. 54 (4), 357-369 (2013).
- Nader, E., et al. Hydroxyurea therapy modulates sickle cell anemia red blood cell physiology: Impact on RBC deformability, oxidative stress, nitrite levels and nitric oxide synthase signalling pathway. Nitric Oxide: Biology and Chemistry. 81, 28-35 (2018).
- Fischer, U. M., Schindler, R., Brixius, K., Mehlhorn, U., Bloch, W. Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes. The Annals of Thoracic Surgery. 84 (6), 2000-2003 (2007).
- Horobin, J. T., Sabapathy, S., Kuck, L., Simmonds, M. J. Shear stress and RBC-NOS Serine1177 Phosphorylation in humans: a dose response. Life. 11 (1), 36 (2021).
- Kuck, L., Grau, M., Simmonds, M. J. Recovery time course of erythrocyte deformability following exposure to shear is dependent upon conditioning shear stress. Biorheology. 54 (5-6), 141-152 (2018).
- Grau, M., et al. Effect of acute exercise on RBC deformability and RBC nitric oxide synthase signalling pathway in young sickle cell anaemia patients. Scientific Reports. 9 (1), 11813 (2019).
- Feelisch, M. . Methods in Nitric Oxide Research. , (1998).
- Cortese-Krott, M. M., et al. Human red blood cells at work: identification and visualization of erythrocytic eNOS activity in health and disease. Blood>. 120 (20), 4229-4237 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved