Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Detección de alteraciones dinámicas en las proteínas de los glóbulos rojos basada en inmunotinción
En este artículo
Resumen
La captura de los cambios dinámicos en la activación proteica de los glóbulos rojos enucleados plantea desafíos metodológicos, como la preservación de los cambios dinámicos en los estímulos agudos para su posterior evaluación. El protocolo presentado describe las técnicas de preparación y tinción de muestras que permiten la preservación y el análisis de los cambios proteicos relevantes y su posterior detección.
Resumen
El marcaje de anticuerpos de las proteínas de los glóbulos rojos (RBC) es un método semicuantitativo de uso común para detectar cambios en el contenido general de proteínas o alteraciones agudas en los estados de activación de las proteínas. Facilita la evaluación de los tratamientos con hematíes, la caracterización de las diferencias en ciertos estados de la enfermedad y la descripción de las coherencias celulares. La detección de la activación de proteínas agudamente alterada (por ejemplo, a través de la mecanotransducción) requiere una preparación adecuada de la muestra para preservar las modificaciones proteicas que de otro modo serían temporales. El principio básico incluye la inmovilización de los sitios de unión diana de las proteínas glóbulos rojos deseadas para permitir la unión inicial de anticuerpos primarios específicos. La muestra se procesa posteriormente para garantizar las condiciones óptimas para la unión del anticuerpo secundario al anticuerpo primario correspondiente. La selección de anticuerpos secundarios no fluorescentes requiere un tratamiento adicional, incluido el acoplamiento biotina-avidina y la aplicación de 3,3-diaminobencidina-tetraclorhidrato (DAB) para desarrollar la tinción, que debe controlarse en tiempo real bajo un microscopio para detener la oxidación y, por lo tanto, la intensidad de la tinción, a tiempo. Para la detección de la intensidad de las manchas, las imágenes se toman con un microscopio óptico estándar. En una modificación de este protocolo, se puede aplicar en su lugar un anticuerpo secundario conjugado con fluoresceína, lo que tiene la ventaja de que no es necesario ningún paso de desarrollo adicional. Este procedimiento, sin embargo, requiere un objetivo de fluorescencia conectado a un microscopio para la detección de manchas. Dada la naturaleza semicuantitativa de estos métodos, es imperativo proporcionar varias tinciones de control para tener en cuenta las reacciones de anticuerpos no específicas y las señales de fondo. Aquí, presentamos tanto los protocolos de tinción como los procesos analíticos correspondientes para comparar y discutir los respectivos resultados y ventajas de las diferentes técnicas de tinción.
Introducción
Los glóbulos rojos (RBC) atraviesan el sistema cardiovascular durante 70 a 140 días, con una edad media de los glóbulos rojos de aproximadamente 115 días 1,2. Los glóbulos rojos senescentes o dañados son eliminados de la circulación por eritrofagocitosis, un proceso de limpieza eficiente impulsado por los macrófagos3. La vida útil predeterminada de estas células es una consecuencia de la entrega de los orgánulos celulares, incluidos el núcleo, las mitocondrias y los ribosomas, durante la diferenciacióny la maduración. Por lo tanto, los glóbulos rojos circulantes están desprovistos de una maquinaria de traducción, lo que impide la síntesis de nuevas proteínas3. De ello se deduce que las modificaciones dinámicas postraduccionales de las proteínas existentes representan el único mecanismo viable de regulación bioquímica aguda en respuesta a los factores estresantes extracelulares e intracelulares que actúan sobre los glóbulos rojos5.
Las fuerzas mecánicas parecen ser las principales señales extracelulares que causan la activación o modulación de las vías bioquímicas dentro de los glóbulos rojos. El descubrimiento de la proteína mecanosensible, Piezo1, en las membranas de los glóbulos rojos6 inspiró varias líneas de investigación que investigan la señalización activada mecánicamente en estas células7. Por ejemplo, avances recientes han demostrado que las propiedades físicas de los glóbulos rojos están reguladas activamente por cambios agudos y dinámicos de las proteínas8, que incluyen la fosforilación postraduccional y la ubiquitinación9. Dado que estas modificaciones normales difieren en ciertas enfermedades 9,10,11, parece ser de interés científico y clínico determinar el estado de activación de las proteínas de los glóbulos rojos, específicamente en relación con los procesos mecanobiológicos.
La determinación de los cambios agudos en los estados de activación de la proteína de los glóbulos rojos plantea algunos desafíos metodológicos. Por ejemplo, el almacenamiento de muestras de glóbulos rojos para su posterior análisis requiere la preservación de las proteínas de glóbulos rojos modificadas, ya que las modificaciones postraduccionales no son duraderas. Además, los métodos clásicos de detección de proteínas (p. ej., Western blot) son notoriamente difíciles de estandarizar en los glóbulos rojos debido a la baja abundancia de proteínas en relación con la hemoglobina, que representa ~98% del contenido de proteínas en estas células12. Por lo tanto, la tinción basada en anticuerpos de los glóbulos rojos conservados químicamente ha sido el método de elección cuando se investigan modificaciones agudas de importantes proteínas de los glóbulos rojos, como la isoforma específica de los glóbulos rojos de la óxido nítrico sintasa (RBC-NOS)13,14. Se ha demostrado que RBC-NOS produce enzimáticamente óxido nítrico (NO), que parece indispensable para las propiedades esenciales de los glóbulos rojos, incluida la deformabilidad de los glóbulos rojos15,16,17. Las modificaciones postraduccionales de los glóbulos rojos-NOS regulan la actividad catalítica de las enzimas, dándose como resultado que la fosforilación del residuo de serina 1177 aumenta la actividad enzimática, mientras que la fosforilación de los residuos serina 114 o treonina 495 se ha relacionado con una disminución de la actividad de los glóbulos rojos18,19.
En conjunto, las modificaciones temporales de las proteínas de los glóbulos rojos contribuyen a una función celular importante, y los protocolos estandarizados que permiten la detección de estas proteínas modificadas son de gran valor. Aquí, presentamos dos protocolos distintos que explotan anticuerpos específicos para facilitar la detección de la activación de la proteína RBC-NOS, y discutimos las recomendaciones para el análisis y la interpretación de datos.
El rendimiento de los protocolos descritos se evaluó midiendo el aumento bien informado en la fosforilación de RBC-NOS en el residuo de serina 1177 en respuesta a fuerzas mecánicas que reflejan las que ocurren dentro de la vasculatura humana (5 Pa).
Protocolo
Los protocolos aquí descritos están alineados con la Declaración de Helsinki y fueron aprobados por los Comités de Ética de la Universidad Alemana del Deporte de Colonia (16/09/2013) y de la Universidad de Griffith (2019/808). Los voluntarios fueron examinados para garantizar la ausencia de patologías relevantes y proporcionaron su consentimiento informado por escrito.
1. Tinción de proteínas de glóbulos rojos mediante protocolos de inmunohistoquímica
NOTA: En la Tabla de Materiales se proporciona una lista detallada de los productos químicos y materiales necesarios. En las siguientes secciones se describe la preparación de las soluciones requeridas, seguida de una descripción detallada del protocolo de inmunohistoquímica (Figura 1).
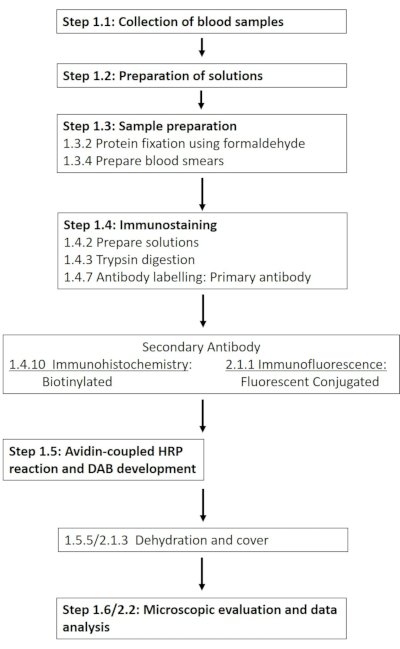
Figura 1: Esquema de los pasos individuales necesarios para la tinción inmunohistoquímica e inmunofluorescencia de RBC-NOS en el sitio de fosforilación 1177. Se presenta un flujo de trabajo típico de los protocolos presentados que abarca desde la preparación de la solución y la toma de muestras de sangre hasta la detección y visualización basadas en anticuerpos. Haga clic aquí para ver una versión más grande de esta figura.
- Toma de muestra de sangre
- Obtener muestras de sangre (10 ml de sangre entera) de siete varones sanos. Los voluntarios eran individuos sanos que, según se informa, no padecían enfermedades cardiovasculares, hematológicas, neurológicas, endocrinas o metabólicas. Los voluntarios también eran no fumadores.
- Extraer sangre con una aguja estéril y una jeringa de una vena prominente en la región antecubital del antebrazo, y transferirla inmediatamente a tubos recubiertos con uno de los siguientes anticoagulantes: heparina sódica (para inmunohistoquímica) o ácido etilendiaminotetraacético (EDTA; para marcaje fluorescente).
- Exponer las muestras de sangre anticoagulada a fuerzas mecánicas controladas con precisión utilizando un sistema de cizallamiento tipo Couette, como se describió anteriormente 7,20.
- El aparato de cizallamiento consta de una copa giratoria y un bob estacionario, separados por un espacio de 300 μm. Transfiera la muestra de sangre al espacio, lo que hace que la velocidad de rotación controlable con precisión de la copa ejerza fuerzas mecánicas bien controladas sobre la muestra. Los datos representativos presentados aquí se produjeron mediante la aplicación de fuerzas mecánicas que reflejan las que ocurren dentro de la vasculatura humana (5 Pa) durante períodos prolongados (300 s).
- Preparación de las soluciones necesarias para la inmunotinción
- Prepare las soluciones como se muestra en la Tabla 1. Las soluciones pueden prepararse antes de realizar el procedimiento de inmunotinción y almacenarse a una temperatura determinada hasta que se necesiten.
NOTA: La duración del almacenamiento puede variar entre los productos químicos. Consulte la ficha de datos de seguridad del material.
- Prepare las soluciones como se muestra en la Tabla 1. Las soluciones pueden prepararse antes de realizar el procedimiento de inmunotinción y almacenarse a una temperatura determinada hasta que se necesiten.
- Preparación de la muestra
- Procesar sangre entera inmediatamente después de la extracción o el tratamiento experimental (cuando corresponda; por ejemplo, estímulo mecánico en nuestras muestras; ver paso 1.1.3) para poder detectar efectos de corta duración, por ejemplo, después de la aplicación de esfuerzos cortantes, ejercicio, exposición a hipoxia de corta duración, etc.
- Realice la fijación de proteínas de glóbulos rojos con formaldehído de la siguiente manera: diluya la sangre entera en una proporción de 1:2 en una solución de paraformaldehído al 4% durante 20 minutos a temperatura ambiente (RT). Centrifugar la muestra a 132 x g durante 3 min a RT y retirar con cuidado el sobrenadante mediante pipeteo.
- Vuelva a suspender el gránulo de glóbulos rojos en dos volúmenes de solución salina tamponada con fosfato (PBS) 0,1 mol/L (dilución 1:3) e incube durante 5 min a RT. Repita la centrifugación como se ha descrito anteriormente y retire el sobrenadante, que debe ser transparente, pipeteando. Vuelva a suspender el gránulo de RBC en un volumen de 0,1 mol/L de PBS (dilución 1:2).
- Prepare frotis de sangre de la siguiente manera: etiquete un portaobjetos de microscopio con la identificación de la muestra, el anticuerpo aplicado, etc. con un bolígrafo resistente al alcohol (por ejemplo, lápiz). A continuación, añada 10 μl de la solución de glóbulos rojos preparada justo encima del campo de la etiqueta.
- Coloque un segundo portaobjetos sobre la muestra en un ángulo de aproximadamente 45° y disperse la muestra uniformemente a lo largo del portaobjetos. Fije el portaobjetos con calor sobre un quemador Bunsen colocando la muestra sobre el quemador con un movimiento constante durante 5-7 s.
NOTA: Se recomienda secar las muestras al aire antes de la fijación con calor. Las muestras se pueden almacenar en RT hasta la tinción (Figura 2).
- Tinción inmunohistoquímica
- Marque dos áreas en cada portaobjetos: un área de prueba en la que los glóbulos rojos se incuban con el respectivo anticuerpo primario y secundario, y un área de control en la que el anticuerpo primario se reemplaza por una solución de control. Esta área sirve como un control dentro del ensayo para determinar la señal de fondo de los glóbulos rojos.
- Prepare las soluciones antes o durante el procedimiento, según la Tabla 2. Se necesita un volumen de 300 μL por área de prueba y 200 μL por área de control.
NOTA: Es importante tener en cuenta que estos procedimientos de tinción basados en anticuerpos producen datos semicuantitativos, en lugar de cuantitativos. Por lo tanto, para garantizar que se puedan extraer conclusiones significativas de los datos producidos, se requieren muestras de control apropiadas (es decir, para proporcionar un punto de referencia para los cambios relativos evaluados en la activación de la proteína). - Para la digestión de la tripsina, descongele la tripsina al 0,1 % y equilibre a RT. Marque dos áreas en cada portaobjetos con un lápiz graso: un área de prueba (2/3 del portaobjetos) y un área de control (1/3 del portaobjetos). Aplique con cuidado solución salina tamponada con tris (TBS) con pipetas de transferencia para lavar las áreas de la muestra. Deje reposar el TBS durante 30 segundos y luego viértalo. Repita el paso de lavado.
NOTA: Agregue las siguientes soluciones tanto al control como al área de prueba, a menos que se indique lo contrario. Las áreas deben estar suficientemente cubiertas con la solución respectiva. Aplique las soluciones con pipetas de transferencia desechables y cambie las pipetas después de cada solución. - Añadir tripsina al 0,1%, cubrir los portaobjetos con una cámara de incubación especialmente diseñada con tapa o papel de aluminio, e incubar durante 30 minutos a 37 °C en una incubadora. Después de la incubación, detenga la reacción enzimática agregando agua del grifo. Vierte la solución. Lave ambas áreas 3 veces con TBS, como se describió anteriormente.
- Para bloquear la activación de la peroxidasa, agregue la solución de metanol e incube durante 30 minutos en RT. Cubra los portaobjetos durante ese tiempo. Vierte la solución.
NOTA: Para la detección de inmunofluorescencia (sección 2), este paso puede omitirse, dado que el bloqueo de las peroxidasas endógenas sirve para prevenir la señal artefactual causada por la detección con peroxidasa de rábano picante (HRP) e hidrato de 3,3′-diaminobencidina (DAB). - Lave ambas áreas 3 veces con TBS, como se describe en el paso 1.4.3. Agregue una solución de leche descremada al 3% e incube durante 30 minutos a RT para bloquear. Vierte la solución. No lavar después.
- Agregue anticuerpos primarios (AB) solo al área de prueba. Agregue la solución de control AB (consulte la Tabla 2) al área de control. Incubar las muestras a 4 °C durante la noche. Cubra los portaobjetos durante ese tiempo para evitar que se sequen.
NOTA: Evite transferir las soluciones de la prueba al área de control, ya que esto influirá en los valores de control. - Vierta la solución de anticuerpos. Lave ambas áreas 3 veces con TBS, como se describe en el paso 1.4.3.
- Realice un paso de bloqueo para evitar el enlace no específico. Añadir un 3% de suero normal de cabra e incubar durante 30 min a RT. Vierte la solución.
- Agregue la solución de anticuerpos secundarios e incube durante 30 minutos a RT. Vierta la solución de anticuerpos. Lave las áreas 3 veces con TBS, como se describe en el paso 1.4.3.
- Desarrollo de tinción y cobertura
- Llevar a cabo la reacción HRP acoplada a avidina (ver dilución en la Tabla 2) añadiendo una solución diluida de avidina-peroxidasa e incubando durante 30 min a RT. Verter la solución.
- Prepare la mezcla de DAB para desarrollar la inmunotinción antes de su uso, según la Tabla 3.
PRECAUCIÓN: DAB es peligroso. Considere las indicaciones de peligro H341 (se sospecha que causa defectos genéticos) y H350 (puede causar cáncer). Considere los siguientes consejos de prudencia: P201, P202, P280, P308+P313, P405 y P501. - Realice la tinción de control de DAB de la siguiente manera: recoja la solución HRP del paso 1.5.1 de un portaobjetos y mezcle con un pequeño volumen (por ejemplo, 1 ml) de solución de DAB preparada en un tubo de centrífuga separado antes de teñir. La mezcla debe desarrollar un color marrón/gris.
- Coloque los portaobjetos bajo un microscopio (aumento de al menos 200x) y agregue solución DAB a ambas áreas. Controle la tinción de los glóbulos rojos continuamente y detenga la tinción retirando la solución DAB con una pipeta desechable antes de que el fondo comience a colorear. Para la tinción con serina 1177 de RBC-NOS, el tiempo de incubación de DAB es de aproximadamente 17 min.
- Realice la deshidratación de la muestra. Coloque los portaobjetos en una rejilla de vidrio y sumérjalos durante 5 s cada uno en soluciones de etanol de varias diluciones, comenzando con el 70%, seguido del 96%, luego del 100% y finalmente en xilol. Retire los portaobjetos de la rejilla y colóquelos sobre un pañuelo de papel, con glóbulos rojos en la parte superior para absorber el exceso de líquido.
- Agregue dos o tres gotas de medio de montaje a lo largo de la guía. Cubra el portaobjetos con un cubreobjetos. Evite la inclusión de burbujas de aire, ya que esto dificulta la evaluación microscópica. Seque las muestras al menos durante la noche en una campana extractora.
- Realización de una evaluación microscópica
- Para la visualización y la obtención de imágenes, coloque los portaobjetos en un microscopio de luz transmitida con un aumento de al menos 200x. Asegúrese de que el microscopio esté acoplado a una cámara para tomar imágenes de los glóbulos rojos teñidos.
- Encienda la fuente de luz del microscopio. Encienda la cámara conectada al microscopio e inicie el software de control del microscopio. Utilice la microscopía de campo claro para determinar el enfoque adecuado girando las perillas de ajuste de enfoque grueso y fino y encontrando el nivel de enfoque donde los glóbulos rojos son visibles.
- Establezca los valores de fondo de las imágenes en 220 ± 5 valores de gris, medidos en tres áreas libres de celdas de la diapositiva. Para ello, abra la primera imagen con el software gratuito ImageJ. Seleccione la opción Valores medios de grises utilizando el panel Establecer medidas. Utilice el icono ovalado para medir el valor de gris con el comando Medir . Si los valores medidos están fuera de rango, ajuste la luz de fondo en el microscopio en consecuencia. Repita estos pasos hasta que los valores de fondo sean correctos.
NOTA: Estos valores de fondo deben estar dentro del rango dado para todas las imágenes tomadas. De lo contrario, los datos no son comparables. - Para el análisis del valor de gris de los RBC, marque el borde de cada RBC con la herramienta de selección Oval del software ImageJ. Determine los valores de gris de los glóbulos rojos individuales mediante el comando Medir . Mida los valores de gris de un mínimo de 50 glóbulos rojos de la prueba y un mínimo de 10 glóbulos rojos del área de control.
NOTA: El número total de glóbulos rojos analizados se puede ajustar individualmente. Cuantos más glóbulos rojos se analicen, más significativo será el resultado. Sin embargo, el número total de glóbulos rojos analizados debe ser comparable para cada condición, sujeto, etc. dentro de un experimento dado.- Evite el análisis de glóbulos rojos cerca del lápiz graso, ya que las manchas pueden ser incompletas en esta área. Evite el análisis de glóbulos rojos superpuestos, ya que esto afecta a la intensidad de la tinción. Utilice únicamente glóbulos rojos que estén separados de otros glóbulos rojos. Analice al menos cinco imágenes de la prueba y al menos dos imágenes del área de control para la evaluación de los glóbulos rojos 50/10. Incluya los glóbulos rojos de cada imagen en el análisis final.
- Para calcular la intensidad de la tinción, calcule las señales finales como:
(área de prueba individual RBC - fondo medio del área de prueba) - (área de control individual RBC - fondo medio del área de control)

Figura 2: Representación del proceso fijador y generación de frotis de sangre. (Esquema creado con BioRender.com.) Las muestras de sangre diluidas se fijan químicamente en paraformaldehído, luego se centrifugan y se lavan con solución salina tamponada con fosfato. Finalmente, la sangre resuspendida se unta en un portaobjetos de vidrio y se fija térmicamente flotando sobre la llama de un quemador Bunsen. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Condiciones de preparación y almacenamiento de las soluciones necesarias para la tinción inmunohistoquímica. La solución se puede preparar antes del protocolo. Haga clic aquí para descargar esta tabla.
Tabla 2: Descripción de las soluciones de anticuerpos para uso inmediato. Haga clic aquí para descargar esta tabla.
Tabla 3: Componentes y protocolo para preparar la solución DAB para su uso inmediato. Haga clic aquí para descargar esta tabla.
2. Marcaje fluorescente de proteínas de glóbulos rojos
NOTA: En la siguiente sección se describe una adaptación del protocolo inmunohistoquímico, desarrollado con el objetivo de permitir el uso de anticuerpos con conjugados fluorescentes (Figura 1).
La preparación de la muestra de sangre para el protocolo de inmunofluorescencia es idéntica a la descrita en la sección 1, por lo que la siguiente sección comienza con la tinción de las muestras.
- Tinción por inmunofluorescencia
- Incubar con el anticuerpo conjugado fluorescente secundario (para el volumen, ver paso 1.4.2) durante 30 min a RT protegido de la luz, utilizando una cámara de incubación especialmente diseñada o papel de aluminio.
- Vierta la solución de anticuerpos secundarios y lave las muestras 3 veces con TBS. Deje el lavado final en las muestras para evitar que se sequen.
- Vierta el TBS y retire las muestras de la gradilla de muestras una a la vez para evitar la exposición prolongada a la luz. Para deshidratar las muestras, exponga los portaobjetos a diferentes soluciones de etanol durante ~ 5 s cada una, comenzando con el 70 %, seguido del 90 % y finalmente el 100 %. Exponga los portaobjetos a una solución de xilol/xileno durante 5 s.
- Prepare un cubreobjetos con dos o tres gotas de medio de montaje y luego monte el portaobjetos con el cubreobjetos. Asegure una distribución uniforme del medio de montaje aplicando una ligera presión con pinzas o un instrumento metálico estéril similar. Elimine las burbujas de aire, que de otro modo podrían interferir con la obtención de imágenes, con el mismo instrumento. Deje que las muestras se sequen durante la noche en un espacio oscuro y seco.
- Evaluación microscópica
- Para la visualización y la obtención de imágenes, coloque el portaobjetos en la platina del microscopio con un aumento total de al menos 400x. Encienda la fuente de luz del microscopio y la fuente de luz fluorescente, asegurándose de que la fuente de luz fluorescente esté ajustada a la intensidad máxima.
- Encienda la cámara conectada al microscopio e inicie el software de control del microscopio. Utilice la microscopía de campo claro para determinar el enfoque adecuado girando las perillas de ajuste de enfoque grueso y fino, y encontrando el nivel de enfoque donde los glóbulos rojos son visibles.
NOTA: La exposición excesiva a la luz puede causar fotoblanqueo de los conjugados fluorescentes. Se puede utilizar una diapositiva de un experimento anterior para este propósito, para minimizar la exposición a la luz de las diapositivas que aún no se han analizado. - Determine la intensidad óptima del láser inspeccionando los glóbulos rojos en el área de control. Asegúrese de que la intensidad sea lo suficientemente alta como para que los glóbulos rojos sean visibles, sin producir una gran señal de fondo. Mantenga la intensidad y el tiempo de exposición consistentes entre áreas y muestras para garantizar la comparabilidad.
- Capture imágenes fluorescentes y de campo claro en al menos tres áreas distintas del área de prueba del portaobjetos, seleccionadas al azar. Para seleccionar un área, desplácese lejos de los bordes del portaobjetos marcados por el lápiz lipídico con los controles de platina del microscopio. Seleccione un área que muestre una distribución uniforme de una capa RBC singular.
- Ajuste el tiempo de exposición a 1 s para imágenes fluorescentes y capture una imagen utilizando los controles del software de control del microscopio. Cambie al modo de campo claro, establezca el tiempo de exposición en 'Auto' y capture la imagen de campo claro correspondiente.
- Capture imágenes fluorescentes y de campo claro en al menos dos áreas distintas seleccionadas al azar del área de control del portaobjetos repitiendo el paso 2.2.3.
- Guarde las imágenes en formato .tif para conservar los valores de gris originales de los píxeles, evitar la compresión y llevar metadatos de la adquisición.
- Mida los valores de gris de los glóbulos rojos capturados. Abra ImageJ (o FIJI21; consulte el archivo complementario 1). Determine los valores de gris de los glóbulos rojos individuales. Para ello, marque cada celda individual con la herramienta de selección Óvalo y analice con el comando Medir .
NOTA: Los glóbulos rojos no deben analizarse si se superponen con otras células, ya que esto puede aumentar la señal resultante. - Resalte entre tres y cinco áreas libres de glóbulos rojos y determine los valores de gris para proporcionar una medida de la señal de fondo. Analice al menos 150 glóbulos rojos de al menos tres imágenes distintas para cada área de prueba, y al menos 50 glóbulos rojos de al menos dos imágenes distintas para cada área de control.
NOTA: Se puede recomendar el análisis de más células/áreas para minimizar la variabilidad. Dado que la población de glóbulos rojos es inherentemente heterogénea, la variabilidad de la señal entre células puede ser significativa, dependiendo de la proteína de interés. - Realice análisis de datos alternativos de las imágenes capturadas mediante el comando macro. Cree/instale un comando de macro a través de la versión FIJI de ImageJ para la selección automatizada, la corrección de fondo y el análisis del valor de gris de una imagen determinada.
NOTA: Esta rutina utiliza umbrales automatizados para detectar las celdas presentes en una imagen determinada utilizando una copia de la imagen original, produciendo una superposición que se impone a la imagen original para extraer los valores de gris de los glóbulos rojos fluorescentes. La macro se deposita como un archivo .ijm, como Archivo de codificación suplementario 1. - Abra el archivo de imagen en formato .tif listo para su análisis en FIJI. Abra la macro RBC fluorescence.ijm (Supplementary Coding File 1) y haga clic en Ejecutar.
NOTA: La macro está configurada para imágenes obtenidas con un aumento de 600x y una gran relación señal-ruido. La selección automática de células debe ser revisada por el investigador.
- Calcule las señales finales como:
(área de prueba RBC - fondo del área de prueba) - (área de control RBC - fondo del área de control) para análisis manual;
(área de prueba - área de control) para análisis automatizado.
Resultados
El protocolo presentado, que describe los métodos que facilitan la detección de alteraciones agudas en las proteínas de los glóbulos rojos, se probó en una alteración proteica mecánicamente sensible bien conocida: la fosforilación de los glóbulos rojos en el residuo de serina 1177. La sangre entera se obtuvo de voluntarios sanos y posteriormente se dividió en dos alícuotas separadas. Una muestra de sangre dada se expuso a un esfuerzo de cizallamiento mecánico de magnitud fisiológica (5 Pa) durante 300 s, que...
Discusión
La literatura reciente sugiere que la proteína RBC-NOS es de crucial importancia para la regulación de la deformabilidad de los glóbulos rojos 15,22,23, lo que a su vez facilita su paso a través de capilares estrechos 24. La actividad proteica depende en gran medida de las modificaciones proteicas postraduccionales, en particular de la fosforilación de ciertos residuos18. El ...
Divulgaciones
Todos los autores han revelado que no hay conflictos de intereses.
Agradecimientos
LK agradece el apoyo de una beca del Programa de Capacitación en Investigación del Gobierno de Australia.
Materiales
| Name | Company | Catalog Number | Comments |
| 3,3′-Diaminobenzidin -tetrahydrochloride Hydrate | Sigma/Merck | D5637 | DAB |
| Ammoniumchloride | Merck /Millipore | 101145 | NH4Cl |
| Centrifuge 5427 R | Eppendorf | 5409000010 | |
| Coverslips | VWR | 631-0147 | |
| di-sodium Hydrogen Phosphate Dihydrate | Merck /Millipore | 106580 | Na2HPO4. 2 H2O |
| Disposable transfer pipettes | VWR | 612-6803 | |
| Entellan | Merck /Millipore | 107961 | rapid mounting medium for microscopy |
| Ethanol denaturated using 1 % methyl ethyl ketone (MEK) | Hofmann | 642 | |
| Glucose-Oxidase | Sigma/Merck | G2133 | |
| Grease pencil | Dako | S 2002 | |
| Horse-radish peroxidase/ExtrAvidin−Peroxidase | Sigma/Merck | E-2886 | HRP |
| Hydrochloric acid | Merck /Millipore | 109057 | HCl |
| Hydrogen peroxide, 30% | Merck /Millipore | 107203 | H2O2 |
| ImageJ Software | Freeware | ||
| Laser-assisted optical rotational cell analyser (LORCA) | RR Mechatronics | Ektacytometer instrument used for shearing | |
| Methanol | Merck /Millipore | 106009 | |
| Microscope slides | VWR | 630-1985 | |
| Nickel(II)-sulfate Hexahydrate | Sigma/Merck | N4882 | NiSO4.6H2O |
| Normal Goat serum | Agilent/DAKO | X0907 | NGS |
| Paraformaldehyde | Merck /Millipore | 818715 | PFA |
| Pipettes Eppendorf Reference 2 | VWR | 613-5836/ 613-5839 | |
| Rabbit Anti-phospho eNOS Antibody (Ser1177) | Merck/Millipore | 07-428-I | Primary Antibody |
| Reaction tubes, 2ml | Eppendorf | 30120094 | |
| Secondary Antibody goat anti rabbit | Agilent/DAKO | E0432 | Secondary Antibody |
| Skim milk powder | Bio-Rad | 170-6404 | |
| Sodium chloride | Merck /Millipore | 106404 | NaCl |
| Sodium Dihydrogen Phosphate Monohydrate | Merck /Millipore | 106346 | NaH2PO4.H2O |
| Sodium hydroxide, 1 M | Merck /Millipore | 150706 | NaOH |
| Tris(hydroxymethyl)-aminomethane | Merck /Millipore | 108382 | Tris |
| Trypsin | Sigma/Merck | T7409 | |
| Tween20 | Merck /Millipore | 822184 | |
| Whatman Glas microfiber filter, quality GF/F | Merck /Millipore | WHA1825047 | |
| Xylol | VWR Chemicals | 2,89,73,465 | |
| ß-D-Glucose monohydrate | Merck /Millipore | 14431-43-7 |
Referencias
- Cohen, R. M., et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood. 112 (10), 4284-4291 (2008).
- Mock, D. M., et al. Red blood cell (RBC) survival determined in humans using RBCs labeled at multiple biotin densities. Transfusion. 51 (5), 1047-1057 (2011).
- Thiagarajan, P., Parker, C. J., Prchal, J. T. How do red blood cells die?. Frontiers in Physiology. 12, 655393 (2021).
- Moras, M., Lefevre, S. D., Ostuni, M. A. From erythroblasts to mature red blood cells: organelle clearance in mammals. Frontiers in Physiology. 8, 1076 (2017).
- Pretini, V., et al. Red blood cells: chasing interactions. Frontiers in Physiology. 10, 945 (2019).
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Kuck, L., Peart, J. N., Simmonds, M. J. Piezo1 regulates shear-dependent nitric oxide production in human erythrocytes. American Journal of Physiology. Heart and Circulatory Physiology. 323 (1), H24-H37 (2022).
- Kuck, L., Peart, J. N., Simmonds, M. J. Active modulation of human erythrocyte mechanics. American Journal of Physiology. Cell Physiology. 319 (2), C250-C257 (2020).
- Strader, M. B., et al. Post-translational modification as a response to cellular stress induced by hemoglobin oxidation in sickle cell disease. Scientific Reports. 10 (1), 14218 (2020).
- Pecankova, K., Majek, P., Cermak, J., Dyr, J. E. Posttranslational modifications of red blood cell ghost proteins as "signatures" for distinguishing between low- and high-risk myelodysplastic syndrome patients. Turkish Journal of Haematology. 34 (1), 111-113 (2017).
- Grau, M., et al. High red blood cell nitric oxide synthase activation is not associated with improved vascular function and red blood cell deformability in sickle cell anaemia. British Journal of Haematology. 168 (5), 728-736 (2015).
- Sae-Lee, W., et al. The protein organization of a red blood cell. Cell Reports. 40 (3), 111103 (2022).
- Suhr, F., et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982 (2012).
- Kuck, L., Grau, M., Bloch, W., Simmonds, M. J. Shear stress ameliorates superoxide impairment to erythrocyte deformability with concurrent nitric oxide synthase activation. Frontiers in Physiology. 10, 36 (2019).
- Grau, M., et al. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759 (2013).
- Simmonds, M. J., Detterich, J. A., Connes, P. Nitric oxide, vasodilation and the red blood cell. Biorheology. 51 (2-3), 121-134 (2014).
- Bor-Kucukatay, M., Wenby, R. B., Meiselman, H. J., Baskurt, O. K. Effects of nitric oxide on red blood cell deformability. American Journal of Physiology. Heart and Circulatory Physiology. 284 (5), H1577-H1584 (2003).
- Suhr, F., et al. Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes. Nitric Oxide: Biology and Chemistry. 20 (2), 95-103 (2009).
- Grau, M., et al. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clinical Hemorheology and Microcirculation. 63 (3), 199-215 (2016).
- Grau, M., Kuck, L., Dietz, T., Bloch, W., Simmonds, M. J. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology. 10 (1), 47 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ozüyaman, B., Grau, M., Kelm, M., Merx, M. W., Kleinbongard, P. RBC NOS: regulatory mechanisms and therapeutic aspects. Trends in Molecular Medicine. 14 (7), 314-322 (2008).
- Kleinbongard, P., et al. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943-2951 (2006).
- McMahon, T. J. Red blood cell deformability, vasoactive mediators, and adhesion. Frontiers in Physiology. 10, 1417 (2019).
- Bizjak, D. A., Brinkmann, C., Bloch, W., Grau, M. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: a study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS One. 10 (4), 0125206 (2015).
- Di Pietro, N., et al. Nitric oxide synthetic pathway and cGMP levels are altered in red blood cells from end-stage renal disease patients. Molecular and Cellular Biochemistry. 417 (1-2), 155-167 (2016).
- Grau, M., et al. Even patients with mild COVID-19 symptoms after SARS-CoV-2 infection show prolonged altered red blood cell morphology and rheological parameters. Journal of Cellular and Molecular Medicine. 26 (10), 3022-3030 (2022).
- Mozar, A., et al. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clinical Hemorheology and Microcirculation. 64 (1), 47-53 (2016).
- Ulker, P., Gunduz, F., Meiselman, H. J., Baskurt, O. K. Nitric oxide generated by red blood cells following exposure to shear stress dilates isolated small mesenteric arteries under hypoxic conditions. Clinical Hemorheology and Microcirculation. 54 (4), 357-369 (2013).
- Nader, E., et al. Hydroxyurea therapy modulates sickle cell anemia red blood cell physiology: Impact on RBC deformability, oxidative stress, nitrite levels and nitric oxide synthase signalling pathway. Nitric Oxide: Biology and Chemistry. 81, 28-35 (2018).
- Fischer, U. M., Schindler, R., Brixius, K., Mehlhorn, U., Bloch, W. Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes. The Annals of Thoracic Surgery. 84 (6), 2000-2003 (2007).
- Horobin, J. T., Sabapathy, S., Kuck, L., Simmonds, M. J. Shear stress and RBC-NOS Serine1177 Phosphorylation in humans: a dose response. Life. 11 (1), 36 (2021).
- Kuck, L., Grau, M., Simmonds, M. J. Recovery time course of erythrocyte deformability following exposure to shear is dependent upon conditioning shear stress. Biorheology. 54 (5-6), 141-152 (2018).
- Grau, M., et al. Effect of acute exercise on RBC deformability and RBC nitric oxide synthase signalling pathway in young sickle cell anaemia patients. Scientific Reports. 9 (1), 11813 (2019).
- Feelisch, M. . Methods in Nitric Oxide Research. , (1998).
- Cortese-Krott, M. M., et al. Human red blood cells at work: identification and visualization of erythrocytic eNOS activity in health and disease. Blood>. 120 (20), 4229-4237 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados