Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выявление динамических изменений белков эритроцитов с помощью иммуноокрашивания
В этой статье
Резюме
Регистрация динамических изменений в белковой активации энуклеированных эритроцитов ставит перед нами методологические задачи, такие как сохранение динамических изменений острых стимулов для последующей оценки. Представленный протокол описывает методы пробоподготовки и окрашивания, которые позволяют сохранять и анализировать соответствующие изменения белка и последующее обнаружение.
Аннотация
Мечение антителами белков эритроцитов (эритроцитов) является широко используемым полуколичественным методом для обнаружения изменений в общем содержании белка или острых изменений в состояниях активации белка. Это облегчает оценку лечения эритроцитами, характеристику различий в определенных состояниях заболевания и описание клеточной когерентности. Обнаружение остро измененной активации белка (например, посредством механотрансдукции) требует соответствующей подготовки образца для сохранения временных модификаций белка. Основной принцип включает в себя иммобилизацию сайтов-мишеней связывания желаемых белков эритроцитов для обеспечения первоначального связывания специфических первичных антител. Образец подвергается дальнейшей обработке, чтобы гарантировать оптимальные условия для связывания вторичного антитела с соответствующим первичным антителом. Выделение нефлуоресцентных вторичных антител требует дополнительной обработки, включающей сопряжение биотин-авидин и применение 3,3-диаминобензидин-тетрагидрохлорида (DAB) для развития окрашивания, которое необходимо контролировать в режиме реального времени под микроскопом, чтобы вовремя остановить окисление и, следовательно, интенсивность окрашивания. Для определения интенсивности окрашивания изображения делаются с помощью стандартного светового микроскопа. В модификации этого протокола вместо него может быть применено флуоресцеин-конъюгированное вторичное антитело, преимущество которого заключается в том, что нет необходимости в дальнейшем этапе разработки. Эта процедура, однако, требует флуоресцентного объектива, прикрепленного к микроскопу для обнаружения окрашивания. Учитывая полуколичественный характер этих методов, крайне важно обеспечить несколько контрольных красителей для учета неспецифических реакций антител и фоновых сигналов. Здесь мы представляем как протоколы окрашивания, так и соответствующие аналитические процессы, чтобы сравнить и обсудить соответствующие результаты и преимущества различных методов окрашивания.
Введение
Эритроциты (эритроциты) проходят через сердечно-сосудистую систему в течение 70-140 дней, при этом средний возраст эритроцитов составляет примерно 115 дней1,2. Стареющие или поврежденные эритроциты удаляются из кровотока с помощью эритрофагоцитоза, эффективного процесса очистки, управляемого макрофагами3. Предопределенная продолжительность жизни этих клеток является одним из следствий отказа клеточных органелл, включая ядро, митохондрии и рибосомы, во время дифференцировки исозревания. Таким образом, циркулирующие эритроциты лишены трансляционного механизма, препятствующего синтезу новых белков3. Из этого следует, что динамические, посттрансляционные модификации существующих белков представляют собой единственный жизнеспособный механизм острой биохимической регуляции в ответ на внеклеточные и внутриклеточные стрессоры, действующие на эритроциты5.
Механические силы, по-видимому, являются основными внеклеточными сигналами, которые вызывают активацию или модуляцию биохимических путей в эритроцитах. Открытие механочувствительного белка Piezo1 в мембранах эритроцитов6 вдохновило несколько направлений исследований, изучающих механически активированную передачу сигналов в этих клетках7. Например, последние достижения показали, что физические свойства эритроцитов активно регулируются острыми и динамическими изменениями белков8, включая посттрансляционное фосфорилирование и убиквитинирование9. Поскольку эти нормальные модификации различаются при определенных заболеваниях 9,10,11, представляется научным и клиническим интересом определение состояния активации белков эритроцитов, особенно в отношении механобиологических процессов.
Определение острых изменений состояний активации белка эритроцитов ставит ряд методологических задач. Например, хранение образцов эритроцитов для последующего анализа требует сохранения модифицированных белков эритроцитов, так как посттрансляционные модификации недолговечны. Более того, классические методы обнаружения белка (например, вестерн-блоттинг), как известно, трудно стандартизировать в эритроцитах из-за низкого содержания белков по отношению к гемоглобину, на долю которого приходится ~98% содержания белка в этих клетках12. Таким образом, окрашивание химически консервированных эритроцитов на основе антител является методом выбора при исследовании острых модификаций важных белков эритроцитов, таких как эритро-специфическая изоформа синтазы оксида азота (RBC-NOS)13,14. Было показано, что RBC-NOS ферментативно продуцирует оксид азота (NO), который, по-видимому, необходим для основных свойств эритроцитов, включая деформируемость эритроцитов15,16,17. Посттрансляционные модификации RBC-NOS регулируют каталитическую активность фермента, при этом фосфорилирование остатка серина 1177 описано для увеличения активности фермента, в то время как фосфорилирование остатков серина 114 или треонина 495 было связано со снижением активности RBC-NOS18,19.
В совокупности временные модификации белков эритроцитов вносят свой вклад в важную клеточную функцию, и стандартизированные протоколы, позволяющие обнаруживать эти модифицированные белки, имеют высокую ценность. В этой статье мы представим два различных протокола, которые используют специфические антитела для облегчения обнаружения активации белка RBC-NOS, и обсудим рекомендации по анализу и интерпретации данных.
Эффективность описанных протоколов оценивалась путем измерения хорошо зарегистрированного увеличения фосфорилирования RBC-NOS в остатке серина 1177 в ответ на механические силы, отражающие те, которые происходят в сосудистой сети человека (5 Па).
протокол
Протоколы, описанные здесь, соответствуют Хельсинкской декларации и были одобрены комитетами по этике Немецкого университета спорта в Кельне (16.09.2013) и Университета Гриффита (2019/808). Добровольцы прошли скрининг на отсутствие соответствующих патологий и получили письменное информированное согласие.
1. Окрашивание белков эритроцитов по протоколам иммуногистохимии
ПРИМЕЧАНИЕ: Подробный список необходимых химикатов и материалов приведен в таблице материалов. В следующих разделах описывается приготовление необходимых растворов, за которыми следует подробное описание протокола иммуногистохимии (рис. 1).
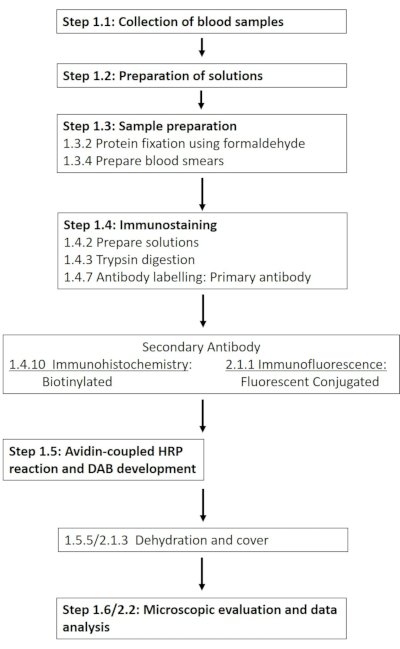
Рисунок 1: Схема отдельных этапов, необходимых для иммуногистохимического и иммунофлуоресцентного окрашивания эритроцитов-NOS в сайте фосфорилирования 1177. Представлен типичный рабочий процесс представленных протоколов, охватывающий период от приготовления раствора и забора крови до обнаружения и визуализации на основе антител. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Забор образца крови
- Получить образцы крови (10 мл цельной крови) у семи здоровых мужчин. Добровольцы были здоровыми людьми, которые, как сообщается, не страдали сердечно-сосудистыми, гематологическими, неврологическими, эндокринными или метаболическими заболеваниями. Добровольцы также были некурящими.
- Возьмите кровь с помощью стерильной иглы и шприца из выступающей вены в локтевой области предплечья и немедленно переложите в пробирки, покрытые одним из следующих антикоагулянтов: гепарином натрия (для иммуногистохимии) или этилендиаминтетрауксусной кислотой (ЭДТА; для флуоресцентного мечения).
- Подвергают образцы крови с антикоагулянтами точно контролируемым механическим воздействиям с помощью системы сдвига типа Куэтта, как описано выше 7,20.
- Режущий аппарат состоит из вращающейся чашки и неподвижного боба, разделенных зазором 300 мкм. Перенесите образец крови в зазор, что приведет к тому, что точно контролируемая скорость вращения чашки будет оказывать на образец хорошо контролируемые механические силы. Репрезентативные данные, представленные здесь, были получены путем применения механических сил, отражающих силы, возникающие в сосудистой сети человека (5 Па), в течение длительного времени (300 с).
- Приготовление растворов, необходимых для иммуноокрашивания
- Готовят растворы, как указано в таблице 1. Растворы могут быть приготовлены перед проведением процедуры иммуноокрашивания и храниться при заданной температуре до тех пор, пока они не понадобятся.
ПРИМЕЧАНИЕ: Продолжительность хранения может варьироваться в зависимости от химикатов. Ознакомьтесь с паспортом безопасности материала.
- Готовят растворы, как указано в таблице 1. Растворы могут быть приготовлены перед проведением процедуры иммуноокрашивания и храниться при заданной температуре до тех пор, пока они не понадобятся.
- Подготовка образцов
- Обрабатывайте цельную кровь сразу после отмены или экспериментального лечения (где это применимо; например, механический стимул в наших образцах; см. шаг 1.1.3), чтобы иметь возможность обнаружить кратковременные эффекты, например, после приложения напряжения сдвига, физической нагрузки, кратковременного воздействия гипоксии и т. д.
- Фиксацию белка эритроцитов с помощью формальдегида проводят следующим образом: цельную кровь разводят в соотношении 1:2 в 4% растворе параформальдегида в течение 20 мин при комнатной температуре (RT). Центрифугируют образец при 132 x g в течение 3 мин при RT и осторожно удаляют надосадочную жидкость пипетированием.
- Повторно суспендируйте гранулу эритроцитов в двух объемах 0,1 моль/л фосфатно-солевого буфера (PBS) (разведение 1:3) и инкубируйте в течение 5 мин при RT. Повторите центрифугирование, как описано выше, и удалите надосадочную жидкость, которая должна быть прозрачной, путем пипетирования. Повторно суспендируйте гранулу эритроцитов в одном объеме 0,1 моль/л PBS (разведение 1:2).
- Подготовьте мазки крови следующим образом: пометьте предметное стекло микроскопа с идентификатором образца, нанесенными антителами и т. д. с помощью спиртостойкой ручки (например, карандаша). Затем добавьте 10 мкл приготовленного раствора эритроцитов прямо над полем этикетки.
- Поместите второе предметное стекло на образец под углом примерно 45° и равномерно распределите образец вдоль предметного стекла. Закрепите ползун над горелкой Бунзена, наведя образец над горелкой с постоянным движением в течение 5-7 с.
ПРИМЕЧАНИЕ: Перед термофиксацией образцы рекомендуется высушить на воздухе. Образцы могут храниться в RT до окрашивания (рис. 2).
- Иммуногистохимическое окрашивание
- На каждом предметном стекле отметьте две области: тестовую область, в которой эритроциты инкубируются с соответствующими первичными и вторичными антителами, и контрольную область, в которой первичное антитело заменяется контрольным раствором. Эта область служит в качестве пробирного контроля для определения фонового сигнала эритроцитов.
- Готовьте растворы до или во время процедуры, как указано в таблице 2. Объем 300 мкл требуется на тестовую область и 200 мкл на контрольную зону.
ПРИМЕЧАНИЕ: Важно отметить, что эти процедуры окрашивания на основе антител дают полуколичественные, а не количественные данные. Таким образом, для того, чтобы на основе полученных данных можно было сделать значимые выводы, абсолютно необходимы соответствующие контрольные образцы (т.е. для обеспечения ориентира для оцениваемых относительных изменений активации белка). - Для переваривания трипсина разморозьте 0,1% трипсина и уравновешивайте до RT. Отметьте на каждом предметном стекле две области с помощью жирного карандаша: тестовую область (2/3 предметного стекла) и контрольную область (1/3 предметного стекла). Осторожно нанесите трис-буферный физиологический раствор (TBS) с помощью трансферных пипеток для промывки участков образца. Дайте TBS постоять 30 с, а затем слейте его. Повторите этап стирки.
ПРИМЕЧАНИЕ: Добавьте следующие решения как в контрольную, так и в тестовую область, если не описано иное. Участки должны быть в достаточной степени покрыты соответствующим раствором. Наносите растворы с помощью одноразовых трансферных пипеток и меняйте пипетки после каждого раствора. - Добавьте 0,1% трипсина, накройте предметные стекла специальной инкубационной камерой с крышкой или алюминиевой фольгой и инкубируйте в течение 30 минут при 37 °C в инкубаторе. После инкубации остановите ферментную реакцию, добавив водопроводную воду. Слейте раствор. Промойте обе области 3 раза TBS, как описано выше.
- Для блокировки активации пероксидазы добавляют раствор метанола и инкубируют в течение 30 мин при RT. Накройте предметные стекла в течение этого времени. Слейте раствор.
ПРИМЕЧАНИЕ: При иммунофлюоресцентном обнаружении (раздел 2) этот этап может быть опущен, учитывая, что блокирование эндогенных пероксидаз служит для предотвращения артефактного сигнала, вызванного обнаружением с помощью пероксидазы хрена (HRP) и 3,3′-диаминобензидина гидрата (DAB). - Промойте обе области 3 раза TBS, как описано в шаге 1.4.3. Добавьте 3% раствор обезжиренного молока и инкубируйте в течение 30 мин при RT до блокировки. Слейте раствор. После этого не стирать.
- Добавляйте первичные антитела (АБ) только в тестовую область. Добавьте в область управления решение AB (см. таблицу 2). Инкубируйте образцы при температуре 4 °C в течение ночи. Накройте предметные стекла в течение этого времени, чтобы предотвратить высыхание.
ПРИМЕЧАНИЕ: Избегайте переноса растворов из тестовой зоны в контрольную, так как это повлияет на контрольные значения. - Слейте раствор антител. Промойте обе области 3 раза TBS, как описано в шаге 1.4.3.
- Выполните шаг блокировки, чтобы предотвратить неспецифическую привязку. Добавьте 3% обычную козью сыворотку и инкубируйте 30 мин при RT. Слейте раствор.
- Добавьте раствор вторичных антител и инкубируйте в течение 30 мин при ЛТ. Слейте раствор антител. Промойте участки 3 раза TBS, как описано в шаге 1.4.3.
- Разработка окрашивания и покрытия
- Проводят авидин-связанную реакцию HRP (см. разведение в табл. 2), добавляя разбавленный раствор авидинпероксидазы и инкубируя в течение 30 мин при РТ. Слейте раствор.
- Перед использованием приготовьте смесь DAB для развития иммуноокрашивания, как указано в таблице 3.
ВНИМАНИЕ: DAB опасен. Обратите внимание на заявления об опасности H341 (подозревается в возникновении генетических дефектов) и H350 (может вызвать рак). Примите во внимание следующие меры предосторожности: P201, P202, P280, P308+P313, P405 и P501. - Контрольное окрашивание DAB выполняют следующим образом: перед окрашиванием берут раствор HRP из этапа 1.5.1 со предметного стекла и смешивают с небольшим объемом (например, 1 мл) приготовленного раствора DAB в отдельной центрифужной пробирке. Смесь должна приобрести коричнево-серый цвет.
- Поместите предметные стекла под микроскоп (увеличение не менее 200x) и добавьте DAB-раствор на обе области. Постоянно контролируйте окрашивание эритроцитов и остановите окрашивание, удалив раствор DAB с помощью одноразовой пипетки до того, как фон начнет окрашиваться. Для окрашивания эритроцитами серина 1177 время инкубации DAB составляет около 17 мин.
- Выполните обезвоживание образца. Поместите предметные стекла в стеклянную стойку и погрузите на 5 с каждый в растворы этанола различного разведения, начиная с 70%, затем до 96%, а затем до 100% и, наконец, в ксилол. Снимите предметные стекла со стойки и положите на салфетку так, чтобы эритроциты были вверху, чтобы впитать лишнюю жидкость.
- Добавьте две-три капли монтажного носителя по всей длине слайда. Накройте слайд с помощью покровного стекла. Избегайте включения пузырьков воздуха, так как это затрудняет микроскопическую оценку. Просушите образцы не менее ночи в вытяжном шкафу.
- Проведение микроскопической оценки
- Для визуализации и визуализации поместите предметные стекла в микроскоп с проходящим светом с увеличением не менее 200x. Убедитесь, что микроскоп подключен к камере, чтобы сфотографировать окрашенные эритроциты.
- Включите источник света микроскопа. Включите камеру, подключенную к микроскопу, и запустите управляющее программное обеспечение микроскопа. Используйте светлопольную микроскопию, чтобы определить подходящую фокусировку, поворачивая ручки грубой и точной регулировки фокуса и находя уровень фокусировки, при котором видны эритроциты.
- Установите фоновые значения снимков на 220 ± 5 значений серого, измеренных на трех свободных от ячеек областях слайда. Для этого откройте первый снимок с помощью бесплатного программного обеспечения ImageJ. Выберите опцию Средние значения серого с помощью панели Задать измерения. Используйте овальный значок, чтобы измерить значение серого цвета с помощью команды Измерить . Если измеренные значения выходят за пределы допустимого диапазона, отрегулируйте фоновое освещение микроскопа соответствующим образом. Повторяйте эти действия до тех пор, пока фоновые значения не станут правильными.
ПРИМЕЧАНИЕ: Эти значения фона должны быть в пределах заданного диапазона для всех сделанных изображений. В противном случае данные несопоставимы. - Для анализа значения серого эритроцитов отметьте край каждого эритроцита с помощью инструмента выделения «Овал» в программном обеспечении ImageJ. Определите значения серого для отдельных эритроцитов с помощью команды Измерить . Измерьте значения серого минимум 50 эритроцитов из теста и минимум 10 эритроцитов из контрольной области.
ПРИМЕЧАНИЕ: Общее количество анализируемых эритроцитов может быть скорректировано индивидуально. Чем больше эритроцитов проанализировано, тем значимее результат. Однако общее количество анализируемых эритроцитов должно быть сопоставимо для каждого состояния, субъекта и т.д. в рамках данного эксперимента.- Избегайте анализа эритроцитов рядом с жирным карандашом, так как окрашивание в этой области может быть неполным. Избегайте анализа перекрывающихся эритроцитов, так как это влияет на интенсивность окрашивания. Используйте только те эритроциты, которые отделены от других эритроцитов. Проанализируйте не менее пяти изображений из теста и не менее двух изображений из контрольной области для оценки 50/10 эритроцитов. Включите эритроциты с каждой картинки в окончательный анализ.
- Чтобы рассчитать интенсивность окрашивания, вычислите конечные сигналы следующим образом:
(индивидуальная тестовая зона эритроцит - средний фон тестовой зоны) - (индивидуальная контрольная область эритроцит - средний фон контрольной зоны)

Рисунок 2: Изображение процесса фиксации и образования мазка крови. (Схема создана с помощью BioRender.com.) Разбавленные образцы крови химически фиксируют в параформальдегиде, затем центрифугируют и промывают фосфатно-солевым буфером. Наконец, ресуспендированная кровь размазывается по предметному стеклу и термически фиксируется путем зависания над пламенем горелки Бунзена. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Условия приготовления и хранения растворов, необходимых для иммуногистохимического окрашивания. Раствор может быть приготовлен до протокола. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Описание растворов антител для немедленного применения. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 3: Компоненты и протокол подготовки раствора DAB к немедленному использованию. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
2. Флуоресцентное мечение белков эритроцитов
ПРИМЕЧАНИЕ: В следующем разделе описывается адаптация иммуногистохимического протокола, разработанного с целью обеспечения возможности использования антител с флуоресцентными конъюгатами (рис. 1).
Подготовка образцов крови для протокола иммунофлюоресценции идентична той, что описана в разделе 1, поэтому следующий раздел начинается с окрашивания образцов.
- Иммунофлуоресцентное окрашивание
- Инкубируют со вторичным флуоресцентным конъюгированным антителом (объем см. в шаге 1.4.2) в течение 30 мин при ОТ, защищенном от света, используя либо специально построенную инкубационную камеру, либо алюминиевую фольгу.
- Слейте вторичный раствор антител и промойте образцы 3 раза TBS. Оставьте окончательную промывку на образцах, чтобы предотвратить их высыхание.
- Слейте TBS и вынимайте образцы из штатива образцов по одному, чтобы предотвратить длительное воздействие света. Для обезвоживания образцов подвергают предметные стекла воздействию различных растворов этанола в течение ~5 с каждый, начиная с 70%, затем 90% и, наконец, 100%. Подвергайте предметные стекла воздействию раствора ксилола/ксилола в течение 5 с.
- Подготовьте покровный лист с двумя-тремя каплями монтажного материала, а затем закрепите салазки с помощью покровного стекла. Обеспечьте равномерное распределение монтажной среды, слегка надавливая пинцетом или аналогичным стерильным металлическим инструментом. Удалите пузырьки воздуха, которые в противном случае могут помешать визуализации, с помощью того же инструмента. Оставьте образцы сохнуть на ночь в темном и сухом месте.
- Микроскопическая оценка
- Для визуализации и визуализации поместите предметное стекло на предметный столик микроскопа с общим увеличением не менее 400x. Включите источник света микроскопа и источник флуоресцентного света, убедившись, что источник флуоресцентного света настроен на максимальную интенсивность.
- Включите камеру, подключенную к микроскопу, и запустите управляющее программное обеспечение микроскопа. Используйте светлопольную микроскопию, чтобы определить подходящую фокусировку, поворачивая ручки грубой и точной регулировки фокусировки и находя уровень фокусировки, при котором видны эритроциты.
ПРИМЕЧАНИЕ: Чрезмерное воздействие света может привести к фотообесцвечиванию флуоресцентных конъюгатов. Для этого можно использовать слайд из предыдущего эксперимента, чтобы свести к минимуму световое воздействие на слайды, которые еще предстоит проанализировать. - Определите оптимальную интенсивность лазерного излучения, проверив эритроциты в контрольной зоне. Убедитесь, что интенсивность достаточно высока, чтобы эритроциты были видны, но при этом не создавали большого фонового сигнала. Поддерживайте одинаковую интенсивность и время экспозиции между областями и образцами, чтобы обеспечить сопоставимость.
- Захват светлопольных и флуоресцентных изображений по крайней мере в трех различных областях тестовой области предметного стекла, выбранных случайным образом. Чтобы выбрать область, отведите курсор от краев предметного стекла, отмеченных липидной ручкой, с помощью элементов управления предметным столиком микроскопа. Выберите область, демонстрирующую равномерное распределение сингулярного слоя эритроцитов.
- Установите время экспозиции 1 с для флуоресцентных изображений и сделайте снимок с помощью программного обеспечения управления микроскопом. Переключитесь в режим светлого поля, установите время экспозиции на «Авто» и сделайте соответствующий снимок светлого поля.
- Захват яркопольных и флуоресцентных изображений по меньшей мере в двух различных случайно выбранных областях контрольной области предметного стекла, повторив шаг 2.2.3.
- Сохраняйте изображения в формате .tif, чтобы сохранить исходные значения серого пикселей, предотвратить сжатие и сохранить метаданные получения.
- Измерьте значения серого для захваченных эритроцитов. Откройте ImageJ (или FIJI21; см. Дополнительный файл 1). Определите серые значения отдельных эритроцитов. Для этого отметьте каждую отдельную ячейку инструментом «Овальное выделение» и проанализируйте с помощью команды «Измерить ».
ПРИМЕЧАНИЕ: Эритроциты не следует анализировать, если они перекрываются с другими клетками, так как это может увеличить результирующий сигнал. - Выделите от трех до пяти областей, свободных от эритроцитов, и определите значения серого, чтобы обеспечить измерение фонового сигнала. Проанализируйте не менее 150 эритроцитов по крайней мере из трех различных изображений для каждой тестовой области и не менее 50 эритроцитов по крайней мере из двух различных изображений для каждой контрольной области.
ПРИМЕЧАНИЕ: Для минимизации вариабельности может быть рекомендован анализ большего количества клеток/областей. Учитывая, что популяция эритроцитов по своей природе гетерогенна, межклеточная вариабельность сигнала может быть значительной, в зависимости от интересующего белка. - Выполняйте альтернативный анализ данных захваченных изображений с помощью команды макроса. Создайте/установите команду макроса в версии ImageJ для FIJI для автоматического выбора, коррекции фона и анализа значений серого для данного изображения.
ПРИМЕЧАНИЕ: Эта процедура использует автоматическое пороговое значение для обнаружения клеток, присутствующих в данном изображении, используя копию исходного изображения, создавая наложение, которое накладывается на исходное изображение для извлечения значений серого флуоресцентных эритроцитов. Макрос хранится в виде файла .ijm в виде дополнительного файла кодирования 1. - Откройте файл изображения в формате .tif, готовый к анализу в FIJI. Откройте макрос RBC fluorescence.ijm (Supplementary Coding File 1) и нажмите кнопку Выполнить.
ПРИМЕЧАНИЕ: Макрос настроен для изображений, полученных с 600-кратным увеличением и большим соотношением сигнал/шум. Автоматический отбор клеток должен быть рассмотрен исследователем.
- Вычислите конечные сигналы следующим образом:
(test area RBC - test area background) - (control area RBC - control area background) для ручного анализа;
(тестовая зона - контрольная зона) для автоматизированного анализа.
Результаты
Представленный протокол, описывающий методы, облегчающие выявление острых изменений в белках эритроцитов, был апробирован на известном механически чувствительном изменении белка: фосфорилировании эритроцитов-NOS по остатку серина 1177. Цельная кровь была получена от здоровых доброволь...
Обсуждение
В современной литературе высказывается предположение, что белок RBC-NOS имеет решающее значение для регуляции деформируемости эритроцитов 15,22,23, что, в свою очередь, облегчает их прохождение через узкие капилляры 24. Активнос...
Раскрытие информации
Все авторы сообщили, что конфликт интересов отсутствует.
Благодарности
LK выражает признательность за поддержку стипендии Австралийской государственной программы подготовки научных кадров.
Материалы
| Name | Company | Catalog Number | Comments |
| 3,3′-Diaminobenzidin -tetrahydrochloride Hydrate | Sigma/Merck | D5637 | DAB |
| Ammoniumchloride | Merck /Millipore | 101145 | NH4Cl |
| Centrifuge 5427 R | Eppendorf | 5409000010 | |
| Coverslips | VWR | 631-0147 | |
| di-sodium Hydrogen Phosphate Dihydrate | Merck /Millipore | 106580 | Na2HPO4. 2 H2O |
| Disposable transfer pipettes | VWR | 612-6803 | |
| Entellan | Merck /Millipore | 107961 | rapid mounting medium for microscopy |
| Ethanol denaturated using 1 % methyl ethyl ketone (MEK) | Hofmann | 642 | |
| Glucose-Oxidase | Sigma/Merck | G2133 | |
| Grease pencil | Dako | S 2002 | |
| Horse-radish peroxidase/ExtrAvidin−Peroxidase | Sigma/Merck | E-2886 | HRP |
| Hydrochloric acid | Merck /Millipore | 109057 | HCl |
| Hydrogen peroxide, 30% | Merck /Millipore | 107203 | H2O2 |
| ImageJ Software | Freeware | ||
| Laser-assisted optical rotational cell analyser (LORCA) | RR Mechatronics | Ektacytometer instrument used for shearing | |
| Methanol | Merck /Millipore | 106009 | |
| Microscope slides | VWR | 630-1985 | |
| Nickel(II)-sulfate Hexahydrate | Sigma/Merck | N4882 | NiSO4.6H2O |
| Normal Goat serum | Agilent/DAKO | X0907 | NGS |
| Paraformaldehyde | Merck /Millipore | 818715 | PFA |
| Pipettes Eppendorf Reference 2 | VWR | 613-5836/ 613-5839 | |
| Rabbit Anti-phospho eNOS Antibody (Ser1177) | Merck/Millipore | 07-428-I | Primary Antibody |
| Reaction tubes, 2ml | Eppendorf | 30120094 | |
| Secondary Antibody goat anti rabbit | Agilent/DAKO | E0432 | Secondary Antibody |
| Skim milk powder | Bio-Rad | 170-6404 | |
| Sodium chloride | Merck /Millipore | 106404 | NaCl |
| Sodium Dihydrogen Phosphate Monohydrate | Merck /Millipore | 106346 | NaH2PO4.H2O |
| Sodium hydroxide, 1 M | Merck /Millipore | 150706 | NaOH |
| Tris(hydroxymethyl)-aminomethane | Merck /Millipore | 108382 | Tris |
| Trypsin | Sigma/Merck | T7409 | |
| Tween20 | Merck /Millipore | 822184 | |
| Whatman Glas microfiber filter, quality GF/F | Merck /Millipore | WHA1825047 | |
| Xylol | VWR Chemicals | 2,89,73,465 | |
| ß-D-Glucose monohydrate | Merck /Millipore | 14431-43-7 |
Ссылки
- Cohen, R. M., et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood. 112 (10), 4284-4291 (2008).
- Mock, D. M., et al. Red blood cell (RBC) survival determined in humans using RBCs labeled at multiple biotin densities. Transfusion. 51 (5), 1047-1057 (2011).
- Thiagarajan, P., Parker, C. J., Prchal, J. T. How do red blood cells die?. Frontiers in Physiology. 12, 655393 (2021).
- Moras, M., Lefevre, S. D., Ostuni, M. A. From erythroblasts to mature red blood cells: organelle clearance in mammals. Frontiers in Physiology. 8, 1076 (2017).
- Pretini, V., et al. Red blood cells: chasing interactions. Frontiers in Physiology. 10, 945 (2019).
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Kuck, L., Peart, J. N., Simmonds, M. J. Piezo1 regulates shear-dependent nitric oxide production in human erythrocytes. American Journal of Physiology. Heart and Circulatory Physiology. 323 (1), H24-H37 (2022).
- Kuck, L., Peart, J. N., Simmonds, M. J. Active modulation of human erythrocyte mechanics. American Journal of Physiology. Cell Physiology. 319 (2), C250-C257 (2020).
- Strader, M. B., et al. Post-translational modification as a response to cellular stress induced by hemoglobin oxidation in sickle cell disease. Scientific Reports. 10 (1), 14218 (2020).
- Pecankova, K., Majek, P., Cermak, J., Dyr, J. E. Posttranslational modifications of red blood cell ghost proteins as "signatures" for distinguishing between low- and high-risk myelodysplastic syndrome patients. Turkish Journal of Haematology. 34 (1), 111-113 (2017).
- Grau, M., et al. High red blood cell nitric oxide synthase activation is not associated with improved vascular function and red blood cell deformability in sickle cell anaemia. British Journal of Haematology. 168 (5), 728-736 (2015).
- Sae-Lee, W., et al. The protein organization of a red blood cell. Cell Reports. 40 (3), 111103 (2022).
- Suhr, F., et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982 (2012).
- Kuck, L., Grau, M., Bloch, W., Simmonds, M. J. Shear stress ameliorates superoxide impairment to erythrocyte deformability with concurrent nitric oxide synthase activation. Frontiers in Physiology. 10, 36 (2019).
- Grau, M., et al. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759 (2013).
- Simmonds, M. J., Detterich, J. A., Connes, P. Nitric oxide, vasodilation and the red blood cell. Biorheology. 51 (2-3), 121-134 (2014).
- Bor-Kucukatay, M., Wenby, R. B., Meiselman, H. J., Baskurt, O. K. Effects of nitric oxide on red blood cell deformability. American Journal of Physiology. Heart and Circulatory Physiology. 284 (5), H1577-H1584 (2003).
- Suhr, F., et al. Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes. Nitric Oxide: Biology and Chemistry. 20 (2), 95-103 (2009).
- Grau, M., et al. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clinical Hemorheology and Microcirculation. 63 (3), 199-215 (2016).
- Grau, M., Kuck, L., Dietz, T., Bloch, W., Simmonds, M. J. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology. 10 (1), 47 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ozüyaman, B., Grau, M., Kelm, M., Merx, M. W., Kleinbongard, P. RBC NOS: regulatory mechanisms and therapeutic aspects. Trends in Molecular Medicine. 14 (7), 314-322 (2008).
- Kleinbongard, P., et al. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943-2951 (2006).
- McMahon, T. J. Red blood cell deformability, vasoactive mediators, and adhesion. Frontiers in Physiology. 10, 1417 (2019).
- Bizjak, D. A., Brinkmann, C., Bloch, W., Grau, M. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: a study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS One. 10 (4), 0125206 (2015).
- Di Pietro, N., et al. Nitric oxide synthetic pathway and cGMP levels are altered in red blood cells from end-stage renal disease patients. Molecular and Cellular Biochemistry. 417 (1-2), 155-167 (2016).
- Grau, M., et al. Even patients with mild COVID-19 symptoms after SARS-CoV-2 infection show prolonged altered red blood cell morphology and rheological parameters. Journal of Cellular and Molecular Medicine. 26 (10), 3022-3030 (2022).
- Mozar, A., et al. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clinical Hemorheology and Microcirculation. 64 (1), 47-53 (2016).
- Ulker, P., Gunduz, F., Meiselman, H. J., Baskurt, O. K. Nitric oxide generated by red blood cells following exposure to shear stress dilates isolated small mesenteric arteries under hypoxic conditions. Clinical Hemorheology and Microcirculation. 54 (4), 357-369 (2013).
- Nader, E., et al. Hydroxyurea therapy modulates sickle cell anemia red blood cell physiology: Impact on RBC deformability, oxidative stress, nitrite levels and nitric oxide synthase signalling pathway. Nitric Oxide: Biology and Chemistry. 81, 28-35 (2018).
- Fischer, U. M., Schindler, R., Brixius, K., Mehlhorn, U., Bloch, W. Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes. The Annals of Thoracic Surgery. 84 (6), 2000-2003 (2007).
- Horobin, J. T., Sabapathy, S., Kuck, L., Simmonds, M. J. Shear stress and RBC-NOS Serine1177 Phosphorylation in humans: a dose response. Life. 11 (1), 36 (2021).
- Kuck, L., Grau, M., Simmonds, M. J. Recovery time course of erythrocyte deformability following exposure to shear is dependent upon conditioning shear stress. Biorheology. 54 (5-6), 141-152 (2018).
- Grau, M., et al. Effect of acute exercise on RBC deformability and RBC nitric oxide synthase signalling pathway in young sickle cell anaemia patients. Scientific Reports. 9 (1), 11813 (2019).
- Feelisch, M. . Methods in Nitric Oxide Research. , (1998).
- Cortese-Krott, M. M., et al. Human red blood cells at work: identification and visualization of erythrocytic eNOS activity in health and disease. Blood>. 120 (20), 4229-4237 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены