需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
基于免疫染色的红细胞蛋白动态改变检测
摘要
捕获去核红细胞蛋白质活化的动态变化带来了方法学挑战,例如保留急性刺激的动态变化以供以后评估。所提出的方案描述了样品制备和染色技术,这些技术能够保存和分析相关的蛋白质变化和随后的检测。
摘要
红细胞(RBC)蛋白的抗体标记是一种常用的半定量方法,用于检测总蛋白质含量的变化或蛋白质活化状态的急性改变。它有助于评估红细胞治疗,表征某些疾病状态的差异以及描述细胞一致性。检测急性改变的蛋白质活化(例如,通过机械转导)需要足够的样品制备,以保留其他暂时的蛋白质修饰。基本原理包括固定所需红细胞蛋白的靶结合位点,以实现特异性一抗的初始结合。对样品进行进一步处理,以保证二抗与相应一抗结合的最佳条件。非荧光二抗的选择需要额外的处理,包括生物素-亲和素偶联和应用3,3-二氨基联苯胺-四盐酸盐(DAB)进行染色,需要在显微镜下实时控制染色,以便及时停止氧化,从而停止染色强度。对于染色强度检测,使用标准光学显微镜拍摄图像。在该方案的修改中,可以应用荧光素偶联的二抗,其优点是不需要进一步的开发步骤。然而,该过程需要将荧光物镜连接到显微镜上进行染色检测。鉴于这些方法的半定量性质,必须提供几种对照染色剂来解释非特异性抗体反应和背景信号。在这里,我们介绍了染色方案和相应的分析过程,以比较和讨论不同染色技术各自的结果和优势。
引言
红细胞 (RBC) 在心血管系统中穿行 70 至 140 天,平均红细胞年龄约为 115 天 1,2。衰老或受损的红细胞通过噬红细胞作用从循环中去除,这是一种由巨噬细胞驱动的高效清除过程3。这些细胞的预定寿命是在分化和成熟过程中放弃细胞器(包括细胞核、线粒体和核糖体)的结果之一4。因此,循环红细胞缺乏翻译机制,排除了新蛋白质的合成3。因此,对现有蛋白质的动态翻译后修饰代表了响应作用于红细胞的细胞外和细胞内应激源的急性生化调节的唯一可行机制5。
机械力似乎是导致红细胞内生化途径激活或调节的主要细胞外线索。在红细胞膜6中发现机械敏感蛋白Piezo1激发了研究这些细胞中机械激活信号传导的几条研究线7。例如,最近的进展表明,红细胞的物理性质受到蛋白质8的急性和动态变化的积极调节,其中包括翻译后磷酸化和泛素化9。由于这些正常修饰在某些疾病中有所不同9,10,11,因此确定RBC蛋白的激活状态似乎具有科学和临床意义,特别是与机械生物学过程有关。
红细胞蛋白活化状态急性变化的测定带来了一些方法学挑战。例如,储存红细胞样品以供以后分析需要保存修饰的红细胞蛋白,因为翻译后修饰是不持久的。此外,众所周知,经典的蛋白质检测方法(例如蛋白质印迹)很难在红细胞中标准化,因为相对于血红蛋白的蛋白质丰度较低,血红蛋白占这些细胞中蛋白质含量的~98%12。因此,在研究重要红细胞蛋白(例如一氧化氮合酶的红细胞特异性亚型(RBC-NOS))的急性修饰时,基于抗体的化学保存红细胞染色一直是首选方法13,14。RBC-NOS已被证明可以酶促产生一氧化氮(NO),这对于基本的RBC特性(包括RBC变形性)似乎是必不可少的15,16,17。红细胞-NOS的翻译后修饰调节催化酶活性,丝氨酸1177残基的磷酸化被描述为增加酶活性,而丝氨酸114或苏氨酸495残基的磷酸化与红细胞-NOS活性降低有关18,19。
总的来说,红细胞蛋白的临时修饰有助于重要的细胞功能,并且能够检测这些修饰蛋白的标准化方案具有很高的价值。在这里,我们提出了两种不同的方案,它们利用特异性抗体来促进RBC-NOS蛋白活化的检测,并讨论了数据分析和解释的建议。
通过测量丝氨酸1177残基处RBC-NOS磷酸化的增加来评估所描述方案的性能,以响应于反映人体脉管系统内发生的机械力(5 Pa)的机械力。
研究方案
此处描述的协议符合《赫尔辛基宣言》,并已获得德国科隆体育大学(2013 年 9 月 16 日)和格里菲斯大学(2019/808)伦理委员会的批准。对志愿者进行筛选以确保没有相关病理,并提供书面知情同意书。
1. 使用免疫组织化学方案对红细胞蛋白进行染色
注意: 材料表中提供了所需化学品和材料的详细清单。以下部分描述了所需溶液的制备,然后详细介绍了免疫组织化学方案(图1)。
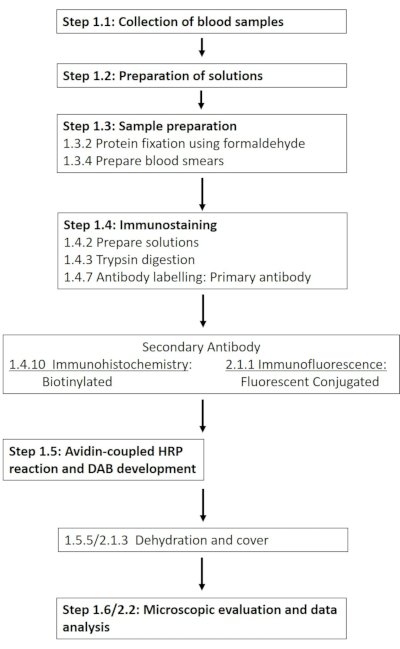
图 1:在磷酸化位点 1177 对 RBC-NOS 进行免疫组织化学和免疫荧光染色所需的各个步骤示意图。 介绍了从溶液制备和血液采样到基于抗体的检测和可视化的方案的典型工作流程。 请点击此处查看此图的大图。
- 采集血液样本
- 从七名健康男性身上获取血液样本(10 mL 全血)。据报道,志愿者是没有心血管、血液、神经、内分泌或代谢疾病的健康个体。志愿者也是非吸烟者。
- 使用无菌针头和注射器从前臂肘部区域的突出静脉收集血液,并立即转移到涂有以下抗凝剂之一的管中:肝素钠(用于免疫组织化学)或乙二胺四乙酸(EDTA;用于荧光标记)。
- 使用Couette型剪切系统将抗凝血液样品暴露于精确控制的机械力下,如前所述7,20。
- 剪切装置包括一个可旋转的杯子和一个固定的鲍勃,由300μm的间隙隔开。将血液样本转移到间隙中,这导致杯子的精确可控旋转速度对样品施加控制良好的机械力。这里提供的代表性数据是通过施加反映人体脉管系统(5 Pa)内长时间(300 s)发生的机械力而产生的。
- 制备免疫染色所需的溶液
- 如 表1所示制备溶液。溶液可以在执行免疫染色程序之前制备,并在给定温度下储存,直到需要为止。
注意:储存时间可能因化学品而异。查看材料安全数据表。
- 如 表1所示制备溶液。溶液可以在执行免疫染色程序之前制备,并在给定温度下储存,直到需要为止。
- 样品制备
- 在抽断或实验性处理后立即处理全血(如适用;例如,我们样品中的机械刺激;参见步骤1.1.3),以便能够检测短期效应,例如在剪切应力施加,运动,短期缺氧暴露等之后。
- 使用甲醛进行红细胞蛋白固定,如下所示:在室温(RT)下以1:2的比例在4%多聚甲醛溶液中稀释全血20分钟。在室温下以132× g 离心样品3分钟,并通过移液小心地除去上清液。
- 将RBC沉淀重悬于两体积的0.1mol/L磷酸盐缓冲盐水(PBS)(1:3稀释)中,并在室温下孵育5分钟。 如上所述重复离心,并通过移液除去应透明的上清液。将红细胞沉淀重悬于一个体积的0.1mol/L PBS(1:2稀释)中。
- 准备血涂片如下:使用耐酒精笔(例如铅笔)在显微镜载玻片上标记样品ID,应用的抗体等。然后,在标签字段正上方加入 10 μL 制备的红细胞溶液。
- 将第二张载玻片以大约45°的角度放在样品上,并将样品沿载玻片均匀分散。通过将样品悬停在本生燃烧器上并持续移动 5-7 秒,将载玻片热固定在本生燃烧器上。
注意:建议在热固定之前对样品进行风干。样品可以在室温下储存直到染色(图2)。
- 免疫组化染色
- 在每张载玻片上标记两个区域:一个测试区域,其中红细胞与相应的一抗和二抗一起孵育,以及一个对照区域,其中一抗被对照溶液替换。该区域用作测定内对照,以确定红细胞的背景信号。
- 在手术前或手术过程中制备溶液,如 表2所示。每个测试区域需要 300 μL 的体积,每个对照区域需要 200 μL 的体积。
注意:需要注意的是,这些基于抗体的染色程序产生的是半定量数据,而不是定量数据。因此,为了确保从产生的数据中得出有意义的结论,绝对需要适当的对照样品(即,为评估的蛋白质活化相对变化提供参考点)。 - 对于胰蛋白酶消化,解冻0.1%胰蛋白酶并平衡至室温。 用油脂铅笔在每张载玻片上标记两个区域:测试区域(载玻片的2/3)和对照区(载玻片的1/3)。使用移液器小心地涂抹三缓冲盐水(TBS)以清洗样品区域。让TBS静置30秒,然后将其倒掉。重复洗涤步骤。
注意:除非另有说明,否则将以下解决方案添加到控件和测试区域。这些领域需要用相应的解决方案充分覆盖。使用一次性移液器涂抹溶液,并在每种溶液后切换移液器。 - 加入0.1%胰蛋白酶,使用带有盖子或铝箔的专用培养室盖住载玻片,并在培养箱中于37°C孵育30分钟。孵育后,通过加入自来水来停止酶反应。倒出溶液。如上所述,用TBS清洗两个区域3次。
- 为了阻断过氧化物酶活化,加入甲醇溶液并在室温下孵育30分钟。 在此期间盖上载玻片。倒出溶液。
注意:对于免疫荧光检测(第2节),可以省略此步骤,因为阻断内源性过氧化物酶有助于防止由辣根过氧化物酶(HRP)和3,3′-二氨基联苯胺水合物(DAB)检测引起的人工信号。 - 用TBS清洗两个区域3次,如步骤1.4.3中所述。加入3%脱脂牛奶溶液,在室温下孵育30分钟以阻断。倒出溶液。事后不要洗。
- 仅将一抗 (AB) 添加到测试区域。将AB控制溶液(见 表2)添加到控制区域。将样品在4°C孵育过夜。在此期间盖上载玻片以防止干燥。
注意:避免将溶液从测试转移到对照区域,因为这会影响控制值。 - 倒出抗体溶液。用TBS清洗两个区域3次,如步骤1.4.3中所述。
- 执行阻止步骤以防止非特异性绑定。加入3%的普通山羊血清,在室温下孵育30分钟。
- 加入二抗溶液并在室温下孵育30分钟。 倒出抗体溶液。用TBS清洗该区域3次,如步骤1.4.3中所述。
- 染色和覆盖的发展
- 通过加入稀释的亲和素-过氧化物酶溶液并在室温下孵育30分钟来进行亲和素偶联HRP反应(参见 表2中的稀释)。
- 如 表3所示,在使用前准备DAB混合物以进行免疫染色。
注意:轻拍很危险。考虑危害声明H341(怀疑引起遗传缺陷)和H350(可能导致癌症)。考虑以下防范说明:P201、P202、P280、P308+P313、P405 和 P501。 - 按如下方式进行DAB对照染色:从载玻片中收集步骤1.5.1中的HRP溶液,并在染色前在单独的离心管中与少量(例如,1mL)制备的DAB溶液混合。混合物应呈棕色/灰色。
- 将载玻片放在显微镜下(放大倍数至少200倍),并将DAB溶液添加到两个区域。持续监测红细胞的染色,并在背景开始着色之前用一次性移液管去除DAB溶液来停止染色。对于RBC-NOS丝氨酸1177染色,DAB孵育时间约为17分钟。
- 进行样品脱水。将载玻片放在玻璃架中,每次浸入各种稀释度的乙醇溶液中5秒,从70%开始,然后是96%,然后是100%,最后在二甲苯中。从载玻片架上取下载玻片并放在纸巾上,顶部有红细胞以吸收多余的液体。
- 在整个载玻片中加入两到三滴安装介质。使用盖玻片盖住载玻片。避免包含气泡,因为这会阻碍显微镜评估。将样品在通风橱中干燥至少过夜。
- 进行显微镜评估
- 为了进行可视化和成像,将载玻片放入放大倍率至少为200倍的透射光显微镜中。确保显微镜与相机耦合,以拍摄染色的红细胞。
- 打开显微镜光源。打开装有显微镜的相机并启动显微镜控制软件。使用明场显微镜通过转动粗焦和精细调焦旋钮并找到可见红细胞的焦点水平来确定合适的焦点。
- 将图片的背景值设置为 220 ± 5 个灰度值,在幻灯片的三个无单元格区域上测量。为此,请使用免费提供的软件ImageJ打开第一张图片。选择使用面板设置测量值的平均灰度值选项。使用椭圆形图标通过"测量"命令测量灰度值。如果测量值超出范围,请相应地调整显微镜的背景光。重复这些步骤,直到背景值正确。
注意:对于拍摄的所有图像,这些背景值应在给定范围内。否则,数据没有可比性。 - 要分析 RBC 灰度值,请使用 ImageJ 软件中的椭圆形选择工具标记每个 RBC 的边缘。使用" 测量 "命令确定单个 RBC 的灰度值。测量测试中至少 50 个 RBC 和对照区域中至少 10 个 RBC 的灰度值。
注意:分析的红细胞总数可以单独调整。分析的红细胞越多,结果就越有意义。但是,对于给定实验中的每个条件,受试者等,分析的红细胞总数应该是可比的。- 避免在油脂铅笔附近分析红细胞,因为该区域的染色可能不完整。避免分析重叠的红细胞,因为这会影响染色强度。仅使用与其他红细胞分开的红细胞。 分析来自测试的至少五张图像和来自对照区域的至少两张图像,以评估 50/10 个红细胞。 在最终分析中包括每张图片中的红细胞。
- 要计算染色强度,请将最终信号计算为:
(单个测试区域 RBC - 平均测试区域背景)- (单个控制区域 RBC - 平均控制区域背景)

图2:固定过程和血涂片生成的描述。 (使用 BioRender.com 创建的方案。稀释的血液样品在多聚甲醛中化学固定,然后离心并用磷酸盐缓冲盐水洗涤。最后,将重悬的血液涂抹在载玻片上,并通过悬停在本生燃烧器火焰上 进行 热固定。 请点击此处查看此图的大图。
表1:免疫组织化学染色所需溶液的制备和储存条件。 解决方案可以在协议之前制备。 请按此下载此表格。
表2:立即使用的抗体溶液说明。请按此下载此表格。
表 3:准备 DAB 解决方案以供立即使用的组件和协议。请按此下载此表格。
2. 红细胞蛋白的荧光标记
注意:以下部分概述了免疫组织化学方案的改编,旨在使抗体与荧光偶联物一起使用(图1)。
免疫荧光方案的血液样品制备与第1节中描述的相同,因此下一节从样品染色开始。
- 免疫荧光染色
- 使用专用培养室或铝箔在室温下与二级荧光偶联抗体(体积参见步骤1.4.2)孵育30分钟。
- 倒出二抗溶液,用TBS洗涤样品3次。 将最后的洗涤留在样品上以防止它们变干。
- 倒出TBS,然后逐个从样品架上取出样品,以防止长时间暴露在光线下。为了使样品脱水,将载玻片暴露于不同的乙醇溶液中~5秒,从70%开始,然后是90%,最后是100%。将载玻片暴露在二甲苯/二甲苯溶液中5秒。
- 准备带有两到三滴安装介质的盖玻片,然后用盖玻片安装载玻片。通过用镊子或类似的无菌金属器械施加轻微压力,确保封片剂均匀分布。使用相同的仪器消除气泡,否则可能会干扰成像。将样品在黑暗干燥的空间中干燥过夜。
- 显微镜评估
- 为了进行可视化和成像,将载玻片放在显微镜载物台上,总放大倍率至少为400倍。打开显微镜光源和荧光光源,确保将荧光光源调整到最大强度。
- 打开装有显微镜的相机并启动显微镜控制软件。使用明场显微镜通过转动粗焦和精细焦距调节旋钮来确定合适的焦距,并找到可见红细胞的焦距水平。
注意:过度暴露在光线下可能会导致荧光偶联物的光漂白。为此,可以使用先前实验中的载玻片,以最大程度地减少尚未分析的载玻片的光照。 - 通过检查控制区域中的红细胞来确定最佳激光强度。确保强度足够高,使红细胞可见,同时不产生较大的背景信号。保持区域和样品之间的强度和曝光时间一致,以确保可比性。
- 在载玻片测试区域的至少三个不同区域中捕获明场和荧光图像,随机选择。要选择一个区域,请使用显微镜载物台控件平移离开由脂质笔标记的载玻片边缘。选择表现出单个 RBC 层均匀分布的区域。
- 将荧光图像的曝光时间设置为1秒,并使用显微镜控制软件的软件控件捕获图像。切换到明场模式,将曝光时间设置为"自动",并捕获相应的明场图像。
- 通过重复步骤2.2.3,在载玻片控制区域的至少两个不同的随机选择区域中捕获明场和荧光图像。
- 以.tif格式保存图像,以保留像素的原始灰度值,防止压缩,并携带采集的元数据。
- 测量捕获的 RBC 的灰度值。 打开 ImageJ(或 FIJI21;请参阅 补充文件 1)。确定单个 RBC 的灰度值。为此,请使用 椭圆 形选择工具标记每个单独的单元格,并使用 "测量 "命令进行分析。
注意:如果红细胞与其他细胞重叠,则不应对其进行分析,因为这可能会增加产生的信号。 - 突出显示三到五个没有红细胞的区域,并确定灰度值以提供背景信号的测量值。分析每个测试区域的至少三个不同图像中的至少 150 个 RBC,以及每个对照区域的至少两个不同图像中的至少 50 个 RBC。
注意:可能建议分析更多细胞/区域以最大程度地减少变异性。鉴于红细胞群本质上是异质性的,信号的细胞间变异性可能很大,这取决于感兴趣的蛋白质。 - 使用宏命令对捕获的图像执行替代数据分析。通过斐济版 ImageJ 创建/安装宏命令,用于给定图像的自动选择、背景校正和灰度值分析。
注意:此例程使用自动阈值来检测给定图像中存在的细胞,使用原始图像的副本,产生施加到原始图像上的叠加层以提取荧光红细胞的灰度值。宏作为 .ijm 文件作为 补充编码文件 1 存放。 - 以.tif格式打开图像文件,以便在斐济进行分析。打开 RBC 荧光.ijm(补充编码文件 1)宏,然后单击 "运行"。
注意:宏是为以 600 倍放大倍率和大信噪比获得的图像设置的。细胞的自动选择应由研究者进行审查。
- 计算最终信号为:
(测试区域RBC - 测试区域背景)-(控制区域RBC - 控制区域背景)用于手动分析;
(测试区域-控制区域)进行自动分析。
结果
所提出的方案描述了促进检测红细胞蛋白急性改变的方法,并在一种众所周知的机械敏感蛋白质改变上进行了测试:丝氨酸1177残基处红细胞-NOS的磷酸化。从健康志愿者那里获得全血,随后分成两个单独的等分试样。将给定的血液样品暴露于生理量级(5 Pa)的机械剪切应力下300秒,先前显示其在丝氨酸117714处引起RBC-NOS磷酸化。在停止机械剪切暴露后,立即将血液样品固定在多聚?...
讨论
最近的文献高度表明,RBC-NOS蛋白对于调节RBC变形性至关重要15,22,23,这反过来又促进了它们通过狭窄的毛细血管24。蛋白质活性高度依赖于翻译后蛋白质修饰,特别是某些残基的磷酸化18。感兴趣的焦点在于磷酸化位点1177,其与RBC-NOS蛋白23的活化有关。这种蛋白质的改变已?...
披露声明
所有作者都透露不存在利益冲突。
致谢
LK感谢澳大利亚政府研究培训计划奖学金的支持。
材料
| Name | Company | Catalog Number | Comments |
| 3,3′-Diaminobenzidin -tetrahydrochloride Hydrate | Sigma/Merck | D5637 | DAB |
| Ammoniumchloride | Merck /Millipore | 101145 | NH4Cl |
| Centrifuge 5427 R | Eppendorf | 5409000010 | |
| Coverslips | VWR | 631-0147 | |
| di-sodium Hydrogen Phosphate Dihydrate | Merck /Millipore | 106580 | Na2HPO4. 2 H2O |
| Disposable transfer pipettes | VWR | 612-6803 | |
| Entellan | Merck /Millipore | 107961 | rapid mounting medium for microscopy |
| Ethanol denaturated using 1 % methyl ethyl ketone (MEK) | Hofmann | 642 | |
| Glucose-Oxidase | Sigma/Merck | G2133 | |
| Grease pencil | Dako | S 2002 | |
| Horse-radish peroxidase/ExtrAvidin−Peroxidase | Sigma/Merck | E-2886 | HRP |
| Hydrochloric acid | Merck /Millipore | 109057 | HCl |
| Hydrogen peroxide, 30% | Merck /Millipore | 107203 | H2O2 |
| ImageJ Software | Freeware | ||
| Laser-assisted optical rotational cell analyser (LORCA) | RR Mechatronics | Ektacytometer instrument used for shearing | |
| Methanol | Merck /Millipore | 106009 | |
| Microscope slides | VWR | 630-1985 | |
| Nickel(II)-sulfate Hexahydrate | Sigma/Merck | N4882 | NiSO4.6H2O |
| Normal Goat serum | Agilent/DAKO | X0907 | NGS |
| Paraformaldehyde | Merck /Millipore | 818715 | PFA |
| Pipettes Eppendorf Reference 2 | VWR | 613-5836/ 613-5839 | |
| Rabbit Anti-phospho eNOS Antibody (Ser1177) | Merck/Millipore | 07-428-I | Primary Antibody |
| Reaction tubes, 2ml | Eppendorf | 30120094 | |
| Secondary Antibody goat anti rabbit | Agilent/DAKO | E0432 | Secondary Antibody |
| Skim milk powder | Bio-Rad | 170-6404 | |
| Sodium chloride | Merck /Millipore | 106404 | NaCl |
| Sodium Dihydrogen Phosphate Monohydrate | Merck /Millipore | 106346 | NaH2PO4.H2O |
| Sodium hydroxide, 1 M | Merck /Millipore | 150706 | NaOH |
| Tris(hydroxymethyl)-aminomethane | Merck /Millipore | 108382 | Tris |
| Trypsin | Sigma/Merck | T7409 | |
| Tween20 | Merck /Millipore | 822184 | |
| Whatman Glas microfiber filter, quality GF/F | Merck /Millipore | WHA1825047 | |
| Xylol | VWR Chemicals | 2,89,73,465 | |
| ß-D-Glucose monohydrate | Merck /Millipore | 14431-43-7 |
参考文献
- Cohen, R. M., et al. Red cell life span heterogeneity in hematologically normal people is sufficient to alter HbA1c. Blood. 112 (10), 4284-4291 (2008).
- Mock, D. M., et al. Red blood cell (RBC) survival determined in humans using RBCs labeled at multiple biotin densities. Transfusion. 51 (5), 1047-1057 (2011).
- Thiagarajan, P., Parker, C. J., Prchal, J. T. How do red blood cells die?. Frontiers in Physiology. 12, 655393 (2021).
- Moras, M., Lefevre, S. D., Ostuni, M. A. From erythroblasts to mature red blood cells: organelle clearance in mammals. Frontiers in Physiology. 8, 1076 (2017).
- Pretini, V., et al. Red blood cells: chasing interactions. Frontiers in Physiology. 10, 945 (2019).
- Cahalan, S. M., et al. Piezo1 links mechanical forces to red blood cell volume. eLife. 4, e07370 (2015).
- Kuck, L., Peart, J. N., Simmonds, M. J. Piezo1 regulates shear-dependent nitric oxide production in human erythrocytes. American Journal of Physiology. Heart and Circulatory Physiology. 323 (1), H24-H37 (2022).
- Kuck, L., Peart, J. N., Simmonds, M. J. Active modulation of human erythrocyte mechanics. American Journal of Physiology. Cell Physiology. 319 (2), C250-C257 (2020).
- Strader, M. B., et al. Post-translational modification as a response to cellular stress induced by hemoglobin oxidation in sickle cell disease. Scientific Reports. 10 (1), 14218 (2020).
- Pecankova, K., Majek, P., Cermak, J., Dyr, J. E. Posttranslational modifications of red blood cell ghost proteins as "signatures" for distinguishing between low- and high-risk myelodysplastic syndrome patients. Turkish Journal of Haematology. 34 (1), 111-113 (2017).
- Grau, M., et al. High red blood cell nitric oxide synthase activation is not associated with improved vascular function and red blood cell deformability in sickle cell anaemia. British Journal of Haematology. 168 (5), 728-736 (2015).
- Sae-Lee, W., et al. The protein organization of a red blood cell. Cell Reports. 40 (3), 111103 (2022).
- Suhr, F., et al. Moderate exercise promotes human RBC-NOS activity, NO production and deformability through Akt kinase pathway. PLoS One. 7 (9), e45982 (2012).
- Kuck, L., Grau, M., Bloch, W., Simmonds, M. J. Shear stress ameliorates superoxide impairment to erythrocyte deformability with concurrent nitric oxide synthase activation. Frontiers in Physiology. 10, 36 (2019).
- Grau, M., et al. RBC-NOS-dependent S-nitrosylation of cytoskeletal proteins improves RBC deformability. PLoS One. 8 (2), e56759 (2013).
- Simmonds, M. J., Detterich, J. A., Connes, P. Nitric oxide, vasodilation and the red blood cell. Biorheology. 51 (2-3), 121-134 (2014).
- Bor-Kucukatay, M., Wenby, R. B., Meiselman, H. J., Baskurt, O. K. Effects of nitric oxide on red blood cell deformability. American Journal of Physiology. Heart and Circulatory Physiology. 284 (5), H1577-H1584 (2003).
- Suhr, F., et al. Intensive exercise induces changes of endothelial nitric oxide synthase pattern in human erythrocytes. Nitric Oxide: Biology and Chemistry. 20 (2), 95-103 (2009).
- Grau, M., et al. Regulation of red blood cell deformability is independent of red blood cell-nitric oxide synthase under hypoxia. Clinical Hemorheology and Microcirculation. 63 (3), 199-215 (2016).
- Grau, M., Kuck, L., Dietz, T., Bloch, W., Simmonds, M. J. Sub-fractions of red blood cells respond differently to shear exposure following superoxide treatment. Biology. 10 (1), 47 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ozüyaman, B., Grau, M., Kelm, M., Merx, M. W., Kleinbongard, P. RBC NOS: regulatory mechanisms and therapeutic aspects. Trends in Molecular Medicine. 14 (7), 314-322 (2008).
- Kleinbongard, P., et al. Red blood cells express a functional endothelial nitric oxide synthase. Blood. 107 (7), 2943-2951 (2006).
- McMahon, T. J. Red blood cell deformability, vasoactive mediators, and adhesion. Frontiers in Physiology. 10, 1417 (2019).
- Bizjak, D. A., Brinkmann, C., Bloch, W., Grau, M. Increase in red blood cell-nitric oxide synthase dependent nitric oxide production during red blood cell aging in health and disease: a study on age dependent changes of rheologic and enzymatic properties in red blood cells. PLoS One. 10 (4), 0125206 (2015).
- Di Pietro, N., et al. Nitric oxide synthetic pathway and cGMP levels are altered in red blood cells from end-stage renal disease patients. Molecular and Cellular Biochemistry. 417 (1-2), 155-167 (2016).
- Grau, M., et al. Even patients with mild COVID-19 symptoms after SARS-CoV-2 infection show prolonged altered red blood cell morphology and rheological parameters. Journal of Cellular and Molecular Medicine. 26 (10), 3022-3030 (2022).
- Mozar, A., et al. Red blood cell nitric oxide synthase modulates red blood cell deformability in sickle cell anemia. Clinical Hemorheology and Microcirculation. 64 (1), 47-53 (2016).
- Ulker, P., Gunduz, F., Meiselman, H. J., Baskurt, O. K. Nitric oxide generated by red blood cells following exposure to shear stress dilates isolated small mesenteric arteries under hypoxic conditions. Clinical Hemorheology and Microcirculation. 54 (4), 357-369 (2013).
- Nader, E., et al. Hydroxyurea therapy modulates sickle cell anemia red blood cell physiology: Impact on RBC deformability, oxidative stress, nitrite levels and nitric oxide synthase signalling pathway. Nitric Oxide: Biology and Chemistry. 81, 28-35 (2018).
- Fischer, U. M., Schindler, R., Brixius, K., Mehlhorn, U., Bloch, W. Extracorporeal circulation activates endothelial nitric oxide synthase in erythrocytes. The Annals of Thoracic Surgery. 84 (6), 2000-2003 (2007).
- Horobin, J. T., Sabapathy, S., Kuck, L., Simmonds, M. J. Shear stress and RBC-NOS Serine1177 Phosphorylation in humans: a dose response. Life. 11 (1), 36 (2021).
- Kuck, L., Grau, M., Simmonds, M. J. Recovery time course of erythrocyte deformability following exposure to shear is dependent upon conditioning shear stress. Biorheology. 54 (5-6), 141-152 (2018).
- Grau, M., et al. Effect of acute exercise on RBC deformability and RBC nitric oxide synthase signalling pathway in young sickle cell anaemia patients. Scientific Reports. 9 (1), 11813 (2019).
- Feelisch, M. . Methods in Nitric Oxide Research. , (1998).
- Cortese-Krott, M. M., et al. Human red blood cells at work: identification and visualization of erythrocytic eNOS activity in health and disease. Blood>. 120 (20), 4229-4237 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。