Method Article
النماذج الحجمية المبسطة كاستراتيجية فعالة لتجزئة شبكات الأكتين في التصوير المقطعي بالتبريد الإلكتروني
In This Article
Summary
هنا ، نقدم بروتوكولا لوضع نماذج حجمية مبسطة في أحجام ثلاثية الأبعاد صاخبة ومعقدة ومقطعية. يسمح ذلك بالتجزئة السريعة لكثافة خيوط الأكتين ، والكشف عن الانحناء المنهجي للخيوط والفجوات في خيوط حزمة الشعر ، بالإضافة إلى القياس الكمي المريح لخصائص النموذج الحجمي ، مثل المسافات.
Abstract
تظل الطرق الفعالة لاستخراج السمات ذات الأهمية واحدة من أكبر التحديات التي تواجه تفسير التصوير المقطعي الإلكتروني بالتبريد. تم اقتراح العديد من الأساليب الآلية ، يعمل العديد منها بشكل جيد مع مجموعات البيانات عالية التباين حيث يمكن اكتشاف الميزات ذات الأهمية بسهولة ويتم فصلها بوضوح عن بعضها البعض. تتميز مجموعات البيانات المقطعية المجسمة بالتبريد والإلكترون في الأذن الداخلية بمجموعة كثيفة من خيوط الأكتين المعبأة سداسية والتي غالبا ما تكون مترابطة عبر المرض. تجعل هذه الميزات التجزئة الآلية أمرا صعبا للغاية ، مما يزيد من تفاقم البيئة عالية الضوضاء للتصوير المقطعي الإلكتروني بالتبريد والتعقيد العالي للميزات المكدفة. باستخدام المعرفة المسبقة حول تنظيم حزمة الأكتين ، وضعنا طبقات من نموذج أكتين الكرة والعصا المبسط للغاية للحصول أولا على ملاءمة عالمية لخريطة الكثافة ، متبوعة بتعديلات إقليمية ومحلية للنموذج. نوضح أن بناء النموذج الحجمي لا يسمح لنا فقط بالتعامل مع التعقيد العالي ، ولكنه يوفر أيضا قياسات وإحصائيات دقيقة حول حزمة الأكتين. تعمل النماذج الحجمية أيضا كنقاط تثبيت للتجزئة المحلية ، كما هو الحال في الموصلات المتقاطعة بين الأكتين والأكتين. يمكن أن يكون بناء النموذج الحجمي ، خاصة عند تعزيزه من خلال مناهج التركيب الآلي القائمة على الكمبيوتر ، بديلا قويا عندما لا تنجح مناهج التجزئة الآلية التقليدية.
Introduction
يسمح التصوير المقطعي بالتبريد بالتصوير المقطعي الإلكتروني بتصور عضيات كاملة أو أجزاء من الخلايا والأنسجة بدقة نانومتر في حالتها القريبة من الحالةالأصلية 1،2،3 باستخدام إما التجميد الغاطس4 أو التجميد عالي الضغط التزجيج فائق السرعة5. نظرا لأنه لا يمكن تحمل سوى جرعة إلكترون محدودة من خلال العينة المحفوظة بالتبريد وغير الملوثة والمرطبة المجمدة ، فإن البيانات ثلاثية الأبعاد المقطعية صاخبة للغاية. غالبا ما يمكن تقليل هذه الضوضاء بشكل كبير من خلال مجموعة متنوعة من خوارزميات تصفية الضوضاء6،7 ، بما في ذلك الانتشار غير الخطي متباينالخواص 8 ، والترشيح الثنائي9 ، والترشيح المتوسط المتكرر10.
علاوة على ذلك ، فإن قيود الميل في مرحلة المجهر ، مما يؤدي إلى فقدان إسفين من المعلومات ، وحقيقة أن سمك العينة يزيد بزوايا إمالة عالية ، يؤدي إلى إعادة بناء ثلاثية الأبعاد بدقة متباينة الخواص. هذا يعني أن الكثافة ملطخة في البعد الثالث بسبب انخفاض الدقة في الاتجاه Z. نتيجة لذلك ، يبدو شكل الجزيئات الكبيرة مشوها (أي أقل تحديدا واستطالة في البعد الثالث).
من بين أكبر التحديات في تفسير البيانات المقطعية الاستخراج الآلي للميزات ذات الصلة ، والمعروف أيضا باسم التجزئة11. مع ميزات الشكل الفريدة الكافية والضوضاء المنخفضة ، يمكن تحديد الآلات الجزيئية الكبيرة في أحجام 3D المعقدة من خلال مطابقةالقالب 12،13،14 ؛ ومع ذلك ، فإن نجاح مطابقة القوالب يعتمد على دقة التصوير المقطعي ، ونموذج البحث المناسب ، بالإضافة إلى خصائص الحجم والشكل لأحجام الميزات. إذا كانت السمات ذات الأهمية متباعدة بما فيه الكفاية ويمكن بسهولة تحديد الزخارف المتكررة (مثل الآلات الجزيئية الكبيرة) ، فيمكن دمج الأحجام الفرعية للتصوير المقطعي لزيادة نسبة الإشارة إلى الضوضاء ومتوسط تشوهات شكل الجسيمات الفردية. تم الإبلاغ عن التجزئة الآلية لشبكة خيوط الأكتين في التصوير المقطعي الإلكتروني للحافة الرقيقة لخلايا Dictyostelium discoideum المجمدة عن طريق مطابقةالقالب 15.
ومع ذلك ، إذا كانت السمات ذات الأهمية متقاربة ، فإن تباين دقة البيانات يمكن أن يؤدي إلى تلطيخ من كثافات الخريطة في الاتجاه Z (على طول اتجاه شعاع الإلكترون) ، مما يؤدي إلى اندماج واضح لغلاف الكثافة للآلات الجزيئية المتقاربة أو المجمعات فوق الجزيئية. في مثل هذه الحالات ، قد لا تكون الأساليب الآلية للتجزئة ، مثل مستجمعات المياه16 ، أو تجزئة الحدود17 ، أو مجموعة متنوعة من مناهج التصنيف القائمة على التعلمالآلي 18،19 ، قادرة على التعرف على السمات ذات الاهتمام أو إنشاء حدود صحيحة حول كائن محل اهتمام. في كثير من الأحيان ، ينتهي الأمر إما بعدد قليل من القطع الكبيرة جدا أو بحجم مجزأ بشكل كبير ، حيث يلزم بذل الكثير من الجهد لدمج العديد من القطع الصغيرة حتى ينظر إلى ميزة الاهتمام على أنها كاملة. يمكن أن يكون هذا التنظيم اليدوي لنتائج التجزئة كثيف العمالة وقد يفشل تماما عندما يكون هيكل الاهتمام عبارة عن مجموعة من الخيوط المتقاربة المترابطة عبر روابط قصيرة. في هذه الشبكة العملاقة من الهياكل الخيطية ، قد يكون من الصعب توجيه الذات. هذا لأنه ، بسبب تباين الدقة ، يبدو أن الكثافات تمتزج مع بعضها البعض ، مما يمثل تحديا هائلا لكل من مناهج التجزئة اليدوية الآلية والتفاعلية. نتيجة لذلك ، يمكن للمرء بسهولة "القفز" بين الخيوط عند فحص المناطق الصغيرة بصريا فقط.
لحسن الحظ ، في حالة حزمة الأكتين في الأهداب المجسمة لخلايا شعر الأذن الداخلية ، لدينا معرفة بالتنظيم العام لحزمة الأكتين واتجاهية خيوط الأكتين20،21. تتكون حزمة الأكتين من مئات خيوط الأكتين السداسية المعبأة بكثافة بقطر 6-8 نانومتر ، والتي تتباعد حوالي 12-13 نانومتر عن بعضها البعض22.
سمح لنا ذلك باتباع نهج مختلف إلى حد ما للتجزئة يعتمد على نماذج الكرة والعصا المبسطة لتمثيل خيوط الأكتين. تضمنت الإستراتيجية في وقت واحد وضع مجموعة منتظمة مثالية من نماذج الخيوط في ألواح من خرائط كثافة التصوير المقطعي الإلكتروني بالتبريد لبناء نموذج ثلاثي الأبعاد لحزمة الأكتين طبقة تلو الأخرى. تأكدنا من أن النموذج لديه ملاءمة عامة عامة لخريطة الكثافة قبل إجراء تعديلات محلية على نماذج الخيوط الفردية أو مجموعات نماذج الخيوط لتتناسب بشكل وثيق مع خريطة الكثافة. من خلال الترميز اللوني التلقائي لقيمة كثافة الخريطة في موقع نموذج الفتيل ، تمكنا من اكتشاف الفجوات الظاهرة بسهولة في حزمة الأكتين. تسمح النماذج الحجمية بتحليل كمي للخصائص الحجمية ، مثل المسافات بين خيوط الأكتين ، وتؤدي أيضا إلى عرض مبسط لتنظيم الشبكة الخيطية ثلاثية الأبعاد الشاملة.
بالإضافة إلى ذلك ، يمكن أن تعمل النماذج أيضا كهياكل تثبيت لتجزئة الميزات الإضافية ، مثل وصلات الأكتين والأكتين ، حيث يمكن اختيار (أجزاء من) نماذج خيوط فردية ، والتي يمكن من خلالها إنشاء مناطق كثافة خريطة نصف قطرها مناسبة للفحص والمزيد من التجزئة.
نعتقد أن نهج التجزئة القائم على النموذج الحجمي مفيد بشكل خاص لشبكات البنية الخيطية الكبيرة التي قد تحتوي على فجوات ووصلات متقاطعة بين الخيوط. تميل خوارزميات التجزئة إلى العمل محليا ، في حين أن الدماغ البشري يأخذ مناطق أكبر في الاعتبار ، وبالتالي يتفوق على أجهزة الكمبيوتر عندما يتعلق الأمر بالتعرف على هياكل الخيوط ، حتى في بيئة معقدة وعالية الضوضاء.
Protocol
يتبع البروتوكول إرشادات لجنة أخلاقيات البحث البشري بجامعة ساوث إيست.
1. مصدر بيانات التصوير المقطعي الإلكتروني بالتبريد لبناء النموذج الحجمي
ملاحظة: تم نشر عمليات إعادة البناء المقطعية المجسمة المجمدة للإلكترون المجسمة المستخدمة في مبنى نموذج حجميسابقا 22،23 ، وتم الحصول عليها كما وصفها Metlagel et al.22.
يتم توفير نصوص UCSF Chimera python لنمذجة الأهداب المجسمة في الملف التكميلي 1 وملف الترميز التكميلي 1 وملف الترميز التكميلي 2 وملف الترميز التكميلي 3 وملف الترميز التكميلي 4 وملف الترميز التكميلي 5.
- باختصار ، امسح الأهداب المجسمة من السطح القمي للظهارة الحسية لأوتريكول الفأر على فيلم دعم الكربون المزركش لشبكة المجهر الإلكتروني (EM). بعد ذلك ، قم بإجراء تزجيج تجميد بالغرق فائق السرعة وجمع البيانات المقطعية بالتبريد والإلكترون أحادي المحور على الفحص المجهري الإلكتروني للإرسال المبرد (cryo-TEM) ، الذي يعمل عند 300 كيلو فولت مع إلغاء تركيز اسمي يتراوح بين 3.5-4.5 ميكرومتر ، باستخدام كاميرا من نوع CMOS في وضع التكامل ، بحجم بكسل يتراوح من 0.47 إلى 0.59 نانومتر (انظر جدول المواد).
- عادة ما تكون الجرعة النموذجية لجمع البيانات أحادية المحور 80-100 إلكترون / Å2. أعد بناء وحدات تخزين التصوير المقطعي ثلاثية الأبعاد باستخدام حزمة البرامج IMOD24 ، إما عن طريق الإسقاط الخلفي المرجح أو طريقة SIRT25،26.
- قم بإزالة التشويش على التصوير المقطعي باستخدام الوسيط المتكرر أو التصفية الثنائية في Priism27 أو خيار الانتشار غير الخطي متباين الخواص في IMOD.
ملاحظة: كانت حزمة البرامج الرئيسية المستخدمة للتصور التفاعلي وبناء النموذج الحجمي والتحليل الكمي هي برنامج UCSF Chimera28،29. يتم سرد جميع حزم البرامج المستخدمة في جدول المواد.
2. إعداد بيانات التصوير المقطعي الإلكتروني بالتبريد لبناء النموذج الحجمي
- دوران التصوير المقطعي
ملاحظة: الغرض من هذه الخطوة هو العثور على "الزوايا المثلى" التي يتم فيها محاذاة قلب الأكتين في محاور من المحاور الثلاثة (x و z) ، بحيث يمكن وضع النماذج في 3D بمحور واحد فقط للقلق. يتم تنفيذ الخطوات التالية ضمن حزمة برامج IMOD.- افتح 3dmod (IMOD) وافتح ملف مكدس الصور ثلاثي الأبعاد بتنسيق ملف .mrc. تأكد من أن المكدس ثلاثي الأبعاد في وضع تدرج الرمادي 16 بت ويعرض أبعاد X و Y و Z الصحيحة في رأس ملف الصورة الخاص به. إذا لزم الأمر، قم بإجراء تصحيحات باستخدام الأمر alterheader : alterheader -d (x_pixelspacing) ، (y_pixelspacing) ، (z_pixelspacing) inputfilename.mrc في موجه الأوامر. إذا كان المكدس ثلاثي الأبعاد بتنسيق ملف TIFF، فاستخدم الأمر tif2mrc inputfilename.tif outputfilename.mrc في موجه الأوامر لإنشاء ملف .mrc.
- افحص التصوير المقطعي بصريا وافتح "القطاعة" (بالضغط على الشرطة المائلة للخلف "\") للعثور على أفضل زوايا الدوران في أبعاد X و Y و Z لمحاذاة مستوى خيوط الأكتين مع المستوى Z. قم بمعالجة الدوران X ، والدوران Y ، وشريط الدوران Z لمعرفة الزاوية المثلى التي تتم عندها محاذاة خيوط الأكتين على المستويين X و Z. لاحظ أن تغيير متوسط السماكة لعرض التصوير المقطعي (سميك: Img) يمكن أن يساعد في العثور على مقدار مثالي لمتوسط الكثافة في المستوى Z وبالتالي زيادة التباين. قم بتكبير وتصغير التصوير المقطعي من خلال استخدام مفتاحي + و - ، على التوالي ، على لوحة المفاتيح.
- بمجرد تحديد الزوايا المثالية للدوران ، قم بتدوير المخطط المقطعي عن طريق كتابة الأمر IMOD rotatevol -a (زوايا دوران Z) ، (زوايا دوران Y) ، (زوايا دوران X) ، (زوايا دوران X) ، (ارتفاع y) ، (عمق z) inputfilename.mrc outputfilename.mrc في موجه الأوامر. تأكد من منح الخريطة مساحة كبيرة لاستيعاب الدوران لتجنب قطع أجزاء من الخريطة عند التدوير.
ملاحظة: لمزيد من المعلومات حول كيفية استخدام الأمر rotatevol، استخدم الخيار من قائمة التعليمات، أو قم بزيارة عنوان URL التالي (https://bio3d.colorado.edu/imod/doc/man/rotatevol.html). لا يغير هذا الأمر (rotatevol) الخريطة المعروضة حاليا في نافذة IMOD، بل ينشئ ملف خريطة جديدا مع خريطة كثافة يتم تدويرها. - باستخدام نافذة مقسم طريقة العرض، حدد إحداثيات X وY وZ لزاويتين متقابلتين من الخريطة لتحديد منطقة الاقتصاص التي تحتوي على المساحة المجسمة باستخدام الأمر trimvol .
- أستخدم الأمر IMOD Trimvol لاقتصاص الخريطة عند الإحداثيات التي تم الحصول عليها مسبقا ، عن طريق كتابة trimvol -x (x-coordiante 1) ، (x-coordiante 2) -y (y-coordiante 1) ، (y-coordiante 2) -z (z-coordiante 1) ، (z-coordiante 2) inputfilename.mrc outputfilename.mrc في موجه الأوامر. الآن ، أصبحت الخريطة أصغر بكثير ، وبالتالي أسهل وأسرع للعمل معها من هذه النقطة فصاعدا.
ملاحظة: لمزيد من المعلومات حول كيفية استخدام الأمر trimvol، استخدم الخيار من قائمة التعليمات، أو قم بزيارة عنوان URL التالي (https://bio3d.colorado.edu/imod/doc/man/trimvol.html). تقوم هذه الخطوات بإنشاء ملف .mrc تم تدويره وقصه.
- تصفية التصوير المقطعي
ملاحظة: تستخدم هذه الخطوة مرشح انتشار متباين الخواص غير الخطي (NAD) الذي يوفره IMOD لتقليل الضوضاء. استخدمنا كقيمة أولية تلك الموصى بها في صفحة مساعدة IMOD لتصفية الانتشار غير الخطي متباين الخواص ، كما هو موضح في عنوان URL التالي (https://bio3d.colorado.edu/imod/doc/NADexample.html) ، وتم استخدامها كقيم أولية.- اكتب etomo في موجه الأوامر لبدء واجهة مستخدم etomo graphic الخاصة ب IMOD.
- حدد خيار الانتشار غير الخطي متباين الخواص من قائمة etomo وحدد ملف الخريطة (اختر وحدة تخزين).
- للعثور على قيمة K وعدد التكرارات التي توفر أفضل نتائج التصفية ، كما هو محكوم عليه من خلال الفحص البصري ، قم بتطبيق عامل تصفية NAD على وحدة تخزين اختبار أصغر لاستخراج وحدة تخزين اختبار مرشح NAD المحددة. انقر على أداة Rubberband أعلى واجهة 3dmod ، وانقر بزر الماوس الأيسر فوق السحب لتحديد حجم الاختبار ، وانقر فوق الزرين Hi و Lo للإشارة إلى أن شريحة Z هي حدود وحدة تخزين الاختبار (احصل على نطاق حجم الاختبار من 3dmod). قم باستخراج حجم الاختبار بالنقر فوق استخراج حجم الاختبار.
- قم بتصفية وحدة تخزين الاختبار باستخدام قيم K مختلفة (البحث عن قيمة K لوحدة تخزين الاختبار > قائمة قيم K)، مثل 0.1 و1 و1 و10 و15 و25 و30 و50 و75. قم بإجراء تصفية NAD مع كل قيمة من قيم K المحددة (تشغيل بقيم K مختلفة > عرض نتائج اختبار قيم K المختلفة). استخدم نافذة مقسم طريقة العرض لتقييم أداء عامل تصفية NAD وحدد قيمة K التي سيتم استخدامها لتصفية وحدة التخزين بأكملها.
- استخدم قيمة K المحددة في الخطوة 2.2.4 واختبر أعدادا مختلفة من التكرارات، مثل 2 و5 و8 و11 و15 و21 (ابحث عن رقم تكرار لوحدة تخزين الاختبار > قائمة التكرارات). قم بتقييم أداء عامل تصفية NAD للتكرارات المختلفة إما بالنقر فوق عرض نتائج اختبار التكرار المختلفة أو باستخدام أداة مقسم طريقة عرض. اختر قيمة لعدد مختلف من التكرارات.
- استخدم قيمة K المحددة وعدد التكرارات (تصفية وحدة التخزين الكاملة > قيمة K والتكرارات) وقم بتصفية وحدة التخزين بأكملها (تصفية وحدة التخزين الكاملة). سيظهر وحدة تخزين تمت تصفيتها حديثا في نفس الدليل حيث يوجد وحدة التخزين الكاملة المحملة بامتداد ملف .nad المرفق بملف .mrc.
ملاحظة: تقوم هذه الخطوات بإنشاء ملف .mrc تمت تصفيته باستخدام عامل تصفية NAD ويعرض ضوضاء أقل وبالتالي نسبة إشارة إلى ضوضاء محسنة.
3. بناء النموذج الحجمي
- إعداد وضع نموذج 3D
ملاحظة: الغرض من هذه الخطوة هو إعداد الخريطة وتحليلها لوضع النماذج الحجمية ثلاثية الأبعاد في خريطة الكثافة المستديرة والخالفة من الضوضواء باستخدام برنامج UCSF Chimera.- باستخدام نافذة القطاعة ، احصل على عرض مقطعي (لوح من 30 شريحة / 28.4 نانومتر) لتحديد إحداثيات Z لمركز بلاطة الكثافة ، حيث سيتم وضع نموذج خيوط الأكتين. انقر فوق مركز كثافة الفتيل ولاحظ إحداثيات Z في نافذة IMOD الرئيسية.
- لاحظ الإحداثيات المحددة لوضع النموذج المستقبلي في UCSF Chimera.
ملاحظة: يتم استخدام إحداثيات Z المشار إليها من هذه الخطوة خلال الخطوة 4 للعثور بسهولة على نماذج خيوط الأكتين المعدة مسبقا ووضعها في ارتفاعات Z الصحيحة ، مما يجعل وضع النموذج أسرع.
- وضع نموذج 3D
ملاحظة: الغرض من هذه الخطوة هو وضع نموذج حجمي ثلاثي الأبعاد في خريطة الكثافة المعدة باستخدام UCSF Chimera.- في UCSF Chimera، افتح الخريطة التي تمت تصفيتها ومستديرة (ملف > مفتوح)
- تحقق مما إذا كانت معلمات الخريطة قد تم تعيينها بشكل صحيح عن طريق تحديد المعالم > المستويات وإحداثيات > المعالم في عارض وحدة التخزين لفتح واجهة المعالم والإحداثيات. تحقق من حجم Voxel لمعرفة ما إذا كان قد تم تعيين تباعد voxel الصحيح باستخدام أمر الرأس في موجه الأوامر (في IMOD). إذا لم يكن الأمر كذلك ، فقم بتصحيح واجهة Voxel Size إلى تباعد voxel الصحيح. قم بتوسيط الخريطة لتعيين الكاميرا في منتصف نافذة العرض (فهرس الأصل > المركز).
- افتح نافذة التحكم في الكاميرا (أدوات > عرض التحكم > الكاميرا). بعد ذلك، اضبط عرض الكاميرا على العرض الإملائي (الإسقاط > الإملائي)
- قم بتحميل نموذج البرنامج النصي للغة python المعدة مسبقا (File > Open > ActinFilamentPlane.py) وافتح أكبر عدد ممكن من البرامج النصية لمستوى خيوط الأكتين كما توجد مستويات خيوط الأكتين في الخريطة.
- قم بنقل الطرز المحملة عن طريق تشغيل وضع ماوس الحركة (أدوات > الحركة > وضع الماوس). قم بتمكين خيار ماوس الحركة (تعيين وضع حركة الماوس > تحديد الحركة). استخدم Ctrl + Drag لتحديد أي نماذج موجودة في الجلسة وانقر بزر الماوس الأيمن (أو أي مفتاح آخر محدد في تفضيل > الماوس) لتحريك النماذج في الاتجاه المطلوب.
ملاحظة: تم إنشاء النماذج بكرات وعصي بسماكة معينة (نصف قطر نص ActinFilamentPlane.py) وبمسافات معينة (Lattice_Spacing من نص ActinFilamentPlane.py). - لتصور النموذج الذي يهتم به المرء فقط، افتح لوحة النموذج (أدوات > عناصر التحكم العامة > لوحة النموذج). انقر فوق خانات الاختيار ضمن S (إظهار) لتمكين أو تعطيل رؤية نموذج معين.
- قم بتنشيط لوحة سطر الأوامر (أدوات > عناصر التحكم العامة > سطر الأوامر).
- بعد وضع كل نموذج مستوى خيوط الأكتين على ارتفاع Z المناسب ، احذف أي خيوط أكتين زائدة في كل نموذج مستوى خيوط الأكتين عن طريق تحديد الجزء الزائد من النماذج ، وعن طريق كتابة del sel (حذف محدد) في سطر الأوامر أسفل نافذة العرض الرئيسية UCSF Chimera.
- تصور مستوى خيوط أكتين واحد فقط في كل مرة ، من خلال الانتقال إلى نافذة لوحة النموذج وتحديد وإخفاء جميع نماذج خيوط الأكتين الأخرى (Ctrl + انقر فوق > إخفاء).
- لتصور أجزاء من كثافة الخريطة الموجودة على مقربة مباشرة من نموذج مستوى خيوط الأكتين الفردي ذي الاهتمام، حدد النموذج (>تحديد لوحة النموذج) وافتح لوحة تحكم المنطقة في عارض مستوى الصوت (عارض وحدة التخزين > الميزات > المنطقة). اضبط نصف قطر المنطقة على 100 Å، ثم انقر فوق Zone لتقسيم الخريطة في دائرة نصف قطرها 100 Å (= 10 نانومتر) من النموذج المحدد. لاحظ أن البعد في Chimera تم تعيينه في Angstrøm (1 Å = 0.1 نانومتر).
- إذا لزم الأمر، اضبط النموذج ليناسب خريطة الكثافة عن طريق تشغيل وضع ماوس الحركة. حدد بشكل متعدد أي نماذج ليست في الموضع المناسب لنقل النماذج ليتم وضعها بشكل صحيح داخل خريطة الكثافة المخصصة.
- للتغلب على خطأ البرمجة في ActinFilamentPlane.py ، قم بتشغيل البرنامج النصي FixingMarkerID.py ، والذي يعمل على إصلاح MarkerID المفقود ل "الذرات" (الكرات في نموذج الكرة والعصا). حدد النموذج بأكمله واكتب FixingMarkerID.py runscript في سطر الأوامر (يجب تحديد البرنامج النصي بواسطة الدليل الصحيح ، مثل C: \ directory \ Script.py).
- إذا كانت خريطة الكثافة تشير إلى أن خيوط الأكتين منحنية ، فتأكد من تقسيم خيوط الأكتين المستقيمة إلى أجزاء متعددة لاستيعاب الانحناء عن طريق تحديد النماذج المطلوبة وكتابة رقم dividelinks.py runscript. يتم وضع علامات إضافية (محددة بالرقم الموجود في الأمر) داخل نموذج الأكتين على مسافة متساوية من بعضها البعض ، مما يجعل "المفاصل" حيث يمكن ثني النموذج.
- اضبط الوصلات لتعكس الانحناء عن طريق تحريك "مفاصل" علامة إضافية على طول الخريطة المخصصة باستخدام وضع ماوس الحركة. أضف علامات إضافية إلى النموذج حسب الحاجة باستخدام البرنامج النصي dividelinks.py .
- للتحقق من وضع جميع خيوط الأكتين بشكل صحيح داخل كثافات الأكتين، استخدم أشرطة القطع بالنقر فوق أدوات > التحكم في العرض > الكاميرا في القائمة المنسدلة UCSF Chimera لفتح نافذة التحكم في الكاميرا ، ثم حدد العرض الجانبي لرؤية شريطي القطع (مستويي القطع القريب والبعيد) للكاميرا. اسحب شريطين أصفرين إلى شق ضيق بالنقر بزر الماوس الأيسر واسحب جزء القطع باستخدام زر الماوس الأوسط لفحص النماذج قليلا في كل مرة.
ملاحظة: اكتمل الآن النموذج الأساسي للأكتين الفراغي.
- تجزئة الغشاء
ملاحظة: الغرض من هذه الخطوة هو إنشاء نموذج سطحي لغشاء الأهداب المجسمة- يستخدم تجزئة الأسطح أداة Volume Tracer (أدوات > بيانات وحدة التخزين > متتبع الحجم).
- في نافذة Volume Tracer، انقر فوق الماوس، وحدد فقط الخيارين وضع العلامات على مستويات البيانات وربط علامة جديدة بالعلامة المحددة. يسمح ذلك بوضع العلامات بدقة على نفس المستوى Z (عند عرض مستوى Z واحد). تحقق أيضا من وضع العلامات باستخدام زر الماوس الأوسط في نافذة Volume Tracer.
- إنشاء مجموعة علامات جديدة (ملف > مجموعة علامات جديدة). يجب إنشاء مجموعة العلامات 1 وتحديدها في نافذة Volume Tracer .
- استخدم عارض مستوى الصوت لعرض مستويات Z مفردة في نافذة العرض الرئيسية (المحور إلى الياء > واحد.)
- باستخدام زر الماوس الأوسط ، تتبع الغشاء من أحد طرفي الغشاء المرئي إلى آخر. يجب توصيل جميع العلامات بوصلات من طرف إلى آخر.
- قم بإلغاء تحديد العلامة التي تم وضعها مؤخرا بالضغط على Ctrl + Click on background حيث لا يوجد عنصر واحد قابل للتحديد. هذا يضمن أن العلامة التالية التي سيتم وضعها متصلة بالروابط في المستوى الجديد ، وليس بأثر غشاء سابق لمستوى Z آخر.
- كرر تتبع الغشاء لكل 10 نانومتر في نفس اتجاه التتبع من أحد طرفي الغشاء المرئي إلى جانب آخر.
- بمجرد تقسيم العديد من النطاقات المتوازية للأغشية ، انتقل إلى نافذة Volume Tracer وانقر فوق الميزات > الأسطح. يؤدي ذلك إلى تمكين واجهة السطح في نافذة Volume Tracer . انقر فوق إنشاء بجوار واجهة الأسطح لإنشاء أسطح بين نطاقات تجزئة الغشاء. هذا يخلق رفرف رفيع من نموذج السطح يملأ آثار الغشاء المتباعدة.
ملاحظة: اكتمل الآن إنشاء نموذج سطح غشاء الفراغ.
- نمذجة Crosslinker
ملاحظة: الغرض من هذه الخطوة هو نمذجة الروابط المتشابكة بين خيوط الأكتين.- يمكن أيضا وضع الروابط المتقاطعة باستخدام أداة Volume Tracer .
- في نافذة Volume Tracer ، انقر بزر الماوس الأيسر للتحقق فقط من وضع العلامات على Surfaces وربط علامة جديدة بالعلامة المحددة. بعد ذلك، حدد وضع العلامات باستخدام زر الماوس الأوسط في نافذة Volume Tracer .
- تصور فقط الكثافات حول نموذج مستوى خيوط الأكتين الفردي ذي الأهمية باستخدام وظيفة المنطقة. اضبط نصف قطر المنطقة على 100 Å لتصور الخريطة داخل دائرة نصف قطرها 100 Å من النموذج المحدد.
- ضع العلامات عبر الكثافة المرئية للروابط المتقاطعة بالنقر فوق زر الماوس الأوسط. بمجرد وضع علامتين (وبالتالي يتم نمذجة رابط متقاطع واحد) ، تأكد من إلغاء تحديد العلامة الثانية لمنع الروابط من الاتصال باستمرار بنموذج الربط المتقاطع التالي.
- كرر الخطوات المذكورة أعلاه لكل مستوى خيوط أكتين وكرر العملية المذكورة أعلاه بأكملها إلى جميع الاتجاهات الرئيسية الثلاثة التي يمكن أن توجد فيها الروابط المتقاطعة. عند تقسيم مستويات خيوط الأكتين في الاتجاه القطري ، حدد يدويا نماذج خيوط الأكتين بشكل فردي.
ملاحظة: لكل نموذج من نماذج الأكتين المتشابك ، يمكننا تسجيل الموضع على خيوط الأكتين التي تتصل بها الروابط المتشابكة المفترضة. يمكن ، من حيث المبدأ ، استخراج هذه المعلومات لتحليل المتابعة باستخدام متوسط التصوير المقطعي الفرعي ، وهو خارج نطاق هذه الدراسة.
4. التحليل الكمي للنموذج ثلاثي الأبعاد
- تحليل الفجوات
ملاحظة: الغرض من هذه الخطوة هو اكتشاف الفجوات في خيوط الأكتين.- يمكن تحليل العناصر المحددة. حدد معلماتها، مثل لونها، باستخدام أداة Inspect Selection (الإجراء > Inspect).
- يمكن تحديد لون العنصر المحدد عن طريق تحديد أي عنصر قابل للتحديد في UCSF Chimera، وعن طريق تغيير اللون بجوار قسم اللون في نافذة فحص التحديد .
- حدد حجم العلامات والارتباطات عن طريق تحديد أي علامات وارتباطات في UCSF Chimera، وعن طريق تغيير القيم الموجودة بجوار قسم نصف القطر في نافذة فحص التحديد ، حيث توجد الوحدات في Angstrøm.
- قم بإجراء تحليل الفجوات عن طريق الكشف التلقائي عن فجوات الكثافة ، باستخدام وظيفة القيم في مواضع الذرة (أدوات > بيانات الحجم > القيم في مواضع الذرة).
- حدد الخريطة التي ستقرأ فيها القيم عن طريق تحديد الخريطة المطلوبة بجوار قسم بيانات الحجم في نافذة القيم في مواضع الذرة . حدد النموذج الذي سيتم فيه تعيين معلمة لجميع العلامات عن طريق تحديد النموذج المطلوب بجوار قسم الجزيء .
- باستخدام زر الرسم البياني في الجزء السفلي من نافذة القيم في مواضع الذرة ، يتم إنشاء رسم بياني في نافذة جديدة تسمى Render/Select by Attribute. سيؤدي Ctrl + النقر فوق الرسم البياني إلى إضافة أو إزالة نقاط القطع ، والتي يمكن تحديد ألوان مختلفة لها. قم بإلغاء تحديد Keep Opaque لتطبيق لون شفاف على المشهد. لا يمكن تلوين العلامات ذات الكثافة التي تقل عن عتبة معينة ، والتي تمثل الفجوات ، ولكن يمكن أيضا تحديدها ، وبالتالي تسمح لنا بحساب علامات الأرقام في منطقة الفجوة. للتحديد ، انقر فوق تحديد > سمة > value_mapname.
- تحديد المسافات بين الأكتين
- لقياس المسافات بين الأكتينات، ضع العلامات على مستوى XZ واحد (يشار إليه في UCSF Chimera باسم المستوى Y) باستخدام نافذة Volume Tracer ، والنقر فوق الماوس، والتحقق من وضع العلامات فقط على مستويات البيانات وإلغاء تحديد ربط علامة جديدة بالعلامة المحددة. يسمح ذلك بوضع العلامات بدقة على نفس المستوى Y (عندما يتم عرض مستوى Z واحد). تحقق أيضا من وضع علامات باستخدام زر الماوس الأوسط في نافذة Volume Tracer وضع العلامات على مستوى Y المستهدف محل الاهتمام لقياس المسافة بين الأكتين.
- بمجرد وضع علامة على مواضع الأكتين في الطائرة Y الفردية بنجاح ، حدد جميع العلامات واكتب الأمر findclash #model-spec test self overlapCutoff -200 hbondAllowance 0 log true Linewidth 10 pbColor black في سطر الأوامر أسفل مستوى خيوط الأكتين. يجد هذا جميع الاشتباكات بين العلامات على مسافة 200 Å (overlapCutoff -200) ، ويخلق خطوطا سوداء (pbColor black) بسمك 10 Å (عرض الخط 10) بين العلامات.
- نظرا لوجود علامات متداخلة ضمن النطاق المحدد البالغ 200 Å ، قم بإزالة القياسات الزائدة عن الحاجة التي لا تشكل روابط بين أقرب العلامات المجاورة فقط. قم بذلك باستخدام البرنامج النصي RemoveCross.py المتوفر على موقع UCSF Chimera على الويب ، والذي يزيل جميع الارتباطات المتداخلة التي ليست أقصر ارتباط مع العلامات المجاورة لها.
- لقياس مسافة الروابط المتبقية، حدد جميع الروابط الزائفة (الروابط التي تم إنشاؤها بواسطة findclash) واستخدم pblengths.py البرنامج النصي python عن طريق كتابة pblengths.py runscript. راجع القيم المقاسة من سجل الرد (الأدوات > الأدوات المساعدة > سجل الرد). بعد ذلك ، انسخ القيم التي تم الحصول عليها من سجل الرد وانقلها إلى جدول بيانات أو أي أداة أخرى مناسبة لإنشاء رسم بياني.
النتائج
باستخدام التصوير المقطعي الإلكتروني بالتبريد للأهداب المجسمة الفردية غير الملوثة والمجمدة المضمنة في الجليد الزجاجي ، حصلنا على خرائط كثافة لحزمة الأكتين مع خيوط الأكتين المرتبة سداسية ، مرتبطة ببروتينات الموصلالمتقاطعة 23. كان بعد فوكسل الفردي 0.947 نانومتر. أشار الفحص البصري في برنامج تقطيع IMOD لعرض حجم التصوير المقطعي بأكمله (400 شريحة / 379 نانومتر) إلى وجود هياكل خيطية تتماشى مع المحور الطولي للأهداب المجسمة ، كما يتضح من المناظر الطولية (XY-level; الشكل 1A-C ، اللوحات العلوية) وكذلك في طرق عرض المقطع العرضي (XZ-Level; الشكل 1A-C ، الألواح السفلية). لاحظنا أن عرض الإسقاط من خلال شبكة خيوط 400 شريحة / 379 نانومتر أصبح أكثر وضوحا عند تدوير الحجم الأصلي المعاد بناؤه بمقدار -6 درجات حول المحور X ، و -13.5 درجة حول المحور Y ، و 5 درجات حول المحور Z. في هذه الزاوية ، تتم محاذاة جميع الخيوط فوق بعضها البعض ، وبالتالي يكون التباين أقصى قدر ، كما يمكن تقديره من طرق العرض المقطعية (الشكل 1 ب). نظرا لأن شرائح المقطع العرضي المفردة لا تحتوي على إشارة كافية لتمييز خيوط الأكتين بشكل لا لبس فيه ، فقد اخترنا عرض لوح من 30 شريحة / 28.4 نانومتر ، والذي يظهر بوضوح نمطا سداسيا في عرض المقطع العرضي. تشير الخطوط الزرقاء في الشكل 1C (الألواح العلوية) إلى موضع منتصف الألواح المقطعية المقابلة 30 شريحة / 28.4 نانومتر في الألواح السفلية.
الانحرافات الصغيرة عن زاوية الرؤية المثلى هذه ، بأقل من ±2 درجة ، قللت بشكل كبير من الترتيب المتصور لشبكة خيوط الأكتين (الشكل 1 أ ، ج) ، وهو مؤشر على مدى سهولة الضياع في الحجم ثلاثي الأبعاد للتصوير المقطعي.
لتوضيح التحدي المتمثل في استخدام مناهج التجزئة الآلية ، مثل تجزئة مستجمعات المياه ، اخترنا حجما فرعيا صغيرا (يصور على أنه ذهب) لتجزئة مستجمعات المياه ، كما هو مطبق في حزمة برامج UCSF Chimera (أدوات > بيانات الحجم > Segger > Segment). يشار إلى موضع المجلد الفرعي بالنسبة لخريطة الأهداب المجسمة بأكملها من خلال الجزء الداخلي الصغير في الشكل 1 ب.
يوضح الشكل 1D-F الحجم الفرعي المختار في اتجاهات مختلفة ، حيث يوضح الشكل 1D ، E اتجاه المشاهدة الطولي والشكل 1F يوضح اتجاه الرؤية المقطعي. تشير الأسهم الموجودة على الجانب الأيسر من الشكل 1D-F إلى اتجاه خيوط الأكتين.
يوضح الشكل 1D-F (الألواح اليمنى) نتائج تجزئة مستجمعات المياه. يتم ترميز المجلد الفرعي بالألوان بواسطة هوية الكائن ، مع تعيين الألوان بشكل عشوائي للكائنات المختلفة. تشير الألوان المختلفة إلى هوية كائن مختلفة ، ومن ثم يتضح من الشكل 1D-F أن كثافات الخريطة للخيوط كانت مجزأة على طول محور الفتيل ، في حين تم إعطاء نفس اللون وبالتالي هوية الكائن لكثافات الخريطة التي تربط الخيوط المجاورة. بمعنى آخر ، لم تكن خوارزمية تجزئة مستجمعات المياه قادرة على متابعة خريطة كثافة خيوط الأكتين لفترة طويلة ، وبدلا من ذلك أدت إلى ربط الكثافات من الخيوط المجاورة. في حين أنه من الممكن تنظيم التحديد يدويا (على سبيل المثال ، عن طريق حذف الكائنات أو دمجها) ، فإن هذا النهج يتطلب عمالة كثيفة وبالتالي يستغرق وقتا طويلا.
على الرغم من أنه ليس من الضروري تماما أن تعمل استراتيجية بناء النموذج الحجمي الخاصة بنا ، إلا أنها ساعدت في إعادة توجيه (تدوير) الخريطة ثلاثية الأبعاد بحيث يتماشى محور شبكة خيوط الأكتين مع المحور Y ومستويات نموذج خيوط الأكتين المتوافقة مع المستوى XY للتصوير المقطعي. نشير إلى هذا الاتجاه على أنه الاتجاه القياسي للعرض المقطعي المجسمة الأهداب.
لذلك قررنا استكشاف استراتيجية مختلفة لتجزئة الصور ، مستغلين حقيقة أن خيوط الأكتين أظهرت تنظيما منتظما شاملا (التعبئة السداسية) ، مع تباعد منتظم واتجاه إجمالي محدد للحزمة. كانت استراتيجيتنا هي إيجاد ملاءمة شاملة لنماذج حزمة الأكتين ، كمجموعة من الخيوط ، متبوعة بتعديلات إقليمية ثم محلية لموضع النموذج لتناسب خريطة الكثافة التجريبية. من خلال وضع نموذج شامل أولا ، يمكننا التغلب على غموض الخريطة المحلية ، واكتشاف الاتجاهات الإقليمية لانحرافات النموذج عن تنظيمه الأصلي ، مثل ثني الفتيل.
لوضع النموذج ، عرضنا ألواح من الكثافة (10 شرائح / 9.47 نانومتر) في الاتجاه القياسي الذي يتوافق مع سمك طبقة واحدة من خيوط الأكتين ، والتي تم تركيب طبقة من نماذج خيوط الأكتين المستقيمة المتباعدة بانتظام. هذا بالطبع هو تبسيط مفرط لخيوط الأكتين ، كل منها يتكون من مجموعة خطية من مونومرات الأكتين ذات التناظر الحلزوني. يوضح الشكل 2A-C ثلاث طبقات تمثيلية عند ارتفاعات Z مختلفة ، مع قضبان حمراء اللون تمثل خيوط الأكتين. تظهر الألواح العلوية ، التي تصور ~ 30 شريحة / 28.4 نانومتر مقاطع عرضية بسمك 28.4 نانومتر ، حيث تم وضع طبقة نموذج أكتين فردية من 19 قضيبا ، بينما تظهر الألواح السفلية اتجاها طوليا (وإن كان موضحا في عرض المنظور). يوضح الشكل 2D النموذج المبسط الكامل ، سواء في طرق عرض المقطع العرضي (اللوحة العلوية) أو المنظور الطولي (اللوحة السفلية). سمح لنا الاتجاه المقطعي بوضع الخيوط بثقة جيدة. هنا ، أثبتت خطوتنا الأصلية لإعادة توجيه الحجم بأكمله ليتزامن مع المحاور الرئيسية للتصوير المقطعي أنها مفيدة ، لأنها تعني أن اتجاه نموذجنا في اتجاه الرؤية القياسي لدينا كان أيضا موازيا للمحاور الرئيسية. ومع ذلك ، بالمعنى الدقيق للكلمة ، كان نهجنا سينجح أيضا بدون إعادة توجيه التصوير المقطعي ، فقط وضع النموذج على الكثافة كان أكثر صعوبة.
عند الفحص الدقيق للألواح الفردية لخريطة الكثافة ، لاحظنا أن نموذج الأكتين المستقيم تماما لا يتناسب مع خريطة الكثافة المرصودة التي تتحرك من الطرف القريب إلى الطرف البعيد (أي باتجاه الحافة) من الأهداب المجسمة (الشكل 3A-C). بالقرب من طرف الأهداب المجسمة ، تم إزاحة كثافة الخريطة للخيوط بأكثر من 13 نانومتر (تباعد الأكتين والأكتين) ، والتي يمكننا تعويضها عن طريق ضبط النموذج أثناء الانتقال من الجزء القريب إلى الجزء البعيد من خريطة كثافة الأهداب المجسمة ، وبالتالي إدخال انحناء تدريجي صغير ولكن يمكن تمييزه في نموذج الأكتين الخاص بنا. يوضح الشكل 3D لوحا واحدا من كثافة خريطة خيوط الأكتين ، مع نموذج حجمي مثبت على خريطة الكثافة. تظهر مقارنة بين النموذج المستقيم (الأحمر) والمنحني (الأصفر) في الشكل 3E. يتم تقدير هذا الانحناء بشكل أفضل من خلال إمالة لوح من خريطة الكثافة مع النموذج الموضوع بمقدار 80 درجة حول المحور X ، مما يسمح للمرء بالحصول على عرض منظور على طول اتجاه خيوط الأكتين (الشكل 3D ، E).
كان من الممكن أن يتسبب انحراف النموذجين ، مع إزاحة موضع نموذج الأكتين بالقرب من الطرف بنفس المسافة تقريبا مثل تباعد خيوط الأكتين ، في حدوث الكثير من الارتباك إذا لم نمضي قدما بالطريقة التي فعلناها. سمح لنا هذا الوضع "العالمي" لطبقة من نموذج خيوط الأكتين ، متبوعا بالتعديل "الإقليمي" ، باكتشاف هذا الانحناء ، والذي بالكاد يمكن ملاحظته في العرض الطولي أو المقطعي. ومع ذلك ، فإن تراكب النموذجين ، كما هو موضح في الشكل 3E ، يكشف عن الاختلاف الدقيق.
يسمح تكرار هذا النهج للطبقات المتعددة بالحصول على نموذج ثلاثي الأبعاد كامل (الشكل 3F) ، يقتصر فقط على عدم اليقين في البيانات في أعلى وأسفل الأهداب المجسمة ، عند عرضها في اتجاه المقطع العرضي (الشكل 3G). يحدث هذا النقص في الكثافة بسبب الإسفين المفقود في جمع البيانات المقطعية (أحادية المحور) وتباين دقة البيانات المقابلة ، ويشار إلى تأثيره من خلال عدم وجود كثافة خريطة محددة جيدا لأغشية الأهداب المجسمة
بمجرد أن يكون لدينا نموذج ثلاثي الأبعاد ، قمنا بترميز كل موقع من مواقع النموذج الحجمي وفقا لقيمة كثافة الخريطة في هذا الموضع. تم تلوين مناطق النموذج ذات كثافة الخريطة الضعيفة الأساسية باللون الأحمر ، في حين أن مناطق النموذج ذات إشارة كثافة الخريطة القوية كانت ملونة باللون الأصفر (الشكل 4 أ). نفسر هذه المناطق ذات اللون الأحمر ، والتي يمكن أن تمتد إلى عشرات النانومترات ، على أنها فجوات في هياكل خيوط الأكتين التي ، نظرا لمداها ، لا يمكن أن تعزى إلى اختلافات الكثافة التي تتم مواجهتها بشكل متكرر في بيئة الضوضاء العالية لخريطة cryo-EM. تميل الضوضاء إلى التأثير على الفوكسل الفردية أو مجموعات صغيرة من الفوكسل ، ولكن من غير المرجح أن تكون مصدرا للأحجام التي تتكون من مئات الفوكسل ، والتي تكون كثافة الفتيل مفقودة لها. بدلا من ذلك ، من المحتمل أن تكون هذه الفجوات سمة حقيقية لشبكة الأكتين المجسمة وقد تشكل مواقع لدوران الأكتين. يحتوي الشكل 4 أ على قيمتين مختلفتين لكثافة الخريطة ، كما هو موضح باللون الأزرق الفاتح والأزرق الداكن. وتجدر الإشارة صراحة إلى أن نهج بناء النموذج الحجمي الخاص بنا ، جنبا إلى جنب مع الترميز اللوني الآلي لنموذجنا في المناطق ذات الكثافة الضعيفة ، هو طريقة سريعة ومريحة لاكتشاف وتصور توزيع هذه الفجوات في نموذج خيوط الأكتين ، والذي كان من الممكن أن يكون صعبا للغاية لولا ذلك.
كما هو موضح في الشكل 4 ب ، يمكن إخفاء أجزاء من النموذج الحجمي في المواقع ذات الكثافة الضعيفة نسبيا بسهولة بناء على النتائج التي تم الحصول عليها في الشكل 4 أ. ينتج عن هذا بعد ذلك نموذج أكثر تجزئة قد يصور بشكل أكثر واقعية نموذج الأكتين في الأهداب المجسمة كان البديل المتمثل في بناء امتدادات صغيرة من خيوط الأكتين كثيف العمالة وربما يكون قد فشل تماما ، بسبب المشاكل التي تمت مناقشتها عند وصف الشكل 1.
بالإضافة إلى ذلك ، يسمح لنا النموذج الحجمي بنمذجة الموصلات المتقاطعة بسهولة عن طريق وضع اتصال (كما هو موضح باللون الأحمر) بين مواضع نقطة النموذج لنموذج خيوط الأكتين على جانبي التوصيل المتقاطع (الشكل 4C). في نهجنا المبسط ، لا نحتاج إلى وضع أي افتراض حول الهوية الدقيقة لكل بروتين متصل ، الأمر الذي يتطلب دقة أعلى و / أو أساليب وضع العلامات المتطورة. بدلا من ذلك ، كل ما نحتاج إلى تحديده هو ما إذا كانت الكثافة موجودة تربط خيوط الأكتين المجاورة. إذا كان هناك ، فيمكننا وضع اتصال قصير من خيوط واحدة إلى نظيره المجاور. في الشكل 4D ، يظهر نموذج لخمسة خيوط أكتين مع موصلاتها المتقاطعة ، مما يعطي انطباعا عن توزيع الموصلات المتقاطعة على طول محور خيوط الأكتين.
ميزة أخرى لبناء نموذج حجمي لحزمة الأكتين هي أنه يمكن للمرء أن يحدد بسرعة التباعد بين خيوط الأكتين المجاورة (الشكل 4E-H). يوضح الشكل 4E ، F عرضا مقطعيا لخريطة الكثافة بدون نموذج مناسب للشبكة السداسية لكثافة الخريطة ، على التوالي. يوضح الشكل 4G النموذج مع وصلات بين أقرب الكرات المجاورة. يسمح UCSF Chimera بالحساب التلقائي لمسافة أقرب المراكز المجاورة ، والتي يمكن بعد ذلك رسم نتيجتها كتوزيع مسافة (الشكل 4H). يظهر بناء النموذج لمجموعتي بيانات إضافيتين في الشكل التكميلي 1 والشكل التكميلي 2.
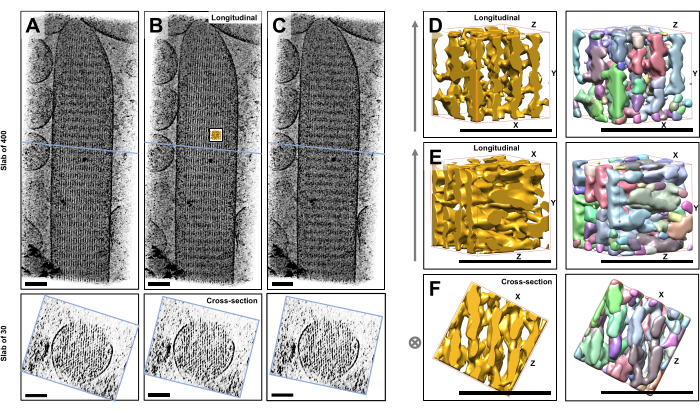
الشكل 1: التحديات التي يواجهها تجزئة مستجمعات المياه للتصوير المقطعي لخلايا الشعر. (AC) الإسقاطات الطولية (400 شريحة / 379 نانومتر) من خلال الخريطة ثلاثية الأبعاد المقطعية في المستوى XY (الألواح العلوية) وطرق العرض المقطعية (30 شريحة / 28.4 نانومتر) في مستوى XZ (الألواح السفلية). (أ) الخريطة المقطعية المستدارة -2 درجة على طول المحور Y من اتجاهها الأمثل. (ب) خريطة مقطعية في الاتجاه الأمثل ، يتم تحديدها عن طريق تعديل زوايا دوران المحاور X و Y و Z (X = -6 ° و Y = -13.5 ° و Z = 5 °) والكشف عن درجة عالية من الترتيب في خريطة الكثافة ، مما يشير إلى شبكة خيوط أكتين عالية الترتيب. (ج) الخريطة المقطعية التي تدور +2 درجة على طول المحور Y من اتجاهها الأمثل؛ إن الدوران الذي لا يقل عن 2 درجة حول المحور Y بعيدا عن اتجاه الرؤية الأمثل يضر بشدة بالانتظام المتصور لخريطة الكثافة. تكشف الألواح السفلية عن انتظام مصفوفة خيوط الأكتين عند عرضها في اتجاه المقطع العرضي. يشير الخط الأزرق في ACC إلى موضع البلاطة المقطعية. (D-F) مكعب 50 نانومتر × 50 نانومتر × 50 نانومتر ينظر إليه من ثلاثة اتجاهات مختلفة قبل (الألواح اليسرى) وبعد (الألواح اليمنى) تجزئة مستجمعات المياه. لاحظ أن تجزئة مستجمعات المياه تفشل في اكتشاف كثافة خيوط الأكتين المستمرة ، في حين أن خيوط الأكتين المجاورة واتصالها المتقاطع تشترك في نفس هوية الكائن ، مما يشير إلى أن تجزئة مستجمعات المياه ليست نهجا مناسبا لتجزئة المقطع. في اللوحات D-F ، تظهر خريطة الكثافة في Chimera على أنها نمط الخريطة "Surface". (أ-ج) أشرطة المقياس = 100 نانومتر. (D-F) أشرطة المقياس = 50 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
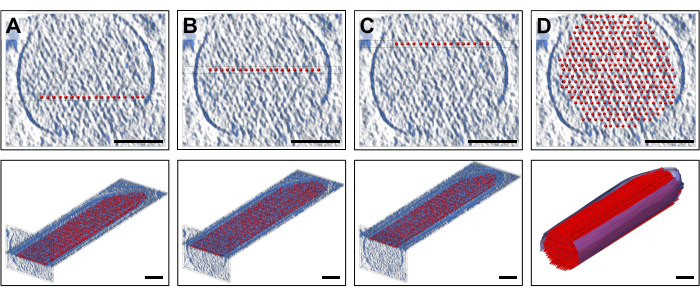
الشكل 2: بناء نموذج خيوط الأكتين الكروية والعصا الحجمي. (AC) أعلى: مقاطع عرضية 30 شريحة / 28.4 نانومتر لخريطة الكثافة مع نموذج خيوط أكتين مبسط أحادي الطبقة موضوعة على ارتفاع Z مختلف. أسفل: لوح واحد 10 شريحة / 9.47 نانومتر من خريطة الكثافة مع نموذج خيوط أكتين مبسط أحادي الطبقة. (د) نموذج كامل لخيوط الأكتين المستقيمة في عرض مقطعي 30 شريحة/28.4 نانومتر (أعلى) وعرض منظور (أسفل)؛ أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
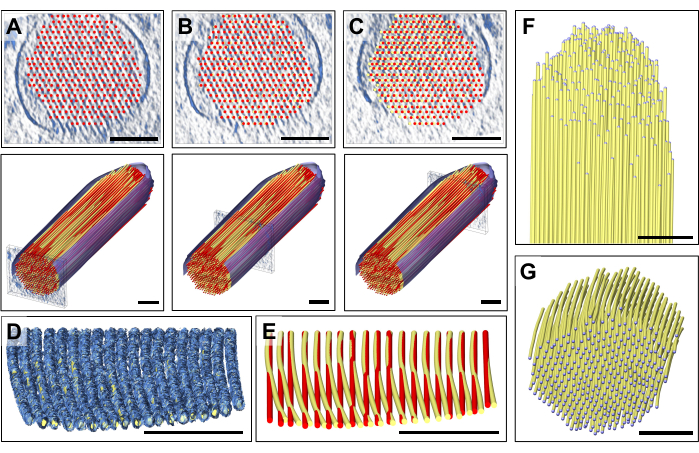
الشكل 3: تعديل النموذج لتصحيح الانحناء المكتشف لكثافة خيوط الأكتين. (AC) كشف الفحص البصري الدقيق للنموذج ، إما في عرض المقطع العرضي (الألواح العلوية) أو العرض الطولي (الألواح السفلية) ، عن ملاءمة جيدة للنموذج مع خريطة الكثافة في الطرف القريب من الأهداب المجسمة ومع ذلك ، عندما يتحرك المرء نحو الطرف البعيد من الأهداب المجسمة ، يصبح الملاءمة أسوأ بشكل متزايد لجميع نماذج خيوط الأكتين. يمكن تصحيح ذلك عن طريق تحريك كرات نموذج الكرة والعصا إلى موضع خريطة الكثافة الصحيح ، مما ينتج عنه نموذج خيوط أكتين منحني قليلا. يظهر النموذج المستقيم باللون الأحمر ، ويظهر النموذج المنحني المصحح باللون الأصفر. (د) لوح واحد من خريطة الكثافة مع تركيب النموذج المنحني عليه ، مما يكشف عن انحناء كثافة الأكتين باتجاه طرف الأهداب المجسمة تم تدوير نموذج الأكتين بزاوية 80 درجة حول المحور X لإظهار هذا الانحناء الدقيق والكبير لخيوط الأكتين بشكل أفضل. (ه) مقارنة بين نموذج الأكتين المستقيم غير المصحح المبين باللون الأحمر ونموذج الأكتين المنحني المصحح المبين باللون الأصفر. لأسباب تتعلق بالوضوح ، يتم عرض طبقة واحدة فقط من نموذج خيوط الأكتين. (إف جي) نموذج حزمة الأكتين مع خيوط الأكتين المنحنية والمصححة الموضحة في الاتجاه الطولي (F) والمقطع العرضي (G). يظهر الغشاء المجزأ باللون الأزرق. في اللوحة D ، تظهر خريطة الكثافة في Chimera كنمط الخريطة "Mesh". أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
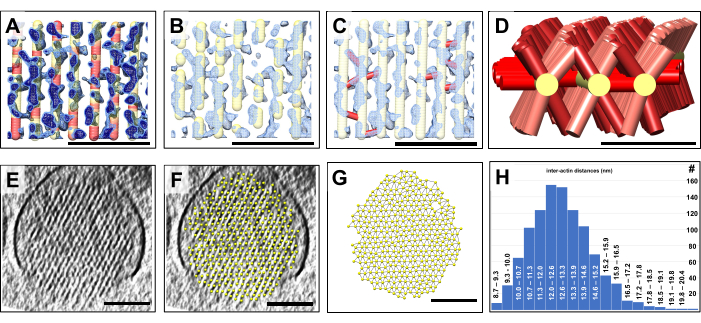
الشكل 4: الكشف عن الفجوات في حزمة الأكتين باستخدام بناء النموذج الحجمي. القياس الكمي للخصائص الحجمية باستخدام نماذج الكرة والعصا. (أ-ج) تظهر منطقة صغيرة من لوح طولي بسمك ~ 10 شريحة / 9.47 نانومتر لخريطة كثافة الأهداب المجسمة باللون الأزرق ، جنبا إلى جنب مع نموذج خيوط الأكتين المنحني والمصحح. (أ) تظهر خريطة الكثافة عند عتبة كثافة أقل (أزرق فاتح) وعتبة كثافة أعلى (أزرق داكن). هناك مناطق من نموذج خيوط الأكتين لا توجد كثافة مقابلة لها. في مثل هذه المواقع ، تم ترميز النموذج باللون الأحمر لتمثيل نقص الكثافة. نفسر هذه المواقع على أنها فجوات في خيوط الأكتين. (ب) نموذج خيوط الأكتين التي تبدو مجزأة، مما يعكس الافتقار إلى كثافة خيوط الأكتين في مواقع الفجوات هذه. (ج) نموذج خيوط الأكتين ذات الوصلات المتقاطعة (الموضحة باللون الأحمر) المضافة في المواقع التي تم العثور فيها على كثافة قوية لربط خيوط الأكتين المجاورة. (د) تظهر ثلاثة خيوط أكتين نموذجية مختارة مع موصلات متقاطعة لخيوط الأكتين المجاورة (والتي لم تظهر من أجل الوضوح). لاحظ أن العديد من مواضع خيوط الأكتين المحتملة ، وليس كلها ، تشغلها بروتينات الموصل. (ه) لوح مقطع عرضي 30 شريحة / 28.4 نانومتر من كثافة الأهداب المجسمة (و) نموذج خيوط الأكتين المثبتة على لوح كثافة الأهداب المجسمة المقطعي 30 شريحة / 28.4 نانومتر. (ز) نموذج خيوط الأكتين بدون كثافة الخريطة الأساسية. الكشف التلقائي عن أقرب مسافات خيوط الأكتين المجاورة ، كما يتضح من الوصلات الرقيقة بين كرات نموذج خيوط الأكتين. (ح) الرسم البياني لمسافات نموذج خيوط الأكتين. في اللوحات A-C ، تظهر خريطة الكثافة في Chimera على أنها نمط الخريطة "Mesh". (أ-ج) أشرطة المقياس = 50 نانومتر. (د) شريط المقياس = 25 نانومتر. (E-G) أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: بناء نموذج لأول مجموعتين إضافيتين من مجموعات بيانات الأهداب المجسمة الإضافية. (أ-ج) تظهر منطقة صغيرة من شريحة ~ 10 / 9.47 نانومتر من خريطة كثافة الأهداب المجسمة باللون الأزرق باستخدام عرض وضع الشبكة. يظهر النموذج الذي تم وضعه في البداية باللون الأحمر والنموذج المصحح موضح باللون الأصفر. (أ) كثافة الخريطة فقط. (ب) النموذج الأولي الذي تم وضعه في خريطة الكثافة. (ج) وضع النموذج المصحح في خريطة الكثافة. (D-E) منطقة أهداب مجسمة أكبر بدون (D) ومع (E) النموذج المصحح المثبت على لوح طولي بسمك ~ 10 شريحة / 9.47 نانومتر لخريطة كثافة الأهداب المجسمة (إف جي) يتم عرض منطقة التصوير المقطعي المجسمة بأكملها. (و) الخريطة فقط. (ز) خريطة بالنموذج المصحح. (ح) تراكب النماذج الأولية والمصححة. أشرطة المقياس = 100 نانومتر الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: بناء نموذج لمجموعتي بيانات الأهداب الفراغية الإضافيتين. (أ-ج) تظهر منطقة صغيرة من شريحة ~ 10 / 9.47 نانومتر من خريطة كثافة الأهداب المجسمة باللون الأزرق باستخدام عرض وضع الشبكة. يظهر النموذج الذي تم وضعه في البداية باللون الأحمر والنموذج المصحح موضح باللون الأصفر. (أ) كثافة الخريطة فقط. (ب) النموذج الأولي الذي تم وضعه في خريطة الكثافة. (ج) وضع النموذج المصحح في خريطة الكثافة. (D-E) منطقة أهداب مجسمة أكبر بدون (D) ومع (E) النموذج المصحح المثبت على لوح طولي بسمك ~ 10 شريحة / 9.47 نانومتر لخريطة كثافة الأهداب المجسمة (إف جي) يتم عرض منطقة التصوير المقطعي المجسمة بأكملها. (و) الخريطة فقط. (ز) خريطة بالنموذج المصحح. (ح) تراكب النموذج الأولي والمصحح. أشرطة المقياس = 100 نانومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 1: نصوص UCSF Chimera python لنمذجة الأهداب الفراغية. الرجاء النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 1: pblengths.py. الرجاء النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 2: RemoveCross.py. الرجاء النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 3: ActinFilamentPlane.py. الرجاء النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 4: dividelinks.py. الرجاء النقر هنا لتنزيل هذا الملف.
ملف الترميز التكميلي 5: FixingMarkerID.py. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
لقد أظهرنا أن الأساليب الآلية للتجزئة ، مثل تجزئة مستجمعات المياه ، يمكن أن تفشل في البيئة عالية الضوضاء والتعقيد لتصوير المقطعي الإلكتروني المجرد لخلايا الشعر. يبدو التمييز بين أي جزء من هذه الشبكة الخيطية يمثل خيوط الأكتين وما يشكل روابط متقاطعة على مستوى البيئة المحلية أمرا صعبا في أحسن الأحوال عند فحص المجلدات الفرعية المقطعية الصغيرة. يستفيد نهج بناء النموذج المستخدم في هذه الدراسة من المعرفة المسبقة بالترتيب واسع النطاق لحزمة الأكتين ، مما يساعد في تطوير توقع حول اتجاه خيوط الأكتين وكثافة الروابط المتقاطعة. ربما يكون الأهم من ذلك هو أن الدماغ البشري يمكنه بسهولة العثور على أنماط من خلال النظر في السياق الأكبر خارج توزيع الكثافة المحلية ، في حين أن خوارزمية الكمبيوتر تعمل فقط لمنطقة صغيرة نسبيا تعتبرها الخوارزمية. ومن ثم، لا يمكن بسهولة أخذ الاتجاهات الأوسع نطاقا في الاعتبار. من خلال تركيب نموذج عالميا على طبقة من الكثافة ، تجنبنا الارتباك الذي يمكن أن يحدث عند محاولة إنشاء نموذج لأجزاء صغيرة من خيوط الأكتين المفردة في المرة الواحدة. بالطبع ، يفترض هذا التركيب العالمي ترتيبا يمتد لمسافات كبيرة. ومع ذلك ، نظرا لأن لدينا انحناء تدريجيا صغيرا غير متوقع ولكنه مهم لخيوط الأكتين ، فإن الملاءمة العالمية كانت مجرد تقريب أولي ، وتطلبت تعديلات محلية للنموذج لتناسب خريطة الكثافة. نظرا لأن النموذج الأولي كان نقطة انطلاق جيدة ، يمكن إجراء التعديلات بثقة عالية. كانت إحدى المزايا الكبيرة لنهجنا هي أنه يمكننا اختيار عرض منطقة محددة فقط من الكثافة ، مما ساعد على تقليل تعقيد المشهد. علاوة على ذلك ، ساعد عرض لوح كثافة الخريطة على طول محور نموذج الفتيل في تحديد الانحناء غير المتوقع ، والذي من المرجح أن نفتقده عند عرض أحجام فرعية أصغر. سهل وضع النموذج الأولي أيضا التكبير والتصغير السريع ، للتبديل بين العرض العام للطبقة المعنية من خيوط الأكتين وطرق العرض التفصيلية لإجراء تعديلات على النموذج.
تضمنت الخطوات الحاسمة داخل البروتوكول تدوير الخريطة بعد الفحص البصري ، وإنشاء النموذج ووضعه في خريطة الكثافة ، بالإضافة إلى تقسيم نموذج الفتيل إلى أجزاء أصغر. يمكن بعد ذلك تعديل موضع الذرة للأجزاء مكانيا ليناسب خريطة الكثافة ، و / أو ترميز اللون لاكتشاف الفجوات.
يمكن أيضا تعديل هذا النهج لبناء نموذج الأكتين عن طريق وضع مجموعة من "الذرات" (أي كرات نموذج الكرة والعصا) في كثافات الخيوط باستخدام عرض مقطعي لشريحة 10-30 / 9.47-28.4 نانومتر لوح متوسط الكثافة ، والذي يمكن بعد ذلك توصيله بالروابط (أي عصي نموذج الكرة والعصا). لقد استخدمنا هذا النهج ، وهو تعديل من البروتوكول الموصوف هنا بالتفصيل ، لبناء النموذج الحجمي في المنطقة المستدقة من الأهداب المجسمة لخلايا الشعر23. علاوة على ذلك ، كما وصفنا هنا ، فإن نهج بناء النموذج الحجمي الخاص بنا مناسب أيضا لتجزئة وبناء نموذج الأغشية.
بينما يمكن تطبيق بناء النموذج الحجمي على أي خريطة كثافة تظهر ميزات خيوطية ، فإن التقنية التي وصفناها هنا تكون أكثر فاعلية عندما يكون لدينا مجموعة من الخيوط المتباعدة بانتظام ، والتي يمكن الحصول على ملاءمة عالمية لنموذج حجمي. يعتمد أيضا على الميزات الخيطية لتغيير اتجاهها بطريقة تدريجية. إذا كانت هناك مكامن الخلل المفاجئة والمنعطفات الحادة في الهياكل الخيطية ، فقد لا يكون نهجنا مفيدا بشكل خاص للتجزئة.
في غضون ذلك ، طور المتعاونون معنا نهجا آليا للتتبع الآلي للخيوط يتبع مفهوما مشابها يستخدم هنا للتجزئة اليدوية30،31. من الآن فصاعدا ، قد يكون أفضل نهج هو مزيج من التحديد اليدوي ووضع نموذج متناثر أولي (حتى بضع كرات فقط) في الكثافة كنقطة بداية ، ثم السماح لخوارزمية البحث والتركيب بإنهاء تتبع الخيوط.
تقلل النماذج الحجمية المبسطة من تعقيد النظام وتسمح بتقدير أنماط معينة ، مثل انحناء خيوط الأكتين بالقرب من الحافة ، بشكل أفضل. أيضا ، يمكن استخدام النموذج الحجمي ك "مرساة" لعرض منطقة كثافة حول نموذج الكرة والعصا المختارة ، مما يسمح باكتشاف وتصور كثافات الربط المتقاطع بين خيوط الأكتين المجاورة. تسمح القدرة على تحديد الخيوط الفردية وتعيين أنصاف أقطار مناسبة كمنطقة يتم فيها عرض الكثافة مرة أخرى بتقليل التعقيد الهائل للمشهد إلى مستوى يمكن التحكم فيه.
كانت إحدى مزايا نهج بناء النموذج الحجمي هذا للتركيب العالمي ، متبوعا بالتعديلات المحلية ، هو أننا تمكنا من تحديد المناطق التي بدا فيها أن خيوط الأكتين متقطعة ، وتمت الإشارة إلى فجوات كبيرة في خيوط الأكتين من خلال غياب كثافة الخريطة. نظرا لأننا وضعنا نموذجا حجميا للكرة والعصا ، يمكننا الاستفادة من روتين في حزمة برامج UCSF Chimera التي تقوم بترميز كل موضع كرة نموذجي وفقا لقيمة كثافة الخريطة في هذا الموقع. سمح هذا النهج بالكشف السريع عن فجوات خيوط الأكتين وتصورها في حزمة الأكتين ، وهي ميزة مهمة بيولوجيا وجدناها في التصوير المقطعي الإلكتروني بالتبريد ، والتي كان من الصعب جدا اكتشافها وتصورها باستخدام مناهج التجزئة التقليدية. ميزة أخرى لنموذجنا الحجمي هي أنه يمكن الحصول بسهولة على الخصائص الحجمية بما في ذلك الأطوال والمسافات ، مما يسمح بإجراء الأرقام الفعلية وبالتالي إجراء تحليل إحصائي.
باختصار ، يعد وضع نقطة النموذج اليدوي التفاعلي ، الذي ربما يتم تعزيزه من خلال قدرات التركيب المحلي الآلي اللاحق وتتبع الخيوط ، نهجا واعدا إلى حد ما للتصور والتحليل الكمي للأحجام الخلوية المقطعية للإلكترون. هذا لأنه يستخدم قوة الدماغ البشري للتعرف على الأنماط وقوة علوم الكمبيوتر لتحسين النموذج.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة أو أي تضارب في المصالح أخرى.
Acknowledgements
نود أن نشكر الدكتور بيتر بار جيليسبي وفريقه على دورهم في إعداد العينات والأعضاء السابقين في مختبر Auer ومختبر الدكتورة دوريت حنين لدورهم في جمع البيانات المقطعية. نود أيضا أن نشكر توم جودارد من UCSF Resource للحوسبة الحيوية والتصور والمعلوماتية (RBVI) على توفير العديد من نصوص UCSF Chimera.
Materials
| Name | Company | Catalog Number | Comments |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/download.html | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=win64/chimera-1.16-win64.exe | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=mac64/chimera-1.16-mac64.dmg | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=linux_x86_64/chimera-1.16-linux_x86_64.bin | |
| Excel | Microsoft | Version 2211 https://www.office.com/?auth=1 | |
| Falcon II | Thermofisher | https://www.thermofisher.com/de/de/home/electron-microscopy/products/accessories-em/falcon-detector.html | |
| IMOD | University of Colorado | Version 4.11.1 https://bio3d.colorado.edu/imod/download.html | |
| PC Desktop | Intel | Windows 10, ver. 22H2 | |
| PC Laptop | Gigabyte | Windows 10, ver. 22H2 | |
| Powerpoint | Microsoft | Version 2211 https://www.office.com/?auth=1 | |
| Titan Krios Electron Microscope | Thermofisher | https://www.thermofisher.com/de/de/home/electron-microscopy/products/transmission-electron-microscopes/krios-g4-cryo-tem.html | |
| Word | Microsoft | Version 2211 https://www.office.com/?auth=1 |
References
- Downing, K. H., Sui, H., Auer, M. Electron tomography: A 3D view of the subcellular world. Analytical Chemistry. 79 (21), 7949-7957 (2007).
- Koning, R. I., Koster, A. J. Cellular nanoimaging by cryo electron tomography. Methods in Molecular Biology. 950, 227-251 (2013).
- Asano, S., Engel, B. D., Baumeister, W. In situ cryo-electron tomography: A post-reductionist approach to structural biology. Journal of Molecular Biology. 428 (2), 332-343 (2016).
- Serwas, D., Davies, K. M. Getting started with in situ cryo-electron tomography. Methods in Molecular Biology. 2215, 3-23 (2021).
- McDonald, K. L., Auer, M. High-pressure freezing, cellular tomography, and structural cell biology. Biotechniques. 41 (2), 137-143 (2006).
- Narasimha, R., et al. Evaluation of denoising algorithms for biological electron tomography. Journal of Structural Biology. 164 (1), 7-17 (2008).
- Frangakis, A. S. It's noisy out there! A review of denoising techniques in cryo-electron tomography. Journal of Structural Biology. 213 (4), 107804 (2021).
- Frangakis, A. S., Hegerl, R. Noise reduction in electron tomographic reconstructions using nonlinear anisotropic diffusion. Journal of Structural Biology. 135 (3), 239-250 (2001).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. Journal of Structural Biology. 144 (1-2), 114-122 (2003).
- vander Heide, P., Xu, X. -. P., Marsh, B. J., Hanein, D., Volkmann, N. Efficient automatic noise reduction of electron tomographic reconstructions based on iterative median filtering. Journal of Structural Biology. 158 (2), 196-204 (2007).
- Volkmann, N. Methods for segmentation and interpretation of electron tomographic reconstructions. Methods in Enzymology. 483, 31-46 (2010).
- Böhm, J., et al. Toward detecting and identifying macromolecules in a cellular context: template matching applied to electron tomograms. Proceedings of the National Academy of Sciences. 97 (26), 14245-14250 (2000).
- Frangakis, A. S., et al. Identification of macromolecular complexes in cryoelectron tomograms of phantom cells. Proceedings of the National Academy of Sciences. 99 (22), 14153-14158 (2002).
- Lebbink, M. N., et al. Template matching as a tool for annotation of tomograms of stained biological structures. Journal of Structural Biology. 158 (3), 327-335 (2007).
- Rigort, A., et al. Automated segmentation of electron tomograms for a quantitative description of actin filament networks. Journal of Structural Biology. 177 (1), 135-144 (2012).
- Volkmann, N. A novel three-dimensional variant of the watershed transform for segmentation of electron density maps. Journal of Structural Biology. 138 (1-2), 123-129 (2002).
- Bajaj, C., Yu, Z., Auer, M. Volumetric feature extraction and visualization of tomographic molecular imaging. Journal of Structural Biology. 144 (1-2), 132-143 (2003).
- Yu, Z., Frangakis, A. S. Classification of electron sub-tomograms with neural networks and its application to template-matching. Journal of Structural Biology. 174 (3), 494-504 (2011).
- Moebel, E., et al. Deep learning improves macromolecule identification in 3D cellular cryo-electron tomograms. Nature Methods. 18 (11), 1386-1394 (2021).
- Tilney, L. G., Derosier, D. J., Mulroy, M. J. The organization of actin filaments in the stereocilia of cochlear hair cells. The Journal of Cell Biology. 86 (1), 244-259 (1980).
- Tilney, L. G., Tilney, M. S., DeRosier, D. J. Actin filaments, stereocilia, and hair cells: how cells count and measure. Annual Review of Cell Biology. 8, 257-274 (1992).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Song, J., et al. A cryo-tomography-based volumetric model of the actin core of mouse vestibular hair cell stereocilia lacking plastin 1. Journal of Structural Biology. 210 (1), 107461 (2020).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Agulleiro, J. I., Fernandez, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27 (4), 582-583 (2011).
- Fernandez, J. J. Computational methods for electron tomography. Micron. 43 (10), 1010-1030 (2012).
- Chen, H., Clyborne, W. K., Sedat, J. W., Agard, D. A. Priism: an integrated system for display and analysis of 3-D microscope images. Biomedical Image Processing and Three-Dimensional Microscopy. 1660, 784-790 (1992).
- Pettersen, E. F., et al. UCSF Chimera-a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25 (13), 1605-1612 (2004).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of Structural Biology. 157 (1), 281-287 (2007).
- Sazzed, S., et al. Tracing actin filament bundles in three-dimensional electron tomography density maps of hair cell stereocilia. Molecules. 23 (4), 882 (2018).
- Sazzed, S., Scheible, P., He, P., Wriggers, J. Spaghetti tracer: A framework for tracing semiregular filamentous densities in 3D tomograms. Biomolecules. 12 (8), 1022 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved