Method Article
מודלים נפחיים פשוטים כאסטרטגיה יעילה לפילוח רשתות אקטין בטומוגרפיות קריו-אלקטרונים
In This Article
Summary
כאן, אנו מציגים פרוטוקול להצבת מודלים נפחיים פשוטים לנפחים תלת מימדיים רועשים, מורכבים וטומוגרפיים. זה מאפשר פילוח מהיר של צפיפות חוטי אקטין, זיהוי כיפוף נימה שיטתי ושל פערים בחוטי צרור השיער, כמו גם כימות נוח של מאפייני המודל הנפחי, כגון מרחקים.
Abstract
שיטות יעילות לחילוץ תכונות מעניינות נותרו אחד האתגרים הגדולים ביותר לפירוש טומוגרפיה של קריו-אלקטרונים. הוצעו גישות אוטומטיות שונות, שרבות מהן עובדות היטב עבור מערכי נתונים בעלי ניגודיות גבוהה שבהם ניתן לזהות בקלות את התכונות המעניינות ומופרדות בבירור זו מזו. מערכי הנתונים הטומוגרפיים של סטריאוציליה קריו-אלקטרונים באוזן הפנימית שלנו מאופיינים במערך צפוף של חוטי אקטין ארוזים במשושה המחוברים לעתים קרובות. תכונות אלו הופכות את הפילוח האוטומטי למאתגר מאוד, ומחמיר עוד יותר על ידי סביבת הרעש הגבוהה של טומוגרמות קריו-אלקטרונים והמורכבות הגבוהה של התכונות הצפופות. תוך שימוש בידע קודם על ארגון צרור האקטין, הנחנו שכבות של מודל אקטין כדור ומקל פשוט ביותר כדי להשיג תחילה התאמה גלובלית למפת הצפיפות, ולאחר מכן התאמות אזוריות ומקומיות של המודל. אנו מראים שבניית מודל נפחי לא רק מאפשרת לנו להתמודד עם המורכבות הגבוהה, אלא גם מספקת מדידות וסטטיסטיקות מדויקות על צרור האקטין. מודלים נפחיים משמשים גם כנקודות עיגון לפילוח מקומי, כמו במקרה של מחברי הצלב אקטין-אקטין. בניית מודלים נפחיים, במיוחד כאשר היא מוגברת עוד יותר על ידי גישות התאמה אוטומטיות מבוססות מחשב, יכולה להוות אלטרנטיבה רבת עוצמה כאשר גישות פילוח אוטומטיות קונבנציונליות אינן מצליחות.
Introduction
טומוגרפיה קריו-אלקטרונית מאפשרת לדמיין אברונים שלמים או חלקים של תאים ורקמות ברזולוציות ננומטריות במצבם הכמעט טבעי 1,2,3 באמצעות הקפאת צלילה4 או הקפאה בלחץ גבוה ויטריפיקציה מהירה במיוחד5. מכיוון שרק מינון אלקטרונים מוגבל יכול להיות נסבל על ידי הדגימה המשומרת, הלא מוכתמת והקפואה, נתוני התלת מימד הטומוגרפיים רועשים מאוד. לעתים קרובות ניתן להפחית רעש זה באופן משמעותי על ידי מגוון אלגוריתמים לסינון רעשים 6,7, כולל דיפוזיה אנזוטרופית לא ליניארית8, סינון דו-צדדי9 וסינון חציוני רקורסיבי10.
יתר על כן, מגבלות ההטיה של שלב המיקרוסקופ, וכתוצאה מכך טריז חסר של מידע, והעובדה שעובי הדגימה גדל בזוויות הטיה גבוהות, מובילות לשחזורים תלת מימדיים ברזולוציה אנאיזוטרופית. המשמעות היא שהצפיפות נמרחת בממד השלישי עקב רזולוציה נמוכה יותר בכיוון Z. כתוצאה מכך, צורת המקרומולקולות נראית מעוותת (כלומר, פחות מוגדרת ומוארכת בממד השלישי).
בין האתגרים הגדולים ביותר בפרשנות של נתונים טומוגרפיים הוא חילוץ אוטומטי של התכונות הרלוונטיות, הידוע גם בשם פילוח11. עם תכונות צורה ייחודיות מספיקות ורעש נמוך, ניתן לזהות מכונות מקרומולקולריות בנפחים תלת מימדיים מורכבים על ידי התאמת תבנית 12,13,14; עם זאת, ההצלחה של התאמת תבניות תלויה ברזולוציית טומוגרפיה, במודל חיפוש מתאים, כמו גם במאפייני הגודל והצורה של נפחי התכונות. אם התכונות המעניינות מרווחות מספיק זו מזו וניתן לזהות בקלות מוטיבים חוזרים (כגון מכונות מקרומולקולריות גדולות), ניתן לשלב תת-נפחי טומוגרפיה כדי להגדיל את יחס האות לרעש וכדי לממוצע עיוותים בצורת חלקיקים בודדים. דווח על פילוח אוטומטי של רשת חוטי אקטין בטומוגרפיה אלקטרונית של הקצה הדק של תאי Dictyostelium discoideum קפואים על ידי התאמת תבניות15.
עם זאת, אם התכונות המעניינות מרוחקות זה מזה, האניזוטרופיה של רזולוציית הנתונים יכולה להוביל למריחה של צפיפות המפה בכיוון Z (לאורך כיוון אלומת האלקטרונים), וכתוצאה מכך מיזוג לכאורה של מעטפת הצפיפות של מכונות מקרומולקולריות או קומפלקסים סופרמולקולריים המרוחקים זה מזה. במקרים כאלה, גישות אוטומטיות לסגמנטציה, כגון קו פרשת מים16, פילוח גבולות17, או מגוון גישות סיווג מבוססות למידת מכונה18,19, עשויות שלא להיות מסוגלות לזהות את תכונות העניין או לקבוע גבול נכון סביב אובייקט עניין. לעתים קרובות, בסופו של דבר מגיעים לכמה יצירות גדולות מאוד או לכרך מפולח מדי, שבו נדרש מאמץ רב כדי למזג חלקים קטנים רבים עד שהתכונה המעניינת נתפסת כשלמה. אוצרות ידנית כזו של תוצאות פילוח יכולה להיות עתירת עבודה ואף עלולה להיכשל לחלוטין כאשר מבנה העניין הוא מערך של חוטים המרוחקים זה מזה המחוברים זה לזה באמצעות קישורים קצרים. ברשת הענקית הזו של מבנים חוטיים, זה יכול להיות קשה להתמצא. הסיבה לכך היא שעקב אניזוטרופיה ברזולוציה, נראה כי צפיפויות מתמזגות זו בזו, ומציבות אתגר אדיר הן עבור גישות אוטומטיות והן עבור גישות פילוח ידניות אינטראקטיביות. כתוצאה מכך, ניתן בקלות "לקפוץ" בין חוטים כאשר בודקים חזותית רק אזורים קטנים.
למרבה המזל, במקרה של צרור האקטין בסטריאוציליה של תאי שיער באוזן הפנימית, יש לנו ידע על הארגון הכללי של צרור האקטין והכיווניות של חוטי האקטין20,21. צרור האקטין מורכב ממאות חוטי אקטין משושים ארוזים בצפיפות בקוטר 6-8 ננומטר, המרוחקים כ-12-13 ננומטר זה מזה22.
זה איפשר לנו לנקוט בגישה שונה למדי לסגמנטציה המבוססת על מודלים פשוטים של כדור ומקל לייצוג חוטי אקטין. האסטרטגיה כללה הצבת מערך רגיל אידיאלי של מודלים נימה לתוך לוחות של מפות צפיפות טומוגרפיה קריו-אלקטרונים כדי לבנות מודל תלת מימדי של צרור האקטין שכבה אחר שכבה. וידאנו שלמודל יש התאמה כללית כללית למפת הצפיפות לפני ביצוע התאמות מקומיות למודלים בודדים של נימה או קבוצות של דגמי נימה כדי להתאים באופן הדוק למפת הצפיפות. על ידי קידוד צבע אוטומטי של ערך צפיפות המפה במיקום מודל הנימה, הצלחנו לזהות בקלות פערים לכאורה בצרור האקטין. מודלים נפחיים מאפשרים ניתוח כמותי של מאפיינים נפחיים, כגון מרחקים בין חוטי אקטין, וגם מובילים לתצוגה פשוטה של ארגון הרשת התלת-ממדית הכולל.
בנוסף, מודלים יכולים לשמש גם כמבני עיגון לפילוח של תכונות נוספות, כגון מקשרי אקטין-אקטין, שכן ניתן לבחור (חלקים) מדגמי נימה בודדים, שסביבם ניתן ליצור אזורי צפיפות מפת רדיוס מתאימים לבדיקה ופילוח נוסף.
אנו מאמינים שגישת הפילוח מבוססת המודל הנפחי שלנו שימושית במיוחד עבור רשתות מבנה חוטים גדולות שעשויות להכיל פערים וחיבורים צולבים בין חוטים. אלגוריתמי סגמנטציה נוטים לפעול באופן מקומי, בעוד שהמוח האנושי לוקח בחשבון אזורים גדולים יותר, ולכן עדיף על מחשבים בכל הנוגע לזיהוי מבני חוטים, אפילו בסביבה מורכבת עם רעש גבוה.
Protocol
הפרוטוקול עוקב אחר ההנחיות של ועדת האתיקה למחקר בבני אדם של אוניברסיטת סאות'איסט.
1. מקור נתונים טומוגרפיה קריו-אלקטרונית לבניית מודלים נפחיים
הערה: השחזורים הטומוגרפיים של סטריאוציליה קריו-אלקטרונים המשמשים לבניית מודל נפחי פורסמו בעבר22,23, והתקבלו כמתואר על ידי Metlagel et al.22.
סקריפטי הפיתון של UCSF Chimera למידול סטריאוציליה מסופקים בקובץ משלים 1, קובץ קידוד משלים 1, קובץ קידוד משלים 2, קובץ קידוד משלים 3, קובץ קידוד משלים 4 וקובץ קידוד משלים 5.
- בקצרה, כתם סטריאוציליה מהמשטח האפיקלי של האפיתל החושי של העכבר על סרט התמיכה בפחמן התחרה של רשת מיקרוסקופ אלקטרונים (EM). לאחר מכן, בצע ויטריפיקציה מהירה במיוחד של הקפאת צלילה ואיסוף נתונים טומוגרפיים קריו-אלקטרונים חד-ציריים במיקרוסקופ אלקטרונים שידור קריוגני (cryo-TEM), המופעל ב-300 קילו וולט עם דה-פוקוס נומינלי של 3.5-4.5 מיקרומטר, באמצעות מצלמה מסוג CMOS במצב אינטגרציה, עם גודל פיקסלים של 0.47 עד 0.59 ננומטר (ראה טבלת חומרים).
- מינון טיפוסי לאיסוף נתונים חד-צירי הוא בדרך כלל 80-100 אלקטרונים/Å2. שחזר את אמצעי האחסון התלת-ממדיים של הטומוגרמה באמצעות חבילת התוכנה IMOD24, על ידי הקרנה לאחור משוקללת או בשיטת SIRT 25,26.
- Denoise את הטומוגרפיה באמצעות סינון חציוני רקורסיבי או דו-צדדי ב-Priism27 או אפשרות הדיפוזיה האנזוטרופית הלא ליניארית ב-IMOD.
הערה: חבילת התוכנה העיקרית ששימשה להדמיה אינטראקטיבית, בניית מודלים נפחיים וניתוח כמותי הייתה תוכנת UCSF Chimera28,29. כל חבילות התוכנה שנעשה בהן שימוש מפורטות בטבלת החומרים.
2. הכנת נתוני טומוגרפיה קריו-אלקטרונית לבניית מודל נפחי
- סיבוב טומוגרמה
הערה: מטרת שלב זה היא למצוא את "הזוויות האופטימליות" שבהן ליבת האקטין מיושרת בשניים מתוך שלושת הצירים (x ו-z), כך שהצבת הדגמים בתלת מימד יכולה להיעשות עם ציר אחד בלבד לדאוג לגביו. השלבים הבאים מתבצעים בתוך חבילת התוכנה של IMOD.- פתח את 3dmod (IMOD) ופתח את קובץ אוסף התמונות התלת-ממדי בתבנית קובץ .mrc. ודאו שהאוסף התלת-ממדי נמצא במצב גווני אפור של 16 סיביות ומציג את הממדים הנכונים של X, Y, Z בכותרת העליונה של קובץ התמונה. במידת הצורך, בצע תיקונים באמצעות הפקודה alterheader : alterheader -d (x_pixelspacing),(y_pixelspacing),(z_pixelspacing) inputfilename.mrc בשורת הפקודה. אם המחסנית התלת-ממדית היא בתבנית קובץ TIFF, השתמש בפקודה tif2mrc inputfilename.tif outputfilename.mrc בשורת הפקודה כדי ליצור קובץ .mrc.
- בדוק חזותית את הטומוגרמה ופתח את "פורס" (על ידי לחיצה על לוכסן הפוך "\") כדי למצוא את זוויות הסיבוב הטובות ביותר בממדי X, Y ו-Z ליישור מישור נימה האקטין עם מישור Z. תפעל את סיבוב X, סיבוב Y, סרגל סיבוב Z כדי לגלות את הזווית האופטימלית שבה חוטי האקטין מיושרים במישורי X ו-Z. שימו לב ששינוי העובי הממוצע לתצוגת הטומוגרמה (עבה: Img) יכול לעזור במציאת כמות אידיאלית של ממוצע הצפיפות במישור Z ובכך להגדיל את הניגודיות. התקרב והקטן את הטומוגרמה על ידי שימוש במקשי + ו- , בהתאמה, במקלדת.
- לאחר זיהוי הזוויות האידיאליות לסיבוב, סובב את הטומוגרמה על ידי הקלדת הפקודה IMOD rotatevol -a (זוויות סיבוב Z), (זוויות סיבוב Y), (זוויות סיבוב X) -s (רוחב x), (גובה y), (עומק z) inputfilename.mrc outputfilename.mrc לתוך שורת הפקודה. הקפד לתת למפה הרבה מקום כדי להכיל את הסיבוב כדי להימנע מחיתוך חלקים מהמפה בעת הסיבוב.
הערה: לקבלת מידע נוסף על אופן השימוש בפקודה rotatevol, השתמש באפשרות מתפריט העזרה או בקר בכתובת ה-URL הבאה (https://bio3d.colorado.edu/imod/doc/man/rotatevol.html). פקודה זו (rotatevol) אינה משנה את המפה המוצגת כעת בחלון IMOD, אלא יוצרת קובץ מפה חדש עם מפת צפיפות מסובבת. - באמצעות חלון הפריסה, זהה את הקואורדינטות X, Y ו-Z של שתי פינות מנוגדות של מפה כדי לזהות את אזור החיתוך המכיל את הסטריאוציליום באמצעות הפקודה trimvol .
- השתמש בפקודה IMOD Trimvol כדי לחתוך את המפה בקואורדינטות שהושגו בעבר, על ידי הקלדת trimvol -x (x-coordiante 1),( x-coordiante 2) -y (y-coordiante 1),( y-coordiante 2) -z (z-coordiante 1),( z-coordiante 2) inputfilename.mrc outputfilename.mrc לתוך שורת הפקודה. כעת, המפה הרבה יותר קטנה, ולכן קל ומהיר יותר לעבוד איתה מנקודה זו ואילך.
הערה: לקבלת מידע נוסף על אופן השימוש בפקודה trimvol, השתמש באפשרות מתפריט העזרה או בקר בכתובת ה-URL הבאה (https://bio3d.colorado.edu/imod/doc/man/trimvol.html). שלבים אלה יוצרים קובץ .mrc שסובב ונחתך.
- סינון טומוגרפיה
הערה: שלב זה משתמש במסנן דיפוזיה אנזוטרופית לא ליניארית (NAD) המסופק על ידי IMOD להפחתת רעש. השתמשנו כערך ראשוני באלה המומלצים בדף העזרה של IMOD לסינון דיפוזיה אנזוטרופית לא ליניארית, כפי שמפורט בכתובת ה-URL הבאה (https://bio3d.colorado.edu/imod/doc/NADexample.html), ושימשנו כערכים ההתחלתיים.- הקלד etomo בשורת הפקודה כדי להפעיל את ממשק המשתמש הגרפי etomo של IMOD.
- בחר באפשרות דיפוזיה אנזוטרופית לא ליניארית מתפריט etomo ובחר את קובץ המפה (בחר אמצעי אחסון).
- על מנת למצוא ערך K ואת מספר האיטרציות המספקות את תוצאות הסינון הטובות ביותר, כפי שנשפט על-ידי בדיקה חזותית, החל את מסנן ה- NAD על נפח בדיקה קטן יותר כדי לחלץ את נפח הבדיקה של מסנן ה- NAD שצוין. לחץ על כלי רצועת הגומי בחלק העליון של ממשק 3dmod, לחץ לחיצה ימנית על גרירה כדי לבחור את נפח הבדיקה, ולחץ על הלחצנים Hi ו-Lo כדי לציין את פרוסת ה-Z כגבול של נפח הבדיקה (קבל טווח נפח בדיקה מ-3dmod). חלץ את אמצעי האחסון של הבדיקה על-ידי לחיצה על חלץ נפח בדיקה.
- סנן את אמצעי האחסון לבדיקה באמצעות ערכי K שונים (חפש ערך K עבור אמצעי אחסון לבדיקה > רשימת ערכי K), כגון 0.1, 1,5, 10, 15, 25, 30, 50 ו- 75. בצע סינון NAD עם כל אחד מערכי K שצוינו (הפעל עם ערכי K שונים > הצג תוצאות בדיקה של ערכי K שונים). השתמש בחלון כלי הפריסה כדי להעריך את הביצועים של מסנן NAD ובחר ערך K שישמש לסינון אמצעי האחסון כולו.
- השתמש בערך K שזוהה בשלב 2.2.4 ובדוק מספרים שונים של חזרות, כגון 2, 5, 8, 11, 15 ו- 21 (חפש מספר איטרציה עבור אמצעי אחסון לבדיקה > רשימת איטרציות). הערך את ביצועי מסנן NAD עבור איטרציות שונות על-ידי לחיצה על הצג תוצאות בדיקת איטרציה שונות או שימוש בכלי פריסה. בחר ערך עבור מספר שונה של חזרות.
- השתמש בערך K שזוהה ובמספר האיטרציות (סנן ערך נפח מלא > K ואיטרציות) וסנן את כל אמצעי האחסון (מסנן נפח מלא). אמצעי אחסון חדש שסונן יופיע באותה ספריה שבה נמצא אמצעי האחסון המלא שנטען עם סיומת קובץ .nad המצורפת לקובץ ה- .mrc.
הערה: שלבים אלה יוצרים קובץ .mrc שסונן באמצעות מסנן NAD ומציג רעש נמוך יותר ובכך יחס אות לרעש משופר.
3. בניית מודל נפחי
- הכנת מיקום מודל תלת מימד
הערה: מטרת שלב זה היא להכין ולנתח את המפה להצבת מודלים נפחיים תלת מימדיים במפת הצפיפות המסובבת והמנוטרלת באמצעות תוכנית UCSF Chimera.- באמצעות חלון הפורס, קבל חתך view (לוח של 30 פרוסות/28.4 ננומטר) כדי לזהות את קואורדינטות ה-Z של מרכז לוח הצפיפות, שלתוכו יש למקם את מודל נימה האקטין. לחץ על מרכז צפיפות החוטים ושים לב לקואורדינטות Z בחלון הראשי של IMOD.
- שימו לב לקואורדינטות שזוהו להצבת מודל עתידי ב-UCSF Chimera.
הערה: קואורדינטות ה-Z שצוינו משלב זה משמשות במהלך שלב 4 כדי למצוא ולמקם בקלות דגמי חוטי אקטין מוכנים מראש בגבהי ה-Z הנכונים, מה שהופך את מיקום הדגם למהיר יותר.
- מיקום מודל תלת מימד
הערה: מטרת שלב זה היא למקם מודל נפחי תלת מימדי במפת הצפיפות המוכנה באמצעות UCSF Chimera.- ב-UCSF Chimera, פתח את המפה המסוננת והמסובבת (קובץ > פתוח)
- בדוק אם הפרמטרים של המפה מוגדרים כהלכה על ידי בחירה בתכונות > מישורים ותכונות > קואורדינטות במציג אמצעי האחסון כדי לפתוח את ממשק התכונה והקואורדינטות. בדוק את גודל Voxel כדי לראות אם המרווח הנכון בין הווקסל מוגדר באמצעות פקודת הכותרת בשורת הפקודה (ב- IMOD). אם לא, תקן את ממשק Voxel Size למרווח הווקסל הנכון. מרכז את המפה כדי להגדיר את המצלמה במרכז viewחלון (אינדקס מקור > מרכז).
- פתח את חלון בקרת המצלמה (כלים > בקרת צפייה > מצלמה). לאחר מכן, הגדר את תצוגת המצלמה לתצוגה אורתוגרפית (הקרנה > אורתוגרפית)
- טען את מודל סקריפט הפיתון המוכן מראש (File > Open > ActinFilamentPlane.py) ופתח כמה שיותר סקריפטים של מישור נימה אקטין כמו שיש מישורי נימה אקטין במפה.
- העבר את הדגמים שנטענו על ידי הפעלת מצב עכבר תנועה (כלים > תנועה > מצב עכבר תנועה). הפעל את אפשרות עכבר התנועה (הגדר מצב עכבר תנועה > בחירת תנועה). השתמש ב-Ctrl + גרירה כדי לבחור מספר דגמים הקיימים בהפעלה ולחץ באמצעות לחצן העכבר הימני (או כל מקש אחר שצוין בהעדפה > עכבר) כדי להזיז את המודלים בכיוון הרצוי.
הערה: הדגמים נוצרו עם כדורים ומקלות בעובי מסוים (רדיוס של כתב ActinFilamentPlane.py) ועם מרווחים מסוימים (Lattice_Spacing של כתב ActinFilamentPlane.py). - כדי להמחיש רק את הדגם שמעניין אתכם, פתחו את החלונית Model (Tools > General Controls > Model Panel). לחץ על תיבות סימון תחת S (הצג) כדי להפעיל או להשבית את הנראות של דגם נתון.
- הפעל את לוח שורת הפקודה (כלים > פקדים כלליים > שורת הפקודה).
- לאחר הצבת כל דגם מישור נימה אקטין לגובה ה-Z המתאים לו, מחק את כל חוטי האקטין העודפים בכל דגם מישור נימה אקטין על ידי בחירת החלק העודף של הדגמים, ועל ידי הקלדת del sel (מחק נבחר) בשורת הפקודה בתחתית חלון התצוגה הראשי של UCSF Chimera.
- הצג באופן חזותי רק מישור חוט אקטין אחד בכל פעם, על-ידי מעבר לחלון לוח הדגם ובחירה והסתרה של כל דגמי חוטי האקטין האחרים (Ctrl + לחיצה > הסתר).
- כדי להמחיש חלקים מצפיפות המפה שנמצאים בסמיכות מיידית למודל מישור נימה יחיד המבוקש, בחר את הדגם (לוח הדגם > בחר) ופתח את לוח הבקרה של האזור במציג אמצעי האחסון (Volume Viewer > Features > Zone). מגדירים את רדיוס האזור ל-100 Å ולאחר מכן לוחצים על אזור כדי לאזור את המפה ברדיוס של 100 Å (= 10 ננומטר) מהדגם שנבחר. שימו לב שהממד בכימרה מוגדר באנגסטרום (1 Å = 0.1 ננומטר).
- במידת הצורך, התאם את הדגם כך שיתאים למפת הצפיפות על ידי הפעלת מצב עכבר תנועה. בחר במספר רב דגמים שאינם במיקום הנכון כדי להזיז את הדגמים כך שימוקמו כראוי בתוך מפת הצפיפות האזורית.
- כדי להתגבר על באג תכנות ב-ActinFilamentPlane.py, הריצו את סקריפט FixingMarkerID.py , שמתקן את ה-MarkerID החסר של ה"אטומים" (כדורים במודל הכדור והמקל). בחר את המודל כולו והקלד runscript FixingMarkerID.py בשורת הפקודה (יש לציין את קובץ ה- Script לפי הספריה הנכונה, כגון C: \ directory \ Script.py).
- אם מפת הצפיפות מצביעה על כך שחוט האקטין מעוקל, הקפד לחלק את חוט האקטין הישר למספר חלקים כדי להתאים לעקמומיות על ידי בחירת הדגמים הרצויים והקלדת מספר dividelinks.py runscript. סמנים נוספים (המצוינים על ידי המספר בפקודה) ממוקמים בתוך דגם האקטין במרחק שווה זה מזה, ויוצרים "מפרקים" שבהם ניתן לכופף את הדגם.
- כוונן את המפרקים כך שישקפו את העקמומיות על-ידי הזזת "מפרקים" נוספים של סמן לאורך המפה המיועדת באמצעות מצב עכבר תנועה. הוסף סמנים נוספים למודל לפי הצורך באמצעות קובץ ה- Script dividelinks.py .
- כדי לוודא שכל חוטי האקטין ממוקמים כראוי בתוך צפיפות האקטין, השתמש בסרגלי חיתוך על-ידי לחיצה על כלים > בקרת צפייה > מצלמה בתפריט הנפתח UCSF Chimera כדי לפתוח את חלון בקרת המצלמה , ולאחר מכן בחר Side View כדי לראות את שני פסי החיתוך (מישורי חיתוך קרובים ורחוקים) של המצלמה. גרור שני פסים צהובים לתוך חריץ צר על ידי לחיצה שמאלית וגרור את חלק החיתוך באמצעות לחצן העכבר האמצעי כדי לבדוק את הדגמים פיסה קטנה אחת בכל פעם.
הערה: מודל הליבה של הסטריאוציליום אקטין הושלם כעת.
- פילוח ממברנה
הערה: מטרת שלב זה היא ליצור מודל פני השטח של קרום הסטריאוציליה.- פילוח המשטחים משתמש בכלי Volume Tracer (כלים > נתוני נפח > Volume Tracer).
- בחלון עוקב אמצעי אחסון, לחץ על עכבר וסמן רק את האפשרויות מקם סמנים במישורי נתונים וקשר סמן חדש לסמן שנבחר. זה מאפשר למקם במדויק את הסמנים באותו מישור Z (כאשר מוצג מישור Z יחיד). כמו כן, סמן את מקם סמנים באמצעות לחצן העכבר האמצעי בחלון עוקב עוצמת הקול.
- צור ערכת סמנים חדשה (קובץ > ערכת סמן חדש). יש ליצור ולבחור את ערכת הסמן 1 בחלון עוקב עוצמת הקול .
- השתמש במציג עוצמת הקול כדי להציג מישורי Z בודדים בחלון הצפייה הראשי (ציר ל-Z > אחד.)
- באמצעות כפתור העכבר האמצעי, עקבו אחר הממברנה מקצה אחד של הממברנה הנראית לקצה השני. כל הסמנים צריכים להיות מחוברים על ידי קישורים מקצה אחד למשנהו.
- בטל את הבחירה בסמן האחרון על ידי לחיצה על Ctrl + לחץ על הרקע שבו לא נמצא פריט אחד שניתן לבחירה. זה מבטיח שהסמן הבא שיוצב מחובר לקישורים במישור החדש, ולא לעקבות ממברנה קודמים של מישור Z אחר.
- חזור על מעקב הממברנה עבור כל 10 ננומטר באותו כיוון של מעקב מקצה אחד של הממברנה הנראית לצד השני.
- לאחר חלוקת רצועות מקבילות רבות של ממברנות, עבור לחלון עוקב עוצמת הקול ולחץ על תכונות > משטחים. זה מאפשר את ממשק פני השטח בחלון עוקב עוצמת הקול . לחץ על Create ליד ממשק Surfaces כדי ליצור משטחים בין רצועות של פילוח ממברנה. זה יוצר דש דק של מודל פני השטח שממלא את עקבות הממברנה המרווחות.
הערה: יצירת מודל משטח הממברנה הסטריאוציליום הושלמה כעת.
- מידול Crosslinker
הערה: מטרת שלב זה היא לדגמן את הקשרים הצולבים בין חוטי אקטין.- ניתן למקם קישורים צולבים גם על ידי שימוש בכלי Volume Tracer .
- בחלון עוקב עוצמת הקול , לחץ לחיצה ימנית כדי לסמן רק את מקם סמנים על משטחים וקשר סמן חדש לסמן שנבחר. לאחר מכן, סמן את מקם סמנים באמצעות לחצן העכבר האמצעי בחלון עוקב עוצמת הקול .
- דמיין רק צפיפויות סביב מודל מישור נימה יחיד של אקטין מעניין באמצעות פונקציית האזור. הגדר את רדיוס האזור ל-100 Å כדי להציג את המפה ברדיוס של 100 Å מהדגם שנבחר.
- מקם סמנים בצפיפויות גלויות של קישורים מוצלבים בלחיצה על לחצן העכבר האמצעי. לאחר הצבת שני סמנים (וכך מעוצב מדגם של קישור צולב יחיד) הקפד לבטל את הבחירה בסמן השני כדי למנוע חיבור רציף של קישורים לדגם הצלב הבא.
- חזור על השלבים לעיל עבור כל מישור נימה של אקטין וחזור על כל התהליך לעיל לכל שלושת הכיוונים העיקריים שבהם עשויים להיות ממוקמים קישורים צולבים. בעת יעוד מישורי נימה אקטין בכיוון האלכסוני, בחר ידנית דגמי נימה אקטין בנפרד.
הערה: עבור כל אחד מדגמי ה-crosslinker של אקטין, אנו יכולים לרשום את המיקום על חוטי האקטין שאליהם מתחברים ה-crosslinkers המשוערים. באופן עקרוני, ניתן לחלץ מידע זה לניתוח מעקב באמצעות מיצוע תת-טומוגרפיה, שהוא מעבר להיקף מחקר זה.
4. ניתוח כמותי של מודל התלת מימד
- ניתוח פערים
הערה: מטרת שלב זה היא לזהות פערים בחוטי האקטין.- ניתן לנתח פריטים נבחרים. ציינו את הפרמטרים שלהם, כגון הצבע שלהם, בעזרת הכלי Inspect Selection (Action > Inspect).
- ניתן לציין את צבע הפריט שנבחר על-ידי בחירת כל פריט הניתן לבחירה ב-UCSF Chimera, ועל-ידי שינוי הצבע לצד המקטע Color בחלון Inspect Selection .
- ציין את גודל הסמנים והקישורים על-ידי בחירת סמנים וקישורים ב- UCSF Chimera, ועל-ידי שינוי הערכים שליד אזור הרדיוס בחלון Inspect Selection , שבו היחידות נמצאות ב- Angstrøm.
- בצע ניתוח פערים על ידי זיהוי אוטומטי של פערי צפיפות, תוך שימוש בפונקציית הערכים במיקומי אטום (כלים > נתוני נפח > ערכי במיקומי אטום).
- בחר את המפה שבה ייקראו הערכים על-ידי בחירת המפה הרצויה לצד המקטע נתוני נפח בחלון ערכים במיקומי אטום . בחר את המודל שבו לכל הסמנים יוקצה פרמטר על ידי בחירת המודל הרצוי ליד קטע המולקולה .
- באמצעות לחצן היסטוגרמה בתחתית החלון Values at Atom Positions , נוצרת היסטוגרמה בחלון חדש הנקרא Render/Select by Attribute. Ctrl + לחיצה על ההיסטוגרמה תוסיף או תסיר נקודות חיתוך, עבורן ניתן לבחור צבעים שונים. בטל את הסימון של Keep Opaque כדי להחיל צבע שקוף על הסצנה. סמנים עם צפיפות מתחת לסף נתון, המייצגים פערים, ניתנים לא רק לצביעה אלא גם לבחירה, ובכך מאפשרים לנו לספור את סמני המספרים באזור הפער. כדי לבחור, לחץ על בחר > תכונה > value_mapname.
- קביעת מרחקי אינטראקטין
- למדידת מרחקים בין פעולות, מקם סמנים על מישור XZ יחיד (המכונה ב-UCSF Chimera מישור Y) באמצעות החלון Volume Tracer , לחיצה על Mouse ובדיקת האפשרות Place Markers on Data Planes בלבד וביטול הסימון של Link new marker to the former former to selected marker. זה מאפשר למקם במדויק את הסמנים באותו מישור Y (כאשר מוצג מישור Z יחיד). כמו כן, סמן את מקם סמנים באמצעות לחצן העכבר האמצעי בחלון עוקב עוצמת הקול ומקם את הסמנים על מישור Y יעד מעניין למדידת מרחק בין אקטין.
- לאחר שמיקומי האקטין של מישור Y יחיד מסומנים בהצלחה, בחר את כל הסמנים והקלד את הפקודה findclash #model-spec test self overlap Cutoff -200 hbondAllowance 0 log true Linewidth 10 pbצבע שחור בשורת הפקודה בתחתית מישור נימה האקטין. זה מוצא את כל ההתנגשויות בין הסמנים במרחק של 200 Å (overlapCutoff -200), ויוצר קווים שחורים (pbColor black) בעובי של 10 Å (רוחב קו 10) בין הסמנים.
- מכיוון שישנם סמנים חופפים בטווח הנתון של 200 Å, הסר מדידות מיותרות שאינן מקשרות רק בין הסמנים הקרובים והסמוכים ביותר. עשה זאת על ידי שימוש בסקריפט RemoveCross.py המסופק באתר UCSF Chimera, שמסיר את כל הקישורים החופפים שאינם הקישור הקצר ביותר עם הסמנים הסמוכים לו.
- כדי למדוד את המרחק של הקשרים שנותרו, בחר את כל הפסאודובונדים (קישורים שנוצרו על ידי findclash) והשתמש בסקריפט python pblengths.py על ידי הקלדת runscript pblengths.py. ראה את הערכים הנמדדים מיומן התשובות (כלים > כלי עזר > יומן התשובות). לאחר מכן, העתק את הערכים שהתקבלו מיומן התשובות והעבר לגיליון אלקטרוני או לכל כלי מתאים אחר ליצירת היסטוגרמה.
תוצאות
באמצעות טומוגרפיה קריו-אלקטרונית של סטריאוציליה אינדיבידואלית לא מוכתמת וקפואה המוטמעת בקרח זגוגית, השגנו מפות צפיפות של צרור האקטין עם חוטי האקטין המסודרים במשושה שלו, המקושרים על ידי חלבונים צולבים23. הממד של ווקסל בודד היה 0.947 ננומטר. בדיקה ויזואלית בתוכנית הפורס IMOD של עיבוד נפח של הטומוגרמה כולה (400 פרוסות/379 ננומטר) הצביעה על נוכחות של מבנים חוטיים המיושרים עם ציר האורך של הסטריאוציליה, כפי שניתן לראות בתצוגות אורך (מישור XY; איור 1A-C, לוחות עליונים) כמו גם בתצוגות חתך (מישור XZ; איור 1A-C, לוחות תחתונים). שמנו לב שתצוגת ההקרנה דרך רשת הנימה של 400 פרוסות/379 ננומטר הפכה ברורה ביותר כאשר סובבו את הנפח המשוחזר המקורי ב-6° סביב ציר ה-X, -13.5° סביב ציר ה-Y ו-5° סביב ציר ה-Z. בזווית זו, כל החוטים מיושרים זה על גבי זה, ומכאן שהניגודיות היא מקסימלית, כפי שניתן להעריך מתצוגות החתך (איור 1B). מכיוון שלפרוסות חתך בודדות אין מספיק אות כדי להבחין באופן חד משמעי בין חוטי אקטין, בחרנו לעבד בנפח לוח של 30 פרוסות/28.4 ננומטר, המראה בבירור דפוס משושה בתצוגת החתך. הקווים הכחולים באיור 1C (לוחות עליונים) מציינים את המיקום של האמצע של לוחות החתך המתאימים של 30 פרוסות/28.4 ננומטר בפאנלים התחתונים.
סטיות קטנות מזווית הצפייה האופטימלית הזו, עד ±2°, הפחיתו משמעותית את הסדר הנתפס של רשת חוטי האקטין (איור 1A,C), מה שמהווה אינדיקציה באיזו קלות ללכת לאיבוד בנפח התלת-ממדי של הטומוגרמה.
כדי להמחיש את האתגר בשימוש בגישות פילוח אוטומטיות, כגון פילוח פרשת מים, בחרנו בתת-נפח קטן (המתואר כזהב) לפילוח פרשת המים, כפי שיושם בחבילת התוכנה UCSF Chimera (כלים > נתוני נפח > Segger > Segment). מיקום נפח המשנה ביחס לכל מפת הסטריאוציליה מסומן על ידי הכניסה הקטנה באיור 1B.
איור 1D-F מציג את נפח המשנה שנבחר בכיוונים שונים, כאשר איור 1D,E מציג כיוון צפייה אורכי ואיור 1F מציג כיוון צפייה בחתך. החצים בצד שמאל של איור 1D-F מציינים את הכיוון של חוטי האקטין.
איור 1D-F (לוחות ימניים) מציג את התוצאות של פילוח פרשת המים. נפח המשנה מקודד בצבע לפי זהות האובייקט, כאשר הצבעים מוקצים באופן אקראי לאובייקטים השונים. צבעים שונים מצביעים על זהות אובייקט שונה, ולכן מתברר מאיור 1D-F שצפיפות המפה של חוטים הייתה מקוטעת לאורך ציר החוטים, בעוד שאותו צבע וכך זהות אובייקט ניתנו לצפיפות המפה שחיברה חוטים שכנים. במילים אחרות, אלגוריתם פילוח פרשת המים לא היה מסוגל לעקוב אחר מפת הצפיפות של חוטי אקטין במשך תקופה ממושכת, ובמקום זאת הוביל לחיבור צפיפויות מחוטים שכנים. אמנם ניתן לאצור את הבחירה באופן ידני (למשל, על ידי מחיקה או מיזוג של אובייקטים), אך גישה זו דורשת עבודה רבה ולכן גוזלת זמן.
למרות שזה לא הכרחי לחלוטין שאסטרטגיית בניית המודל הנפחי שלנו תעבוד, זה עזר לכוון מחדש (לסובב) את המפה התלת מימדית כך שציר רשת חוטי האקטין מיושר עם ציר ה-Y ומישורי מודל נימה האקטין מיושרים עם מישור ה-X-Y של הטומוגרמה. אנו מתייחסים לכיוון זה ככיוון הסטנדרטי לתצוגה טומוגרפית סטריאוציליה.
לכן החלטנו לבחון אסטרטגיה אחרת לפילוח תמונה, תוך ניצול העובדה שחוטי האקטין הציגו ארגון קבוע כולל (אריזה משושה), עם ריווח קבוע וכיוון חבילה כללי מוגדר. האסטרטגיה שלנו הייתה למצוא התאמה כוללת של מודלים של צרור אקטין, כמערך של חוטים, ולאחר מכן התאמות אזוריות ולאחר מכן מקומיות של מיקום המודל כך שיתאים למפת הצפיפות הניסיונית. על ידי הצבת מודל כולל תחילה, אנו יכולים להתגבר על אי בהירות במפה המקומית, ולזהות מגמות אזוריות של סטיות של המודל מהארגון המקורי שלו, כגון כיפוף חוטים.
כדי למקם את המודל, הצגנו לוחות בצפיפות (10 פרוסות/9.47 ננומטר) בכיוון הסטנדרטי המתאים לעובי של שכבה אחת של חוטי האקטין, אליהם הותאמה שכבה של דגמי חוטי אקטין ישרים במרווחים קבועים. זהו כמובן פישוט יתר של חוטי אקטין, שכל אחד מהם מורכב ממערך ליניארי של מונומרים אקטין עם סימטריה סלילית. איור 2A-C מציג שלוש שכבות מייצגות בגבהי Z שונים, כאשר המוטות בצבע אדום מייצגים את חוטי האקטין. הפאנלים העליונים, המתארים ~30 פרוסות/חתכים בעובי 28.4 ננומטר, מראים באיזה גובה Z הוצבה שכבת מודל אקטין בודדת של 19 מוטות, ואילו הלוחות התחתונים מראים כיוון אורך (אם כי מוצג בתצוגת פרספקטיבה). איור 2D מציג את המודל הפשוט השלם, הן בתצוגת החתך (הפאנל העליון) והן בפרספקטיבה האורכית (הפאנל התחתון). כיוון החתך אפשר לנו למקם את החוטים בביטחון רב. כאן, המהלך המקורי שלנו לכוון מחדש את כל הנפח כך שיתאים לצירים העיקריים של הטומוגרמות הוכיח את עצמו כמועיל, מכיוון שמשמעות הדבר הייתה שהכיוון של המודל שלנו בכיוון הצפייה הסטנדרטי שלנו היה מקביל גם לצירים הראשיים. עם זאת, באופן קפדני, הגישה שלנו הייתה עובדת גם ללא הכיוון מחדש של הטומוגרמה, רק מיקום המודל לצפיפות היה מאתגר יותר.
לאחר בדיקה מדוקדקת של לוחות בודדים של מפת הצפיפות, שמנו לב שמודל אקטין ישר לחלוטין לא התאים למפת הצפיפות שנצפתה שנעה מהקצה הפרוקסימלי לקצה הדיסטלי (כלומר, לכיוון הקצה) של הסטריאוציליה (איור 3A-C). בסמוך לקצה הסטריאוציליה, צפיפות המפה עבור חוטים נעקרה ביותר מ-13 ננומטר (מרווח אקטין-אקטין), שיכולנו לפצות על כך על ידי התאמת המודל תוך כדי מעבר מהחלק הפרוקסימלי לחלק הדיסטלי של מפת צפיפות הסטריאוציליה, ובכך הכנסנו עקמומיות הדרגתית קטנה אך ניתנת להבחנה למודל האקטין שלנו. איור תלת מימד מציג לוח יחיד של צפיפות המפה של חוט האקטין, עם מודל נפחי המותאם למפת הצפיפות. השוואה בין המודל הישר (אדום) למודל המעוקל (צהוב) מוצגת באיור 3E. עקמומיות זו מוערכת בצורה הטובה ביותר על ידי הטיית לוח של מפת הצפיפות עם המודל הממוקם ב-80 מעלות סביב ציר ה-X, מה שמאפשר לאדם לקבל מבט פרספקטיבה לאורך כיוון חוטי האקטין (איור 3D,E).
הסטייה של שני הדגמים, כאשר מיקום מודל האקטין ליד הקצה הוסט בערך באותו מרחק כמו המרווח של חוטי האקטין, יכלה לגרום לבלבול רב אם לא היינו ממשיכים בדרך שעשינו. מיקום "גלובלי" זה של שכבה של מודל נימה אקטין, ואחריו התאמה "אזורית", אפשרו לנו לזהות עקמומיות זו, שבקושי מורגשת במבט האורך או החתך. עם זאת, שכבת-על של שני הדגמים, כפי שמוצג באיור 3E, חושפת את ההבדל העדין.
חזרה על גישה זו עבור שכבות מרובות מאפשרת לקבל מודל תלת-ממדי שלם (איור 3F), מוגבל רק על ידי אי-ודאות הנתונים בחלק העליון והתחתון של הסטריאוציליה, כאשר מסתכלים עליו בכיוון החתך (איור 3G). חוסר צפיפות זה נגרם על ידי הטריז החסר באיסוף נתונים טומוגרפיים (חד-צירי) ואניזוטרופיה של רזולוציית נתונים מתאימה, והשפעתו מסומנת על ידי היעדר צפיפות מפה מוגדרת היטב עבור ממברנות סטריאוציליה.
ברגע שהיה לנו מודל תלת מימדי, קידדנו בצבע כל מיקום של המודל הנפחי בהתאם לערך צפיפות המפה במיקום זה. אזורים במודל עם צפיפות מפה חלשה בסיסית נצבעו באדום, בעוד שאזורים במודל עם אות צפיפות מפה חזק נצבעו בצהוב (איור 4A). אנו מפרשים אזורים בצבע אדום כאלה, שיכולים להשתרע על פני עשרות ננומטרים, כפערים במבני חוטי האקטין שבשל היקפם לא ניתן לייחס לשינויי צפיפות שנתקלים בהם לעתים קרובות בסביבת הרעש הגבוה של מפת cryo-EM. רעש נוטה להשפיע על ווקסלים בודדים או קבוצות קטנות של ווקסלים, אך לא סביר שהוא יהיה המקור לנפחים המורכבים ממאות ווקסלים, שעבורם חסרה צפיפות נימה. במקום זאת, פערים כאלה עשויים להיות מאפיין אמיתי של רשת הסטריאוציליה אקטין ועשויים להוות אתרים של תחלופת אקטין. לאיור 4A יש שני ערכי צפיפות מפה שונים, שמוצגים בכחול בהיר ובכחול כהה. יש לציין במפורש כי גישת בניית המודל הנפחי שלנו, בשילוב עם קידוד צבע אוטומטי של המודל שלנו באזורים בעלי צפיפות חלשה, היא דרך מהירה ונוחה לזהות ולהמחיש את התפלגות הפערים הללו במודל נימה אקטין, שאחרת היה קשה מאוד.
כפי שמוצג באיור 4B, חלקים מהמודל הנפחי במקומות עם צפיפות חלשה יחסית יכולים להיות מוסתרים בקלות על סמך התוצאות שהתקבלו באיור 4A. התוצאה היא מודל מקוטע יותר שעשוי לתאר בצורה מציאותית יותר את מודל האקטין בסטריאוציליה. האלטרנטיבה של בניית רצועות קטנות של חוטי אקטין הייתה דורשת עבודה עתירת עבודה וייתכן שנכשלה לחלוטין, בשל הבעיות שנדונו בעת תיאור איור 1.
בנוסף, המודל הנפחי מאפשר לנו לעצב בקלות את המחברים הצולבים פשוט על ידי הצבת חיבור (מוצג באדום) בין מיקומי נקודת המודל של מודל חוט האקטין משני צידי החיבור הצולב (איור 4C). בגישה הפשוטה שלנו, איננו צריכים להניח שום הנחה לגבי הזהות המדויקת של כל חלבון צולב, מה שידרוש רזולוציה גבוהה יותר ו/או גישות תיוג מתוחכמות. במקום זאת, כל מה שאנחנו צריכים לקבוע הוא אם קיימת צפיפות המגשרת על חוטי אקטין סמוכים; אם יש, נוכל למקם חיבור קצר מחוט אחד למקבילו הסמוך. באיור 4D מוצג דגם של חמישה חוטי אקטין עם המחברים הצולבים שלהם, מה שנותן רושם של התפלגות המחברים הצולבים לאורך ציר נימה האקטין.
יתרון נוסף בבניית מודל נפחי של צרור האקטין הוא שניתן לקבוע במהירות את המרווח בין חוטי אקטין סמוכים (איור 4E-H). איור 4E,F מציג תצוגת חתך של מפת הצפיפות ללא ועם מודל המותאם לסריג המשושה של צפיפות המפה, בהתאמה. איור 4G מציג את המודל עם חיבורים בין הכדורים השכנים הקרובים ביותר. UCSF Chimera מאפשר חישוב אוטומטי של המרחק של מרכזי השכנים הקרובים ביותר, שאת תוצאתו ניתן לשרטט כהתפלגות מרחק (איור 4H). בניית מודל עבור שני מערכי נתונים נוספים מוצגת באיור משלים 1 ובאיור משלים 2.
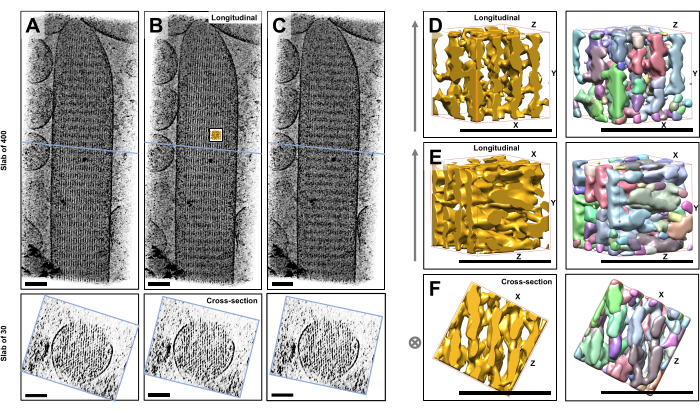
איור 1: האתגרים בהם נתקל פילוח פרשת המים של טומוגרפיות סטריאוציליה של תאי שיער. (A-C) הקרנות אורכיות (400 פרוסות/379 ננומטר) דרך המפה התלת-ממדית הטומוגרפית במישור XY (הפאנלים העליונים) ותצוגות חתך (30 פרוסות/28.4 ננומטר) במישור XZ (פאנלים תחתונים). (A) מפה טומוגרפית מסובבת -2° לאורך ציר ה-Y מהכיוון האופטימלי שלה. (B) מפה טומוגרפית בכיוון האופטימלי, שנקבעת על ידי התאמת זוויות הסיבוב של צירי X, Y ו-Z (X = -6°, Y = -13.5°, ו-Z= 5°) וגילוי דרגה גבוהה של סדר במפת הצפיפות, מה שמרמז על רשת חוטי אקטין מסודרת מאוד. (C) מפה טומוגרפית מסובבת +2° לאורך ציר ה-Y מהכיוון האופטימלי שלה; סיבוב של עד 2 מעלות סביב ציר ה-Y הרחק מכיוון הצפייה האופטימלי פוגע קשות בסדירות הנתפסת של מפת הצפיפות. הפאנלים התחתונים חושפים את הסדירות של מערך חוטי האקטין כאשר מסתכלים עליהם בכיוון החתך. הקו הכחול ב-A-C מציין את מיקום לוח החתך. (ד-ו) קובייה של 50 ננומטר x 50 ננומטר x 50 ננומטר הנצפית משלושה כיוונים שונים לפני (לוחות שמאליים) ואחרי (לוחות ימניים) פילוח פרשת המים. שימו לב שפילוח פרשת המים אינו מצליח לזהות צפיפות חוטי אקטין רציפה, בעוד שחוטי אקטין סמוכים והחיבור הצולב שלהם חולקים את אותה זהות אובייקט, מה שמצביע על כך שפילוח פרשת מים אינו גישה מתאימה לפילוח טומוגרפיה. בפאנלים D-F, מפת הצפיפות בכימרה מוצגת בסגנון מפה "משטח". (א-ג) פסי קנה מידה = 100 ננומטר. (ד-ו) פסי קנה מידה = 50 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
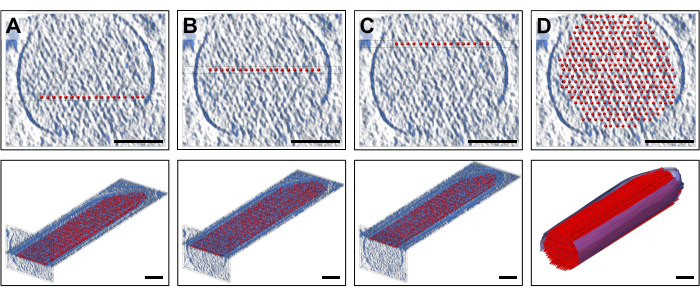
איור 2: בניית מודל נימה אקטין כדורי ומקל נפחי. (A-C) למעלה: תצוגות חתך של 30 פרוסות/28.4 ננומטר של מפת הצפיפות עם מודל נימה אקטין מפושט בשכבה אחת הממוקם בגובה Z שונה. למטה: לוח יחיד של 10 פרוסות/9.47 ננומטר של מפת הצפיפות עם מודל נימה אקטין פשוט בשכבה אחת. (ד) מודל נימה אקטין ישר שלם בתצוגת חתך של 30 פרוסות/28.4 ננומטר (למעלה) ותצוגת פרספקטיבה (למטה); פסי קנה מידה = 100 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
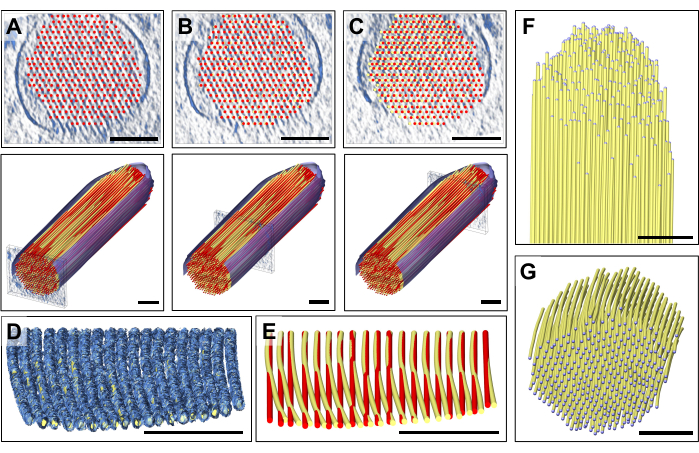
איור 3: התאמת המודל לתיקון הכיפוף שזוהה של צפיפות חוטי אקטין. (A-C) בדיקה ויזואלית קפדנית של המודל, בין אם בתצוגת חתך (פאנלים עליונים) או במבט אורך (פאנלים תחתונים), חשפה התאמה טובה של המודל עם מפת הצפיפות בקצה הפרוקסימלי של הסטריאוציליה. עם זאת, ככל שמתקדמים לעבר הקצה הדיסטלי של הסטריאוציליה, ההתאמה הופכת גרועה יותר ויותר עבור כל דגמי חוטי האקטין. ניתן לתקן זאת על ידי הזזת הכדורים של מודל הכדור והמקל למיקום מפת הצפיפות הנכון, מה שמביא למודל נימה אקטין מעוקל מעט. הדגם הישר מוצג באדום, והדגם הכפוף המתוקן מוצג בצהוב. (D) לוח בודד של מפת הצפיפות עם המודל המעוקל המותאם אליו, החושף את העקמומיות של צפיפות האקטין לכיוון קצה הסטריאוציליה. מודל האקטין סובב 80 מעלות סביב ציר ה-X כדי להראות טוב יותר את הכיפוף העדין אך המשמעותי הזה של חוטי האקטין. (E) השוואה בין מודל האקטין הישר והלא מתוקן שמוצג באדום לבין מודל האקטין המעוקל והמתוקן שמוצג בצהוב. מטעמי בהירות, מוצגת רק שכבה אחת של מודל נימה אקטין. (פ-ז) דגם צרור אקטין עם חוטי אקטין מעוקלים ומתוקנים המוצגים בכיוון אורך (F) וחתך (G). הממברנה המפולחת מוצגת בכחול. בחלונית D, מפת הצפיפות ב-Chimera מוצגת בסגנון מפה "Mesh". פסי קנה מידה = 100 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
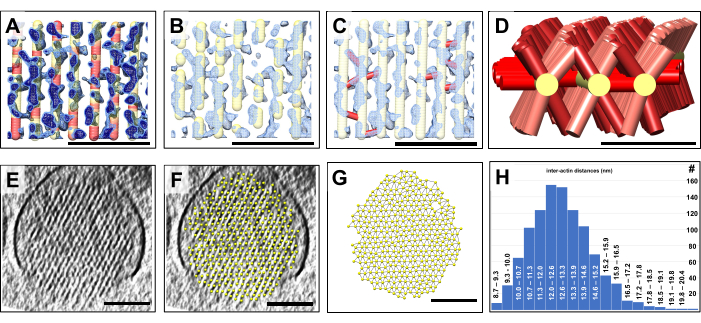
איור 4: גילוי פערים בחבילת האקטין באמצעות בניית מודל נפחי. כימות תכונות נפחיות באמצעות מודלים של כדור ומקל. (א-ג) אזור קטן של לוח אורך בעובי ~10 פרוסה/9.47 ננומטר של מפת צפיפות הסטריאוציליה מוצג בכחול, יחד עם מודל חוט האקטין המעוקל והמתוקן. (A) מפת הצפיפות מוצגת בסף צפיפות נמוך יותר (כחול בהיר) ובסף צפיפות גבוה יותר (כחול כהה). ישנם אזורים במודל נימה אקטין שעבורם אין צפיפות מתאימה. במקומות כאלה, המודל מקודד בצבע אדום כדי לייצג חוסר צפיפות. אנו מפרשים את המיקומים הללו כפערים בחוטי האקטין. (ב) דגם של חוטי האקטין הנראים מקוטעים, המשקפים את היעדר צפיפות חוטי האקטין במקומות כאלה. (C) דגם של חוטי האקטין עם חוליות צולבות (מוצג באדום) שנוספו במקומות שבהם נמצאה צפיפות חזקה כדי לגשר על חוטי אקטין סמוכים. (ד) שלושה חוטי אקטין מדגם נבחרים מוצגים עם מחברים צולבים לחוטי אקטין סמוכים (שאינם מוצגים לשם הבהרה). שימו לב שרבים, אך לא כולם, מיקומי נימה בין-אקטין אפשריים תפוסים על ידי חלבוני מחברים; (E) חתך רוחב של 30 פרוסות/לוח 28.4 ננומטר של צפיפות הסטריאוציליה. (F) דגם של חוטי אקטין המותאמים ללוח צפיפות הסטריאוציליה של 30 פרוסות / 28.4 ננומטר. (ז) דגם של חוטי אקטין ללא צפיפות המפה הבסיסית. זיהוי אוטומטי של מרחקי נימה של השכן הקרוב ביותר, כפי שמצוין על ידי חיבורים דקים בין כדורי מודל נימה אקטין. (ח) היסטוגרמה של מרחקי מודל נימה אקטין. בלוחות A-C, מפת הצפיפות ב-Chimera מוצגת כמפה בסגנון "Mesh". (א-ג) פסי קנה מידה = 50 ננומטר. (D) סרגל קנה מידה = 25 ננומטר. (א-ג) פסי קנה מידה = 100 ננומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: בניית מודל עבור הראשון מבין שני מערכי נתונים נוספים של סטריאוציליה. (א-ג) אזור קטן של לוח אורך בעובי ~10 פרוסה/9.47 ננומטר של מפת צפיפות הסטריאוציליה מוצג בכחול באמצעות תצוגת מצב רשת. הדגם שהוצב בתחילה מוצג באדום והדגם המתוקן מוצג בצהוב. (A) צפיפות מפה בלבד. (B) מודל ראשוני שמוצב במפת הצפיפות. (ג) מודל מתוקן שהוכנס למפת הצפיפות. (ד-ה) אזור סטריאוציליה גדול יותר ללא (D) ועם (E) המודל המתוקן המותאם ללוח אורך בעובי ~10 / 9.47 ננומטר של מפת צפיפות הסטריאוציליה. (פ-ז) כל אזור הטומוגרמה של הסטריאוציליה מוצג. (F) מפה בלבד. (ז) מפה עם הדגם המתוקן. (ח) סופרפוזיציה של המודלים הראשוניים והמתוקנים. פסי קנה מידה = 100 ננומטר אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: בניית מודל עבור השני מבין שני מערכי נתונים נוספים של סטריאוציליה. (א-ג) אזור קטן של לוח אורך בעובי ~10 פרוסה/9.47 ננומטר של מפת צפיפות הסטריאוציליה מוצג בכחול באמצעות תצוגת מצב רשת. הדגם שהוצב בתחילה מוצג באדום והדגם המתוקן מוצג בצהוב; (A) צפיפות מפה בלבד. (B) מודל ראשוני שמוצב במפת הצפיפות. (ג) מודל מתוקן שהוכנס למפת הצפיפות. (ד-ה) אזור סטריאוציליה גדול יותר ללא (D) ועם (E) המודל המתוקן המותאם ללוח אורך בעובי ~10 / 9.47 ננומטר של מפת צפיפות הסטריאוציליה. (פ-ז) כל אזור הטומוגרמה של הסטריאוציליה מוצג. (F) מפה בלבד. (ז) מפה עם הדגם המתוקן. (ח) סופרפוזיציה של המודל הראשוני והמתוקן. פסי קנה מידה = 100 ננומטר. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: סקריפטים של UCSF Chimera python למידול סטריאוציליה. אנא לחץ כאן להורדת קובץ זה.
קובץ קידוד משלים 1: pblengths.py. אנא לחץ כאן להורדת קובץ זה.
קובץ קידוד משלים 2: RemoveCross.py. אנא לחץ כאן להורדת קובץ זה.
קובץ קידוד משלים 3: ActinFilamentPlane.py. אנא לחץ כאן להורדת קובץ זה.
קובץ קידוד משלים 4: dividelinks.py. אנא לחץ כאן להורדת קובץ זה.
קובץ קידוד משלים 5: FixingMarkerID.py. אנא לחץ כאן להורדת קובץ זה.
Discussion
הראינו שגישות אוטומטיות לסגמנטציה, כגון פילוח פרשת מים, עלולות להיכשל בסביבה בעלת רעש גבוה ומורכבות גבוהה של טומוגרפיות קריו-אלקטרונים של תאי שיער. ההבחנה איזה חלק ברשת חוטית זו מייצג חוטי אקטין ומה מהווה קישורים צולבים ברמת הסביבה המקומית נראית מאתגרת במקרה הטוב כאשר רק בודקים תת-נפחים טומוגרפיים קטנים. גישת בניית המודל המשמשת במחקר זה נהנית מידע מוקדם על הסדר בקנה מידה גדול של צרור האקטין, המסייע בפיתוח ציפייה לגבי האוריינטציה של חוטי האקטין וצפיפות הקישור. אולי אפילו יותר משמעותי הוא שמוח אנושי יכול למצוא בקלות דפוסים על ידי התחשבות בהקשר הרחב יותר מעבר להתפלגות הצפיפות המקומית, בעוד שאלגוריתם ממוחשב עובד רק עבור אזור קטן יחסית שנלקח בחשבון על ידי האלגוריתם; לפיכך, לא ניתן לקחת בחשבון בקלות מגמות בקנה מידה גדול יותר. על ידי התאמת מודל גלובלי לשכבת צפיפות, נמנענו מהבלבול שיכול להתרחש כאשר מנסים ליצור מודל לחלקים קטנים של חוטי אקטין בודדים בכל פעם. כמובן, התאמה גלובלית כזו מניחה סדר המשתרע על פני מרחקים גדולים. עם זאת, מכיוון שהיה לנו כיפוף הדרגתי קטן אך משמעותי של חוטי האקטין, ההתאמה הגלובלית הייתה רק קירוב ראשוני, ודרשה התאמות מקומיות של המודל כדי להתאים למפת הצפיפות. מכיוון שהמודל הראשוני היה נקודת התחלה טובה, ניתן היה לבצע את ההתאמות בביטחון גבוה. יתרון גדול אחד של הגישה שלנו היה שיכולנו לבחור להציג רק אזור מוגדר של צפיפות, מה שעזר להפחית את מורכבות הנוף. יתר על כן, צפייה בלוח צפיפות המפה לאורך ציר מודל החוטים סייעה לזהות את העקמומיות הבלתי צפויה, שסביר להניח שהיינו מפספסים כאשר פשוט היינו מציגים נפחי משנה קטנים יותר. מיקום המודל הראשוני איפשר גם התקרבות והתרחקות מהירה, כדי לסירוגין בין תצוגה כוללת של שכבת חוטי האקטין המתאימה לבין התצוגות המפורטות לביצוע התאמות מודל.
השלבים הקריטיים בפרוטוקול כללו סיבוב המפה לאחר בדיקה חזותית, יצירה ומיקום של המודל במפת הצפיפות, כמו גם חלוקת מודל החוטים למקטעים קטנים יותר. לאחר מכן ניתן היה לכוונן את מיקום האטום של המקטעים כך שיתאים למפת הצפיפות, ו/או לקודד בצבע כדי לזהות פערים.
ניתן לשנות גישה זו של בניית מודל אקטין גם על ידי הצבת קבוצה של "אטומים" (כלומר, הכדורים של מודל הכדור והמקל) לצפיפות נימה על ידי שימוש בתצוגת חתך של לוח צפיפות ממוצע של 10-30 פרוסה/9.47-28.4 ננומטר, אשר לאחר מכן ניתן לחבר באמצעות קשרים (כלומר, המקלות של מודל הכדור והמקל). השתמשנו בגישה זו, שהיא שינוי מהפרוטוקול המתואר כאן בפירוט, לבניית המודל הנפחי באזור המחודד של סטריאוציליה של תאי שיער23. יתר על כן, כפי שתיארנו כאן, גישת בניית המודל הנפחי שלנו מתאימה גם לפילוח ובניית מודל של ממברנות.
בעוד שניתן ליישם בניית מודל נפחי על כל מפת צפיפות המציגה תכונות חוטיות, הטכניקה שתיארנו כאן היא היעילה ביותר כאשר יש לנו מערך של חוטים מרווחים באופן קבוע, שעבורם ניתן להשיג התאמה גלובלית של מודל נפחי. זה תלוי גם בתכונות החוטים כדי לשנות את כיווניותם בצורה הדרגתית. אם יש קיפולים פתאומיים וסיבובים חדים במבנים החוטים, ייתכן שהגישה שלנו לא תהיה מועילה במיוחד לסגמנטציה.
בינתיים, משתפי הפעולה שלנו פיתחו גישה אוטומטית למעקב חוטים אוטומטי העוקבת אחר קונספט דומה המשמש כאן לפילוח ידני30,31. בהמשך, הגישה הטובה ביותר עשויה להיות הכלאה של זיהוי ידני ומיקום של מודל דליל ראשוני (אפילו רק כמה כדורים) לתוך הצפיפות כנקודת התחלה, ואז לתת לאלגוריתם חיפוש והתאמה לסיים את המעקב אחר החוטים.
מודלים נפחיים פשוטים מפחיתים את מורכבות המערכת ומאפשרים להעריך טוב יותר דפוסים מסוימים, כגון כיפוף חוט אקטין ליד הקצה. כמו כן, המודל הנפחי יכול לשמש כ"עוגן" להצגת אזור צפיפות סביב מודל העיגון הכדורי והמקל הנבחר, המאפשר זיהוי והדמיה של צפיפות קישור צולב בין חוטי אקטין סמוכים. היכולת לבחור חוטים בודדים ולהגדיר רדיוסים מתאימים כאזור שבו הצפיפות מוצגת שוב מאפשרת לצמצם את המורכבות העצומה של הנוף לרמה הניתנת לניהול.
יתרון אחד של גישת בניית מודל נפחי זו של התאמה גלובלית, ואחריה התאמות מקומיות, היה שהצלחנו לזהות אזורים שבהם נראה כי חוטי האקטין נקטעו, ופערים משמעותיים בחוטי אקטין צוינו על ידי היעדר צפיפות מפה. מכיוון שהצבנו מודל נפחי של כדור ומקל, יכולנו להשתמש בשגרה בחבילת התוכנה UCSF Chimera שמקודדת בצבע כל מיקום כדור לפי ערך צפיפות המפה באותו מיקום. גישה זו אפשרה זיהוי והדמיה מהירים של פערי חוטי אקטין בצרור האקטין, שהיא תכונה משמעותית מבחינה ביולוגית שמצאנו בטומוגרפיה הקריו-אלקטרונית שלנו, ואשר היה קשה מאוד לזהות ולהמחיש בגישות פילוח מסורתיות. יתרון נוסף של המודל הנפחי שלנו הוא שניתן להשיג בקלות תכונות נפחיות כולל אורכים ומרחקים, מה שמאפשר לבצע מספרים ממשיים ובכך לבצע ניתוח סטטיסטי.
לסיכום, מיקום נקודת מודל ידני אינטראקטיבי, אולי מוגבר עוד יותר על ידי יכולות התאמה מקומיות אוטומטיות ומעקב אחר חוטים, היא גישה מבטיחה למדי להדמיה וניתוח כמותי של נפחים תת-תאיים טומוגרפיים אלקטרונים. הסיבה לכך היא שהוא משתמש בכוחו של המוח האנושי לזיהוי דפוסים ובכוחו של מדעי המחשב לאופטימיזציה של מודלים.
Disclosures
המחברים מצהירים שאין להם אינטרסים פיננסיים מתחרים או ניגודי אינטרסים אחרים.
Acknowledgements
ברצוננו להודות לד"ר פיטר בר-גילספי ולצוותו על תפקידם בהכנת הדגימות, ולחברים לשעבר במעבדת אואר ובמעבדת ד"ר דורית חנין על תפקידם באיסוף נתונים טומוגרפיים. ברצוננו גם להודות לטום גודארד מ-UCSF Resource for Biocomputing, Visualization and Informatics (RBVI) על אספקת סקריפטים שונים של UCSF Chimera.
Materials
| Name | Company | Catalog Number | Comments |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/download.html | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=win64/chimera-1.16-win64.exe | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=mac64/chimera-1.16-mac64.dmg | |
| Chimera | RBVI | Version 1.16 https://www.cgl.ucsf.edu/chimera/cgi-bin/secure/chimera-get.py?file=linux_x86_64/chimera-1.16-linux_x86_64.bin | |
| Excel | Microsoft | Version 2211 https://www.office.com/?auth=1 | |
| Falcon II | Thermofisher | https://www.thermofisher.com/de/de/home/electron-microscopy/products/accessories-em/falcon-detector.html | |
| IMOD | University of Colorado | Version 4.11.1 https://bio3d.colorado.edu/imod/download.html | |
| PC Desktop | Intel | Windows 10, ver. 22H2 | |
| PC Laptop | Gigabyte | Windows 10, ver. 22H2 | |
| Powerpoint | Microsoft | Version 2211 https://www.office.com/?auth=1 | |
| Titan Krios Electron Microscope | Thermofisher | https://www.thermofisher.com/de/de/home/electron-microscopy/products/transmission-electron-microscopes/krios-g4-cryo-tem.html | |
| Word | Microsoft | Version 2211 https://www.office.com/?auth=1 |
References
- Downing, K. H., Sui, H., Auer, M. Electron tomography: A 3D view of the subcellular world. Analytical Chemistry. 79 (21), 7949-7957 (2007).
- Koning, R. I., Koster, A. J. Cellular nanoimaging by cryo electron tomography. Methods in Molecular Biology. 950, 227-251 (2013).
- Asano, S., Engel, B. D., Baumeister, W. In situ cryo-electron tomography: A post-reductionist approach to structural biology. Journal of Molecular Biology. 428 (2), 332-343 (2016).
- Serwas, D., Davies, K. M. Getting started with in situ cryo-electron tomography. Methods in Molecular Biology. 2215, 3-23 (2021).
- McDonald, K. L., Auer, M. High-pressure freezing, cellular tomography, and structural cell biology. Biotechniques. 41 (2), 137-143 (2006).
- Narasimha, R., et al. Evaluation of denoising algorithms for biological electron tomography. Journal of Structural Biology. 164 (1), 7-17 (2008).
- Frangakis, A. S. It's noisy out there! A review of denoising techniques in cryo-electron tomography. Journal of Structural Biology. 213 (4), 107804 (2021).
- Frangakis, A. S., Hegerl, R. Noise reduction in electron tomographic reconstructions using nonlinear anisotropic diffusion. Journal of Structural Biology. 135 (3), 239-250 (2001).
- Jiang, W., Baker, M. L., Wu, Q., Bajaj, C., Chiu, W. Applications of a bilateral denoising filter in biological electron microscopy. Journal of Structural Biology. 144 (1-2), 114-122 (2003).
- vander Heide, P., Xu, X. -. P., Marsh, B. J., Hanein, D., Volkmann, N. Efficient automatic noise reduction of electron tomographic reconstructions based on iterative median filtering. Journal of Structural Biology. 158 (2), 196-204 (2007).
- Volkmann, N. Methods for segmentation and interpretation of electron tomographic reconstructions. Methods in Enzymology. 483, 31-46 (2010).
- Böhm, J., et al. Toward detecting and identifying macromolecules in a cellular context: template matching applied to electron tomograms. Proceedings of the National Academy of Sciences. 97 (26), 14245-14250 (2000).
- Frangakis, A. S., et al. Identification of macromolecular complexes in cryoelectron tomograms of phantom cells. Proceedings of the National Academy of Sciences. 99 (22), 14153-14158 (2002).
- Lebbink, M. N., et al. Template matching as a tool for annotation of tomograms of stained biological structures. Journal of Structural Biology. 158 (3), 327-335 (2007).
- Rigort, A., et al. Automated segmentation of electron tomograms for a quantitative description of actin filament networks. Journal of Structural Biology. 177 (1), 135-144 (2012).
- Volkmann, N. A novel three-dimensional variant of the watershed transform for segmentation of electron density maps. Journal of Structural Biology. 138 (1-2), 123-129 (2002).
- Bajaj, C., Yu, Z., Auer, M. Volumetric feature extraction and visualization of tomographic molecular imaging. Journal of Structural Biology. 144 (1-2), 132-143 (2003).
- Yu, Z., Frangakis, A. S. Classification of electron sub-tomograms with neural networks and its application to template-matching. Journal of Structural Biology. 174 (3), 494-504 (2011).
- Moebel, E., et al. Deep learning improves macromolecule identification in 3D cellular cryo-electron tomograms. Nature Methods. 18 (11), 1386-1394 (2021).
- Tilney, L. G., Derosier, D. J., Mulroy, M. J. The organization of actin filaments in the stereocilia of cochlear hair cells. The Journal of Cell Biology. 86 (1), 244-259 (1980).
- Tilney, L. G., Tilney, M. S., DeRosier, D. J. Actin filaments, stereocilia, and hair cells: how cells count and measure. Annual Review of Cell Biology. 8, 257-274 (1992).
- Metlagel, Z., et al. Electron cryo-tomography of vestibular hair-cell stereocilia. Journal of Structural Biology. 206 (2), 149-155 (2019).
- Song, J., et al. A cryo-tomography-based volumetric model of the actin core of mouse vestibular hair cell stereocilia lacking plastin 1. Journal of Structural Biology. 210 (1), 107461 (2020).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Agulleiro, J. I., Fernandez, J. J. Fast tomographic reconstruction on multicore computers. Bioinformatics. 27 (4), 582-583 (2011).
- Fernandez, J. J. Computational methods for electron tomography. Micron. 43 (10), 1010-1030 (2012).
- Chen, H., Clyborne, W. K., Sedat, J. W., Agard, D. A. Priism: an integrated system for display and analysis of 3-D microscope images. Biomedical Image Processing and Three-Dimensional Microscopy. 1660, 784-790 (1992).
- Pettersen, E. F., et al. UCSF Chimera-a visualization system for exploratory research and analysis. Journal of Computational Chemistry. 25 (13), 1605-1612 (2004).
- Goddard, T. D., Huang, C. C., Ferrin, T. E. Visualizing density maps with UCSF Chimera. Journal of Structural Biology. 157 (1), 281-287 (2007).
- Sazzed, S., et al. Tracing actin filament bundles in three-dimensional electron tomography density maps of hair cell stereocilia. Molecules. 23 (4), 882 (2018).
- Sazzed, S., Scheible, P., He, P., Wriggers, J. Spaghetti tracer: A framework for tracing semiregular filamentous densities in 3D tomograms. Biomolecules. 12 (8), 1022 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved