Method Article
ثقافة الخنازير المعوية 3D العضوية من الخبايا الظهارية المحفوظة بالتبريد وإنشاء أحاديات الخلية
In This Article
Summary
هنا ، وصفنا بروتوكولا لثقافة الخنازير المعوية 3D organoids من الخبايا الظهارية المحفوظة بالتبريد. نحن أيضا وصف طريقة لإنشاء أحادي الخلية المستمدة من المواد العضوية 3D ، مما يسمح بالوصول إلى الجانب القمي للخلايا الظهارية.
Abstract
يتم استخدام الكائنات العضوية المعوية بشكل متزايد لدراسة ظهارة الأمعاء لنمذجة أمراض الجهاز الهضمي ، أو للتحقيق في التفاعلات مع الأدوية والمغذيات والمستقلبات ومسببات الأمراض والميكروبات. تتوفر الآن طرق لاستزراع العضويات المعوية لأنواع متعددة ، بما في ذلك الخنازير ، وهو نوع ذو أهمية كبيرة كحيوان مزرعة وكنموذج متعدي للبشر ، على سبيل المثال ، لدراسة الأمراض الحيوانية المنشأ. هنا ، نقدم وصفا متعمقا لإجراء يستخدم لثقافة عضويات 3D المعوية للخنزير من الخبايا الظهارية المجمدة. يصف البروتوكول كيفية حفظ الخبايا الظهارية بالتبريد من أمعاء الخنزير والإجراءات اللاحقة لثقافة المواد العضوية المعوية 3D. المزايا الرئيسية لهذه الطريقة هي (i) التفكك الزمني لعزل الخبايا من ثقافة المواد العضوية 3D ، (ii) إعداد مخزونات كبيرة من الخبايا المحفوظة بالتبريد المشتقة من شرائح معوية متعددة ومن عدة في وقت واحد ، وبالتالي (iii) تقليل الحاجة إلى أخذ عينات من الأنسجة الطازجة من الحيوانات الحية. نقوم أيضا بتفصيل بروتوكول لإنشاء طبقة أحادية الخلية مشتقة من عضويات 3D للسماح بالوصول إلى الجانب القمي للخلايا الظهارية ، وهو موقع التفاعلات مع العناصر الغذائية أو الميكروبات أو الأدوية. بشكل عام ، تعد البروتوكولات الموضحة هنا موردا مفيدا لدراسة ظهارة معوية الخنازير في البحوث البيطرية والطبية الحيوية.
Introduction
تتكون ظهارة الأمعاء من طبقة أحادية من الخلايا تغطي الغشاء المخاطي الهضمي عند الواجهة مع البيئة اللمعية. يرتبط هذا الوضع بوظائف متنوعة ، مثل امتصاص المغذيات ووظيفة الحاجز الواقي ، والتي يدعمها وجود الخلايا الجذعية وأنواع الخلايا الظهارية المتمايزة المتعددة (الخلايا الامتصاصية ، والغدد الصماء المعوية ، والبانيث ، والكأس)1. خطوط الخلايا الخالدة المستخدمة تقليديا لدراسة الخلايا الظهارية لها قيود كبيرة ، لأنها لا تعكس التعقيد الخلوي للظهارة المعوية وتقدم تشوهات جينومية2. قدم تطوير المواد العضوية ثلاثية الأبعاد (3D) بواسطة Sato et al.3 نموذجا جديدا لدراسة ظهارة الأمعاء ذات الصلة الفسيولوجية المحسنة. في الواقع ، تستمد الكائنات العضوية المعوية من الخلايا الجذعية غير المحولة ، وتتكون من أنواع متعددة من الخلايا ، وتلخص وظائف ظهارة الأمعاء. يتم استخدام الكائنات العضوية المعوية بشكل متزايد لفهم تطور ووظائف ظهارة الأمعاء وتفاعلاتها مع مسببات الأمراض والمواد المغذية والسموم والأدوية والميكروبات ومستقلباتها2.
تم تطوير الطرق المستخدمة في زراعة الكائنات العضوية المعوية في البداية للبشر والفئران ، وقد تم تكييفها مؤخرا مع الأنواع الأخرى ، بما في ذلك الخنازير4. كان Gonzales et al.5 أول من استزرع عضويات الخنازير من الصائم. منذ ذلك الحين ، تم وصف عضويات الخنازير لقطاعات الأمعاء الأخرى (الاثني عشر ، الدقاق ، والقولون) 6،7،8 ، وقد ثبت أنها تحتفظ بالنمط الظاهري الخاص بالموقع9،10،11. تستخدم الآن عضويات 3D المعوية للخنزير بشكل شائع لدراسة تأثير العناصر الغذائية12,13 أو الالتهابات المعوية 6,8,14.
وصفت معظم الدراسات ثقافة الكائنات العضوية المعوية بدءا من الخبايا الظهارية المعزولة حديثا. ومع ذلك ، فإن هذا ليس ممكنا دائما لأسباب لوجستية ، لا سيما عند العمل مع الحيوانات الكبيرة مثل الخنازير. في الواقع ، يمكن أن تكون المرافق الحيوانية للخنازير بعيدة عن المختبر حيث يتم استزراع المواد العضوية ، مما يعقد تنظيم العمل. علاوة على ذلك ، فإن الثقافة العضوية تستغرق وقتا طويلا. وبالتالي ، ليس من العملي زراعة خطوط عضوية متعددة في وقت واحد ، على سبيل المثال ، من قطاعات أمعاء مختلفة أو عدة. للتحايل على هذه المشكلات ، وصفت بعض الدراسات التي أجريت على البشر والخيول والخنازير طرقا لزراعة المواد العضوية من الأنسجة المعوية المجمدة (أو الخزعات) أو من الخبايا الظهارية المعزولة4،15،16،17. تسمح هذه الطرق بالحفظ بالتبريد للخلايا الجذعية الظهارية المعوية من أجزاء أمعاء متعددة لحيوان واحد ، والتي يمكن استخدامها بعد ذلك لزراعة المواد العضوية عند الحاجة. علاوة على ذلك ، يسمح هذا بانخفاض قوي في عدد الحيوانات الحية المستخدمة كمتبرعين للخلايا الجذعية ، حيث يمكن إنشاء مخزونات كبيرة من الخبايا المحفوظة بالتبريد (مبادئ 3R). ميزة أخرى لهذه الطريقة هي نمو الكائنات العضوية المعوية فقط من الحيوانات ذات الأهمية بعد الحصول على نتائج النمط الظاهري أو الوراثي ، وهو فعال للغاية من حيث التكلفة.
في الجسم الحي ، تستقطب الخلايا الظهارية المعوية ، مع توجيه الجانب القمي نحو التجويف. في المختبر ، في المواد العضوية ثلاثية الأبعاد ، يواجه الجانب القمي للخلايا الظهارية أيضا التجويف (أي داخل المواد العضوية)4. تمنع هذه المنظمة الوصول إلى الجانب القمي ، وهي مشكلة عند دراسة تأثيرات المكونات اللمعية (مثل العناصر الغذائية والميكروبات والمستقلبات) على الخلايا الظهارية. للتحايل على هذا العيب ، تم تطوير عدة طرق ، مثل زراعة الخلايا العضوية كطبقة أحادية 2D ، والحقن المجهري ، وانعكاس القطبية ("المواد العضوية القمية")18,19. تظهر ثقافة الخلايا العضوية أحادية الطبقات باعتبارها النظام الأكثر كفاءة وقابلية للتتبع. المبدأ هو فصل المواد العضوية 3D إلى خلايا مفردة وزرعها على وعاء زراعة الخلايا المغلفة مسبقا بطبقة رقيقة من المصفوفة خارج الخلية (ECM) 20. في ظروف الاستزراع هذه ، يكون الجانب القمي للخلايا الظهارية متجها لأعلى ، وبالتالي يمكن الوصول إليه من خلال العلاجات التجريبية20. تم تكييف ثقافة أحاديات الخلايا العضوية مؤخرا لأمعاء الخنزير21,22. تم استخدام أحاديات الخلايا المشتقة من عضويات الخنازير ثلاثية الأبعاد لتطبيقات متعددة ، بما في ذلك دراسة الالتهابات المعوية6،23،24،25 ، ونقل العناصر الغذائية9 ، ونمذجة أمراض الجهاز الهضمي 26.
هنا ، تقدم هذه الدراسة أولا بروتوكولا مفصلا لثقافة وصيانة عضويات 3D المعوية للخنازير المشتقة من الخبايا الظهارية المحفوظة بالتبريد (الشكل 1). ثم ، يتم وصف بروتوكول لإنشاء أحاديات الخلايا من عضويات 3D المعوية الخنازير. توفر الطرق الموصوفة هنا أدوات تجريبية يمكن استخدامها لدراسة ظهارة معوية الخنازير لنقل المغذيات ، ووظيفة الحاجز ، والتفاعلات بين الكائنات الحية الدقيقة والمضيف.
Protocol
تمت الموافقة على هذا البروتوكول من قبل لجنة الأخلاقيات المحلية (N°TOXCOM / 0136 / PP) وفقا للتوجيه الأوروبي بشأن حماية الحيوانات المستخدمة للأغراض العلمية (2010/63 / EU). يوصف هذا البروتوكول للصائم كمثال ، ولكن يمكن استخدامه لكل جزء من الأمعاء الدقيقة والكبيرة (الاثني عشر ، الصائم ، الدقاق ، القولون).
1. عزل الخبايا الظهارية من الأمعاء الصغيرة
ملاحظة: قم بإعداد مخزون من وسط النسر المعدل الكامل من Dulbecco (DMEMc) مع DMEM المكمل بمصل بقري جنيني بنسبة 10٪ (FBS) و 1٪ بنسلين-ستربتومايسين (P / S). تحضير 50 مل من القسامات وتخزينها في 4 درجة مئوية لمدة 1 شهر.
- إعداد الحلول (يتم ذلك في يوم عزل القبو)
- تحضير محلول التفكك الذي يحتوي على محلول ملحي مخزن للفوسفات (PBS) ، 3 مللي مول ديثيوثريتول (DTT) ، 9 مللي متر حمض إيثيلين ديامينيترايتيك (EDTA) ، 10 ميكرومتر Y27632 مثبط ROCK ، و 1٪ بنسلين-ستربتومايسين (P / S) وتخزينه على الثلج.
- تحضير محلول التجميد الذي يحتوي على DMEMc و 10٪ FBS و 10٪ ثنائي ميثيل سلفوكسيد (DMSO) ومثبط 10 μM Y27632 ROCK وتخزينه على الثلج (تركيز FBS النهائي هو 18٪).
- قم بإعداد محلول النقل الذي يحتوي على برنامج تلفزيوني بارد مكمل ب 1٪ P / S وقم بتخزينه على الجليد.
- عزل الخبايا الظهارية
- ذبح خنزير صغير عن طريق التخدير الكهربائي تليها الاستنزاف.
- مباشرة بعد الذبح ، افتح بطن الخنزير الصغير بمشرط وأزل الأمعاء بأكملها.
- جمع ما يقرب من 2 سم من شريحة الأمعاء وتخزينها في محلول النقل البارد. احتفظ بالقطعة على الجليد حتى عزل القبو (حتى 2 ساعة).
- ضع المنديل في طبق بتري. افتح الجزء المعوي طوليا واغسل الأنسجة بعناية في برنامج تلفزيوني بارد مكمل ب 1٪ P / S لإزالة محتوى الأمعاء.
- انقل المنديل إلى طبق بتري جديد مملوء ب 10 مل من برنامج تلفزيوني بارد مكمل ب 1٪ P / S.
- امسك الأنسجة بملاقط وأزل الزغب والمخاط المتبقي عن طريق كشط شريحة المجهر.
ملاحظة: يمكن التحقق من إزالة الزغابات (الهيكل على شكل لسان) عن طريق المراقبة المجهرية للطاف. - انقل الأنسجة إلى أنبوب مخروطي سعة 15 مل يحتوي على 5 مل من محلول تفكك الثلج البارد واحتضانه لمدة 30 دقيقة في درجة حرارة الغرفة (RT) على شاكر دوار (15 دورة في الدقيقة).
- انقل المنديل إلى طبق بتري جديد وأضف 10 مل من برنامج تلفزيوني بارد مكمل ب 1٪ P / S.
- عزل الخبايا ميكانيكيا عن طريق كشط الغشاء المخاطي بقوة مع شريحة المجهر.
ملاحظة: تحت المجهر ، تحقق من وجود الخبايا الظهارية في PBS (الشكل 2 أ). - نضح محلول القبو باستخدام ماصة مصلية وتصفية من خلال مصفاة خلية 100 ميكرومتر في أنبوب مخروطي 50 مل.
- ماصة 10 ميكرولتر من الحل والتحقق من وجود الخبايا تحت المجهر. أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تحت خزانة معقمة للسلامة البيولوجية ، تخلص من المادة الطافية وأعد تعليق حبيبات الخبايا في 10 مل من DMEMc البارد المكمل بمثبط 10 ميكرومتر Y27632 ROCK.
- ماصة 10 ميكرولتر من محلول القبو في لوحة 48 بئر. احسب يدويا عدد الخبايا تحت المجهر بتكبير 10x ، واحسب تركيز الخبايا لكل مل من المحلول.
ملاحظة: يمكن استخدام الخبايا المعزولة مباشرة لاستزراع العضويات المعوية. ومع ذلك ، غالبا ما يكون أكثر ملاءمة للحفاظ على مجموعة كبيرة من الخبايا من كل خنزير صغير واستخدامها لاحقا للثقافة العضوية.
- تجميد الخبايا الظهارية
- انقل حجما يتوافق مع 900 خبايا في أنبوب مخروطي سعة 15 مل. أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية وأعد تعليق حبيبات الخبايا في 1 مل من محلول التجميد. انقله إلى أنبوب التبريد وضع القارورة في وعاء تجميد الخلايا.
- قم بتخزين حاوية تجميد الخلايا في درجة حرارة -80 درجة مئوية لمدة 24 ساعة ثم انقل القوارير إلى النيتروجين السائل لتخزينها على المدى الطويل.
2. إنشاء خنزير معوي 3D عضويات من الخبايا الظهارية المجمدة
ملاحظة: يتم استزراع عضويات 3D المعوية الصغيرة في وسط استزراع تجاري مصمم لنمو الكائنات العضوية البشرية ، وتستكمل ب 1٪ P / S و 100 ميكروغرام / مل من عامل مضاد للميكروبات للخلايا الأولية ، وتخزن في 4 درجات مئوية لمدة تصل إلى أسبوع واحد. يتم استخدام مصفوفة خارج الخلية مشتقة من الورم (ECM) لثقافة المواد العضوية 3D. يتم عرض جميع مراجع المنتجات التجارية في جدول المواد.
- تحضير المواد
- ضع أطراف الماصة عند -20 درجة مئوية (على الأقل طوال الليل).
- ضع الحصصات المجمدة من ECM (500 ميكرولتر) عند 4 درجات مئوية على الأقل 1 ساعة مقدما.
- قم بتسخين صفيحة 48 بئرا مسبقافي حاضنة CO 2 37 درجة مئوية ، 5٪.
- ضع وسيط الثقافة في RT.
- قم بتسخين حمام مائي مسبقا على درجة حرارة 37 درجة مئوية.
- ضع دلو ثلج صغير تحت غطاء المحرك في ظروف معقمة.
- ذوبان الخبايا الظهارية المجمدة
- قم بإذابة قارورة تحتوي على 900 سرداب مجمد بسرعة في حمام مائي عند 37 درجة مئوية (أقل من 5 دقائق).
- انقل محلول القبو إلى أنبوب مخروطي سعة 15 مل.
- أجهزة الطرد المركزي عند 300 × جم لمدة 5 دقائق في RT. إزالة المادة الطافية
- أضف 150 ميكرولتر من ECM مع أطراف مبردة للحصول على تركيز نهائي يبلغ 150 تشفيرا لكل 25 ميكرولتر من ECM. ماصة صعودا وهبوطا 10 مرات للحصول على تعليق متجانس من الخبايا في ECM.
ملاحظة: احتفظ دائما بوحدة التحكم الإلكترونية على الجليد لتجنب البلمرة. استخدم دائما أطراف الماصة المبردة مسبقا عند -20 درجة مئوية لمعالجة ECM. ماصة ببطء لتجنب صنع فقاعات الهواء في ECM. يتم استخدام ECM غير مخفف في هذه الخطوة لمنع القطرات الصغيرة من الانهيار. - قم بزرع ستة آبار بقطرة 25 ميكرولتر لكل بئر مع أطراف مبردة في صفيحة 48 بئر تم تسخينها مسبقا.
ملاحظة: حافظ على الطرف عموديا ، في وسط البئر ، وقم بسحب الماصة ببطء دون إدخال الهواء للحصول على قبة. هنا ، يتم استخدام 48 لوحة بئر ، لأن الرقم العضوي عادة ما يكون منخفضا عند البدء من الخبايا المجمدة. - احتضان لمدة 30 دقيقة في حاضنة 37 درجة مئوية ، 5 ٪ CO2 لبلمرة ECM.
- أضف 250 ميكرولتر لكل بئر من وسط الاستزراع في RT. احتضان حاضنة 37 درجة مئوية ، 5٪ CO 2 وقم بتغيير وسط الاستزراع كل2-3 أيام
ملاحظة: عادة ما تكون الخبايا غير مرئية بعد إجراء الذوبان ، ويتم فصل معظم الخلايا في ECM (الشكل 2B).
3. مرور خنزير صغير معوي 3D عضويات مشتقة من الخبايا المجمدة
ملاحظة: عادة ما يكون وقت الحصول على المواد العضوية من الخبايا المجمدة أطول مما كان عليه عند البدء من الخبايا الطازجة. عادة ما تكون المواد العضوية جاهزة للانقسام بعد 10 أيام من الذوبان (الشكل 2 ب).
- تحضير المواد
- ضع القسامات المجمدة من ECM (500 ميكرولتر) عند 4 درجات مئوية لمدة 1 ساعة على الأقل.
- قم بتسخين الألواح المكونة من 24 بئرا مسبقا عند 37 درجة مئوية.
- قم بتسخين PBS وكاشف تفكك الإنزيم المكمل بمثبط 10 μM Y27632 ROCK في حمام مائي عند 37 درجة مئوية.
- ضع وسيط الثقافة في RT.
- ضع دلو ثلج صغير تحت غطاء المحرك في ظروف معقمة.
- مرور المواد العضوية 3D المشتقة من الخبايا المجمدة
- قم بإزالة وسائط الاستزراع واغسلها ب 250 ميكرولتر من برنامج تلفزيوني مسخن مسبقا عند 37 درجة مئوية.
- أضف 250 ميكرولتر من كاشف تفكك الإنزيم المسخن مسبقا المكمل بمثبط 10 ميكرومتر Y27632 ROCK عند 37 درجة مئوية في كل بئر.
ملاحظة: نظرا لانخفاض عدد المواد العضوية ، يتم إجراء تفكك المواد العضوية مباشرة في كل بئر. - افصل المواد العضوية في ECM عن طريق الكشط باستخدام ماصة P1000 ، وقم بالتجانس بعناية عن طريق سحب خمس مرات.
- احتضان لمدة 5 دقائق في حاضنة 37 درجة مئوية ، 5 ٪ CO2 . افصل الخلايا عن طريق السحب لأعلى ولأسفل 10 مرات باستخدام ماصة P1000.
ملاحظة: الهدف هو الحصول على خلايا معزولة أو مجموعات خلايا صغيرة (<10 خلايا). تحقق من التفكك تحت المجهر. إذا استمرت ملاحظة شظايا كبيرة من المواد العضوية ، كرر الخطوة 3.2.4. - أضف 500 ميكرولتر من DMEMc في كل بئر يحتوي على خلايا منفصلة ، وقم بتجميع ما يصل إلى 12 بئرا في أنبوب مخروطي سعة 15 مل يحتوي على 3 مل من DMEMc البارد.
- جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق الحبيبات في 1 مل من DMEMc البارد.
- عد الخلايا بتخفيف 1: 2 باللون الأزرق Trypan باستخدام عداد خلية.
ملاحظة: يمكن لعداد الخلايا الآلي حساب الخلايا داخل مجموعات صغيرة ، إن وجدت. - أجهزة الطرد المركزي الحجم اللازم من محلول الخلية للحصول على 3000 خلية حية لكل قبة (قبة واحدة لكل بئر من لوحة 24 بئرا) عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أعد تعليق الخلايا ب 17 ميكرولتر من DMEMc البارد لكل 3000 خلية حية على الجليد. اضبط مستوى الصوت على العدد المطلوب من الآبار.
- أضف ببطء 33 ميكرولتر من ECM البارد مع أطراف مبردة لكل 3000 خلية حية وقم بالتجانس على الجليد دون تكوين فقاعات. اضبط مستوى الصوت على العدد المطلوب من الآبار.
ملاحظة: يتم إعادة تعليق الخلايا في محلول يحتوي على 1/3 DMEMc و 2/3 ECM. لكل قبة ، هناك حاجة إلى 50 ميكرولتر من هذا المحلول. ECM المخفف أرخص وأسهل في الماصة. - قم بزرع الآبار ب 50 ميكرولتر من تعليق خلية ECM لكل بئر مع أطراف مبردة في 24 لوحة بئر تم تسخينها مسبقا.
- احتضان لمدة 30 دقيقة في حاضنة 37 درجة مئوية ، 5 ٪ CO2 لبلمرة ECM.
- أضف 500 ميكرولتر من وسط الاستزراع لكل بئر. احتضان في حاضنة 37 درجة مئوية ، 5٪ CO 2 وتغيير وسط الاستزراع كل2-3 أيام
ملاحظة: يمكن استخدام المواد العضوية إما مباشرة في i) التجارب ، ii) صيانة ثقافة 3D العضوية ، iii) التجميد ، أو iv) بذر أحاديات الخلايا العضوية (الشكل 1). تحقق من نمو المواد العضوية باستخدام المجهر كل يوم لاختيار التوقيت الأمثل لتقسيم المواد العضوية. يجب أن يكون للعضويات تجويف واضح وفارغ وحواف محددة جيدا. لا ينبغي استخدام المواد العضوية الناضجة ذات الحطام الأسود في التجويف للتقسيم (الشكل 3).
4. الحفاظ على الثقافة العضوية في 3D
ملاحظة: للمرور ، يجب أن تظهر المواد العضوية واضحة مع تجويف فارغ. يظهر الحطام الأسود في التجويف بعد حوالي 5 أيام من الانقسام ويشير إلى وجود خلايا ميتة. يفضل الحد من عدد الخلايا الميتة في وقت المرور من أجل الصيانة المثلى للثقافة. وبالتالي ينبغي تكييف الجدول الزمني لتجنب الوصول إلى هذه المرحلة من النضج.
- تحضير المواد
- ضع حصص ECM (500 ميكرولتر) عند 4 درجات مئوية للذوبان لمدة 1 ساعة على الأقل.
- قم بتسخين طبق من 24 بئرا مسبقا على درجة حرارة 37 درجة مئوية.
- قم بالتسخين المسبق لكاشف تفكك الإنزيم المكمل بمثبط 10 ميكرومتر Y27632 ROCK في حمام مائي عند 37 درجة مئوية.
- ضع وسيط الثقافة في RT.
- ضع دلو ثلج صغير تحت غطاء المحرك في ظروف معقمة.
- مرور المواد العضوية المعوية 3D
- افصل المواد العضوية باستخدام ECM عن طريق الكشط باستخدام ماصة P1000. تجانس بعناية عن طريق سحب الماصة في وسط الاستزراع ، ونقلها إلى أنبوب مخروطي سعة 15 مل يحتوي على 5 مل من DMEMc البارد على الجليد.
ملاحظة: مطلوب أنبوب مخروطي واحد سعة 15 مل لبركة بها 12 بئرا من المواد العضوية المستزرعة في قباب سعة 50 ميكرولتر في 24 لوحة بئر. - أجهزة الطرد المركزي المواد العضوية المجمعة عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
ملاحظة: تشكل الكائنات العضوية حبيبات بيضاء في قاع الأنبوب. إذا كانت المواد العضوية لا تزال في التعليق في ECM بعد الطرد المركزي ، فقم بشفط المادة الطافية العلوية بعناية (دون لمس طبقة ECM) ، وقم بالتجانس عن طريق السحب 10 مرات باستخدام ماصة P1000 ، وكرر خطوة الطرد المركزي. يجب ألا تكون طبقة ECM مرئية بعد هذا الإجراء. - قم بشفط المادة الطافية بعناية وأعد تعليق حبيبات الخلية في 1 مل من كاشف تفكك الإنزيم الذي تم تسخينه مسبقا مع مثبط 10 ميكرومتر Y27632 ROCK. ماصة صعودا وهبوطا 10 مرات لبدء تفكك المواد العضوية.
- احتضان لمدة 5 دقائق في حمام مائي 37 درجة مئوية للهضم الأنزيمي.
- قم بتعطيل المواد العضوية ميكانيكيا عن طريق سحب 10 مرات باستخدام ماصة P1000. تحقق من تعليق الخلية تحت المجهر.
ملاحظة: الهدف هو الحصول على خلايا معزولة أو مجموعات خلايا صغيرة. إذا استمرت ملاحظة شظايا عضوية كبيرة ، كرر الحضانة (الخطوة 4.2.4) والاضطراب الميكانيكي (الخطوة 4.2.5). - أضف 4 مل من DMEMc المثلج البارد. جهاز طرد مركزي عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية
- تخلص من المادة الطافية وأعد تعليق حبيبات الخلايا العضوية في 1 مل من DMEMc.
- تابع كما هو موضح أعلاه (الخطوات 3.2.7 إلى 3.2.13) لحساب الخلايا وزرع الخلايا العضوية في 50 ميكرولتر من قباب ECM التي تحتوي على 3000 خلية حية في صفيحة 24 بئر تم تسخينها مسبقا.
- افصل المواد العضوية باستخدام ECM عن طريق الكشط باستخدام ماصة P1000. تجانس بعناية عن طريق سحب الماصة في وسط الاستزراع ، ونقلها إلى أنبوب مخروطي سعة 15 مل يحتوي على 5 مل من DMEMc البارد على الجليد.
5. تجميد المواد العضوية 3D
- قم بإعداد الحجم اللازم (1 مل لمجموعة من قبتين) من محلول التجميد الذي يحتوي على DMEMc المكمل بمثبط 10٪ FBS و 10٪ DMSO و 10 μM Y27632 ROCK وتخزينه على الثلج (تركيز FBS النهائي هو 18٪).
- قم بإزالة وسط الاستزراع من الآبار المراد تجميده.
- أضف 1 مل من محلول التجميد إلى البئر الأول المراد تجميده ، وافصل ECM عن طريق الكشط ، وقم بالتجانس مع طرف الماصة.
- انقل المعلق العضوي من البئر الأول إلى البئر الثاني ليتم تجميده.
- انقل بركة البئرين إلى أنبوب تبريد وضع القارورة في حاوية تجميد الخلايا.
- قم بتخزين حاوية تجميد الخلايا في -80 درجة مئوية لمدة 24 ساعة ، ثم انقل القوارير إلى النيتروجين السائل للتخزين طويل الأجل.
6. ثقافة أحاديات الخلية المستمدة من المواد العضوية 3D
ملاحظة: يتم استزراع أحاديات الطبقات من الخلايا العضوية الخنازير في وسط 2D يتكون من وسط الاستزراع المستخدم في المواد العضوية ثلاثية الأبعاد مع 20٪ FBS.
- تحضير المواد
- قم بإعداد وسيط 2D واحتفظ به في RT.
- قم بالتسخين المسبق لكاشف تفكك الإنزيم المكمل بمثبط 10 ميكرومتر Y27632 ROCK في حمام مائي عند 37 درجة مئوية.
- طلاء إدراج الثقافة
- تعقيم زوج من الملقط ونقلها إلى خزانة السلامة الحيوية.
- ضع حشوات زراعة الخلايا (0.33 سم2) في طبق من 24 بئرا باستخدام الملقط.
- تحضير محلول الطلاء الذي يحتوي على الكولاجين الوريدي المخفف عند 50 ميكروغرام / مل في برنامج تلفزيوني بارد. ماصة صعودا وهبوطا لخلط
- أضف 150 ميكرولتر من محلول الكولاجين الوريدي المخفف إلى كل ملحق مزرعة خلوي ، وهو ما يعادل 22.7 ميكروغرام / سم2.
ملاحظة: قم بتوجيه الماصة عموديا بعناية إلى وسط الغشاء القابل للنفاذ وتحقق من أن محلول الكولاجين يغطي كل الغشاء. - ضع اللوحة في حاضنة 37 درجة مئوية ، 5٪ CO2 واتركها طوال الليل (أو لمدة لا تقل عن 3 ساعات).
- بذر الخلايا العضوية 3D في إدراج ثقافة الخلية
- قم بإعداد تعليق خلية من المواد العضوية ثلاثية الأبعاد ، كما هو موضح في الخطوات 4.2.1 إلى 4.2.7.
- عد الخلايا بتخفيف 1: 2 باللون الأزرق Trypan مع عداد الخلايا ، واحسب الحجم اللازم لزرع 2.5 × 10 5 خلايا لكل إدراج مزرعة ، بما يتوافق مع 7.6 × 105 خلايا / سم2.
- أجهزة الطرد المركزي الحجم اللازم لتعليق الخلية عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أثناء الطرد المركزي ، قم بشفط محلول الطلاء بعناية من إدخالات الثقافة ، واتركه يجف في RT تحت الغطاء بدون غطاء لمدة 5 دقائق.
- بعد الطرد المركزي ، تخلص من المادة الطافية وأعد تعليق حبيبات الخلية بالحجم اللازم من الوسط 2D المكمل بمثبط 10 μM Y27632 ROCK. هناك حاجة إلى حجم 200 ميكرولتر من الوسط ثنائي الأبعاد الذي يحتوي على الخلايا لكل إدخال.
- بذرة 200 ميكرولتر من معلق الخلية (2.5 × 105 خلايا) على الغشاء القابل للنفاذ المطلي (الجانب القمي) (الشكل 4 أ).
ملاحظة: ماصة ببطء في وسط الغشاء والحفاظ على الطرف عمودي. - أضف 500 ميكرولتر من الوسط 2D المكمل بمثبط 10 μM Y27632 ROCK إلى الجزء السفلي (الجانب القاعدي). احتضان في 37 درجة مئوية ، 5 ٪ حاضنة CO2 .
- بعد يوم واحد من البذر ، استبدل الوسائط القمية والقاعدية بوسط 2D جديد بدون مثبط Y27632 ROCK.
- تغيير الوسيط 2D كل يوم. تصبح الطبقة الأحادية متقاربة بعد 1 يوم من البذر ، ويمكن بعد ذلك استخدامها للتجارب.
ملاحظة: تؤكد قيمة المقاومة الكهربائية عبر الظهارة (TEER) فوق الفراغ (إدراج بدون خلايا) الوصول إلى التقاء (الشكل 4B).
7. التلوين المناعي للخلايا العضوية أحادية الطبقات
- إعداد الحلول
ملاحظة: اضبط حجم المحاليل وفقا لعدد الآبار المراد تلطيخها ؛ مطلوب 200 ميكرولتر من المحلول في كل خطوة لبئر واحد. يتم توفير مراجع لجميع المنتجات التجارية في جدول المواد.- قم بإعداد محلول بارافورمالدهايد (PFA) بنسبة 4٪ تحت غطاء كيميائي بإضافة 5 مل من 32٪ PFA إلى 35 مل من PBS. تحضير 10 مل من القسامات وتخزينها في درجة حرارة -20 درجة مئوية.
تنبيه: قم دائما بالتلاعب ب PFA تحت الغطاء الكيميائي ، أثناء ارتداء قفازات النتريل. - قم بإعداد محلول 0.2٪ Triton X100-PBS ، عن طريق إضافة 2 ميكرولتر من Triton X100 إلى 1 مل من PBS مباشرة قبل الاستخدام. ابق في RT.
- تحضير 10٪ من محلول مصل الألبومين البقري (BSA) -PBS عن طريق إضافة 100 ملغ من BSA إلى 1 مل من PBS. ابق في RT.
- قم بإعداد محلول BSA-PBS بنسبة 1٪ عن طريق إضافة 10 مجم من BSA إلى 1 مل من PBS. ابق في RT.
- قم بإعداد محلول من الجسم المضاد الأولي للأوكلودين المخفف عند 1: 200 عن طريق إضافة 5 ميكرولتر من الجسم المضاد الأولي إلى 995 ميكرولتر من 1٪ PBS BSA. الحفاظ على الحل على الجليد.
- قم بإعداد محلول من الجسم المضاد الثانوي المخفف عند 1: 1000 عن طريق إضافة 1 ميكرولتر من الجسم المضاد الثانوي إلى 999 ميكرولتر من 1٪ BSA-PBS. الحفاظ على الحل على الجليد ، محمية من الضوء.
- تحضير محلول من phalloidin TRITC عند 10 ميكروغرام / مل عن طريق إضافة 10 ميكرولتر من TRITC عند 1 ملغ / مل إلى 990 ميكرولتر من PBS. الحفاظ على الجليد ، محمية من الضوء.
- قم بإعداد محلول بارافورمالدهايد (PFA) بنسبة 4٪ تحت غطاء كيميائي بإضافة 5 مل من 32٪ PFA إلى 35 مل من PBS. تحضير 10 مل من القسامات وتخزينها في درجة حرارة -20 درجة مئوية.
- تلطيخ مناعي
ملاحظة: ما لم يذكر خلاف ذلك ، يتم إجراء جميع الحضانات في RT ، تحت التحريك البطيء على منصة هزازة (30 دورة في الدقيقة). يتم إجراء التلوين المناعي مباشرة في إدراج ثقافة الخلية.- إزالة الوسط القاعدي والقمي. ضع اللوحة تحت الغطاء الكيميائي.
- اغسل الطبقات الأحادية مرتين باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
- ثبت الطبقة الأحادية للخلية ب 200 ميكرولتر من 4٪ PFA عند RT واحتضانها لمدة 20 دقيقة عند RT.
- اغسل الطبقات الأحادية مرتين باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
ملاحظة: بعد خطوات التثبيت والغسيل ، يمكن الاحتفاظ بالطبقة الأحادية عند 4 درجات مئوية في PBS لمدة 1 أسبوع. - قم بإزالة PBS ، وتخلل مع 200 ميكرولتر من 0.2٪ Triton X100-PBS ، واحتضانها لمدة 20 دقيقة.
- اغسل الطبقات الأحادية مرتين باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
- أضف 200 ميكرولتر من محلول الأجسام المضادة الأولية في 1٪ BSA-PBS واحتضانها طوال الليل عند 4 درجات مئوية ، تحت التحريك البطيء على منصة هزازة. قم بتضمين بئر تحكم سلبي عن طريق إضافة 1٪ فقط من BSA-PBS بدون الجسم المضاد الأساسي.
- اغسل الطبقة الأحادية ثلاث مرات باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
- أضف 200 ميكرولتر من الأجسام المضادة الثانوية في 1٪ BSA-PBS واحتضانها في RT لمدة 2 ساعة ، محمية من الضوء.
- اغسل الطبقة الأحادية ثلاث مرات باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
- أضف 200 ميكرولتر من phalloidin TRITC بمعدل 10 ميكروغرام / مل واحتضانها لمدة 10 دقائق.
- اغسل الطبقات الأحادية مرتين باستخدام 200 ميكرولتر من PBS في RT واحتضانها لمدة 5 دقائق.
- إزالة برنامج تلفزيوني وقطع الغشاء بمشرط.
- استعادة الغشاء مع زوج من ملاقط ووضعه على شريحة المجهر ، مع الجانب القمي متجها لأعلى.
- أضف 15 ميكرولتر من وسط التركيب المكمل ب DAPI عند 1: 1000 مباشرة على الغشاء. ضع غطاء وأغلق.
- يحفظ في درجة حرارة 4 درجات مئوية ، محميا من الضوء ، حتى التصوير.
النتائج
باتباع البروتوكول الموضح أعلاه ، يتم الحصول على الخبايا الظهارية من أمعاء الخنزير وحفظها بالتبريد للتخزين طويل الأجل في النيتروجين السائل (الشكل 1 والشكل 2 أ). بعد الذوبان ، يتم زرع الخلايا الجذعية القبو في ECM (الشكل 2B). عادة ما يتم فقد بنية القبو بعد هذه الخطوة ، بسبب تفكك بنية القبو في ECM. يمكن ملاحظة الكائنات العضوية في غضون 3-4 أيام ، ثم تنمو بسرعة وتطور الهياكل الناشئة (الشكل 2 ب). لقد نجحنا في الحصول على المواد العضوية بعد إذابة الخبايا المجمدة في >80٪ من المحاولات. بعد حوالي 10 أيام من ذوبان الجليد (وفقا لمعدل نمو المواد العضوية) ، يتم إجراء مرور من المواد العضوية لتوسيع الثقافة (الشكل 3). تنمو الكائنات العضوية بشكل أسرع بعد الانقسام ، وتقدم مورفولوجيات متنوعة ، مع بعض الكيسي وغالبية الكائنات العضوية الناشئة. من أجل الصيانة المثلى للثقافة ، يجب أن تقدم الكائنات العضوية المستخدمة للمرور تجويفا واضحا وفارغا وحواف محددة جيدا (أمثلة تشير إليها الأسهم الخضراء) مع عدم وجود حطام أسود في التجويف (يشار إليه بالأسهم الحمراء) ، كما لوحظ في الكائنات العضوية الناضجة (الشكل 3). وجدنا أن حطام الخلايا السوداء يبدأ في التراكم في حوالي اليوم 6 بعد المرور. وبالتالي ، يوصى بتقسيم أو تجميد المواد العضوية في اليوم 4-5 بعد المرور.
مرحلة نضج المواد العضوية هي أيضا نقطة مهمة في الحصول على أحاديات الطبقة الخلوية. المواد العضوية ذات النضج المتقدم (المشار إليها بوجود حطام الخلايا السوداء في التجويف) ليست مثالية للبذور أحادية الطبقة. عادة ما نفصل المواد العضوية ثلاثية الأبعاد بعد 4 أيام من المرور لجمع الخلايا لثقافة 2D. هناك حاجة إلى ما يقرب من بئر إلى ثلاثة آبار من المواد العضوية ثلاثية الأبعاد المزروعة في 3000 خلية لكل قبة 50 ميكرولتر من ECM لبذر ملحق مزرعة واحد مع 2.5 × 105 خلايا. تلتصق الخلايا وتشكل طبقة أحادية متقاربة بالكامل في غضون يوم واحد (الشكل 4 أ) ، وهو ما يؤكده ارتفاع TEER البالغ حوالي 700 Ω سم2 (الشكل 4 ب). ومع ذلك ، يصعب تصور حواف الخلية بواسطة الفحص المجهري برايت فيلد في هذه النقطة الزمنية المبكرة ، ربما بسبب انخفاض مستوى التمايز. يظل TEER مرتفعا لمدة 3 أيام (الشكل 4B).
يشير تلطيخ الأكتين إلى أن الجانب القمي للخلايا الظهارية موجه نحو التجويف في الكائنات العضوية ثلاثية الأبعاد (الشكل 5 أ). تشكل الخلايا العضوية المصنفة في ملحق المستزرع طبقة مفردة متقاربة من الخلايا الظهارية ، مع توجيه الجانب القمي نحو الجزء العلوي (الشكل 4B ، C). يكشف تلطيخ Occludin عن وجود تقاطعات ضيقة في الجانب القمي للخلايا الظهارية في المواد العضوية 3D وفي أحاديات الخلية (الشكل 5A-C).
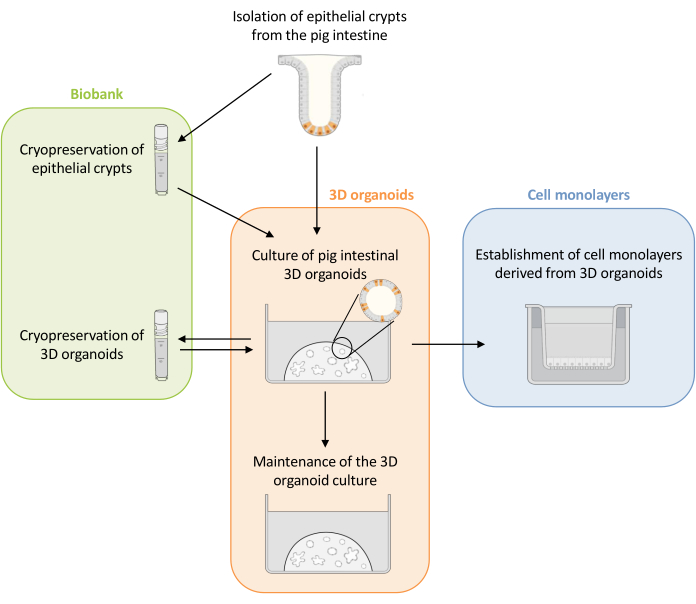
الشكل 1: تمثيل تخطيطي للطرق المستخدمة لاستزراع المواد العضوية ثلاثية الأبعاد وأحاديات الخلايا المشتقة من الكائنات العضوية. يتم عزل الخبايا الظهارية من الأمعاء الخنازير. يمكن استخدام هذه الخبايا على الفور لثقافة 3D organoids أو ii) تجميدها وتخزينها في بنك حيوي في النيتروجين السائل. يمكن إذابة الخبايا المحفوظة بالتبريد واستخدامها لثقافة المواد العضوية 3D. يمكن الحفاظ على ثقافة 3D العضوية مع تقسيم متتالي ، أو تجميدها وتخزينها في البنك الحيوي. يمكن الحصول على أحاديات الخلية من ثقافة 3D العضوية للسماح بالوصول إلى الجانب القمي للخلايا ودراسة وظيفة الحاجز الظهاري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
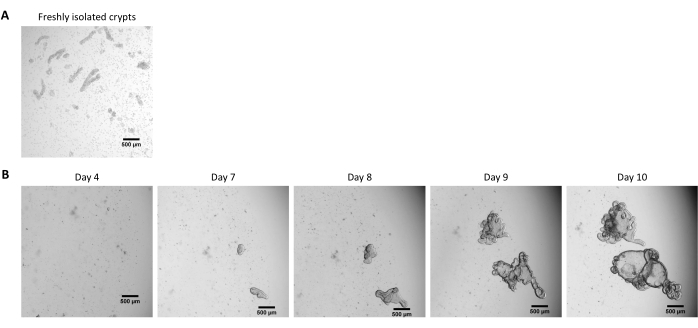
الشكل 2: ثقافة عضويات 3D معوية الخنازير من الخبايا الظهارية المحفوظة بالتبريد. (أ) صورة مجهرية تمثيلية لأقبية صائمية معزولة حديثا. (ب) صور مجهرية تمثيلية لعضويات 3D تم الحصول عليها بعد ذوبان الخبايا الصائمية. تم استزراع المواد العضوية في قبة 25 ميكرولتر من ECM في لوحة 48 بئر. يوضح الشكل صورا للعضويات ثلاثية الأبعاد في 4 و 7 و 8 و 9 و 10 أيام بعد البذر. يمثل شريط المقياس 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
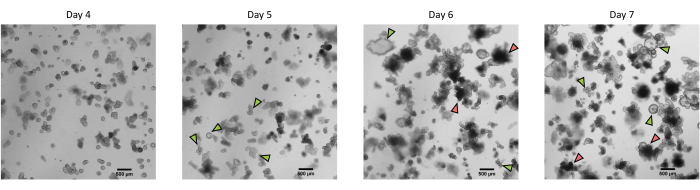
الشكل 3: مورفولوجيا الكائنات العضوية ثلاثية الأبعاد المعوية للخنزير المشتقة من الخبايا الظهارية المحفوظة بالتبريد بعد المقطع الأول. صور مجهرية تمثيلية تظهر تطور المواد العضوية المشتقة من أقبية الصائم المحفوظة بالتبريد بعد المقطع الأول من اليوم 4 إلى اليوم 7. تشير الأسهم الخضراء إلى عضويات واضحة مناسبة لمرور أو بذر الطبقات الأحادية. تشير الأسهم الحمراء إلى المواد العضوية الناضجة غير المناسبة لتقسيم أو بذر الطبقات الأحادية ؛ وبالتالي ، يجب استخدام الآبار قبل ظهور هذا المورفولوجيا. يمثل شريط المقياس 500 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: خصائص الخلايا أحادية الطبقات المشتقة من عضويات 3D المعوية الخنازير . (أ) صور مجهرية تمثيلية لمورفولوجيا أحادية الطبقة على مدار 3 أيام. تم زرع الخلايا العضوية الصائمية عند 2.5 × 105 خلايا في 0.33 سم2 إدراج زراعة الخلايا المغلفة بالكولاجين الرابع عند 50 نانوغرام / مل. يمثل شريط المقياس 500 ميكرومتر. (ب) المقاومة الكهربائية عبر الظهارة (TEER) للطبقات أحادية الخلية العضوية على مدار 3 أيام. تتوافق النقاط المتصلة بخط مع نفس البئر في أوقات مختلفة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
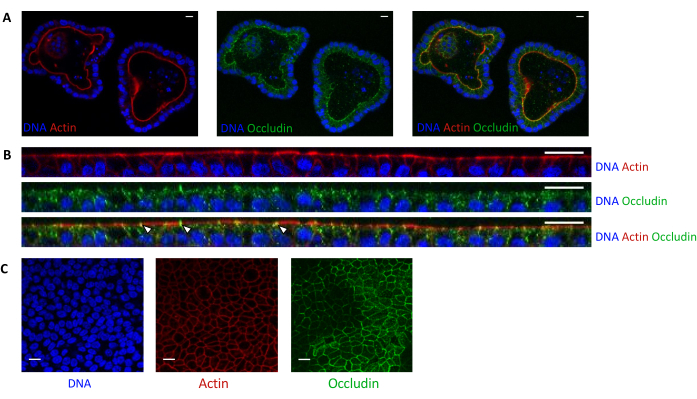
الشكل 5: تصوير عضويات الصائم الخنازير المستزرعة في 3D أو 2D. التصوير المجهري متحد البؤر ل (A) 3D organoids بعد 5 أيام من الانقسام و (B ، C) أحادي الطبقة العضوية للخلايا العضوية بعد 3 أيام من البذر (B: قسم XZ ؛ C: قسم XY). كان الحمض النووي (الأزرق) ملطخا ب DAPI. الأكتين (الأحمر) كان ملطخا بالقضيب. كان Occludin (الأخضر) ملطخا بجسم مضاد متعدد النسيلة. تشير الأسهم البيضاء إلى occludin المترجمة عند التقاطع الضيق. يمثل شريط المقياس 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يصف هذا البروتوكول طريقة تستخدم لحفظ الخبايا الظهارية بالتبريد من الأمعاء الصغيرة للتخزين طويل الأجل والثقافة اللاحقة للمواد العضوية 3D. يستخدم هذا البروتوكول محلول تجميد يحتوي على DMSO و FBS ومثبط Y27632 ROCK و DMEM والمضادات الحيوية. حصلت دراسة أخرى أجريت على الخنازير على عضويات من خبايا محفوظة بالتبريد في محلول تجميد مماثل ولكن بدون مثبط ROCK15. تم تضمين مثبط Y27632 ROCK لمنع موت الخلايا المبرمج والحفاظ على تجمع الخلايا الجذعية لأنه بعد ذوبان الجليد ، يتم فصل خلايا القبو الظهارية ، مما قد يؤدي إلى موت الخلايا ("anoikis") 27،28. ومن المثير للاهتمام أنه تم الحصول على الخيول المعوية من الخبايا الظهارية المجمدة في وسط استزراع يحتوي فقط على DMEM و DMSO16. لم يتم اختبار هذه الطريقة البسيطة للخبايا الظهارية الخنازير حتى الآن. تم نشر طرق أخرى لزراعة الكائنات العضوية البشرية والخنازير من الأنسجة المجمدة أو الخزعات بدلا من الخبايا الظهارية 4,17. ميزة هذه الطريقة هي القدرة على حفظ الأنسجة المعوية بالتبريد مباشرة دون إجراء إجراء عزل القبو ، الأمر الذي يتطلب وقتا ومعدات مختبرية. قد يكون هذا مناسبا عندما يتعين جمع الأنسجة بعيدا عن المختبر. ومع ذلك ، عند عزل الخبايا مباشرة بعد الذبح ، يمكن معالجة أجزاء كبيرة من الأمعاء للحصول على عدد كبير جدا من الخبايا ، وهذا ليس هو الحال عند البدء من شظايا الأنسجة الصغيرة المجمدة. بعد ذوبان الخبايا الظهارية ، لوحظت المواد العضوية من 3-4 أيام بعد البذر وانقسامها بعد 10 أيام. هذا معدل نمو أبطأ مما كان عليه عند بدء الاستزراع من الخبايا الظهارية الطازجة ، والتي تم الحصول على المواد العضوية من اليوم الأول بعد البذر ، ويمكن عادة تقسيمها في حوالي اليوم 511. كما أبلغ خليل وآخرون عن تأخر نمو معوية الخنازير عند البدء من الخباياالمجمدة 15 ، مما يشير إلى أن الخلايا الجذعية قد تتطلب وقتا لاستعادة قدرتها على التكاثر. حصلنا أيضا على عدد أقل من المواد العضوية عند البدء من الخبايا المجمدة مقارنة بالخبايا الطازجة ، والتي قد تكون بسبب موت الخلايا الجذعية أثناء عملية التجميد. في بعض محاولات ذوبان الخبايا (<20٪) ، لم نحصل على مواد عضوية من الخبايا المجمدة ، ربما بسبب إجراء الحفظ بالتبريد دون المستوى الأمثل (على سبيل المثال ، تأخر التجميد بعد عزل القبو ربما أكثر من 1 ساعة). وبالتالي ، نوصي بإبقاء الخبايا على الجليد حتى العد ، وتجميدها في أسرع وقت ممكن.
بالنسبة إلى المواد العضوية 3D ، اخترنا استخدام وسيط ثقافة عضوي تجاري مصمم للبشر. في الواقع ، أظهرت التقارير السابقة أن الكائنات العضوية المعوية للخنازير تنمو بكفاءة مع هذه الوسيلة8،11،14،19،25،26،29،30. من المهم أن يكون وسيط الاستزراع هذا جاهزا للاستخدام وأن يكون له تركيز موحد لعوامل النمو داخل الدفعة. ومع ذلك ، فإن هذه الوسيلة الثقافية مكلفة ، وتكوينها غير معلن ، وبالتالي لا يمكن تعديل تكوينها. في المقابل ، قامت دراسات أخرى بزراعة عضويات معوية للخنزير في وسائط مخصصة تحتوي على مثبطات دوائية و / أو عامل نمو مؤتلف و / أو وسائط مشروطة5،6،7،21. على الرغم من أن هذه الطريقة مرنة للغاية وأرخص ، إلا أنها تستغرق وقتا طويلا لإنتاج وسائط مكيفة وقد تفتقر إلى قابلية التكرار بسبب التباين المحتمل في تركيز عوامل النمو في الوسائط المكيفة. وبالتالي ، يجب التحقق من جودة كل دفعة من الوسائط المكيفة عن طريق قياس نمو الأعضاء أو التعبير الجيني للعلامة31.
أظهرت دراسة أن عضويات الخنازير الصائمية المستزرعة في نفس وسط الاستزراع العضوي التجاري المستخدم هنا نمت بشكل أسرع وبدت أقل تمايزا ، مقارنة بالكائنات المعوية المستزرعة بوسائط تحتوي على عامل نمو مؤتلف و / أو وسائط مشروطة23. تسهل الحالة التكاثرية العالية ثقافة المواد العضوية 3D ، ولكنها قد تتطلب إحداث تمايز لتكون أكثر تمثيلا للخصائص الفسيولوجية المعوية. في هذا البروتوكول ، لمرور المواد العضوية 3D ، يتم فصل الخلايا بالكامل للعد ، مما يسمح بالتحكم في عدد الخلايا المصنفة في ECM. هذا يزيد من استنساخ النمط الظاهري للعضويات ، والذي يتأثر بشدة بكثافتها. علاوة على ذلك ، فإن عد الخلايا يتجنب الحصول على ثقافة منخفضة للغاية أو مكتظة ، مما يتطلب تكييف جدول الثقافة. أعدت معظم الدراسات الأخرى شظايا عضوية غير منفصلة تماما إلى خلايا مفردة ، واستخدمت نسبة تخفيف للتمرير. هذه الطريقة أكثر وضوحا ، ولكنها قد تحفز التباين وفقا للكثافة العضوية للثقافة.
بالنسبة للثقافة في الطبقات الأحادية ، يتم زرع الخلايا العضوية في إدخالات الثقافة المغلفة مسبقا بطبقة رقيقة من ECM ، والتي تسمح بربط الخلايا ولكنها تتجنب نمو المواد العضوية في 3D. استخدم هذا البروتوكول الكولاجين من النوع الرابع كبروتين ECM ، كما هو موضح سابقا في الخنازير23. استخدمت دراسات أخرى مع أحاديات عضوية الخنازير نفس ECM المشتق من الورم المستخدم هنا لثقافة المواد العضوية ثلاثية الأبعاد6،8،9،21،25،30. ميزة استخدام الكولاجين هي القدرة على توحيد تركيز البروتين بتركيبة محددة تماما ، وهذا ليس هو الحال في ECM المشتق من الورم. تتمثل إحدى الخطوات الحاسمة لنجاح ثقافة أحاديات الطبقة الخلوية في الانتباه إلى المظهر المرئي للعضويات 3D السلائف ، والتي يجب أن يكون لها حواف محددة جيدا وتجويف فارغ بدون حطام أسود. في الواقع ، المواد العضوية ذات مستوى النضج العالي ومعدل التكاثر المنخفض ليست مصدرا مناسبا للخلايا لثقافة 2D. وبالتالي ، فإن توقيت تفكك المواد العضوية 3D إلى خلايا مفردة أمر بالغ الأهمية لنجاح هذه الخطوة.
تسمح ثقافة 2D monolayers من الخلايا المفردة بتوحيد عدد الخلايا المصنفة ، وهو أمر أكثر صعوبة عند البدء من شظايا عضوية ، كما هو الحال في بعض الطرق الأخرى. لقد زرعنا 7.6 × 10 5 خلايا لكل سم 2 ، وهي نسبة عالية مقارنة بمعظم الدراسات الأخرى 21،22،23 في الخنازير التي استخدمت كثافة خلايا أقل ، تتراوح من 0.25 × 10 5 خلايا لكل سم 2 إلى 1.78 × 10 5 خلايا لكل سم 2. يشكل شرط وجود عدد كبير من الخلايا العضوية قيدا على هذا البروتوكول ، لكنه سمح لنا بالحصول بسرعة على طبقة أحادية متقاربة ، تغطي بالكامل إدراج الثقافة بعد يوم 1. في المقابل ، حصل Vermeire et al.23 على التقاء بعد 4-7 أيام بكثافة أقل من الخلايا المصنفة (من 0.25 × 105 خلايا / سم 2 إلى 0.4 × 105 خلايا / سم2). استخدمت بعض الدراسات أيضا أحاديات الخلايا العضوية للخنزير التي لم تغطي سطح الثقافة بالكامل للعدوى بالفيروسات 8,30. في هذه الظروف ، يمكن الوصول إلى الجانب القمي للخلايا الظهارية للعلاج ، ولكن هناك حاجة إلى طبقات أحادية متقاربة تماما إذا كان الهدف هو دراسة امتصاص المغذيات أو نفاذية الظهارة.
بالنسبة للخلايا العضوية أحادية الطبقة ، تم استخدام وسط استزراع عضوي تجاري مكمل بنسبة 20٪ FBS ، بناء على دراسة حديثة على الطبقات الأحادية المشتقة من الأمعاءالبقري 32. في اختباراتنا، كانت المكملات التي تحتوي على 20٪ FBS ضرورية للحصول على طبقة أحادية متقاربة بالكامل، ربما بسبب متطلبات عامل النمو المرتفع. على العكس من ذلك ، أنشأت دراسات أخرى تستخدم نفس الوسيط التجاري طبقة أحادية بدون FBSإضافي 8،25،30 ، ولكن دون الوصول إلى التقاء كامل. استخدمت دراسات أخرى أيضا مكملات تحتوي على 20٪ FBS في وسط مخصص لثقافة أحاديات الخلايا العضوية للخنزير21,22. في تجاربنا ، يكون TEER مرتفعا بعد يوم واحد من البذر (حوالي 700 Ω سم 2) ، ويظل مرتفعا حتى اليوم الثالث (حوالي 1500 Ω سم2 ؛ وهذا يتوافق مع تكوين تقاطعات ضيقة ، كما يتضح من تعبير الإطباق. حصل Van der Hee et al. على قيم TEER مماثلة تزيد عن 72 ساعة لأحاديات الطبقة أحادية الخلايا العضوية الصائمية21. كما أظهروا أنه يمكن الحفاظ على الطبقات الأحادية حتى اليوم 12-15 مع تغييرات الوسائط اليومية. في المقابل ، أبلغت دراسات أخرى عن قيم TEER أقل بكثير (حوالي 200 Ω · سم2) للطبقة الأحادية للخلايا العضويةالخنازير 6,22. قد تكون هذه الاختلافات بين الدراسات مرتبطة بجزء القناة الهضمية الذي تمت دراسته أو بالوسائط المستخدمة التي تؤثر على التمايز الظهاري.
في الختام ، فإن البروتوكول أعلاه لزراعة عضويات 3D المعوية للخنزير من الخبايا الظهارية المجمدة يسهل تنظيم عمل الثقافة. يقلل من الحاجة إلى الحصول على الأنسجة الطازجة من الحيوانات الحية. نوضح أيضا كيفية إنشاء أحاديات الخلايا المتقاربة بالكامل المشتقة من عضويات الخنازير في أقل من 3 أيام. وبالتالي ، يمكن أن تكون بروتوكولاتنا موارد مفيدة للعلماء الذين يدرسون ظهارة معوية الخنازير للبحوث البيطرية أو الطبية الحيوية.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل معهد كارنو فرنسا فيوتشر إليفاج ("مشروع OrganoPig") ومن قبل INRAE HOLOFLUX ("مشروع Holopig"). المؤلفون ممتنون لمرافق Genotoul الأساسية (TRI). نحن نقدر كريستيل كنودسن (GenPhySE ، INRAE ، تولوز) للتدقيق اللغوي الدقيق.
Materials
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer’s recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
References
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465(2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368(2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682(2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375(2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031(2022).
- Zhu, M., Qin, Y. -C., Gao, C. -Q., Yan, H. -C., Wang, X. -Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143(2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94(2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821(2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011(2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196(2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394(2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430(2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved