Method Article
Kultivierung von Ferkel-Darm-3D-Organoiden aus kryokonservierten Epithelkrypten und Etablierung von Zellmonoschichten
In diesem Artikel
Zusammenfassung
In dieser Arbeit beschreiben wir ein Protokoll zur Kultivierung von 3D-Organoiden aus kryokonservierten Epithelkryptionen. Wir beschreiben auch eine Methode zur Etablierung von Zellmonolagen, die von 3D-Organoiden abgeleitet sind und den Zugang zur apikalen Seite von Epithelzellen ermöglichen.
Zusammenfassung
Darmorganoide werden zunehmend verwendet, um das Darmepithel für die Modellierung von Verdauungskrankheiten zu untersuchen oder um Wechselwirkungen mit Medikamenten, Nährstoffen, Metaboliten, Krankheitserregern und der Mikrobiota zu untersuchen. Methoden zur Kultivierung von Darmorganoiden stehen jetzt für mehrere Spezies zur Verfügung, darunter auch Schweine, eine Spezies, die sowohl als Nutztier als auch als translationales Modell für den Menschen von großem Interesse ist, z. B. zur Untersuchung von Zoonosen. Hier geben wir eine ausführliche Beschreibung eines Verfahrens, das zur Kultivierung von 3D-Organoiden aus gefrorenen Epithelkrypten verwendet wird. Das Protokoll beschreibt die Kryokonservierung von Epithelkrypten aus dem Schweinedarm und die anschließenden Verfahren zur Kultivierung von 3D-Darmorganoiden. Die Hauptvorteile dieser Methode sind (i) die zeitliche Dissoziation der Isolierung von Krypten aus der Kultur von 3D-Organoiden, (ii) die Präparation großer Bestände an kryokonservierten Krypten, die aus mehreren Darmsegmenten und von mehreren Tieren gleichzeitig stammen, und damit (iii) die Verringerung der Notwendigkeit, frisches Gewebe von lebenden Tieren zu beproben. Wir beschreiben auch ein Protokoll zur Etablierung von Zellmonolayern, die von 3D-Organoiden abgeleitet sind, um den Zugang zur apikalen Seite von Epithelzellen zu ermöglichen, die der Ort der Wechselwirkungen mit Nährstoffen, Mikroben oder Medikamenten ist. Insgesamt sind die hier beschriebenen Protokolle eine nützliche Ressource für die Untersuchung des Darmepithels von Schweinen in der veterinärmedizinischen und biomedizinischen Forschung.
Einleitung
Das Darmepithel besteht aus einer Monoschicht von Zellen, die die Verdauungsschleimhaut an der Grenzfläche zur luminalen Umgebung bedecken. Diese Position ist mit verschiedenen Funktionen verbunden, wie z. B. der Nährstoffaufnahme und der Barrierefunktion, die durch das Vorhandensein von Stammzellen und mehreren differenzierten Epithelzelltypen (absorbierende, enteroendokrine, Paneth- und Becherzellen) unterstützt werden1. Immortalisierte Zelllinien, die traditionell zur Untersuchung von Epithelzellen verwendet werden, weisen große Einschränkungen auf, da sie nicht die zelluläre Komplexität des Darmepithels widerspiegeln und genomische Anomalien aufweisen2. Die Entwicklung von dreidimensionalen (3D) Organoiden durch Sato et al.3 lieferte ein neues Modell zur Untersuchung des Darmepithels mit einer verbesserten physiologischen Relevanz. Tatsächlich werden Darmorganoide aus nicht transformierten Stammzellen gewonnen, bestehen aus mehreren Zelltypen und rekapitulieren die Funktionalität des Darmepithels. Darmorganoide werden zunehmend verwendet, um die Entwicklung und Funktion des Darmepithels und seine Wechselwirkungen mit Krankheitserregern, Nährstoffen, Toxinen, Medikamenten, der Mikrobiota und ihren Metaboliten zu verstehen2.
Ursprünglich für Menschen und Mäuse entwickelt, wurden die Methoden zur Kultivierung von Darmorganoiden in jüngster Zeit auch auf andere Spezies übertragen, darunter Schweine4. Gonzales et al.5 waren die ersten, die Schweineorganoide aus dem Jejunum kultivierten; Seitdem wurden porcine Organoide für andere Darmsegmente (Zwölffingerdarm, Ileum und Dickdarm) beschrieben6,7,8, und es wurde gezeigt, dass sie einen ortsspezifischen Phänotyp beibehalten 9,10,11. 3D-Organoide aus Schweinedarm werden heute häufig verwendet, um die Wirkung von Nährstoffen 12,13 oder Darminfektionen 6,8,14 zu untersuchen.
Die meisten Studien haben die Kultivierung von Darmorganoiden ausgehend von frisch isolierten Epithelkrypten beschrieben. Dies ist jedoch aus logistischen Gründen nicht immer möglich, insbesondere bei der Arbeit mit großen Tieren wie Schweinen. In der Tat können sich Tiereinrichtungen für Schweine weit vom Labor entfernt befinden, in dem Organoide kultiviert werden, was die Arbeitsorganisation erschwert. Darüber hinaus ist die Organoidkultur zeitaufwändig; Daher ist es nicht praktikabel, mehrere Organoidlinien gleichzeitig zu züchten, z. B. aus verschiedenen Darmsegmenten oder mehreren Tieren. Um diese Probleme zu umgehen, wurden in einigen Studien an Menschen, Pferden und Schweinen Methoden zur Kultivierung von Organoiden aus gefrorenem Darmgewebe (oder Biopsien) oder aus isolierten Epithelkryptenbeschrieben 4,15,16,17. Diese Methoden ermöglichen die Kryokonservierung von Darmepithelstammzellen aus mehreren Darmsegmenten eines einzigen Tieres, die dann bei Bedarf zur Züchtung von Organoiden verwendet werden können. Darüber hinaus ermöglicht dies eine starke Reduzierung der Anzahl lebender Tiere, die als Spender von Stammzellen verwendet werden, da große Bestände an kryokonservierten Krypten angelegt werden können (Prinzipien von 3R). Ein weiterer Vorteil dieser Methode besteht darin, dass intestinale Organoide nur von Tieren von Interesse gezüchtet werden, nachdem phänotypische oder genotypische Ergebnisse erzielt wurden, was sehr kostengünstig ist.
In vivo sind die Darmepithelzellen polarisiert, wobei die apikale Seite zum Lumen gerichtet ist. In vitro ist bei 3D-Organoiden die apikale Seite der Epithelzellen ebenfalls dem Lumen zugewandt (d. h. innerhalb der Organoide)4. Diese Organisation verhindert den Zugang zur apikalen Seite, was ein Problem darstellt, wenn die Auswirkungen von luminalen Komponenten (z. B. Nährstoffe, Mikroben, Metaboliten) auf Epithelzellen untersucht werden. Um diesen Nachteil zu umgehen, wurden verschiedene Methoden entwickelt, wie z. B. die Kultur von Organoidzellen als 2D-Monolayer, die Mikroinjektion und die Polaritätsumkehr ("apikale Organoide")18,19. Die Kultivierung von Organoidzell-Monoschichten entwickelt sich zum effizientesten und kontrollierbarsten System. Das Prinzip besteht darin, 3D-Organoide in einzelne Zellen zu dissoziieren und sie auf ein Zellkulturgefäß zu legen, das zuvor mit einer dünnen Schicht extrazellulärer Matrix (EZM) beschichtet war20. Unter diesen Kulturbedingungen ist die apikale Seite der Epithelzellen nach oben gerichtet und somit für experimentelle Behandlungen zugänglich20. Die Kultivierung von Organoidzell-Monoschichten wurde kürzlich für den Schweinedarm adaptiert21,22; Zellmonoschichten, die aus Schweine-3D-Organoiden gewonnen wurden, wurden für zahlreiche Anwendungen verwendet, darunter die Untersuchung von enterischen Infektionen 6,23,24,25, des Transports von Nährstoffen 9 und der Modellierung von Verdauungskrankheiten 26.
In dieser Arbeit wird zunächst ein detailliertes Protokoll für die Kultivierung und Konservierung von 3D-Organoiden aus dem Darm von Schweinen vorgestellt, die aus kryokonservierten Epithelkrypten gewonnen wurden (Abbildung 1). Anschließend wird ein Protokoll zur Etablierung von Zellmonoschichten aus 3D-Organoiden im Darm von Schweinen beschrieben. Die hier beschriebenen Methoden bieten experimentelle Werkzeuge, mit denen das Darmepithel von Schweinen auf Nährstofftransport, Barrierefunktion und Wirt-Mikroorganismus-Interaktionen untersucht werden kann.
Protokoll
Dieses Protokoll wurde von der lokalen Ethikkommission (N°TOXCOM/0136/PP) in Übereinstimmung mit der europäischen Richtlinie zum Schutz von Tieren, die für wissenschaftliche Zwecke verwendet werden (2010/63/EU), genehmigt. Dieses Protokoll wird beispielhaft für das Jejunum beschrieben, kann aber für jedes Segment des Dünn- und Dickdarms (Zwölffingerdarm, Jejunum, Ileum, Dickdarm) verwendet werden.
1. Isolierung von Epithelkrypten aus dem Ferkeldarm
HINWEIS: Bereiten Sie einen Vorrat an vollständigem Dulbecco's Modified Eagle Medium (DMEMc) mit DMEM vor, ergänzt mit 10 % fötalem Kälberserum (FBS) und 1 % Penicillin-Streptomycin (P/S). Bereiten Sie 50-ml-Aliquots vor und lagern Sie sie 1 Monat lang bei 4 °C.
- Vorbereitung der Lösungen (am Tag der Krypta-Isolierung)
- Die Dissoziationslösung, die phosphatgepufferte Kochsalzlösung (PBS), 3 mM Dithiothreitol (DTT), 9 mM Ethylendiamintetraessigsäure (EDTA), 10 μM Y27632 ROCK-Inhibitor und 1 % Penicillin-Streptomycin (P/S) enthält, wird hergestellt und auf Eis gelagert.
- Die Gefrierlösung, die DMEMc, 10 % FBS, 10 % Dimethylsulfoxid (DMSO) und 10 μM Y27632 ROCK-Inhibitor enthält, wird vorbereitet und auf Eis gelagert (die endgültige FBS-Konzentration beträgt 18 %).
- Bereiten Sie die Transportlösung vor, die kaltes PBS enthält, das mit 1 % P/S angereichert ist, und lagern Sie es auf Eis.
- Isolierung von Epithelkrypten
- Schlachtung eines Ferkels durch Elektronarkose mit anschließender Ausblutung.
- Öffnen Sie unmittelbar nach der Schlachtung den Bauch des Ferkels mit einem Skalpell und entfernen Sie den gesamten Darm.
- Sammeln Sie ca. 2 cm eines Darmsegments und lagern Sie es in kalter Transportlösung. Halten Sie das Segment bis zur Isolation der Krypta auf Eis (bis zu 2 Stunden).
- Legen Sie das Taschentuch in eine Petrischale. Öffnen Sie den Darmabschnitt in Längsrichtung und waschen Sie das Gewebe vorsichtig in kaltem PBS, das mit 1% P/S ergänzt wird, um den Darminhalt zu entfernen.
- Übertragen Sie das Gewebe in eine neue Petrischale, die mit 10 ml kaltem PBS gefüllt ist, ergänzt mit 1 % P/S.
- Halten Sie das Taschentuch mit einer Pinzette fest und entfernen Sie die Zotten und den restlichen Schleim, indem Sie mit einem Objektträger abkratzen.
HINWEIS: Die Entfernung der Zotten (der zungenförmigen Struktur) kann durch mikroskopische Betrachtung des Überstandes überprüft werden. - Das Gewebe wird in ein konisches 15-ml-Röhrchen mit 5 ml eiskalter Dissoziationslösung überführt und 30 Minuten lang bei Raumtemperatur (RT) auf einem rotierenden Schüttler (15 U/min) inkubiert.
- Übertragen Sie das Gewebe in eine neue Petrischale und fügen Sie 10 ml kaltes PBS hinzu, ergänzt mit 1% P/S.
- Isolieren Sie die Krypten mechanisch, indem Sie die Schleimhaut mit einem Objektträger fest abkratzen.
Anmerkungen: Überprüfen Sie unter dem Mikroskop das Vorhandensein von Epithelkrypten in PBS (Abbildung 2A). - Die Kryptenlösung wird mit einer serologischen Pipette abgesaugt und durch ein 100-μm-Zellsieb in einem konischen 50-ml-Röhrchen filtriert.
- Pipettieren Sie 10 μl der Lösung und überprüfen Sie das Vorhandensein von Krypten unter einem Mikroskop. Bei 300 x g für 5 min bei 4 °C zentrifugieren.
- Entsorgen Sie den Überstand unter einer sterilen Biosicherheitswerkbank und resuspendieren Sie das Kryptenpellet in 10 ml kaltem DMEMc, ergänzt mit 10 μM Y27632 ROCK-Inhibitor.
- Pipettieren Sie 10 μl der Kryptenlösung in eine 48-Well-Platte. Zählen Sie die Anzahl der Krypten manuell unter einem Mikroskop mit einer 10-fachen Vergrößerung und berechnen Sie die Konzentration der Krypten pro ml Lösung.
HINWEIS: Die isolierten Krypten können direkt zur Kultivierung von Darmorganoiden verwendet werden. Oft ist es jedoch bequemer, eine große Menge Krypten von jedem Ferkel zu kryokonservieren und sie später für die Organoidkultur zu verwenden.
- Einfrieren von Epithelkrypten
- Übertragen Sie ein Volumen, das 900 Krypten entspricht, in ein konisches 15-ml-Röhrchen. Bei 300 x g für 5 min bei 4 °C zentrifugieren.
- Verwerfen Sie den Überstand und resuspendieren Sie das Kryptenpellet in 1 ml der Gefrierlösung. In ein Kryoröhrchen umfüllen und die Durchstechflasche in einen Behälter zum Einfrieren der Zellen geben.
- Lagern Sie den Gefrierbehälter der Zelle 24 h bei -80 °C und überführen Sie die Fläschchen dann zur Langzeitlagerung in flüssigen Stickstoff.
2. Etablierung von 3D-Organoiden aus gefrorenen Epithelkrypten im Ferkeldarm
HINWEIS: 3D-Organoide aus dem Darm von Ferkeln werden in einem kommerziellen Nährmedium kultiviert, das für das Wachstum menschlicher Organoide formuliert ist, mit 1 % P/S und 100 μg/ml eines antimikrobiellen Wirkstoffs für Primärzellen ergänzt und bis zu 1 Woche bei 4 °C gelagert. Eine aus dem Tumor stammende extrazelluläre Matrix (EZM) wird für die Kultivierung von 3D-Organoiden verwendet. Alle Referenzen kommerzieller Produkte sind in der Materialtabelle aufgeführt.
- Vorbereitung der Materialien
- Platzieren Sie die Pipettenspitzen bei -20 °C (mindestens über Nacht).
- Die gefrorenen Aliquots des ECM (500 μL) mindestens 1 h vorher bei 4 °C platzieren.
- Eine 48-Well-Platte in einem Inkubator mit 37 °C und 5 % CO2 vorwärmen.
- Platzieren Sie das Nährmedium bei RT.
- Ein Wasserbad auf 37 °C vorwärmen.
- Stellen Sie einen kleinen Eiskübel unter aseptischen Bedingungen unter die Haube.
- Auftauen gefrorener Epithelkrypten
- Tauen Sie ein Fläschchen mit 900 gefrorenen Krypten schnell im Wasserbad bei 37 °C (weniger als 5 Minuten) auf.
- Übertragen Sie die Kryptenlösung in ein konisches 15-ml-Röhrchen.
- Bei 300 x g für 5 min bei RT zentrifugieren. Entfernen Sie den Überstand
- Fügen Sie 150 μl des ECM mit gekühlten Spitzen hinzu, um eine Endkonzentration von 150 Krypten pro 25 μl EZM zu erhalten. Pipettieren Sie 10 Mal auf und ab, um eine homogene Suspension der Krypten im ECM zu erhalten.
Anmerkungen: Halten Sie das ECM immer auf Eis, um eine Polymerisation zu vermeiden. Verwenden Sie immer vorgekühlte Pipettenspitzen bei -20 °C, um das ECM zu manipulieren. Pipettieren Sie langsam, um Luftblasen im Motorsteuergerät (ECM) zu vermeiden. In diesem Schritt wird ein unverdünntes ECM verwendet, um zu verhindern, dass die kleinen Tropfen kollabieren. - Säen Sie sechs Vertiefungen mit einem 25-μl-Tropfen pro Vertiefung mit gekühlten Spitzen in einer vorgewärmten 48-Well-Platte.
Anmerkungen: Halten Sie die Spitze senkrecht, in der Mitte der Vertiefung, und pipettieren Sie langsam, ohne Luft zuzuführen, um eine Kuppel zu erhalten. Hier werden 48-Well-Platten verwendet, da die Organoidzahl in der Regel niedrig ist, wenn man von gefrorenen Krypten ausgeht. - 30 min in einem 37 °C, 5% CO2 -Inkubator zur Polymerisation der ECM inkubieren.
- Fügen Sie 250 μl pro Vertiefung des Nährmediums bei RT hinzu. Inkubieren Sie in einem Inkubator mit 37 °C und 5 % CO 2 und wechseln Sie das Nährmedium alle2-3 Tage
HINWEIS: Die Krypten sind nach dem Auftauen in der Regel nicht sichtbar, und die meisten Zellen sind in der EZM dissoziiert (Abbildung 2B).
3. Passage von 3D-Organoiden aus dem Ferkeldarm, die aus gefrorenen Krypten gewonnen wurden
HINWEIS: Die Zeit, um Organoide aus gefrorenen Krypten zu gewinnen, ist in der Regel länger als bei der Entnahme aus frischen Krypten. Organoide sind in der Regel 10 Tage nach dem Auftauen bereit für die Spaltung (Abbildung 2B).
- Vorbereitung der Materialien
- Die gefrorenen Aliquots des ECM (500 μL) bei 4 °C für mindestens 1 h aufstellen.
- Die 24-Well-Platten auf 37 °C vorwärmen.
- Das PBS und das mit 10 μM Y27632 ROCK-Inhibitor ergänzte Enzymdissoziationsreagenz werden in einem Wasserbad bei 37 °C vorgewärmt.
- Platzieren Sie das Nährmedium bei RT.
- Stellen Sie einen kleinen Eiskübel unter aseptischen Bedingungen unter die Haube.
- Passage von 3D-Organoiden, die aus gefrorenen Krypten gewonnen wurden
- Entfernen Sie die Nährmedien und waschen Sie sie mit 250 μl vorgewärmtem PBS bei 37 °C.
- 250 μl vorgewärmtes Enzymdissoziationsreagenz ergänzt mit 10 μM Y27632 ROCK-Inhibitor bei 37 °C in jede Vertiefung geben.
HINWEIS: Aufgrund der geringen Anzahl von Organoiden erfolgt die Dissoziation der Organoide direkt in jeder Vertiefung. - Lösen Sie die Organoide im ECM ab, indem Sie sie mit einer P1000-Pipette abkratzen, und homogenisieren Sie sie vorsichtig durch fünfmaliges Pipettieren.
- 5 min in einem Inkubator mit 5 % CO2 -Temperatur bei 37 °C inkubieren. Dissoziieren Sie die Zellen, indem Sie mit einer P1000-Pipette 10 Mal auf und ab pipettieren.
HINWEIS: Ziel ist es, isolierte Zellen oder kleine Zellcluster (<10 Zellen) zu erhalten. Überprüfen Sie die Dissoziation unter dem Mikroskop. Wenn immer noch große Fragmente von Organoiden beobachtet werden, wiederholen Sie Schritt 3.2.4. - Geben Sie 500 μl DMEMc in jede Vertiefung, die dissoziierte Zellen enthält, und sammeln Sie bis zu 12 Vertiefungen in einem konischen 15-ml-Röhrchen mit 3 ml kaltem DMEMc.
- Bei 500 x g für 5 min bei 4 °C zentrifugieren. Verwerfen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml kaltem DMEMc.
- Zählen Sie die Zellen mit einer Verdünnung von 1:2 in Trypanblau mit einem Zellzähler.
HINWEIS: Der automatische Zellzähler kann die Zellen innerhalb kleiner Cluster zählen, falls vorhanden. - Zentrifugieren Sie das erforderliche Volumen der Zelllösung, um 3.000 lebende Zellen pro Kuppel (eine Kuppel pro Vertiefung der 24-Well-Platte) bei 500 x g für 5 min bei 4 °C zu erhalten.
- Resuspendieren Sie die Zellen mit 17 μl kaltem DMEMc pro 3.000 lebende Zellen auf Eis. Stellen Sie die Lautstärke auf die erforderliche Anzahl von Vertiefungen ein.
- Fügen Sie langsam 33 μl kalte ECM mit gekühlten Spitzen pro 3.000 lebende Zellen hinzu und homogenisieren Sie auf Eis, ohne Blasen zu bilden. Stellen Sie die Lautstärke auf die erforderliche Anzahl von Vertiefungen ein.
Anmerkungen: Die Zellen werden in einer Lösung, die 1/3 DMEMc und 2/3 ECM enthält, resuspendiert. Für jede Kuppel werden 50 μL dieser Lösung benötigt. Verdünntes ECM ist billiger und einfacher zu pipettieren. - Die Vertiefungen werden mit 50 μl der ECM-Zellsuspension pro Vertiefung mit gekühlten Spitzen in einer vorgewärmten 24-Well-Platte besät.
- 30 min in einem 37 °C, 5% CO2 -Inkubator zur Polymerisation der ECM inkubieren.
- Fügen Sie 500 μl des Nährmediums pro Vertiefung hinzu. Inkubieren Sie in einem 37 °C, 5% CO 2 -Inkubator und wechseln Sie das Nährmedium alle2-3 Tage
HINWEIS: Die Organoide können entweder direkt für i) Experimente, ii) Aufrechterhaltung der 3D-Organoidkultur, iii) Einfrieren oder iv) Aussaat der Organoidzell-Monoschichten verwendet werden (Abbildung 1). Überprüfen Sie das Wachstum der Organoide täglich mit einem Mikroskop, um den optimalen Zeitpunkt für die Spaltung der Organoide zu wählen. Die Organoide müssen ein klares und leeres Lumen und gut definierte Ränder haben. Reife Organoide mit schwarzen Ablagerungen im Lumen sollten nicht zur Spaltung verwendet werden (Abbildung 3).
4. Pflege der Organoidkultur in 3D
Anmerkungen: Für die Durchlässigkeit sollten Organoide mit einem leeren Lumen klar erscheinen. Schwarze Trümmer erscheinen etwa 5 Tage nach der Teilung im Lumen und weisen auf das Vorhandensein abgestorbener Zellen hin. Die Begrenzung der Anzahl der toten Zellen zum Zeitpunkt der Passage ist für eine optimale Aufrechterhaltung der Kultur vorzuziehen. Der Zeitplan sollte daher angepasst werden, um das Erreichen dieses Reifegrades zu vermeiden.
- Aufbereitung des Materials
- Die Aliquots des ECM (500 μL) zum Auftauen mindestens 1 h bei 4 °C auftauen.
- Eine 24-Well-Platte auf 37 °C vorwärmen.
- Das mit 10 μM Y27632 ROCK-Inhibitor versetzte Enzymdissoziationsreagenz wird im Wasserbad bei 37 °C vorgewärmt.
- Platzieren Sie das Nährmedium bei RT.
- Stellen Sie einen kleinen Eiskübel unter aseptischen Bedingungen unter die Haube.
- Passage von intestinalen 3D-Organoiden
- Lösen Sie die Organoide mit dem ECM, indem Sie sie mit einer P1000-Pipette abkratzen. Durch Pipettieren im Nährmedium vorsichtig homogenisieren und in ein konisches 15-ml-Röhrchen mit 5 ml kaltem DMEMc auf Eis überführen.
HINWEIS: Ein konisches 15-ml-Röhrchen wird für einen Pool mit 12 Vertiefungen von Organoiden benötigt, die in 50-μl-Kuppeln in 24-Well-Platten kultiviert werden. - Die gesammelten Organoide werden bei 500 x g für 5 min bei 4 °C zentrifugiert.
Anmerkungen: Die Organoide bilden ein weißes Kügelchen am Boden des Röhrchens. Wenn sich die Organoide nach der Zentrifugation noch in der Suspension im ECM befinden, saugen Sie den oberen Überstand vorsichtig ab (ohne die ECM-Schicht zu berühren), homogenisieren Sie durch 10-maliges Pipettieren mit einer P1000-Pipette und wiederholen Sie den Zentrifugationsschritt. Die ECM-Schicht sollte nach diesem Vorgang nicht mehr sichtbar sein. - Saugen Sie den Überstand vorsichtig ab und resuspendieren Sie das Zellpellet in 1 ml vorgewärmtem Enzymdissoziationsreagenz, das mit 10 μM Y27632 ROCK-Inhibitor ergänzt wird. Pipettieren Sie 10 Mal auf und ab, um die Dissoziation der Organoide einzuleiten.
- Zur enzymatischen Verdauung 5 min im 37 °C warmen Wasserbad inkubieren.
- Brechen Sie die Organoide mechanisch auf, indem Sie 10 Mal mit einer P1000-Pipette pipettieren. Überprüfen Sie die Zellsuspension unter dem Mikroskop.
HINWEIS: Das Ziel ist es, isolierte Zellen oder kleine Zellcluster zu erhalten. Wenn immer noch große Organoidfragmente zu beobachten sind, wiederholen Sie die Inkubation (Schritt 4.2.4) und den mechanischen Aufschluss (Schritt 4.2.5). - Fügen Sie 4 ml eiskaltes DMEMc hinzu. Zentrifugieren bei 500 x g für 5 min bei 4 °C
- Verwerfen Sie den Überstand und resuspendieren Sie das Organoidzellpellet in 1 ml DMEMc.
- Gehen Sie wie oben beschrieben vor (Schritte 3.2.7 bis 3.2.13), um die Zellen zu zählen und die organoiden Zellen in 50 μl ECM-Kuppeln mit 3000 lebenden Zellen in vorgewärmten 24-Well-Platten auszusäen.
- Lösen Sie die Organoide mit dem ECM, indem Sie sie mit einer P1000-Pipette abkratzen. Durch Pipettieren im Nährmedium vorsichtig homogenisieren und in ein konisches 15-ml-Röhrchen mit 5 ml kaltem DMEMc auf Eis überführen.
5. Einfrieren von 3D-Organoiden
- Bereiten Sie das erforderliche Volumen (1 ml für ein Becken mit zwei Kuppeln) einer DMEMc-haltigen Gefrierlösung vor, die mit 10 % FBS, 10 % DMSO und 10 μM Y27632 ROCK-Inhibitor ergänzt wird, und lagern Sie sie auf Eis (die endgültige FBS-Konzentration beträgt 18 %).
- Entfernen Sie das Nährmedium aus den zu gefrierenden Vertiefungen.
- Geben Sie 1 ml der Gefrierlösung in die erste Vertiefung, die eingefroren werden soll, lösen Sie das ECM durch Schaben und homogenisieren Sie es mit der Pipettenspitze.
- Übertragen Sie die Organoid-Suspension aus der ersten Vertiefung in die zweite Vertiefung, die eingefroren werden soll.
- Übertragen Sie das Becken der beiden Vertiefungen in ein Kryoröhrchen und legen Sie das Fläschchen in einen Behälter zum Einfrieren der Zellen.
- Lagern Sie den Gefrierbehälter der Zelle 24 Stunden lang bei -80 °C und überführen Sie die Fläschchen dann zur Langzeitlagerung in flüssigen Stickstoff.
6. Kultivierung von Zellmonolayern, die aus 3D-Organoiden gewonnen werden
HINWEIS: Monoschichten von Schweine-Organoidzellen werden in einem 2D-Medium kultiviert, das aus dem für 3D-Organoide verwendeten Nährmedium besteht, das mit 20 % FBS ergänzt wird.
- Vorbereitung der Materialien
- Bereiten Sie das 2D-Medium vor und bewahren Sie es bei RT auf.
- Das mit 10 μM Y27632 ROCK-Inhibitor versetzte Enzymdissoziationsreagenz wird im Wasserbad bei 37 °C vorgewärmt.
- Beschichtung des Kultureinsatzes
- Sterilisieren Sie eine Pinzette und legen Sie sie in die Biosicherheitswerkbank.
- Legen Sie die Zellkultureinsätze (0,33 cm2) mit der Pinzette in eine 24-Well-Platte.
- Bereiten Sie die Beschichtungslösung vor, die Kollagen i.v. enthält, verdünnt mit 50 μg/ml in kaltem PBS. Pipettieren Sie zum Mischen auf und ab
- Zu jedem Zellkultureinsatz werden 150 μl der verdünnten Kollagen-IV-Lösung gegeben, was 22,7 μg/cm2 entspricht.
Anmerkungen: Richten Sie die Pipette vorsichtig senkrecht in die Mitte der durchlässigen Membran aus und überprüfen Sie, ob die Kollagenlösung die gesamte Membran bedeckt. - Legen Sie die Platte in einen Inkubator mit 37 °C und 5 % CO2 und lassen Sie sie über Nacht (oder mindestens 3 Stunden) stehen.
- Seeding von 3D-Organoidzellen in Zellkultureinsätze
- Aus den 3D-Organoiden wird eine Zellsuspension hergestellt, wie in den Schritten 4.2.1 bis 4.2.7 beschrieben.
- Zählen Sie die Zellen mit einer Verdünnung von 1:2 in Trypanblau mit einem Zellzähler und berechnen Sie das erforderliche Volumen, um 2,5 x 10 5 Zellen pro Kultureinsatz zu säen, was 7,6 x 105 Zellen/cm2 entspricht.
- Das erforderliche Volumen der Zellsuspension bei 500 x g für 5 min bei 4 °C zentrifugieren.
- Während der Zentrifugation die Beschichtungslösung vorsichtig aus den Kultureinsätzen absaugen und bei RT unter der Haube ohne Deckel 5 Minuten trocknen lassen.
- Nach der Zentrifugation wird der Überstand verworfen und das Zellpellet in der erforderlichen Menge an 2D-Medium, ergänzt mit 10 μM Y27632 ROCK-Inhibitor, resuspendiert. Für jeden Einsatz wird ein Volumen von 200 μl 2D-Medium benötigt, das die Zellen enthält.
- 200 μl der Zellsuspension (2,5 x 10,5 Zellen) auf die beschichtete permeable Membran (apikale Seite) aufbringen (Abbildung 4A).
Anmerkungen: Pipettieren Sie langsam in der Mitte der Membran und halten Sie die Spitze senkrecht. - 500 μl des mit 10 μM Y27632 ROCK-Inhibitors ergänzten 2D-Mediums in das untere Kompartiment (Basalseite) geben. Inkubation in einem Inkubator mit 5 % CO2 bei 37 °C.
- Einen Tag nach der Aussaat werden die apikalen und basalen Medien durch frisches 2D-Medium ohne den Y27632 ROCK-Inhibitor ersetzt.
- Wechseln Sie das 2D-Medium jeden Tag. Die Monolage wird 1 Tag nach der Aussaat konfluent und kann dann für Experimente verwendet werden.
HINWEIS: Ein transepithelialer elektrischer Widerstand (TEER) über dem Leerzeichen (Einsatz ohne Zellen) bestätigt, dass die Konfluenz erreicht ist (Abbildung 4B).
7. Immunfärbung von Organoidzell-Monoschichten
- Aufbereitung von Lösungen
Anmerkungen: Passen Sie das Volumen der Lösungen entsprechend der Anzahl der zu färbenden Wells an. Für eine Vertiefung werden in jedem Schritt 200 μl der Lösung benötigt. Verweise auf alle kommerziellen Produkte finden Sie in der Materialtabelle.- Bereiten Sie eine 4%ige Paraformaldehyd (PFA)-Lösung unter einer chemischen Haube vor, indem Sie 5 ml 32 % PFA zu 35 ml PBS hinzufügen. 10 ml Aliquots zubereiten und bei -20 °C lagern.
VORSICHT: Manipulieren Sie das PFA immer unter der chemischen Haube, während Sie Nitrilhandschuhe tragen. - Bereiten Sie eine Lösung von 0,2 % Triton X100-PBS vor, indem Sie unmittelbar vor der Anwendung 2 μl Triton X100 zu 1 ml PBS hinzufügen. Bleiben Sie bei RT.
- Bereiten Sie eine 10%ige Rinderserumalbumin (BSA)-PBS-Lösung vor, indem Sie 100 mg BSA zu 1 ml PBS hinzufügen. Bleiben Sie bei RT.
- Bereiten Sie eine 1%ige BSA-PBS-Lösung vor, indem Sie 10 mg BSA zu 1 ml PBS hinzufügen. Bleiben Sie bei RT.
- Es wird eine Lösung des Okkludin-Primärantikörpers hergestellt, die im Verhältnis 1:200 verdünnt wird, indem 5 μl Primärantikörper zu 995 μL 1% PBS BSA hinzugefügt werden. Bewahren Sie die Lösung auf Eis auf.
- Stellen Sie eine Lösung des Sekundärantikörpers her, die im Verhältnis 1:1.000 verdünnt ist, indem 1 μl Sekundärantikörper zu 999 μl 1% BSA-PBS hinzugefügt wird. Bewahren Sie die Lösung auf Eis und vor Licht geschützt auf.
- Bereiten Sie eine Lösung von Phalloidin TRITC in einer Dosierung von 10 μg/ml vor, indem Sie 10 μl TRITC mit 1 mg/ml zu 990 μl PBS hinzufügen. Auf Eis aufbewahren, vor Licht schützen.
- Bereiten Sie eine 4%ige Paraformaldehyd (PFA)-Lösung unter einer chemischen Haube vor, indem Sie 5 ml 32 % PFA zu 35 ml PBS hinzufügen. 10 ml Aliquots zubereiten und bei -20 °C lagern.
- Immunfärbung
Anmerkungen: Sofern nicht anders angegeben, werden alle Inkubationen bei RT unter langsamem Rühren auf einer Schaukelplattform (30 U/min) durchgeführt. Die Immunfärbung erfolgt direkt im Zellkultureinsatz.- Entfernen Sie das basale und apikale Medium. Legen Sie die Platte unter die chemische Haube.
- Waschen Sie die Monoschichten zweimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
- Die Zellmonolagen werden mit 200 μl 4% PFA bei RT fixiert und 20 min bei RT inkubiert.
- Waschen Sie die Monoschichten zweimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
Anmerkungen: Nach den Fixierungs- und Waschschritten kann die Monoschicht 1 Woche lang bei 4 °C in PBS aufbewahrt werden. - Entfernen Sie das PBS, permeabilisieren Sie es mit 200 μl 0,2 % Triton X100-PBS und inkubieren Sie es 20 Minuten lang.
- Waschen Sie die Monoschichten zweimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
- 200 μl primäre Antikörperlösung in 1 % BSA-PBS zugeben und über Nacht bei 4 °C unter langsamem Rühren auf einer Schaukelplattform inkubieren. Schließen Sie eine Negativkontrollvertiefung ein, indem Sie nur 1 % BSA-PBS ohne den primären Antikörper hinzufügen.
- Waschen Sie die Monoschichten dreimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
- Fügen Sie 200 μl Sekundärantikörper in 1% BSA-PBS hinzu und inkubieren Sie sie bei RT für 2 h, geschützt vor dem Licht.
- Waschen Sie die Monoschichten dreimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
- Fügen Sie 200 μl Phalloidin TRITC bei 10 μg/ml hinzu und inkubieren Sie es 10 Minuten lang.
- Waschen Sie die Monoschichten zweimal mit 200 μl PBS bei RT und inkubieren Sie sie 5 Minuten lang.
- Entfernen Sie das PBS und schneiden Sie die Membran mit einem Skalpell auf.
- Stellen Sie die Membran mit einer Pinzette wieder her und legen Sie sie mit der apikalen Seite nach oben auf einen Objektträger.
- 15 μL des mit DAPI angereicherten Eindeckmediums im Verhältnis 1:1.000 direkt auf die Membran geben. Legen Sie ein Deckglas und versiegeln Sie es.
- Bis zur Aufnahme bei 4 °C lichtgeschützt lagern.
Ergebnisse
Nach dem oben beschriebenen Protokoll werden Epithelkrypten aus dem Schweinedarm gewonnen und für die Langzeitlagerung in flüssigem Stickstoff kryokonserviert (Abbildung 1 und Abbildung 2A). Nach dem Auftauen werden die Kryptenstammzellen in der EZM ausgesät (Abbildung 2B). Die Kryptenstruktur geht in der Regel nach diesem Schritt verloren, da die Kryptenstruktur im ECM zerfällt. Die Organoide können innerhalb von 3-4 Tagen beobachtet werden und wachsen dann schnell und entwickeln knospende Strukturen (Abbildung 2B). Wir erhielten erfolgreich Organoide, nachdem wir gefrorene Krypten in >80% der Versuche aufgetaut hatten. Etwa 10 Tage nach dem Auftauen (entsprechend der Wachstumsrate der Organoide) wird eine Passage von Organoiden durchgeführt, um die Kultur zu erweitern (Abbildung 3). Die Organoide wachsen nach der Spaltung schneller und weisen unterschiedliche Morphologien auf, wobei einige zystische und die meisten knospenden Organoide vorhanden sind. Um eine optimale Aufrechterhaltung der Kultur zu gewährleisten, müssen die für die Passage verwendeten Organoide ein klares und leeres Lumen und gut definierte Ränder aufweisen (Beispiele durch grüne Pfeile gekennzeichnet) ohne schwarze Ablagerungen im Lumen (gekennzeichnet durch rote Pfeile), wie dies bei reifen Organoiden zu beobachten ist (Abbildung 3). Wir fanden heraus, dass sich die Trümmer der schwarzen Blutkörperchen um den 6. Tag nach der Passage ansammeln. Daher wird empfohlen, die Organoide am 4.-5. Tag nach der Passage zu spalten oder einzufrieren.
Auch das Reifestadium der Organoide ist ein wichtiger Punkt bei der Gewinnung von Zellmonolagen. Organoide mit fortgeschrittener Reife (angezeigt durch das Vorhandensein von schwarzen Blutkörperchen im Lumen) sind nicht optimal, um Monoschichten zu besiedeln. In der Regel dissoziieren wir 3D-Organoide 4 Tage nach der Passage, um Zellen für die 2D-Kultur zu sammeln. Etwa ein bis drei Vertiefungen mit 3D-Organoiden, die mit 3.000 Zellen pro 50-μl-Kuppel der EZM kultiviert werden, werden benötigt, um einen Kultureinsatz mit 2,5 x 105 Zellen zu besiedeln. Die Zellen heften sich an und bilden innerhalb von 1 Tag eine vollständig konfluierende Monoschicht (Abbildung 4A), was durch den hohen TEER von etwa 700 Ω·cm2 bestätigt wird (Abbildung 4B). Allerdings sind die Zellränder zu diesem frühen Zeitpunkt mit der Hellfeldmikroskopie nur schwer sichtbar zu machen, was wahrscheinlich auf ein geringes Differenzierungsniveau zurückzuführen ist. Der TEER bleibt 3 Tage lang hoch (Abbildung 4B).
Die Aktinfärbung zeigt an, dass die apikale Seite der Epithelzellen in 3D-Organoiden zum Lumen hin ausgerichtet ist (Abbildung 5A). Organoide Zellen, die in den Kultureinsatz eingesät werden, bilden eine konfluente einzelne Schicht von Epithelzellen, wobei die apikale Seite zum oberen Kompartiment hin ausgerichtet ist (Abbildung 4B, C). Die Okkludinfärbung zeigt das Vorhandensein von Tight Junctions an der apikalen Seite der Epithelzellen in 3D-Organoiden und in Zellmonolagen (Abbildung 5A-C).
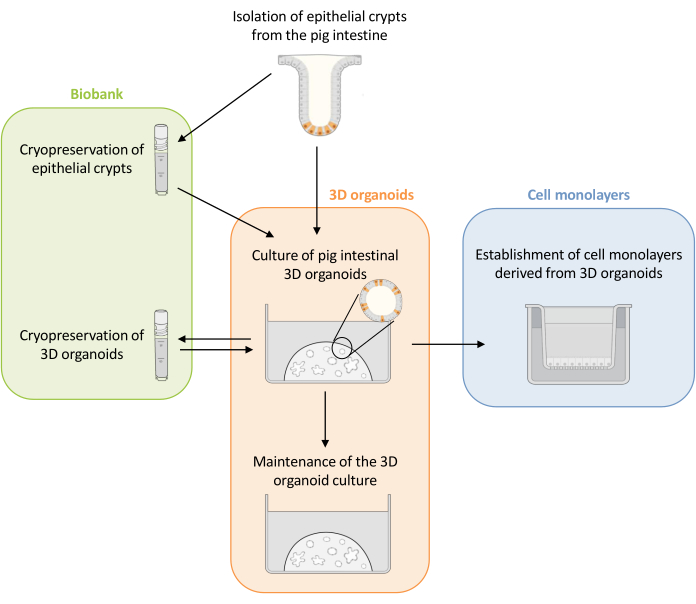
Abbildung 1: Schematische Darstellung der Methoden zur Kultivierung von 3D-Organoiden und Zellmonolayern, die von Organoiden abgeleitet sind. Epithelkrypten werden aus dem Ferkeldarm isoliert. Diese Krypten können i) sofort zur Kultivierung von 3D-Organoiden verwendet oder ii) eingefroren und in einer Biobank in flüssigem Stickstoff gelagert werden. Kryokonservierte Krypten können aufgetaut und zur Kultivierung von 3D-Organoiden verwendet werden. Die 3D-Organoidkultur kann durch sukzessive Spaltung beibehalten oder eingefroren und in der Biobank gelagert werden. Aus der 3D-Organoidkultur können Zellmonoschichten gewonnen werden, um den Zugang zur apikalen Seite der Zellen zu ermöglichen und die epitheliale Barrierefunktion zu untersuchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
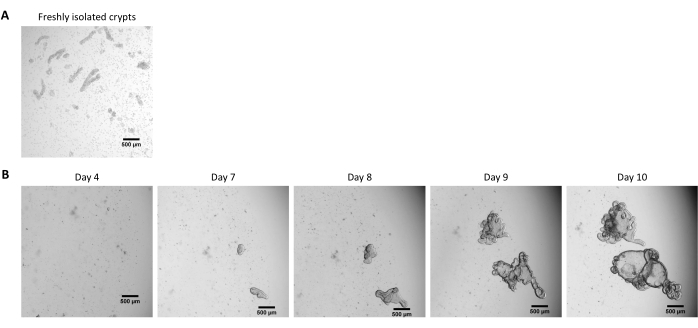
Abbildung 2: Kultivierung von 3D-Organoiden aus kryokonservierten Epithelkryptionen. (A) Repräsentative mikroskopische Aufnahme frisch isolierter Jejunalkrypten. (B) Repräsentative mikroskopische Aufnahmen von 3D-Organoiden, die nach dem Auftauen der jejunalen Krypten aufgenommen wurden. Die Organoide wurden in einer 25 μL EZM-Kuppel in einer 48-Well-Platte kultiviert. Die Abbildung zeigt Bilder der 3D-Organoide 4, 7, 8, 9 und 10 Tage nach der Aussaat. Der Maßstabsbalken stellt 500 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
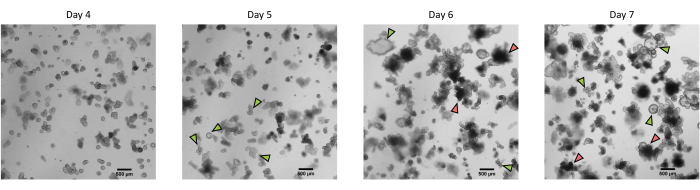
Abbildung 3: Morphologie von 3D-Organoiden aus dem Darm von Schweinen, die aus kryokonservierten Epithelkrypten nach der ersten Passage gewonnen wurden. Repräsentative mikroskopische Aufnahmen, die die Entwicklung von Organoiden aus kryokonservierten Jejunumkrypten nach der ersten Passage von Tag 4 bis Tag 7 zeigen. Grüne Pfeile zeigen klare Organoide an, die für die Passage oder Aussaat von Monoschichten geeignet sind. Rote Pfeile zeigen reife Organoide an, die nicht zum Spalten oder Aussäen von Monoschichten geeignet sind. Daher sollten Brunnen vor der Erscheinung dieser Morphologie verwendet werden. Der Maßstabsbalken stellt 500 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Charakteristika von Zellmonolayern, die aus 3D-Organoiden aus Schweineintestinalen abgeleitet wurden . (A) Repräsentative mikroskopische Aufnahmen der Monolayer-Morphologie über 3 Tage. Jejunum-Organoidzellen wurden bei 2,5 x 105 Zellen in 0,33 cm2 Zellkultureinsätze eingesät, die mit Kollagen i.v. bei 50 ng/ml beschichtet waren. Der Maßstabsbalken stellt 500 μm dar. (B) Transepithelialer elektrischer Widerstand (TEER) von Organoidzell-Monolagen über 3 Tage. Punkte, die durch eine Linie verbunden sind, entsprechen demselben Well zu unterschiedlichen Zeiten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
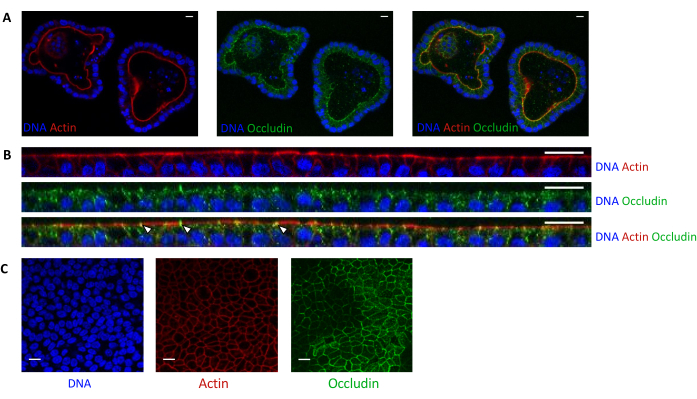
Abbildung 5: Bildgebung von Schweine-Jejunum-Organoiden, die in 3D oder 2D kultiviert wurden. Konfokalmikroskopische Bildgebung von (A) 3D-Organoiden 5 Tage nach der Teilung und (B,C)-Organoidzell-Monolayern 3 Tage nach der Aussaat (B: XZ-Schnitt; C: XY-Abschnitt). Die DNA (blau) wurde mit DAPI gefärbt. Aktin (rot) wurde mit Phalloidin gefärbt. Occludin (grün) wurde mit einem polyklonalen Antikörper gefärbt. Weiße Pfeile zeigen Occludin an, das an der Tight Junction lokalisiert ist. Der Maßstabsbalken stellt 20 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Dieses Protokoll beschreibt eine Methode zur Kryokonservierung von Epithelkrypten aus dem Ferkeldarm für die Langzeitlagerung und anschließende Kultivierung von 3D-Organoiden. Dieses Protokoll verwendet eine Gefrierlösung, die DMSO, FBS, den Y27632 ROCK-Inhibitor, DMEM und Antibiotika enthält. In einer anderen Studie an Schweinen wurden Organoide aus Krypten gewonnen, die in einer ähnlichen Gefrierlösung kryokonserviert wurden, jedoch ohne den ROCK-Inhibitor15. Der Y27632 ROCK-Inhibitor wurde hinzugefügt, um Apoptose zu verhindern und den Stammzellpool aufrechtzuerhalten, da epitheliale Kryptenzellen nach dem Auftauen dissoziiert werden, was zum Zelltod ("anoikis") führen kann27,28. Interessanterweise wurden equine Enteroide aus Epithelkrypten gewonnen, die in einem Nährmedium eingefroren wurden, das nur DMEM und DMSO16 enthielt; Diese einfache Methode wurde noch nicht für Epithelkrypten von Schweinen getestet. Es wurden andere Methoden veröffentlicht, um Organoide von Menschen und Schweinen aus gefrorenem Gewebe oder Biopsien anstelle von Epithelkrypten zu züchten 4,17. Der Vorteil dieser Methode ist die Möglichkeit, das Darmgewebe direkt zu kryokonservieren, ohne die Kryptenisolierung durchzuführen, die Zeit und Laborgeräte erfordert. Dies kann praktisch sein, wenn das Gewebe weit weg vom Labor entnommen werden muss. Bei der Isolierung der Krypten unmittelbar nach der Schlachtung können jedoch große Darmsegmente verarbeitet werden, um eine sehr hohe Anzahl von Krypten zu erhalten, was bei der Entnahme von kleinen gefrorenen Gewebefragmenten nicht der Fall ist. Nach dem Auftauen der Epithelkrypten wurden die Organoide 3-4 Tage nach der Aussaat beobachtet und nach 10 Tagen gespalten. Dies ist eine langsamere Wachstumsrate als beim Beginn der Kultur aus frischen Epithelkrypten, für die die Organoide ab Tag 1 nach der Aussaat gewonnen wurden, und kann in der Regel um Tag 5bis 11 geteilt werden. Khalil et al. berichteten auch über ein verzögertes Wachstum von Schweineenteroiden, wenn sie von gefrorenen Krypten ausgehen15, was darauf hindeutet, dass Stammzellen möglicherweise Zeit benötigen, um ihre proliferative Kapazität wiederzuerlangen. Wir erhielten auch eine geringere Anzahl von Organoiden, wenn wir aus gefrorenen Krypten im Vergleich zu frischen Krypten ausgingen, was auf das Absterben von Stammzellen während des Einfrierprozesses zurückzuführen sein könnte. Bei einigen Versuchen des Auftauens von Krypten (<20%) erhielten wir keine Organoide aus gefrorenen Krypten, wahrscheinlich aufgrund eines suboptimalen Kryokonservierungsverfahrens (z. B. verzögertes Einfrieren nach Kryptenisolierung von wahrscheinlich mehr als 1 h). Wir empfehlen daher, die Krypten bis zur Zählung auf Eis zu legen und sie so schnell wie möglich einzufrieren.
Für 3D-Organoide haben wir uns für ein kommerzielles Organoid-Nährmedium entschieden, das für den Menschen entwickelt wurde. In der Tat haben frühere Berichte gezeigt, dass Schweinedarmorganoide mit diesem Medium effizient wachsen 8,11,14,19,25,26,29,30. Es ist von Interesse, dass dieses Nährmedium gebrauchsfertig ist und eine standardisierte Konzentration von Wachstumsfaktoren innerhalb einer Charge aufweist. Dieses Nährmedium ist jedoch kostspielig, seine Zusammensetzung ist nicht offenbart und es ist daher nicht möglich, seine Zusammensetzung zu modulieren. Im Gegensatz dazu wurden in anderen Studien Darmorganoide von Schweinen in maßgeschneiderten Medien kultiviert, die pharmakologische Inhibitoren, rekombinante Wachstumsfaktoren und/oder konditionierte Medien enthielten 5,6,7,21. Obwohl diese Methode sehr flexibel und kostengünstig ist, ist sie zeitaufwändig für die Herstellung konditionierter Medien und kann aufgrund der potenziellen Variabilität in der Konzentration von Wachstumsfaktoren in konditionierten Medien nicht reproduzierbar sein. Daher sollte die Qualität jeder Charge konditionierter Medien durch Messung des Organoidwachstums oder der Markergenexpressionvalidiert werden 31.
Eine Studie hat gezeigt, dass jejunale Organoide von Schweinen, die in demselben kommerziellen Organoid-Nährmedium kultiviert wurden, das hier verwendet wurde, schneller wuchsen und weniger differenziert zu sein schienen, verglichen mit Enteroiden, die mit Medien kultiviert wurden, die rekombinanten Wachstumsfaktor und/oder konditionierten Medien enthielten23. Ein hoher proliferativer Zustand erleichtert die Kultivierung von 3D-Organoiden, erfordert jedoch möglicherweise eine Induktion der Differenzierung, um repräsentativer für die physiologischen Eigenschaften des Darms zu sein. Bei diesem Protokoll werden die Zellen für die Passage von 3D-Organoiden für die Zählung vollständig dissoziiert, wodurch die Anzahl der in der EZM ausgesäten Zellen kontrolliert werden kann. Dies erhöht die Reproduzierbarkeit des Phänotyps von Organoiden, die stark von ihrer Dichte beeinflusst wird. Darüber hinaus vermeidet die Zählung der Zellen, dass eine zu niedrige oder überfüllte Kultur erhalten wird, was eine Anpassung des Kulturplans erfordert. In den meisten anderen Studien wurden Organoidfragmente hergestellt, die nicht vollständig in einzelne Zellen dissoziiert waren, und ein Verdünnungsverhältnis für die Passage verwendet. Diese Methode ist einfacher, kann aber je nach Organoiddichte der Kultur zu einer Variabilität führen.
Für die Kultur in Monoschichten werden Organoidzellen in Kultureinsätze eingesät, die mit einer dünnen EZM-Schicht vorbeschichtet sind, die die Anheftung von Zellen ermöglicht, aber das Wachstum von Organoiden in 3D verhindert. Bei diesem Protokoll wurde Kollagen Typ IV als ECM-Protein verwendet, wie zuvor bei Schweinenbeschrieben 23. Andere Studien mit Schweine-Organoid-Monolayern verwendeten die gleiche tumorabgeleitete EZM, die hier verwendet wurde, um 3D-Organoide zu kultivieren 6,8,9,21,25,30. Der Vorteil der Verwendung von Kollagen ist die Möglichkeit, die Proteinkonzentration mit einer vollständig definierten Zusammensetzung zu standardisieren, was bei der tumorbedingten EZM nicht der Fall ist. Ein entscheidender Schritt für den Erfolg der Kultivierung von Zellmonolayern besteht darin, auf das visuelle Erscheinungsbild der Vorläufer-3D-Organoide zu achten, die gut definierte Kanten und ein leeres Lumen ohne schwarze Trümmer aufweisen sollten. In der Tat sind Organoide mit einem hohen Reifegrad und einer niedrigen Proliferationsrate keine geeignete Zellquelle für die 2D-Kultur. Daher ist der Zeitpunkt der Dissoziation von 3D-Organoiden in einzelne Zellen entscheidend für den Erfolg dieses Schritts.
Die Kultivierung von 2D-Monoschichten aus einzelnen Zellen ermöglicht die Standardisierung der Anzahl der ausgesäten Zellen, was schwieriger ist, wenn man von Organoidfragmenten ausgeht, wie es bei einigen anderen Methoden der Fall ist. Wir säten 7,6 x 10 5 Zellen pro cm2 aus, was im Vergleich zu den meisten anderen Studien 21,22,23 bei Schweinen mit einer geringeren Zelldichte von 0,25 x 105 Zellen pro cm2 bis 1,78 x 105 Zellen pro cm2 hoch ist. Die Forderung nach einer hohen Anzahl von Organoidzellen stellt eine Einschränkung dieses Protokolls dar, aber es ermöglichte uns, schnell eine konfluente Monoschicht zu erhalten, die den Kultureinsatz nach 1 Tag vollständig bedeckt. Im Gegensatz dazu erreichten Vermeire et al.23 eine Konfluenz nach 4-7 Tagen mit einer geringeren Dichte der ausgesäten Zellen (von 0,25 x 10 5 Zellen/cm2 auf 0,4 x 105 Zellen/cm2). In einigen Studien wurden auch Organoidzell-Monoschichten von Schweinen verwendet, die die Kulturoberfläche für Infektionen mit Viren nicht vollständig bedeckten 8,30. Unter diesen Bedingungen ist die apikale Seite der Epithelzellen für Behandlungen zugänglich, aber vollständig konfluierende Monoschichten sind erforderlich, wenn das Ziel darin besteht, die Nährstoffaufnahme oder die Epithelpermeabilität zu untersuchen.
Für Organoidzell-Monolayer wurde ein kommerzielles Organoid-Nährmedium verwendet, das mit 20 % FBS ergänzt wurde, basierend auf einer kürzlich durchgeführten Studie an Rinder-Enteroid-Monolayern32. In unseren Tests war die Supplementierung mit 20% FBS notwendig, um vollständig konfluierende Monolagen zu erhalten, wahrscheinlich aufgrund eines hohen Wachstumsfaktorbedarfs. Im Gegenteil, andere Studien, die das gleiche kommerzielle Medium verwendeten, haben Monolagen ohne zusätzliche FBS 8,25,30 etabliert, ohne jedoch eine vollständige Konfluenz zu erreichen. In anderen Studien wurde auch eine Supplementierung mit 20 % FBS in einem maßgeschneiderten Medium für die Kultivierung von Organoidzell-Monolayern von Schweinen verwendet21,22. In unseren Experimenten ist TEER 1 Tag nach der Aussaat hoch (ca. 700 Ω·cm 2) und bleibt bis Tag 3 hoch (ca. 1.500 Ω·cm2; dies stimmt mit der Bildung von Tight Junctions überein, was durch die Expression von Occludin angezeigt wird. Van der Hee et al. erhielten ähnliche TEER-Werte über 72 h für Jejunum-Organoidzell-Monolayer21. Sie zeigten auch, dass Monoschichten bis zum 12. bis 15. Tag mit täglichem Medienwechsel aufrechterhalten werden können. Im Gegensatz dazu haben andere Studien viel niedrigere TEER-Werte (ca. 200 Ω·cm2) für Organoidzell-Monoschichten von Schweinen berichtet 6,22. Diese Unterschiede zwischen den Studien könnten mit dem untersuchten Darmsegment oder den verwendeten Medien zusammenhängen, die die Epitheldifferenzierung beeinflussen.
Zusammenfassend lässt sich sagen, dass das obige Protokoll zur Zucht von Schweinedarm-3D-Organoiden aus gefrorenen Epithelkrypten die Organisation der Kulturarbeit erleichtert. Es reduziert den Bedarf an frischem Gewebe, das von lebenden Tieren gewonnen werden muss. Wir erklären auch, wie man in weniger als 3 Tagen vollständig konfluierende Zellmonoschichten aus Schweineorganoiden herstellen kann. Daher könnten unsere Protokolle nützliche Ressourcen für Wissenschaftler sein, die das Darmepithel von Schweinen für die veterinärmedizinische oder biomedizinische Forschung untersuchen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom Institut Carnot France Futur Elevage ("OrganoPig"-Projekt) und von INRAE HOLOFLUX ("Holopig"-Projekt) unterstützt. Dankbar sind die Autoren den Genotoul Core Facilities (TRI). Wir danken Christelle Knudsen (GenPhySE, INRAE, Toulouse) für das sorgfältige Korrekturlesen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer's recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
Referenzen
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465 (2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368 (2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682 (2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375 (2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031 (2022).
- Zhu, M., Qin, Y. -. C., Gao, C. -. Q., Yan, H. -. C., Wang, X. -. Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -. H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143 (2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94 (2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821 (2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011 (2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196 (2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394 (2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten