Method Article
Kriyokorunmuş Epitel Kriptlerinden Domuz Yavrusu Bağırsak 3D Organoidlerinin Kültürü ve Hücre Tek Katmanlarının Oluşturulması
Bu Makalede
Özet
Burada, kriyokorunmuş epitel kriptlerinden domuz bağırsak 3D organoidlerini kültürlemek için bir protokol açıklıyoruz. Ayrıca, epitel hücrelerinin apikal tarafına erişime izin veren 3D organoidlerden türetilen hücre monokatmanları oluşturmak için bir yöntem de açıklıyoruz.
Özet
Bağırsak organoidleri, sindirim hastalığı modellemesi için bağırsak epitelini incelemek veya ilaçlar, besinler, metabolitler, patojenler ve mikrobiyota ile etkileşimleri araştırmak için giderek daha fazla kullanılmaktadır. Bağırsak organoidlerini kültüre alma yöntemleri, hem çiftlik hayvanı hem de insanlar için, örneğin zoonotik hastalıkları incelemek için translasyonel bir model olarak büyük ilgi çeken bir tür olan domuzlar da dahil olmak üzere birçok tür için artık mevcuttur. Burada, dondurulmuş epitel kriptlerinden domuz bağırsak 3D organoidlerini kültürlemek için kullanılan bir prosedürün derinlemesine bir tanımını veriyoruz. Protokol, domuz bağırsağından epitel kriptlerinin nasıl korunacağını ve sonraki prosedürlerin 3D bağırsak organoidlerinin kültürüne nasıl uygulanacağını açıklar. Bu yöntemin başlıca avantajları, (i) kriptlerin 3D organoidlerin kültüründen izolasyonunun zamansal ayrışması, (ii) birden fazla bağırsak segmentinden ve aynı anda birkaç hayvandan elde edilen büyük kriyokorunmuş kript stoklarının hazırlanması ve böylece (iii) canlı hayvanlardan taze dokuları örnekleme ihtiyacının azaltılmasıdır. Ayrıca, epitel hücrelerinin apikal tarafına erişime izin vermek için 3D organoidlerden türetilen hücre monokatmanlarını oluşturmak için bir protokolü detaylandırıyoruz, bu da besinler, mikroplar veya ilaçlarla etkileşimlerin yeridir. Genel olarak, burada açıklanan protokoller, veterinerlik ve biyomedikal araştırmalarda domuz bağırsak epitelini incelemek için yararlı bir kaynaktır.
Giriş
Bağırsak epiteli, luminal ortam ile arayüzde sindirim mukozasını kaplayan tek katmanlı bir hücre tabakasından oluşur. Bu pozisyon, kök hücrelerin varlığı ve çoklu farklılaşmış epitel hücre tipleri (emici, enteroendokrin, Paneth ve kadeh hücreleri)1 ile desteklenen besin emilimi ve bariyer fonksiyonu gibi çeşitli işlevlerle ilişkilidir. Geleneksel olarak epitel hücrelerini incelemek için kullanılan ölümsüzleştirilmiş hücre hatları, bağırsak epitelinin hücresel karmaşıklığını yansıtmadıkları ve genomik anormallikler gösterdikleri için büyük sınırlamalara sahiptir2. Sato ve ark.3 tarafından üç boyutlu (3D) organoidlerin geliştirilmesi, bağırsak epitelini gelişmiş bir fizyolojik alaka düzeyi ile incelemek için yeni bir model sağlamıştır. Gerçekten de, bağırsak organoidleri dönüştürülmemiş kök hücrelerden türetilir, çoklu hücre tiplerinden oluşur ve bağırsak epitelinin işlevselliğini özetler. Bağırsak organoidleri, bağırsak epitelinin gelişimini ve işlevlerini ve patojenler, besinler, toksinler, ilaçlar, mikrobiyota ve metabolitleri ile etkileşimlerini anlamak için giderek daha fazla kullanılmaktadır2.
Başlangıçta insanlar ve fareler için geliştirilen bağırsak organoidlerini kültürlemek için kullanılan yöntemler son zamanlarda domuzlar4 de dahil olmak üzere diğer türlere uyarlanmıştır. Gonzales ve ark.5, jejunumdan domuz organoidlerini kültüre alan ilk kişilerdi; O zamandan beri, domuz organoidleri diğer bağırsak segmentleri (duodenum, ileum ve kolon)6,7,8 için tanımlanmıştır ve konuma özgü bir fenotip9,10,11'i koruduğu gösterilmiştir. Domuz bağırsağı 3D organoidleri artık besin maddelerinin12,13 veya enterik enfeksiyonların 6,8,14 etkisini incelemek için yaygın olarak kullanılmaktadır.
Çalışmaların çoğu, yeni izole edilmiş epitel kriptlerinden başlayarak bağırsak organoidlerinin kültürünü tanımlamıştır. Bununla birlikte, bu, özellikle domuzlar gibi büyük hayvanlarla çalışırken, lojistik nedenlerden dolayı her zaman mümkün değildir. Gerçekten de, domuzlar için hayvan tesisleri, organoidlerin kültürlendiği laboratuvardan uzağa yerleştirilebilir ve bu da iş organizasyonunu zorlaştırır. Dahası, organoid kültür zaman alıcıdır; Bu nedenle, örneğin farklı bağırsak segmentlerinden veya birkaç hayvandan aynı anda birden fazla organoid çizgi yetiştirmek pratik değildir. Bu sorunları aşmak için, insanlarda, atlarda ve domuzlarda yapılan birkaç çalışma, organoidleri dondurulmuş bağırsak dokularından (veya biyopsilerden) veya izole epitel kriptlerinden 4,15,16,17 kültürleme yöntemlerini tanımlamıştır. Bu yöntemler, bağırsak epitel kök hücrelerinin tek bir hayvanın birden fazla bağırsak segmentinden kriyoprezervasyonuna izin verir, bu da gerektiğinde organoidleri büyütmek için kullanılabilir. Dahası, bu, kök hücre bağışçısı olarak kullanılan canlı hayvan sayısında güçlü bir azalmaya izin verir, çünkü büyük kriyokorunmuş kript stokları oluşturulabilir (3R ilkeleri). Bu yöntemin bir diğer avantajı, bağırsak organoidlerinin, fenotipik veya genotipik sonuçlar elde edildikten sonra sadece ilgili hayvanlardan büyümesidir ve bu da oldukça uygun maliyetlidir.
İn vivo, bağırsak epitel hücreleri polarize olur ve apikal taraf lümene doğru yönlendirilir. İn vitro, 3D organoidlerde, epitel hücrelerinin apikal tarafı da lümene (yani organoidlerin içine) bakar4. Bu organizasyon, luminal bileşenlerin (örneğin, besinler, mikroplar, metabolitler) epitel hücreleri üzerindeki etkilerini incelerken bir sorun olan apikal tarafa erişimi önler. Bu dezavantajı aşmak için, organoid hücrelerin 2D monokatmanlar olarak kültürlenmesi, mikroenjeksiyon ve polaritenin tersine çevrilmesi ("apikal-out organoidler") gibi çeşitli yöntemler geliştirilmiştir18,19. Organoid hücre monokatmanlarının kültürü, en verimli ve izlenebilir sistem olarak ortaya çıkmaktadır. Prensip, 3D organoidleri tek hücrelere ayırmak ve daha önce ince bir hücre dışı matris (ECM) tabakası (ECM) 20 ile kaplanmış bir hücre kültürü kabına tohumlamaktır. Bu kültür koşullarında, epitel hücrelerinin apikal tarafı yukarı bakmaktadır ve bu nedenle deneysel tedaviler için erişilebilir20. Organoid hücre monokatmanlarının kültürü yakın zamanda domuz bağırsağı21,22 için uyarlanmıştır; Domuz 3D organoidlerinden türetilen hücre monokatmanları, enterik enfeksiyonların incelenmesi 6,23,24,25, besin maddelerinin taşınması9 ve sindirim hastalığı modellemesi 26 dahil olmak üzere birçok uygulama için kullanılmıştır.
Burada, bu çalışma ilk olarak kriyokorunmuş epitel kriptlerinden türetilen domuz bağırsağı 3D organoidlerinin kültürü ve bakımı için ayrıntılı bir protokol sunmaktadır (Şekil 1). Daha sonra, domuz bağırsağı 3D organoidlerinden hücre monokatmanları oluşturmak için bir protokol tanımlanmıştır. Burada açıklanan yöntemler, besin taşınması, bariyer fonksiyonu ve konakçı-mikroorganizma etkileşimleri için domuz bağırsak epitelini incelemek için kullanılabilecek deneysel araçlar sağlar.
Protokol
Bu protokol, bilimsel amaçlarla kullanılan hayvanların korunmasına ilişkin Avrupa direktifi (2010/63/EU) uyarınca yerel etik kurul (N°TOXCOM/0136/PP) tarafından onaylanmıştır. Bu protokol jejunum için örnek olarak tanımlanmıştır, ancak ince ve kalın bağırsağın her segmenti (duodenum, jejunum, ileum, kolon) için kullanılabilir.
1. Epitel kriptlerinin domuz yavrusu bağırsağından izolasyonu
NOT: %10 fetal sığır serumu (FBS) ve %1 penisilin-streptomisin (P/S) ile desteklenmiş DMEM ile birlikte Dulbecco'nun modifiye kartal besiyerinin (DMEMc) tamamını hazırlayın. 50 mL alikot hazırlayın ve 1 ay boyunca 4 ° C'de saklayın.
- Çözeltilerin hazırlanması (kript izolasyonunun yapıldığı gün yapılacak)
- Fosfat tamponlu salin (PBS), 3 mM ditiyotreitol (DTT), 9 mM etilendiamintetraasetik asit (EDTA), 10 μM Y27632 ROCK inhibitörü ve% 1 penisilin-streptomisin (P / S) içeren ayrışma çözeltisini hazırlayın ve buz üzerinde saklayın.
- DMEMc,% 10 FBS,% 10 dimetil sülfoksit (DMSO) ve 10 μM Y27632 ROCK inhibitörü içeren dondurma çözeltisini hazırlayın ve buz üzerinde saklayın (nihai FBS konsantrasyonu% 18'dir).
- %1 P/S ile takviye edilmiş soğuk PBS içeren taşıma solüsyonunu hazırlayın ve buz üzerinde saklayın.
- Epitel kriptlerinin izolasyonu
- Bir domuz yavrusunu elektronarkoz ile kesin ve ardından exsanguinasyon yapın.
- Kesimden hemen sonra, domuz yavrusu karnını bir neşterle açın ve tüm bağırsağı çıkarın.
- Bir bağırsak segmentinin yaklaşık 2 cm'sini toplayın ve soğuk taşıma çözeltisinde saklayın. Segmenti kript izolasyonuna kadar (2 saate kadar) buz üzerinde tutun.
- Mendili bir Petri kabına yerleştirin. Bağırsak segmentini uzunlamasına açın ve bağırsak içeriğini çıkarmak için dokuyu% 1 P / S ile desteklenmiş soğuk PBS'de dikkatlice yıkayın.
- Dokuyu,% 1 P / S ile desteklenmiş 10 mL soğuk PBS ile doldurulmuş yeni bir Petri kabına aktarın.
- Dokuyu cımbızla tutun ve villusu ve kalan mukusları mikroskop slaytı ile kazıyarak çıkarın.
NOT: Villusun (dil şeklindeki yapı) çıkarılması, süpernatanın mikroskobik gözlemi ile kontrol edilebilir. - Dokuyu 5 mL buz gibi soğuk ayrışma çözeltisi içeren 15 mL'lik bir konik tüpe aktarın ve dönen bir çalkalayıcıda (15 rpm) oda sıcaklığında (RT) 30 dakika inkübe edin.
- Dokuyu yeni bir Petri kabına aktarın ve% 1 P / S ile desteklenmiş 10 mL soğuk PBS ekleyin.
- Mukozayı mikroskop slumu ile sıkıca kazıyarak kriptleri mekanik olarak izole edin.
NOT: Mikroskop altında, PBS'de epitel kriptlerinin varlığını doğrulayın (Şekil 2A). - Kript çözeltisini serolojik bir pipetle aspire edin ve 50 mL'lik bir konik tüp içinde 100 μm'lik bir hücre süzgecinden geçirin.
- Çözeltinin 10 μL'sini pipet edin ve mikroskop altında kriptlerin varlığını doğrulayın. 4 °C'de 5 dakika boyunca 300 x g'de santrifüj.
- Steril bir biyogüvenlik kabini altında, süpernatantı atın ve 10 μM Y27632 ROCK inhibitörü ile desteklenmiş 10 mL soğuk DMEMc'de kript peletini yeniden askıya alın.
- Kript çözeltisinin 10 μL'sini 48 delikli bir plakaya pipetin. 10x büyütme ile mikroskop altında kript sayısını manuel olarak sayın ve çözeltinin mL'si başına kript konsantrasyonunu hesaplayın.
NOT: İzole edilmiş kriptler doğrudan bağırsak organoidlerini kültürlemek için kullanılabilir. Bununla birlikte, her domuz yavrusundan büyük bir kript grubunu kriyoprotekte etmek ve daha sonra organoid kültür için kullanmak genellikle daha uygundur.
- Epitel kriptlerinin dondurulması
- 15 mL'lik bir konik tüpte 900 kriptoya karşılık gelen bir hacmi aktarın. 4 °C'de 5 dakika boyunca 300 x g'de santrifüj.
- Süpernatantı atın ve kript topaklarını dondurma çözeltisinin 1 mL'sinde yeniden askıya alın. Bir kriyotüpe aktarın ve şişeyi bir hücre dondurma kabına yerleştirin.
- Hücre dondurma kabını 24 saat boyunca -80 ° C'de saklayın ve ardından şişeleri uzun süreli depolama için sıvı azota aktarın.
2. Dondurulmuş epitel kriptlerinden domuz yavrusu bağırsak 3D organoidlerinin kurulması
NOT: Domuz yavrusu bağırsak 3D organoidleri, insan organoidlerinin büyümesi için formüle edilmiş, birincil hücreler için% 1 P / S ve 100 μg / mL antimikrobiyal ajan ile desteklenmiş ve 1 haftaya kadar 4 ° C'de saklanan ticari bir kültür ortamında kültürlenir. 3D organoidlerin kültürü için tümör kaynaklı bir hücre dışı matris (ECM) kullanılır. Ticari ürünlerin tüm referansları Malzeme Tablosunda sunulmuştur.
- Malzemelerin hazırlanması
- Pipetli uçları -20 °C'ye (en azından gece boyunca) yerleştirin.
- ECM'nin dondurulmuş alikotlarını (500 μL) en az 1 saat önceden 4 °C'ye yerleştirin.
- 48 delikli bir plakayı 37 ° C, % 5 CO2 inkübatörde önceden ısıtın.
- Kültür ortamını RT'ye yerleştirin.
- Bir su banyosunu 37 °C'de önceden ısıtın.
- Aseptik koşullar altında kaputun altına küçük bir buz kovası yerleştirin.
- Dondurulmuş epitel kriptlerinin çözülmesi
- 900 dondurulmuş kript içeren bir şişeyi su banyosunda 37 ° C'de (5 dakikadan az) hızla çözün.
- Kript çözümünü 15 mL'lik bir konik tüpe aktarın.
- RT'de 5 dakika boyunca 300 x g'de santrifüj. Süpernatantı çıkarın
- 25 μL ECM başına 150 kriptlik nihai konsantrasyon elde etmek için soğutulmuş uçlarla 150 μL ECM ekleyin. ECM'de homojen bir kript süspansiyonu elde etmek için 10 kez yukarı ve aşağı pipet yapın.
NOT: Polimerizasyonu önlemek için ECM'yi daima buz üzerinde tutun. ECM'yi manipüle etmek için her zaman -20 °C'de önceden soğutulmuş pipet uçları kullanın. ECM'de hava kabarcıkları oluşmasını önlemek için yavaşça pipetin. Bu adımda, küçük damlaların çökmesini önlemek için seyreltilmemiş bir ECM kullanılır. - Önceden ısıtılmış 48 delikli bir plakada soğutulmuş uçlarla kuyu başına 25 μL'lik bir damla ile altı kuyucuğu tohumlayın.
NOT: Ucu dikey, kuyunun ortasında tutun ve bir kubbe elde etmek için hava girmeden yavaşça pipetin. Burada, dondurulmuş kriptlerden başlarken organoid sayısı genellikle düşük olduğu için 48 kuyucuklu plakalar kullanılır. - ECM'nin polimerizasyonu için 37 ° C,% 5 CO2 inkübatörde 30 dakika inkübe edin.
- RT'de kültür ortamının kuyucuğu başına 250 μL ekleyin. 37 ° C,% 5 CO 2 inkübatörde inkübe edin ve kültür ortamını her2-3 günde bir değiştirin
NOT: Kriptler genellikle çözme prosedüründen sonra görünmez ve hücrelerin çoğu ECM'de ayrışır (Şekil 2B).
3. Dondurulmuş kriptlerden elde edilen domuz yavrusu bağırsak 3D organoidlerinin geçişi
NOT: Dondurulmuş kriptlerden organoid elde etme süresi genellikle taze kriptlerden başlamaktan daha uzundur. Organoidler genellikle çözüldükten 10 gün sonra bölünmeye hazırdır (Şekil 2B).
- Malzemelerin hazırlanması
- ECM'nin dondurulmuş alikotlarını (500 μL) en az 1 saat boyunca 4 ° C'de yerleştirin.
- 24 delikli plakaları 37 °C'de önceden ısıtın.
- PBS ve enzim ayrışma reaktifini 10 μM Y27632 ROCK inhibitörü ile desteklenmiş olarak 37 °C'de bir su banyosunda önceden ısıtın.
- Kültür ortamını RT'ye yerleştirin.
- Aseptik koşullar altında kaputun altına küçük bir buz kovası yerleştirin.
- Dondurulmuş kriptlerden türetilen 3D organoidlerin geçişi
- Kültür ortamını çıkarın ve 37 °C'de 250 μL önceden ısıtılmış PBS ile yıkayın.
- Her bir kuyucukta 37 ° C'de 10 μM Y27632 ROCK inhibitörü ile desteklenmiş 250 μL önceden ısıtılmış enzim ayrışma reaktifi ekleyin.
NOT: Organoid sayısının az olması nedeniyle, organoidlerin ayrışması doğrudan her bir kuyucukta gerçekleştirilir. - ECM'deki organoidleri P1000 pipetle kazıyarak ayırın ve beş kez pipetleyerek dikkatlice homojenize edin.
- 37 ° C,% 5 CO2 inkübatörde 5 dakika inkübe edin. P1000 pipet kullanarak 10 kez yukarı ve aşağı pipetleme yaparak hücreleri ayırın.
NOT: Amaç, izole edilmiş hücreler veya küçük hücre kümeleri (<10 hücre) elde etmektir. Ayrışmayı mikroskop altında doğrulayın. Büyük organoid parçaları hala gözleniyorsa, adım 3.2.4'ü tekrarlayın. - Ayrışmış hücreler içeren her bir kuyucuğa 500 μL DMEMc ekleyin ve 3 mL soğuk DMEMc içeren 15 mL'lik bir konik tüpte 12 kuyucuğa kadar havuzlayın.
- 4 °C'de 5 dakika boyunca 500 x g'de santrifüj. Süpernatantı atın ve peleti 1 mL soğuk DMEMc'de yeniden askıya alın.
- Bir hücre sayacı ile Trypan mavisinde 1: 2 seyreltme ile hücreleri sayın.
NOT: Otomatik hücre sayacı, varsa, küçük kümeler içindeki hücreleri sayabilir. - Kubbe başına 3.000 canlı hücreye (24 delikli plakanın kuyusu başına bir kubbe) sahip olmak için hücre çözeltisinin gerekli hacmini, 4 ° C'de 5 dakika boyunca 500 x g'de santrifüjleyin.
- Buz üzerindeki 3.000 canlı hücre başına 17 μL soğuk DMEMc ile hücreleri yeniden askıya alın. Ses seviyesini gerekli kuyu sayısına ayarlayın.
- 3.000 canlı hücre başına soğutulmuş uçlarla yavaşça 33 μL soğuk ECM ekleyin ve kabarcık oluşturmadan buz üzerinde homojenize edin. Ses seviyesini gerekli kuyu sayısına ayarlayın.
NOT: Hücreler 1/3 DMEMc ve 2/3 ECM içeren bir çözelti içinde yeniden askıya alınır. Her kubbe için, bu çözeltinin 50 μL'sine ihtiyaç vardır. Seyreltilmiş ECM daha ucuzdur ve pipetlenmesi daha kolaydır. - Kuyucukları, önceden ısıtılmış 24 kuyucuklu bir plakada soğutulmuş uçlarla kuyucuk başına 50 μL ECM hücresi süspansiyonu ile tohumlayın.
- ECM'nin polimerizasyonu için 37 ° C,% 5 CO2 inkübatörde 30 dakika inkübe edin.
- Kuyu başına 500 μL kültür ortamı ekleyin. 37 °C, %5 CO 2 inkübatörde inkübe edin ve kültür ortamını her2-3 günde bir değiştirin
NOT: Organoidler doğrudan i) deneyler, ii) 3D organoid kültürün bakımı, iii) dondurulması veya iv) organoid hücre tek katmanlarının tohumlanması için kullanılabilir (Şekil 1). Organoidleri bölmek için en uygun zamanlamayı seçmek için organoidlerin büyümesini her gün mikroskopla kontrol edin. Organoidler açık ve boş bir lümene ve iyi tanımlanmış kenarlara sahip olmalıdır. Lümeninde siyah döküntü bulunan olgun organoidler bölme için kullanılmamalıdır (Şekil 3).
4. Organoid kültürün 3D olarak bakımı
NOT: Geçiş için, organoidler boş bir lümen ile net görünmelidir. Siyah enkaz, bölünmeden yaklaşık 5 gün sonra lümende ortaya çıkar ve ölü hücrelerin varlığını gösterir. Geçiş sırasında ölü hücrelerin sayısının sınırlandırılması, kültürün optimal bakımı için tercih edilir. Bu nedenle program, bu olgunluk aşamasına ulaşmaktan kaçınmak için uyarlanmalıdır.
- Malzemenin hazırlanması
- ECM'nin alikotlarını (500 μL) en az 1 saat boyunca çözmek için 4 ° C'ye yerleştirin.
- 24 delikli bir plakayı 37 °C'de önceden ısıtın.
- 10 μM Y27632 ROCK inhibitörü ile desteklenmiş enzim ayrışma reaktifini 37 °C'de bir su banyosunda önceden ısıtın.
- Kültür ortamını RT'ye yerleştirin.
- Aseptik koşullar altında kaputun altına küçük bir buz kovası yerleştirin.
- Bağırsak 3D organoidlerinin geçişi
- P1000 pipetle kazıyarak organoidleri ECM ile ayırın. Kültür ortamında pipetleyerek dikkatlice homojenize edin ve buz üzerinde 5 mL soğuk DMEMc içeren 15 mL'lik bir konik tüpe aktarın.
NOT: 24 delikli plakalarda 50 μL kubbelerde kültürlenmiş 12 kuyucuklu organoid içeren bir havuz için bir adet 15 mL konik tüp gereklidir. - Toplanan organoidleri 500 x g'de 4 °C'de 5 dakika boyunca santrifüj edin.
NOT: Organoidler tüpün dibinde beyaz bir pelet oluşturur. Santrifüjlemeden sonra organoidler hala ECM'deki süspansiyondaysa, üst süpernatantı dikkatlice aspire edin (ECM tabakasına dokunmadan), bir P1000 pipet ile 10 kez pipetleyerek homojenize edin ve santrifüjleme adımını tekrarlayın. ECM tabakası bu işlemden sonra görünür olmamalıdır. - Süpernatantı dikkatlice aspire edin ve hücre peletini 10 μM Y27632 ROCK inhibitörü ile desteklenmiş 1 mL önceden ısıtılmış enzim ayrışma reaktifinde yeniden askıya alın. Organoidlerin ayrışmasını başlatmak için 10 kez yukarı ve aşağı pipet.
- Enzimatik sindirim için 37 ° C'lik bir su banyosunda 5 dakika inkübe edin.
- P1000 pipet ile 10 kez pipetleme yaparak organoidleri mekanik olarak bozun. Hücre süspansiyonunu mikroskop altında kontrol edin.
NOT: Amaç, yalıtılmış hücreler veya küçük hücre kümeleri elde etmektir. Büyük organoid fragmanlar hala gözleniyorsa, inkübasyonu (adım 4.2.4) ve mekanik bozulmayı (adım 4.2.5) tekrarlayın. - 4 mL buz gibi soğuk DMEMc ekleyin. 4 °C'de 5 dakika boyunca 500 x g'de santrifüj
- Süpernatantı atın ve organoid hücre peletini 1 mL DMEMc'de yeniden askıya alın.
- Hücreleri saymak ve organoid hücreleri önceden ısıtılmış 24 delikli plakalarda 3000 canlı hücre içeren 50 μL ECM kubbesinde tohumlamak için yukarıda açıklandığı gibi ilerleyin (adım 3.2.7 ila 3.2.13).
- P1000 pipetle kazıyarak organoidleri ECM ile ayırın. Kültür ortamında pipetleyerek dikkatlice homojenize edin ve buz üzerinde 5 mL soğuk DMEMc içeren 15 mL'lik bir konik tüpe aktarın.
5. 3D organoidlerin dondurulması
- % 10 FBS,% 10 DMSO ve 10 μM Y27632 ROCK inhibitörü ile desteklenmiş DMEMc içeren gerekli hacim (iki kubbeli bir havuz için 1 mL) dondurma çözeltisini hazırlayın ve buz üzerinde saklayın (nihai FBS konsantrasyonu% 18'dir).
- Dondurulacak kuyucuklardan kültür ortamını çıkarın.
- Dondurulacak ilk kuyucuğa 1 mL dondurma çözeltisi ekleyin, ECM'yi kazıyarak ayırın ve pipet ucu ile homojenize edin.
- Organoid süspansiyonu dondurulacak ilk kuyudan ikinci kuyucuğa aktarın.
- İki kuyucuğun havuzunu bir kriyotüpe aktarın ve şişeyi bir hücre dondurma kabına yerleştirin.
- Hücre dondurma kabını 24 saat boyunca -80 ° C'de saklayın ve ardından şişeleri uzun süreli depolama için sıvı azota aktarın.
6. 3D organoidlerden türetilen hücre monokatmanlarının kültürü
NOT: Domuz organoid hücrelerinin tek katmanları,% 20 FBS ile desteklenmiş 3D organoidler için kullanılan kültür ortamından oluşan bir 2D ortamda kültürlenir.
- Malzemelerin hazırlanması
- 2B ortamı hazırlayın ve RT'de tutun.
- 10 μM Y27632 ROCK inhibitörü ile desteklenmiş enzim ayrışma reaktifini 37 °C'de bir su banyosunda önceden ısıtın.
- Kültür kesici ucunun kaplanması
- Bir çift cımbızı sterilize edin ve biyogüvenlik kabinine aktarın.
- Hücre kültürü eklerini (0,33cm2) cımbızla 24 delikli bir plakaya yerleştirin.
- Soğuk PBS'de 50 μg/mL'de seyreltilmiş kollajen IV içeren kaplama çözeltisini hazırlayın. Karıştırmak için yukarı ve aşağı pipet
- Her hücre kültürü ekine 150 μL seyreltilmiş kollajen IV çözeltisi ekleyin, bu da 22,7 μg /cm2'ye karşılık gelir.
NOT: Pipetin geçirgen membranın merkezine dikey olarak dikkatlice yönlendirilmesi ve kollajen çözeltisinin tüm membranı kapsadığını kontrol edin. - Plakayı 37 ° C,% 5 CO2 inkübatöre yerleştirin ve gece boyunca bırakın (veya en az 3 saat).
- 3D organoid hücrelerin hücre kültürü eklerine tohumlanması
- 4.2.1 ila 4.2.7 arasındaki adımlarda açıklandığı gibi 3B organoidlerden bir hücre süspansiyonu hazırlayın.
- Bir hücre sayacı ile Trypan mavisinde 1: 2 seyreltilmiş hücreleri sayın ve kültür eki başına 2.5 x 10 5 hücreyi tohumlamak için gerekli hacmi hesaplayın, bu da 7.6 x 105 hücre /cm2'ye karşılık gelir.
- Hücre süspansiyonunun gerekli hacmini 500 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin.
- Santrifüjleme sırasında, kaplama çözeltisini kültür uçlarından dikkatlice aspire edin ve RT'de kapaksız olarak kaputun altında 5 dakika kurumaya bırakın.
- Santrifüjlemeden sonra, süpernatantı atın ve hücre peletini 10 μM Y27632 ROCK inhibitörü ile desteklenmiş gerekli hacimde 2D ortamda yeniden askıya alın. Her kesici uç için hücreleri içeren 200 μL'lik bir 2D ortam hacmi gereklidir.
- Hücre süspansiyonunun (2.5 x 105 hücreli) kaplanmış geçirgen membran (apikal taraf) üzerine 200 μL tohumu (Şekil 4A).
NOT: Membranın ortasına yavaşça pipet uygulayın ve ucu dikey tutun. - Alt bölmeye (bazal tarafa) 10 μM Y27632 ROCK inhibitörü ile desteklenmiş 500 μL 2D ortam ekleyin. 37 ° C,% 5 CO2 inkübatörde inkübe edin.
- Tohumlamadan bir gün sonra, apikal ve bazal ortamları Y27632 ROCK inhibitörü olmadan taze 2D ortamla değiştirin.
- 2B ortamı her gün değiştirin. Tek katman, tohumlamadan 1 gün sonra birleşir ve daha sonra deneyler için kullanılabilir.
NOT: Boşluğun üzerindeki transepitelyal elektrik direnci (TEER) değeri (hücresiz ek), akıcılığa ulaşıldığını doğrular (Şekil 4B).
7. Organoid hücre monokatmanlarının immünoboyaması
- Çözümlerin hazırlanması
NOT: Çözeltilerin hacmini boyanacak kuyucuk sayısına göre ayarlayın; Bir kuyu için her adımda 200 μL çözelti gereklidir. Tüm ticari ürünlere referanslar Malzeme Tablosunda verilmiştir.- 35 mL PBS'ye 5 mL% 32 PFA ekleyerek kimyasal bir başlık altında% 4'lük bir paraformaldehit (PFA) çözeltisi hazırlayın. 10 mL alikot hazırlayın ve -20 °C'de saklayın.
DİKKAT: Nitril eldiven giyerken PFA'yı daima kimyasal başlığın altında manipüle edin. - Kullanımdan hemen önce 2 μL Triton X100 ila 1 mL PBS ekleyerek %0,2 Triton X100-PBS çözeltisi hazırlayın. RT'de tutun.
- 1 mL PBS'ye 100 mg BSA ekleyerek %10'luk bir sığır serum albümini (BSA)-PBS çözeltisi hazırlayın. RT'de tutun.
- 1 mL PBS'ye 10 mg BSA ekleyerek %1'lik bir BSA-PBS çözeltisi hazırlayın. RT'de tutun.
- %1 PBS BSA'nın 995 μL'sine 5 μL primer antikor ekleyerek 1:200'de seyreltilmiş oklüdin primer antikorunun bir çözeltisini hazırlayın. Çözeltiyi buz üzerinde tutun.
- %1 BSA-PBS'nin 999 μL'sine 1 μL ikincil antikor ekleyerek 1:1.000'de seyreltilmiş sekonder antikorun bir çözeltisini hazırlayın. Çözeltiyi ışıktan korunmuş buz üzerinde tutun.
- 990 μL PBS'ye 1 mg / mL'de 10 μL TRITC ekleyerek 10 μg / mL'de bir falloidin TRITC çözeltisi hazırlayın. Işıktan korunarak buz üzerinde tutun.
- 35 mL PBS'ye 5 mL% 32 PFA ekleyerek kimyasal bir başlık altında% 4'lük bir paraformaldehit (PFA) çözeltisi hazırlayın. 10 mL alikot hazırlayın ve -20 °C'de saklayın.
- İmmün boyama
NOT: Aksi belirtilmedikçe, tüm inkübasyonlar RT'de, sallanan bir platformda (30 rpm) yavaş ajitasyon altında gerçekleştirilir. İmmün boyama doğrudan hücre kültürü ekinde gerçekleştirilir.- Bazal ve apikal ortamı çıkarın. Plakayı kimyasal başlığın altına yerleştirin.
- Tek katmanları RT'de 200 μL PBS ile iki kez yıkayın ve 5 dakika boyunca inkübe edin.
- Hücre monokatmanlarını RT'de 200 μL% 4 PFA ile sabitleyin ve RT'de 20 dakika boyunca inkübe edin.
- Tek katmanları RT'de 200 μL PBS ile iki kez yıkayın ve 5 dakika boyunca inkübe edin.
NOT: Fiksasyon ve yıkama adımlarından sonra, tek katman PBS'de 1 hafta boyunca 4 °C'de tutulabilir. - PBS'yi çıkarın, 200 μL% 0.2 Triton X100-PBS ile geçirgenleştirin ve 20 dakika boyunca inkübe edin.
- Tek katmanları RT'de 200 μL PBS ile iki kez yıkayın ve 5 dakika boyunca inkübe edin.
- % 1 BSA-PBS'ye 200 μL primer antikor çözeltisi ekleyin ve sallanan bir platformda yavaş ajitasyon altında 4 ° C'de gece boyunca inkübe edin. Birincil antikor olmadan sadece% 1 BSA-PBS ekleyerek negatif bir kontrol kuyusu ekleyin.
- Tek katmanları RT'de 200 μL PBS ile üç kez yıkayın ve 5 dakika boyunca inkübe edin.
- % 1 BSA-PBS'ye 200 μL ikincil antikor ekleyin ve ışıktan korunarak RT'de 2 saat boyunca inkübe edin.
- Tek katmanları RT'de 200 μL PBS ile üç kez yıkayın ve 5 dakika boyunca inkübe edin.
- 10 μg / mL'de 200 μL falloidin TRITC ekleyin ve 10 dakika boyunca inkübe edin.
- Tek katmanları RT'de 200 μL PBS ile iki kez yıkayın ve 5 dakika boyunca inkübe edin.
- PBS'yi çıkarın ve zarı bir neşterle kesin.
- Zarı bir çift cımbızla kurtarın ve apikal tarafı yukarı bakacak şekilde mikroskop slaydına yerleştirin.
- DAPI ile desteklenmiş montaj ortamının 15 μL'sini doğrudan membran üzerine 1:1.000'de ekleyin. Bir kapak askısı yerleştirin ve mühürleyin.
- Görüntülemeye kadar ışıktan korunmuş olarak 4 °C'de saklayın.
Sonuçlar
Yukarıda tarif edilen protokolü takiben, epitel kriptleri domuz bağırsağından elde edilir ve sıvı azotta uzun süreli depolama için kriyokorunur (Şekil 1 ve Şekil 2A). Çözüldükten sonra, kript kök hücreleri ECM'de tohumlanır (Şekil 2B). Crypt yapısı genellikle ECM'deki crypt yapısının parçalanması nedeniyle bu adımdan sonra kaybolur. Organoidler 3-4 gün içinde gözlenebilir ve daha sonra hızla büyür ve tomurcuklanan yapılar geliştirir (Şekil 2B). Dondurulmuş kriptleri çözdükten sonra girişimlerin% >80'inde organoidleri başarıyla elde ettik. Çözülmeden yaklaşık 10 gün sonra (organoidlerin büyüme hızına göre), kültürü genişletmek için bir organoid geçişi yapılır (Şekil 3). Organoidler ayrıldıktan sonra daha hızlı büyürler ve bazı kistik ve tomurcuklanan organoidlerin çoğunluğu ile çeşitli morfolojiler sunarlar. Kültürün optimal bakımı için, geçiş için kullanılan organoidler, olgun organoidlerde gözlendiği gibi, lümende siyah döküntü içermeyen (kırmızı oklarla gösterilen) net ve boş bir lümen ve iyi tanımlanmış kenarlar (yeşil oklarla gösterilen örnekler) sunmalıdır (Şekil 3). Siyah hücre kalıntılarının, geçişten sonraki 6. gün civarında birikmeye başladığını bulduk. Bu nedenle, organoidlerin 4-5. günde pas sonrası ayrılması veya dondurulması önerilir.
Organoidlerin olgunluk aşaması da hücre monokatmanlarının elde edilmesinde önemli bir noktadır. İleri olgunluğa sahip organoidler (lümende siyah hücre kalıntılarının varlığı ile gösterilir), tek katmanlı tohumlar için optimal değildir. Genellikle 2D kültür için hücre toplamak için geçişten 4 gün sonra 3D organoidleri ayırırız. ECM'nin 50 μL kubbesi başına 3.000 hücrede kültürlenmiş yaklaşık bir ila üç kuyucuk 3D organoid, 2,5 x 105 hücreli bir kültür ekinin tohumlanması için gereklidir. Hücreler 1 gün içinde bağlanır ve tamamen birleşen bir tek katman oluşturur (Şekil 4A), bu da yaklaşık 700 Ω ·cm2'lik yüksek TEER ile doğrulanır (Şekil 4B). Bununla birlikte, hücre kenarlarının, muhtemelen düşük bir farklılaşma seviyesi nedeniyle, bu erken zaman noktasında parlak alan mikroskobu ile görselleştirilmesi zordur. TEER 3 gün boyunca yüksek kalır (Şekil 4B).
Aktin boyaması, epitel hücrelerinin apikal tarafının 3D organoidlerde lümene doğru yönlendirildiğini gösterir (Şekil 5A). Kültür ekinde tohumlanan organoid hücreler, apikal tarafı üst bölmeye doğru yönlendirilmiş olarak birleşen tek bir epitel hücresi tabakası oluşturur (Şekil 4B, C). Oklüdin boyaması, 3D organoidlerde ve hücre monokatmanlarında epitel hücrelerinin apikal tarafında sıkı kavşakların varlığını ortaya koymaktadır (Şekil 5A-K).
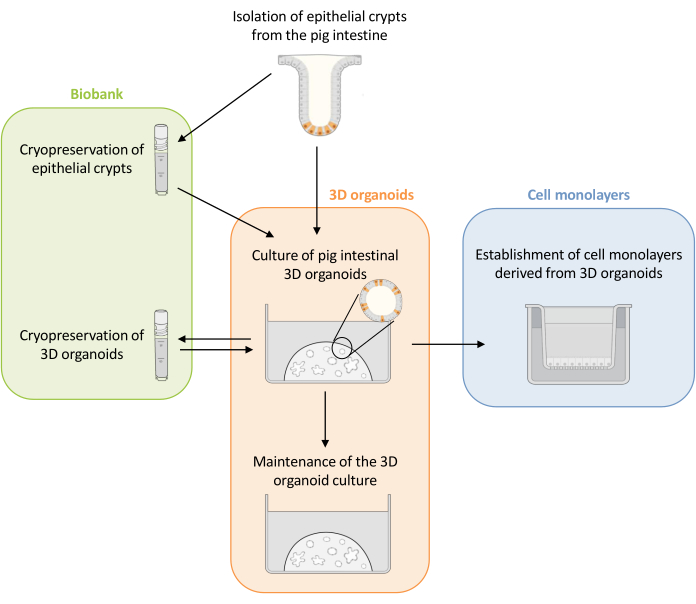
Şekil 1: Organoidlerden türetilen 3D organoidleri ve hücre monokatmanlarını kültürlemek için kullanılan yöntemlerin şematik gösterimi. Epitel kriptleri domuz yavrusu bağırsağından izole edilir. Bu kriptler i) 3D organoidleri kültürlemek için hemen kullanılabilir veya ii) dondurulabilir ve sıvı azotta bir biyobankada saklanabilir. Kriyokorunmuş kriptler çözülebilir ve 3D organoidleri kültürlemek için kullanılabilir. 3D organoid kültür, ardışık bölme ile korunabilir veya dondurulabilir ve biyobankada saklanabilir. Hücrelerin apikal tarafına erişime izin vermek ve epitel bariyer fonksiyonunu incelemek için 3D organoid kültürden hücre monokatmanları elde edilebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
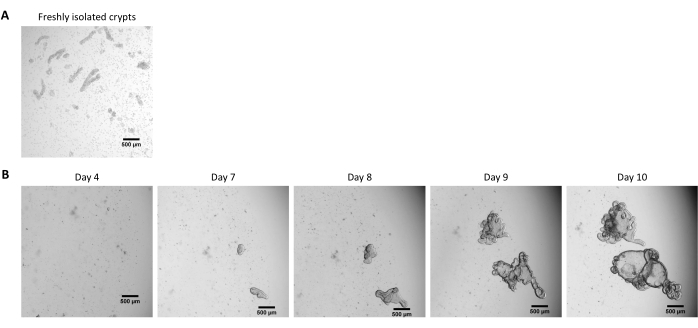
Şekil 2: Kriyokorunmuş epitel kriptlerinden domuz bağırsağı 3D organoidlerinin kültürü. (A) Yeni izole edilmiş jejunal kriptlerin temsili mikroskobik görüntüsü. (B) Jejunal kriptlerin çözülmesinden sonra elde edilen 3D organoidlerin temsili mikroskobik görüntüleri. Organoidler, 48 delikli bir plakada 25 μL'lik bir ECM kubbesinde kültürlendi. Şekil, tohumlamadan 4, 7, 8, 9 ve 10 gün sonra 3D organoidlerin görüntülerini göstermektedir. Ölçek çubuğu 500 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
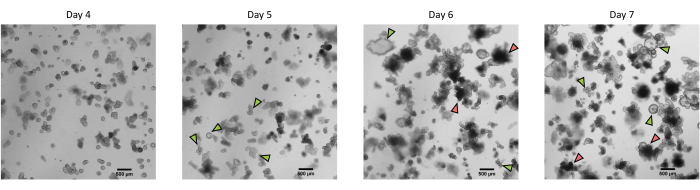
Şekil 3: İlk geçişten sonra kriyokorunmuş epitel kriptlerinden türetilen domuz bağırsağı 3D organoidlerinin morfolojisi. 4. günden 7. güne kadar ilk geçişten sonra kriyokorunmuş jejunum kriptlerinden türetilen organoidlerin gelişimini gösteren temsili mikroskobik görüntüler. Yeşil oklar, tek katmanların geçişi veya tohumlanması için uygun olan berrak organoidleri gösterir. Kırmızı oklar, tek katmanları bölmek veya tohumlamak için uygun olmayan olgun organoidleri gösterir; Bu nedenle, kuyular bu morfolojinin ortaya çıkmasından önce kullanılmalıdır. Ölçek çubuğu 500 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Domuz bağırsağı 3D organoidlerinden türetilen hücre monokatmanlarının özellikleri . (A) Tek katmanlı morfolojinin 3 gün boyunca temsili mikroskobik görüntüleri. Jejunum organoid hücreleri 2.5 x 105 hücrede, 50 ng/mL'de kollajen IV ile kaplanmış0.33 cm2 hücre kültürü eklerine tohumlandı. Ölçek çubuğu, 3 gün boyunca organoid hücreli monokatmanların 500 μm. (B) Transepitelyal elektrik direncini (TEER) temsil eder. Bir çizgi ile bağlanan noktalar, farklı zamanlarda aynı kuyuya karşılık gelir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
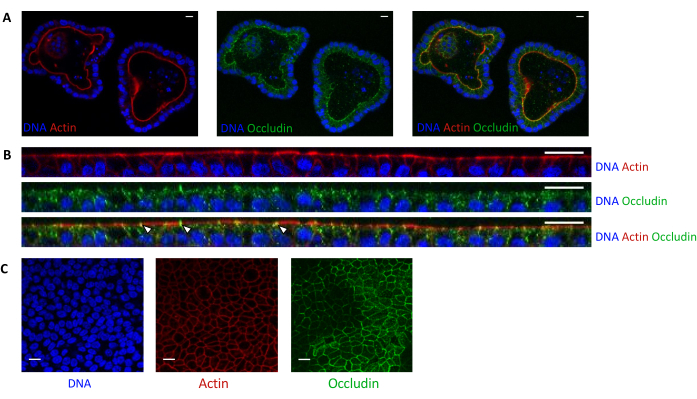
Şekil 5: 3D veya 2D olarak kültürlenmiş domuz jejunum organoidlerinin görüntülenmesi. (A) 3D organoidlerin bölünmeden 5 gün sonra ve (B,C) organoid hücreli monokatmanların tohumlamadan 3 gün sonra konfokal mikroskopi görüntülenmesi (B: XZ kesiti; C: XY bölümü). DNA (mavi) DAPI ile boyandı. Aktin (kırmızı) faloidin ile boyandı. Occludin (yeşil) poliklonal antikor ile boyandı. Beyaz oklar, sıkı kavşakta lokalize olan oklüdini gösterir. Ölçek çubuğu 20 μm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, uzun süreli depolama ve daha sonra 3D organoidlerin kültürü için domuz yavrusu bağırsağından epitel kriptlerini kriyoproteksiyon için kullanılan bir yöntemi tanımlar. Bu protokol DMSO, FBS, Y27632 ROCK inhibitörü, DMEM ve antibiyotik içeren bir dondurma çözeltisi kullanır. Domuzlarda yapılan bir başka çalışmada, benzer bir dondurma çözeltisinde kriyokorunmuş kriptlerden organoidler elde edildi, ancak ROCK inhibitörü15 olmadan. Y27632 ROCK inhibitörü, apoptozu önlemek ve kök hücre havuzunu korumak için dahil edilmiştir, çünkü çözüldükten sonra epitel kript hücreleri ayrışır, bu da hücre ölümüne ('anoikis') yol açabilir27,28. İlginç bir şekilde, at enteroidleri, sadece DMEM ve DMSO16 içeren bir kültür ortamında dondurulmuş epitel kriptlerinden elde edilmiştir; Bu basit yöntem henüz domuz epitel kriptleri için test edilmemiştir. Epitel kriptleri yerine dondurulmuş dokulardan veya biyopsilerden insan ve domuz organoidleri yetiştirmek için başka yöntemler de yayınlanmıştır 4,17. Bu yöntemin avantajı, zaman ve laboratuvar ekipmanı gerektiren kript izolasyon prosedürünü gerçekleştirmeden bağırsak dokularını doğrudan kriyoproteksiyon yeteneğidir. Bu, dokuların laboratuvardan uzakta toplanması gerektiğinde uygun olabilir. Bununla birlikte, kesimden hemen sonra kriptleri izole ederken, küçük donmuş doku parçalarından başlayarak durum böyle olmayan çok sayıda kript elde etmek için bağırsağın büyük bölümleri işlenebilir. Epitel kriptlerinin çözülmesinden sonra, organoidler tohumlamadan 3-4 gün sonra gözlendi ve 10 gün sonra ayrıldı. Bu, kültürün taze epitel kriptlerinden başlatılmasından daha yavaş bir büyüme oranıdır, bunun için organoidler tohumlama sonrası 1. günden elde edilmiştir ve genellikle 5. gün11 civarında bölünebilir. Khalil ve ark. ayrıca dondurulmuş kriptlerden15 başlayarak domuz enteroidlerinin gecikmiş bir büyümesini bildirmiştir, bu da kök hücrelerin proliferatif kapasitelerini geri kazanmaları için zamana ihtiyaç duyabileceğini düşündürmektedir. Ayrıca, dondurulmuş kriptlerden başlarken, dondurma işlemi sırasında kök hücrelerin ölümünden kaynaklanabilecek taze kriptlere kıyasla daha az sayıda organoid elde ettik. Bazı kript çözme girişimlerinde (% <20), muhtemelen optimal olmayan bir kriyoprezervasyon prosedürü nedeniyle (örneğin, muhtemelen 1 saatten fazla kript izolasyonundan sonra gecikmiş dondurma) dondurulmuş kriptlerden organoidler elde edemedik. Bu nedenle, kriptleri sayana kadar buz üzerinde tutmanızı ve mümkün olduğunca çabuk dondurmanızı öneririz.
3D organoidler için, insanlar için formüle edilmiş ticari bir organoid kültür ortamı kullanmayı seçtik. Gerçekten de, önceki raporlar domuz bağırsak organoidlerinin bu ortamla verimli bir şekilde büyüdüğünü göstermiştir 8,11,14,19,25,26,29,30. Bu kültür ortamının kullanıma hazır olması ve bir parti içinde standart bir büyüme faktörü konsantrasyonuna sahip olması ilgi çekicidir. Bununla birlikte, bu kültür ortamı maliyetlidir, bileşimi açıklanmamıştır ve bu nedenle bileşimini modüle etmek mümkün değildir. Buna karşılık, diğer çalışmalarda domuz bağırsak organoidleri farmakolojik inhibitörler, rekombinant büyüme faktörü ve / veya şartlandırılmış ortam 5,6,7,21 içeren özelleştirilmiş ortamlarda kültürlenmiştir. Son derece esnek ve daha ucuz olmasına rağmen, bu yöntem şartlandırılmış ortamların üretimi için zaman alıcıdır ve koşullu ortamdaki büyüme faktörlerinin konsantrasyonundaki potansiyel değişkenlik nedeniyle tekrarlanabilirlikten yoksun olabilir. Bu nedenle, her bir koşullu ortam partisinin kalitesi, organoid büyüme veya marker gen ekspresyonu31 ölçülerek doğrulanmalıdır.
Bir çalışma, burada kullanılan aynı ticari organoid kültür ortamında kültürlenen domuz jejunal organoidlerinin, rekombinant büyüme faktörü ve / veya şartlandırılmış medya içeren ortamlarla kültürlenen enteroidlere kıyasla daha hızlı büyüdüğünü ve daha az farklılaşmış göründüğünü göstermiştir23. Yüksek proliferatif bir durum, 3D organoidlerin kültürünü kolaylaştırır, ancak bağırsak fizyolojik özelliklerini daha fazla temsil etmek için farklılaşmayı indüklemeyi gerektirebilir. Bu protokolde, 3D organoidlerin geçişi için, hücreler sayım için tamamen ayrıştırılır ve ECM'de tohumlanan hücre sayısını kontrol etmeye izin verir. Bu, yoğunluklarından oldukça etkilenen organoidlerin fenotipinin tekrarlanabilirliğini arttırır. Dahası, hücreleri saymak, kültür programını uyarlamayı gerektiren çok düşük veya aşırı kalabalık bir kültür elde etmekten kaçınır. Diğer çalışmaların çoğu, tek hücrelere tamamen ayrışmamış organoid fragmanlar hazırladı ve geçiş için bir seyreltme oranı kullandı. Bu yöntem daha basittir, ancak kültürün organoid yoğunluğuna göre değişkenliğe neden olabilir.
Tek katmanlı kültür için, organoid hücreler, hücrelerin bağlanmasına izin veren, ancak organoidlerin 3D'de büyümesini önleyen ince bir ECM tabakası ile önceden kaplanmış kültür eklerine ekilir. Bu protokol, daha önce domuzlarda23'te tarif edildiği gibi, bir ECM proteini olarak kollajen tip IV'ü kullandı. Domuz organoid monokatmanları ile yapılan diğer çalışmalar, burada 3D organoidleri 6,8,9,21,25,30'u kültürlemek için kullanılan tümör kaynaklı ECM'yi kullanmıştır. Kollajen kullanmanın avantajı, protein konsantrasyonunu tümör kaynaklı ECM'de geçerli olmayan, tam olarak tanımlanmış bir bileşimle standartlaştırma yeteneğidir. Hücre monokatmanları kültürünün başarısı için kritik bir adım, iyi tanımlanmış kenarlara ve siyah döküntü içermeyen boş bir lümene sahip olması gereken öncü 3D organoidlerin görsel görünümüne dikkat etmektir. Gerçekten de, yüksek olgunlaşma seviyesine ve düşük proliferatif orana sahip organoidler, 2D kültür için uygun bir hücre kaynağı değildir. Bu nedenle, 3D organoidlerin tek hücrelere ayrışmasının zamanlaması, bu adımın başarısı için çok önemlidir.
Tek hücrelerden 2D tek katmanlı kültür, tohumlanan hücre sayısının standartlaştırılmasına izin verir, bu da diğer bazı yöntemlerde yapıldığı gibi organoid parçalardan başlarken daha zordur. Cm2 başına 7.6 x 10 5 hücre tohumladık, bu da cm2 başına 0.25 x 105 hücre ile cm2 başına 1.78 x 10 5 hücre arasında değişen daha düşük bir hücre yoğunluğu kullanan domuzlarda 21.22.23 diğer çalışmaların çoğuna kıyasla yüksektir. Çok sayıda organoid hücrenin gerekliliği bu protokolün bir sınırlamasını oluşturur, ancak 1 gün sonra kültür ekini tamamen kaplayan hızlı bir şekilde akıcı bir tek katman elde etmemizi sağladı. Buna karşılık, Vermeire ve ark.23, tohumlanan hücrelerin daha düşük bir yoğunluğu ile 4-7 gün sonra akıcılık elde etmişlerdir (0.25 x 10 5 hücre / cm2'den 0.4 x 105 hücre /cm2'ye). Bazı çalışmalar, virüs 8,30 ile enfeksiyonlar için kültür yüzeyini tam olarak kaplamayan domuz organoid hücre monokatmanlarınıda kullanmıştır. Bu koşullarda, epitel hücrelerinin apikal tarafına tedaviler için erişilebilir, ancak amaç besin emilimini veya epitel geçirgenliğini incelemek ise, tamamen birleşen tek katmanlar gereklidir.
Organoid hücre monokatmanları için, sığır enteroid türevi monokatmanlar32 üzerine yapılan yeni bir araştırmaya dayanarak,% 20 FBS ile desteklenmiş ticari bir organoid kültür ortamı kullanılmıştır. Testlerimizde, muhtemelen yüksek bir büyüme faktörü gereksinimi nedeniyle, tamamen akıcı tek katmanlı elde etmek için% 20 FBS takviyesi gerekliydi. Aksine, aynı ticari ortamı kullanan diğer çalışmalar, ek FBS 8,25,30 olmadan, ancak tam akıcılığa ulaşmadan tek katmanlar oluşturmuştur. Diğer çalışmalar ayrıca, domuz organoid hücre monokatmanlarının kültürü için özelleştirilmiş bir ortamda% 20 FBS ile takviye kullanmıştır21,22. Deneylerimizde, TEER tohumlamadan 1 gün sonra yüksektir (yaklaşık 700 Ω · cm2) ve 3. güne kadar yüksek kalır (yaklaşık 1.500 Ω ·cm2; Bu, oklüdin ifadesiyle belirtildiği gibi sıkı bağlantıların oluşumu ile tutarlıdır. Van der Hee ve ark., jejunum organoid hücre monokatmanları21 için 72 saat üzerinde benzer TEER değerleri elde etmişlerdir. Ayrıca, tek katmanların günlük medya değişiklikleriyle 12-15. güne kadar korunabileceğini gösterdiler. Buna karşılık, diğer çalışmalar domuz organoid hücre monokatmanları için çok daha düşük TEER değerleri (yaklaşık 200 Ω ·cm2) bildirmiştir 6,22. Çalışmalar arasındaki bu farklılıklar, çalışılan bağırsak segmenti veya epitel farklılaşmasını etkileyen kullanılan medya ile ilgili olabilir.
Sonuç olarak, dondurulmuş epitel kriptlerinden domuz bağırsağı 3D organoidleri yetiştirmek için yukarıdaki protokol, kültür çalışmalarının organizasyonunu kolaylaştırır. Canlı hayvanlardan elde edilecek taze dokulara olan ihtiyacı azaltır. Ayrıca, domuz organoidlerinden türetilen tamamen birleşik hücre monokatmanlarının 3 günden daha kısa sürede nasıl oluşturulacağını da açıklıyoruz. Bu nedenle, protokollerimiz veterinerlik veya biyomedikal araştırmalar için domuz bağırsak epitelini inceleyen bilim adamları için yararlı kaynaklar olabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma Institut Carnot France Futur Elevage ("OrganoPig" projesi) ve INRAE HOLOFLUX ("Holopig" projesi) tarafından desteklenmiştir. Yazarlar Genotoul çekirdek tesislerine (TRI) minnettardır. Christelle Knudsen'e (GenPhySE, INRAE, Toulouse) dikkatli redaksiyonu için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer’s recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
Referanslar
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33(2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465(2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368(2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682(2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375(2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031(2022).
- Zhu, M., Qin, Y. -C., Gao, C. -Q., Yan, H. -C., Wang, X. -Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143(2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94(2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821(2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011(2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196(2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394(2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430(2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15(2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır