Method Article
Cultura de Organoides 3D Intestinais de Leitões a partir de Criptas Epiteliais Criopreservadas e Estabelecimento de Monocamadas Celulares
Neste Artigo
Resumo
Neste trabalho, descrevemos um protocolo de cultivo de organoides 3D intestinais de suínos a partir de criptas epiteliais criopreservadas. Descrevemos também um método para estabelecer monocamadas celulares derivadas de organoides 3D, permitindo o acesso ao lado apical de células epiteliais.
Resumo
Os organoides intestinais estão sendo cada vez mais usados para estudar o epitélio intestinal para modelagem de doenças digestivas, ou para investigar interações com drogas, nutrientes, metabólitos, patógenos e a microbiota. Métodos para cultivar organoides intestinais estão agora disponíveis para várias espécies, incluindo porcos, que é uma espécie de grande interesse tanto como animal de criação quanto como modelo translacional para humanos, por exemplo, para estudar doenças zoonóticas. Aqui, descrevemos em profundidade um procedimento usado para cultivar organoides 3D intestinais de suínos a partir de criptas epiteliais congeladas. O protocolo descreve como criopreservar criptas epiteliais do intestino de suínos e os procedimentos subsequentes para cultura de organoides intestinais 3D. As principais vantagens deste método são (i) a dissociação temporal do isolamento de criptas da cultura de organoides 3D, (ii) a preparação de grandes estoques de criptas criopreservadas derivadas de múltiplos segmentos intestinais e de vários animais ao mesmo tempo e, portanto, (iii) a redução da necessidade de coletar amostras de tecidos frescos de animais vivos. Também detalhamos um protocolo para estabelecer monocamadas celulares derivadas de organoides 3D para permitir o acesso ao lado apical das células epiteliais, que é o local de interações com nutrientes, micróbios ou drogas. De modo geral, os protocolos aqui descritos são um recurso útil para o estudo do epitélio intestinal de suínos em pesquisas veterinárias e biomédicas.
Introdução
O epitélio intestinal é formado por uma monocamada de células que recobre a mucosa digestiva na interface com o meio luminal. Essa posição está associada a diversas funções, como absorção de nutrientes e função de barreira, que são suportadas pela presença de células-tronco e múltiplos tipos de células epiteliais diferenciadas (absortivas, enteroendócrinas, paneth e caliciformes)1. Linhagens celulares imortalizadas tradicionalmente utilizadas para o estudo de células epiteliais apresentam grandes limitações, pois não refletem a complexidade celular do epitélio intestinal e apresentam anormalidadesgenômicas2. O desenvolvimento de organoides tridimensionais (3D) por Sato et al.3 forneceu um novo modelo para o estudo do epitélio intestinal com melhor relevância fisiológica. De fato, os organoides intestinais são derivados de células-tronco não transformadas, são compostos por vários tipos celulares e recapitulam a funcionalidade do epitélio intestinal. Os organoides intestinais estão sendo cada vez mais utilizados para compreender o desenvolvimento e as funções do epitélio intestinal e suas interações com patógenos, nutrientes, toxinas, fármacos, microbiota e seus metabólitos2.
Inicialmente desenvolvidos para humanos e camundongos, os métodos utilizados para cultivo de organoides intestinais foram recentemente adaptados para outras espécies, incluindosuínos4. Gonzales et al.5 foram os primeiros a cultivar organoides de suínos a partir do jejuno; Desde então, organoides suínos têm sido descritos para outros segmentos intestinais (duodeno, íleo e cólon)6,7,8 e demonstraram manter um fenótipo local-específico9,10,11. Organoides 3D intestinais de suínos são atualmente comumente utilizados para estudar o efeito de nutrientes 12,13 ou infecções entéricas 6,8,14.
A maioria dos estudos descreveu a cultura de organoides intestinais a partir de criptas epiteliais recém-isoladas. No entanto, isso nem sempre é viável por razões logísticas, principalmente quando se trabalha com animais de grande porte, como porcos. De fato, as instalações para animais para suínos podem ser localizadas longe do laboratório onde os organoides são cultivados, o que dificulta a organização do trabalho. Além disso, a cultura de organoides é demorada; Assim, não é prático cultivar simultaneamente múltiplas linhas organoides, por exemplo, a partir de diferentes segmentos intestinais ou vários animais. Para contornar essas questões, poucos estudos em humanos, equinos e suínos descreveram métodos para cultura de organoides a partir de tecidos intestinais congelados (ou biópsias) ou de criptas epiteliais isoladas 4,15,16,17. Esses métodos permitem a criopreservação de células-tronco epiteliais intestinais de múltiplos segmentos intestinais de um único animal, que podem ser usadas para cultivar organoides quando necessário. Além disso, isso permite uma forte redução no número de animais vivos utilizados como doadores de células-tronco, uma vez que grandes estoques de criptas criopreservadas podem ser criados (princípios do 3R). Outra vantagem deste método é o crescimento de organoides intestinais apenas a partir de animais de interesse após a obtenção de resultados fenotípicos ou genotípicos, o que é altamente custo-efetivo.
In vivo, as células epiteliais intestinais são polarizadas, com o lado apical direcionado para a luz. In vitro, em organoides 3D, o lado apical das células epiteliais também está voltado para o lúmen (ou seja, dentro dos organoides)4. Essa organização impede o acesso ao lado apical, o que é um problema ao estudar os efeitos de componentes luminais (por exemplo, nutrientes, micróbios, metabólitos) nas células epiteliais. Para contornar essa desvantagem, vários métodos têm sido desenvolvidos, como o cultivo de células organoides como monocamadas 2D, microinjeção e reversão de polaridade ("apical-out organoids")18,19. A cultura de monocamadas de células organoides vem emergindo como o sistema mais eficiente e tratável. O princípio é dissociar organoides 3D em células únicas e semeá-los em um vaso de cultura celular previamente revestido com uma fina camada de matriz extracelular (MEC)20. Nessas condições de cultura, a face apical das células epiteliais está voltada para cima, sendo, portanto, acessível a tratamentos experimentais20. A cultura de monocamadas de células organoides foi recentemente adaptada para o intestino desuínos 21,22; monocamadas celulares derivadas de organoides 3D de suínos têm sido utilizadas para múltiplas aplicações, incluindo o estudo de infecções entéricas 6,23,24,25, o transporte de nutrientes9 e a modelagem de doenças digestivas 26.
Aqui, este estudo apresenta primeiramente um protocolo detalhado para o cultivo e manutenção de organoides 3D intestinais de suínos derivados de criptas epiteliais criopreservadas (Figura 1). Em seguida, um protocolo é descrito para estabelecer monocamadas celulares a partir de organoides 3D intestinais de suínos. Os métodos aqui descritos fornecem ferramentas experimentais que podem ser usadas para estudar o epitélio intestinal de suínos quanto ao transporte de nutrientes, função de barreira e interações hospedeiro-microrganismo.
Protocolo
Este protocolo foi aprovado pelo comitê de ética local (N°TOXCOM/0136/PP) de acordo com a diretiva europeia sobre a proteção de animais usados para fins científicos (2010/63/UE). Este protocolo é descrito para o jejuno como exemplo, mas pode ser usado para cada segmento do intestino delgado e grosso (duodeno, jejuno, íleo, cólon).
1. Isolamento de criptas epiteliais do intestino do leitão
NOTA: Preparar um estoque de meio águia modificado de Dulbecco completo (DMEMc) com DMEM suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina-estreptomicina (P/S). Preparar alíquotas de 50 mL e armazená-las a 4 °C por 1 mês.
- Preparação das soluções (a ser feita no dia do isolamento da cripta)
- Preparar a solução de dissociação contendo solução salina tamponada com fosfato (PBS), ditiotreitol (DTT) 3 mM, ácido etilenodiaminotetracético (EDTA) 9 mM, inibidor de ROCK Y27632 μM e penicilina-estreptomicina a 1% (P/S) e armazenar no gelo.
- Preparar a solução de congelamento contendo DMEMc, FBS a 10%, dimetilsulfóxido a 10% (DMSO) e inibidor de ROCK Y27632 μM e armazenar no gelo (a concentração final de FBS é de 18%).
- Preparar a solução de transporte contendo PBS frio suplementado com 1% P/S e armazená-la no gelo.
- Isolamento de criptas epiteliais
- Abate de um leitão por eletronarcose seguido de exsanguinação.
- Imediatamente após o abate, abra o abdômen do leitão com um bisturi e remova todo o intestino.
- Coletar aproximadamente 2 cm de um segmento intestinal e armazená-lo em solução de transporte a frio. Mantenha o segmento no gelo até o isolamento da cripta (até 2 h).
- Coloque o tecido em uma placa de Petri. Abra o segmento intestinal longitudinalmente e lave cuidadosamente o tecido em PBS frio suplementado com P/S a 1% para remover o conteúdo intestinal.
- Transferir o tecido para uma nova placa de Petri preenchida com 10 mL de PBS frio suplementado com 1% P/S.
- Segure o tecido com uma pinça e remova as vilosidades e o muco restante raspando com uma lâmina de microscópio.
NOTA: A remoção das vilosidades (a estrutura em forma de língua) pode ser verificada pela observação microscópica do sobrenadante. - Transferir o tecido para um tubo cônico de 15 mL contendo 5 mL de solução de dissociação gelada e incubar por 30 min à temperatura ambiente (TR) em um agitador rotativo (15 rpm).
- Transferir o tecido para uma nova placa de Petri e adicionar 10 mL de PBS frio suplementado com 1% P/S.
- Isole as criptas mecanicamente raspando firmemente a mucosa com uma lâmina de microscópio.
OBS: Ao microscópio, verificar a presença de criptas epiteliais em PBS (Figura 2A). - Aspirar a solução da cripta com um pipeto sorológico e filtrar através de um filtro celular de 100 μm em um tubo cônico de 50 mL.
- Pipetar 10 μL da solução e verificar a presença de criptas ao microscópio. Centrifugar a 300 x g durante 5 min a 4 °C.
- Sob um gabinete de biossegurança estéril, descarte o sobrenadante e ressuspenda o pellet de criptas em 10 mL de DMEMc frio suplementado com 10 μM inibidor de ROCK Y27632.
- Pipetar 10 μL da solução da cripta em uma placa de 48 poços. Contar manualmente o número de criptas ao microscópio com aumento de 10x e calcular a concentração de criptas por mL de solução.
NOTA: As criptas isoladas podem ser usadas diretamente para cultura de organoides intestinais. No entanto, muitas vezes é mais conveniente criopreservar um grande lote de criptas de cada leitão e usá-las mais tarde para cultura de organoides.
- Congelamento de criptas epiteliais
- Transferir um volume correspondente a 900 criptas em um tubo cônico de 15 mL. Centrifugar a 300 x g durante 5 min a 4 °C.
- Eliminar o sobrenadante e voltar a suspender o pellet de criptas em 1 ml da solução de congelação. Transfira para um criotubo e coloque o frasco para injetáveis num recipiente de congelamento celular.
- Conservar o recipiente de congelação de células a -80 °C durante 24 h e, em seguida, transferir os frascos para injetáveis para azoto líquido para armazenamento a longo prazo.
2. Estabelecimento de organoides 3D intestinais de leitões a partir de criptas epiteliais congeladas
NOTA: Os organoides intestinais 3D de leitões são cultivados em meio de cultura comercial formulado para o crescimento de organoides humanos, suplementado com 1% P/S e 100 μg/mL de um agente antimicrobiano para células primárias, e armazenado a 4 °C por até 1 semana. Uma matriz extracelular (MEC) derivada de tumor é usada para a cultura de organoides 3D. Todas as referências de produtos comerciais são apresentadas na Tabela de Materiais.
- Preparação de materiais
- Coloque as pontas da pipeta a -20 °C (pelo menos durante a noite).
- Colocar as alíquotas congeladas da MEC (500 μL) a 4 °C com pelo menos 1 h de antecedência.
- Pré-aqueça uma placa de 48 poços em uma incubadora de 37 °C e 5% de CO2 .
- Coloque o meio de cultura no RT.
- Pré-aqueça em banho-maria a 37 °C.
- Coloque um pequeno balde de gelo sob o capô em condições assépticas.
- Descongelamento de criptas epiteliais congeladas
- Descongelar rapidamente um frasco para injetáveis contendo 900 criptas congeladas em banho-maria a 37 °C (menos de 5 min).
- Transfira a solução da cripta para um tubo cônico de 15 mL.
- Centrifugar a 300 x g por 5 min em RT. Retire o sobrenadante
- Adicionar 150 μL da MEC com pontas resfriadas para obter uma concentração final de 150 criptas por 25 μL de MEC. Pipetar para cima e para baixo 10 vezes para obter uma suspensão homogênea de criptas na MEC.
OBS: Mantenha sempre o ECM no gelo para evitar a polimerização. Use sempre pontas de pipeta pré-resfriadas a -20 °C para manipular o ECM. Pipetar lentamente para evitar a formação de bolhas de ar na MEC. Um ECM não diluído é usado nesta etapa para evitar que as pequenas gotas entrem em colapso. - Semeando seis poços com uma gota de 25 μL por poço com pontas resfriadas em uma placa pré-aquecida de 48 poços.
OBS: Mantenha a ponta vertical, no centro do poço, e pipete lentamente sem introduzir ar para obter uma cúpula. Aqui, placas de 48 poços são usadas, já que o número de organoides geralmente é baixo quando se parte de criptas congeladas. - Incubar por 30 min em estufa a 37 °C, 5% CO2 para polimerização da MEC.
- Adicionar 250 μL por poço de meio de cultura em RT. Incubar em uma incubadora de 37 °C, 5% CO 2 e trocar o meio de cultura a cada2-3 dias
NOTA: As criptas geralmente não são visíveis após o procedimento de descongelamento, e a maioria das células está dissociada na MEC (Figura 2B).
3. Passagem de organoides 3D intestinais de leitões derivados de criptas congeladas
NOTA: O tempo para obter organoides de criptas congeladas é geralmente maior do que quando se inicia a partir de criptas frescas. Os organoides geralmente estão prontos para serem divididos 10 dias após o descongelamento (Figura 2B).
- Preparação de materiais
- Colocar as alíquotas congeladas da MEC (500 μL) a 4 °C durante, pelo menos, 1 h.
- Pré-aqueça as placas de 24 poços a 37 °C.
- Pré-aquecer o PBS e o reagente de dissociação enzimática suplementado com 10 μM Y27632 inibidor de ROCK em banho-maria a 37 °C.
- Coloque o meio de cultura no RT.
- Coloque um pequeno balde de gelo sob o capô em condições assépticas.
- Passagem de organoides 3D derivados de criptas congeladas
- Retire o meio de cultura e lave com 250 μL de PBS pré-aquecido a 37 °C.
- Adicionar 250 μL de reagente de dissociação enzimática pré-aquecido suplementado com 10 μM de inibidor de ROCK Y27632 a 37 °C em cada poço.
NOTA: Devido ao baixo número de organoides, a dissociação dos organoides é realizada diretamente em cada poço. - Destacar os organoides na MEC raspando com uma pipeta P1000 e homogeneizar cuidadosamente por pipetagem cinco vezes.
- Incubar durante 5 minutos numa incubadora a 37 °C, 5% CO2 . Dissociar as células pipetando para cima e para baixo 10 vezes usando uma pipeta P1000.
NOTA: O objetivo é obter células isoladas ou pequenos aglomerados de células (<10 células). Verifique a dissociação ao microscópio. Se ainda forem observados grandes fragmentos de organoides, repetir o passo 3.2.4. - Adicionar 500 μL de DMEMc em cada poço contendo células dissociadas e agrupar até 12 poços em um tubo cônico de 15 mL contendo 3 mL de DMEMc frio.
- Centrifugar a 500 x g durante 5 min a 4 °C. Eliminar o sobrenadante e ressuspender o pellet em 1 mL de DMEMc frio.
- Conte as células com uma diluição de 1:2 em azul de Trypan com um contador de células.
Observação : O contador de células automatizado pode contar as células dentro de pequenos clusters, se presente. - Centrifugar o volume necessário da solução celular para ter 3.000 células vivas por cúpula (uma cúpula por poço da placa de 24 poços) a 500 x g por 5 min a 4 °C.
- Ressuspender as células com 17 μL de DMEMc frio por 3.000 células vivas no gelo. Ajuste o volume ao número necessário de poços.
- Adicione lentamente 33 μL de ECM fria com pontas resfriadas por 3.000 células vivas e homogeneize no gelo sem formar bolhas. Ajuste o volume ao número necessário de poços.
NOTA: As células são ressuspensas em uma solução contendo 1/3 DMEMc e 2/3 ECM. Para cada cúpula, são necessários 50 μL desta solução. O ECM diluído é mais barato e mais fácil de pipetar. - Semeando os poços com 50 μL da suspensão de células ECM por poço com pontas resfriadas em uma placa de 24 poços pré-aquecida.
- Incubar por 30 min em estufa a 37 °C, 5% CO2 para polimerização da MEC.
- Adicionar 500 μL do meio de cultura por poço. Incubar em uma incubadora a 37 °C, 5% CO 2 e trocar o meio de cultura a cada2-3 dias
NOTA: Os organoides podem ser usados diretamente para i) experimentos, ii) manutenção da cultura de organoides 3D, iii) congelamento, ou iv) semeadura das monocamadas de células organoides (Figura 1). Verifique o crescimento dos organoides com um microscópio todos os dias para escolher o momento ideal para dividir os organoides. Os organoides devem ter lúmen claro e vazio e bordas bem definidas. Organoides maduros com restos pretos no lúmen não devem ser usados para divisão (Figura 3).
4. Manutenção da cultura de organoides em 3D
NOTA: Para a passagem, os organoides devem aparecer claros com um lúmen vazio. Detritos pretos aparecem no lúmen aproximadamente 5 dias após a divisão e indicam a presença de células mortas. Limitar o número de células mortas no momento da passagem é preferível para a manutenção ideal da cultura. O cronograma deve, portanto, ser adaptado para evitar atingir esse estágio de maturidade.
- Preparação do material
- Colocar as alíquotas da MEC (500 μL) a 4 °C para descongelar durante, pelo menos, 1 h.
- Pré-aqueça uma placa de 24 poços a 37 °C.
- Pré-aquecer o reagente de dissociação enzimática suplementado com 10 μM Y27632 inibidor de ROCK em banho-maria a 37 °C.
- Coloque o meio de cultura no RT.
- Coloque um pequeno balde de gelo sob o capô em condições assépticas.
- Passagem de organoides intestinais 3D
- Separar os organoides com a MEC raspando com uma pipeta P1000. Homogeneizar cuidadosamente por pipetagem no meio de cultura e transferir para um tubo cônico de 15 mL contendo 5 mL de DMEMc gelado sobre gelo.
NOTA: Um tubo cônico de 15 mL é necessário para uma piscina com 12 poços de organoides cultivados em cúpulas de 50 μL em placas de 24 poços. - Centrifugar os organoides recolhidos a 500 x g durante 5 min a 4 °C.
NOTA: Os organoides formam uma pelota branca no fundo do tubo. Se os organoides ainda estiverem na suspensão na MEC após a centrifugação, aspirar cuidadosamente o sobrenadante superior (sem tocar na camada da MEC), homogeneizar pipetando 10 vezes com uma pipeta P1000 e repetir a etapa de centrifugação. A camada de ECM não deve ficar visível após esse procedimento. - Aspirar cuidadosamente o sobrenadante e ressuspender o pellet celular em 1 mL de reagente de dissociação enzimática pré-aquecido suplementado com 10 μM inibidor de ROCK Y27632. Pipetar para cima e para baixo 10 vezes para iniciar a dissociação dos organoides.
- Incubar durante 5 minutos em banho-maria a 37 °C para digestão enzimática.
- Interrompa mecanicamente os organoides pipetando 10 vezes com uma pipeta P1000. Verifique a suspensão celular ao microscópio.
NOTA: O objetivo é obter células isoladas ou pequenos aglomerados de células. Se ainda forem observados grandes fragmentos organoides, repetir a incubação (passo 4.2.4) e a ruptura mecânica (passo 4.2.5). - Adicionar 4 mL de DMEMc gelado. Centrifugar a 500 x g durante 5 min a 4 °C
- Eliminar o sobrenadante e ressuspender o pellet de células organoides em 1 mL de DMEMc.
- Proceda como descrito acima (passos 3.2.7 a 3.2.13) para contar as células e semear as células organoides em 50 μL de cúpulas de MEC contendo 3000 células vivas em placas pré-aquecidas de 24 poços.
- Separar os organoides com a MEC raspando com uma pipeta P1000. Homogeneizar cuidadosamente por pipetagem no meio de cultura e transferir para um tubo cônico de 15 mL contendo 5 mL de DMEMc gelado sobre gelo.
5. Congelamento de organoides 3D
- Preparar o volume necessário (1 mL para um pool de duas cúpulas) de solução de congelamento contendo DMEMc suplementado com FBS a 10%, DMSO a 10% e inibidor de ROCK Y27632 μM e armazenar no gelo (a concentração final de FBS é de 18%).
- Retire o meio de cultura dos poços a serem congelados.
- Adicionar 1 mL da solução de congelamento ao primeiro poço a ser congelado, separar a MEC por raspagem e homogeneizar com a ponta da pipeta.
- Transfira a suspensão organoide do primeiro poço para o segundo poço a ser congelado.
- Transfira a piscina dos dois poços para um criotubo e coloque o frasco para injetáveis em um recipiente de congelamento celular.
- Conservar o recipiente de congelação celular a -80 °C durante 24 h e, em seguida, transferir os frascos para injetáveis para azoto líquido para armazenamento a longo prazo.
6. Cultura de monocamadas celulares derivadas de organoides 3D
NOTA: Monocamadas de células organoides de suínos são cultivadas em meio 2D composto pelo meio de cultura utilizado para organoides 3D suplementado com 20% de SFB.
- Preparação de materiais
- Prepare o meio 2D e mantenha-o em RT.
- Pré-aquecer o reagente de dissociação enzimática suplementado com 10 μM Y27632 inibidor de ROCK em banho-maria a 37 °C.
- Revestimento da pastilha de cultura
- Esterilize uma pinça e transfira-as para o gabinete de biossegurança.
- Colocar as pastilhas de cultura celular (0,33 cm2) em uma placa de 24 poços com a pinça.
- Preparar a solução de revestimento contendo colagénio IV diluído a 50 μg/ml em PBS frio. Pipetar para cima e para baixo para misturar
- Adicionar 150 μL da solução de colágeno IV diluída a cada pastilha de cultura celular, o que corresponde a 22,7 μg/cm2.
NOTA: Orientar cuidadosamente a pipeta verticalmente para o centro da membrana permeável e verificar se a solução de colágeno cobre toda a membrana. - Coloque a placa numa incubadora a 37 °C, 5% CO2 e deixe durante a noite (ou durante um mínimo de 3 h).
- Semeadura de células organoides 3D em inserções de cultura celular
- Preparar uma suspensão celular a partir dos organoides 3D, conforme descrito nos passos 4.2.1 a 4.2.7.
- Contar as células com uma diluição de 1:2 em azul de Trypan com um contador de células e calcular o volume necessário para semear 2,5 x 10 5 células por inserção de cultura, correspondendo a 7,6 x 105 células/cm2.
- Centrifugar o volume necessário da suspensão celular a 500 x g durante 5 min a 4 °C.
- Durante a centrifugação, aspirar cuidadosamente a solução de revestimento das pastilhas de cultura e deixar secar em RT sob o capô sem tampa por 5 min.
- Após a centrifugação, descartar o sobrenadante e ressuspender o pellet celular no volume necessário de meio 2D suplementado com 10 μM inibidor de ROCK Y27632. Um volume de 200 μL de meio 2D contendo as células é necessário para cada inserção.
- Semeando 200 μL da suspensão celular (2,5 x 105 células) para a membrana permeável revestida (lado apical) (Figura 4A).
OBS: Pipetar lentamente no centro da membrana e manter a ponta vertical. - Adicionar 500 μL do meio 2D suplementado com 10 μM do inibidor Y27632 ROCK ao compartimento inferior (lado basal). Incubar em uma incubadora a 37 °C, 5% CO2 .
- Um dia após a semeadura, substituir o meio apical e basal por meio 2D fresco sem o inibidor Y27632 ROCK.
- Mude o meio 2D todos os dias. A monocamada torna-se confluente 1 dia após a semeadura, podendo então ser usada para experimentos.
NOTA: Um valor de resistência elétrica transepitelial (TEER) acima do espaço em branco (inserir sem células) confirma que a confluência foi atingida (Figura 4B).
7. Imunomarcação de monocamadas de células organoides
- Preparação de soluções
OBS: Ajustar o volume de soluções de acordo com o número de poços a serem corados; São necessários 200 μL da solução em cada etapa para um poço. As referências a todos os produtos comerciais são fornecidas na Tabela de materiais.- Preparar uma solução de paraformaldeído (PFA) a 4% sob uma capa química adicionando 5 ml de PFA a 32% a 35 ml de PBS. Preparar alíquotas de 10 ml e conservar a -20 °C.
CUIDADO: Sempre manipule o PFA sob o capô químico, usando luvas nitrílicas. - Preparar uma solução de Triton X100-PBS a 0,2%, adicionando 2 μL de Triton X100 a 1 ml de PBS imediatamente antes da utilização. Mantenha-se na RT.
- Preparar uma solução de albumina de soro bovino (BSA)-PBS a 10% adicionando 100 mg de BSA a 1 mL de PBS. Mantenha-se na RT.
- Preparar uma solução de BSA-PBS a 1% adicionando 10 mg de BSA a 1 ml de PBS. Mantenha-se na RT.
- Preparar uma solução do anticorpo primário ocludina diluída a 1:200 adicionando 5 μL de anticorpo primário a 995 μL de BSA PBS a 1%. Mantenha a solução no gelo.
- Preparar uma solução do anticorpo secundário diluída a 1:1.000 adicionando 1 μL de anticorpo secundário a 999 μL de BSA-PBS a 1%. Mantenha a solução no gelo, protegida da luz.
- Preparar uma solução de faloidina TRITC a 10 μg/mL adicionando 10 μL de TRITC a 1 mg/mL a 990 μL de PBS. Manter no gelo, protegido da luz.
- Preparar uma solução de paraformaldeído (PFA) a 4% sob uma capa química adicionando 5 ml de PFA a 32% a 35 ml de PBS. Preparar alíquotas de 10 ml e conservar a -20 °C.
- Imunomarcação
NOTA: Salvo indicação em contrário, todas as incubações são realizadas em TR, sob agitação lenta em plataforma de balanço (30 rpm). A imunomarcação é realizada diretamente na inserção da cultura celular.- Retirar o meio basal e apical. Coloque a placa sob o capô químico.
- Lavar as monocamadas duas vezes com 200 μL de PBS em TR e incubar por 5 min.
- Fixar as monocamadas celulares com 200 μL de PFA a 4% em TR e incubar por 20 min em TR.
- Lavar as monocamadas duas vezes com 200 μL de PBS em TR e incubar por 5 min.
NOTA: Após as etapas de fixação e lavagem, a monocamada pode ser mantida a 4 °C em PBS por 1 semana. - Remover o PBS, permeabilizar com 200 μL de Triton X100-PBS a 0,2% e incubar por 20 min.
- Lavar as monocamadas duas vezes com 200 μL de PBS em TR e incubar por 5 min.
- Adicionar 200 μL de solução de anticorpos primários em BSA-PBS a 1% e incubar durante a noite a 4 °C, sob agitação lenta sobre uma plataforma de balanço. Incluir um poço de controle negativo adicionando apenas 1% de BSA-PBS sem o anticorpo primário.
- Lavar as monocamadas três vezes com 200 μL de PBS em TR e incubar por 5 min.
- Adicionar 200 μL de anticorpo secundário em BSA-PBS a 1% e incubar em TR por 2 h, protegido da luz.
- Lavar as monocamadas três vezes com 200 μL de PBS em TR e incubar por 5 min.
- Adicionar 200 μL de faloidina TRITC a 10 μg/mL e incubar por 10 min.
- Lavar as monocamadas duas vezes com 200 μL de PBS em TR e incubar por 5 min.
- Retire o PBS e corte a membrana com um bisturi.
- Recupere a membrana com uma pinça e coloque-a em uma lâmina de microscópio, com o lado apical voltado para cima.
- Adicionar 15 μL do meio de montagem suplementado com DAPI a 1:1.000 diretamente na membrana. Coloque uma tampa e lacre.
- Conservar a 4 °C, protegido da luz, até à obtenção de imagens.
Resultados
Seguindo o protocolo descrito acima, criptas epiteliais são obtidas do intestino de suínos e criopreservadas para armazenamento em nitrogênio líquido a longo prazo (Figura 1 e Figura 2A). Após o descongelamento, as células-tronco das criptas são semeadas na MEC (Figura 2B). A estrutura da cripta é geralmente perdida após esta etapa, devido à desintegração da estrutura da cripta no ECM. Os organoides podem ser observados dentro de 3-4 dias, e então crescem rapidamente e desenvolvem estruturas em brotamento (Figura 2B). Obtivemos organoides após o descongelamento de criptas congeladas em >80% das tentativas. Aproximadamente 10 dias após o descongelamento (de acordo com a taxa de crescimento dos organoides), é realizada a passagem dos organoides para expansão da cultura (Figura 3). Os organoides crescem mais rapidamente após a secundarização, e apresentam morfologias diversas, com alguns organoides císticos e a maioria de brotantes. Para uma ótima manutenção da cultura, os organoides utilizados para a passagem devem apresentar lúmen claro e vazio e bordas bem definidas (exemplos indicados por setas verdes) sem restos pretos no lúmen (indicados por setas vermelhas), como observado em organoides maduros (Figura 3). Descobrimos que os detritos de células pretas começam a se acumular por volta do 6º dia pós-passagem. Assim, recomenda-se dividir ou congelar os organoides no dia 4-5 pós-passagem.
O estágio de maturidade dos organoides também é um ponto importante na obtenção de monocamadas celulares. Organoides com maturidade avançada (indicada pela presença de restos de células pretas no lúmen) não são ideais para semear monocamadas. Costumamos dissociar organoides 3D 4 dias após a passagem para coletar células para cultura 2D. Aproximadamente um a três poços de organoides 3D cultivados a 3.000 células por cúpula de 50 μL da MEC são necessários para semear uma pastilha de cultura com 2,5 x 105 células. As células se ligam e formam uma monocamada totalmente confluente em 1 dia (Figura 4A), o que é confirmado pelo TEER alto de cerca de 700 Ω·cm2 (Figura 4B). No entanto, as bordas celulares são difíceis de visualizar por microscopia de campo claro neste momento inicial, provavelmente devido a um baixo nível de diferenciação. O TEER permanece elevado por 3 dias (Figura 4B).
A coloração de actina indica que a face apical das células epiteliais está orientada para o lúmen em organoides 3D (Figura 5A). As células organoides semeadas em cultura inserem uma única camada confluente de células epiteliais, com o lado apical orientado para o compartimento superior (Figura 4B,C). A coloração oclusal revela a presença de tight junctions na face apical das células epiteliais em organoides 3D e em monocamadas celulares (Figura 5A-C).
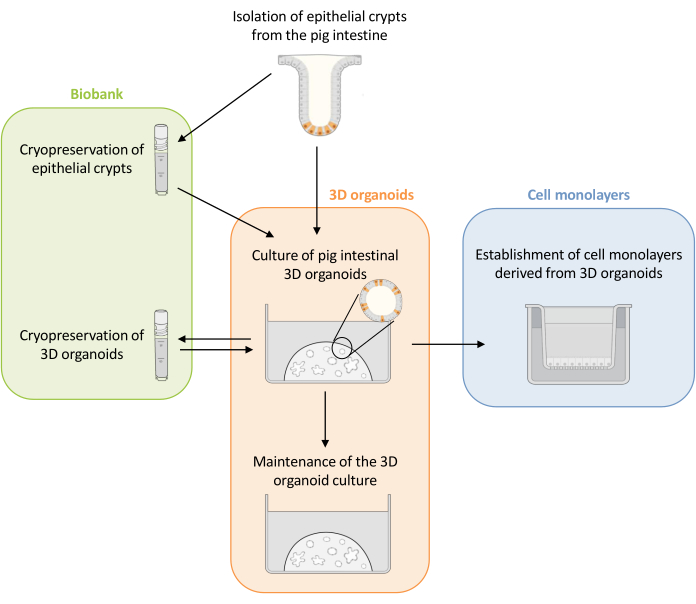
Figura 1: Representação esquemática dos métodos utilizados para cultura de organoides 3D e monocamadas celulares derivadas de organoides. As criptas epiteliais são isoladas do intestino do leitão. Essas criptas podem i) ser usadas imediatamente para cultura de organoides 3D ou ii) ser congeladas e armazenadas em um biobanco em nitrogênio líquido. Criptas criopreservadas podem ser descongeladas e usadas para cultivar organoides 3D. A cultura organoide 3D pode ser mantida com bipartição sucessiva, ou congelada e armazenada no biobanco. Monocamadas celulares podem ser obtidas a partir da cultura organoide 3D para permitir o acesso ao lado apical das células e estudar a função de barreira epitelial. Clique aqui para ver uma versão maior desta figura.
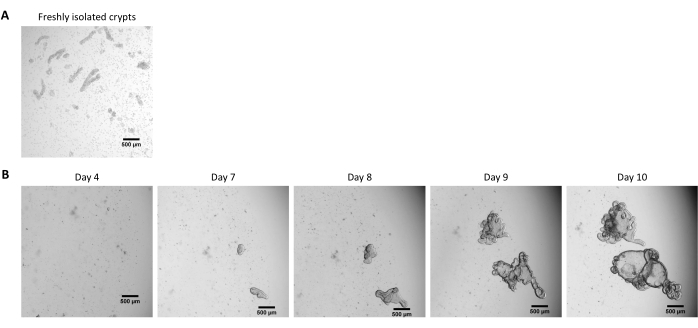
Figura 2: Cultura de organoides 3D intestinais de suínos a partir de criptas epiteliais criopreservadas. (A) Imagem microscópica representativa de criptas jejunais recém-isoladas. (B) Imagens microscópicas representativas de organoides 3D obtidas após o descongelamento das criptas jejunais. Os organoides foram cultivados em uma cúpula de 25 μL de MEC em uma placa de 48 poços. A figura mostra imagens dos organoides 3D aos 4, 7, 8, 9 e 10 dias pós-semeadura. A barra de escala representa 500 μm. Clique aqui para ver uma versão maior desta figura.
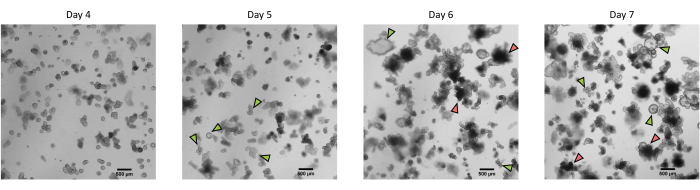
Figura 3: Morfologia de organoides 3D intestinais de suínos derivados de criptas epiteliais criopreservadas após a primeira passagem. Imagens microscópicas representativas mostrando o desenvolvimento de organoides derivados de criptas criptas criopreservadas do jejuno após a primeira passagem do dia 4 para o dia 7. As setas verdes indicam organoides claros apropriados para a passagem ou semeadura de monocamadas. As setas vermelhas indicam organoides maduros não adequados para dividir ou semear monocamadas; Assim, poços devem ser utilizados antes da aparição desta morfologia. A barra de escala representa 500 μm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Características das monocamadas celulares derivadas de organoides 3D intestinais de suínos . (A) Imagens microscópicas representativas da morfologia da monocamada ao longo de 3 dias. As células organoides do jejuno foram semeadas a 2,5 x 10,55 células em pastilhas de cultura de células de 0,33cm2 revestidas com colágeno IV a 50 ng/mL. A barra de escala representa 500 μm. (B) Resistência elétrica transepitelial (TEER) de monocamadas de células organoides durante 3 dias. Pontos conectados por uma linha correspondem ao mesmo poço em momentos diferentes. Clique aqui para ver uma versão maior desta figura.
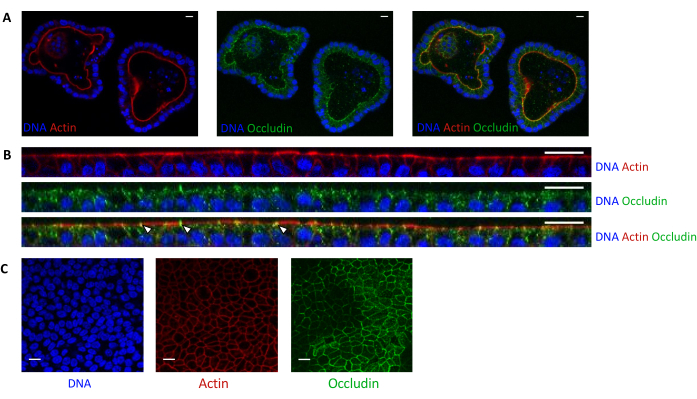
Figura 5: Imagem de organoides do jejuno de suínos cultivados em 3D ou 2D. Microscopia confocal de (A) organoides 3D 5 dias após a divisão e (B,C) monocamadas de células organoides 3 dias após a semeadura (B: secção XZ; C: seção XY). DNA (azul) foi corado com DAPI. Actina (vermelho) foi corada com faloidina. A ocludina (verde) foi corada com anticorpo policlonal. Setas brancas indicam ocludina localizada na junção apertada. A barra de escala representa 20 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um método utilizado para criopreservar criptas epiteliais do intestino de leitões para o armazenamento a longo prazo e posterior cultura de organoides 3D. Este protocolo utiliza uma solução de congelamento contendo DMSO, FBS, inibidor Y27632 ROCK, DMEM e antibióticos. Outro estudo em suínos obteve organoides de criptas criopreservadas em solução de congelamento semelhante, porém sem o inibidor de ROCK15. O inibidor Y27632 ROCK foi incluído para prevenir a apoptose e manter o pool de células-tronco, uma vez que, após o descongelamento, as células epiteliais das criptas são dissociadas, o que pode levar à morte celular ('anoikis')27,28. Curiosamente, enteróides equinos foram obtidos de criptas epiteliais congeladas em meio de cultura contendo apenas DMEM e DMSO16; Este método simples ainda não foi testado para criptas epiteliais de suínos. Outros métodos foram publicados para cultivar organoides humanos e suínos a partir de tecidos congelados ou biópsias em vez de criptas epiteliais 4,17. A vantagem deste método é a capacidade de criopreservar diretamente os tecidos intestinais sem realizar o procedimento de isolamento de criptas, o que requer tempo e equipamentos de laboratório. Isso pode ser conveniente quando os tecidos precisam ser coletados longe do laboratório. No entanto, ao isolar as criptas imediatamente após o abate, grandes segmentos do intestino podem ser processados para obter um número muito alto de criptas, o que não é o caso quando se inicia a partir de pequenos fragmentos de tecido congelado. Após o descongelamento das criptas epiteliais, organoides foram observados de 3 a 4 dias pós-semeadura e divididos após 10 dias. Esta é uma taxa de crescimento mais lenta do que quando se inicia a cultura a partir de criptas epiteliais frescas, para as quais os organoides foram obtidos a partir do 1º dia pós-semeadura, e geralmente pode ser dividida por volta do dia 511. Khalil e col. também relataram um crescimento retardado de enteróides suínos quando se iniciam a partir de criptas congeladas15, sugerindo que as células-tronco podem requerer tempo para recuperar sua capacidade proliferativa. Também obtivemos um número menor de organoides quando partimos de criptas congeladas em comparação com criptas frescas, o que pode ser devido à morte de células-tronco durante o processo de congelamento. Em algumas tentativas de descongelamento de criptas (<20%), não obtivemos organoides de criptas congeladas, provavelmente devido a um procedimento de criopreservação subótimo (por exemplo, congelamento tardio após isolamento de criptas provavelmente mais de 1 h). Assim, recomendamos manter as criptas no gelo até a contagem e congelá-las o mais rápido possível.
Para organoides 3D, optou-se por utilizar um meio de cultura organoide comercial formulado para humanos. De fato, relatos prévios mostraram que organoides intestinais de suínos crescem eficientemente com este meio 8,11,14,19,25,26,29,30. É de interesse que este meio de cultura esteja pronto para uso e tenha uma concentração padronizada de fatores de crescimento dentro de um lote. No entanto, esse meio de cultura é caro, sua composição não é revelada e, portanto, não é possível modular sua composição. Em contrapartida, outros estudos cultivaram organoides intestinais de suínos em meios personalizados contendo inibidores farmacológicos, fator de crescimento recombinante e/ou meios condicionados 5,6,7,21. Embora altamente flexível e mais barato, este método é demorado para a produção de meios condicionados e pode carecer de reprodutibilidade devido à potencial variabilidade na concentração de fatores de crescimento em meios condicionados. Assim, a qualidade de cada lote de meio condicionado deve ser validada pela medida do crescimento organoide ou da expressão gênica do marcador31.
Um estudo mostrou que organoides jejunais de suínos cultivados no mesmo meio de cultura organoide comercial aqui utilizado cresceram mais rapidamente e pareceram menos diferenciados, em comparação com enteroides cultivados com meios contendo fator de crescimento recombinante e/ou meios condicionados23. Um alto estado proliferativo facilita a cultura de organoides 3D, mas pode exigir a indução da diferenciação para ser mais representativa das características fisiológicas intestinais. Neste protocolo, para a passagem de organoides 3D, as células são totalmente dissociadas para contagem, permitindo controlar o número de células semeadas na MEC. Isso aumenta a reprodutibilidade do fenótipo dos organoides, que é altamente influenciado por sua densidade. Além disso, a contagem das células evita a obtenção de uma cultura muito baixa ou superlotada, o que requer a adaptação do cronograma de cultura. A maioria dos outros estudos preparou fragmentos organoides não totalmente dissociados de células isoladas e usou uma razão de diluição para a passagem. Este método é mais simples, mas pode induzir variabilidade de acordo com a densidade organoide da cultura.
Para o cultivo em monocamadas, as células organoides são semeadas em pastilhas de cultura pré-revestidas com uma fina camada de MEC, que permite a fixação das células, mas evita o crescimento de organoides em 3D. Esse protocolo utilizou colágeno tipo IV como proteína da MEC, como descrito anteriormente em suínos23. Outros estudos com monocamadas organoides de suínos utilizaram a mesma MEC derivada do tumor aqui utilizada para cultura de organoides 3D 6,8,9,21,25,30. A vantagem do uso do colágeno é a capacidade de padronizar a concentração proteica com uma composição totalmente definida, o que não é o caso da MEC derivada do tumor. Um passo crítico para o sucesso da cultura de monocamadas celulares é prestar atenção à aparência visual dos organoides precursores 3D, que devem ter bordas bem definidas e um lúmen vazio sem detritos pretos. De fato, organoides com alto nível de maturação e baixa taxa proliferativa não são uma fonte apropriada de células para cultura 2D. Assim, o momento da dissociação dos organoides 3D em células isoladas é crucial para o sucesso desta etapa.
O cultivo de monocamadas 2D a partir de células isoladas permite padronizar o número de células semeadas, o que é mais difícil quando se inicia a partir de fragmentos organoides, como realizado em alguns outros métodos. Semeamos 7,6 x 10 5 células por cm 2, o que é alto em comparação com a maioria dos outros estudos 21,22,23 em suínos que utilizaram uma densidade celular menor, variando de 0,25 x 10 5 células por cm 2 a 1,78 x 10 5 células por cm 2. A exigência de um número elevado de células organoides constitui uma limitação deste protocolo, mas nos permitiu obter rapidamente uma monocamada confluente, cobrindo totalmente a inserção da cultura após 1 dia. Em contraste, Vermeire et al.23 obtiveram confluência após 4-7 dias com menor densidade de células semeadas (de 0,25 x10 5 células/cm 2 a 0,4 x 105 células/cm2). Alguns estudos também utilizaram monocamadas de células organoides de suínos que não cobriam totalmente a superfície de cultura para infecções por vírus 8,30. Nessas condições, o lado apical das células epiteliais é acessível para tratamentos, mas monocamadas totalmente confluentes são necessárias se o objetivo for estudar a absorção de nutrientes ou a permeabilidade epitelial.
Para as monocamadas de células organoides, foi utilizado meio de cultura organoide comercial suplementado com SFB a 20%, baseado em estudo recente sobre monocamadas derivadas de enteróides bovinos32. Em nossos testes, a suplementação com 20% de SFB foi necessária para a obtenção de monocamadas totalmente confluentes, provavelmente devido à alta exigência de fator de crescimento. Ao contrário, outros estudos utilizando o mesmo meio comercial estabeleceram monocamadas sem FBS adicional 8,25,30, mas sem atingir confluência completa. Outros estudos também utilizaram a suplementação com SFB a 20% em meio personalizado para cultura de monocamadas de células organoides suínas21,22. Em nossos experimentos, o TEER é alto 1 dia após a semeadura (em torno de 700 Ω·cm 2), e permanece alto até o dia 3 (em torno de 1.500 Ω·cm2; isso é consistente com a formação de tight junctions, como indicado pela expressão de occludina. obtiveram valores TEER semelhantes ao longo de 72 h para monocamadas de células organoides do jejuno21. Eles também demonstraram que as monocamadas podem ser mantidas até o dia 12-15 com trocas diárias de meio. Em contraste, outros estudos relataram valores TEER muito mais baixos (em torno de 200 Ω·cm2) para monocamadas de células organoides de suínos 6,22. Essas diferenças entre os estudos podem estar relacionadas ao segmento intestinal estudado ou aos meios utilizados que influenciam a diferenciação epitelial.
Em conclusão, o protocolo acima para o cultivo de organoides 3D intestinais de suínos a partir de criptas epiteliais congeladas facilita a organização do trabalho de cultura. Reduz a necessidade de obter tecidos frescos de animais vivos. Também explicamos como estabelecer monocamadas celulares totalmente confluentes derivadas de organoides suínos em menos de 3 dias. Assim, nossos protocolos poderiam ser recursos úteis para cientistas que estudam o epitélio intestinal de suínos para pesquisas veterinárias ou biomédicas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Institut Carnot France Futur Elevage (projeto "OrganoPig") e pelo INRAE HOLOFLUX (projeto "Holopig"). Os autores agradecem às instalações centrais de Genotoul (TRI). Agradecemos a Christelle Knudsen (GenPhySE, INRAE, Toulouse) pela revisão cuidadosa.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer's recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
Referências
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465 (2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368 (2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682 (2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375 (2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031 (2022).
- Zhu, M., Qin, Y. -. C., Gao, C. -. Q., Yan, H. -. C., Wang, X. -. Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -. H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143 (2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94 (2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821 (2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011 (2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196 (2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394 (2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados