Method Article
Cultivo de organoides 3D intestinales de lechones a partir de criptas epiteliales criopreservadas y establecimiento de monocapas celulares
En este artículo
Resumen
Aquí, describimos un protocolo para cultivar organoides 3D intestinales de cerdo a partir de criptas epiteliales criopreservadas. También describimos un método para establecer monocapas celulares derivadas de organoides 3D, permitiendo el acceso al lado apical de las células epiteliales.
Resumen
Los organoides intestinales se utilizan cada vez más para estudiar el epitelio intestinal para el modelado de enfermedades digestivas, o para investigar interacciones con medicamentos, nutrientes, metabolitos, patógenos y la microbiota. Los métodos para cultivar organoides intestinales ahora están disponibles para múltiples especies, incluidos los cerdos, que es una especie de gran interés tanto como animal de granja como modelo traslacional para humanos, por ejemplo, para estudiar enfermedades zoonóticas. Aquí, damos una descripción en profundidad de un procedimiento utilizado para cultivar organoides 3D intestinales de cerdo a partir de criptas epiteliales congeladas. El protocolo describe cómo criopreservar criptas epiteliales del intestino de cerdo y los procedimientos posteriores para cultivar organoides intestinales 3D. Las principales ventajas de este método son (i) la disociación temporal del aislamiento de criptas del cultivo de organoides 3D, (ii) la preparación de grandes existencias de criptas criopreservadas derivadas de múltiples segmentos intestinales y de varios animales a la vez, y por lo tanto (iii) la reducción de la necesidad de tomar muestras de tejidos frescos de animales vivos. También detallamos un protocolo para establecer monocapas celulares derivadas de organoides 3D para permitir el acceso al lado apical de las células epiteliales, que es el sitio de interacciones con nutrientes, microbios o medicamentos. En general, los protocolos descritos aquí son un recurso útil para estudiar el epitelio intestinal del cerdo en la investigación veterinaria y biomédica.
Introducción
El epitelio intestinal está formado por una monocapa de células que cubren la mucosa digestiva en la interfaz con el ambiente luminal. Esta posición está asociada a diversas funciones, como la absorción de nutrientes y la función barrera, que son apoyadas por la presencia de células madre y múltiples tipos de células epiteliales diferenciadas (absorción, enteroendocrina, Paneth y células caliciformes)1. Las líneas celulares inmortalizadas utilizadas tradicionalmente para estudiar las células epiteliales tienen grandes limitaciones, ya que no reflejan la complejidad celular del epitelio intestinal y presentan anomalías genómicas2. El desarrollo de organoides tridimensionales (3D) por Sato et al.3 proporcionó un nuevo modelo para estudiar el epitelio intestinal con una mayor relevancia fisiológica. De hecho, los organoides intestinales se derivan de células madre no transformadas, están compuestos de múltiples tipos de células y recapitulan la funcionalidad del epitelio intestinal. Los organoides intestinales se utilizan cada vez más para comprender el desarrollo y las funciones del epitelio intestinal y sus interacciones con patógenos, nutrientes, toxinas, medicamentos, la microbiota y sus metabolitos2.
Inicialmente desarrollados para humanos y ratones, los métodos utilizados para cultivar organoides intestinales se han adaptado recientemente a otras especies, incluidos los cerdos4. Gonzales et al.5 fueron los primeros en cultivar organoides porcinos del yeyuno; Desde entonces, se han descrito organoides porcinos para otros segmentos intestinales (duodeno, íleon y colon)6,7,8, y se ha demostrado que conservan un fenotipo específico de la ubicación9,10,11. Los organoides 3D intestinales de cerdo ahora se usan comúnmente para estudiar el efecto de los nutrientes 12,13 o las infecciones entéricas 6,8,14.
La mayoría de los estudios han descrito el cultivo de organoides intestinales a partir de criptas epiteliales recién aisladas. Sin embargo, esto no siempre es factible por razones logísticas, especialmente cuando se trabaja con animales grandes como los cerdos. De hecho, las instalaciones para animales para cerdos pueden ubicarse lejos del laboratorio donde se cultivan los organoides, lo que complica la organización del trabajo. Además, el cultivo de organoides requiere mucho tiempo; Por lo tanto, no es práctico cultivar simultáneamente múltiples líneas de organoides, por ejemplo, de diferentes segmentos intestinales o varios animales. Para eludir estos problemas, algunos estudios en humanos, caballos y cerdos han descrito métodos para cultivar organoides a partir de tejidos intestinales congelados (o biopsias) o de criptas epiteliales aisladas 4,15,16,17. Estos métodos permiten la criopreservación de células madre epiteliales intestinales de múltiples segmentos intestinales de un solo animal, que luego se pueden usar para cultivar organoides cuando sea necesario. Además, esto permite una fuerte reducción en el número de animales vivos utilizados como donantes de células madre, ya que se pueden crear grandes reservas de criptas criopreservadas (principios de 3R). Otra ventaja de este método es el crecimiento de organoides intestinales solo de animales de interés después de obtener resultados fenotípicos o genotípicos, lo cual es altamente rentable.
In vivo, las células epiteliales intestinales están polarizadas, con el lado apical dirigido hacia la luz. In vitro, en organoides 3D, el lado apical de las células epiteliales también está orientado hacia el lumen (es decir, dentro de los organoides)4. Esta organización impide el acceso al lado apical, que es un problema cuando se estudian los efectos de los componentes luminales (por ejemplo, nutrientes, microbios, metabolitos) en las células epiteliales. Para sortear esta desventaja, se han desarrollado varios métodos, como el cultivo de células organoides como monocapas 2D, la microinyección y la inversión de polaridad ("organoides apicales")18,19. El cultivo de monocapas de células organoides está emergiendo como el sistema más eficiente y manejable. El principio es disociar organoides 3D en células individuales y sembrarlas en un recipiente de cultivo celular previamente recubierto con una capa delgada de matriz extracelular (ECM)20. En estas condiciones de cultivo, el lado apical de las células epiteliales está orientado hacia arriba, por lo que es accesible a los tratamientos experimentales20. El cultivo de monocapas de células organoides fue recientemente adaptado para el intestino porcino21,22; Las monocapas celulares derivadas de organoides 3D de cerdo se han utilizado para múltiples aplicaciones, incluyendo el estudio de infecciones entéricas 6,23,24,25, el transporte de nutrientes 9 y el modelado de enfermedades digestivas 26.
Aquí, este estudio presenta primero un protocolo detallado para el cultivo y mantenimiento de organoides 3D intestinales de cerdo derivados de criptas epiteliales criopreservadas (Figura 1). Luego, se describe un protocolo para establecer monocapas celulares a partir de organoides 3D intestinales de cerdo. Los métodos descritos aquí proporcionan herramientas experimentales que se pueden utilizar para estudiar el epitelio intestinal del cerdo para el transporte de nutrientes, la función de barrera y las interacciones huésped-microorganismo.
Protocolo
Este protocolo fue aprobado por el comité de ética local (N°TOXCOM/0136/PP) de acuerdo con la directiva europea sobre la protección de los animales utilizados para fines científicos (2010/63/UE). Este protocolo se describe para el yeyuno como un ejemplo, pero se puede utilizar para cada segmento del intestino delgado y grueso (duodeno, yeyuno, íleon, colon).
1. Aislamiento de criptas epiteliales del intestino del lechón.
NOTA: Prepare un stock de medio de águila modificado completo de Dulbecco (DMEMc) con DMEM suplementado con 10% de suero fetal bovino (FBS) y 1% de penicilina-estreptomicina (P / S). Preparar 50 ml de alícuotas y almacenarlas a 4 °C durante 1 mes.
- Preparación de soluciones (que se realizará el día del aislamiento de la cripta)
- Prepare la solución de disociación que contiene solución salina tamponada con fosfato (PBS), 3 mM de ditiothreitol (DTT), ácido etilendiaminotetraacético (EDTA) de 9 mM, inhibidor de ROCK de 10 μM de Y27632 y penicilina-estreptomicina al 1% (P/S) y guárdela en hielo.
- Prepare la solución de congelación que contiene DMEMc, 10% de FBS, 10% de dimetilsulfóxido (DMSO) y 10 μM Y27632 inhibidor de ROCK y guárdela en hielo (la concentración final de FBS es del 18%).
- Prepare la solución de transporte que contiene PBS frío suplementado con 1% P/S y guárdela en hielo.
- Aislamiento de criptas epiteliales
- Sacrificar un lechón por electronarcosis seguido de exsanguición.
- Inmediatamente después del sacrificio, abra el abdomen del lechón con un bisturí y retire todo el intestino.
- Recoger aproximadamente 2 cm de un segmento intestinal y almacenarlo en una solución de transporte frío. Mantenga el segmento en hielo hasta el aislamiento de la cripta (hasta 2 h).
- Coloque el tejido en una placa de Petri. Abra el segmento intestinal longitudinalmente y lave cuidadosamente el tejido en PBS frío suplementado con 1% P / S para eliminar el contenido intestinal.
- Transfiera el tejido a una nueva placa de Petri llena con 10 ml de PBS frío suplementado con 1% de P / S.
- Sostenga el tejido con pinzas y retire las vellosidades y el moco restante raspando con un portaobjetos de microscopio.
NOTA: La eliminación de las vellosidades (la estructura en forma de lengua) se puede verificar mediante la observación microscópica del sobrenadante. - Transfiera el tejido a un tubo cónico de 15 ml que contenga 5 ml de solución de disociación helada e incube durante 30 minutos a temperatura ambiente (RT) en un agitador giratorio (15 rpm).
- Transfiera el tejido a una nueva placa de Petri y agregue 10 ml de PBS frío suplementado con 1% de P / S.
- Aísle las criptas mecánicamente raspando firmemente la mucosa con un portaobjetos de microscopio.
NOTA: Bajo un microscopio, verifique la presencia de criptas epiteliales en PBS (Figura 2A). - Aspirar la solución de cripta con una pipeta serológica y filtrar a través de un filtro de células de 100 μm en un tubo cónico de 50 ml.
- Pipet 10 μL de la solución y verificar la presencia de criptas bajo un microscopio. Centrifugar a 300 x g durante 5 min a 4 °C.
- Bajo un gabinete de bioseguridad estéril, deseche el sobrenadante y vuelva a suspender el pellet de criptas en 10 ml de DMEMc frío suplementado con 10 μM Y27632 inhibidor ROCK.
- Pipet 10 μL de la solución de cripta en una placa de 48 pocillos. Cuente manualmente el número de criptas bajo un microscopio con un aumento de 10x y calcule la concentración de criptas por ml de solución.
NOTA: Las criptas aisladas se pueden utilizar directamente para cultivar organoides intestinales. Sin embargo, a menudo es más conveniente criopreservar un gran lote de criptas de cada lechón y usarlas más tarde para el cultivo de organoides.
- Congelación de criptas epiteliales
- Transfiera un volumen correspondiente a 900 criptas en un tubo cónico de 15 ml. Centrifugar a 300 x g durante 5 min a 4 °C.
- Deseche el sobrenadante y vuelva a suspender el pellet de criptas en 1 ml de la solución de congelación. Transfiera a un criotubo y coloque el vial en un recipiente de congelación celular.
- Conservar el envase de congelación de células a -80 °C durante 24 h y, a continuación, transferir los viales a nitrógeno líquido para su almacenamiento a largo plazo.
2. Establecimiento de organoides 3D intestinales de lechones a partir de criptas epiteliales congeladas
NOTA: Los organoides 3D intestinales de lechones se cultivan en un medio de cultivo comercial formulado para el crecimiento de organoides humanos, suplementado con 1% P/S y 100 μg/ml de un agente antimicrobiano para células primarias, y se almacenan a 4 °C durante un máximo de 1 semana. Una matriz extracelular derivada de tumores (ECM) se utiliza para el cultivo de organoides 3D. Todas las referencias de productos comerciales se presentan en la Tabla de materiales.
- Preparación de materiales
- Colocar las puntas de la pipeta a -20 °C (al menos durante la noche).
- Colocar las alícuotas congeladas del MCE (500 μL) a 4 °C con al menos 1 h de antelación.
- Precaliente una placa de 48 pocillos en una incubadora deCO2 al 5% a 37 °C.
- Coloque el medio de cultivo en RT.
- Precalentar un baño maría a 37 °C.
- Coloque un pequeño cubo de hielo debajo de la capucha en condiciones asépticas.
- Descongelación de criptas epiteliales congeladas
- Descongelar rápidamente un vial que contiene 900 criptas congeladas en baño maría a 37 °C (menos de 5 min).
- Transfiera la solución de cripta a un tubo cónico de 15 ml.
- Centrifugar a 300 x g durante 5 min en RT. Retire el sobrenadante
- Añadir 150 μL de la ECM con puntas enfriadas para obtener una concentración final de 150 criptas por 25 μL de ECM. Pipet arriba y abajo 10 veces para obtener una suspensión homogénea de criptas en el ECM.
NOTA: Siempre mantenga el ECM en hielo para evitar la polimerización. Utilice siempre puntas de pipeta preenfriadas a -20 °C para manipular la ECM. Pipeta lentamente para evitar hacer burbujas de aire en el ECM. Se utiliza una ECM sin diluir en este paso para evitar que las pequeñas gotas colapsen. - Siembre seis pocillos con una caída de 25 μL por pocillo con puntas enfriadas en una placa de 48 pocillos precalentada.
NOTA: Mantenga la punta vertical, en el centro del pozo, y pipete lentamente sin introducir aire para obtener una cúpula. Aquí, se utilizan placas de 48 pocillos, ya que el número de organoides suele ser bajo cuando se parte de criptas congeladas. - Incubar durante 30 min en una incubadora deCO2 al 5% a 37 °C para la polimerización de la ECM.
- Añadir 250 μL por pocillo de medio de cultivo a RT. Incubar en una incubadora deCO2 a 37 °C, al 5% y cambiar el medio de cultivo cada 2-3 días
NOTA: Las criptas generalmente no son visibles después del procedimiento de descongelación, y la mayoría de las celdas están disociadas en la ECM (Figura 2B).
3. Paso de organoides 3D intestinales de lechones derivados de criptas congeladas
NOTA: El tiempo para obtener organoides de criptas congeladas suele ser más largo que cuando se comienza con criptas nuevas. Los organoides generalmente están listos para dividirse 10 días después de la descongelación (Figura 2B).
- Preparación de materiales
- Colocar las alícuotas congeladas del MCE (500 μL) a 4 °C durante al menos 1 h.
- Precaliente las placas de 24 pocillos a 37 °C.
- Precaliente el PBS y el reactivo de disociación enzimática suplementado con 10 μM Y27632 inhibidor ROCK en un baño maría a 37 °C.
- Coloque el medio de cultivo en RT.
- Coloque un pequeño cubo de hielo debajo de la capucha en condiciones asépticas.
- Paso de organoides 3D derivados de criptas congeladas
- Retirar los medios de cultivo y lavar con 250 μL de PBS precalentado a 37 °C.
- Añadir 250 μL de reactivo de disociación enzimática precalentado suplementado con 10 μM Y27632 inhibidor ROCK a 37 °C en cada pocillo.
NOTA: Debido al bajo número de organoides, la disociación de organoides se realiza directamente en cada pocillo. - Separe los organoides en el ECM raspando con una pipeta P1000 y homogeneice cuidadosamente pipeteando cinco veces.
- Incubar durante 5 min en una incubadora deCO2 al 5% a 37 °C. Disociar las células pipeteando hacia arriba y hacia abajo 10 veces usando una pipeta P1000.
NOTA: El objetivo es obtener células aisladas o grupos de células pequeñas (<10 células). Verifique la disociación bajo un microscopio. Si todavía se observan grandes fragmentos de organoides, repetir el paso 3.2.4. - Agregue 500 μL de DMEMc en cada pocillo que contenga células disociadas, y agrupe hasta 12 pocillos en un tubo cónico de 15 ml que contenga 3 ml de DMEMc frío.
- Centrifugar a 500 x g durante 5 min a 4 °C. Deseche el sobrenadante y vuelva a suspender el pellet en 1 ml de DMEMc frío.
- Cuente las celdas con una dilución de 1:2 en azul de tripano con un contador de celdas.
NOTA: El contador de celdas automatizado puede contar las celdas dentro de grupos pequeños, si están presentes. - Centrifugar el volumen necesario de la solución celular para tener 3.000 células vivas por domo (un domo por pocillo de la placa de 24 pocillos) a 500 x g durante 5 min a 4 °C.
- Resuspender las células con 17 μL de DMEMc frío por cada 3.000 células vivas en hielo. Ajuste el volumen al número requerido de pozos.
- Agregue lentamente 33 μL de ECM fría con puntas enfriadas por cada 3,000 células vivas y homogeneice en hielo sin hacer burbujas. Ajuste el volumen al número requerido de pozos.
NOTA: Las células se resuspenden en una solución que contiene 1/3 de DMEMc y 2/3 de ECM. Para cada domo, se necesitan 50 μL de esta solución. El ECM diluido es más barato y más fácil de pipetear. - Sembrar los pocillos con 50 μL de suspensión de células ECM por pocillo con puntas enfriadas en una placa de 24 pocillos precalentada.
- Incubar durante 30 min en una incubadora deCO2 al 5% a 37 °C para la polimerización de la ECM.
- Añadir 500 μL del medio de cultivo por pocillo. Incubar en una incubadora deCO2 a 37 °C, al 5% y cambiar el medio de cultivo cada 2-3 días
NOTA: Los organoides se pueden usar directamente para i) experimentos, ii) mantenimiento del cultivo de organoides 3D, iii) congelación, o iv) siembra de las monocapas celulares organoides (Figura 1). Verifique el crecimiento de los organoides con un microscopio todos los días para elegir el momento óptimo para dividir los organoides. Los organoides deben tener una luz clara y vacía y bordes bien definidos. Los organoides maduros con restos negros en la luz no deben usarse para dividir (Figura 3).
4. Mantenimiento del cultivo de organoides en 3D
NOTA: Para el paso, los organoides deben aparecer claros con un lumen vacío. Los restos negros aparecen en el lumen aproximadamente 5 días después de la división e indican la presencia de células muertas. Limitar el número de células muertas en el momento del paso es preferible para un mantenimiento óptimo del cultivo. Por lo tanto, el calendario debe adaptarse para evitar alcanzar esta etapa de madurez.
- Preparación del material
- Colocar las alícuotas del MCE (500 μL) a 4 °C para descongelar durante al menos 1 h.
- Precaliente una placa de 24 pocillos a 37 °C.
- Precaliente el reactivo de disociación enzimática suplementado con 10 μM Y27632 inhibidor de ROCK en un baño maría a 37 °C.
- Coloque el medio de cultivo en RT.
- Coloque un pequeño cubo de hielo debajo de la capucha en condiciones asépticas.
- Paso de organoides 3D intestinales
- Separar los organoides con el ECM raspando con una pipeta P1000. Homogeneizar cuidadosamente pipeteando en el medio de cultivo y transferir a un tubo cónico de 15 ml que contenga 5 ml de DMEMc frío en hielo.
NOTA: Se requiere un tubo cónico de 15 ml para una piscina con 12 pocillos de organoides cultivados en domos de 50 μL en placas de 24 pocillos. - Centrifugar los organoides recogidos a 500 x g durante 5 min a 4 °C.
NOTA: Los organoides forman una bolita blanca en el fondo del tubo. Si los organoides todavía están en la suspensión en la ECM después de la centrifugación, aspire cuidadosamente el sobrenadante superior (sin tocar la capa ECM), homogeneice pipeteando 10 veces con una pipeta P1000 y repita el paso de centrifugación. La capa ECM no debe ser visible después de este procedimiento. - Aspirar cuidadosamente el sobrenadante y resuspender el pellet celular en 1 ml de reactivo de disociación enzimática precalentado suplementado con 10 μM Y27632 inhibidor ROCK. Pipet arriba y abajo 10 veces para iniciar la disociación de los organoides.
- Incubar durante 5 min en un baño maría a 37 °C para la digestión enzimática.
- Interrumpir mecánicamente los organoides pipeteando 10 veces con una pipeta P1000. Verifique la suspensión celular bajo el microscopio.
NOTA: El objetivo es obtener células aisladas o grupos de células pequeñas. Si todavía se observan fragmentos organoides grandes, repetir la incubación (paso 4.2.4) y la interrupción mecánica (paso 4.2.5). - Agregue 4 ml de DMEMc helado. Centrífuga a 500 x g durante 5 min a 4 °C
- Deseche el sobrenadante y resuspenda el pellet de células organoides en 1 ml de DMEMc.
- Proceder como se describe anteriormente (pasos 3.2.7 a 3.2.13) para contar las células y sembrar las células organoides en 50 μL de domos ECM que contienen 3000 células vivas en placas de 24 pocillos precalentadas.
- Separar los organoides con el ECM raspando con una pipeta P1000. Homogeneizar cuidadosamente pipeteando en el medio de cultivo y transferir a un tubo cónico de 15 ml que contenga 5 ml de DMEMc frío en hielo.
5. Congelación de organoides 3D
- Prepare el volumen necesario (1 ml para un grupo de dos domos) de solución de congelación que contenga DMEMc suplementado con 10% de FBS, 10% de DMSO y 10 μM de inhibidor de ROCK Y27632 y guárdelo en hielo (la concentración final de FBS es del 18%).
- Retirar el medio de cultivo de los pozos a congelar.
- Agregue 1 ml de la solución de congelación al primer pocillo a congelar, separe la ECM raspando y homogeneice con la punta de la pipeta.
- Transfiera la suspensión organoide del primer pozo al segundo pozo a congelar.
- Transfiera la piscina de los dos pocillos a un criotubo y coloque el vial en un recipiente de congelación celular.
- Conservar el envase de congelación de células a -80 °C durante 24 h y, a continuación, transferir los viales a nitrógeno líquido para su almacenamiento a largo plazo.
6. Cultivo de monocapas celulares derivadas de organoides 3D
NOTA: Las monocapas de células organoides de cerdo se cultivan en un medio 2D compuesto por el medio de cultivo utilizado para organoides 3D suplementados con 20% de FBS.
- Preparación de materiales
- Prepare el medio 2D y manténgalo en RT.
- Precaliente el reactivo de disociación enzimática suplementado con 10 μM Y27632 inhibidor de ROCK en un baño maría a 37 °C.
- Recubrimiento del inserto de cultivo
- Esterilice un par de pinzas y transfiéralas al gabinete de bioseguridad.
- Coloque los insertos de cultivo celular (0,33 cm2) en una placa de 24 pocillos con las pinzas.
- Preparar la solución de recubrimiento que contiene colágeno IV diluido a 50 μg/ml en PBS frío. Pipete arriba y abajo para mezclar
- Añadir 150 μL de la solución IV de colágeno diluido a cada inserto de cultivo celular, lo que corresponde a 22,7 μg/cm2.
NOTA: Oriente cuidadosamente la pipeta verticalmente en el centro de la membrana permeable y compruebe que la solución de colágeno cubre toda la membrana. - Colocar la placa en una incubadora a 37 °C, 5% CO2 y dejar toda la noche (o durante un mínimo de 3 h).
- Siembra de células organoides 3D en insertos de cultivo celular
- Preparar una suspensión celular a partir de los organoides 3D, como se describe en los pasos 4.2.1 a 4.2.7.
- Contar las células con una dilución de 1:2 en azul de tripano con un contador de celdas, y calcular el volumen necesario para sembrar 2,5 x 10 5 células por inserto de cultivo, correspondiente a 7,6 x 105 células/cm2.
- Centrifugar el volumen necesario de la suspensión celular a 500 x g durante 5 min a 4 °C.
- Durante la centrifugación, aspire cuidadosamente la solución de recubrimiento de los insertos de cultivo y deje secar a RT debajo de la campana sin la tapa durante 5 minutos.
- Después de la centrifugación, deseche el sobrenadante y vuelva a suspender el pellet celular en el volumen necesario de medio 2D suplementado con un inhibidor ROCK de 10 μM Y27632. Se necesita un volumen de 200 μL de medio 2D que contenga las células para cada inserto.
- Semilla 200 μL de la suspensión celular (2,5 x 105 células) sobre la membrana permeable recubierta (lado apical) (Figura 4A).
NOTA: Pipet lentamente en el centro de la membrana y mantenga la punta vertical. - Añadir 500 μL del medio 2D suplementado con 10 μM Y27632 inhibidor ROCK en el compartimento inferior (lado basal). Incubar en una incubadora de 37 °C, 5% deCO2 .
- Un día después de la siembra, reemplace los medios apicales y basales con medio 2D fresco sin el inhibidor ROCK Y27632.
- Cambie el medio 2D cada día. La monocapa se vuelve confluente 1 día después de la siembra, y luego se puede usar para experimentos.
NOTA: Un valor de resistencia eléctrica transepitelial (TEER) por encima del espacio en blanco (inserte sin celdas) confirma que se ha alcanzado la confluencia (Figura 4B).
7. Inmunotinción de monocapas de células organoides
- Preparación de soluciones
NOTA: Ajuste el volumen de soluciones de acuerdo con el número de pocillos a teñir; Se requieren 200 μL de la solución en cada paso para un pozo. Las referencias a todos los productos comerciales se proporcionan en la tabla de materiales.- Prepare una solución de paraformaldehído (PFA) al 4% bajo una campana química agregando 5 ml de PFA al 32% a 35 ml de PBS. Preparar 10 ml de alícuotas y conservar a -20 °C.
PRECAUCIÓN: Siempre manipule el PFA debajo de la capucha química, mientras usa guantes de nitrilo. - Prepare una solución de Triton X100-PBS al 0,2%, agregando 2 μL de Triton X100 a 1 ml de PBS inmediatamente antes de su uso. Manténgase en RT.
- Prepare una solución de albúmina sérica bovina (BSA)-PBS al 10% agregando 100 mg de BSA a 1 ml de PBS. Manténgase en RT.
- Prepare una solución de BSA-PBS al 1% agregando 10 mg de BSA a 1 ml de PBS. Manténgase en RT.
- Preparar una solución del anticuerpo primario de ocludina diluido a 1:200 añadiendo 5 μL de anticuerpo primario a 995 μL de BSA PBS al 1%. Mantenga la solución en hielo.
- Preparar una solución del anticuerpo secundario diluido a 1:1.000 añadiendo 1 μL de anticuerpo secundario a 999 μL de BSA-PBS al 1%. Mantenga la solución en hielo, protegida de la luz.
- Preparar una solución de faloidina TRITC a 10 μg/ml añadiendo 10 μL de TRITC a 1 mg/ml a 990 μL de PBS. Mantener sobre hielo, protegido de la luz.
- Prepare una solución de paraformaldehído (PFA) al 4% bajo una campana química agregando 5 ml de PFA al 32% a 35 ml de PBS. Preparar 10 ml de alícuotas y conservar a -20 °C.
- Inmunotinción
NOTA: A menos que se indique lo contrario, todas las incubaciones se realizan en RT, bajo agitación lenta en una plataforma oscilante (30 rpm). La inmunotinción se realiza directamente en el inserto de cultivo celular.- Eliminar el medio basal y apical. Coloque la placa debajo de la campana química.
- Lavar las monocapas dos veces con 200 μL de PBS a RT e incubar durante 5 min.
- Fijar las monocapas celulares con 200 μL de PFA al 4% a RT e incubar durante 20 min a RT.
- Lavar las monocapas dos veces con 200 μL de PBS a RT e incubar durante 5 min.
NOTA: Después de los pasos de fijación y lavado, la monocapa se puede mantener a 4 °C en PBS durante 1 semana. - Retirar el PBS, permeabilizar con 200 μL de Triton X100-PBS al 0,2% e incubar durante 20 min.
- Lavar las monocapas dos veces con 200 μL de PBS a RT e incubar durante 5 min.
- Añadir 200 μL de solución de anticuerpos primarios en BSA-PBS al 1% e incubar durante la noche a 4 °C, bajo agitación lenta sobre una plataforma oscilante. Incluya un pozo de control negativo agregando solo un 1% de BSA-PBS sin el anticuerpo primario.
- Lavar las monocapas tres veces con 200 μL de PBS a RT e incubar durante 5 min.
- Añadir 200 μL de anticuerpo secundario en BSA-PBS al 1% e incubar a RT durante 2 h, protegido de la luz.
- Lavar las monocapas tres veces con 200 μL de PBS a RT e incubar durante 5 min.
- Añadir 200 μL de faloidina TRITC a 10 μg/ml e incubar durante 10 min.
- Lavar las monocapas dos veces con 200 μL de PBS a RT e incubar durante 5 min.
- Retire el PBS y corte la membrana con un bisturí.
- Recupere la membrana con un par de pinzas y colóquela en un portaobjetos de microscopio, con el lado apical hacia arriba.
- Añadir 15 μL del medio de montaje suplementado con DAPI a 1:1.000 directamente sobre la membrana. Coloque un cubreobjetos y selle.
- Conservar a 4 °C, protegido de la luz, hasta obtener imágenes.
Resultados
Siguiendo el protocolo descrito anteriormente, las criptas epiteliales se obtienen del intestino del cerdo y se criopreservan para su almacenamiento a largo plazo en nitrógeno líquido (Figura 1 y Figura 2A). Después de la descongelación, las células madre de la cripta se siembran en la ECM (Figura 2B). La estructura de la cripta generalmente se pierde después de este paso, debido a la desintegración de la estructura de la cripta en el ECM. Los organoides se pueden observar en 3-4 días, y luego crecen rápidamente y desarrollan estructuras en gemación (Figura 2B). Obtuvimos con éxito organoides después de descongelar criptas congeladas en el >80% de los intentos. Aproximadamente 10 días después de la descongelación (según la tasa de crecimiento de los organoides), se realiza un paso de organoides para expandir el cultivo (Figura 3). Los organoides crecen más rápido después de la división, y presentan diversas morfologías, con algunos organoides quísticos y la mayoría de los que inciden. Para un mantenimiento óptimo del cultivo, los organoides utilizados para el paso deben presentar una luz clara y vacía y bordes bien definidos (ejemplos indicados por flechas verdes) sin restos negros en el lumen (indicados por flechas rojas), como se observa en organoides maduros (Figura 3). Encontramos que los restos de células negras comienzan a acumularse alrededor del día 6 después del fallecimiento. Por lo tanto, se recomienda dividir o congelar los organoides en el día 4-5 después del fallecimiento.
La etapa de madurez de los organoides también es un punto importante en la obtención de monocapas celulares. Los organoides con madurez avanzada (indicada por la presencia de restos de células negras en la luz) no son óptimos para sembrar monocapas. Por lo general, disociamos los organoides 3D 4 días después del paso para recolectar células para el cultivo 2D. Se necesitan aproximadamente de uno a tres pocillos de organoides 3D cultivados a 3.000 células por cúpula de 50 μL de la ECM para sembrar un inserto de cultivo con 2,5 x 105 células. Las células se unen y forman una monocapa totalmente confluente en 1 día (Figura 4A), lo que se confirma por el alto TEER de alrededor de 700 Ω · cm2 (Figura 4B). Sin embargo, los bordes celulares son difíciles de visualizar mediante microscopía de campo claro en este punto de tiempo temprano, probablemente debido a un bajo nivel de diferenciación. El TEER permanece alto durante 3 días (Figura 4B).
La tinción de actina indica que el lado apical de las células epiteliales está orientado hacia la luz en los organoides 3D (Figura 5A). Las células organoides sembradas en el inserto de cultivo forman una sola capa confluente de células epiteliales, con el lado apical orientado hacia el compartimiento superior (Figura 4B, C). La tinción de occludina revela la presencia de uniones estrechas en el lado apical de las células epiteliales en organoides 3D y en monocapas celulares (Figura 5A-C).
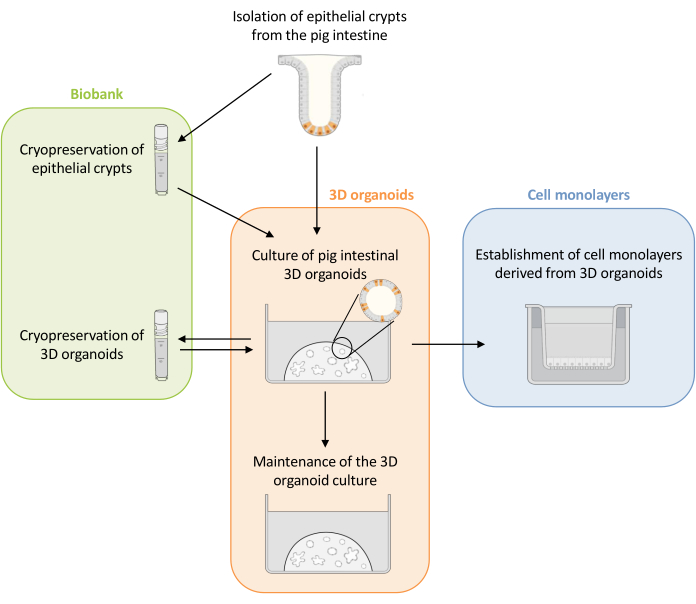
Figura 1: Representación esquemática de los métodos utilizados para cultivar organoides 3D y monocapas celulares derivadas de organoides. Las criptas epiteliales se aíslan del intestino del lechón. Estas criptas pueden i) ser utilizadas inmediatamente para cultivar organoides 3D o ii) ser congeladas y almacenadas en un biobanco en nitrógeno líquido. Las criptas criopreservadas se pueden descongelar y usar para cultivar organoides 3D. El cultivo de organoides 3D puede mantenerse con división sucesiva, o congelarse y almacenarse en el biobanco. Las monocapas celulares se pueden obtener del cultivo de organoides 3D para permitir el acceso al lado apical de las células y estudiar la función de barrera epitelial. Haga clic aquí para ver una versión más grande de esta figura.
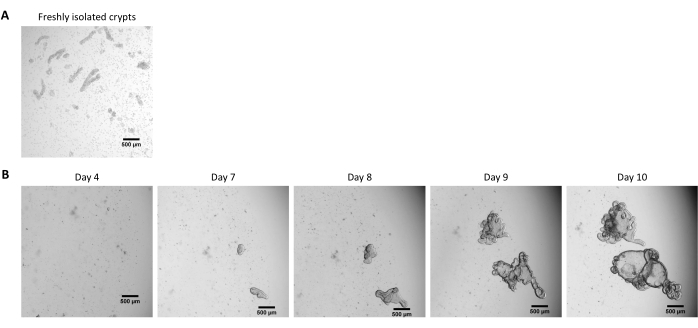
Figura 2: Cultivo de organoides 3D intestinales de cerdo a partir de criptas epiteliales criopreservadas. (A) Imagen microscópica representativa de criptas yeyunales recién aisladas. (B) Imágenes microscópicas representativas de organoides 3D obtenidas después del deshielo de las criptas yeyuales. Los organoides se cultivaron en una cúpula de 25 μL de ECM en una placa de 48 pocillos. La figura muestra imágenes de los organoides 3D a los 4, 7, 8, 9 y 10 días después de la siembra. La barra de escala representa 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
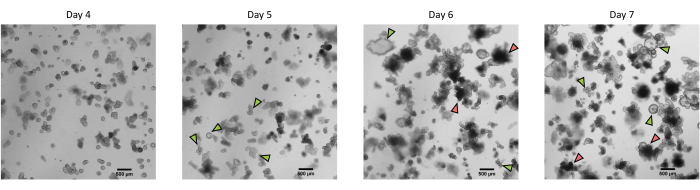
Figura 3: Morfología de organoides 3D intestinales de cerdo derivados de criptas epiteliales criopreservadas después del primer paso. Imágenes microscópicas representativas que muestran el desarrollo de organoides derivados de criptas de yeyuno criopreservadas después del primer paso del día 4 al día 7. Las flechas verdes indican organoides claros apropiados para el paso o la siembra de monocapas. Las flechas rojas indican organoides maduros no adecuados para dividir o sembrar monocapas; Por lo tanto, los pocillos deben usarse antes de la aparición de esta morfología. La barra de escala representa 500 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Características de las monocapas celulares derivadas de organoides 3D intestinales de cerdo . (A) Imágenes microscópicas representativas de la morfología monocapa durante 3 días. Las células organoides de yeyuno se sembraron a 2,5 x 105 células en insertos de cultivo celular de 0,33 cm2 recubiertos con colágeno IV a 50 ng / ml. La barra de escala representa 500 μm. (B) Resistencia eléctrica transepitelial (TEER) de monocapas de células organoides durante 3 días. Los puntos conectados por una línea corresponden al mismo pozo en diferentes momentos. Haga clic aquí para ver una versión más grande de esta figura.
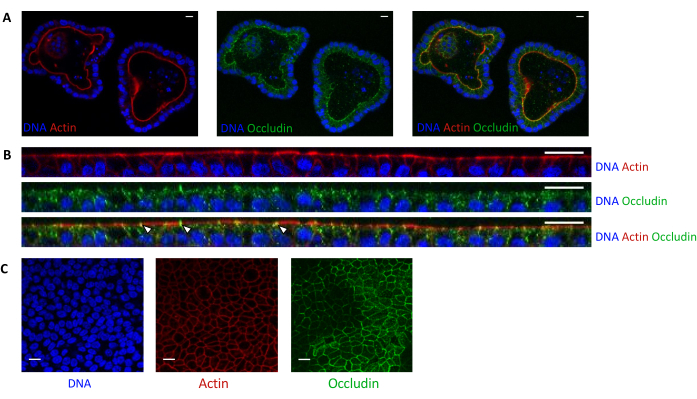
Figura 5: Imágenes de organoides de yeyuno de cerdo cultivados en 3D o 2D. Imágenes de microscopía confocal de (A) organoides 3D 5 días después de la división y (B, C) monocapas de células organoides 3 días después de la siembra (B: sección XZ; C: sección XY). El ADN (azul) fue teñido con DAPI. La actina (rojo) se tiñó con faloidina. La occludina (verde) se tiñó con un anticuerpo policlonal. Las flechas blancas indican occludina localizada en la unión estrecha. La barra de escala representa 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un método utilizado para criopreservar criptas epiteliales del intestino del lechón para el almacenamiento a largo plazo y el posterior cultivo de organoides 3D. Este protocolo utiliza una solución de congelación que contiene DMSO, FBS, el inhibidor de ROCK Y27632, DMEM y antibióticos. Otro estudio en cerdos obtuvo organoides de criptas criopreservadas en una solución de congelación similar pero sin el inhibidor ROCK15. El inhibidor ROCK Y27632 fue incluido para prevenir la apoptosis y mantener el conjunto de células madre ya que, después de la descongelación, las células de la cripta epitelial se disocian, lo que puede conducir a la muerte celular ('anoikis')27,28. Curiosamente, los enteroides equinos se han obtenido de criptas epiteliales congeladas en un medio de cultivo que contiene solo DMEM y DMSO16; Este método simple aún no ha sido probado para criptas epiteliales de cerdo. Se han publicado otros métodos para cultivar organoides humanos y porcinos a partir de tejidos congelados o biopsias en lugar de criptas epiteliales 4,17. La ventaja de este método es la capacidad de criopreservar directamente los tejidos intestinales sin realizar el procedimiento de aislamiento de cripta, que requiere tiempo y equipo de laboratorio. Esto puede ser conveniente cuando los tejidos tienen que ser recolectados lejos del laboratorio. Sin embargo, al aislar las criptas inmediatamente después del sacrificio, se pueden procesar grandes segmentos del intestino para obtener un número muy alto de criptas, lo que no es el caso cuando se parte de pequeños fragmentos de tejido congelado. Después de la descongelación de las criptas epiteliales, se observaron organoides de 3 a 4 días después de la siembra y se dividieron después de 10 días. Esta es una tasa de crecimiento más lenta que cuando se inicia el cultivo a partir de criptas epiteliales frescas, para las cuales los organoides se obtuvieron desde el día 1 después de la siembra, y generalmente se pueden dividir alrededor del día 511. Khalil et al. también informaron un retraso en el crecimiento de enteroides porcinos al partir de criptas congeladas15, lo que sugiere que las células madre podrían requerir tiempo para recuperar su capacidad proliferativa. También obtuvimos un menor número de organoides al partir de criptas congeladas en comparación con criptas frescas, lo que podría deberse a la muerte de células madre durante el proceso de congelación. En algunos intentos de descongelación de criptas (<20%), no obtuvimos organoides de criptas congeladas, probablemente debido a un procedimiento de criopreservación subóptimo (por ejemplo, congelación retrasada después del aislamiento de criptas de probablemente más de 1 h). Por lo tanto, recomendamos mantener las criptas en hielo hasta que se cuenten, y congelarlas lo más rápido posible.
Para los organoides 3D, elegimos utilizar un medio de cultivo de organoides comercial formulado para humanos. De hecho, informes anteriores han demostrado que los organoides intestinales de cerdo crecen eficientemente con este medio 8,11,14,19,25,26,29,30. Es de interés que este medio de cultivo esté listo para usar y tenga una concentración estandarizada de factores de crecimiento dentro de un lote. Sin embargo, este medio de cultivo es costoso, su composición no se revela y, por lo tanto, no es posible modular su composición. En contraste, otros estudios han cultivado organoides intestinales de cerdo en medios personalizados que contienen inhibidores farmacológicos, factor de crecimiento recombinante y/o medios acondicionados 5,6,7,21. Aunque es altamente flexible y más barato, este método requiere mucho tiempo para la producción de medios acondicionados y puede carecer de reproducibilidad debido a la posible variabilidad en la concentración de factores de crecimiento en medios acondicionados. Por lo tanto, la calidad de cada lote de medios acondicionados debe validarse midiendo el crecimiento de organoides o la expresión génica marcador31.
Un estudio ha demostrado que los organoides yeyunales de cerdo cultivados en el mismo medio de cultivo de organoides comercial utilizado aquí crecieron más rápido y parecían menos diferenciados, en comparación con los enteroides cultivados con medios que contienen factor de crecimiento recombinante y / o medios condicionados23. Un alto estado proliferativo facilita el cultivo de organoides 3D, pero podría requerir una diferenciación inductora para ser más representativa de las características fisiológicas intestinales. En este protocolo, para el paso de organoides 3D, las células se disocian completamente para el conteo, lo que permite controlar el número de células sembradas en ECM. Esto aumenta la reproducibilidad del fenotipo de los organoides, que está muy influenciado por su densidad. Además, el conteo de las células evita obtener un cultivo demasiado bajo o saturado, que requiere adaptar el programa de cultivo. La mayoría de los otros estudios prepararon fragmentos de organoides no completamente disociados a células individuales, y utilizaron una relación de dilución para el paso. Este método es más sencillo, pero podría inducir variabilidad según la densidad organoide del cultivo.
Para el cultivo en monocapas, las células organoides se siembran en insertos de cultivo prerecubiertos con una capa delgada de ECM, que permite la unión de células pero evita el crecimiento de organoides en 3D. Este protocolo utilizó colágeno tipo IV como proteína ECM, como se describió previamente en cerdos23. Otros estudios con monocapas organoides de cerdo utilizaron la misma ECM derivada de tumores utilizada aquí para cultivar organoides 3D 6,8,9,21,25,30. La ventaja de usar colágeno es la capacidad de estandarizar la concentración de proteínas con una composición completamente definida, lo que no es el caso en la ECM derivada del tumor. Un paso crítico para el éxito del cultivo de monocapas celulares es prestar atención a la apariencia visual de los organoides 3D precursores, que deben tener bordes bien definidos y una luz vacía sin restos negros. De hecho, los organoides con un alto nivel de maduración y una baja tasa proliferativa no son una fuente apropiada de células para el cultivo 2D. Por lo tanto, el momento de la disociación de los organoides 3D en células individuales es crucial para el éxito de este paso.
El cultivo de monocapas 2D a partir de células individuales permite estandarizar el número de células sembradas, lo cual es más difícil cuando se parte de fragmentos de organoides, como se realiza en algunos otros métodos. Sembramos 7.6 x 10 5 células por cm 2, lo cual es alto en comparación con la mayoría de los otros estudios 21,22,23 en cerdos que utilizaron una densidad celular más baja, que varió de 0.25 x 10 5 células por cm 2 a 1.78 x 10 5 células por cm 2. El requerimiento de un alto número de células organoides constituye una limitación de este protocolo, pero nos permitió obtener rápidamente una monocapa confluente, cubriendo completamente el inserto de cultivo después de 1 día. En contraste, Vermeire et al.23 obtuvieron confluencia después de 4-7 días con una menor densidad de células sembradas (de 0,25 x 105 células/cm 2 a 0,4 x 105 células/cm2). Algunos estudios también han utilizado monocapas de células organoides de cerdo que no cubrieron completamente la superficie de cultivo para infecciones con virus 8,30. En estas condiciones, el lado apical de las células epiteliales es accesible para los tratamientos, pero se requieren monocapas totalmente confluentes si el objetivo es estudiar la absorción de nutrientes o la permeabilidad epitelial.
Para las monocapas de células organoides, se utilizó un medio de cultivo de organoides comercial suplementado con 20% de FBS, basado en un estudio reciente sobre monocapas derivadas de enteroides bovinos32. En nuestras pruebas, la suplementación con FBS al 20% fue necesaria para obtener monocapas totalmente confluentes, probablemente debido a un alto requerimiento de factor de crecimiento. Por el contrario, otros estudios que utilizan el mismo medio comercial han establecido monocapas sin FBS adicionales 8,25,30, pero sin llegar a la confluencia completa. Otros estudios también han utilizado la suplementación con 20% de FBS en un medio personalizado para el cultivo de monocapas de células organoides de cerdo21,22. En nuestros experimentos, TEER es alto 1 día después de la siembra (alrededor de 700 Ω·cm 2), y permanece alto hasta el día 3 (alrededor de 1,500 Ω·cm2; esto es consistente con la formación de uniones estrechas, como lo indica la expresión de ocludina. Van der Hee et al. obtuvieron valores TEER similares a lo largo de 72 h para monocapas de células organoides yeyunum21. También demostraron que las monocapas se pueden mantener hasta el día 12-15 con cambios diarios de medios. En contraste, otros estudios han reportado valores de TEER mucho más bajos (alrededor de 200 Ω·cm2) para monocapas de células organoides de cerdo 6,22. Estas diferencias entre los estudios podrían estar relacionadas con el segmento intestinal estudiado o con los medios utilizados que influyen en la diferenciación epitelial.
En conclusión, el protocolo anterior para cultivar organoides 3D intestinales de cerdo a partir de criptas epiteliales congeladas facilita la organización del trabajo de cultivo. Reduce la necesidad de obtener tejidos frescos de animales vivos. También explicamos cómo establecer monocapas celulares totalmente confluentes derivadas de organoides porcinos en menos de 3 días. Por lo tanto, nuestros protocolos podrían ser recursos útiles para los científicos que estudian el epitelio intestinal del cerdo para la investigación veterinaria o biomédica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo del Institut Carnot France Futur Elevage (proyecto "OrganoPig") y del INRAE HOLOFLUX (proyecto "Holopig"). Los autores están agradecidos a las instalaciones centrales de Genotoul (TRI). Agradecemos a Christelle Knudsen (GenPhySE, INRAE, Toulouse) por su cuidadosa revisión.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer’s recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
Referencias
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465 (2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368 (2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682 (2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375 (2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031 (2022).
- Zhu, M., Qin, Y. -. C., Gao, C. -. Q., Yan, H. -. C., Wang, X. -. Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -. H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143 (2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94 (2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821 (2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011 (2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196 (2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394 (2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados