Method Article
Coltura di organoidi intestinali 3D di maialino da cripte epiteliali crioconservate e creazione di monostrati cellulari
In questo articolo
Riepilogo
Qui, descriviamo un protocollo per la coltura di organoidi intestinali 3D di maiale da cripte epiteliali crioconservate. Descriviamo anche un metodo per stabilire monostrati cellulari derivati da organoidi 3D, consentendo l'accesso al lato apicale delle cellule epiteliali.
Abstract
Gli organoidi intestinali vengono sempre più utilizzati per studiare l'epitelio intestinale per la modellazione delle malattie digestive o per studiare le interazioni con farmaci, nutrienti, metaboliti, agenti patogeni e microbiota. I metodi per la coltura di organoidi intestinali sono ora disponibili per più specie, compresi i suini, che è una specie di grande interesse sia come animale da allevamento che come modello traslazionale per l'uomo, ad esempio, per studiare le malattie zoonotiche. Qui, diamo una descrizione approfondita di una procedura utilizzata per la coltura di organoidi 3D intestinali di maiale da cripte epiteliali congelate. Il protocollo descrive come crioconservare le cripte epiteliali dall'intestino del maiale e le successive procedure per la coltura di organoidi intestinali 3D. I principali vantaggi di questo metodo sono (i) la dissociazione temporale dell'isolamento delle cripte dalla coltura di organoidi 3D, (ii) la preparazione di grandi stock di cripte crioconservate derivate da più segmenti intestinali e da più animali contemporaneamente, e quindi (iii) la riduzione della necessità di campionare tessuti freschi da animali vivi. Dettagliamo anche un protocollo per stabilire monostrati cellulari derivati da organoidi 3D per consentire l'accesso al lato apicale delle cellule epiteliali, che è il sito di interazioni con nutrienti, microbi o farmaci. Nel complesso, i protocolli qui descritti sono una risorsa utile per lo studio dell'epitelio intestinale suino nella ricerca veterinaria e biomedica.
Introduzione
L'epitelio intestinale è formato da un monostrato di cellule che ricopre la mucosa digestiva all'interfaccia con l'ambiente luminale. Questa posizione è associata a diverse funzioni, come l'assorbimento dei nutrienti e la funzione barriera, che sono supportate dalla presenza di cellule staminali e da più tipi di cellule epiteliali differenziate (cellule assorbenti, enteroendocrine, Paneth e calici)1. Le linee cellulari immortalizzate tradizionalmente utilizzate per studiare le cellule epiteliali hanno importanti limitazioni, poiché non riflettono la complessità cellulare dell'epitelio intestinale e presentano anomalie genomiche2. Lo sviluppo di organoidi tridimensionali (3D) da parte di Sato et al.3 ha fornito un nuovo modello per studiare l'epitelio intestinale con una migliore rilevanza fisiologica. Infatti, gli organoidi intestinali derivano da cellule staminali non trasformate, sono composti da più tipi di cellule e ricapitolano la funzionalità dell'epitelio intestinale. Gli organoidi intestinali vengono sempre più utilizzati per comprendere lo sviluppo e le funzioni dell'epitelio intestinale e le sue interazioni con agenti patogeni, sostanze nutritive, tossine, farmaci, microbiota e suoi metaboliti2.
Inizialmente sviluppati per l'uomo e i topi, i metodi utilizzati per la coltura di organoidi intestinali sono stati recentemente adattati ad altre specie, compresi i suini4. Gonzales et al.5 furono i primi a coltivare organoidi di maiale dal digiuno; Da allora, organoidi suini sono stati descritti per altri segmenti intestinali (duodeno, ileo e colon)6,7,8 e hanno dimostrato di mantenere un fenotipo specifico della posizione 9,10,11. Gli organoidi 3D intestinali di maiale sono ora comunemente usati per studiare l'effetto dei nutrienti 12,13 o delle infezioni enteriche 6,8,14.
La maggior parte degli studi ha descritto la coltura di organoidi intestinali a partire da cripte epiteliali appena isolate. Tuttavia, ciò non è sempre fattibile per motivi logistici, in particolare quando si lavora con animali di grossa taglia come i maiali. In effetti, le strutture per animali per suini possono essere situate lontano dal laboratorio in cui vengono coltivati gli organoidi, il che complica l'organizzazione del lavoro. Inoltre, la coltura organoide richiede molto tempo; Pertanto, non è pratico coltivare contemporaneamente più linee organoidi, ad esempio da diversi segmenti intestinali o da diversi animali. Per aggirare questi problemi, alcuni studi su esseri umani, cavalli e maiali hanno descritto metodi per coltivare organoidi da tessuti intestinali congelati (o biopsie) o da cripte epiteliali isolate 4,15,16,17. Questi metodi consentono la crioconservazione delle cellule staminali epiteliali intestinali da più segmenti intestinali di un singolo animale, che possono quindi essere utilizzati per coltivare organoidi quando necessario. Inoltre, ciò consente una forte riduzione del numero di animali vivi utilizzati come donatori di cellule staminali, poiché è possibile creare grandi stock di cripte crioconservate (principi di 3R). Un altro vantaggio di questo metodo è la crescita di organoidi intestinali solo da animali di interesse dopo aver ottenuto risultati fenotipici o genotipici, che è altamente conveniente.
In vivo, le cellule epiteliali intestinali sono polarizzate, con il lato apicale diretto verso il lume. In vitro, negli organoidi 3D, anche il lato apicale delle cellule epiteliali è rivolto verso il lume (cioè all'interno degli organoidi)4. Questa organizzazione impedisce l'accesso al lato apicale, che è un problema quando si studiano gli effetti dei componenti luminali (ad esempio, nutrienti, microbi, metaboliti) sulle cellule epiteliali. Per aggirare questo svantaggio, sono stati sviluppati diversi metodi, come la coltura di cellule organoidi come monostrati 2D, la microiniezione e l'inversione di polarità ("organoidi apical-out")18,19. La coltura di monostrati di cellule organoidi sta emergendo come il sistema più efficiente e trattabile. Il principio è quello di dissociare organoidi 3D in singole cellule e seminarle su un vaso di coltura cellulare precedentemente rivestito con un sottile strato di matrice extracellulare (ECM)20. In queste condizioni di coltura, il lato apicale delle cellule epiteliali è rivolto verso l'alto ed è quindi accessibile ai trattamenti sperimentali20. La coltura di monostrati di cellule organoidi è stata recentemente adattata per l'intestino suino21,22; monostrati cellulari derivati da organoidi 3D di maiale sono stati utilizzati per molteplici applicazioni, tra cui lo studio delle infezioni enteriche 6,23,24,25, il trasporto di nutrienti9 e la modellazione delle malattie digestive 26.
Qui, questo studio presenta per la prima volta un protocollo dettagliato per la coltura e il mantenimento di organoidi 3D intestinali di maiale derivati da cripte epiteliali crioconservate (Figura 1). Quindi, viene descritto un protocollo per stabilire monostrati cellulari da organoidi 3D intestinali di maiale. I metodi qui descritti forniscono strumenti sperimentali che possono essere utilizzati per studiare l'epitelio intestinale del maiale per il trasporto dei nutrienti, la funzione barriera e le interazioni ospite-microrganismo.
Protocollo
Questo protocollo è stato approvato dal comitato etico locale (N°TOXCOM/0136/PP) in conformità con la direttiva europea sulla protezione degli animali utilizzati a fini scientifici (2010/63/UE). Questo protocollo è descritto per il digiuno come esempio, ma può essere utilizzato per ogni segmento dell'intestino tenue e crasso (duodeno, digiuno, ileo, colon).
1. Isolamento delle cripte epiteliali dall'intestino dei maialini
NOTA: Preparare una scorta di terreno completo per aquila modificata di Dulbecco (DMEMc) con DMEM integrato con siero bovino fetale al 10% (FBS) e all'1% di penicillina-streptomicina (P/S). Preparare 50 ml di aliquote e conservarle a 4 °C per 1 mese.
- Preparazione delle soluzioni (da effettuarsi il giorno dell'isolamento della cripta)
- Preparare la soluzione di dissociazione contenente soluzione salina tamponata fosfato (PBS), 3 mM ditiotreitolo (DTT), 9 mM di acido etilendiamminotetraacetico (EDTA), inibitore ROCK 10 μM Y27632 e 1% di penicillina-streptomicina (P/S) e conservare su ghiaccio.
- Preparare la soluzione di congelamento contenente DMEMc, 10% FBS, 10% dimetil solfossido (DMSO) e 10 μM Y27632 inibitore ROCK e conservare su ghiaccio (la concentrazione finale di FBS è del 18%).
- Preparare la soluzione di trasporto contenente PBS freddo integrato con 1% P/S e conservarla su ghiaccio.
- Isolamento delle cripte epiteliali
- Macellare un maialino mediante elettronarcosi seguita da dissanguamento.
- Immediatamente dopo la macellazione, aprire l'addome del maialino con un bisturi e rimuovere l'intero intestino.
- Raccogliere circa 2 cm di un segmento intestinale e conservarlo in una soluzione di trasporto fredda. Mantenere il segmento sul ghiaccio fino all'isolamento della cripta (fino a 2 ore).
- Posizionare il tessuto in una capsula di Petri. Aprire il segmento intestinale longitudinalmente e lavare accuratamente il tessuto in PBS freddo integrato con 1% P / S per rimuovere il contenuto intestinale.
- Trasferire il tessuto in una nuova capsula di Petri riempita con 10 ml di PBS freddo integrato con 1% di P/S.
- Tenere il tessuto con una pinzetta e rimuovere i villi e il muco rimanente raschiando con un vetrino da microscopio.
NOTA: La rimozione dei villi (la struttura a forma di lingua) può essere controllata mediante osservazione microscopica del surnatante. - Trasferire il tessuto in un tubo conico da 15 mL contenente 5 mL di soluzione di dissociazione ghiacciata e incubare per 30 minuti a temperatura ambiente (RT) su uno shaker rotante (15 rpm).
- Trasferire il tessuto in una nuova capsula di Petri e aggiungere 10 ml di PBS freddo integrato con 1% di P/S.
- Isolare meccanicamente le cripte raschiando saldamente la mucosa con un vetrino da microscopio.
NOTA: Al microscopio, verificare la presenza di cripte epiteliali nella PBS (Figura 2A). - Aspirare la soluzione criptata con un pipet sierologico e filtrare attraverso un filtro cellulare da 100 μm in un tubo conico da 50 ml.
- Pipet 10 μL della soluzione e verificare la presenza di cripte al microscopio. Centrifugare a 300 x g per 5 minuti a 4 °C.
- Sotto un armadio di biosicurezza sterile, scartare il surnatante e risospendere il pellet di cripte in 10 ml di DMEMc freddo integrato con inibitore 10 μM Y27632 ROCK.
- Pipet 10 μL della soluzione della cripta in una piastra da 48 pozzetti. Contare manualmente il numero di cripte al microscopio con un ingrandimento 10x e calcolare la concentrazione di cripte per ml di soluzione.
NOTA: Le cripte isolate possono essere utilizzate direttamente per la coltura di organoidi intestinali. Tuttavia, è spesso più conveniente crioconservare un grande lotto di cripte da ciascun maialino e usarle in seguito per la coltura organoide.
- Congelamento delle cripte epiteliali
- Trasferire un volume corrispondente a 900 cripte in un tubo conico da 15 ml. Centrifugare a 300 x g per 5 minuti a 4 °C.
- Scartare il surnatante e risospendere il pellet di cripte in 1 ml della soluzione congelante. Trasferire in un criotubo e posizionare il flaconcino in un contenitore per il congelamento delle cellule.
- Conservare il contenitore di congelamento cellulare a -80 °C per 24 ore e quindi trasferire i flaconcini in azoto liquido per la conservazione a lungo termine.
2. Creazione di organoidi 3D intestinali di maialino da cripte epiteliali congelate
NOTA: Gli organoidi 3D intestinali dei suinetti sono coltivati in un terreno di coltura commerciale formulato per la crescita di organoidi umani, integrati con 1% di P / S e 100 μg / ml di un agente antimicrobico per cellule primarie e conservati a 4 ° C per un massimo di 1 settimana. Una matrice extracellulare derivata dal tumore (ECM) viene utilizzata per la coltura di organoidi 3D. Tutti i riferimenti dei prodotti commerciali sono presentati nella tabella dei materiali.
- Preparazione dei materiali
- Posizionare le punte delle pipette a -20 °C (almeno durante la notte).
- Porre le aliquote congelate della ECM (500 μL) a 4 °C con almeno 1 h di anticipo.
- Preriscaldare una piastra da 48 pozzetti in un incubatore a 37 °C, 5% CO2 .
- Posiziona il terreno di coltura su RT.
- Preriscaldare un bagnomaria a 37 °C.
- Posizionare un piccolo secchiello per il ghiaccio sotto il cofano in condizioni asettiche.
- Scongelamento delle cripte epiteliali congelate
- Scongelare rapidamente un flaconcino contenente 900 cripte congelate a bagnomaria a 37 °C (meno di 5 min).
- Trasferire la soluzione criptata in un tubo conico da 15 ml.
- Centrifugare a 300 x g per 5 minuti a RT. Rimuovere il surnatante
- Aggiungere 150 μL di ECM con punte raffreddate per ottenere una concentrazione finale di 150 cripte per 25 μL di ECM. Pipet su e giù 10 volte per ottenere una sospensione omogenea delle cripte nella ECM.
NOTA: Tenere sempre l'ECM sul ghiaccio per evitare la polimerizzazione. Utilizzare sempre punte di pipette pre-refrigerate a -20 °C per manipolare l'ECM. Pipet lentamente per evitare di formare bolle d'aria nell'ECM. In questa fase viene utilizzato un ECM non diluito per evitare che le piccole gocce collassano. - Seminare sei pozzetti con una goccia di 25 μL per pozzetto con punte raffreddate in una piastra preriscaldata da 48 pozzetti.
NOTA: Tenere la punta verticale, al centro del pozzetto, e pipettare lentamente senza introdurre aria per ottenere una cupola. Qui vengono utilizzate piastre a 48 pozzetti, poiché il numero di organoidi è solitamente basso quando si parte da cripte ghiacciate. - Incubare per 30 minuti in un incubatore a 37 °C, 5% CO2 per la polimerizzazione della ECM.
- Aggiungere 250 μL per pozzetto di terreno di coltura a RT. Incubare in un incubatore a 37 °C, 5% CO 2 e cambiare il terreno di coltura ogni2-3 giorni
NOTA: Le cripte di solito non sono visibili dopo la procedura di scongelamento e la maggior parte delle cellule sono dissociate nell'ECM (Figura 2B).
3. Passaggio di organoidi 3D intestinali di maialino derivati da cripte ghiacciate
NOTA: Il tempo per ottenere organoidi da cripte ghiacciate è solitamente più lungo rispetto a quando si parte da cripte fresche. Gli organoidi sono solitamente pronti per la divisione 10 giorni dopo lo scongelamento (Figura 2B).
- Preparazione dei materiali
- Porre le aliquote congelate della ECM (500 μL) a 4 °C per almeno 1 ora.
- Preriscaldare le piastre da 24 pozzetti a 37 °C.
- Preriscaldare il PBS e il reagente di dissociazione enzimatica integrati con inibitore 10 μM Y27632 ROCK a bagnomaria a 37 °C.
- Posiziona il terreno di coltura su RT.
- Posizionare un piccolo secchiello per il ghiaccio sotto il cofano in condizioni asettiche.
- Passaggio di organoidi 3D derivati da cripte ghiacciate
- Rimuovere i terreni di coltura e lavare con 250 μL di PBS preriscaldato a 37 °C.
- Aggiungere 250 μL di reagente di dissociazione enzimatica preriscaldato integrato con 10 μM Y27632 inibitore ROCK a 37 °C in ciascun pozzetto.
NOTA: A causa del basso numero di organoidi, la dissociazione degli organoidi viene eseguita direttamente in ciascun pozzetto. - Staccare gli organoidi nell'ECM raschiando con un pipet P1000 e omogeneizzare accuratamente pipettando cinque volte.
- Incubare per 5 minuti in un incubatore a 37 °C, 5% CO2 . Dissociare le celle mediante pipettaggio su e giù 10 volte utilizzando un pipet P1000.
NOTA: L'obiettivo è ottenere cellule isolate o cluster di piccole cellule (cellule <10). Verificare la dissociazione al microscopio. Se si osservano ancora grandi frammenti di organoidi, ripetere il punto 3.2.4. - Aggiungere 500 μL di DMEMc in ciascun pozzetto contenente cellule dissociate e raggruppare fino a 12 pozzetti in un tubo conico da 15 mL contenente 3 ml di DMEMc freddo.
- Centrifugare a 500 x g per 5 minuti a 4 °C. Scartare il surnatante e risospendere il pellet in 1 mL di DMEMc freddo.
- Contare le celle con una diluizione di 1:2 in blu Trypan con un contatore di celle.
NOTA: il contatore automatico delle celle può contare le celle all'interno di piccoli cluster, se presenti. - Centrifugare il volume necessario della soluzione cellulare per avere 3.000 celle vive per cupola (una cupola per pozzetto della piastra a 24 pozzetti) a 500 x g per 5 minuti a 4 °C.
- Risospendere le cellule con 17 μL di DMEMc freddo per 3.000 cellule vive su ghiaccio. Regolare il volume in base al numero richiesto di pozzetti.
- Aggiungere lentamente 33 μL di ECM freddo con punte raffreddate per 3.000 cellule vive e omogeneizzare su ghiaccio senza formare bolle. Regolare il volume in base al numero richiesto di pozzetti.
NOTA: Le cellule vengono risospese in una soluzione contenente 1/3 DMEMc e 2/3 ECM. Per ogni cupola sono necessari 50 μL di questa soluzione. L'ECM diluito è più economico e più facile da pipettare. - Seminare i pozzetti con 50 μL di sospensione di cellule ECM per pozzetto con punte raffreddate in una piastra preriscaldata da 24 pozzetti.
- Incubare per 30 minuti in un incubatore a 37 °C, 5% CO2 per la polimerizzazione della ECM.
- Aggiungere 500 μL del terreno di coltura per pozzetto. Incubare in un incubatore a 37 °C, 5% CO 2 e cambiare il terreno di coltura ogni2-3 giorni
NOTA: Gli organoidi possono essere utilizzati direttamente per i) esperimenti, ii) mantenimento della coltura di organoidi 3D, iii) congelamento o iv) semina dei monostrati di cellule organoidi (Figura 1). Controlla la crescita degli organoidi con un microscopio ogni giorno per scegliere il momento ottimale per la scissione degli organoidi. Gli organoidi devono avere un lume chiaro e vuoto e bordi ben definiti. Gli organoidi maturi con detriti neri nel lume non devono essere usati per la scissione (Figura 3).
4. Mantenimento della coltura organoide in 3D
NOTA: Per il passaggio, gli organoidi dovrebbero apparire chiari con un lume vuoto. I detriti neri appaiono nel lume circa 5 giorni dopo la scissione e indicano la presenza di cellule morte. Limitare il numero di cellule morte al momento del passaggio è preferibile per il mantenimento ottimale della coltura. Il calendario dovrebbe quindi essere adattato per evitare di raggiungere questo stadio di maturità.
- Preparazione del materiale
- Porre le aliquote della ECM (500 μL) a 4 °C per lo scongelamento per almeno 1 ora.
- Preriscaldare una piastra da 24 pozzetti a 37 °C.
- Preriscaldare il reagente di dissociazione enzimatica integrato con 10 μM Y27632 inibitore ROCK a bagnomaria a 37 °C.
- Posiziona il terreno di coltura su RT.
- Posizionare un piccolo secchiello per il ghiaccio sotto il cofano in condizioni asettiche.
- Passaggio di organoidi 3D intestinali
- Staccare gli organoidi con l'ECM raschiando con un pipet P1000. Omogeneizzare accuratamente mediante pipettaggio nel terreno di coltura e trasferire in un tubo conico da 15 mL contenente 5 mL di DMEMc freddo su ghiaccio.
NOTA: Un tubo conico da 15 ml è necessario per una piscina con 12 pozzetti di organoidi coltivati in cupole da 50 μL in piastre da 24 pozzetti. - Centrifugare gli organoidi raccolti a 500 x g per 5 minuti a 4 °C.
NOTA: Gli organoidi formano un pellet bianco sul fondo del tubo. Se gli organoidi sono ancora nella sospensione nell'ECM dopo la centrifugazione, aspirare con attenzione il surnatante superiore (senza toccare lo strato ECM), omogeneizzare mediante pipettaggio 10 volte con un pipet P1000 e ripetere la fase di centrifugazione. Il livello ECM non dovrebbe essere visibile dopo questa procedura. - Aspirare con cautela il surnatante e risospendere il pellet cellulare in 1 mL di reagente di dissociazione enzimatica preriscaldato integrato con inibitore 10 μM Y27632 ROCK. Pipet su e giù 10 volte per iniziare la dissociazione degli organoidi.
- Incubare per 5 minuti a bagnomaria a 37 °C per la digestione enzimatica.
- Interrompere meccanicamente gli organoidi pipettando 10 volte con un pipet P1000. Controllare la sospensione cellulare al microscopio.
NOTA: L'obiettivo è ottenere cellule isolate o cluster di piccole cellule. Se si osservano ancora frammenti organoidi di grandi dimensioni, ripetere l'incubazione (punto 4.2.4) e la rottura meccanica (fase 4.2.5). - Aggiungere 4 ml di DMEMc ghiacciato. Centrifugare a 500 x g per 5 minuti a 4 °C
- Scartare il surnatante e risospendere il pellet di cellule organoidi in 1 mL di DMEMc.
- Procedere come descritto sopra (punti da 3.2.7 a 3.2.13) per contare le cellule e seminare le cellule organoidi in 50 μL di cupole ECM contenenti 3000 cellule vive in piastre preriscaldate a 24 pozzetti.
- Staccare gli organoidi con l'ECM raschiando con un pipet P1000. Omogeneizzare accuratamente mediante pipettaggio nel terreno di coltura e trasferire in un tubo conico da 15 mL contenente 5 mL di DMEMc freddo su ghiaccio.
5. Congelamento di organoidi 3D
- Preparare il volume necessario (1 mL per una piscina di due cupole) di soluzione congelante contenente DMEMc integrata con 10% FBS, 10% DMSO e 10 μM Y27632 inibitore ROCK e conservare su ghiaccio (la concentrazione finale di FBS è del 18%).
- Rimuovere il terreno di coltura dai pozzetti da congelare.
- Aggiungere 1 mL della soluzione di congelamento al primo pozzetto da congelare, staccare l'ECM raschiando e omogeneizzare con la punta del pipet.
- Trasferire la sospensione organoide dal primo pozzetto al secondo pozzetto da congelare.
- Trasferire la piscina dei due pozzetti in un criotubo e posizionare la fiala in un contenitore di congelamento cellulare.
- Conservare il contenitore di congelamento cellulare a -80 °C per 24 ore, quindi trasferire i flaconcini in azoto liquido per la conservazione a lungo termine.
6. Coltura di monostrati cellulari derivati da organoidi 3D
NOTA: Monostrati di cellule organoidi di maiale sono coltivati in un terreno 2D composto dal terreno di coltura utilizzato per organoidi 3D integrato con il 20% di FBS.
- Preparazione dei materiali
- Prepara il supporto 2D e tienilo su RT.
- Preriscaldare il reagente di dissociazione enzimatica integrato con 10 μM Y27632 inibitore ROCK a bagnomaria a 37 °C.
- Rivestimento dell'inserto di coltura
- Sterilizzare un paio di pinzette e trasferirle nell'armadio di biosicurezza.
- Posizionare gli inserti di coltura cellulare (0,33 cm2) in una piastra a 24 pozzetti con le pinzette.
- Preparare la soluzione di rivestimento contenente collagene IV diluito a 50 μg/ml in PBS freddo. Pipet su e giù per mescolare
- Aggiungere 150 μL della soluzione diluita di collagene IV a ciascun inserto di coltura cellulare, che corrisponde a 22,7 μg/cm2.
NOTA: Orientare con attenzione il pipettaggio verticalmente al centro della membrana permeabile e controllare che la soluzione di collagene copra tutta la membrana. - Posizionare la piastra in un incubatore a 37 °C, 5% CO2 e lasciare per una notte (o per un minimo di 3 ore).
- Semina di cellule organoidi 3D in inserti di coltura cellulare
- Preparare una sospensione cellulare dagli organoidi 3D, come descritto nei passaggi da 4.2.1 a 4.2.7.
- Contare le cellule con una diluizione di 1:2 in blu Trypan con un contatore di cellule e calcolare il volume necessario per seminare 2,5 x 10 5 cellule per inserto di coltura, corrispondente a 7,6 x 105 cellule/cm2.
- Centrifugare il volume necessario della sospensione cellulare a 500 x g per 5 minuti a 4 °C.
- Durante la centrifugazione, aspirare con cura la soluzione di rivestimento dagli inserti di coltura e lasciare asciugare a RT sotto il cofano senza il coperchio per 5 minuti.
- Dopo la centrifugazione, scartare il surnatante e risospendere il pellet cellulare nel volume necessario di mezzo 2D integrato con inibitore 10 μM Y27632 ROCK. Per ogni inserto è necessario un volume di 200 μL di mezzo 2D contenente le celle.
- Seminare 200 μL della sospensione cellulare (2,5 x 105 cellule) sulla membrana permeabile rivestita (lato apicale) (Figura 4A).
NOTA: Pipet lentamente al centro della membrana e mantenere la punta verticale. - Aggiungere 500 μL del mezzo 2D integrato con 10 μM Y27632 inibitore ROCK al compartimento inferiore (lato basale). Incubare in un incubatore a 37 °C, 5% CO2 .
- Un giorno dopo la semina, sostituire i mezzi apicali e basali con terreno 2D fresco senza l'inibitore Y27632 ROCK.
- Cambia il supporto 2D ogni giorno. Il monostrato diventa confluente 1 giorno dopo la semina e può quindi essere utilizzato per esperimenti.
NOTA: un valore di resistenza elettrica transepiteliale (TEER) sopra il bianco (inserire senza celle) conferma che la confluenza è stata raggiunta (Figura 4B).
7. Immunocolorazione dei monostrati di cellule organoidi
- Preparazione delle soluzioni
NOTA: Regolare il volume delle soluzioni in base al numero di pozzetti da colorare; Sono necessari 200 μL della soluzione ad ogni fase per un pozzetto. I riferimenti a tutti i prodotti commerciali sono forniti nella tabella dei materiali.- Preparare una soluzione di paraformaldeide (PFA) al 4% sotto un cappuccio chimico aggiungendo 5 ml di PFA al 32% a 35 ml di PBS. Preparare 10 ml di aliquote e conservare a -20 °C.
ATTENZIONE: manipolare sempre il PFA sotto il cappuccio chimico, indossando guanti in nitrile. - Preparare una soluzione allo 0,2% di Triton X100-PBS, aggiungendo 2 μL di Triton X100 a 1 mL di PBS immediatamente prima dell'uso. Continua a RT.
- Preparare una soluzione di albumina sierica bovina al 10% (BSA)-PBS aggiungendo 100 mg di BSA a 1 ml di PBS. Continua a RT.
- Preparare una soluzione di BSA-PBS all'1% aggiungendo 10 mg di BSA a 1 mL di PBS. Continua a RT.
- Preparare una soluzione dell'anticorpo primario occludina diluito a 1:200 aggiungendo 5 μL di anticorpo primario a 995 μL di PBS BSA all'1%. Mantenere la soluzione sul ghiaccio.
- Preparare una soluzione dell'anticorpo secondario diluito a 1:1.000 aggiungendo 1 μL di anticorpo secondario a 999 μL di BSA-PBS all'1%. Tenere la soluzione sul ghiaccio, al riparo dalla luce.
- Preparare una soluzione di falloidina TRITC a 10 μg/mL aggiungendo 10 μL di TRITC a 1 mg/mL a 990 μL di PBS. Conservare in ghiaccio, al riparo dalla luce.
- Preparare una soluzione di paraformaldeide (PFA) al 4% sotto un cappuccio chimico aggiungendo 5 ml di PFA al 32% a 35 ml di PBS. Preparare 10 ml di aliquote e conservare a -20 °C.
- Immunocolorazione
NOTA: Salvo diversa indicazione, tutte le incubazioni vengono eseguite a RT, sotto lenta agitazione su una piattaforma a dondolo (30 giri). L'immunocolorazione viene eseguita direttamente nell'inserto della coltura cellulare.- Rimuovere il mezzo basale e apicale. Posizionare la piastra sotto il cappuccio chimico.
- Lavare i monostrati due volte con 200 μL di PBS a RT e incubare per 5 minuti.
- Fissare i monostrati cellulari con 200 μL di PFA al 4% a RT e incubare per 20 minuti a RT.
- Lavare i monostrati due volte con 200 μL di PBS a RT e incubare per 5 minuti.
NOTA: Dopo le fasi di fissaggio e lavaggio, il monostrato può essere mantenuto a 4 °C in PBS per 1 settimana. - Rimuovere il PBS, permeabilizzare con 200 μL di Triton X100-PBS allo 0,2% e incubare per 20 minuti.
- Lavare i monostrati due volte con 200 μL di PBS a RT e incubare per 5 minuti.
- Aggiungere 200 μL di soluzione anticorpale primaria in BSA-PBS all'1% e incubare per una notte a 4 °C, agitando lentamente su una piattaforma a dondolo. Includere un pozzo di controllo negativo aggiungendo solo l'1% di BSA-PBS senza l'anticorpo primario.
- Lavare i monostrati tre volte con 200 μL di PBS a RT e incubare per 5 minuti.
- Aggiungere 200 μL di anticorpo secondario in BSA-PBS all'1% e incubare a RT per 2 ore, al riparo dalla luce.
- Lavare i monostrati tre volte con 200 μL di PBS a RT e incubare per 5 minuti.
- Aggiungere 200 μL di falloidina TRITC a 10 μg/mL e incubare per 10 minuti.
- Lavare i monostrati due volte con 200 μL di PBS a RT e incubare per 5 minuti.
- Rimuovere il PBS e tagliare la membrana con un bisturi.
- Recuperare la membrana con un paio di pinzette e posizionarla su un vetrino da microscopio, con il lato apicale rivolto verso l'alto.
- Aggiungere 15 μL del mezzo di montaggio integrato con DAPI a 1:1.000 direttamente sulla membrana. Posizionare un coprivetrino e sigillare.
- Conservare a 4 °C, al riparo dalla luce, fino all'imaging.
Risultati
Seguendo il protocollo sopra descritto, le cripte epiteliali sono ottenute dall'intestino del maiale e crioconservate per la conservazione a lungo termine in azoto liquido (Figura 1 e Figura 2A). Dopo lo scongelamento, le cellule staminali della cripta vengono seminate nella ECM (Figura 2B). La struttura della cripta viene solitamente persa dopo questo passaggio, a causa della disintegrazione della struttura della cripta nell'ECM. Gli organoidi possono essere osservati entro 3-4 giorni, e quindi crescere rapidamente e sviluppare strutture in erba (Figura 2B). Abbiamo ottenuto con successo organoidi dopo aver scongelato le cripte congelate in >80% dei tentativi. Circa 10 giorni dopo lo scongelamento (in base al tasso di crescita degli organoidi), viene eseguito un passaggio di organoidi per espandere la coltura (Figura 3). Gli organoidi crescono più velocemente dopo la scissione e presentano morfologie diverse, con alcuni organoidi cistici e una maggioranza di organoidi in erba. Per un mantenimento ottimale della coltura, gli organoidi utilizzati per il passaggio devono presentare un lume chiaro e vuoto e bordi ben definiti (esempi indicati da frecce verdi) senza detriti neri nel lume (indicati da frecce rosse), come osservato negli organoidi maturi (Figura 3). Abbiamo scoperto che i detriti delle cellule nere iniziano ad accumularsi intorno al giorno 6 dopo il passaggio. Pertanto, si consiglia di dividere o congelare gli organoidi al giorno 4-5 dopo il passaggio.
La fase di maturità degli organoidi è anche un punto importante per ottenere monostrati cellulari. Gli organoidi con maturità avanzata (indicati dalla presenza di detriti a cellule nere nel lume) non sono ottimali per seminare monostrati. Di solito dissociamo gli organoidi 3D 4 giorni dopo il passaggio per raccogliere cellule per la coltura 2D. Circa da uno a tre pozzetti di organoidi 3D coltivati a 3.000 cellule per cupola da 50 μL della ECM sono necessari per seminare un inserto di coltura con 2,5 x 105 cellule. Le cellule si attaccano e formano un monostrato completamente confluente entro 1 giorno (Figura 4A), che è confermato dall'elevato TEER di circa 700 Ω·cm2 (Figura 4B). Tuttavia, i bordi delle cellule sono difficili da visualizzare al microscopio a campo chiaro in questo primo momento, probabilmente a causa di un basso livello di differenziazione. Il TEER rimane elevato per 3 giorni (Figura 4B).
La colorazione dell'actina indica che il lato apicale delle cellule epiteliali è orientato verso il lume negli organoidi 3D (Figura 5A). Le cellule organoidi seminate in coltura formano un singolo strato confluente di cellule epiteliali, con il lato apicale orientato verso il compartimento superiore (Figura 4B,C). La colorazione dell'occludina rivela la presenza di giunzioni strette sul lato apicale delle cellule epiteliali negli organoidi 3D e nei monostrati cellulari (Figura 5A-C).
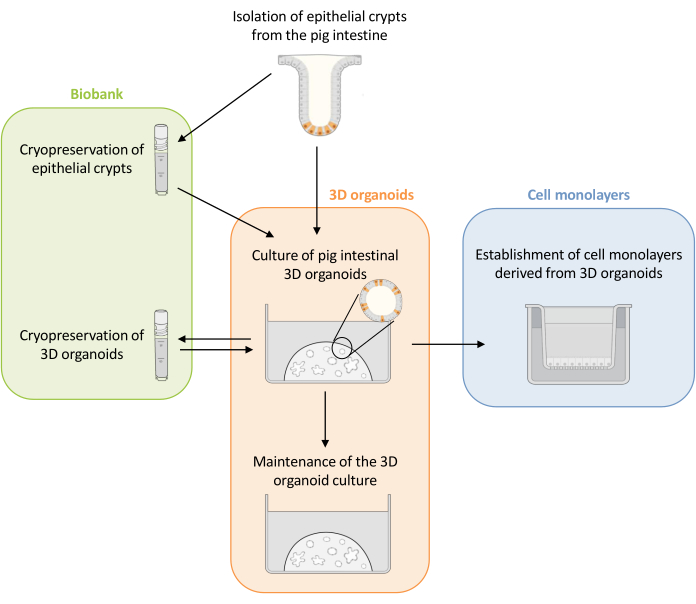
Figura 1: Rappresentazione schematica dei metodi utilizzati per la coltura di organoidi 3D e monostrati cellulari derivati da organoidi. Le cripte epiteliali sono isolate dall'intestino dei maialini. Queste cripte possono i) essere utilizzate immediatamente per coltivare organoidi 3D o ii) essere congelate e conservate in una biobanca in azoto liquido. Le cripte crioconservate possono essere scongelate e utilizzate per coltivare organoidi 3D. La coltura di organoidi 3D può essere mantenuta con successiva scissione o congelata e conservata nella biobanca. I monostrati cellulari possono essere ottenuti dalla coltura di organoidi 3D per consentire l'accesso al lato apicale delle cellule e studiare la funzione di barriera epiteliale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
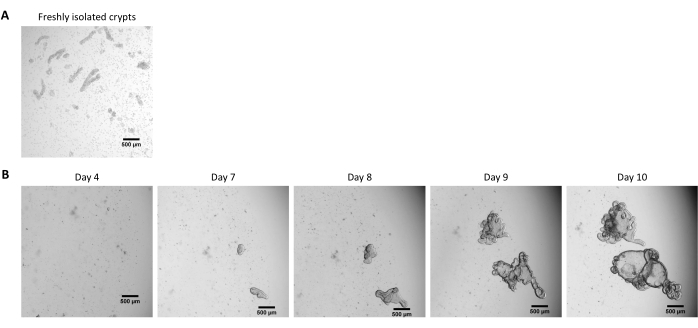
Figura 2: Coltura di organoidi 3D intestinali di maiale provenienti da cripte epiteliali crioconservate. (A) Immagine microscopica rappresentativa di cripte digiunali appena isolate. (B) Immagini microscopiche rappresentative di organoidi 3D ottenute dopo lo scongelamento delle cripte digiunali. Gli organoidi sono stati coltivati in una cupola da 25 μL di ECM in una piastra da 48 pozzetti. La figura mostra le immagini degli organoidi 3D a 4, 7, 8, 9 e 10 giorni dopo la semina. La barra della scala rappresenta 500 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
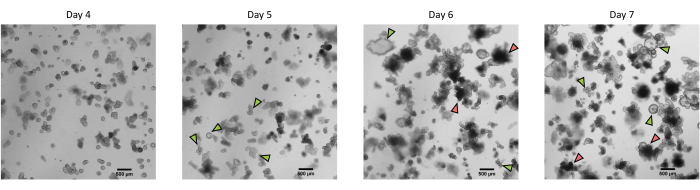
Figura 3: Morfologia degli organoidi 3D intestinali dei suini derivati da cripte epiteliali crioconservate dopo il primo passaggio. Immagini microscopiche rappresentative che mostrano lo sviluppo di organoidi derivati da cripte di digiuno crioconservate dopo il primo passaggio dal giorno 4 al giorno 7. Le frecce verdi indicano organoidi chiari appropriati per il passaggio o la semina di monostrati. Le frecce rosse indicano organoidi maturi non adatti alla scissione o alla semina di monostrati; Pertanto, i pozzi dovrebbero essere usati prima dell'apparizione di questa morfologia. La barra della scala rappresenta 500 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Caratteristiche dei monostrati cellulari derivati da organoidi 3D intestinali di maiale . (A) Immagini microscopiche rappresentative della morfologia monostrato nell'arco di 3 giorni. Le cellule organoidi di digiuno sono state seminate a 2,5 x 105 cellule in inserti di coltura cellulare di 0,33 cm2 rivestiti di collagene IV a 50 ng / ml. La barra della scala rappresenta 500 μm. (B) Resistenza elettrica transepiteliale (TEER) dei monostrati di cellule organoidi per 3 giorni. I punti collegati da una linea corrispondono allo stesso pozzo in momenti diversi. Fare clic qui per visualizzare una versione ingrandita di questa figura.
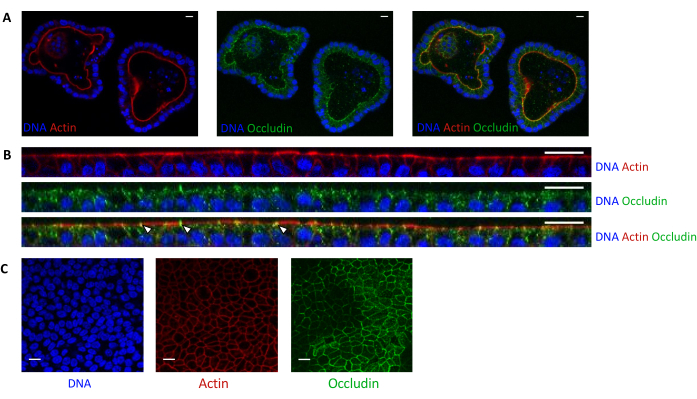
Figura 5: Imaging di organoidi di digiuno suino coltivati in 3D o 2D. Microscopia confocale di (A) organoidi 3D 5 giorni dopo la scissione e (B,C) monostrati di cellule organoidi 3 giorni dopo la semina (sezione B: XZ; C: Sezione XY). Il DNA (blu) è stato colorato con DAPI. L'actina (rossa) era macchiata con falloidina. L'occludina (verde) è stata colorata con un anticorpo policlonale. Le frecce bianche indicano l'occludina localizzata alla giunzione stretta. La barra della scala rappresenta 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Questo protocollo descrive un metodo utilizzato per crioconservare le cripte epiteliali dall'intestino dei suinetti per la conservazione a lungo termine e la successiva coltura di organoidi 3D. Questo protocollo utilizza una soluzione di congelamento contenente DMSO, FBS, l'inibitore Y27632 ROCK, DMEM e antibiotici. Un altro studio sui suini ha ottenuto organoidi da cripte crioconservate in una soluzione di congelamento simile ma senza l'inibitore ROCK15. L'inibitore Y27632 ROCK è stato incluso per prevenire l'apoptosi e mantenere il pool di cellule staminali poiché, dopo lo scongelamento, le cellule della cripta epiteliale vengono dissociate, il che può portare alla morte cellulare ("anoikis")27,28. È interessante notare che gli enteroidi equini sono stati ottenuti da cripte epiteliali congelate in un terreno di coltura contenente solo DMEM e DMSO16; Questo semplice metodo non è stato ancora testato per le cripte epiteliali dei maiali. Altri metodi sono stati pubblicati per coltivare organoidi umani e suini da tessuti congelati o biopsie invece di cripte epiteliali 4,17. Il vantaggio di questo metodo è la capacità di crioconservare direttamente i tessuti intestinali senza eseguire la procedura di isolamento della cripta, che richiede tempo e attrezzature di laboratorio. Questo potrebbe essere conveniente quando i tessuti devono essere raccolti lontano dal laboratorio. Tuttavia, quando si isolano le cripte immediatamente dopo la macellazione, è possibile elaborare ampi segmenti dell'intestino per ottenere un numero molto elevato di cripte, il che non è il caso quando si parte da piccoli frammenti di tessuto congelato. Dopo lo scongelamento delle cripte epiteliali, gli organoidi sono stati osservati da 3-4 giorni dopo la semina e divisi dopo 10 giorni. Questo è un tasso di crescita più lento rispetto a quando si inizia la coltura da cripte epiteliali fresche, per le quali gli organoidi sono stati ottenuti dal giorno 1 post-semina, e di solito possono essere divisi intorno al giorno 511. Khalil et al. hanno anche riportato una crescita ritardata degli enteroidi di maiale quando si parte dalle cripte congelate15, suggerendo che le cellule staminali potrebbero richiedere tempo per recuperare la loro capacità proliferativa. Abbiamo anche ottenuto un numero inferiore di organoidi quando si parte da cripte congelate rispetto alle cripte fresche, che potrebbe essere dovuto alla morte delle cellule staminali durante il processo di congelamento. In alcuni tentativi di scongelamento delle cripte (<20%), non abbiamo ottenuto organoidi da cripte congelate, probabilmente a causa di una procedura di crioconservazione non ottimale (ad esempio, congelamento ritardato dopo l'isolamento della cripta probabilmente superiore a 1 ora). Pertanto, si consiglia di tenere le cripte sul ghiaccio fino al conteggio e congelarle il più rapidamente possibile.
Per gli organoidi 3D, abbiamo scelto di utilizzare un terreno di coltura organoide commerciale formulato per gli esseri umani. In effetti, rapporti precedenti hanno dimostrato che gli organoidi intestinali di maiale crescono in modo efficiente con questo mezzo 8,11,14,19,25,26,29,30. È interessante che questo terreno di coltura sia pronto all'uso e abbia una concentrazione standardizzata di fattori di crescita all'interno di un lotto. Tuttavia, questo terreno di coltura è costoso, la sua composizione non è divulgata e quindi non è possibile modularne la composizione. Al contrario, altri studi hanno coltivato organoidi intestinali di maiale in terreni personalizzati contenenti inibitori farmacologici, fattore di crescita ricombinante e / o terreni condizionati 5,6,7,21. Sebbene altamente flessibile ed economico, questo metodo richiede molto tempo per la produzione di mezzi condizionati e potrebbe mancare di riproducibilità a causa della potenziale variabilità nella concentrazione dei fattori di crescita nei mezzi condizionati. Pertanto, la qualità di ciascun lotto di mezzi condizionati dovrebbe essere convalidata misurando la crescita organoide o l'espressione genica del marcatore31.
Uno studio ha dimostrato che gli organoidi digiunali di maiale coltivati nello stesso terreno di coltura di organoidi commerciali qui utilizzato crescevano più velocemente e sembravano meno differenziati, rispetto agli enteroidi coltivati con terreni contenenti fattore di crescita ricombinante e/o terreni condizionati23. Un elevato stato proliferativo facilita la coltura di organoidi 3D, ma potrebbe richiedere di indurre la differenziazione per essere più rappresentativa delle caratteristiche fisiologiche intestinali. In questo protocollo, per il passaggio di organoidi 3D, le cellule sono completamente dissociate per il conteggio, permettendo di controllare il numero di cellule seminate in ECM. Ciò aumenta la riproducibilità del fenotipo degli organoidi, che è fortemente influenzato dalla loro densità. Inoltre, il conteggio delle cellule evita di ottenere una coltura troppo bassa o sovraffollata, che richiede l'adattamento del programma di coltura. La maggior parte degli altri studi ha preparato frammenti organoidi non completamente dissociati in singole cellule e ha utilizzato un rapporto di diluizione per il passaggio. Questo metodo è più semplice, ma potrebbe indurre variabilità in base alla densità organoide della coltura.
Per la coltura in monostrati, le cellule organoidi vengono seminate in inserti di coltura prepatinati con un sottile strato di ECM, che consente l'attaccamento delle cellule ma evita la crescita di organoidi in 3D. Questo protocollo utilizzava collagene di tipo IV come proteina ECM, come descritto in precedenza nei suini23. Altri studi con monostrati organoidi di maiale hanno utilizzato la stessa ECM derivata dal tumore utilizzata qui per la coltura di organoidi 3D 6,8,9,21,25,30. Il vantaggio dell'utilizzo del collagene è la capacità di standardizzare la concentrazione proteica con una composizione completamente definita, che non è il caso della ECM derivata dal tumore. Un passo fondamentale per il successo della coltura di monostrati cellulari è prestare attenzione all'aspetto visivo degli organoidi 3D precursori, che dovrebbero avere bordi ben definiti e un lume vuoto senza detriti neri. In effetti, gli organoidi con un alto livello di maturazione e un basso tasso proliferativo non sono una fonte appropriata di cellule per la coltura 2D. Pertanto, la tempistica della dissociazione degli organoidi 3D in singole cellule è cruciale per il successo di questa fase.
La coltura di monostrati 2D da singole cellule consente di standardizzare il numero di cellule seminate, il che è più difficile quando si parte da frammenti organoidi, come eseguito in altri metodi. Abbiamo seminato 7,6 x 10 5 cellule per cm 2, che è alto rispetto alla maggior parte degli altri studi 21,22,23 nei suini che utilizzavano una densità cellulare inferiore, che andava da0,25 x 10 5 cellule per cm 2 a 1,78 x 10 5 cellule per cm2. Il requisito di un elevato numero di cellule organoidi costituisce una limitazione di questo protocollo, ma ci ha permesso di ottenere rapidamente un monostrato confluente, coprendo completamente l'inserto di coltura dopo 1 giorno. Al contrario, Vermeire et al.23 hanno ottenuto la confluenza dopo 4-7 giorni con una minore densità di cellule seminate (da 0,25 x 10 5 cellule / cm 2 a 0,4 x 105 cellule / cm2). Alcuni studi hanno anche utilizzato monostrati di cellule organoidi di maiale che non coprivano completamente la superficie di coltura per le infezioni da virus 8,30. In queste condizioni, il lato apicale delle cellule epiteliali è accessibile per i trattamenti, ma sono necessari monostrati completamente confluenti se l'obiettivo è studiare l'assorbimento dei nutrienti o la permeabilità epiteliale.
Per i monostrati di cellule organoidi, è stato utilizzato un terreno di coltura organoide commerciale integrato con il 20% di FBS, sulla base di un recente studio su monostrati derivati da enteroidi bovini32. Nei nostri test, l'integrazione con il 20% di FBS era necessaria per ottenere monostrati completamente confluenti, probabilmente a causa di un elevato fabbisogno di fattore di crescita. Al contrario, altri studi che utilizzano lo stesso mezzo commerciale hanno stabilito monostrati senza FBS aggiuntivo 8,25,30, ma senza raggiungere la piena confluenza. Altri studi hanno anche utilizzato l'integrazione con FBS al 20% in un mezzo personalizzato per la coltura di monostrati di cellule organoidi di maiale21,22. Nei nostri esperimenti, il TEER è alto 1 giorno dopo la semina (circa 700 Ω·cm 2), e rimane alto fino al giorno 3 (circa 1.500 Ω·cm2; questo è coerente con la formazione di giunzioni strette, come indicato dall'espressione di occludina. Van der Hee et al. hanno ottenuto valori TEER simili su 72 h per i monostrati di cellule organoidi di digiuno21. Hanno anche dimostrato che i monostrati possono essere mantenuti fino al giorno 12-15 con cambi giornalieri dei media. Al contrario, altri studi hanno riportato valori di TEER molto più bassi (circa 200 Ω·cm2) per i monostrati di cellule organoidi di suino 6,22. Queste differenze tra gli studi potrebbero essere correlate al segmento intestinale studiato o ai mezzi utilizzati che influenzano la differenziazione epiteliale.
In conclusione, il protocollo di cui sopra per far crescere organoidi 3D intestinali di maiale da cripte epiteliali congelate facilita l'organizzazione del lavoro di coltura. Riduce la necessità di ottenere tessuti freschi da animali vivi. Spieghiamo anche come stabilire monostrati cellulari completamente confluenti derivati da organoidi di maiale in meno di 3 giorni. Pertanto, i nostri protocolli potrebbero essere risorse utili per gli scienziati che studiano l'epitelio intestinale suino per la ricerca veterinaria o biomedica.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Institut Carnot France Futur Elevage (progetto "OrganoPig") e da INRAE HOLOFLUX (progetto "Holopig"). Gli autori sono grati alle strutture di base di Genotoul (TRI). Ringraziamo Christelle Knudsen (GenPhySE, INRAE, Tolosa) per l'attenta correzione di bozze.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | AM9260G | Store at room temperature. |
| 15 mL conical tube | Sarstedt | 62.554.502 | |
| 24-well cell culture plate | Corning | 003526 | |
| 48-well cell culture plate | Corning | 003548 | |
| 50 mL polypropylene conical tube | Falcon | 352070 | |
| Bovine Serum Albumine (BSA) | Euromedex | A6003 | Store at 4 °C. |
| Centrifuge Universal 320 R | Hettich | 1406 | |
| Collagene type IV from human placenta | Sigma | C5533 | Prepare the stock solution at 1 mg/mL in acetic acid according to the manufacturer's recommendation. Aliquot (500 µL) and store at -20 °C. |
| CoolCell LX Cell Freezing Container | Corning | 432003 | Used to cryopreserve crypts and organoids. |
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | 16842556 | |
| Coverslips, 22 mm x 50 mm | VWR | 630-1845 | |
| Cryotube ClearLine 1 mL | Clear line | 390706 | Used to cryopreserve crypts and organoids. |
| DAPI | Invitrogen | D1306 | Prepare the stock solution at 5 mg/mL in water according to the manufacturer's recommendation. Aliquot (20 µL) and store at -20 °C |
| Dithiothreitol (DTT) | Merck | 10197777001 | Store at 4 °C. |
| DMEM, high glucose, GlutaMAX Supplement, pyruvate | Thermo Fisher Scientific | 31966047 | Store at 4 °C. |
| DMSO (Dimethyl Sulfoxide) | Corning | 25-950-CQC | Store at room temperature. |
| Epredia Superfrost Plus Adhesion microscopic slide | VWR | 631-9483 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher Scientific | 10270-106 | Store 5 mL aliquots at -20 °C. |
| Fisherbrand Sterile Cell Strainers | Thermo Fisher Scientific | 22363549 | Used for crypt isolation. |
| Fixed Tilt 3D Platform Rotator | VWR | 97025-564 | Used for incubations in the immunostaining protocol. |
| Gibco PBS, pH 7.4 | Thermo Fisher Scientific | 10010015 | Store at 4 °C. |
| Gibco TrypLE Express Enzyme (1x), phenol red | Thermo Fisher Scientific | 12605-010 | Enzyme dissociation reagent. Store at room temperature. |
| Goat anti-rabbit IgG, Alexa fluor 488 | Thermo Fisher Scientific | A-11008 | Secondary antibody. Store at 4 °C. Working dilution 1:1000. |
| IntestiCult Organoid Growth Medium (Human) | Stem Cell Technology | 6010 | Organoid culture medium. Store at -20 °C. Thaw the basal medium and organoid supplement at room temperature and mix (1:1). Store the mix at 4 °C for up to 1 week. |
| Insert with PET membrane transparent Falcon for plate 24 wells | Corning | 353095 | |
| Inverted microscope | Nikon | Eclipse TS2 | |
| Matrigel Basement Membrane Matrix | Corning | 354234 | Tumor-derived extracellular matrix used for the 3D culture of organoids. Matrigel polymerizes at room temperature. Use cooled tips to pipet the Matrigel. Prepare 500 µL aliquots and store at -20 °C. |
| Mounting medium for fluorescence with DAPI | Vectashield | H1250 | Store at 4 °C. |
| Occludin polyclonal antibody | Thermo Fisher Scientific | 71-1500 | Primary antibody. Store at -20 °C. Working dilution 1:200. |
| Paraformaldehyde 32% | Electron microscopy science | 15714 | Prepare 4% paraformaldehyde (PFA) solution under chemical hood by adding 5 mL of 32% PFA to 35 mL of PBS. Aliquot by 10 mL and store at -20 °C. |
| Penicillin-Streptomycin | Sigma | P4333 | Antibacterial. Store 5 mL aliquots at -20 °C. |
| Phalloidin TRITC | Sigma | P1951 | Probe for actin staining. 1 mg/mL stock solution. Store at 4 °C. |
| Primocin | InvivoGen | ant-pm-05 | Antimicrobial agent for primary cells acting on bacteria, mycoplasma and fungi. Store at -20 °C. |
| ROCK Inhibitor (Y27632) | ATCC | ACS-3030 | Used to maintain the stem cells. Prepare the stock solution at 10 mM in sterile water according to the manufacturer's recommendation and store aliquots (50 µL) at -20 °C. |
| Rotating shaker mix XL | Clear line | 062646CL | Used for crypt isolation. |
| Stripette Serological Pipets 10 mL | Corning | 4488 | |
| Tissue Culture Dish | TPP | 93100 | |
| Triton X100 | Sigma | 8787 | Store at room temperature. |
| Trypan Blue stain 0.4% | Thermo Fisher Scientific | T10282 | Store at room temperature. |
| Vacuum system Vacusip | Integra | 159000 | Used to remove the medium of organoid wells. |
Riferimenti
- Peterson, L. W., Artis, D. Intestinal epithelial cells: regulators of barrier function and immune homeostasis. Nature Reviews Immunology. 14 (3), 141-153 (2014).
- In, J. G., et al. Human mini-guts: new insights into intestinal physiology and host-pathogen interactions. Nature Reviews Gastroenterology & Hepatology. 13 (11), 633-642 (2016).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Beaumont, M., et al. Intestinal organoids in farm animals. Veterinary Research. 52 (1), 33 (2021).
- Gonzalez, L. M., Williamson, I., Piedrahita, J. A., Blikslager, A. T., Magness, S. T. Cell lineage identification and stem cell culture in a porcine model for the study of intestinal epithelial regeneration. PLoS One. 8 (6), 66465 (2013).
- Holthaus, D., Delgado-Betancourt, E., Aebischer, T., Seeber, F., Klotz, C. Harmonization of protocols for multi-species organoid platforms to study the intestinal biology of toxoplasma gondii and other protozoan infections. Frontiers in Cellular and Infection Microbiology. 10, 610368 (2021).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Li, L., et al. Porcine intestinal enteroids: a new model for studying enteric coronavirus porcine epidemic diarrhea virus infection and the host innate response. Journal of Virology. 93 (5), 01682 (2019).
- vander Hee, B., Madsen, O., Vervoort, J., Smidt, H., Wells, J. M. Congruence of transcription programs in adult stem cell-derived jejunum organoids and original tissue during long-term culture. Frontiers in Cell and Developmental Biology. 8, 375 (2020).
- Barnett, A. M., et al. Porcine colonoids and enteroids keep the memory of their origin during regeneration. American Journal of Physiology. Cell Physiology. 320 (5), 794-805 (2021).
- Mussard, E., et al. The phenotype of the gut region is more stably retained than developmental stage in piglet intestinal organoids. Frontiers in Cell and Developmental Biology. 10, 983031 (2022).
- Zhu, M., Qin, Y. -. C., Gao, C. -. Q., Yan, H. -. C., Wang, X. -. Q. l-Glutamate drives porcine intestinal epithelial renewal by increasing stem cell activity via upregulation of the EGFR-ERK-mTORC1 pathway. Food & Function. 11 (3), 2714-2724 (2020).
- Wang, Z., et al. Dietary vitamin A affects growth performance, intestinal development, and functions in weaned piglets by affecting intestinal stem cells. Journal of Animal Science. 98 (2), (2020).
- Derricott, H., et al. Developing a 3D intestinal epithelium model for livestock species. Cell and Tissue Research. 375 (2), 409-424 (2019).
- Khalil, H. A., et al. A novel culture system for adult porcine intestinal crypts. Cell and Tissue Research. 365 (1), 123-134 (2016).
- Stewart, A. S., Freund, J. M., Gonzalez, L. M. Advanced three-dimensional culture of equine intestinal epithelial stem cells. Equine Veterinary Journal. 50 (2), 241-248 (2018).
- Tsai, Y. -. H., et al. A method for cryogenic preservation of human biopsy specimens and subsequent organoid culture. Cellular and Molecular Gastroenterology and Hepatology. 6 (2), 218-222 (2018).
- Wilson, S. S., Tocchi, A., Holly, M. K., Parks, W. C., Smith, J. G. A small intestinal organoid model of non-invasive enteric pathogen-epithelial cell interactions. Mucosal Immunology. 8 (2), 352-361 (2015).
- Li, Y., et al. Next-generation porcine intestinal organoids: an apical-out organoid model for swine enteric virus infection and immune response investigations. Journal of Virology. 94 (21), 01006-01020 (2020).
- Moon, C., VanDussen, K. L., Miyoshi, H., Stappenbeck, T. S. Development of a primary mouse intestinal epithelial cell monolayer culture system to evaluate factors that modulate IgA transcytosis. Mucosal Immunology. 7 (4), 818-828 (2014).
- vander Hee, B., et al. Optimized procedures for generating an enhanced, near physiological 2D culture system from porcine intestinal organoids. Stem Cell Research. 28, 165-171 (2018).
- Hoffmann, P., et al. Intestinal organoid-based 2D monolayers mimic physiological and pathophysiological properties of the pig intestine. PLoS One. 16 (8), 0256143 (2021).
- Vermeire, B., Gonzalez, L. M., Jansens, R. J. J., Cox, E., Devriendt, B. Porcine small intestinal organoids as a model to explore ETEC-host interactions in the gut. Veterinary Research. 52 (1), 94 (2021).
- Luo, H., et al. Utility evaluation of porcine enteroids as PDCoV infection model in vitro. Frontiers in Microbiology. 11, 821 (2020).
- Resende, T. P., Medida, R. L., Vannucci, F. A., Saqui-Salces, M., Gebhart, C. Evaluation of swine enteroids as in vitro models for Lawsonia intracellularis infection1,2. Journal of Animal Science. 98 (2), 011 (2020).
- Engevik, A. C., et al. Editing myosin VB gene to create porcine model of microvillus inclusion disease, with microvillus-lined inclusions and alterations in sodium transporters. Gastroenterology. 158 (8), 2236-2249 (2020).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gracz, A. D., Puthoff, B. J., Magness, S. T. Identification, isolation, and culture of intestinal epithelial stem cells from murine intestine. Somatic Stem Cells: Methods and Protocols. 879, 89-107 (2012).
- Ferrandis Vila, M., et al. Dietary fiber sources and non-starch polysaccharide-degrading enzymes modify mucin expression and the immune profile of the swine ileum. PloS One. 13 (11), 0207196 (2018).
- Li, L., et al. IFN-lambda 3 mediates antiviral protection against porcine epidemic diarrhea virus by inducing a distinct antiviral transcript profile in porcine intestinal epithelia. Frontiers in Immunology. 10, 2394 (2019).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Sutton, K. M., Orr, B., Hope, J., Jensen, S. R., Vervelde, L. Establishment of bovine 3D enteroid-derived 2D monolayers. Veterinary Research. 53 (1), 15 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon