Method Article
التقييم المتزامن للقرابة ورقم القسمة والنمط الظاهري عن طريق قياس التدفق الخلوي للخلايا الجذعية والسلفية المكونة للدم
In This Article
Summary
تظهر هنا تقنية قائمة على قياس التدفق الخلوي تسمح بقياس عدد انقسامات الخلايا والنمط الظاهري للخلية السطحية والقرابة الخلوية في وقت واحد. يمكن اختبار هذه الخصائص إحصائيا باستخدام إطار عمل قائم على التقليب.
Abstract
قليل من التقنيات يمكنها تقييم النمط الظاهري والمصير لنفس الخلية في وقت واحد. معظم البروتوكولات الحالية المستخدمة لتوصيف النمط الظاهري ، على الرغم من قدرتها على توليد مجموعات بيانات كبيرة ، تستلزم تدمير الخلية ذات الاهتمام ، مما يجعل من المستحيل تقييم مصيرها الوظيفي. لذلك يصعب وصف أنظمة التمايز البيولوجي غير المتجانسة مثل تكون الدم. بناء على أصباغ تتبع انقسام الخلايا ، قمنا بتطوير بروتوكول لتحديد القرابة ورقم القسمة وحالة التمايز في وقت واحد للعديد من أسلاف المكونة للدم المفردة. يسمح هذا البروتوكول بتقييم إمكانات التمايز خارج الجسم الحي للفئران والأسلاف المكونة للدم البشرية ، المعزولة من مصادر بيولوجية مختلفة. علاوة على ذلك ، نظرا لأنه يعتمد على قياس التدفق الخلوي وعدد محدود من الكواشف ، فإنه يمكن أن يولد بسرعة كمية كبيرة من البيانات ، على مستوى الخلية الواحدة ، بطريقة غير مكلفة نسبيا. كما نقدم خط الأنابيب التحليلي للتحليل أحادي الخلية ، جنبا إلى جنب مع إطار إحصائي قوي. نظرا لأن هذا البروتوكول يسمح بربط انقسام الخلايا والتمايز على مستوى الخلية الواحدة ، فيمكن استخدامه لإجراء تقييم كمي لالتزام المصير المتماثل وغير المتماثل ، والتوازن بين التجديد الذاتي والتمايز ، وعدد الانقسامات لمصير التزام معين. إجمالا ، يمكن استخدام هذا البروتوكول في التصاميم التجريبية التي تهدف إلى كشف الاختلافات البيولوجية بين أسلاف المكونة للدم ، من منظور خلية واحدة.
Introduction
تميز العقد الماضي بالانتشار العالمي لنهج الخلية الواحدة للبيولوجيا الخلوية والجزيئية. باتباع خطوات علم الجينوم أحادي الخلية 1,2 ، من الممكن في الوقت الحاضر دراسة العديد من مكونات الخلية الواحدة (على سبيل المثال ، الحمض النووي ، الحمض النووي الريبي ، البروتينات) ، مع تقنيات أوميكس أحادية الخلية الجديدة التي تزدهر كل عام. وقد ألقت هذه التقنيات الضوء على الأسئلة القديمة والجديدة لمجالات علم المناعة وعلم الأعصاب وعلم الأورام وغيرها، سواء باستخدام خلايا الكائنات الحية البشرية أو النموذجية3. من خلال تسليط الضوء على الاختلافات بين الخلايا الفردية ، دفعت الخلية المفردة -omics إلى تعريف نموذج جديد لتكوين الدم ، يركز على عدم تجانس الخلايا الجذعية والسلفية المكونة للدم (HSPCs) والابتعاد عن النموذج الكلاسيكي للسكان المتجانسين المنفصلين 4,5.
واحدة من العيوب القليلة لجميع تقنيات -omics هي تدمير الخلية ذات الاهتمام ، مما يحول دون إمكانية تقييم وظائفها. على العكس من ذلك ، توفر طرق الخلية الواحدة الأخرى ، مثل فحص زراعة الخلية الواحدة وتقنيات تتبع النسب ، قراءة لوظائف الخلية السلف من خلال تقييم مصير الخلايا الفردية في الجسم الحي 6,7. تتضمن تقنيات تتبع النسب تسمية الخلية ذات الأهمية بعلامة وراثية7 وراثية أو تسمية فلورية 8,9 ، مما يسمح بتتبع مصير خلايا مفردة متعددة في نفس الوقت. ومع ذلك ، فإن توصيف الخلايا الأولية يقتصر عادة على عدد محدود من المعلمات ، مثل التعبير عن عدد قليل من البروتينات السطحية التي تم تقييمها بواسطة قياس التدفق الخلوي10. بالإضافة إلى ذلك ، تتطلب تقنيات تتبع النسب أحادية الخلية اكتشافا شاقا للملصق الخلوي ، عادة عن طريق تسلسل أو تصوير الحمض النووي / الحمض النووي الريبي. هذه النقطة الأخيرة على وجه الخصوص تحد من عدد الحالات التي يمكن اختبارها في تجربة واحدة.
فئة أخرى من الطرق المستخدمة لدراسة وظائف الخلايا المفردة هي أنظمة زراعة الخلايا خارج الجسم الحي ل HSPCs الفردية. سهلة الأداء ، تتضمن هذه المقايسات القياسية الذهبية فرز الخلايا الفردية إلى أوعية زراعة خلايا 96 بئرا ، وبعد المزرعة ، تميز النمط الظاهري لذرية الخلية ، عادة عن طريق قياس التدفق الخلوي أو التحليل المورفولوجي. تم استخدام هذه المقايسات في الغالب لتوصيف التمايز طويل المدى ل HSPCs إلى خلايا ناضجة ، عادة بعد 2-3 أسابيع من الثقافة11,12. بدلا من ذلك ، تم استخدامها لمحاولة الحفاظ على وتوسيع HSPCs خارج الجسم الحي 13،14،15،16،17،18 ، مع وعد بالفائدة الطبية لزراعة الخلايا الجذعية البشرية 19. أخيرا ، تم استخدامها لدراسة الالتزام المبكر ل HSPCs باستخدام الثقافةقصيرة المدى 20 ، مع انخفاض عدد الخلايا المتولدة في هذه الثقافة كونها العامل المحدد الرئيسي. أحد عيوب هذه الأنواع المختلفة من المقايسات خارج الجسم الحي هو أنها تعكس جزئيا فقط التعقيد في الجسم الحي. ومع ذلك ، فهي واحدة من الطرق النادرة لدراسة تمايز HSPC البشري.
إحدى المعلومات المفقودة من طرق الخلية الواحدة الحالية (أوميكس الخلية المفردة ، وتتبع النسب ، والثقافة خارج الجسم الحي) هي الكشف الدقيق عن انقسامات الخلايا ، وهي معلمة أساسية يجب مراعاتها عند دراسة ديناميكيات HSPC21. هناك طريقة بسيطة لتقييم عدد الانقسامات عبر قياس التدفق الخلوي وهي استخدام "أصباغ البروتين" القابلة للذوبان ، مثل 5- (و 6) - كربوكسي فلوريسئين ثنائي أسيتات سكسينيميديل إستر (CFSE) 22. تنتشر أصباغ الانقسام هذه داخل سيتوبلازم الخلايا الملطخة ، وتخفف بمقدار النصف وتنتقل إلى الخليتين البنيتين في كل انقسام خلوي ، مما يسمح بتعداد ما يصل إلى 10 أقسام. من خلال الجمع بين العديد من أصباغ التقسيم ، من الممكن زرع أسلاف فرديين متعددين في نفس البئر ، حيث تسمح كل صبغة فردية بفصل الأحفاد المختلفة. هذا هو المبدأ الكامن وراء استخدام أصباغ الخلايا لتتبع الإرسال النسيلي المتعدد والانقسام الذي تم تقديمه لأول مرة للخلايا الليمفاوية للفئران23,24.
هنا ، نقدم تطوير مقايسة MultiGen للاستخدام مع الفئران و HSPCs البشرية. يسمح باختبار العديد من الخلايا المفردة في وقت واحد لخصائصها في التمايز والانقسام والقرابة خارج الجسم الحي. يسمح هذا الفحص عالي الإنتاجية وسهل الأداء وغير المكلف بقياس النمط الظاهري الخلوي وعدد الانقسامات التي يتم إجراؤها وقرابة الخلية والعلاقة النسيلية مع الخلايا الأخرى في البئر ، كل ذلك في نفس الوقت. يمكن استخدامه لإجراء تقييم كمي لالتزام المصير المتماثل وغير المتماثل ، والتوازن بين التجديد الذاتي والتمايز ، وعدد التقسيمات اللازمة لمصير التزام معين. يتطلب البروتوكول فارز الخلايا المنشط بالتألق (FACS) ومقياس التدفق الخلوي مع قارئ لوحة ، بالإضافة إلى المعدات اللازمة لأداء زراعة الخلايا. بالإضافة إلى البروتوكول الفني لتنفيذ الفحص على HSPCs البشرية ، نقدم أيضا إطار التحليل التفصيلي ، بما في ذلك الاختبار الإحصائي اللازم لتقييم الخصائص الخلوية المتعلقة بمفهوم عائلة الخلية25. تم بالفعل استخدام هذا البروتوكول بنجاح لوصف حجرة الفئران HSPC26,27.
يستخدم البروتوكول التالي خلايا CD34 + المخصبة مغناطيسيا كمادة أولية28. بهذه الطريقة ، من الممكن تلطيخ وعزل HSPCs البشرية بكفاءة من مصادر الدم المختلفة (على سبيل المثال ، دم الحبل السري ونخاع العظام والدم المحيطي). من المهم عدم تجاهل جزء CD34 ، حيث سيتم استخدامه كجزء من البروتوكول لتعيين أنواع مختلفة من عناصر التحكم التجريبية. يمكن زيادة أو تقليل كميات وأحجام الخلايا المذكورة ، وفقا لسير العمل التجريبي والضروريات. وبالمثل ، يمكن تكييف البروتوكول لدراسة أنواع مختلفة من الأسلاف ، ببساطة عن طريق تعديل الأجسام المضادة المستخدمة في فرز الخلايا وخطوات قياس التدفق الخلوي.
Protocol
بالنسبة للبروتوكول التالي ، تم استخدام دم الحبل السري غير المحدد كمصدر HSPC وتم جمعه وفقا للإرشادات التي حددها البنك الحيوي لدم الحبل السري في مستشفى سانت لويس (التفويض AC-2016-2759) ومع إعلان هلسنكي.
ملاحظة: قبل البدء ، تأكد من توفر جميع الكواشف والمعدات اللازمة لهذا البروتوكول ، كما هو مدرج في جدول المواد والمذكور في البروتوكول. قم بإعداد الكواشف ذات الصلة طازجة ولا تقم بتخزينها ، ما لم يذكر ذلك صراحة.
1. تلطيخ صبغة الخلية
ملاحظة: يصف هذا القسم التلوين بأربع مجموعات من أصباغ انقسام الخلايا CFSE والصبغة البنفسجية (CTV). قم بمعالجة جميع الأنابيب في وقت واحد ، حتى لو لم تتم إضافة محلول صبغة الخلية. يتم تنفيذ جميع الخطوات في ظروف معقمة للسماح بخطوة زراعة الخلايا التالية. الوقت المطلوب: حوالي 100 دقيقة.
- معالجة وحدة دم الحبل السري وفقا لبروتوكول الفرز المغناطيسي29. تأكد من توفر كسرين: كسر CD34- كبير وكسر CD34+ أصغر. أدر كلا الأنبوبين لمدة 5 دقائق عند 300 × جم. نضح الطافية دون إزعاج بيليه.
- بالنسبة لجزء CD34 + ، أعد تعليقه في 1 مل من وسط النسر المعدل من Dulbecco (DMEM) بدون مصل بقري جنيني (FBS). عد الخلايا باستخدام مقياس الدم. يجب ألا تزيد كثافة الخلية عن 3 × 106 خلايا / مل. إذا كانت هذه هي الحالة ، فقم بتكييف مستوى الصوت وفقا لذلك. بالنسبة لكسر CD34 ، أعد التعليق في DMEM بدون FBS ، واضبط مستوى الصوت بحد أقصى 6 × 106 خلايا / مل.
- القسمة 250 ميكرولتر من جزء CD34 + إلى أربعة أنابيب بولي بروبيلين سعة 15 مل. قم بتسمية الأنابيب على النحو التالي: CD34 + / CF (CFSE_only) و CD34 + / CV (CFSE_high CTV_low) و CD34 + / VC (CFSE_low CTV_high) و CD34 + / VI (CTV_high). القسمة 250 ميكرولتر من جزء CD34 إلى أربعة أنابيب أخرى من مادة البولي بروبيلين سعة 15 مل. قم بتسمية الأنابيب على النحو التالي: CD34- / CF (CFSE_only) و CD34- / CV (CFSE_high CTV_low) و CD34- / VC (CFSE_low CTV_high) و CD34- / VI (CTV_high). يمكن التخلص من الخلايا المتبقية من جزء CD34.
- قم بإعداد حلين CFSE ، باسم CFSE_high و CFSE_low. بالنسبة CFSE_high (10 ميكرومتر) ، امزج 1.1 مل من DMEM بدون FBS مع 2.2 ميكرولتر من محلول مخزون CFSE (5 مللي مول). بالنسبة CFSE_low (5 ميكرومتر) ، امزج 550 ميكرولتر من DMEM بدون FBS و 0.55 ميكرولتر من محلول مخزون CFSE (5 mM).
- أضف 250 ميكرولتر من محلول CFSE_high إلى أنابيب CF و CV ، و 250 ميكرولتر من محلول CFSE_low إلى أنابيب VC ، و 250 ميكرولتر من DMEM بدون FBS إلى الأنبوب السادس. لضمان مزيج فعال من تعليق الخلية وصبغة الخلية ، قم بإمالة الأنبوب بمقدار 90 درجة تقريبا ، وقم بإيداع محاليل CFSE على جدار الأنبوب. بعد ذلك ، أمسك الأنبوب عموديا لخلط المحلولين ، والماصة ثلاث أو أربع مرات لضمان خلط سريع لمحاليل CFSE مع الخلايا المعاد تعليقها. احتضان في 37 درجة مئوية لمدة 8 دقائق بالضبط.
- بعد الحضانة ، أضف 5 مل من DMEM + 10٪ FBS. احفظ الأنابيب على درجة حرارة 37 درجة مئوية لمدة 5 دقائق.
- أدر الأنابيب لمدة 5 دقائق عند 300 × جم. قم بإزالة المادة الطافية عن طريق الشفط دون إزعاج الحبيبات ، واغسل الحبيبات ب 5 مل من محلول ملحي مخزن بالفوسفات 1x / حمض إيثيلين ديامينيترايتيك (PBS 1x / EDTA). أدر مرة أخرى لمدة 5 دقائق عند 300 × جم. تخلص من المادة الطافية دون إزعاج الحبيبة ، وأعد تعليق حبيبات الخلية في 250 ميكرولتر من 1x PBS / EDTA.
- قم بإعداد حلين CTV ، باسم CTV_high و CTV_low. بالنسبة CTV_high (10 ميكرومتر) ، امزج 1.1 مل من PBS 1x / EDTA و 2.2 ميكرولتر من مخزون CTV (5 مللي مول). بالنسبة CTV_low (5 ميكرومتر) ، امزج 550 ميكرولتر من PBS 1x / EDTA مع 0.55 ميكرولتر من مخزون CTV (5 مللي مول).
- أضف 250 ميكرولتر من محلول CTV_high إلى أنابيب VC و VI ، و 250 ميكرولتر من محلول CTV_low إلى أنبوب CV ، و 250 ميكرولتر من 1x PBS / EDTA إلى أنبوب CF. استخدم نفس الأسلوب الموضح في الخطوة 1.5. احتضان في 37 درجة مئوية لمدة 8 دقائق بالضبط.
- بعد الحضانة ، أضف 5 مل من DMEM + 10٪ FBS. يحفظ على حرارة 37 درجة مئوية لمدة 5 دقائق.
- أدر الأنابيب لمدة 5 دقائق عند 300 × جم ، وتخلص من المادة الطافية دون إزعاج الحبيبات ، ثم اغسل الحبيبات ب 5 مل من 1x PBS / EDTA. أدر مرة أخرى لمدة 5 دقائق عند 300 × جم.
- تخلص من المادة الطافية دون إزعاج الحبيبات ، وأعد تعليق كسور CD34 في 1x PBS / EDTA لتركيز نهائي يبلغ 1.5 × 106 خلايا / مل. أعد تعليق كسور CD34 + في 40 ميكرولتر من المخزن المؤقت للتلطيخ ، وانقل الخلايا إلى أنابيب سعة 1.5 مل.
2. تلطيخ الأجسام المضادة
ملاحظة: يمكن تخصيص تلطيخ الأجسام المضادة وفقا للاحتياجات التجريبية. فقط كسور CD34 + تخضع لتلطيخ الأجسام المضادة ؛ تستخدم كسور CD34 كعنصر تحكم واحد في التلوين لمجموعات صبغة انقسام الخلايا (كسور CV و VC و CF و VI). تم تصميم اللوحة التالية للكشف عن أربعة أنواع من HSPCs: الخلايا الجذعية المكونة للدم (HSCs) ، والأسلاف متعددة القدرات (MPPs) ، والأسلاف متعددة القدرات المحضرة لمفاوية (LMPPs) ، والخلايا السلفية المكونة للدم (HPCs) 12. ومع ذلك ، يتم تقديم تحديد HSCs و MPPs. الوقت المطلوب: 75 دقيقة.
- تحضير تلطيخ واحد لتلطيخ السطح ، وذلك باستخدام حبات التعويض. امزج الخرزات السالبة وحبات الغلوبولين المناعي G (IgG) بنسبة 1: 1 ، للحصول على حجم إجمالي يعادل 20 ميكرولتر × عدد علامات السطح (على سبيل المثال ، 120 ميكرولتر إذا كانت لوحة التلوين تحتوي على ستة أجسام مضادة).
- أرسل 20 ميكرولتر من الخرز إلى أنابيب فردية سعة 1.5 مل لكل علامة. أضف الحجم المقابل لعامل التخفيف لكل جسم مضاد في الأنبوب المقابل (على سبيل المثال ، إذا كان عامل التخفيف 1:20 ، أضف 1 ميكرولتر).
- لتلطيخ خلايا CD34 + ، قم بإعداد مزيج رئيسي من الأجسام المضادة12 ، بناء على الجدول 1. امزج الأجسام المضادة في أنبوب واحد سعة 0.5 مل. أضف 7 ميكرولتر من المزيج الرئيسي للأجسام المضادة إلى كل من شروط CD34 + الأربعة.
- احتضان حبات التعويض وعينات CD34 + عند 4 درجات مئوية لمدة 30 دقيقة على الأقل.
ملاحظة: يجب تكييف وقت الحضانة مع التفاصيل الفنية للأجسام المضادة المستخدمة للتلطيخ. - أثناء الحضانة ، قم بإعداد اللوحة ذات القاع المستدير المكونة من 96 بئرا لاستخدامها في الفرز ، مع إضافة 100 ميكرولتر من وسط زراعة الخلايا إلى كل بئر باستخدام ماصة متعددة القنوات.
ملاحظة: اترك الآبار H8-H12 فارغة. - قم بتسمية أنابيب البولي بروبلين سعة 5 مل لأدوات التحكم في تلطيخ السطح (5 ، باستخدام الخرز) ، وأدوات التحكم في أصباغ انقسام الخلايا (4 ، باستخدام كسور CD34) ، وعينات CD34 + (4).
- في نهاية الحضانة ، اغسل الخلايا والخرز ب 1 مل من المخزن المؤقت للتلطيخ. انقل الحجم الكلي إلى أنابيب البولي بروبلين سعة 5 مل. أجهزة الطرد المركزي الأنابيب لمدة 5 دقائق عند 300 × جم ، ثم تطمح إلى المادة الطافية دون إزعاج الحبيبات.
- أعد تعليق الخلايا في محلول تلطيخ ، باستخدام ما يقرب من 500 ميكرولتر لكل من الخرز وخلايا CD34 + ، و 1 مل لأنابيب CD34.
الجدول 1: قالب لتحضير المزيج الرئيسي للأجسام المضادة لتجربة فرز الخلايا. الرجاء الضغط هنا لتنزيل هذا الجدول.
3. فرز الخلايا
ملاحظة: قد تختلف أرقام الخلايا التي تم فرزها وفقا للعدد الإجمالي للخلايا المتوفرة. في البروتوكول ، يتم توفير الحد الأدنى لرقم الخلية لكل عنصر تحكم. الوقت المطلوب (للوحة واحدة): 100 دقيقة.
- افتح تجربة النموذج أو اضبط تجربة جديدة. قم بإنشاء عينة واحدة وأنابيب متعددة ، واحدة لكل حالة.
- اضبط إستراتيجية البوابات المفصلة في الشكل 1 ، مع إنشاء ستة مخططات بيانية نقطية. أولا ، تصور الخلايا على مخطط نقطي FSC-A / SSC-A ، وانقر نقرا مزدوجا فوق أداة بوابة المضلع لتحديد مجموعة ذات تشتت جانبي منخفض (الشكل 1 أ). في مخطط النقاط التالي (FSC-A / FSC-H) ، انقر بزر الماوس الأيمن على قطعة الأرض وحدد البوابة "خلايا" من القائمة المنسدلة بالنقر فوقها. استخدم نفس أداة البوابات لتحديد مجموعة سكانية ضيقة على القطر بين المحورين (الشكل 1 ب).
- في مخطط النقطة الثالثة (APC مقابل FSH-H) ، اعرض "الخلايا المفردة" للسكان وقم ببوابة الخلايا السلبية للتعبير عن نسب APC (Lin) (الشكل 1C). في الرسم الرابع (CFSE مقابل CTV) ، اعرض السكان "Lin-" وقم بإنشاء أربع بوابات منفصلة ، واحدة لكل مجموعة صبغة (الشكل 1D).
ملاحظة: يجب أن تكون هذه البوابات محكمة ، لتحديد جزء صغير فقط من الخلايا الملطخة بشكل متجانس. - استخدم المخطط الخامس والسادس (APC-Cy7 مقابل BV650 و PE-Cy7 مقابل PE) لتحديد الأسلاف موضع الاهتمام. بوابة بسخاء CD34 + CD38- السكان و CD34 + CD38 + في المؤامرة الخامسة (الشكل 1E). بعد ذلك ، حدد مجتمع CD34 + CD38 في المخطط السادس ، وارسم ثلاث بوابات ، وفقا للشكل 1F.
- قم بتشغيل أنابيب التلوين الفردية التي تحتوي على حبات التعويض ، وانقر فوق الزر "اكتساب ". اضبط جهد أنبوب المضاعف الضوئي (PMT) من القائمة المنسدلة المعلمات ، خاصة بالنسبة لأصباغ انقسام الخلايا (بين 104 و 105 على مقياس أسي).
- قم بتحسين مصفوفة التعويض وفقا للوحة المستخدمة للفرز، باستخدام علامة التبويب التعويض . سجل ما لا يقل عن 5000 حدث في بوابة الخرز ، وانقر فوق الزر "تسجيل ".
- قم بتشغيل كسور CD34 وتحقق من مصفوفة التعويض مرة أخرى. سجل ما لا يقل عن 10000 حدث في البوابة أحادية الخلية.
- قم بتشغيل كسور CD34 + ، وتسجيل ما لا يقل عن 5000 حدث في بوابة الخلية الواحدة. اضبط البوابة لكل مجموعة صبغ ، وقم بتعيين بوابة ضيقة لتحديد مجموعة متجانسة (الشكل 1 د). وبالمثل ، اضبط البوابة لاختيار HSCs و MPPs.
- بمجرد الانتهاء من التحليل وتسجيل جميع الأنابيب ، أدخل اللوحة في الحامل المناسب ، بعد إجراء معايرة Aria القياسية للفرز على لوحات 96 بئرا. يوصى بتبريد اللوحة.
- قم بإعداد قالب فرز اللوحة وفقا للمخطط الموضح في الجدول 2 ، باستخدام تخطيط فرز التجربة. تحتوي الآبار المسماة "CD34-" على 5000-10000 خلية ، مرتبة على بوابة CF / CV / VC / VI. تحتوي الآبار "السائبة" على 500 خلية على الأقل ، مرتبة على البوابة CD34 + CD38-. أخيرا ، تحتوي الآبار أحادية الخلية على حدث واحد فقط لكل مجموعة صبغة انقسام الخلية لكل بئر ، لذلك أربعة أحداث لكل بئر في المجموع.
ملاحظة: يمكن تكييف المجموعات "السائبة" مع مجموعة فرعية محددة من الأسلاف. لا تفرز أقل من 500 خلية. - بالنسبة للفرز ، تابع الترتيب ، وأكمل كل مجموعة صبغة انقسام الخلايا قبل الانتقال إلى المجموعة التالية. على سبيل المثال ، ابدأ بفرز CD34- CF ، في وضع نقاء الخضوع . انقر فوق زر الاكتساب ، ثم على زر الفرز.
- في نهاية فرز CD34 ، أدخل أنبوب CF CD34 + . احصل ، ثم انقر فوق زر الفرز ، مع التأكد من وضع علامة 0/ 16/0 كدرجة نقاء. أخيرا ، قم بفرز الخلايا المهمة ، خلية واحدة لكل بئر ، في نقاء خلية واحدة ، مع التأكد من تحديد خيار فرز الفهرس .
- انتقل إلى تركيبة صبغة انقسام الخلايا التالية ، مع تكرار نفس الترتيب. كمرجع، يقدم الجدول 2 مثالا على لوحة تم فرزها.
ملاحظة: تقوم وظيفة فرز الفهرس بإنشاء ملفات فردية لكل حالة تم فرزها. - في نهاية الفرز، قم بتصدير الملفات كملفات .fcs 3.0. ضع الخلايا في حاضنة 37 درجة مئوية ، 5٪ CO2 . يتم استزراع الخلايا لعدة أيام ، وفقا للتصميم التجريبي ، لمدة 24 ساعة على الأقل26.
الجدول 2: نموذج للوحة فرز الخلايا ذات 96 بئرا ، بناء على المتطلبات المحددة لتحليل التدفق الخلوي المتتالي. الرجاء الضغط هنا لتنزيل هذا الجدول.
4. تحليل بيانات فرز الخلايا
ملاحظة: للتحقق من جودة فرز الخلايا ، يعد تحليل بيانات FACS ضروريا قبل المضي قدما. الناتج الرئيسي لهذه الخطوة هو إنشاء جدول بيانات يحتوي على كثافة العلامة لكل خلية فردية تم فرزها.
- قم بتحميل ملفات .fcs 3.0 في برنامج التحليل.
- تحقق من إعداد التعويض المستخدم أثناء فرز الخلايا ، باستخدام ملفات التلوين الفردية المسجلة قبل الفرز الفعلي.
- قم بتعيين استراتيجية البوابة المنقحة باستخدام الملفات المقابلة للجزء الأكبر المختلف. انسخ والصق تلك البوابات في ملفات فرز الفهرس.
- تحقق من سقوط الخلايا التي تم فرزها في الفهرس في البوابة المحددة. إذا كانت هناك بعض الخلايا التي تم فرزها والتي تم إدخالها بشكل غير صحيح ، فيمكن تحديدها عن طريق تصدير إحداثيات اللوحة المسجلة أثناء فرز الفهرس ، وإزالتها لاحقا في التحليل.
- تصدير الحدث من ملفات فرز الفهرس كمعلمات تعويضية. قم بتصديرها كملفات .csv ، مع تحديد الخيارات " قيم المقياس " و "المعلمات المعوضة". يجب تصدير هذه الملفات في مجلد باسم "الملفات المصدرة".
- ادمج جميع الملفات في ملف .csv واحد، باستخدام البرنامج النصي في الملف التكميلي 1. اضبط المسار الصحيح باستخدام الوظيفة "setwd". إخراج هذا البرنامج النصي عبارة عن جدول بيانات يحتوي على جميع الأحداث ذات البوابات المختلفة والشدة النسبية لجميع المعلمات.
5. بعد تلطيخ الأجسام المضادة الثقافة
ملاحظة: تنفيذ هذا الجزء من البروتوكول في ظروف معقمة; تتم مشاركة العديد من الكواشف مع الخطوات السابقة ، وتحتاج إلى البقاء معقمة. لتحليل قياس التدفق الخلوي ، استخدم مقياس التدفق الخلوي مع قارئ اللوحة. هذا يسمح بإجراء تلطيخ مباشرة في لوحة زراعة الأنسجة ، مما يقلل من فقدان الخلية إلى الحد الأدنى عن طريق الحد من كمية السحب والغزل. قم بإعداد تلطيخ علامة السطح أحادية اللون باستخدام حبات التعويض ، باستثناء الآبار A1-A4 ، والتي تمثل التلوين الفردي لألوان CF / CV / VC / VI وهي موجودة بالفعل في لوحة 96 بئرا. تساعد المجموعات السائبة التي تم فرزها وفقا لصبغة الخلية في وضع استراتيجية البوابات لعدد الأقسام والبوابات العامة. الوقت المطلوب: 120 دقيقة.
- قبل بدء البروتوكول ، حدد الآبار التي تحتوي على خلية واحدة على الأقل عن طريق فحص اللوحة تحت المجهر المقلوب. تسمح هذه الخطوة بتحسين كمية الأجسام المضادة المستخدمة في التلوين وتسريع الإجراء.
- تحضير ماستر الأجسام المضادة ، وفقا للجدول 3. نظرا لوجود قدر كبير من السحب ، يأخذ الجدول في الاعتبار الخطأ الفني الناتج عن السحب ، بما في ذلك حجم إضافي بنسبة 5٪. تسمح الأجسام المضادة الموصوفة في الجدول بتوصيف مجموعة من HSPCs من عينات دم الحبل السري البشري12.
- أجهزة الطرد المركزي لوحة لمدة 5 دقائق في 300 × غرام. اقلب اللوحة بسرعة تحت الغطاء وفوق منشفة ورقية لإزالة المادة الطافية.
- أضف 8 ميكرولتر من محلول التلوين إلى الآبار A1-A4. أضف 8 ميكرولتر من المزيج إلى الآبار الأخرى.
- امزج الحبيبات السالبة وخرز تعويض IgG بنسبة 1: 1 ، لحجم إجمالي يعادل 120 ميكرولتر. أرسل 20 ميكرولتر في أنبوب واحد سعة 1.5 مل لكل علامة. أضف حجم الجسم المضاد المقابل لعامل التخفيف (على سبيل المثال ، إذا كان عامل التخفيف 1:20 ، أضف 1 ميكرولتر).
ملاحظة: قم بتكييف الحجم الكلي مع عدد العلامات المستخدمة في التلوين (على سبيل المثال ، 100 ميكرولتر إذا كانت لوحة التلوين تحتوي على خمسة أجسام مضادة). - احتضان اللوحة وأدوات التحكم في تعويض التلوين الفردي عند +4 درجة مئوية ، لمدة 30 دقيقة على الأقل.
ملاحظة: يجب تكييف وقت الحضانة مع التفاصيل الفنية للأجسام المضادة المستخدمة في التلطيخ. - اغسل الخرز ب 1 مل من المخزن المؤقت للتلطيخ. انقل الحجم الإجمالي إلى أنابيب البولي بروبلين سعة 5 مل التي تم تسميتها مسبقا. أجهزة الطرد المركزي الأنابيب لمدة 5 دقائق عند 300 × جم ، ثم قم بإزالة المادة الطافية عن طريق الشفط.
- اغسل الخلايا الموجودة في اللوحة بإضافة 100 ميكرولتر من محلول التلوين لكل بئر باستخدام ماصة متعددة القنوات. قم بطرد اللوحة عند 300 × جم لمدة 5 دقائق ، ثم اقلب اللوحة بسرعة أسفل الغطاء وفوق منشفة ورقية لإزالة المادة الطافية.
- أعد تعليق الخلايا في 85 ميكرولتر من المخزن المؤقت للتلطيخ ، باستخدام ماصة متعددة القنوات.
- ابدأ التحليل على مقياس التدفق الخلوي (وضع الاستحواذ) ، باستخدام القالب المخصص والنقر على مخصص. يأخذ هذا القالب المخصص في الاعتبار الميزات التقنية للوحة ذات القاع المستدير المكون من 96 بئرا ، لا سيما أبعاد كل بئر (القطر والعمق والسماكة). يجب أن يصل المسبار إلى قاع البئر ، لذا ضعه في المركز الدقيق للبئرين A1 و H12.
- بعد اختيار الفلوروفورات ذات الأهمية من القائمة التي اقترحها البرنامج ، اضبط إعداد اللوحة باتباع قالب اللوحة في الجدول 2 ، مصححا لعدد الآبار التي تحتوي على خلية واحدة على الأقل.
- حدد 100 ميكرولتر كحد لحجم الاستحواذ. ضع علامة على خيار الإثارة . اضبط معدل الاستحواذ على 1 ميكرولتر / ثانية كحد أقصى ، حيث تعمل السرعة المنخفضة على تحسين الحجم الإجمالي الذي تم تحليله لكل بئر.
- أضف حلول التنظيف والغسيل المناسبة للآبار H8-H12. يترك القالب في الجدول 2 الآبار H8-H12 فارغة على وجه التحديد ، حيث يحتاج مقياس التدفق الخلوي إلى تشغيل مجموعة من ظروف الغسيل في نهاية التحليل.
ملاحظة: يتم تكييف هذه الخطوة مع تفاصيل مقياس التدفق الخلوي المستخدم. - في قسم المؤامرات والبوابات ، قم أولا بتعيين البوابة أحادية الخلية ، باستخدام مخطط التشتت FSC-A / SSC-A ثم مخطط التشتت FSC-H / FSC-A. قم بإنشاء مدرج تكراري لكل علامة اهتمام.
- بمجرد تأكيد الإعدادات ، انتقل إلى قسم التحليل . قم بتحليل التلوين الفردي أولا ، وتسجيل ما لا يقل عن 5000 حدث (النطاق الأمثل: 5000-15000 حدث) ، لكل من حبات التعويض والكسور الملطخة CD34. اضبط الفولتية إذا لزم الأمر.
- بمجرد تسجيل جميع البقع الفردية ، من الممكن بدء عملية الاستحواذ الفعلية ، والنقر فوق وظيفة الاستحواذ .
الجدول 3: مزيج رئيسي من الأجسام المضادة لتجربة قياس التدفق الخلوي ، وتحديدا لتحديد HSPCs من دم الحبل السري البشري. الرجاء الضغط هنا لتنزيل هذا الجدول.
6. تحليل بيانات قياس التدفق الخلوي بعد الاستزراع
ملاحظة: تحليل البيانات الموصوف خاص بالبرنامج المذكور في جدول المواد. الناتج الرئيسي هو إنشاء جدول بيانات يحتوي على معلومات عن كثافة علامة السطح وعدد الأقسام والقرابة لكل خلية تم تحليلها. يتضمن هذا الجزء من البروتوكول نصا مكتوبا بلغة R ، وهو ضروري لسير العمل هذا لإنشاء جدول بيانات التحليل النهائي.
- تصدير الملفات من مقياس التدفق الخلوي كملفات .fcs. قم بتحميلها على برنامج التحليل ، وقم بتجميعها معا ك "تلطيخ واحد" و "مجمع" و "خلية واحدة".
- قم بإعداد مصفوفة تعويض باستخدام ملفات التلوين الفردية ، وقم بتطبيقها على المجموعتين الأخريين عن طريق السحب والإفلات.
ملاحظة: إذا تم استخدام أداة تعويض تلقائية ، فتحقق من الجودة يدويا قبل المضي قدما. - للحصول على بوابة تمثيلية ، قم بتسلسل الآبار السائبة المختلفة في ملف واحد. تبرز هذه الخطوة بسرعة ما إذا كان هناك لونان متداخلان (عادة CV و VC) أو حالات شاذة أخرى ، وبالتالي يجب استبعادهما. بعد النقر على خيار السكان المتسلسلين ، حدد جميع المعلمات غير المعوضة من قائمة "المعلمات" ، ثم انقر فوق التسلسل.
- قم بتحميل الملف المتسلسل إلى مساحة العمل ، ثم قم بتطبيق مصفوفة التعويض عبر السحب والإفلات.
- قم بإعداد استراتيجية البوابات المحددة في الشكل 2 باستخدام الملف المتسلسل. في البوابة أحادية الخلية ، اعرض الأحداث على مخطط مبعثر باستخدام CFSE و CTV. قم بإنشاء بوابة أولى تسمى Labeled ، بما في ذلك جميع الألوان الأربعة واستبعاد التألق التلقائي المحتمل (الشكل 2C). ثم بوابة كل لون على حدة.
- تحتاج الخلايا المسماة ب CV و VC إلى قيمة محولة ، مع الأخذ في الاعتبار أن اللون هو نتيجة إشارات CFSE و CTV. لذلك يتم تدوير الإشارتين المنسقتين على مقياس لوغاريتمي بمقدار 45 درجة ، للسماح لتخفيف القسمة بالمضي قدما بالتوازي مع المحور السيني. يتم اشتقاق هذه القيمة المحولة يدويا ، بالنقر فوق الأدوات ثم اشتقاق المعلمة. الصق الصيغة التالية في مربع الصيغة :

ملاحظة: تفترض المعادلة26 أن CFSE و CTV هما المعلمتان 03 و 17. - لتصور هذه المعلمة الجديدة المسماة المعلمة المشتقة بشكل صحيح ، قم بتعيين محور خطي يتراوح ~ 3-7 ، والنقر فوق خيار معلمة المحور وتحديد تخصيص المحور.
- قم بتطبيق البوابة على كل لون على حدة كمخطط مدرج تكراري: بالنسبة إلى CF و VI ، قم بتعيين CFSE-A و CTV-A على المحور x ، على التوالي. بالنسبة للسيرة الذاتية و VC ، قم بتعيين المعلمة المشتقة حديثا على المحور x. اضبط البوابات المقابلة لكل قمة ، كما هو موضح في الشكل 3.
- ضع البوابة على كل بئر خلية واحدة فردية. تأكد من إضافة المعلمة المشتقة إلى كل بئر تم تحليله. تحقق يدويا من كل بوابة لون لكل بئر ، لاكتشاف الأحداث التي تم تعيينها بشكل غير صحيح إلى قمة معينة. يتم عرض أمثلة على البوابات في الشكل 4.
- بعد اكتمال التحليل ، والتحقق من جميع الآبار ، حدد جميع بوابات CF / CV / VC / VI التي تحتوي على خلية واحدة على الأقل. قم بتصديرها كملفات .csv ، مع تحديد الخيارات "قيم المقياس" و "المعلمات التعويضية". يتم تصدير هذه الملفات في مجلد باسم "الملفات المصدرة".
- ادمج جميع الملفات في .csv واحد ، باستخدام البرنامج النصي R في الملف التكميلي 1. تذكر أن تضبط المسار الصحيح باستخدام الوظيفة "setwd". إخراج هذا البرنامج النصي عبارة عن جدول بيانات يحتوي على جميع الأحداث المسورة المختلفة والشدة النسبية لجميع المعلمات.
- افتح جدول البيانات وأعد تسمية الأعمدة لكل معلمة ، على سبيل المثال ، باستخدام الأسماء التالية: CFSE و CTV و CD90 و CD123 و CD45RA و CD34 و CD38. سيتم استخدام هذه الأسماء لتحديد عتبة البوابة لتعيين هويتها بشكل صحيح لكل خلية.
- أضف ستة أعمدة باسم "حسنا" و "حالة" و "لون" و "جيل" و "Original_cell" و "Culture_time". هذه المتغيرات هي تلك المحددة تجريبيا ويتم استنتاجها من كل صف:
export_A10 CD34 + PBS_CV_Peak 1.csv.1 = A10 (جيد) ، CD34 + (Original_cell) ، PBS (الحالة) ، السيرة الذاتية (اللون) ، Peak_1 (الجيل). - تصدير الآبار السائبة لتحديد القيم الحدية للبوابة: تصدير السكان المعوضين محل الاهتمام (على سبيل المثال ، CD34 + CD38-) كملفات .csv ، وتحديد الخيارات "قيم المقياس" و "المعلمات التعويضية". تصدير هذه الملفات في مجلد باسم "الملفات المصدرة".
- لإيجاد عتبة CD38 ، حدد أكبر قيمة عددية لهذه المعلمة. على العكس من ذلك ، للعثور على عتبة CD34 ، حدد أصغر قيمة عددية لهذه المعلمة. كرر هذه العملية لجميع المعلمات ذات الاهتمام.
ملاحظة: بالنسبة للتحليل المقدم في البروتوكول ، يتم استخدام العلامة CD45RA لتحديد LMPPs في بوابة CD34 + CD38 و CMP / GMP في بوابة CD34 + CD38 +. هذا يعني أنه يجب استخراج قيمتين حديتين مختلفتين لهذه العلامة. - انسخ قيم العتبة والصقها في ملف Excel يسمى "gating_matrix". تم تنظيم هذا الملف وفقا للجدول 4 ، ويسمح بتحليل تجارب مستقلة متعددة. من المهم جدا تسمية كل عمود بالضبط بهذا المخطط: XXYYMMDD_xxh ، حيث يرمز XX إلى الأحرف الأولى من المشغل ، YY آخر رقمين للسنة ، MM للشهر ، DD لليوم ، و xx للنقطة الزمنية للتحليل.
الجدول 4: مصفوفة البوابة لتعيين مصير الخلية ، قبل التحليل الإحصائي. يشير CD45h إلى شدة CD45RA لبوابات المجموعة الفرعية HPC ، بينما يشير CD45l إلى شدة CD45RA للمجموعات الفرعية CD34 + CD38. الرجاء الضغط هنا لتنزيل هذا الجدول.
7. التحليل الإحصائي
ملاحظة: يتضمن الاختبار الإحصائي للبيانات التي تم إنشاؤها خط أنابيب تحليل مخصص ، تم ترميزه باستخدام لغة البرمجة Python (الملف التكميلي 2 والملف التكميلي 3 والملف التكميلي 4). يتم تنظيم البرنامج النصي في ثلاث كتل: الأولى لمعالجة جدول البيانات ، والكتلة الثانية لإنشاء خريطة التمثيل اللوني لتصور البيانات ، والكتلة الأخيرة لإنشاء رسوم بيانية متعددة لتحليل واختبار خصائص التمايز والقسمة.
- بدءا من الكتلة "0_process_data" (الملف التكميلي 2) ، تأكد من تحديد مسارات جدول بيانات gating_matrix والبيانات بشكل صحيح في البرنامج النصي.
- حدد قاموس "cell_cols" ، لتعيين مصائر الخلايا ذات الصلة لكل خلية. في الحالة المحددة ، فإن المصائر هي HSCs و MPPs و LMPPs والأسلاف النخاعية الشائعة (CMPs) والأسلاف الحبيبية أحادية الخلية (GMPs) وأسلاف الخلايا الحمر الضخمة النواة (MEPs) و CD34-.
- باستخدام قيم العتبة المحددة من الآبار السائبة (الخطوة 6.16) ، حدد الدالة "cell_class_exp_time". من الضروري أن تكون متسقا في تسمية العمود ، لتحديد هذه العتبات بشكل صحيح ، باستخدام نفس الاسم المستخدم لتعريف كل عمود في الخطوة 6.12.
- يتم تعريف الأنماط الظاهرية للخلية في البرنامج النصي باستخدام سلسلة من عبارات "if-else" ، بناء على العتبات المكتشفة أثناء تحليل قياس التدفق الخلوي.
ملاحظة: يمكن عرض أنماط ظاهرية مختلفة عن طريق تعديل هذه العبارات لاستيعاب مجموعات العلامات الأخرى. - حدد الشروط التجريبية المحددة ، باستخدام الوظيفة "cond_rule" (على سبيل المثال ، علاجات تجريبية مختلفة). بالنسبة لمجموعة البيانات المقدمة ، تسمى الشروط "GT" و "Diff". وصف وسطي زراعة الخلايا المختلفين المستخدمين لزراعة الخلايا. سيتم استخدام هذه المعلومات بواسطة الكتلة "1_dot_plot" (الملف التكميلي 3) لرسم خريطة الحرارة.
- في الكتلة "2_bar_plot" (الملف التكميلي 4) ، حدد القاموس "class_dct" ، بما في ذلك مصائر الخلايا المنفصلة ذات الأهمية. بالنسبة لمجموعة البيانات المقدمة ، فإن مصائر الخلايا ذات الأهمية هي نفسها الموصوفة لقاموس "cell_cols".
- حدد "conds" (الشروط) و "or_cells" (الخلية الأصلية) و "sym_labs" (تسميات التماثل) و "الأوقات" (النقطة الزمنية التجريبية). هذه هي تكرار المرشحات اللازمة للتآمر. تأخذ "conds" الشروط المحددة في "cond_rule" مرة أخرى ، و "or_cells" هي HSCs و MPPs ، و "sym_labs" تصف نوع الأقسام.
- في الكتلة "2_bar_plot" ، من الممكن رسم الخلايا التي تقدمت حتى القسم 6.
ملاحظة: تتضمن مجموعة البيانات المتوفرة فقط الخلايا حتى القسم 4 ، لذلك تنبثق رسالة خطأ ، لكن هذا لا يمنع البرنامج النصي من العمل. - يمكن استرداد الأرقام التي تم إنشاؤها بواسطة البرنامج النصي في المجلد المسمى "الأشكال" كملفات pdf. تمثل الملفات المسماة "اختبار" الاختبارات الإحصائية المختلفة التي تم إجراؤها للمدرج التكراري المقابل.
النتائج
فرز FACS
تعتمد استراتيجيات بوابات الفرز المقدمة في هذا البروتوكول على الاستراتيجيات المقبولة على نطاق واسع12،30،31. بالنسبة لاستراتيجية البوابات الموضحة في الشكل 1 ، فإن المادة الأولية هي أسلاف دم الحبل السري التي تم تنقيتها مسبقا عن طريق التخصيب المغناطيسي CD34 + ، وهو ما يفسر النسبة المئوية الضئيلة للخلايا الإيجابية النسبية. من الضروري استخدام بوابات ضيقة لمجموعات الصبغة الأربعة داخل الخلايا (على سبيل المثال ، CTV في الشكل) ، لتحسين دقة القمم أثناء التحليل التالي ولبوابة عدد الخلايا الصحيح (الشكل 1 د). في الحالة المعروضة في الشكل ، تختار البوابات أكبر عدد من السكان وأفضل. إن وجود مجموعات متعددة وقريبة لكل مجموعة صبغة انقسام خلوي ، في تجربتنا ، لا يمثل الاختلافات البيولوجية. بدلا من ذلك ، يمكن أن يشير إلى أ) إجراء تلطيخ غير مثالي ، أو ب) عدم تجانس كبير (خاصة في الحجم) في مجموعة البداية من الخلايا. هذا ليس غير متوقع عند البدء من دم الحبل السري أو مصادر بيولوجية معقدة أخرى (مثل شفط نخاع العظم والدم المحيطي). إذا لم يتم تعريف البوابة بإحكام ، فإن التخفيف التدريجي لمجموعات الصبغة المختلفة يمكن أن يؤدي إلى دمج القمم اللاحقة ، خاصة بالنسبة للظروف CV و VC (الشكل 2D). نتيجة سلبية أخرى للبوابة دون المستوى الأمثل هي عدم القدرة على التمييز بكفاءة بين القمم المختلفة بعد زراعة الخلايا ، حيث يمكن أن يؤدي السكان غير المتجانسين إلى قمم ضحلة.
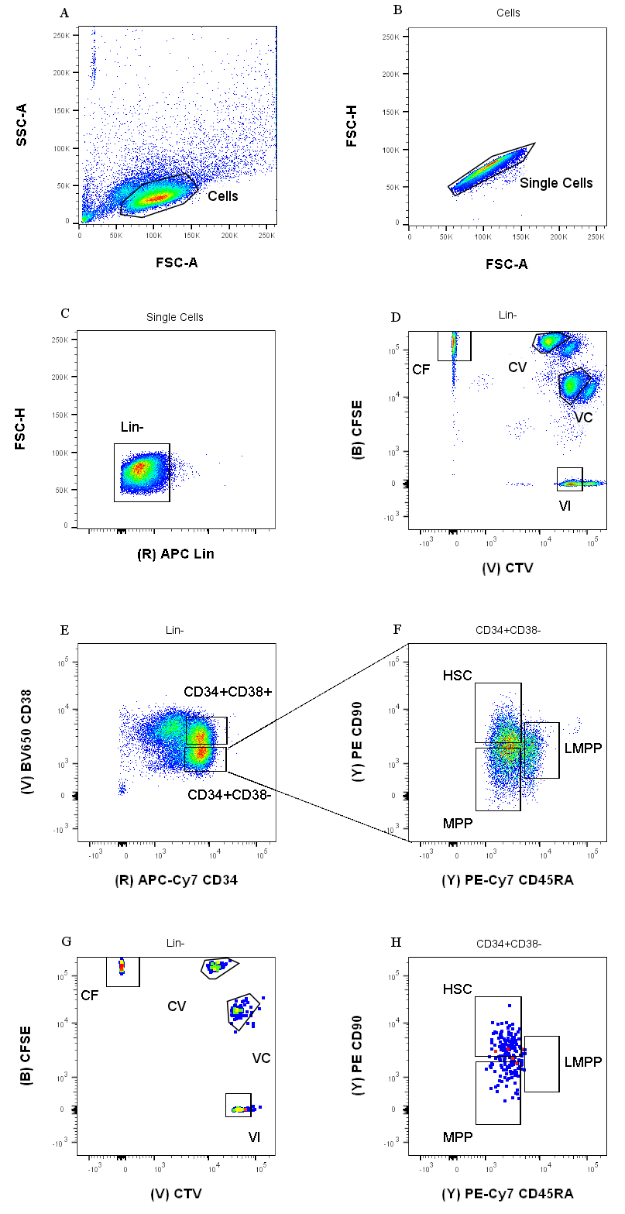
الشكل 1: استراتيجية البوابات لفرز الخلايا. (أ) FSC-A مقابل SSC-A ، لاستبعاد الحطام والخلايا الملوثة. (ب) FSC-A مقابل FSC-H ، لاستبعاد الثنائيات والكتل الخلوية. (C) Lin مقابل FSC-H ، لاستبعاد الخلايا التي هي Lin +. (د) CTV مقابل CFSE ، لتحديد الخلايا الملطخة بمجموعات الصبغة CF و CV و VC و VI. يجب أن تكون البوابات صارمة بما يكفي لتشمل مجموعة متجانسة. (ه) CD34 مقابل CD38 ، لفصل السلف المقيد CD34 + CD38 + (وتسمى أيضا HPCs) عن المقصورة متعددة القدرات CD34 + CD38-. (F) CD45RA مقابل CD90 ، من CD34 + CD38- السكان ، للفصل بين الأسلاف الأكثر نضجا المخصب في HSC (CD90 + CD45RA-) ، و LMPP (CD90midCD45RA+) ، و MPP الأكثر التزاما (CD90-CD45RA-). (ز) الأحداث التي تم فرزها حسب الفهرس ، ممثلة هنا لتلطيخ تركيبة صبغة الخلية و (H) التعبير عن علامات السطح CD90 و CD45RA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحليل التدفق الخلوي بعد زراعة الخلايا
تمثل البيانات الواردة في الشكل 2 HSCs لدم الحبل السري البشري ، والتي يتم الاحتفاظ بها في الثقافة لمدة 72 ساعة ، في وجود العديد من السيتوكينات القادرة على دعم مجموعة من السلف النخاعي والسلائف. تمثل اللوحات من 2A إلى 2D البوابة اللازمة لإثبات قرابة كل خلية من الخلايا الفردية ، بينما تسمح اللوحات 2E إلى 2G بالتنميط الظاهري الخلوي. من المحتمل أن يكون انخفاض وجود أعضاء البرلمان الأوروبي في الشكل نتيجة لظروف الاستزراع المستخدمة لهذه التجربة التمثيلية (الشكل 2F). يؤدي استخدام السيتوكينات المختلفة وظروف المزرعة إلى تغيير النسبة المئوية النسبية لكل مجموعة فرعية ، على غرار اختيار خلايا بدء مختلفة للتجربة.
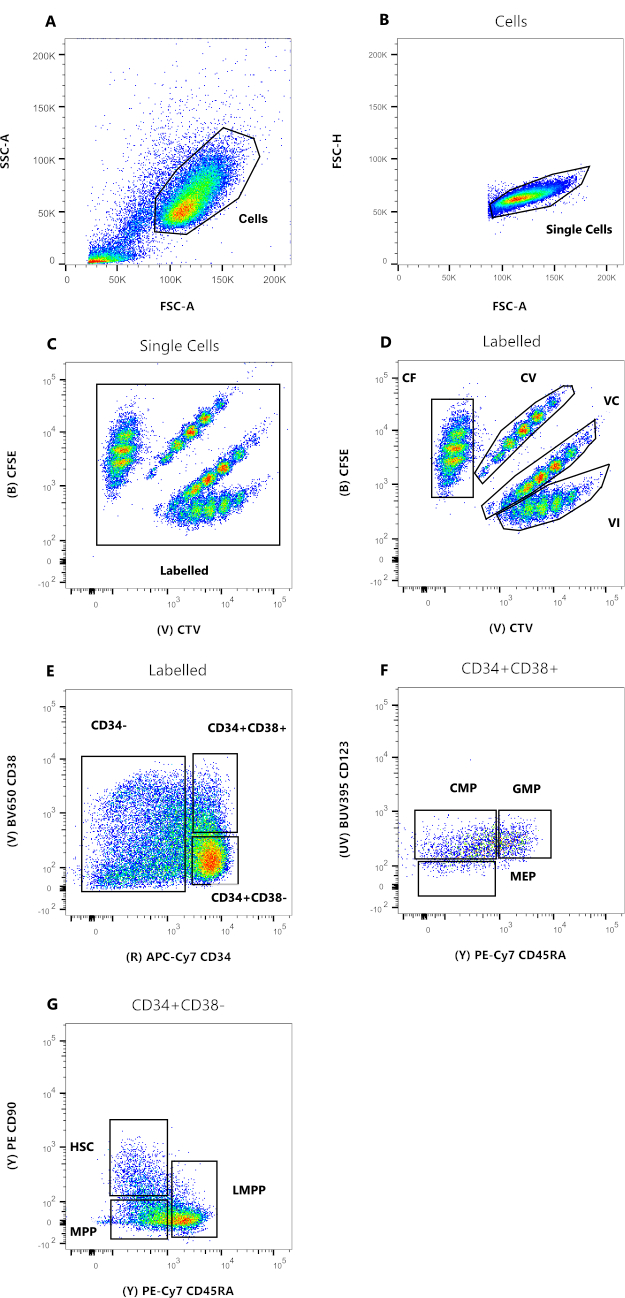
الشكل 2: استراتيجية البوابات لتحليل قياس التدفق الخلوي. (أ) FSC-A مقابل SSC-A ، لاستبعاد الحطام والخلايا الملوثة. (ب) FSC-A مقابل FSC-H ، لاستبعاد الثنائيات والكتل الخلوية. (C) CTV مقابل CFSE ، تسمح البوابة المسماة باستبعاد أي حدث فلورسنت تلقائي يمكن أن يؤثر على دقة البيانات. (د) CTV مقابل CFSE. من المهم للغاية تحديد المجموعات السكانية الأربعة بشكل صارم ، بناء على تخفيفات صبغة انقسام الخلايا. (ه) CD34 مقابل CD38، للتمييز بين السلائف الملتزمة (CD34-)، والأسلاف المقيدة (HPC) (CD34+CD38+)، والأسلاف غير الناضجة (CD34+CD38-). (F) CD45RA مقابل CD123 ، للتمييز بين ثلاثة أنواع من السلف المقيدة: CMP (CD123 + CD45RA-) ، MEP (CD123-CD45RA-) ، و GMP (CD123 + CD45RA+). (ز) CD45RA مقابل CD90 ، من CD34 + CD38- ، لتحديد HSCs و LMPPs و MPPs. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
يعد تعريف الذروة وخطوات التخصيص (الشكل 3 والشكل 4) من الجوانب الحاسمة للبروتوكول ويتطلبان تعريف البوابات الصارمة. بالنسبة لتعريف الذروة (الشكل 3) ، يلزم وجود 1000 حدث على الأقل لتحديد موثوق. بهذا المعنى ، قد يكون من المفيد عزل المزيد من الخلايا أثناء خطوة فرز الخلايا للآبار "السائبة". يصف الشكل 4 أربعة أمثلة لآبار مفردة تحتوي على عائلات متعددة. يوضح هذا الشكل أهمية بوابات الشكل 2D والشكل 3 ، خاصة لتحديد كل عائلة وكل ذروة. يوضح الشكل 4A مثالا مباشرا ، حيث أن جميع الخلايا الموجودة في بوابة CF قريبة جدا من بعضها البعض ويمكن تعيينها بسهولة إلى قمة واحدة. يوضح الشكل 4C مثالا آخر لعائلة موزعة بشكل موحد على قمتين منفصلتين جيدا ، كما هو موضح بوضوح في الرسم البياني للشكل 4D. يكشف الشكل 4E ، G عن أهمية البوابات الصارمة بناء على عدد كبير من الأحداث ؛ كلاهما يعرض بعض الأحداث القريبة ، ولكن خارج بوابات مجموعة الصبغة. يمكن إدراج هذه الأحداث بشكل غير صحيح في بوابتي VI و CF ، استنادا حصريا إلى تحليل البئر الواحدة. أخيرا ، يعرض الشكل 4F ، H مثالين مختلفين للعائلات المنتشرة على قمم متعددة ، مع مثال واحد على قمتين متشابهتين في الشدة (الشكل 4F) وواحد مع ذروتين غير متساويتين في الشدة (الشكل 4H).
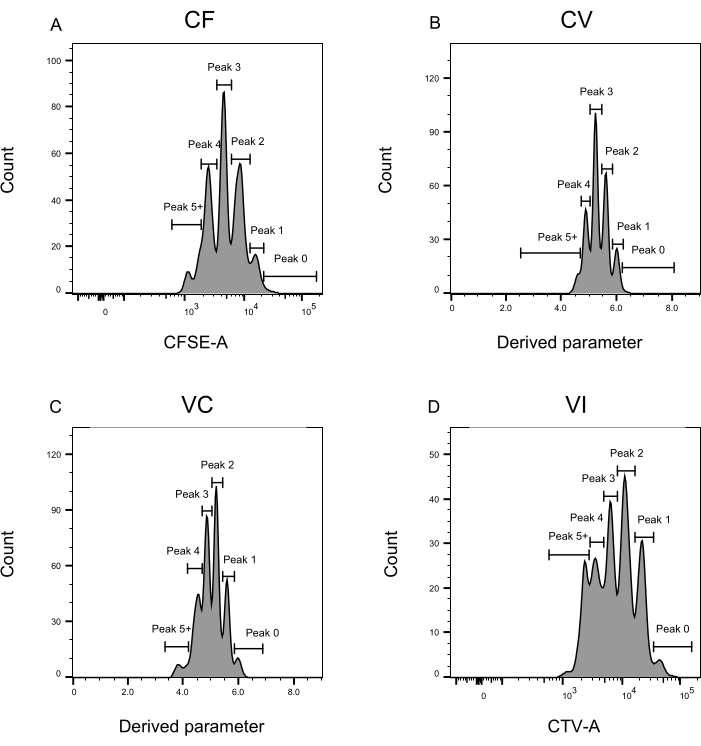
الشكل 3: تعريف الذروة لتحليل قياس التدفق الخلوي. (A-D) يجب تعريف القمم بتسجيل ما لا يقل عن 500 حدث ، لضمان تمثيل جيد لكل قمة فردية. (أ) الرسم البياني لشدة CFSE-A. يمكن تحديد عدة قمم ، كل واحدة تتوافق مع مجموعة مختلفة من الخلايا المنقسمة. (ب، ج) الرسوم البيانية لشدة المعلمة المشتقة ، والتي تمثل خليط CFSE-CTV ، CV (B) و VC (C) ، على التوالي. (د) الرسم البياني لشدة CTV-A. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
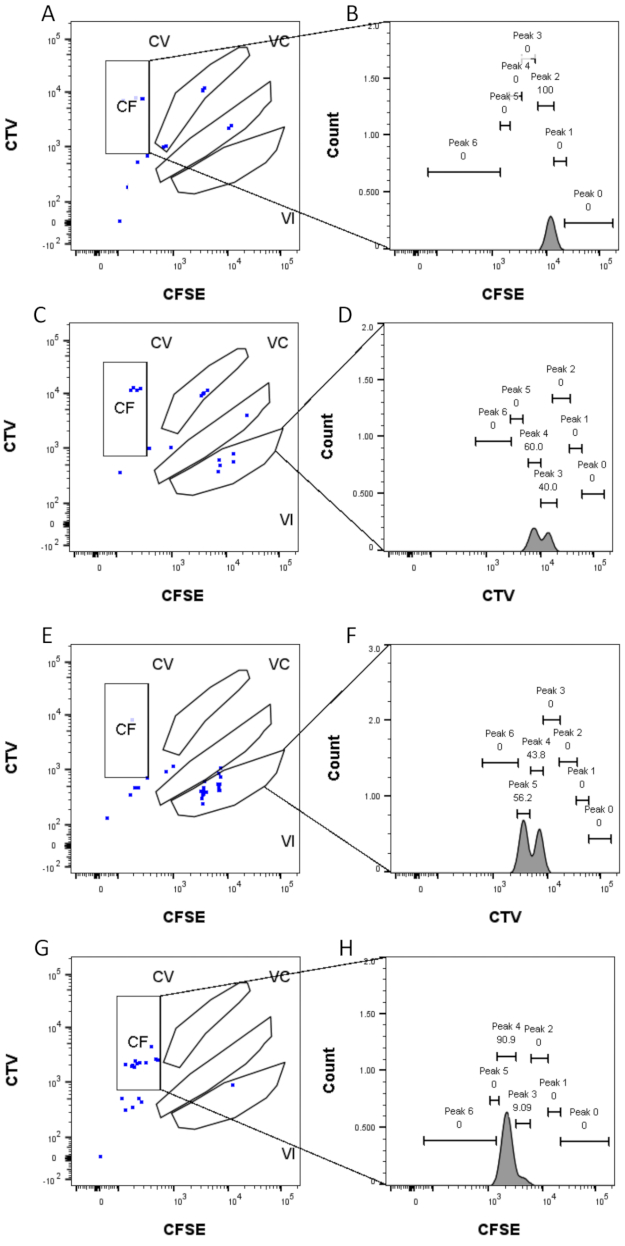
الشكل 4: تعيين الذروة . (أ ، ب) يمكن اكتشاف قمة واحدة فقط لهذا البئر ، في بوابة CF. (ج، د) يمكن اكتشاف قمتين متساويتين تقريبا في هذا البئر ، في البوابة السادسة. تم حل القمم بشكل جيد. (ه، و) يمكن اكتشاف قمتين من شدة مماثلة في هذا البئر ، في البوابة السادسة. تم النظر فقط في الأحداث في البوابة ، بناء على الاستراتيجية الموضوعة باستخدام الآبار السائبة. (ع-ح) يمكن اكتشاف قمتين من الشدة غير المتكافئة في هذا البئر ، في بوابة CF. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تمثيل البيانات والاختبار الإحصائي
يوضح الشكل 5 أنواعا مختلفة من تمثيل البيانات لتجربتين منفصلتين ، تم إجراء كلاهما بعد 72 ساعة من زراعة الخلايا. تم استزراع HSCs و MPPs في وسطين مختلفين لزراعة الخلايا ، من المفترض أن يغيروا انقسام الخلايا وخصائص التمايز. تسمى هذه الوسائط "Diff" (التمايز)32 و "GT"33; الأول يعزز التمايز النخاعي والكريات الحمر ، لأنه يحتوي على الإريثروبويتين (EPO) وعامل تحفيز المستعمرة الحبيبية الأحادية (GM-CSF) ، بينما تم تطوير الثاني في سياق التجارب السريرية للعلاج الجيني ، بهدف الحفاظ على نسبة عالية من HSPCs وتضخيمها. الشكل 5 أ هو خريطة حرارية تمثيلية لحالة "Diff" ، تمثل مجموعة متنوعة من عائلات الخلايا ، سواء في مصائر الخلايا والانقسامات. في خريطة الحرارة هذه ، يمثل كل صف عائلة فردية ، وكل مربع خلية فردية ، وتقوم الأعمدة بتجميع جميع الخلايا الموجودة في نفس الجيل (على سبيل المثال ، الخلايا في الجيل 2 مقسمة مرتين على الأقل). من الممكن التمييز بين العائلات المتجانسة للغاية ، المكونة من نوع خلية واحدة وتعرض نفس العدد من الانقسامات (على سبيل المثال ، العائلة # 63) ، والعائلات غير المتجانسة ، بما في ذلك ثلاثة أنواع من الخلايا على مدى جيلين (على سبيل المثال ، العائلة # 84). نظرا لأن معدل الاسترداد الخلوي لهذا التحليل يبلغ حوالي 70٪ ، نادرا ما يتم ملاحظة العائلات الكاملة ، والتي يتم تعريفها من خلال استعادة جميع خلاياها في أجيال مختلفة (على سبيل المثال ، عائلة من خلية واحدة في الجيل 1 وخليتين في الجيل 2) ، (عرض علامة تصنيف بجوار رقم معرفها في الشكل 5 أ). هناك تفسيرات متعددة تفسر الكشف غير المكتمل ، والذي يمكن أن يكون تقنيا (مشكلة تلطيخ ، فقدان الخلايا بسبب البروتوكول) أو بيولوجيا (موت الخلايا و / أو موت الخلايا المبرمج). يمكن التغلب على القيود التقنية باستخدام محلل مصمم لتقليل الحجم الميت المرتبط بالعينة الفردية ، وعن طريق إجراء تلطيخ الخلية مباشرة في لوحة زراعة الخلايا لتقليل حجم الماصة. على العكس من ذلك ، يمكن أن تساعد الطرق المتعامدة لتحديد مقدار موت الخلايا (على سبيل المثال ، عبر تجارب تصوير الخلايا الحية) في التمييز بين العوامل التقنية والبيولوجية التي تؤدي إلى اكتشاف غير كامل.
يوضح الشكل 5Bi كيفية تصور تأثير حالة المزرعة على تكوين نوع الخلية ، كما لو كان المرء قد أجرى مقايسة بالجملة. هنا ، تعزز حالة Diff عددا أكبر من المصائر ، ونسبة أعلى من خلايا CD34 + (تعرف بأنها جميع أنواع الخلايا باستثناء CD34-). يتم حساب فترات الثقة في البرنامج النصي عبر التمهيد الأساسي ، مع 250,000 مجموعة بيانات تم تشغيلها34. تجدر الإشارة إلى أن جميع الرسوم البيانية الأخرى في الشكل 5 تعرض فترات ثقة محسوبة بنفس الطريقة. يلخص الجدول 5 جميع المعلومات حول عدد العائلات وعدد الخلايا في كل جيل.
يمثل الشكل 5BII بيانيا ناتج الاختبار الإحصائي الذي تم إجراؤه في البرنامج النصي "2_bar_plot". يتوفر وصف رسمي للإطار الإحصائي26. باختصار ، يتيح هذا الإطار اختبار الفرضيات الإحصائية مع افتراض أن الخلايا من نفس العائلة تعتمد (وهو افتراض قابل للاختبار في حد ذاته) ، على عكس الإحصاءات الكلاسيكية التي تتطلب الاستقلال بين جميع الخلايا المرصودة. في الحالة المحددة المعروضة في الشكل ، يتحدى الاختبار الإحصائي الفرضية القائلة بأن خيارات مصير الخلية ل MPPs ، والتي تقاس بترددات أنواع الخلايا المختلفة الموجودة في المزرعة ، مستقلة عن ظروف زراعة الخلايا المستخدمة. أولا ، يتم استخدام إحصائية اختبار G لتقييم التناقض بين ترددات نوع الخلية من وسائط الخلية المختلفة (على سبيل المثال في Bii ، يتم تمثيل هذه الإحصائية بالشريط الأحمر). بعد ذلك ، يتم إجراء التوزيع العشوائي للبيانات عن طريق التقليب ، ومبادلة عائلات كاملة من الخلايا بين حالتي زراعة الخلايا. هذا للحفاظ على الاعتماد بين الخلايا المرتبطة بالأسرة ، مع الحفاظ على عدد العائلات في كل مجموعة متسقا مع البيانات الأصلية. يتم حساب إحصائية اختبار G من مجموعة البيانات العشوائية. القيم الزرقاء الممثلة في 5Bii هي إحصائية اختبار G ل 250,000 تباديل. أخيرا ، يتم حساب قيمة p لتقييم مدى انحراف مجموعة البيانات الأصلية عن توزيع البيانات المتغيرة. في المثال ، تنحرف الإحصائية الأصلية إلى حد كبير عن التوزيع ، مما يؤدي إلى قيمة p صغيرة وبالتالي رفض الفرضية القائلة بأن مصير خلية MPPs مستقل عن ظروف الثقافة.
يمثل الشكل 5C النسبة المئوية لعائلات الخلايا لكل جيل أقصى ، لاستكشاف كيف تغير الظروف المختلفة انقسام الخلايا لكل عائلة خلوية. يوضح مخطط البيانات هذا أنه عند 72 ساعة ، تكمل الخلايا المزروعة في حالة الفرق عددا أكبر من الانقسامات من الخلايا في حالة GT. يتم تمثيل عدد الأجيال القصوى لكل عائلة ، لذلك تعتبر عائلة واحدة تعرض الخلايا في الأجيال 1 و 2 الجيل 2. يمكن استخدام نفس الإطار الإحصائي المستخدم في الشكل 5B لاختبار الاستقلال إحصائيا بين الانقسام الخلوي وحالة الثقافة.
يستكشف الشكل 5D نوع التماثل / عدم التماثل للقسم الأول لأنواع الأسلاف المختلفة (HSCs أو MPPs). بالنسبة لعائلات الخلايا الكاملة في الجيل 1 - الجيل الوحيد الذي يمكن فيه تحديد الخليتين البنيتين بشكل نهائي كخلايا شقيقة - يمكن تعريف أربعة أنواع مختلفة من التماثل / عدم التماثل: تصف التسمية "Sym Undiff" العائلات التي تحتفظ فيها كلتا الابنتين بالنمط الظاهري لخلية المنشأ. "Sym Diff" تعني أن كلتا الابنتين لهما نفس النمط الظاهري ، وهو يختلف عن خلية المنشأ. "Asym Undiff" تعني أن ابنة واحدة تحتفظ فقط بالنمط الظاهري لخلية المنشأ. أخيرا ، يصف "Asym Diff" العائلات التي يكون فيها لكلتا الابنتين أنماط ظاهرية مختلفة ، ولا يوجد أي منهما مثل خلية المنشأ. لاكتساب قوة إحصائية في تقييم هذه المصائر المتماثلة / غير المتماثلة ، من المستحسن إجراء تحليل MultiGen في نقاط زمنية مبكرة ، من أجل مراقبة المزيد من العائلات التي تم العثور على ذريتها في الجيل 1.
أخيرا ، يمثل الشكل 5E النسب المئوية لأنواع الخلايا كدالة لعدد الأقسام ، لاكتساب رؤى حول تقدم نمط التمايز عبر الأقسام. على سبيل المثال ، تشير البيانات المعروضة في الشكل إلى أن الخلايا تتقدم إلى حالة CD34 ، مع أكثر من 50٪ من الخلايا المكتشفة في هذه الفئة بعد ثلاثة أقسام فقط. علاوة على ذلك ، من الممكن أن نستنتج أن MPPs لا تفضل تقسيم التجديد الذاتي ، حيث تحتفظ نسبة صغيرة من الخلايا بالنمط الظاهري الأصلي. ويمكن بعد ذلك اختبار بعض هذه الاستنتاجات باستخدام الإطار الإحصائي الوارد في الأرقام السابقة.
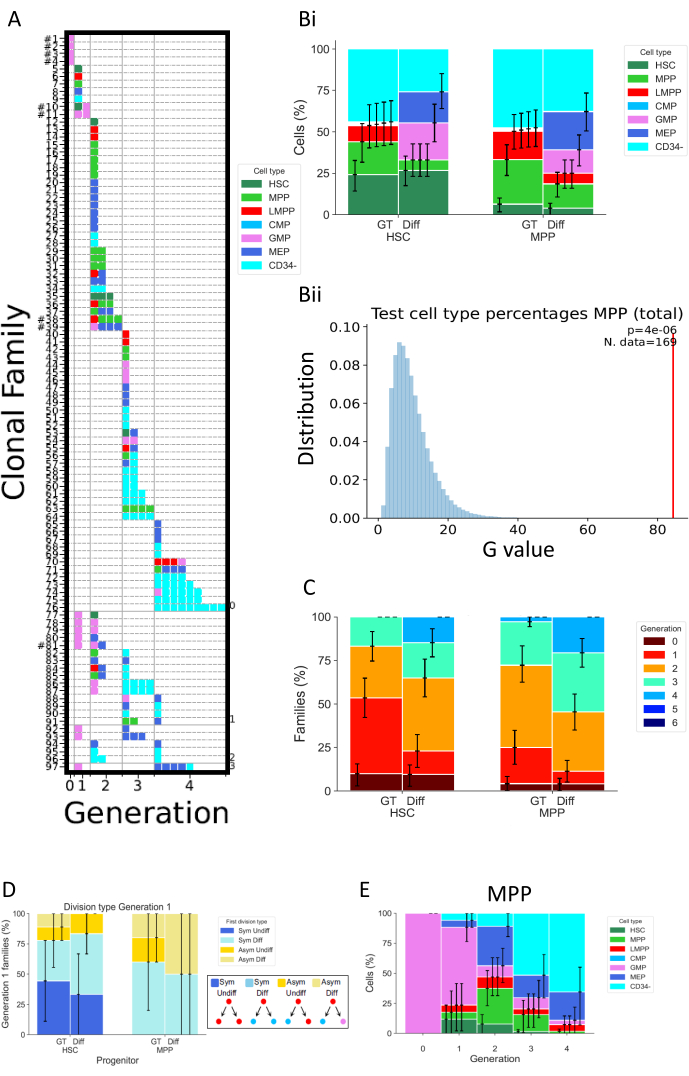
الشكل 5: مثال على تمثيل البيانات لتجربة واحدة مدتها 72 ساعة باستخدام HSPCs دم الحبل السري. (أ) خرائط حرارية لمجموعة بيانات مختارة (HSC ، في وسط "فرق" ، بعد 72 ساعة من الثقافة). تمثل المؤامرات جميع الخلايا الفردية (المربعات) وفقا لقرابتها (الصفوف) ، وعدد الأقسام التي تم إجراؤها (أعمدة ، تسمى الجيل) ، والنمط الظاهري (الألوان). (ثنائي) الرسم البياني يقارن نسب أنواع الخلايا من ذرية الخلايا من HSCs و MPPs ، بين الشرط GT والحالة Diff. (Bii) يمثل الرسم البياني الاختبارات الإحصائية التي أجريت في البرنامج النصي "2_bar_plot" ل MPPs عند 72 ساعة من الثقافة ، مقارنة بين كوكتيلات السيتوكين "Diff" و "GT". يتم عرض القيمة التجريبية باللون الأحمر ، والقيم التي تم إنشاؤها عبر 250000 تباديل باللون الأزرق. يشار إلى قيمة p. لاختبار G في الزاوية اليمنى العليا مع عدد العائلات المستخدمة للاختبار . (ج) الرسم البياني الذي يقارن النسبة المئوية للأسر (314 أسرة في المجموع) في كل جيل (مرمز بالألوان) ، ل HSCs و MPPs لكل حالة ثقافة. يتم حساب فترات الثقة باستخدام 250,000 مجموعة بيانات تم تشغيلها. (د) الرسم البياني الذي يمثل نوع التماثل / عدم التماثل بين مصير الخلايا الوليدة للعائلات التي تحتوي على خليتين في الجيل 1: Sym Undiff (تحتفظ كلتا الابنتين بالنمط الظاهري لخلية المنشأ) ، Sym Diff (كلتا الابنتين لهما نفس النمط الظاهري ، وهو يختلف عن خلية المنشأ) ، Asym Undiff (تحتفظ ابنة واحدة فقط بالنمط الظاهري لخلية المنشأ) ، و Asym Diff (كلتا الابنتين لهما أنماط ظاهرية مختلفة ولا يشبه أي منهما خلية المنشأ). (ه) الرسوم البيانية لمساهمة أنواع الخلايا المصنفة حسب الجيل ل MPPs المستزرعة بكوكتيل "Diff" ؛ ن = 204 خلية و 97 عائلة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 5: وصف عدد العائلات والخلايا التي تم تحليلها لكل حالة تجريبية (خلية المنشأ ووسط زراعة الخلية). الرجاء الضغط هنا لتنزيل هذا الجدول.
الملف التكميلي 1: الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 2: الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 3: الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 4: الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
مقايسة MultiGen هي مقايسة عالية الإنتاجية وسهلة الأداء وغير مكلفة ، وقد كان لها دور فعال في دراسة الخلايا الليمفاوية23،24،35 وخلايا المكونة للدم في الفئران26،27. هنا ، نقدم تطورا جديدا للنهج الذي يسمح بفك تشفير المرحلة المبكرة من التزام HSPC البشري خارج الجسم الحي ، على مستوى الخلية الواحدة باستخدام ثقافة قصيرة المدى (الشكل 6). عادة ما تستخدم أنظمة الاستزراع خارج الجسم الحي أحادية الخلية لتقييم مصير HSPCs على المدى الطويل في الخلايا الناضجة ، ولكن بعض المصائر تحدث في وقت أبكر من غيرها36 ، مما قد يؤدي إلى تحيز التحليل نحو مصائر أقل. بالإضافة إلى ذلك ، عادة ما تفتقد أنظمة الثقافة هذه معلومات حول الانقسامات أثناء الالتزام بالمصير. لقد ثبت أن خطوات الالتزام الأولى تحدث في وقت مبكر من بداية الثقافة ، وأحيانا بدون تقسيم26،37 ، مما يجعل الثقافة قصيرة المدى وتتبع التقسيم ضروريا لدراسة الالتزام المبكر بالمصير. من خلال اتباع المصير والانقسام والقرابة في وقت واحد ، يسمح هذا الفحص بفهم دور التقسيم الأول وقرار المصير في HSPCs البشرية. باستخدام الفحص ، من الممكن استنتاج عدد الانقسامات التي تحدث فيها عملية الالتزام ، والتوازن بين التجديد الذاتي والتمايز لأولئك الأسلاف الأوائل ، وكيف يتم توريث هذه الخصائص عبر الأجيال. على حد علمنا ، هذا هو الفحص الوحيد الذي يسمح بهذه الأنواع من القياسات ل HSPCs البشرية ، بدقة خلية واحدة. بالإضافة إلى ذلك ، باستخدام مجموعات مختلفة من أصباغ انقسام الخلايا ، قمنا بزيادة إنتاجية التحليل ، مما يجعل هذا الفحص أداة قيمة لإنشاء مجموعات بيانات كبيرة بسرعة. تسمح مجموعات الصبغة بمتابعة العديد من العائلات في نفس الآبار ، مما يزيد من عدد الخلايا المتاحة للتحليل في الثقافة قصيرة الأجل. يمكن زيادة عدد التركيبات بشكل أكبر ، عن طريق إضافة أصباغ أخرى (على سبيل المثال ، صبغة صفراء) أو تعديل نسبة CFSE و CTV. ومع ذلك ، فإن هذا يقلل من عدد المعلمات الأخرى التي يمكن تحليلها.
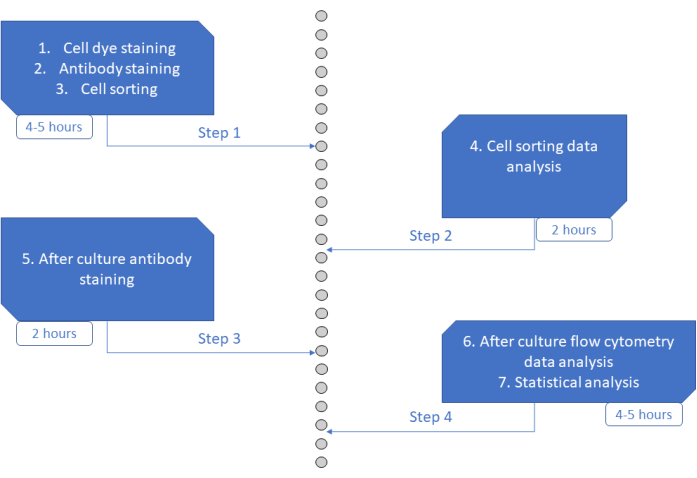
الشكل 6: تمثيل تخطيطي للبروتوكول. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
لإجراء التحليل بنجاح ، نظرا للعدد الكبير من الآبار وانخفاض عدد الخلايا المراد تحليلها ، من الضروري إجراء تحليل قياس التدفق الخلوي على محلل مزود بقارئ ألواح. يتم تكييف الجيل الجديد من أجهزة تحليل مقاعد البدلاء بشكل خاص مع هذا الفحص ، حيث أن معظمها يحتوي على حجم ميت أصغر لتقليل النسبة المئوية لفقدان الخلايا. وهذا بدوره يضمن كفاءة أعلى في استعادة كل بئر بالكامل ، مما يؤدي إلى كفاءة تقدر في نطاق 70٪26. يعد تقدير فقدان الخلية أثناء اكتساب قياس التدفق الخلوي أمرا بالغ الأهمية لتحليل كل عائلة على حدة. على سبيل المثال ، بافتراض عدم موت الخلايا وحساب عدد الأقسام ، من الممكن تقدير عدد الخلايا لكل عائلة. ومع ذلك ، من المستحسن إجراء بعض التجارب التأكيدية ، لا سيما في تقدير موت الخلايا في ظروف المزرعة المختبرة وقياس معدل الاسترداد تجريبيا باستخدام عدد محدد من الخلايا.
واحدة من الخطوات الحاسمة لهذا البروتوكول هي تعيين الذروة. كما ذكرنا سابقا ، يعتمد توزيع الذروة الجيد بشدة على عزل القمم الضيقة جدا عند فرز الخلايا. ومع ذلك ، لا يزال من الصعب تعيين العدد الصحيح من الأقسام بناء على التوزيع بشكل فريد. نظرا لإجراء فرز الخلايا وتحليل قياس التدفق الخلوي على جهازين مختلفين ، لا يمكن مقارنة شدة كل إشارة مباشرة ، لذلك قد يكون من الصعب معرفة ما إذا كانت القمة الأولى التي لوحظت في الطرف الأيمن من الرسم البياني هي الذروة 0 أو الذروة 1. في هذا الصدد ، هناك القليل من الحلول الممكنة. تتمثل إحدى الطرق في إجراء تجربة متعامدة لقياس عدد الانقسامات التي تقوم بها هذه الخلايا بدقة (على سبيل المثال ، تصوير الخلايا الحية). الاحتمال الآخر هو ببساطة حساب عدد الخلايا في البئر تحت مجهر برايت فيلد المقلوب ، قبل إجراء تحليل قياس التدفق الخلوي. سيؤدي هذا إلى استنتاج متوسط عدد الانقسامات (بافتراض عدم موت الخلايا). أخيرا ، يتمثل الحل اللاحق لمهمة الذروة في اكتشاف عدد غير عادي من "العائلات المستحيلة" ؛ تتكون هذه العائلات من عدد أكبر من الممكن من الخلايا لكل جيل (على سبيل المثال ، خمس خلايا في الجيل 2 ، أو خليتين في الجيل 1 وخلية واحدة في الجيل 2). يتم ترميز إمكانية استبعاد العائلات المستحيلة في خطوة التحليل الإحصائي ، وتضع علامة على العائلة المستحيلة. إذا كان حدوث هذه الأخطاء مرتفعا جدا ، فمن المعقول افتراض أن تعيين الذروة يحتاج إلى مراجعة.
في هذا البروتوكول ، قمنا بتضمين بعض الأمثلة على تمثيل البيانات وتحليلها للفحص ، حيث أصبح هذا خطوة أساسية في توليد وتفسير مجموعات البيانات الكبيرة38. المثال الأول هو خريطة التمثيل اللوني التي توضح إجمالي جميع الخلايا التي تم تحليلها ، منظمة لكل عائلة. هذه أداة فعالة لاستكشاف الخصائص العامة للبيانات والاستنتاجات المحتملة: هل تتكون العائلات من أنواع متعددة من الخلايا أم أنها تميل إلى أن تكون متجانسة في التكوين؟ هل تنتشر العائلات على مدى أجيال متعددة ، أم أنها في الغالب تنقسم إلى نفس العدد من المرات؟ ويحتاج هذا التحليل الاستكشافي بعد ذلك إلى استكماله بمخططات واختبارات إحصائية أكثر تحديدا. يمكن استخدامه لتقييم الالتزام بالمصير المتماثل وغير المتماثل كميا ، والتمايز بدون تقسيم ، والتوازن بين التجديد الذاتي والتمايز ، وعدد الانقسامات لمصير التزام معين. من الأساسي ، أثناء التخطيط التجريبي ، ضبط طول مزرعة الخلية وفقا لنوع السؤال المطروح ؛ على سبيل المثال ، بالنسبة للسؤالين الأولين (التوازن المتماثل / غير المتماثل والتمايز بدون تقسيم) ، يسمح التخطيط لخطوات الثقافات القصيرة جدا بعزل عدد كبير من العائلات التي قامت بتقسيم واحد فقط أو لم تقم بأي تقسيم على الإطلاق26. على العكس من ذلك ، تسمح التجارب الأطول باستكشاف عدد الانقسامات المطلوبة لالتزام خلية معينة ، حيث إنها تأخذ عينات من العائلات في مراحل مختلفة من التمايز. ومع ذلك ، لم يتم تصميم هذه الطريقة للثقافات طويلة الأجل (2-3 أسابيع) ، حيث أن تخفيف صبغة الخلية غير قادر على تتبع أكثر من سبعة أو ثمانية أقسام بدقة22. نتيجة لذلك ، يتم تكييف هذه الأداة في الغالب لدراسة الالتزام المبكر للأسلاف المكونة للدم ، وهي ليست مصممة لتقديم استنتاجات قوية حول خصائص التمايز طويلة المدى لهذه الخلايا.
تم تطوير الإطار الإحصائي خصيصا لتحليل هذا النوع من البيانات واستنادا إلى مفهوم التباديل26. كان هذا ضروريا بسبب ملاحظة الاعتماد العائلي على توزيع نوع الخلية وعلى عدد الانقسامات التي تم إجراؤها. بعبارة أخرى، من المرجح أيضا أن تعرض الخلايا التي تنتمي إلى العائلة نفسها أنماطا ظاهرية متشابهة وتقسم العدد نفسه من المرات. في حين أن التحليل المتعمق خارج نطاق هذا العمل ، يجب أن تكون مجموعة الاختبارات الإحصائية المقدمة كافية عند تقييم الظروف المختلفة.
في الختام ، يشكل هذا البروتوكول أداة قيمة لتقييم الديناميات الخلوية للخلايا الجذعية والسلفية المكونة للدم خارج الجسم الحي ، بطريقة سريعة وغير مكلفة. نظرا لمرونته وتعدد استخداماته فيما يتعلق بالنقطة الزمنية وظروف الثقافة ونوع HSPCs التي تم تحليلها ، فإنه يسمح باختبار مجموعة متنوعة من الظروف التجريبية. كاختبار قائم على قياس التدفق الخلوي ، يمكن تنفيذه في معظم المختبرات ، ولا يتطلب معرفة مسبقة واسعة النطاق ، مما يجعله مرشحا جيدا للفحوصات والتجارب التجريبية.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح ذات صلة بهذا العمل. لم يكن للممولين أي دور في تصميم الدراسة أو جمع البيانات وتفسيرها أو قرار تقديم العمل للنشر.
Acknowledgements
نود أن نشكر أعضاء مرفق تدفق كوري التابع لمعهد كوري على مساعدتهم في إعداد تجارب قياس التدفق الخلوي. ونود أيضا أن نعرب عن تقديرنا لمساهمات الأعضاء الآخرين في فريق بيرييه، خلال مناقشات متعددة. نشكر الدكتورة جوليا مارشينغو والبروفيسور هودجكين (معهد والتر إند إليزا هول للبحوث الطبية) على مشاركة بروتوكولهما الخاص بتعدد إرسال أصباغ انقسام الخلايا على الخلايا الليمفاوية. نشكر البنك الحيوي لدم الحبل السري في مستشفى سانت لويس على توفير الموارد البيولوجية اللازمة لتطوير هذا البروتوكول. تم دعم الدراسة بمنحة ATIP-Avenir من CNRS ومؤسسة Bettencourt-Schueller (إلى L.P.) ، ومنح من Labex CelTisPhyBio (ANR-10-LBX-0038) (إلى L.P. و A.D.) ، وبرنامج Idex Paris-Science-Lettres (ANR-10-IDEX-0001-02 PSL) (إلى L.P.) ، وظهور Canceropole INCA (2021-1-EMERG-54b-ICR-1 ، إلى L.P.) ، ومنحة ITMO MIIC (21CM044 ، إلى L.P.). بالإضافة إلى التمويل من مجلس البحوث الأوروبي (ERC) في إطار برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي ERC StG 758170-Microbar (إلى LP) ، تم دعم AD بزمالة من Fondation de France.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
References
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084 (2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041 (2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381 (2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287 (2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540 (2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. . Testing statistical hypotheses. , 784 (2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624 (2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Davison, A. C., Hinkley, D. V. . Bootstrap Methods and their Application. , (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116 (2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898 (2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved