Method Article
Одновременная оценка родства, номера деления и фенотипа с помощью проточной цитометрии гемопоэтических стволовых клеток и клеток-предшественников
В этой статье
Резюме
Здесь представлена методика, основанная на проточной цитометрии, которая позволяет одновременно измерять количество клеточных делений, фенотип поверхностных клеток и клеточное родство. Эти свойства могут быть проверены статистически с использованием структуры на основе перестановок.
Аннотация
Немногие методы могут оценить фенотип и судьбу одной и той же клетки одновременно. Большинство современных протоколов, используемых для характеристики фенотипа, хотя и способны генерировать большие наборы данных, требуют уничтожения интересующей клетки, что делает невозможным оценку ее функциональной судьбы. Поэтому гетерогенные биологические дифференцирующие системы, такие как кроветворение, трудно описать. Основываясь на красителях, отслеживающих деление клеток, мы разработали протокол для одновременного определения родства, номера деления и статуса дифференцировки для многих отдельных гемопоэтических предшественников. Этот протокол позволяет оценить потенциал дифференцировки ex vivo мышиных и человеческих гемопоэтических предшественников, выделенных из различных биологических источников. Более того, поскольку он основан на проточной цитометрии и ограниченном количестве реагентов, он может быстро генерировать большой объем данных на уровне одной клетки относительно недорогим способом. Мы также предоставляем аналитический конвейер для анализа отдельных клеток в сочетании с надежной статистической основой. Поскольку этот протокол позволяет связывать деление и дифференцировку клеток на уровне отдельных клеток, он может быть использован для количественной оценки симметричной и асимметричной судьбы, баланса между самообновлением и дифференцировкой, а также количества делений для данной судьбы обязательств. В целом, этот протокол может быть использован в экспериментальных проектах, направленных на разгадку биологических различий между гемопоэтическими предшественниками с точки зрения отдельных клеток.
Введение
Прошедшее десятилетие ознаменовалось всемирным распространением одноклеточных подходов к клеточной и молекулярной биологии. Следуя по стопам одноклеточной геномики1,2, в настоящее время можно изучать многие компоненты одной клетки (например, ДНК, РНК, белки), с каждым годом появляются новые методы одноклеточной омиксы. Эти методы пролили свет на старые и новые вопросы в области иммунологии, нейробиологии, онкологии и других, как с использованием клеток человека, так и клеток модельного организма3. Подчеркивая различия между отдельными клетками, одноклеточная омика подтолкнула к определению новой модели кроветворения, сосредоточенной на гетерогенности гемопоэтических стволовых и прогениторных клеток (HSPC) и отходящей от классической модели дискретных гомогенных популяций 4,5.
Одним из немногих недостатков всех методов -омикса является разрушение интересующей ячейки, исключающее возможность оценить ее функциональность. И наоборот, другие одноклеточные методы, такие как анализ одноклеточной трансплантации и технологии отслеживания происхождения, обеспечивают считывание функциональности клетки-предка путем оценки судьбы отдельных клеток in vivo 6,7. Технологии отслеживания происхождения включают маркировку интересующей клетки наследуемой генетическойметкой 7 или флуоресцентной меткой8,9, что позволяет одновременно отслеживать судьбу нескольких отдельных клеток. Однако характеристика исходных клеток, как правило, ограничена ограниченным числом параметров, таких как экспрессия нескольких поверхностных белков, оцениваемых с помощью проточной цитометрии10. Кроме того, технологии отслеживания одноклеточных линий требуют трудоемкого обнаружения клеточной метки, как правило, с помощью секвенирования ДНК/РНК или визуализации. Этот последний пункт, в частности, ограничивает количество условий, которые могут быть проверены в одном эксперименте.
Другим классом методов, которые используются для изучения функциональности отдельных клеток, являются системы культивирования клеток ex vivo одиночных HSPC. Простые в выполнении, эти анализы золотого стандарта включают сортировку отдельных клеток в 96-луночные сосуды для культивирования клеток, а затем культивирование, характеризующее фенотип клеточного потомства, как правило, с помощью проточной цитометрии или морфологического анализа. Эти анализы в основном использовались для характеристики долгосрочной дифференцировки HSPC в зрелые клетки, обычно после 2-3 недель культивирования11,12. В качестве альтернативы они были использованы для поддержания и расширения ex vivo HSPCs 13,14,15,16,17,18 с обещанием медицинской пользы для трансплантации стволовых клеток человека 19. Наконец, они были использованы для изучения ранней приверженности HSPC с использованием краткосрочного культивирования20, при этом низкое количество клеток, генерируемых в этой культуре, является основным ограничивающим фактором. Одним из недостатков этих различных видов анализов ex vivo является то, что они лишь частично отражают сложность in vivo; тем не менее, они являются одним из редких способов изучения дифференциации HSPC человека.
Одной из недостающих частей информации из существующих одноклеточных методов (одноклеточная омика, отслеживание происхождения и культура ex vivo) является точное обнаружение клеточных делений, важный параметр, который следует учитывать при изучении динамики HSPC21. Простым способом оценки количества делений с помощью проточной цитометрии является использование растворимых «белковых красителей», таких как сукцинимидиловый эфир диацетата 5- (и 6) карбоксифлуоресцеина (CFSE)22. Эти красители деления диффундируют внутрь цитоплазмы окрашенных клеток, разбавляются наполовину и передаются двум дочерним клеткам при каждом делении клетки, что позволяет перечислить до 10 делений. Комбинируя несколько красителей деления, можно посеять несколько отдельных предшественников в одну лунку, так как каждый отдельный краситель позволяет разделить разных потомков. Это принцип, лежащий в основе использования клеточных красителей для мультиплексного клонального отслеживания и отслеживания деления, который был впервые введен для мышиных лимфоцитов23,24.
Здесь мы представляем разработку анализа MultiGen для использования с мышами и людьми HSPC. Это позволяет одновременно тестировать множество отдельных клеток на их свойства дифференцировки, деления и родства ex vivo. Этот высокопроизводительный, простой в выполнении и недорогой анализ позволяет одновременно измерять клеточный фенотип, количество выполненных делений, а также клеточное родство и клональные отношения с другими клетками в яме. Он может быть использован для количественной оценки симметричной и асимметричной судьбы приверженности, баланса между самообновлением и дифференциацией, а также количества делений, необходимых для данной судьбы обязательства. Для протокола требуется сортировщик клеток, активируемый флуоресценцией (FACS), и проточный цитометр со считывателем планшетов, а также оборудование, необходимое для проведения культивирования клеток. В дополнение к техническому протоколу для проведения анализа на HSPC человека, мы также предоставляем подробную структуру анализа, включая статистическое тестирование, необходимое для оценки клеточных свойств, связанных с концепцией клеточного семейства25. Этот протокол уже был успешно использован для описания мышиного компартмента HSPC26,27.
В следующем протоколе в качестве исходного материала28 используются магнитно обогащенные CD34+ клетки. Таким образом, можно эффективно окрашивать и изолировать HSPC человека из различных источников крови (например, пуповинной крови, костного мозга, периферической крови). Важно не отбрасывать фракцию CD34-, так как она будет использоваться как часть протокола для установки различных типов экспериментального контроля. Упомянутые количества и объемы ячеек могут быть увеличены или уменьшены в зависимости от экспериментального рабочего процесса и потребностей. Аналогичным образом, протокол может быть адаптирован для изучения различных типов предшественников, просто модифицируя антитела, используемые для этапов сортировки клеток и проточной цитометрии.
протокол
Для следующего протокола в качестве источника HSPC использовалась обезличенная пуповинная кровь, собранная в соответствии с руководящими принципами, определенными биобанком пуповинной крови больницы Сен-Луи (разрешение AC-2016-2759) и Хельсинкской декларацией.
ПРИМЕЧАНИЕ: Перед началом работы убедитесь, что все реагенты и оборудование, необходимые для этого протокола, доступны, как указано в таблице материалов и упомянуто в протоколе. Приготовьте соответствующие реагенты в свежем виде и не храните их, если это прямо не указано.
1. Окрашивание клеточным красителем
ПРИМЕЧАНИЕ: В этом разделе описывается окрашивание четырьмя комбинациями красителей клеточного деления CFSE и фиолетового красителя (CTV). Обрабатывайте все пробирки одновременно, даже если не добавлен раствор клеточного красителя. Все этапы выполняются в стерильных условиях, чтобы обеспечить следующий этап культивирования клеток. Необходимое время: около 100 мин.
- Обработайте единицу пуповинной крови в соответствии с протоколоммагнитной сортировки 29. Убедитесь, что доступны две фракции: большая фракция CD34- и меньшая фракция CD34+ . Вращайте обе трубки в течение 5 мин при 300 х г. Аспирируйте надосадочную жидкость, не нарушая гранулы.
- Для фракции CD34+ ресуспендируйте ее в 1 мл модифицированной среды Eagle (DMEM) Dulbecco без эмбриональной бычьей сыворотки (FBS). Подсчитайте клетки с помощью гемоцитометра; плотность клеток не должна быть выше 3 х 10,6 клеток/мл. Если это так, соответствующим образом отрегулируйте громкость. Для фракции CD34 ресуспендируйте в DMEM без FBS и отрегулируйте объем максимум до 6 x 106 клеток / мл.
- Аликвот 250 мкл фракции CD34+ в четыре полипропиленовые пробирки по 15 мл. Маркируйте трубки следующим образом: CD34+/CF (CFSE_only), CD34+/CV (CFSE_high CTV_low), CD34+/VC (CFSE_low CTV_high) и CD34+/VI (CTV_high). Аликвотируйте 250 мкл фракции CD34- в еще четыре полипропиленовые пробирки по 15 мл. Маркируйте пробирки следующим образом: CD34-/CF (CFSE_only), CD34-/CV (CFSE_high CTV_low), CD34-/VC (CFSE_low CTV_high) и CD34-/VI (CTV_high). Оставшиеся клетки из фракции CD34- можно выбросить.
- Приготовьте два раствора CFSE, названные CFSE_high и CFSE_low. Для CFSE_high (10 мкМ) смешайте 1,1 мл DMEM без FBS с 2,2 мкл исходного раствора CFSE (5 мМ). Для CFSE_low (5 мкМ) смешайте 550 мкл DMEM без FBS и 0,55 мкл исходного раствора CFSE (5 мМ).
- Добавьте 250 мкл раствора CFSE_high в трубки CF и CV, 250 мкл раствора CFSE_low в пробирки VC и 250 мкл DMEM без FBS в пробирку VI. Чтобы обеспечить эффективное сочетание клеточной суспензии и клеточного красителя, наклоните пробирку почти на 90 градусов и нанесите растворы CFSE на стенку пробирки. Затем держите пробирку вертикально, чтобы смешать два раствора, и проведите пипеткой три или четыре раза, чтобы обеспечить быстрое смешивание растворов CFSE с ресуспендированными клетками. Инкубировать при 37 °C ровно 8 минут.
- После инкубации добавьте 5 мл DMEM + 10% FBS. Держите пробирки при температуре 37 °C в течение 5 минут.
- Отжим тюбиков в течение 5 мин при 300 х г. Удалите надосадочную жидкость с помощью аспирации, не нарушая гранулы, и промойте гранулы 5 мл фосфатного буферного физиологического раствора 1x / этилендиаминтетрауксусной кислоты (PBS 1x / EDTA). Отжим еще раз на 5 мин при 300 г. Выбросьте надосадочную жидкость, не нарушая гранулу, и ресуспендируйте клеточную гранулу в 250 мкл 1x PBS / EDTA.
- Подготовьте два решения CTV с именами CTV_high и CTV_low. Для CTV_high (10 мкМ) смешайте 1,1 мл PBS 1x/EDTA и 2,2 мкл сырья CTV (5 мМ). Для CTV_low (5 мкМ) смешайте 550 мкл PBS 1x/EDTA с 0,55 мкл сырья CTV (5 мМ).
- Добавьте 250 мкл раствора CTV_high в пробирки VC и VI, 250 мкл раствора CTV_low в трубку CV и 250 мкл 1x PBS / EDTA в пробирку CF. Используйте тот же метод, который описан в шаге 1.5. Инкубировать при 37 °C ровно 8 минут.
- После инкубации добавьте 5 мл DMEM + 10% FBS. Хранить при температуре 37 °C в течение 5 минут.
- Вращайте пробирки в течение 5 минут при 300 x g, выбросьте надосадочную жидкость, не нарушая гранулы, а затем промойте гранулы 5 мл 1x PBS / EDTA. Отжим еще раз на 5 мин при 300 г.
- Выбросьте надосадочную жидкость, не нарушая гранулу, и ресуспендируйте фракции CD34 в 1x PBS / EDTA для конечной концентрации 1,5 x 106 клеток / мл. Ресуспендируют фракции CD34+ в 40 мкл окрашивающего буфера и переносят клетки в пробирки объемом 1,5 мл.
2. Окрашивание антителами
ПРИМЕЧАНИЕ: Окрашивание антител может быть настроено в соответствии с экспериментальными потребностями. Окрашиванию антителами подвергаются только фракции CD34+ ; фракции CD34- используются в качестве единого контроля окрашивания для комбинаций красителей клеточного деления (фракции CV, VC, CF и VI). Следующая панель предназначена для выявления четырех типов HSPC: гемопоэтических стволовых клеток (ГСК), мультипотентных предшественников (MPP), лимфоид-праймированных мультипотентных предшественников (LMPP) и гемопоэтических клеток-предшественников (HPC)12. Тем не менее, представлена идентификация ГСК и МЧП. Необходимое время: 75 мин.
- Подготовьте одинарное окрашивание для окрашивания поверхности, используя компенсационные бусины. Смешайте отрицательные шарики и шарики иммуноглобулина G (IgG) в соотношении 1:1 для общего объема, эквивалентного 20 мкл x количество поверхностных маркеров (например, 120 мкл, если окрашивающая панель содержит шесть антител).
- Отправьте 20 мкл шариков в отдельные пробирки по 1,5 мл для каждого маркера. Добавьте объем, соответствующий коэффициенту разбавления для каждого антитела в соответствующей пробирке (например, если коэффициент разбавления составляет 1:20, добавьте 1 мкл).
- Для окрашивания клеток CD34+ приготовьте основную смесь антител12 на основе таблицы 1. Смешайте антитела в одну пробирку объемом 0,5 мл. Добавьте 7 мкл из основной смеси антител к каждому из четырех состояний CD34+.
- Инкубируйте компенсационные шарики и образцы CD34+ при 4°C в течение не менее 30 минут.
ПРИМЕЧАНИЕ: Время инкубации должно быть адаптировано к техническим деталям антител, используемых для окрашивания. - Во время инкубации подготовьте 96-луночную пластину с круглым дном, которая будет использоваться для сортировки, добавляя 100 мкл среды для культивирования клеток в каждую лунку с помощью многоканальной пипетки.
ПРИМЕЧАНИЕ: Оставьте колодцы H8-H12 пустыми. - Маркируйте полипропиленовые пробирки объемом 5 мл для контроля окрашивания поверхности (5, с использованием шариков), контроля клеточного деления красителей (4, с использованием фракций CD34) и образцов CD34+ (4).
- В конце инкубации промойте клетки и шарики 1 мл окрашивающего буфера. Перенесите общий объем в полипропиленовые пробирки объемом 5 мл. Центрифугируйте пробирки в течение 5 мин при 300 x g, затем вдохните надосадочную жидкость, не нарушая гранулы.
- Ресуспендируют клетки в окрашивающем буфере, используя приблизительно 500 мкл для шариков и CD34+ клеток и 1 мл для CD34-пробирок.
Таблица 1: Шаблон для подготовки мастермикса антител для эксперимента по сортировке клеток. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
3. Сортировка ячеек
ПРИМЕЧАНИЕ: Отсортированные номера ячеек могут варьироваться в зависимости от общего количества доступных ячеек. В протоколе указан минимальный номер ячейки для каждого элемента управления. Необходимое время (для одной тарелки): 100 мин.
- Откройте шаблон эксперимента или задайте новый эксперимент. Создайте один образец и несколько пробирок, по одной на каждое условие.
- Установите стратегию стробирования, описанную на рисунке 1, создав шеститочечные диаграммы. Сначала визуализируйте ячейки на точечной диаграмме FSC-A/SSC-A и дважды щелкните инструмент стробирования полигонов , чтобы выбрать популяцию с низким боковым разбросом (рис. 1A). На следующем точечном графике (FSC-A/FSC-H) щелкните правой кнопкой мыши на графике и выберите ворота «Ячейки» из выпадающего меню, щелкнув по нему. Используйте тот же инструмент стробирования , чтобы выбрать плотную популяцию по диагонали между двумя осями (рис. 1B).
- На третьем точечном графике (APC против FSH-H) отобразите популяцию «Одиночные клетки» и затворите клетки, отрицательные для экспрессии APC Lineage (Lin) (рис. 1C). На четвертом графике (CFSE против CTV) отобразите популяцию «Lin-» и создайте четыре отдельных ворота, по одному для каждой комбинации красителей (рис. 1D).
ПРИМЕЧАНИЕ: Эти ворота должны быть плотными, чтобы отобрать только небольшую часть однородно окрашенных клеток. - Используйте пятый и шестой графики (APC-Cy7 против BV650 и PE-Cy7 против PE), чтобы определить интересующих предшественников. Щедро заверните популяцию CD34 + CD38 и CD34 + CD38+ на пятом графике (рис. 1E). Затем выберите популяцию CD34 + CD38 на шестом графике и нарисуйте три ворота, как показано на рисунке 1F.
- Запустите одиночные окрашивающие тюбики, содержащие компенсационные шарики, нажав кнопку «Получить ». Отрегулируйте напряжение фотоумножителя (ФЭУ) в раскрывающемся меню «Параметры », особенно для красителей деления клеток (от 104 до 105 в биэкспоненциальном масштабе).
- Уточните матрицу компенсации в соответствии с панелью, используемой для сортировки, с помощью вкладки «Компенсация ». Запишите не менее 5 000 событий в ворота бусин, нажав на кнопку «Запись ».
- Запустите дроби CD34- и еще раз проверьте матрицу компенсации. Запишите не менее 10 000 событий в одноклеточном шлюзе.
- Запустите фракции CD34+ , записав не менее 5,000 событий в одноклеточном затворе. Отрегулируйте затвор для каждой комбинации красителей, установив плотный затвор для выбора однородной популяции (рис. 1D). Точно так же отрегулируйте стробирование для выбора HSC и MPP.
- После того, как анализ будет завершен и все пробирки будут записаны, вставьте пластину в соответствующий держатель после выполнения стандартной калибровки Aria для сортировки на 96-луночных пластинах. Рекомендуется охладить плиту.
- Подготовьте шаблон сортировки тарелок по схеме, представленной в таблице 2, используя схему сортировки эксперимента. Лунки под названием «CD34-» содержат 5 000-10 000 ячеек, отсортированных на затворе CF/CV/VC/VI. Скважины «Bulk» содержат не менее 500 ячеек, отсортированных по затвору CD34+CD38-. Наконец, одноклеточные лунки содержат только одно событие на комбинацию красителей деления клеток на лунку, так что всего четыре события на лунку.
ПРИМЕЧАНИЕ: «Массовые» популяции могут быть адаптированы к определенному подмножеству предшественников; Не сортируйте менее 500 ячеек. - Для сортировки действуйте по порядку, завершая каждую комбинацию красителей деления клеток, прежде чем переходить к следующей. Например, начните с сортировки CD34-CF в режиме чистоты текучести. Нажмите на кнопку приобретения, затем на кнопку сортировки.
- В конце сортировки CD34- вставьте трубку CF CD34+ . Приобрести, затем нажмите кнопку сортировки, убедившись, что вы отметили 0/ 16/0 в качестве степени чистоты. Наконец, отсортируйте интересующие ячейки, по одной ячейке на лунку, по чистоте одной ячейки , не забудьте поставить галочку напротив параметра « Сортировка индексов ».
- Перейдите к следующей комбинации красителей деления клеток, повторяя тот же порядок. В качестве справки в таблице 2 приведен пример отсортированной тарелки.
ПРИМЕЧАНИЕ: Функция сортировки индексов генерирует отдельные файлы для каждого отсортированного условия. - По окончании сортировки экспортируйте файлы в формате .fcs 3.0. Поместите клетки в инкубатор с температурой 37 °C, 5% CO2 . Клетки культивируют в течение нескольких дней, согласно экспериментальному дизайну, в течение не менее 24 ч26 часов.
Таблица 2: Шаблон для 96-луночного планшета для сортировки клеток, основанный на конкретных требованиях к последовательному анализу проточной цитометрии. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
4. Анализ данных сортировки ячеек
ПРИМЕЧАНИЕ: Прежде чем двигаться дальше, необходимо проверить качество сортировки ячеек с помощью анализа данных FACS. Основным результатом этого шага является создание электронной таблицы, содержащей интенсивность маркеров каждой отсортированной отдельной ячейки.
- Загрузите файлы .fcs 3.0 в аналитическое программное обеспечение.
- Проверьте настройку компенсации, используемую во время сортировки ячеек, используя отдельные файлы окрашивания, записанные перед фактической сортировкой.
- Задайте пересмотренную стратегию стробирования, используя файлы, соответствующие другой группе. Скопируйте и вставьте эти ворота в файлы сортировки индексов.
- Убедитесь, что ячейки, отсортированные по индексу, попали в заданные ворота. Если есть какие-то отсортированные ячейки, которые были неправильно закрыты, их можно идентифицировать, экспортировав координаты пластины, записанные во время сортировки индекса, и удалить позже в анализе.
- Экспортируйте событие из файлов сортировки индексов в качестве компенсированных параметров. Экспортируйте их в виде .csv файлов, отметив галочками опции «масштабировать значения» и «компенсированные параметры». Эти файлы должны быть экспортированы в папку с именем «Экспортированные файлы».
- Объедините все файлы в один .csv файл, используя сценарий в дополнительном файле 1. Задайте правильный путь с помощью функции «setwd». Результатом этого сценария является электронная таблица, содержащая все события с различным распределением и относительную интенсивность для всех параметров.
5. Окрашивание антител после культуры
ПРИМЕЧАНИЕ: Выполняйте эту часть протокола в стерильных условиях; Несколько реагентов используются совместно с предыдущими этапами и должны оставаться стерильными. Для анализа проточной цитометрии используйте проточный цитометр с планшетным считывателем. Это позволяет проводить окрашивание непосредственно в планшете для культивирования тканей, сводя потери клеток к минимуму за счет ограничения количества пипеток и прядения. Подготовьте поверхностный маркер для одноцветного окрашивания с использованием компенсационных шариков, за исключением лунок A1-A4, которые представляют собой одинарное окрашивание для цветов CF/CV/VC/VI и уже присутствуют в 96-луночной пластине. Объемные популяции, отсортированные в соответствии с клеточным красителем, помогают установить стратегию стробирования для количества делений и общего стробирования. Необходимое время: 120 мин.
- Перед началом протокола отметьте лунки, которые содержат хотя бы одну клетку, проверив пластину под перевернутым микроскопом. Этот шаг позволяет оптимизировать количество антител, используемых для окрашивания, и ускоряет процедуру.
- Приготовьте мастермикс антител в соответствии с таблицей 3. Поскольку существует значительный объем пипетирования, в таблице учитывается техническая ошибка, связанная с пипетированием, в том числе дополнительный объем на 5%. Антитела, описанные в таблице, позволяют охарактеризовать ряд ГСПЦ из образцов пуповинной крови человека12.
- Центрифугируйте пластину в течение 5 мин при 300 х г. Быстро переверните тарелку под капюшоном и над бумажным полотенцем, чтобы удалить надосадочную жидкость.
- Добавьте 8 мкл окрашивающего буфера в лунки А1-А4. Добавьте 8 мкл смеси в другие лунки.
- Смешайте отрицательные шарики и компенсационные шарики IgG в соотношении 1:1, чтобы получить общий объем, эквивалентный 120 мкл. Отправьте 20 мкл в одну пробирку объемом 1,5 мл на каждый маркер. Добавьте объем антитела, соответствующий коэффициенту разбавления (например, если коэффициент разбавления составляет 1:20, добавьте 1 мкл).
ПРИМЕЧАНИЕ: Адаптируйте общий объем к количеству маркеров, используемых для окрашивания (например, 100 мкл, если красящая панель содержит пять антител). - Инкубируйте пластину и регуляторы компенсации одиночного окрашивания при +4 °C в течение не менее 30 мин.
ПРИМЕЧАНИЕ: Время инкубации должно быть адаптировано к техническим деталям антител, используемых для окрашивания. - Вымойте бусины с 1 мл окрашивающего буфера. Перенесите общий объем в предварительно маркированные полипропиленовые пробирки объемом 5 мл. Центрифугируйте пробирки в течение 5 мин при 300 x g, затем удалите надосадочную жидкость с помощью аспирации.
- Промойте клетки в пластине, добавив 100 мкл окрашивающего буфера на лунку с помощью многоканальной пипетки. Центрифугируйте пластину при 300 x g в течение 5 минут, затем быстро переверните пластину под капюшоном и над бумажным полотенцем, чтобы удалить надосадочную жидкость.
- Повторно суспендировать клетки в 85 мкл окрашивающего буфера с помощью многоканальной пипетки.
- Запустите анализ на проточном цитометре (режим сбора), используя специальный шаблон и нажав на пользовательский. Этот индивидуальный шаблон учитывает технические характеристики 96-луночной плиты с круглым дном, в частности, размеры каждой скважины (диаметр, глубина и толщина). Зонд должен достигать дна скважины, поэтому установите его точно в центре скважин A1 и H12.
- После выбора интересующих флуорофоров из списка, предложенного программным обеспечением, установите настройку планшета в соответствии с шаблоном планшета таблицы 2 с поправкой на количество лунок, содержащих по меньшей мере одну ячейку.
- Выберите 100 мкл в качестве предела объема сбора. Отметьте опцию агитации . Установите скорость сбора данных не более 1 мкл/с, так как более низкая скорость улучшает общий объем анализируемой скважины.
- Добавьте соответствующие чистящие и промывочные растворы в колодцы H8-H12. Шаблон в таблице 2 специально оставляет лунки H8-H12 пустыми, так как проточный цитометр должен выполнять ряд условий промывки в конце анализа.
ПРИМЕЧАНИЕ: Этот шаг адаптирован к специфике используемого проточного цитометра. - В разделе «Графики и вентили» сначала установите одноэлементный вентиль, используя диаграмму рассеяния FSC-A/SSC-A, а затем диаграмму рассеяния FSC-H/FSC-A. Создайте гистограмму для каждого интересующего маркера.
- После подтверждения настроек перейдите в раздел «Анализ ». Сначала проанализируйте однократное окрашивание, записав не менее 5000 событий (оптимальный диапазон: 5000-15000 событий), как для компенсационных шариков, так и для фракций, окрашенных CD34. При необходимости отрегулируйте напряжение.
- После того, как все единичные пятна будут зарегистрированы, можно начать фактическое получение, нажав на функцию «Сбор».
Таблица 3: Мастермикс антител для эксперимента по проточной цитометрии, в частности, для идентификации HSPC из пуповинной крови человека. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
6. Анализ данных посткультуральной проточной цитометрии
ПРИМЕЧАНИЕ: Описанный анализ данных специфичен для программного обеспечения, упомянутого в таблице материалов. Основным результатом является создание электронной таблицы, содержащей информацию об интенсивности поверхностного маркера, количестве делений и родстве на каждую анализируемую ячейку. В эту часть протокола включен сценарий, написанный на R, необходимый для этого рабочего процесса для создания итоговой таблицы анализа.
- Экспортируйте файлы с проточного цитометра в виде файлов .fcs. Загрузите их в аналитическое программное обеспечение, сгруппировав их вместе как «одно окрашивание», «массовое» и «одноклеточное».
- Подготовьте компенсационную матрицу, используя одиночные файлы окрашивания, и примените ее к двум другим группам путем перетаскивания.
ПРИМЕЧАНИЕ: Если используется автоматический компенсационный инструмент, проверьте качество вручную, прежде чем продолжить. - Чтобы получить репрезентативный стробирование, объедините различные объемные скважины в один файл. На этом этапе быстро указывается, перекрываются ли два цвета (обычно CV и VC) или другие аномалии, и поэтому их необходимо исключить. После нажатия на опцию « Конкатенировать популяции » выберите все некомпенсированные параметры в меню «параметры», затем нажмите « Сцепить».
- Загрузите объединенный файл в рабочую область, затем примените матрицу компенсации с помощью перетаскивания.
- Подготовьте стратегию стробирования, описанную на рисунке 2 , используя объединенный файл. В одноячеечном затворе отобразите события на точечной диаграмме с CFSE и CTV. Создайте первый вентиль под названием Labeled, включающий все четыре цвета и исключающий возможную автофлуоресценцию (рис. 2C). Затем нанесите каждому цвету по отдельности.
- Ячейки, помеченные CV и VC, нуждаются в преобразованном значении, учитывая, что цвет является результатом сигналов CFSE и CTV. Таким образом, два скоординированных сигнала поворачиваются в логарифмическом масштабе на 45°, чтобы позволить разбавлению деления идти параллельно оси x. Это преобразованное значение выводится вручную, щелкнув «Инструменты», а затем «Производный параметр». Вставьте следующую формулу в поле формулы :

ПРИМЕЧАНИЕ: Уравнение26 предполагает, что CFSE и CTV являются параметрами 03 и 17. - Чтобы правильно визуализировать этот новый параметр с именем «Производный параметр», установите диапазон линейной оси ~ 3-7, щелкнув параметр « Ось » и выбрав « Настроить ось».
- Примените стробирование к каждому цвету в отдельности в виде графика гистограммы: для CF и VI установите CFSE-A и CTV-A на оси x соответственно. Для CV и VC установите новый производный параметр на оси x. Установите ворота, соответствующие каждому пику, как показано на рисунке 3.
- Нанесите стробовку на каждую отдельную одноклеточную лунку. Обязательно добавьте производный параметр в каждую анализируемую скважину. Вручную проверяйте каждый цветовой затвор для каждой лунки, чтобы обнаружить события, которые неправильно назначены заданному пику. Примеры стробирования показаны на рисунке 4.
- После того, как анализ будет завершен и все скважины будут проверены, выберите все затворы CF/CV/VC/VI, содержащие хотя бы одну ячейку. Экспортируйте их в виде .csv файлов, отметив галочками опции «масштабировать значения» и «компенсированные параметры». Эти файлы экспортируются в папку с именем «Экспортированные файлы».
- Объедините все файлы в один .csv с помощью скрипта R в дополнительном файле 1. Не забудьте установить правильный путь с помощью функции «setwd». Результатом этого сценария является электронная таблица, содержащая все различные закрытые события и относительную интенсивность для всех параметров.
- Откройте электронную таблицу и переименуйте столбцы для каждого параметра, например, используя следующие имена: CFSE, CTV, CD90, CD123, CD45RA, CD34, CD38. Эти имена будут использоваться для определения порога стробирования, чтобы правильно присвоить каждой ячейке их идентичность.
- Добавьте шесть столбцов с именами «Колодец», «Состояние», «Цвет», «Поколение», «Original_cell» и «Culture_time». Эти переменные определены экспериментально и выводятся из каждой строки:
export_A10 CD34 + PBS_CV_Peak 1.csv.1 = A10 (колодец), CD34+ (Original_cell), PBS (состояние), CV (цвет), Peak_1 (поколение). - Экспортируйте объемные скважины, чтобы определить пороговые значения для стробирования: экспортируйте интересующую его компенсированную совокупность (например, CD34 + CD38-) в виде .csv файлов, отметив галочками опции «масштабные значения» и «компенсированные параметры». Экспортируйте эти файлы в папку с именем «Экспортированные файлы».
- Чтобы найти пороговое значение для CD38, определите наибольшее числовое значение для этого параметра. И наоборот, чтобы найти порог для CD34, определите наименьшее числовое значение для этого параметра. Повторите этот процесс для всех интересующих параметров.
ПРИМЕЧАНИЕ: Для анализа, представленного в протоколе, маркер CD45RA используется как для идентификации LMPP в затворе CD34+CD38, так и CMP/GMP в затворе CD34+CD38+. Это означает, что для этого маркера необходимо извлечь два разных пороговых значения. - Скопируйте и вставьте пороговые значения в файл Excel с именем «gating_matrix». Этот файл организован в соответствии с таблицей 4 и позволяет анализировать несколько независимых экспериментов. Очень важно называть каждый столбец именно такой схемой: XXYYMMDD_xxh, где XX — два инициала оператора, YY — два последних числа года, MM — месяц, DD — день, xx — момент времени анализа.
Таблица 4: Стробовая матрица для распределения судьбы клеток перед статистическим анализом. CD45h относится к интенсивности CD45RA для стробирования подмножества HPC, в то время как CD45l относится к интенсивности CD45RA для подмножеств CD34 + CD38- . Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
7. Статистический анализ
ПРИМЕЧАНИЕ: Статистическое тестирование сгенерированных данных включает в себя пользовательский конвейер анализа, закодированный с использованием языка программирования Python (дополнительный файл 2, дополнительный файл 3 и дополнительный файл 4). Скрипт состоит из трех блоков: первый для обработки электронной таблицы, второй блок для создания тепловой карты для визуализации данных и последний блок для генерации нескольких гистограмм для анализа и проверки свойств дифференциации и деления.
- Начиная с блока "0_process_data" (Supplemental File 2), убедитесь, что пути к gating_matrix и электронным таблицам данных правильно определены в скрипте.
- Определите словарь «cell_cols», чтобы присвоить каждой ячейке соответствующие судьбы. В конкретном случае судьбой являются ГСК, МПП, ЛМПП, общие миелоидные предшественники (КМП), грануло-моноцитарные предшественники (ГМП), мегакариоцитарно-эритроидные предшественники (МЭП) и CD34-.
- Используя пороговые значения, определенные из насыпных скважин (этап 6.16), определите функцию «cell_class_exp_time». Важно быть последовательным в именовании столбцов, чтобы правильно определить эти пороговые значения, используя то же имя, которое используется для определения каждого столбца на шаге 6.12.
- Фенотипы клеток определяются в сценарии с использованием серии утверждений «если-иначе», основанных на пороговых значениях, обнаруженных во время анализа проточной цитометрии.
ПРИМЕЧАНИЕ: Различные фенотипы могут быть отображены путем изменения этих утверждений для размещения других комбинаций маркеров. - Укажите конкретные условия эксперимента, используя функцию «cond_rule» (например, различные экспериментальные обработки). Для предоставленного набора данных условия называются "GT" и "Diff". Опишите две разные среды для культивирования клеток, используемые для культивирования клеток. Эта информация будет использована блоком "1_dot_plot" (Дополнительный файл 3) для построения тепловой карты.
- В блоке «2_bar_plot» (Supplemental File 4) определите словарь «class_dct», включив в него интересующие судьбы дискретных ячеек. Для предоставленного набора данных интересующие судьбы ячеек совпадают с описанными для словаря «cell_cols».
- Определите «conds» (условия), «or_cells» (исходная ячейка), «sym_labs» (метки симметрии) и «times» (экспериментальная точка времени). Это повторяющиеся фильтры, необходимые для построения графика. «conds» снова принимают условия, определенные в «cond_rule», «or_cells» — это HSC и MPP, а «sym_labs» описывают тип деления.
- В блоке «2_bar_plot» можно наносить на график клетки, которые продвинулись до деления 6.
ПРИМЕЧАНИЕ: Предоставленный набор данных включает только ячейки до деления 4, поэтому появляется сообщение об ошибке, но это не мешает работе скрипта. - Рисунки, сгенерированные сценарием, могут быть извлечены в папку с именем «рисунки» в виде файлов pdf. Файлы с именем «Тест» представляют собой различные статистические тесты, выполненные для соответствующей гистограммы.
Результаты
Сортировка FACS
Стратегии стробирования сортировки, представленные в этом протоколе, основаны на общепринятых стратегиях 12,30,31. Для стратегии стробирования, представленной на рисунке 1, исходным материалом являются предшественники пуповинной крови, предварительно очищенные с помощью магнитного обогащения CD34+, что объясняет незначительный процент положительных клеток Lineage. Важно использовать плотные ворота для четырех внутриклеточных комбинаций красителей (например, CTV на рисунке), чтобы улучшить разрешение пиков во время следующего анализа и установить правильную клеточную популяцию (рис. 1D). В случае, показанном на рисунке, ворота выбирают для самой большой и более определенной популяции. Наличие нескольких близких популяций для каждой комбинации красителей клеточного деления, по нашему опыту, не является репрезентативным для биологических различий. Вместо этого это может указывать на а) неоптимальную процедуру окрашивания или б) большую гетерогенность (особенно по размеру) в исходном пуле клеток. Это не удивительно, если начинать с пуповинной крови или других сложных биологических источников (например, аспиратов костного мозга, периферической крови). Если затвор не четко определен, постепенное разбавление различных комбинаций красителей может привести к слиянию более поздних пиков, особенно для условий CV и VC (рис. 2D). Еще одним негативным последствием неоптимального стробирования является неспособность эффективно различать различные пики после культивирования клеток, поскольку гетерогенная начальная популяция может привести к неглубоким пикам.
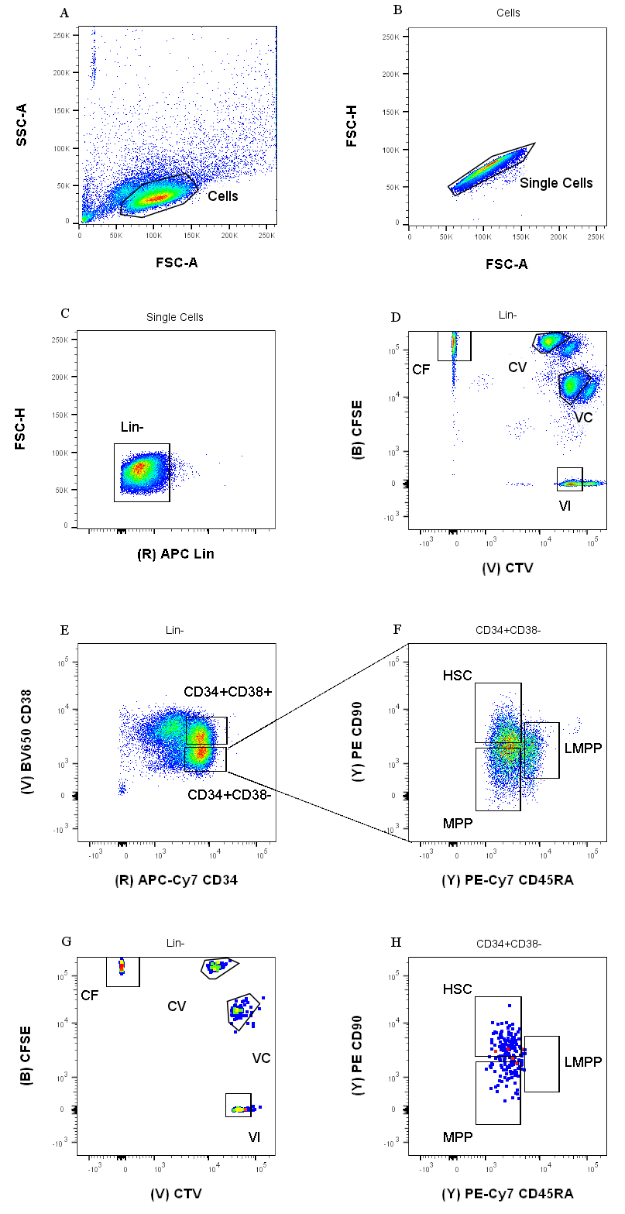
Рисунок 1: Стратегия стробирования для сортировки клеток. (A) FSC-A в сравнении с SSC-A, чтобы исключить мусор и загрязняющие клетки. (B) FSC-A по сравнению с FSC-H, чтобы исключить дублеты и клеточные скопления. (C) Lin по сравнению с FSC-H, чтобы исключить клетки, которые являются Lin +. (D) CTV по сравнению с CFSE, чтобы однозначно идентифицировать клетки, окрашенные комбинациями красителей CF, CV, VC и VI. Ворота должны быть достаточно строгими, чтобы включать однородное население. (E) CD34 по сравнению с CD38, чтобы отделить ограниченные предшественники CD34 + CD38 + (также называемые HPC) от мультипотентного компартмента CD34 + CD38-. (F) CD45RA по сравнению с CD90 из популяции CD34 + CD38-, чтобы разделить наиболее незрелые предшественники, обогащенные HSC (CD90 + CD45RA-), LMPP (CD90 midCD45RA +) и более коммитный MPP (CD90-CD45RA-). (G) События, отсортированные по индексу, представленные здесь для окрашивания комбинацией клеточных красителей и (H) экспрессии поверхностных маркеров CD90 и CD45RA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Анализ проточной цитометрии после культивирования клеток
Данные на рисунке 2 являются репрезентативными для ГСК пуповинной крови человека, хранящихся в культуре в течение 72 ч, в присутствии нескольких цитокинов, способных поддерживать ряд миелоидных предшественников и предшественников. Панели от 2A до 2D представляют собой стробирование, необходимое для установления родства каждой из отдельных клеток, в то время как панели от 2E до 2G позволяют проводить клеточное фенотипирование. Уменьшенное присутствие депутатов Европарламента на рисунке, вероятно, является следствием условий культивирования, использованных для этого репрезентативного эксперимента (рис. 2F). Использование различных цитокинов и условий культивирования изменяет относительный процент каждого подмножества, аналогично отбору различных стартовых клеток для эксперимента.
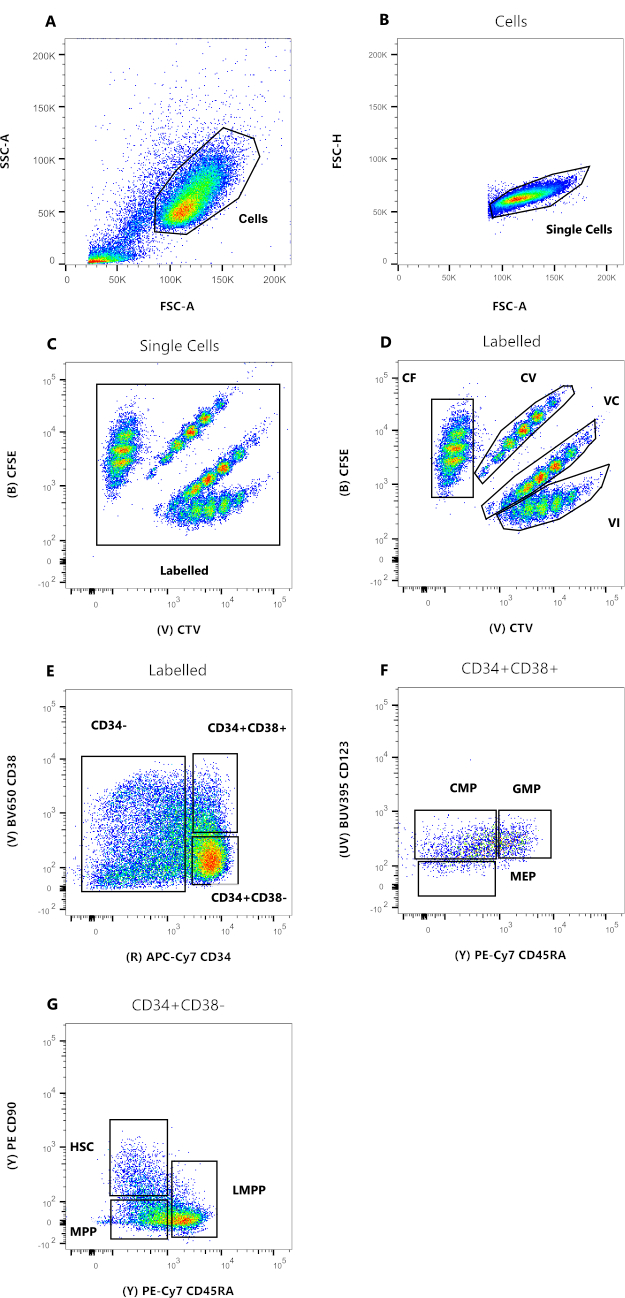
Рисунок 2: Стратегия стробирования для анализа проточной цитометрии. (A) FSC-A по сравнению с SSC-A, чтобы исключить мусор и загрязняющие клетки. (B) FSC-A по сравнению с FSC-H, чтобы исключить дублеты и клеточные скопления. (C) CTV по сравнению с CFSE, затвор с маркировкой позволяет исключить любое автофлуоресцентное событие, которое может повлиять на разрешение данных. (D) CTV против CFSE. Чрезвычайно важно строго заградить четыре популяции на основе разведения красителя клеточного деления. (E) CD34 и CD38, чтобы различать коммитированные предшественники (CD34-), ограниченные предшественники (HPC) (CD34 + CD38 +) и незрелые предшественники (CD34 + CD38-). (F) CD45RA по сравнению с CD123, чтобы различать три типа ограниченных предшественников: CMP (CD123 + CD45RA-), MEP (CD123-CD45RA-) и GMP (CD123 + CD45RA +). (G) CD45RA по сравнению с CD90 из CD34 + CD38-, для идентификации ГСК, LMPP и MPP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Определение пика и этапы присвоения (рис. 3 и рис. 4) являются важнейшими аспектами протокола и требуют определения строгих шлюзов. Для определения пика (рис. 3) для надежной идентификации необходимо не менее 1000 событий. В этом смысле было бы полезно изолировать больше клеток на этапе сортировки клеток для лунок «Bulk». На рисунке 4 описаны четыре примера одиночных скважин, содержащих несколько семейств. Этот рисунок разъясняет важность стробирования на рисунках 2D и 3, особенно для идентификации каждого семейства и каждой вершины. На рисунке 4А показан простой пример, так как все ячейки в затворе CF находятся очень близко друг к другу и могут быть легко отнесены к одному пику. На рисунке 4C показан еще один пример семейства, распределенного однозначно на двух хорошо разделенных пиках, как это четко показано на гистограмме рисунка 4D. На рисунке 4E,G показана важность строгого стробирования, основанного на большом количестве событий; Они оба показывают несколько событий, которые близки, но за пределами ворот комбинации красителей. Эти события могут быть неправильно включены в вентили VI и CF, основываясь исключительно на анализе одной скважины. Наконец, на рисунке 4F,H показаны два разных примера семейств, распределенных по нескольким пикам, с одним примером двух одинаковых пиков интенсивности (рисунок 4F) и одним с двумя неодинаковыми пиками интенсивности (рисунок 4H).
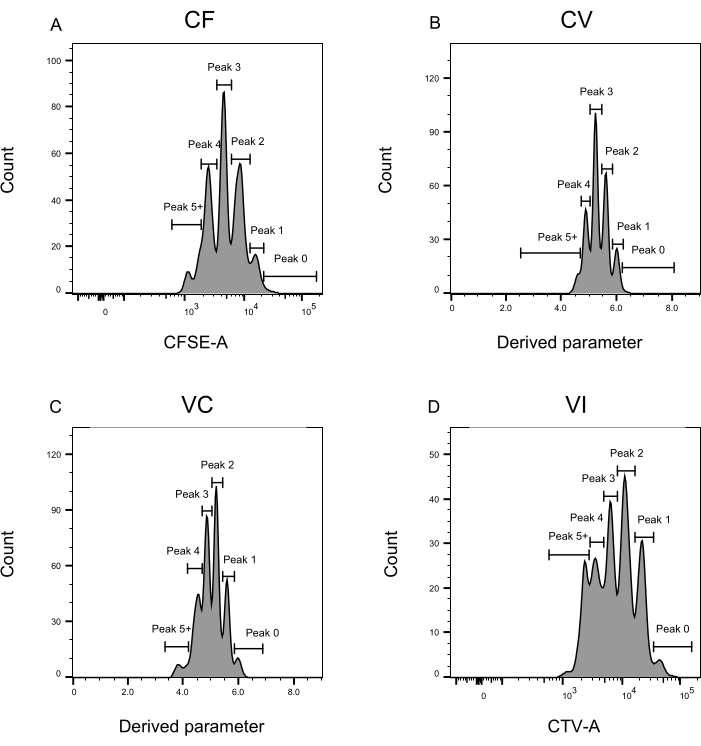
Рисунок 3: Определение пика для анализа проточной цитометрии. (А-Д) Пики должны быть определены, регистрируя не менее 500 событий, чтобы обеспечить хорошее представление для каждого отдельного пика. (A) Гистограмма интенсивности CFSE-A. Можно идентифицировать несколько пиков, каждый из которых соответствует другой популяции делящихся клеток. (В,В) Гистограммы интенсивности производного параметра, представляющие смесь CFSE-CTV, CV (B) и VC (C) соответственно. (D) Гистограмма интенсивности CTV-A. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
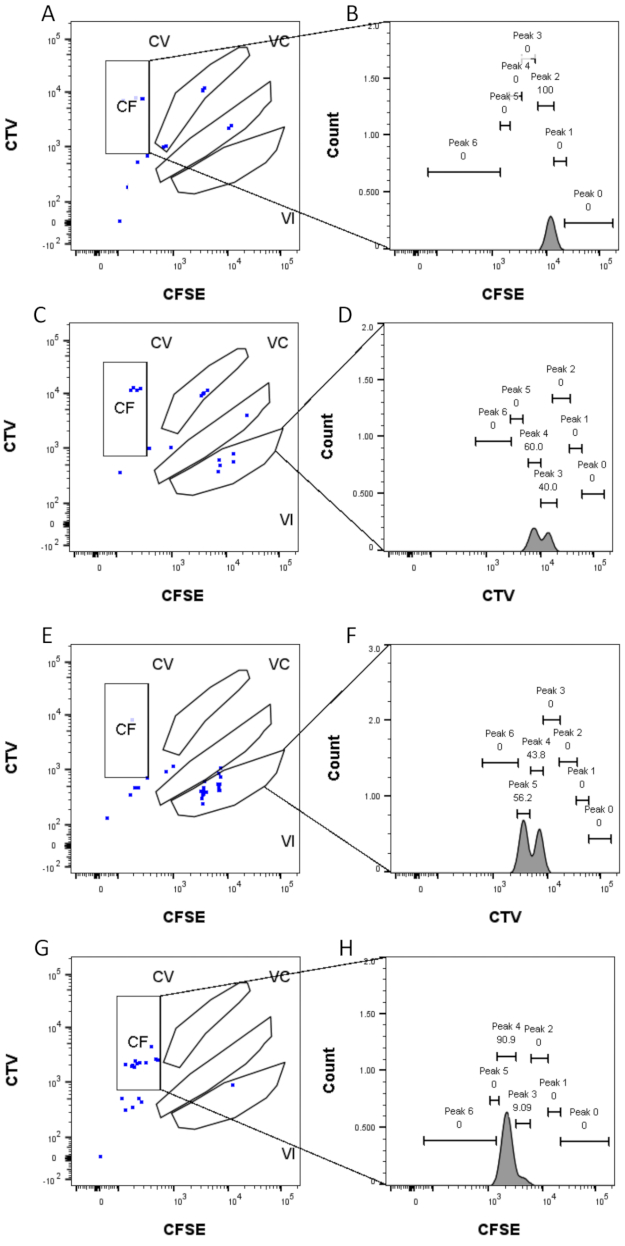
Рисунок 4: Назначение пиков . (А, Б) Для этой скважины можно обнаружить только один пик в затворе CF. (С,Д) В этой скважине, в VI затворе, можно обнаружить два пика почти одинаковой интенсивности. Вершины хорошо разрешены. (Е,Ж) Два пика сопоставимой интенсивности могут быть обнаружены в этой скважине, в VI затворе. Были учтены только события в воротах, основанные на стратегии, установленной с использованием насыпных скважин. (Г-Г) Два пика неодинаковой интенсивности могут быть обнаружены в этой скважине, в затворе CF. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Представление данных и статистическое тестирование
На рисунке 5 показаны различные типы представления данных двух отдельных экспериментов, выполненных через 72 часа культивирования клеток. ГСК и МПП культивировались в двух разных средах для культивирования клеток, которые, как предполагается, изменяют свойства деления и дифференцировки клеток. Эти носители называются «Diff» (Дифференциация)32 и «GT»33; первый способствует дифференцировке миелоидов и эритроидов, поскольку содержит эритропоэтин (ЭПО) и грануло-моноцитарный колониестимулирующий фактор (ГМ-КСФ), в то время как второй был разработан в контексте клинических испытаний генной терапии с целью поддержания и усиления высокого процента ГСПЦ. На рисунке 5А представлена репрезентативная тепловая карта для состояния «Diff», представляющая множество семейств клеток, как в клеточных судьбах, так и в делениях. В этой тепловой карте каждая строка представляет отдельное семейство, каждый квадрат — отдельную ячейку, а столбцы группируют все ячейки, которые находятся в одном поколении (например, ячейки в поколении 2, разделенные как минимум дважды). Можно различать высокооднородные семейства, состоящие из одного типа клеток и демонстрирующие одинаковое количество делений (например, семейство #63), и гетерогенные семейства, включающие три типа клеток в течение двух поколений (например, семейство #84). Поскольку скорость клеточного восстановления для этого анализа составляет примерно 70%, полные семьи, которые определяются тем, что все их клетки восстановлены, возможно, в разных поколениях (например, семейство из одной клетки в поколении 1 и двух клеток в поколении 2), наблюдаются редко (отображение хэштега рядом с их идентификационным номером на рисунке 5A). Существует множество объяснений, объясняющих неполное обнаружение, которые могут быть техническими (проблема окрашивания, потеря клеток из-за протокола) или биологическими (гибель клеток и/или апоптоз). Технические ограничения могут быть преодолены с помощью анализатора, предназначенного для уменьшения мертвого объема, связанного с отдельным образцом, и путем выполнения окрашивания клеток непосредственно в планшете для клеточной культуры для уменьшения объема пипетирования. И наоборот, ортогональные методы определения количества гибели клеток (например, с помощью экспериментов по визуализации живых клеток) могут помочь различить технические и биологические факторы, приводящие к неполному обнаружению.
На рисунке 5Bi показано, как визуализировать влияние условий культивирования на состав типа клеток, как если бы кто-то выполнил объемный анализ. Здесь условие Diff способствует большему количеству судеб и более высокому проценту CD34+ клеток (определяемых как все типы клеток, кроме CD34-). Доверительные интервалы вычисляются в скрипте с помощью базовой начальной загрузки с 250 000 начальных наборов данных34. Стоит отметить, что все остальные гистограммы на рисунке 5 отображают доверительные интервалы, рассчитанные таким же образом. В таблице 5 обобщена вся информация о количестве семей и количестве клеток в каждом поколении.
На рисунке 5Вii графически представлены результаты статистического тестирования, выполненного в 2_bar_plot. Официальное описание статистической основы имеется26. Короче говоря, эта структура позволяет проверять статистическую гипотезу, предполагая, что клетки из одного семейства зависимы (предположение, которое само по себе проверяемо), в отличие от классической статистики, которая требует независимости между всеми наблюдаемыми клетками. В конкретном случае, представленном на рисунке, статистический тест ставит под сомнение гипотезу о том, что выбор клеточной судьбы MPP, измеряемый как частоты различных типов клеток, присутствующих в культуре, не зависит от используемых условий клеточной культуры. Во-первых, статистика G-критерия используется для оценки расхождения между частотами типов ячеек из разных сред ячеек (например, в Bii эта статистика представлена красной полосой). Затем выполняется рандомизация данных с помощью перестановки, меняя местами целые семейства клеток между двумя условиями клеточной культуры. Это делается для того, чтобы сохранить зависимость между клетками, связанными с семьей, при этом количество семей в каждом наборе соответствует исходным данным. Статистика G-критерия рассчитывается на основе рандомизированного набора данных. Синие значения, представленные в 5Bii , представляют собой статистику G-критерия для 250 000 перестановок. Наконец, значение p вычисляется для оценки степени, в которой исходный набор данных отклоняется от распределения переставленных. В этом примере исходная статистика в значительной степени отклоняется от распределения, что приводит к небольшому значению p и, таким образом, отвергает гипотезу о том, что клеточная судьба MPP не зависит от условий культивирования.
На рисунке 5C показан процент семейств клеток на максимальное поколение, чтобы изучить, как различные условия изменяют деление клеток на семейство клеток. Этот график данных показывает, что через 72 часа клетки, культивируемые в состоянии Diff, завершают большее количество делений, чем клетки в состоянии GT. Представлено максимальное количество поколений в каждой семье, поэтому одна семья, которая отображает клетки в поколениях 1 и 2, считается поколением 2. Та же статистическая структура, которая используется для рисунка 5B , может быть использована для статистической проверки независимости между клеточным делением и состоянием культуры.
На рисунке 5D исследуется тип симметрии/асимметрии первого деления для различных типов предков (ГСК или МПП). Для полных клеточных семейств в поколении 1 — единственном поколении, где можно окончательно установить две дочерние клетки как сестринские клетки — можно определить четыре различных типа симметрии/асимметрии: метка «Sym Undiff» описывает семьи, в которых обе дочерние клетки сохраняют фенотип исходной клетки. «Sym Diff» означает, что обе дочери имеют один и тот же фенотип, и он отличается от клетки происхождения. «Asym Undiff» означает, что одна дочь сохраняет только фенотип клетки происхождения. Наконец, «Asym Diff» описывает семьи, в которых обе дочери имеют разные фенотипы, и ни один из них не совпадает с клеткой происхождения. Чтобы получить статистическую мощность в оценке этих симметричных/асимметричных судеб, желательно проводить анализ MultiGen в ранние моменты времени, чтобы наблюдать больше семей, потомство которых находится в поколении 1.
Наконец, на рисунке 5E представлены проценты типов клеток в зависимости от количества делений, чтобы получить представление о прогрессии паттерна дифференцировки между делениями. Например, данные, показанные на рисунке, свидетельствуют о том, что клетки прогрессируют до состояния CD34- , причем более 50% обнаруженных клеток в этом классе находятся всего после трех делений. Более того, можно сделать вывод, что MPP не способствуют самообновлению, поскольку небольшой процент клеток сохраняет исходный фенотип. Некоторые из этих выводов могут быть затем проверены с использованием статистической основы, представленной на предыдущих рисунках.
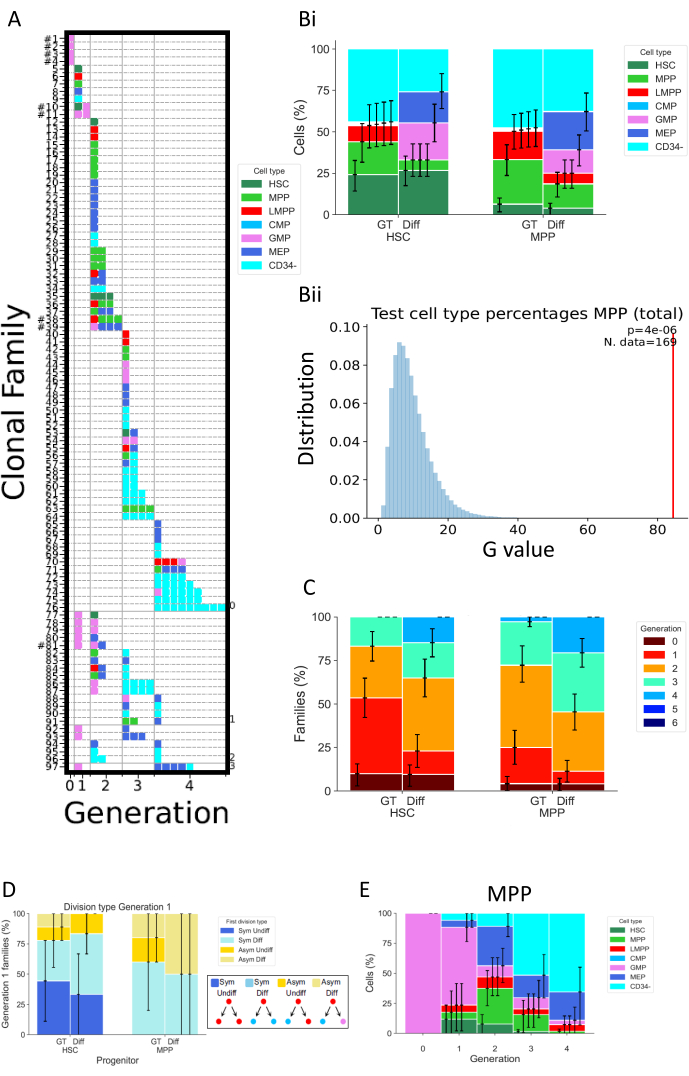
Рисунок 5: Пример представления данных для одного 72-часового эксперимента с использованием HSPC пуповинной крови. (A) Тепловые карты для выбранного набора данных (HSC, в среде «Diff», после 72 ч культивирования). Графики представляют все отдельные ячейки (квадраты) в соответствии с их родством (ряды), количеством выполненных делений (столбцы, называемые генерацией) и фенотипом (цвета). (Би) Гистограмма, сравнивающая пропорции типов клеток клеточного потомства ГСК и МПП, между состоянием GT и состоянием Diff. (Bii) На графике представлены статистические тесты, выполненные в сценарии «2_bar_plot» для MPP через 72 часа культивирования, сравнивая коктейли цитокинов «Diff» и «GT». Экспериментальное значение отображается красным цветом, а значения, полученные с помощью 250 000 перестановок, - синим. Значение p . G-критерия указывается в правом верхнем углу с количеством семейств, используемых для теста. (C) Гистограмма, сравнивающая процент семей (всего 314 семей) в каждом поколении (с цветовой кодировкой) для ГСК и МПП для каждого состояния культуры. Доверительные интервалы вычисляются с 250 000 начальных наборов данных. (D) Гистограмма, представляющая тип симметрии/асимметрии между судьбой дочерних клеток для семей с двумя клетками в поколении 1: Sym Undiff (обе дочери сохраняют фенотип исходной клетки), Sym Diff (обе дочери имеют одинаковый фенотип, и он отличается от клетки происхождения), Asym Undiff (только одна дочь сохраняет фенотип исходной клетки), и Asym Diff (обе дочери имеют разные фенотипы, и ни одна из них не похожа на клетку происхождения). е) гистограммы вклада типов клеток, классифицированных по поколениям, для МПП, культивируемых с коктейлем "Дифф"; n = 204 клетки и 97 семейств. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 5: Описание количества семейств и клеток, проанализированных по каждому экспериментальному условию (клетка происхождения и среда для культивирования клеток). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительный файл 1: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Анализ MultiGen - это высокопроизводительный, простой в выполнении и недорогой анализ, который сыграл важную роль в изучении лимфоцитов 23,24,35 и мышиных гемопоэтических клеток 26,27. Здесь мы представляем новую разработку подхода, которая позволяет расшифровать ex vivo раннюю фазу приверженности HSPC человека на уровне одной клетки с использованием краткосрочной культуры (рис. 6). Одноклеточные системы культивирования ex vivo обычно используются для оценки долгосрочной судьбы HSPC в зрелых клетках, но некоторые судьбы происходят раньше, чем другие36, что потенциально смещает анализ в сторону меньшего количества судеб. Кроме того, эти культурные системы обычно упускают информацию о разделениях во время судьбы. Было показано, что первые шаги приверженности происходят уже в начале культуры, иногда без деления26,37, что делает краткосрочную культуру и отслеживание деления необходимыми для изучения ранней приверженности судьбе. Одновременно отслеживая судьбу, разделение и родство, этот анализ позволяет понять роль первого деления и решения судьбы в HSPC человека. Используя анализ, можно сделать вывод о том, после скольких делений происходит процесс приверженности, баланс между самообновлением и дифференциацией для этих ранних предков и как эти свойства наследуются из поколения в поколение. Насколько нам известно, это единственный анализ, который позволяет проводить такие измерения для HSPC человека с разрешением одной клетки. Кроме того, используя различные комбинации красителей клеточного деления, мы увеличили пропускную способность анализа, что сделало этот анализ ценным инструментом для быстрого создания больших наборов данных. Комбинации красителей позволяют следить за несколькими семействами в одних и тех же лунках, увеличивая количество клеток, доступных для анализа в краткосрочной культуре. Количество комбинаций потенциально может быть увеличено еще больше за счет добавления других красителей (например, желтого красителя) или изменения соотношения CFSE и CTV. Однако это уменьшает количество других параметров, которые можно анализировать.
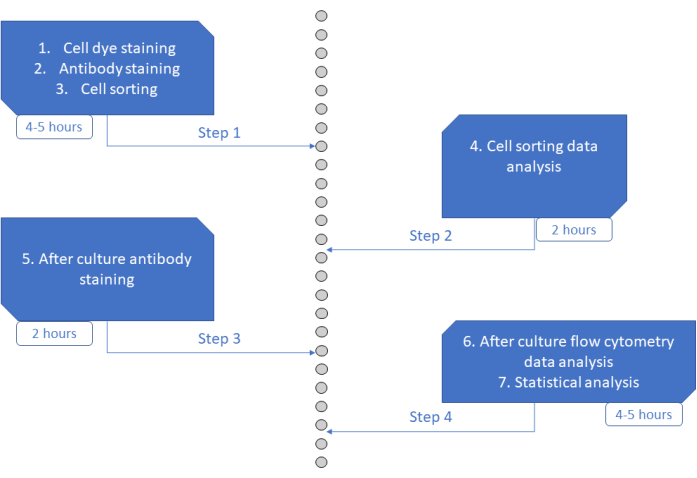
Рисунок 6: Схематическое изображение протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для успешного выполнения анализа из-за большого количества лунок и уменьшенного количества анализируемых клеток необходимо провести анализ проточной цитометрии на анализаторе, оснащенном планшетным считывателем. Новое поколение настольных анализаторов особенно адаптировано к этому анализу, так как большинство из них имеют меньший мертвый объем, чтобы снизить процент потери клеток. Это, в свою очередь, гарантирует более высокую эффективность восстановления всей скважины, что приводит к эффективности, оцениваемой в диапазоне70% 26. Оценка потери клеток во время получения проточной цитометрии имеет решающее значение для анализа каждой отдельной семьи. Например, предполагая отсутствие гибели клеток и подсчитывая количество делений, можно оценить количество клеток в каждой семье. Тем не менее, желательно провести некоторые подтверждающие эксперименты, в частности, по оценке гибели клеток в тестируемых условиях культивирования и экспериментальному измерению скорости восстановления с использованием определенного количества клеток.
Одним из важнейших шагов этого протокола является назначение пика. Как уже упоминалось, распределение пиков хорошего качества сильно зависит от выделения очень узких пиков при сортировке клеток. Тем не менее, по-прежнему трудно определить правильное количество дивизий на основе исключительно распределения. Поскольку сортировка клеток и анализ проточной цитометрии выполняются на двух разных машинах, невозможно напрямую сравнить интенсивность каждого сигнала, поэтому может быть трудно узнать, является ли первый пик, наблюдаемый на правом конце гистограммы, пиком 0 или пиком 1. В связи с этим возможны несколько решений; Одним из способов является проведение ортогонального эксперимента для точного измерения количества делений, выполняемых этими клетками (например, визуализация живых клеток). Другая возможность состоит в том, чтобы просто подсчитать количество клеток в лунке под перевернутым светлопольным микроскопом перед запуском анализа проточной цитометрии. Это приведет к среднему количеству делений (при условии отсутствия гибели клеток). Наконец, постфактум решением для пикового назначения является обнаружение необычного числа «невозможных семейств»; Эти семейства состоят из большего, чем возможно, количества клеток в поколении (например, пять клеток в поколении 2 или две клетки в поколении 1 и одна клетка в поколении 2). Возможность исключения невозможных семейств закодирована на этапе статистического анализа и помечает невозможное семейство. Если частота возникновения этих ошибок слишком велика, разумно предположить, что пиковое назначение необходимо пересмотреть.
В этот протокол мы включили несколько примеров представления и анализа данных для анализа, поскольку это стало важным шагом в создании и интерпретации больших наборов данных38. Первым примером является тепловая карта, показывающая совокупность всех проанализированных клеток, организованных по семействам. Это эффективный инструмент для изучения общих свойств данных и потенциальных выводов: состоят ли семейства из нескольких типов клеток или они, как правило, однородны по составу? Являются ли семьи распределенными по нескольким поколениям, или они в основном делятся одинаковое количество раз? Этот исследовательский анализ должен быть дополнен более конкретными графиками и статистическим тестированием. Он может быть использован для количественной оценки симметричной и асимметричной судьбы приверженности, дифференциации без деления, баланса между самообновлением и дифференциацией, а также количества делений для данной судьбы обязательств. При планировании эксперимента крайне важно установить длину клеточной культуры в соответствии с типом задаваемого вопроса; Например, для первых двух вопросов (симметричный/асимметричный баланс и дифференциация без деления) планирование очень коротких шагов культур позволяет изолировать большое количество семей, которые выполнили только одно деление или вообще не выполнили26. И наоборот, более длительные эксперименты позволяют исследовать количество делений, необходимых для конкретного обязательства клетки, поскольку они отбирают семейства на разных стадиях дифференцировки. Тем не менее, этот метод не рассчитан на длительные культуры (2-3 недели), так как разведение клеточного красителя не способно точно отследить более семи или восьми делений22. Как следствие, этот инструмент в основном адаптирован для изучения ранней приверженности гемопоэтических предшественников и не предназначен для того, чтобы делать надежные выводы о долгосрочных дифференцировочных свойствах этих клеток.
Статистическая основа была разработана специально для анализа такого рода данных и основана на концепции перестановок26. Это было необходимо из-за наблюдения семейной зависимости от распределения типов клеток и от количества выполненных делений. Другими словами, клетки, которые являются частью одного семейства, также с большей вероятностью проявляют сходные фенотипы и делятся одинаковое количество раз. Хотя углубленный анализ выходит за рамки данной работы, предоставленный набор статистических тестов должен быть достаточным для оценки различных условий.
В заключение, этот протокол представляет собой ценный инструмент для оценки клеточной динамики гемопоэтических стволовых клеток и клеток-предшественников ex vivo быстрым и недорогим способом. Благодаря своей гибкости и универсальности в отношении момента времени, условий культивирования и типа анализируемых HSPC, он позволяет тестировать различные экспериментальные условия. В качестве анализа, основанного на проточной цитометрии, он может быть реализован в большинстве лабораторий и не требует обширных предварительных знаний, что делает его хорошим кандидатом для скрининга и пилотных экспериментов.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов, относящегося к данной работе. Спонсоры не играли никакой роли в дизайне исследования, сборе и интерпретации данных или принятии решения о представлении работы для публикации.
Благодарности
Мы хотели бы поблагодарить сотрудников Института Кюри за помощь в организации экспериментов по проточной цитометрии. Мы также хотели бы отметить вклад других членов команды Perié в ходе многочисленных обсуждений. Мы благодарим доктора Джулию Марчинго и профессора Фила Ходжкина (Институт медицинских исследований Уолтера Элизы Холла) за то, что они поделились своим протоколом мультиплексирования красителей клеточного деления на лимфоцитах. Мы благодарим биобанк пуповинной крови больницы Сент-Луиса за предоставление биологических ресурсов, необходимых для разработки этого протокола. Исследование было поддержано грантом ATIP-Avenir от CNRS и Фонда Бетанкур-Шюллер (L.P.), грантами Labex CelTisPhyBio (ANR-10-LBX-0038) (L.P. и A.D.), программой Idex Paris-Science-Lettres (ANR-10-IDEX-0001-02 PSL) (L.P.), Canceropole INCA Emerge (2021-1-EMERG-54b-ICR-1, L.P.) и грантом ITMO MIIC (21CM044, L.P.). Помимо финансирования со стороны Европейского исследовательского совета (ERC) в рамках исследовательской и инновационной программы Европейского Союза Horizon 2020 ERC StG 758170-Microbar (до L.P.), A.D. была поддержана стипендией Фонда Франции.
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
Ссылки
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084 (2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041 (2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381 (2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287 (2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540 (2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. . Testing statistical hypotheses. , 784 (2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624 (2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Davison, A. C., Hinkley, D. V. . Bootstrap Methods and their Application. , (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116 (2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898 (2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены