Method Article
Valutazione simultanea di parentela, numero di divisione e fenotipo tramite citometria a flusso per cellule staminali e progenitrici ematopoietiche
In questo articolo
Riepilogo
Qui viene presentata una tecnica basata sulla citometria a flusso che consente di misurare simultaneamente il numero di divisioni cellulari, il fenotipo cellulare di superficie e la parentela cellulare. Queste proprietà possono essere testate statisticamente utilizzando un framework basato sulla permutazione.
Abstract
Poche tecniche possono valutare contemporaneamente fenotipo e destino per la stessa cellula. La maggior parte degli attuali protocolli utilizzati per caratterizzare il fenotipo, sebbene in grado di generare grandi set di dati, richiedono la distruzione della cellula di interesse, rendendo impossibile valutarne il destino funzionale. Sistemi di differenziazione biologica eterogenei come l'ematopoiesi sono quindi difficili da descrivere. Basandoci sui coloranti di tracciamento della divisione cellulare, abbiamo ulteriormente sviluppato un protocollo per determinare simultaneamente la parentela, il numero di divisione e lo stato di differenziazione per molti progenitori ematopoietici singoli. Questo protocollo consente la valutazione del potenziale di differenziazione ex vivo di progenitori ematopoietici murini e umani, isolati da varie fonti biologiche. Inoltre, poiché si basa sulla citometria a flusso e su un numero limitato di reagenti, può generare rapidamente una grande quantità di dati, a livello di singola cellula, in modo relativamente economico. Forniamo anche la pipeline analitica per l'analisi a cella singola, combinata con un solido quadro statistico. Poiché questo protocollo consente il collegamento della divisione cellulare e della differenziazione a livello di singola cellula, può essere utilizzato per valutare quantitativamente l'impegno del destino simmetrico e asimmetrico, l'equilibrio tra auto-rinnovamento e differenziazione e il numero di divisioni per un dato destino di impegno. Complessivamente, questo protocollo può essere utilizzato in progetti sperimentali volti a svelare le differenze biologiche tra i progenitori ematopoietici, da una prospettiva a singola cellula.
Introduzione
L'ultimo decennio è stato caratterizzato dalla diffusione mondiale di approcci unicellulari alla biologia cellulare e molecolare. Seguendo le fasi della genomica monocellulare1,2, oggi è possibile studiare molti componenti di una singola cellula (ad esempio, DNA, RNA, proteine), con nuove tecniche di omiche monocellulari che fioriscono ogni anno. Queste tecniche hanno fatto luce su questioni vecchie e nuove per i campi dell'immunologia, della neurobiologia, dell'oncologia e altri, sia utilizzando cellule umane che di organismi modello3. Evidenziando le differenze tra le singole cellule, la monocellula -omica ha spinto alla definizione di un nuovo modello di emopoiesi, centrato sull'eterogeneità delle cellule staminali e progenitrici ematopoietiche (HSPC) e allontanandosi dal modello classico di popolazioni omogenee discrete 4,5.
Uno dei pochi inconvenienti di tutte le tecniche -omiche è la distruzione della cella di interesse, precludendo la possibilità di valutarne la funzionalità. Al contrario, altri metodi a singola cellula, come il saggio di trapianto di singola cellula e le tecnologie di tracciamento del lignaggio, forniscono una lettura della funzionalità della cellula antenata valutando il destino delle singole cellule in vivo 6,7. Le tecnologie di tracciamento del lignaggio comportano l'etichettatura della cellula di interesse con un'etichetta genetica ereditabile7 o un'etichetta fluorescente8,9, consentendo di seguire il destino di più singole cellule contemporaneamente. Tuttavia, la caratterizzazione delle cellule di partenza è tipicamente limitata a un numero limitato di parametri, come l'espressione di alcune proteine di superficie valutate mediante citometria a flusso10. Inoltre, le tecnologie di tracciamento della linea unicellulare richiedono un rilevamento laborioso dell'etichetta cellulare, in genere tramite sequenziamento del DNA / RNA o imaging. Quest'ultimo punto in particolare limita il numero di condizioni che possono essere testate in un singolo esperimento.
Un'altra classe di metodi utilizzati per studiare la funzionalità di singole cellule sono i sistemi di coltura cellulare ex vivo di singoli HSPC. Facili da eseguire, questi test gold standard comportano lo smistamento di singole cellule in vasi di coltura cellulare a 96 pozzetti e, dopo la coltura, caratterizzando il fenotipo della progenie cellulare, tipicamente mediante citometria a flusso o analisi morfologica. Questi saggi sono stati utilizzati principalmente per caratterizzare la differenziazione a lungo termine delle HSPC in cellule mature, tipicamente dopo 2-3 settimane di coltura11,12. In alternativa, sono stati utilizzati per cercare di mantenere ed espandere gli HSPC ex vivo 13,14,15,16,17,18, con la promessa di benefici medici per il trapianto di cellule staminali umane 19. Infine, sono stati utilizzati per studiare l'impegno precoce delle HSPC utilizzando colture a breve termine20, con il basso numero di cellule generate in questa coltura come principale fattore limitante. Uno svantaggio di questi diversi tipi di saggi ex vivo è che riflettono solo parzialmente la complessità in vivo; tuttavia, sono uno dei rari modi per studiare la differenziazione umana HSPC.
Un'informazione mancante dai metodi esistenti a singola cellula (single cell-omics, lineage tracing e coltura ex vivo) è la rilevazione accurata delle divisioni cellulari, un parametro essenziale da considerare quando si studia la dinamica HSPC21. Un modo semplice per valutare il numero di divisioni tramite citometria a flusso è l'uso di "coloranti proteici" solubili, come il 5-(e 6)-carbossifluoresceina diacetato succinimidil estere (CFSE)22. Questi coloranti di divisione si diffondono all'interno del citoplasma delle cellule colorate, e diluiti a metà e passati alle due cellule figlie ad ogni divisione cellulare, permettendo di enumerare fino a 10 divisioni. Combinando diversi coloranti di divisione, è possibile seminare più progenitori individuali nello stesso pozzo, poiché ogni singolo colorante consente la separazione dei diversi discendenti. Questo è il principio alla base dell'uso di coloranti cellulari per il tracciamento clonale e divisionale multiplex che è stato introdotto per la prima volta per i linfociti murini23,24.
Qui, presentiamo lo sviluppo del saggio MultiGen per l'uso con HSPC murini e umani. Permette di testare molte singole cellule contemporaneamente per le loro proprietà di differenziazione, divisione e parentela ex vivo. Questo test ad alto rendimento, facile da eseguire e poco costoso consente di misurare il fenotipo cellulare, il numero di divisioni eseguite e la parentela cellulare e la relazione clonale con le altre cellule nel pozzo, tutto allo stesso tempo. Può essere utilizzato per valutare quantitativamente l'impegno del destino simmetrico e asimmetrico, l'equilibrio tra auto-rinnovamento e differenziazione e il numero di divisioni necessarie per un determinato destino di impegno. Il protocollo richiede un selezionatore cellulare attivato a fluorescenza (FACS) e un citometro a flusso con un lettore di piastre, oltre alle attrezzature necessarie per eseguire la coltura cellulare. Oltre al protocollo tecnico per l'esecuzione del test su HSPC umani, forniamo anche il quadro di analisi dettagliato, compresi i test statistici necessari per valutare le proprietà cellulari relative al concetto di famiglia cellulare25. Questo protocollo è già stato utilizzato con successo per descrivere il compartimento murino HSPC26,27.
Il seguente protocollo utilizza celle CD34+ arricchite magneticamente come materiale di partenza28. In questo modo, è possibile colorare e isolare in modo efficiente le HSPC umane da diverse fonti di sangue (ad esempio, sangue del cordone ombelicale, midollo osseo, sangue periferico). È importante non scartare la frazione CD34- , poiché verrà utilizzata come parte del protocollo per impostare diversi tipi di controlli sperimentali. Le quantità e i volumi di celle menzionati possono essere scalati verso l'alto o verso il basso, in base al flusso di lavoro sperimentale e alle necessità. Allo stesso modo, il protocollo può essere adattato allo studio di diversi tipi di progenitori, semplicemente modificando gli anticorpi utilizzati per lo smistamento cellulare e le fasi di citometria a flusso.
Protocollo
Per il seguente protocollo, il sangue del cordone ombelicale de-identificato è stato utilizzato come fonte HSPC e raccolto in conformità con le linee guida definite dalla biobanca del sangue del cordone ombelicale dell'ospedale Saint-Louis (autorizzazione AC-2016-2759) e con la Dichiarazione di Helsinki.
NOTA: prima di iniziare, assicurarsi che tutti i reagenti e le attrezzature necessarie per questo protocollo siano disponibili, come elencato nella tabella dei materiali e menzionato nel protocollo. Preparare i reagenti pertinenti freschi e non conservarli, a meno che non sia esplicitamente indicato.
1. Colorazione del colorante cellulare
NOTA: Questa sezione descrive la colorazione con quattro combinazioni di coloranti per divisione cellulare CFSE e coloranti viola (CTV). Elaborare tutti i tubi contemporaneamente, anche se non viene aggiunta alcuna soluzione di colorante cellulare. Tutte le fasi vengono eseguite in condizioni sterili per consentire la successiva fase di coltura cellulare. Tempo di percorrenza: circa 100 min.
- Elaborare l'unità di sangue del cordone ombelicale secondo un protocollo di selezione magnetica29. Assicurarsi che siano disponibili due frazioni: una frazione CD34- grande e una frazione CD34+ più piccola. Girare entrambi i tubi per 5 minuti a 300 x g. Aspirare il surnatante senza disturbare il pellet.
- Per la frazione CD34+ , risospenderla in 1 mL di terreno Eagle modificato (DMEM) di Dulbecco senza siero fetale bovino (FBS). Contare le cellule usando un emocitometro; la densità cellulare non deve essere superiore a 3 x 106 celle/ml. In tal caso, adattare il volume di conseguenza. Per la frazione CD34, risospendere in DMEM senza FBS e regolare il volume a un massimo di 6 x 106 celle/ml.
- Aliquot 250 μL della frazione CD34+ in quattro tubi di polipropilene da 15 ml. Etichettare le provette come segue: CD34+/CF (CFSE_only), CD34+/CV (CFSE_high CTV_low), CD34+/VC (CFSE_low CTV_high) e CD34+/VI (CTV_high). Aliquot 250 μL della frazione CD34- in altri quattro tubi di polipropilene da 15 ml. Etichettare le provette come segue: CD34-/CF (CFSE_only), CD34-/CV (CFSE_high CTV_low), CD34-/VC (CFSE_low CTV_high) e CD34-/VI (CTV_high). Le cellule rimanenti della frazione CD34- possono essere scartate.
- Preparare due soluzioni CFSE, denominate CFSE_high e CFSE_low. Per CFSE_high (10 μM), miscelare 1,1 mL di DMEM senza FBS con 2,2 μL di soluzione madre CFSE (5 mM). Per CFSE_low (5 μM), miscelare 550 μL di DMEM senza FBS e 0,55 μL di soluzione madre CFSE (5 mM).
- Aggiungere 250 μL della soluzione CFSE_high ai tubi CF e CV, 250 μL della soluzione CFSE_low ai tubi VC e 250 μL di DMEM senza FBS al tubo VI. Per garantire un mix efficiente di sospensione cellulare e colorante cellulare, inclinare il tubo di quasi 90 gradi e depositare le soluzioni CFSE sulla parete del tubo. Quindi, tenere il tubo verticalmente per miscelare le due soluzioni e pipettare tre o quattro volte per garantire una rapida miscelazione delle soluzioni CFSE con le celle risospese. Incubare a 37 °C per 8 minuti precisi.
- Dopo l'incubazione, aggiungere 5 ml di DMEM + 10% FBS. Mantenere i tubi a 37 °C per 5 minuti.
- Girare i tubi per 5 minuti a 300 x g. Rimuovere il surnatante mediante aspirazione senza disturbare il pellet e lavare il pellet con 5 ml di acido salino tamponato fosfato 1x/acido etilendiamminotetraacetico (PBS 1x/EDTA). Girare di nuovo per 5 minuti a 300 x g. Scartare il surnatante senza disturbare il pellet e risospendere il pellet cellulare in 250 μL di 1x PBS / EDTA.
- Preparare due soluzioni CTV, denominate CTV_high e CTV_low. Per CTV_high (10 μM), miscelare 1,1 mL di PBS 1x/EDTA e 2,2 μL di CTV stock (5 mM). Per CTV_low (5 μM), miscelare 550 μL di PBS 1x/EDTA con 0,55 μL di CTV (5 mM).
- Aggiungere 250 μL della soluzione CTV_high alle provette VC e VI, 250 μL della soluzione CTV_low alla provetta CV e 250 μL di 1x PBS /EDTA alla provetta CF. Utilizzare la stessa tecnica descritta nel passaggio 1.5. Incubare a 37 °C per 8 minuti precisi.
- Dopo l'incubazione, aggiungere 5 ml di DMEM + 10% FBS. Conservare a 37 °C per 5 min.
- Girare i tubi per 5 minuti a 300 x g, scartare il surnatante senza disturbare il pellet, quindi lavare il pellet con 5 ml di 1x PBS / EDTA. Girare di nuovo per 5 minuti a 300 x g.
- Scartare il surnatante senza disturbare il pellet e risospendere le frazioni CD34- in 1x PBS / EDTA per una concentrazione finale di 1,5 x 106 cellule / ml. Risospendere le frazioni CD34+ in 40 μL di tampone colorante e trasferire le cellule in provette da 1,5 ml.
2. Colorazione anticorpale
NOTA: La colorazione degli anticorpi può essere personalizzata in base alle esigenze sperimentali. Solo le frazioni CD34+ subiscono la colorazione anticorpale; le frazioni CD34- sono utilizzate come singolo controllo di colorazione per le combinazioni di coloranti per la divisione cellulare (frazioni CV, VC, CF e VI). Il seguente pannello è concepito per il rilevamento di quattro tipi di HSPC: cellule staminali ematopoietiche (HSC), progenitori multipotenti (MPP), progenitori multipotenti innescati da linfoidi (LMPP) e cellule progenitrici ematopoietiche (HPC)12. Tuttavia, viene presentata l'identificazione di HSC e MPP. Tempo di percorrenza: 75 min.
- Preparare la singola colorazione per la colorazione superficiale, utilizzando perline di compensazione. Mescolare sfere negative e sfere di immunoglobuline G (IgG) in un rapporto 1:1, per un volume totale equivalente a 20 μL x il numero di marcatori di superficie (ad esempio, 120 μL se il pannello di colorazione contiene sei anticorpi).
- Spedire 20 μL di perline in singoli tubi da 1,5 ml per ciascun marcatore. Aggiungere il volume corrispondente al fattore di diluizione per ciascun anticorpo nella provetta corrispondente (ad esempio, se il fattore di diluizione è 1:20, aggiungere 1 μL).
- Per colorare le cellule CD34+ , preparare un master mix di anticorpi12, basato sulla Tabella 1. Mescolare gli anticorpi in un singolo tubo da 0,5 ml. Aggiungere 7 μL dalla miscela principale di anticorpi a ciascuna delle quattro condizioni CD34+.
- Incubare le sfere di compensazione e i campioni CD34+ a 4°C per almeno 30 minuti.
NOTA: Il tempo di incubazione deve essere adattato ai dettagli tecnici degli anticorpi utilizzati per la colorazione. - Durante l'incubazione, preparare la piastra a fondo rotondo a 96 pozzetti da utilizzare per la selezione, aggiungendo 100 μL di terreno di coltura cellulare a ciascun pozzetto utilizzando una pipetta multicanale.
NOTA: Lasciare vuoti i pozzi H8-H12. - Etichettare 5 mL di tubi in polipropilene per i controlli di colorazione superficiale (5, utilizzando perline), i controlli dei coloranti di divisione cellulare (4, utilizzando le frazioni CD34) e i campioni CD34+ (4).
- Alla fine dell'incubazione, lavare le cellule e le perle con 1 ml di tampone colorante. Trasferire il volume totale nei tubi di polipropilene da 5 ml. Centrifugare i tubi per 5 minuti a 300 x g, quindi aspirare il surnatante senza disturbare il pellet.
- Risospendere le cellule nel tampone colorante, utilizzando circa 500 μL ciascuna per le perle e le cellule CD34+ e 1 mL per i tubi CD34- .
Tabella 1: Modello per preparare il mastermix di anticorpi per un esperimento di selezione cellulare. Clicca qui per scaricare questa tabella.
3. Ordinamento delle celle
NOTA: i numeri di celle ordinati possono variare in base alla quantità totale di celle disponibili. Nel protocollo, viene fornito un numero minimo di cella per ciascun controllo. Tempo di percorrenza (per un singolo piatto): 100 min.
- Apri l'esperimento modello o imposta un nuovo esperimento. Creare un singolo campione e più tubi, uno per ogni condizione.
- Impostare la strategia di gating descritta nella Figura 1, creando sei diagrammi a punti. Innanzitutto, visualizzare le celle su un grafico a punti FSC-A/SSC-A e fare doppio clic sullo strumento di gating poligonale per selezionare una popolazione con dispersione laterale bassa (Figura 1A). Nel seguente dot plot (FSC-A/FSC-H), fare clic con il tasto destro sul grafico e selezionare il cancello "Celle" dal menu a discesa facendo clic su di esso. Utilizzare lo stesso strumento di gating per selezionare una popolazione stretta sulla diagonale tra i due assi (Figura 1B).
- Nel terzo dot plot (APC vs. FSH-H), visualizzare la popolazione "Single Cells" e gate le celle negative per l'espressione del lignaggio APC (Lin) (Figura 1C). Nel quarto grafico (CFSE vs. CTV), visualizzare la popolazione "Lin-" e creare quattro porte separate, una per ogni combinazione di coloranti (Figura 1D).
NOTA: Queste porte devono essere strette, per selezionare solo una piccola frazione di celle omogeneamente colorate. - Utilizzare il quinto e il sesto grafico (APC-Cy7 vs. BV650 e PE-Cy7 vs. PE) per identificare i progenitori di interesse. Eliminare generosamente la popolazione CD34+CD38- e la CD34+CD38+ nel quinto grafico (Figura 1E). Quindi, selezionare la popolazione CD34 + CD38- nel sesto grafico e disegnare tre porte, secondo la Figura 1F.
- Eseguire i singoli tubi di colorazione contenenti le sfere di compensazione, facendo clic sul pulsante Acquisisci . Regolare le tensioni del tubo fotomoltiplicatore (PMT) dal menu a discesa Parametri , in particolare per i coloranti di divisione cellulare (tra 104 e 105 su scala biesponenziale).
- Perfezionare la matrice di compensazione in base al pannello utilizzato per l'ordinamento, utilizzando la scheda Compensazione . Registra almeno 5.000 eventi nel cancello delle perline, facendo clic sul pulsante Registra .
- Eseguire le frazioni CD34- e controllare nuovamente la matrice di compensazione. Registra almeno 10.000 eventi nella porta a cella singola.
- Eseguire le frazioni CD34+ , registrando almeno 5.000 eventi nella porta a cella singola. Regolare il cancello per ogni combinazione di coloranti, impostando un cancello stretto per selezionare una popolazione omogenea (Figura 1D). Allo stesso modo, regolare il gating per selezionare HSC e MPP.
- Una volta completata l'analisi e registrati tutti i tubi, inserire la piastra nell'apposito supporto, dopo aver eseguito la calibrazione Aria standard per lo smistamento su piastre a 96 pozzetti. Si consiglia di raffreddare la piastra.
- Prepara il modello di ordinamento delle lastre secondo lo schema presentato nella Tabella 2, utilizzando il layout di ordinamento dell'esperimento. I pozzi denominati "CD34-" contengono 5.000-10.000 cellule, ordinate sul gate CF/CV/VC/VI. I pozzetti "Bulk" contengono almeno 500 cellule, ordinate sul gate CD34+CD38-. Infine, i pozzetti unicellulari contengono solo un evento per combinazione di coloranti per divisione cellulare per pozzetto, quindi quattro eventi per pozzetto in totale.
NOTA: Le popolazioni "Bulk" possono essere adattate a specifici sottogruppi di progenitori; Non ordinare meno di 500 celle. - Per l'ordinamento, procedere in ordine, completando ogni combinazione di coloranti per divisione cellulare prima di passare a quella successiva. Ad esempio, iniziare con l'ordinamento del CD34-CF , in modalità di purezza della resa . Fare clic sul pulsante acquisisci, quindi sul pulsante di ordinamento.
- Al termine dell'ordinamento CD34, inserire il tubo CF CD34+ . Acquisisci, quindi fai clic sul pulsante di ordinamento, assicurandoti di aver spuntato 0/ 16/0 come grado di purezza. Infine, ordina le celle di interesse, una cella per pozzetto, in purezza a cella singola , assicurandoti di spuntare l'opzione Index Sorting .
- Passare alla seguente combinazione di coloranti a divisione cellulare, ripetendo lo stesso ordine. Come riferimento, la tabella 2 fornisce un esempio di una lastra ordinata.
Nota : la funzione di ordinamento dell'indice genera singoli file per ogni condizione ordinata. - Al termine dell'ordinamento, esportare i file come file con estensione fcs 3.0. Mettere le cellule in un incubatore a 37 °C, 5% CO2 . Le cellule vengono coltivate per più giorni, secondo il disegno sperimentale, per almeno 24 h26.
Tabella 2: Modello per una piastra di selezione cellulare a 96 pozzetti, basato sui requisiti specifici per la successiva analisi della citometria a flusso. Clicca qui per scaricare questa tabella.
4. Analisi dei dati di ordinamento delle celle
NOTA: per convalidare la qualità dell'ordinamento delle celle, è necessaria l'analisi dei dati FACS prima di andare oltre. L'output principale di questo passaggio è la generazione di un foglio di calcolo contenente le intensità dei marcatori di ogni singola cella ordinata.
- Caricare i file .fcs 3.0 nel software di analisi.
- Verificare l'impostazione di compensazione utilizzata durante l'ordinamento delle celle, utilizzando i singoli file di colorazione registrati prima dell'ordinamento effettivo.
- Impostare la strategia di gating rivista utilizzando i file corrispondenti al bulk diverso. Copiare e incollare tali gate nei file di ordinamento dell'indice.
- Verificare che le celle ordinate con indice siano cadute nel gate impostato. Se sono presenti alcune celle ordinate che sono state erroneamente controllate, possono essere identificate esportando le coordinate delle piastre registrate durante l'ordinamento degli indici e rimosse successivamente nell'analisi.
- Esportare l'evento dai file di ordinamento dell'indice come parametri compensati. Esportali come file .csv, spuntando le opzioni "valori di scala" e "parametri compensati". Questi file devono essere esportati in una cartella denominata "File esportati".
- Combinare tutti i file in un unico file .csv, utilizzando lo script in File supplementare 1. Impostare il percorso corretto con la funzione "setwd". L'output di questo script è un foglio di calcolo contenente tutti gli eventi controllati in modo diverso e le intensità relative per tutti i parametri.
5. Colorazione anticorpale dopo la coltura
NOTA: eseguire questa parte del protocollo in condizioni sterili; Diversi reagenti sono condivisi con i passaggi precedenti e devono rimanere sterili. Per l'analisi della citometria a flusso, utilizzare un citometro a flusso con un lettore di piastre. Ciò consente di eseguire la colorazione direttamente nella piastra di coltura tissutale, riducendo al minimo la perdita cellulare limitando la quantità di pipettaggio e rotazione. Preparare la colorazione monocolore del marcatore superficiale utilizzando le perline di compensazione, ad eccezione dei pozzetti A1-A4, che rappresentano la colorazione singola per i colori CF/CV/VC/VI e sono già presenti nella piastra a 96 pozzetti. Le popolazioni di massa ordinate in base al colorante cellulare aiutano a impostare la strategia di gating per il numero di divisioni e il gating generale. Tempo di percorrenza: 120 min.
- Prima di iniziare il protocollo, contrassegnare i pozzetti che contengono almeno una cellula controllando la piastra al microscopio invertito. Questo passaggio permette di ottimizzare la quantità di anticorpi utilizzati per la colorazione e velocizza la procedura.
- Preparare il mastermix di anticorpi, secondo la Tabella 3. Poiché esiste una quantità significativa di pipettaggio, la tabella considera l'errore tecnico dovuto al pipettaggio, incluso un volume aggiuntivo del 5%. Gli anticorpi descritti nella tabella consentono di caratterizzare una gamma di HSPC da campioni di sangue del cordone ombelicale umano12.
- Centrifugare la piastra per 5 minuti a 300 x g. Capovolgere rapidamente la piastra sotto il cappuccio e sopra un tovagliolo di carta, per rimuovere il surnatante.
- Aggiungere 8 μL di tampone colorante ai pozzetti A1-A4. Aggiungere 8 μL della miscela agli altri pozzetti.
- Mescolare le sfere negative e le sfere di compensazione IgG in un rapporto 1:1, per un volume totale equivalente a 120 μL. Spedire 20 μL in un tubo da 1,5 mL per ciascun marcatore. Aggiungere il volume dell'anticorpo corrispondente al fattore di diluizione (ad esempio, se il fattore di diluizione è 1:20, aggiungere 1 μL).
NOTA: Adattare il volume totale al numero di marcatori utilizzati per la colorazione (ad esempio, 100 μL se il pannello di colorazione contiene cinque anticorpi). - Incubare la piastra e i controlli di compensazione della singola colorazione a +4 °C, per almeno 30 min.
NOTA: Il tempo di incubazione deve essere adattato ai dettagli tecnici degli anticorpi utilizzati per la colorazione. - Lavare le perline con 1 mL di tampone colorante. Trasferire il volume totale nei tubi di polipropilene da 5 mL precedentemente etichettati. Centrifugare le provette per 5 minuti a 300 x g, quindi rimuovere il surnatante tramite aspirazione.
- Lavare le celle nella piastra aggiungendo 100 μL di tampone colorante per pozzetto utilizzando una pipetta multicanale. Centrifugare la piastra a 300 x g per 5 minuti, quindi capovolgere rapidamente la piastra sotto il cofano e sopra un tovagliolo di carta, per rimuovere il surnatante.
- Risospendere le celle in 85 μL di tampone colorante, utilizzando una pipetta multicanale.
- Avviare l'analisi sul citometro a flusso (modalità Acquisizione), utilizzando la dima dedicata e cliccando su personalizzato. Questo modello personalizzato prende in considerazione le caratteristiche tecniche della piastra a fondo rotondo a 96 pozzetti, in particolare le dimensioni di ciascun pozzetto (diametro, profondità e spessore). La sonda deve raggiungere il fondo del pozzo, quindi posizionarla al centro esatto dei pozzi A1 e H12.
- Dopo aver selezionato i fluorofori di interesse dalla lista proposta dal software, impostare il setup della piastra seguendo il modello di piastra della Tabella 2, corretto per il numero di pozzetti contenenti almeno una cella.
- Selezionare 100 μL come limite del volume di acquisizione. Spuntare l'opzione di agitazione . Impostare la velocità di acquisizione su 1 μL/s max, poiché una velocità inferiore migliora il volume totale analizzato per pozzetto.
- Aggiungere le soluzioni di pulizia e lavaggio appropriate ai pozzetti H8-H12. Il modello nella Tabella 2 lascia specificamente vuoti i pozzi H8-H12, poiché il citometro a flusso deve eseguire una serie di condizioni di lavaggio alla fine dell'analisi.
NOTA: Questo passaggio è adattato alle specifiche del citometro a flusso utilizzato. - Nella sezione Grafici e gate, impostare innanzitutto il cancello a cella singola, utilizzando il grafico a dispersione FSC-A/SSC-A, quindi il grafico a dispersione FSC-H/FSC-A. Creare un istogramma per ogni indicatore di interesse.
- Una volta confermate le impostazioni, passare alla sezione Analisi . Analizzare prima la singola colorazione, registrando non meno di 5.000 eventi (range ottimale: 5.000-15.000 eventi), sia per le perle di compensazione che per le frazioni colorate con CD34. Regolare le tensioni se necessario.
- Una volta registrate tutte le singole colorazioni, è possibile avviare l'acquisizione vera e propria, cliccando sulla funzione Acquisizione .
Tabella 3: Mastermix di anticorpi per un esperimento di citometria a flusso, in particolare per l'identificazione di HSPC da sangue del cordone ombelicale umano. Clicca qui per scaricare questa tabella.
6. Analisi dei dati di citometria a flusso post-coltura
NOTA: l'analisi dei dati descritta è specifica per il software menzionato nella tabella dei materiali. L'output principale è la generazione di un foglio di calcolo contenente informazioni per l'intensità del marcatore di superficie, il numero di divisioni e la parentela per ogni cella analizzata. In questa parte del protocollo è incluso uno script scritto in R, necessario a questo flusso di lavoro per generare il foglio di calcolo dell'analisi finale.
- Esportare i file dal citometro a flusso come file .fcs. Caricali sul software di analisi, raggruppandoli come "colorazione singola", "bulk" e "single cell".
- Preparate una matrice di compensazione utilizzando i singoli file di colorazione e applicatela agli altri due gruppi mediante trascinamento della selezione.
NOTA: Se viene utilizzato uno strumento di compensazione automatica, controllare manualmente la qualità prima di procedere ulteriormente. - Per avere un gating rappresentativo, concatenare i diversi pozzi di massa in un unico file. Questo passaggio evidenzia rapidamente se due colori si sovrappongono (tipicamente CV e VC) o altre anomalie e quindi devono essere esclusi. Dopo aver cliccato sull'opzione concatenate popolazioni, selezionare tutti i parametri non compensati dal menu "parametri", quindi fare clic su concatena.
- Caricare il file concatenato nell'area di lavoro, quindi applicare la matrice di compensazione tramite trascinamento della selezione.
- Preparare la strategia di gating definita nella Figura 2 utilizzando il file concatenato. Nel gate a cella singola, visualizzare gli eventi su un grafico a dispersione con CFSE e CTV. Create un primo gate denominato Etichettato, includendo tutti e quattro i colori ed escludendo la possibile autofluorescenza (Figura 2C). Quindi, cancellare ogni colore singolarmente.
- Le celle etichettate con CV e VC necessitano di un valore trasformato, considerando che il colore è il risultato dei segnali CFSE e CTV. I due segnali coordinati vengono quindi ruotati su una scala logaritmica di 45°, per consentire alla diluizione della divisione di procedere in parallelo all'asse x. Questo valore trasformato viene derivato manualmente, facendo clic su Strumenti e quindi su Derive parametro. Incollare la formula seguente nella casella della formula :

NOTA: L'equazione26 assume che CFSE e CTV siano parametri 03 e 17. - Per visualizzare correttamente questo nuovo parametro denominato Parametro derivato, impostare un asse lineare compreso tra ~3 e 7, facendo clic sull'opzione Parametro asse e selezionando Personalizza asse.
- Applicare il gating a ciascun colore singolarmente come grafico di istogramma: per CF e VI, impostare CFSE-A e CTV-A sull'asse x, rispettivamente. Per CV e VC, impostate il nuovo parametro derivato sull'asse x. Impostare le porte corrispondenti a ciascun picco, come mostrato nella Figura 3.
- Applicare il gating a ogni singolo pozzetto a cella singola. Assicurati di aggiungere il parametro derivato a ogni pozzo analizzato. Verificare manualmente ogni porta colore per ogni pozzetto, per rilevare gli eventi assegnati in modo errato a un determinato picco. Esempi di gating sono illustrati nella Figura 4.
- Dopo che l'analisi è stata completata e tutti i pozzi sono stati verificati, selezionare tutti i gate CF/CV/VC/VI che contengono almeno una cella. Esportali come file .csv, spuntando le opzioni "valori di scala" e "parametri compensati". Questi file vengono esportati in una cartella denominata "File esportati".
- Combinare tutti i file in un unico .csv, utilizzando lo script R nel file supplementare 1. Ricordarsi di impostare il percorso giusto con la funzione "setwd". L'output di questo script è un foglio di calcolo contenente tutti i diversi eventi gated e le relative intensità per tutti i parametri.
- Aprire il foglio di calcolo e rinominare le colonne per ciascun parametro, ad esempio utilizzando i seguenti nomi: CFSE, CTV, CD90, CD123, CD45RA, CD34, CD38. Questi nomi verranno utilizzati per identificare la soglia di gating per assegnare correttamente a ciascuna cella la propria identità.
- Aggiungi sei colonne denominate "Well", "Condition", "Color", "Generation", "Original_cell" e "Culture_time". Queste variabili sono quelle definite sperimentalmente e sono dedotte da ogni riga:
export_A10 CD34 + PBS_CV_Peak 1.csv.1 = A10 (bene), CD34+ (Original_cell), PBS (Condizione), CV (Colore) Peak_1 (Generazione). - Esportare i pozzi di massa per identificare i valori soglia per il gating: esportare la popolazione compensata di interesse (ad esempio, CD34 + CD38-) come file .csv, spuntando le opzioni "valori di scala" e "parametri compensati". Esporta questi file in una cartella denominata "File esportati".
- Per trovare la soglia per CD38, identificare il valore numerico massimo per questo parametro. Al contrario, per trovare la soglia per CD34, identificare il valore numerico più piccolo per questo parametro. Ripeti questo processo per tutti i parametri di interesse.
NOTA: Per l'analisi presentata nel protocollo, il marcatore CD45RA viene utilizzato sia per identificare LMPP nel gate CD34+CD38- che CMP/GMP nel gate CD34+CD38+. Ciò significa che è necessario estrarre due diversi valori di soglia per questo marcatore. - Copiare e incollare i valori di soglia in un file excel chiamato "gating_matrix". Questo file è organizzato secondo la Tabella 4 e consente l'analisi di più esperimenti indipendenti. È molto importante nominare ogni colonna esattamente con questo schema: XXYYMMDD_xxh, dove XX sta per le due iniziali dell'operatore, YY gli ultimi due numeri per l'anno, MM per il mese, DD per il giorno e xx per il punto temporale di analisi.
Tabella 4: Matrice di Gating per l'assegnazione del destino cellulare, prima dell'analisi statistica. CD45h si riferisce all'intensità di CD45RA per il gating del sottogruppo HPC, mentre CD45l si riferisce all'intensità di CD45RA per i sottogruppi CD34+CD38- . Clicca qui per scaricare questa tabella.
7. Analisi statistica
NOTA: il test statistico dei dati generati comporta una pipeline di analisi personalizzata, codificata utilizzando il linguaggio di programmazione Python (Supplemental File 2, Supplemental File 3 e Supplemental File 4). Lo script è organizzato in tre blocchi: il primo per l'elaborazione del foglio di calcolo, il secondo blocco per generare la mappa di calore per la visualizzazione dei dati e l'ultimo blocco per generare più istogrammi per analizzare e testare le proprietà di differenziazione e divisione.
- A partire dal blocco "0_process_data" (Supplemental File 2), assicurarsi che i percorsi gating_matrix e del foglio di calcolo dei dati siano definiti correttamente nello script.
- Definire il dizionario "cell_cols", per assegnare i destini delle celle rilevanti a ciascuna cella. Nel caso specifico, i destini sono HSCs, MPPs, LMPPs, progenitori mieloidi comuni (CMPs), progenitori granulo-monocitici (GMPs), progenitori megacariociti-eritroidi (MEPs), e CD34-.
- Utilizzando i valori di soglia definiti dai pozzetti di massa (punto 6.16), definire la funzione "cell_class_exp_time". È essenziale essere coerenti nella denominazione delle colonne, per definire correttamente queste soglie, utilizzando lo stesso nome utilizzato per definire ogni colonna nel passaggio 6.12.
- I fenotipi cellulari sono definiti nello script utilizzando una serie di affermazioni "if-else", basate sulle soglie rilevate durante l'analisi della citometria a flusso.
NOTA: è possibile visualizzare fenotipi diversi modificando queste istruzioni per adattarsi ad altre combinazioni di marcatori. - Specificare le condizioni specifiche sperimentali, utilizzando la funzione "cond_rule" (ad esempio, diversi trattamenti sperimentali). Per il set di dati fornito, le condizioni sono denominate "GT" e "Diff". Descrivere i due diversi terreni di coltura cellulare utilizzati per la coltura delle cellule. Queste informazioni verranno utilizzate dal blocco "1_dot_plot" (file supplementare 3) per tracciare la mappa di calore.
- Nel blocco "2_bar_plot" (file supplementare 4), definire il dizionario "class_dct", compresi i destini delle celle discrete di interesse. Per il set di dati fornito, i destini delle celle di interesse sono gli stessi descritti per il dizionario "cell_cols".
- Definisci "conds" (condizioni), "or_cells" (cella originale), "sym_labs" (etichette di simmetria) e "times" (il punto temporale sperimentale). Questi sono filtri ripetuti necessari per la tracciatura. "conds" riprendono le condizioni definite in "cond_rule", "or_cells" sono HSC e MPP e "sym_labs" descrivono il tipo di divisioni.
- Nel blocco "2_bar_plot", è possibile tracciare celle che sono progredite fino alla divisione 6.
Nota : il set di dati fornito include solo celle fino alla divisione 4, quindi viene visualizzato un messaggio di errore, ma ciò non impedisce il funzionamento dello script. - Le figure generate dallo script possono essere recuperate nella cartella denominata "figure" come file pdf. I file denominati "Test" rappresentano i diversi test statistici eseguiti per l'istogramma corrispondente.
Risultati
Smistamento FACS
Le strategie di smistamento presentate in questo protocollo si basano su strategie ampiamente accettate 12,30,31. Per la strategia di gating presentata nella Figura 1, il materiale di partenza sono i progenitori del sangue del cordone ombelicale precedentemente purificati tramite arricchimento magnetico CD34+, il che spiega la percentuale trascurabile di cellule positive al lignaggio. È essenziale utilizzare porte strette per le quattro combinazioni di coloranti intracellulari (ad esempio, il CTV nella figura), per migliorare la risoluzione dei picchi durante l'analisi successiva e per bloccare la corretta popolazione cellulare (Figura 1D). Nel caso visualizzato nella figura, le porte selezionano per la popolazione più grande e meglio definita. La presenza di popolazioni multiple e vicine per ogni combinazione di coloranti a divisione cellulare non è, nella nostra esperienza, rappresentativa delle differenze biologiche. Invece, potrebbe indicare a) una procedura di colorazione non ottimale, o b) una grande eterogeneità (specialmente nelle dimensioni) nel pool iniziale di cellule. Ciò non è inaspettato quando si parte dal sangue del cordone ombelicale o da altre fonti biologiche complesse (ad esempio, aspirati del midollo osseo, sangue periferico). Se il gate non è ben definito, la progressiva diluizione delle diverse combinazioni di coloranti può portare alla fusione dei picchi successivi, in particolare per le condizioni CV e VC (Figura 2D). Un'altra conseguenza negativa di un gating subottimale è l'incapacità di distinguere in modo efficiente i diversi picchi dopo la coltura cellulare, poiché una popolazione iniziale eterogenea può portare a picchi poco profondi.
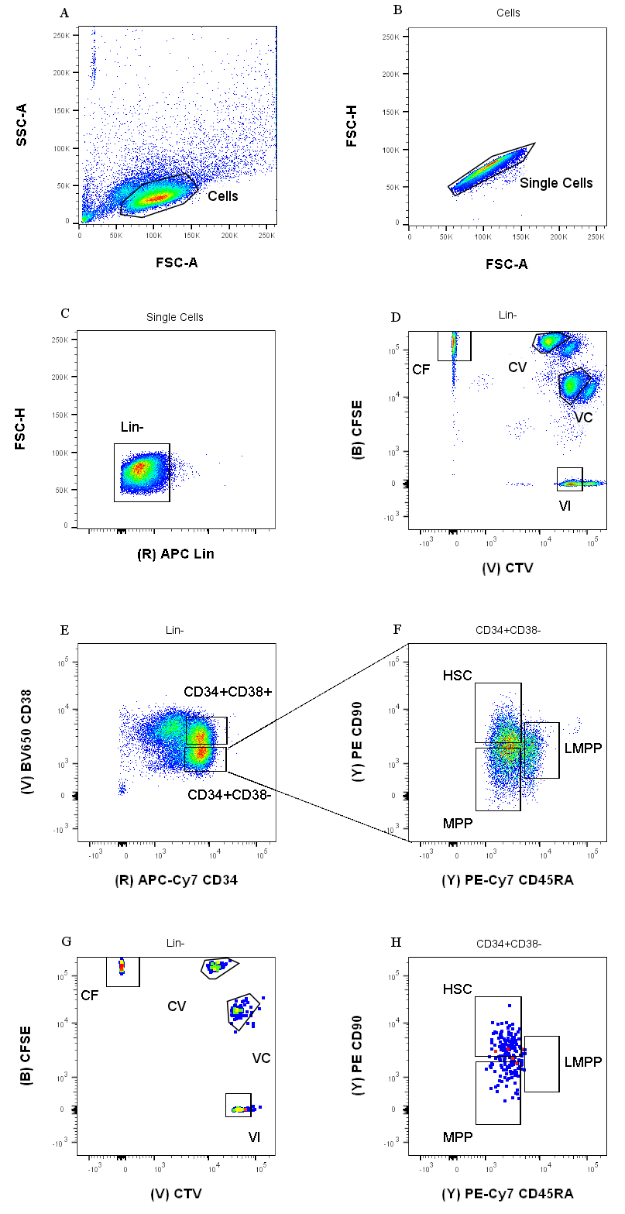
Figura 1: Strategia di gating per lo smistamento delle celle. (A) FSC-A contro SSC-A, per escludere detriti e cellule contaminanti. (B) FSC-A contro FSC-H, per escludere doppiette e grumi di cellule. (C) Lin contro FSC-H, per escludere le celle che sono Lin+. (D) CTV contro CFSE, per identificare univocamente le cellule colorate con le combinazioni di coloranti CF, CV, VC e VI. Le porte dovrebbero essere abbastanza rigorose da includere una popolazione omogenea. (E) CD34 versus CD38, per separare i progenitori ristretti CD34+CD38+ (chiamati anche HPC) dal compartimento multipotente CD34+CD38-. (F) CD45RA versus CD90, dalla popolazione CD34+CD38-, per separare tra i progenitori più immaturi arricchiti nell'HSC (CD90+CD45RA-), nel LMPP (CD90midCD45RA+) e nel più impegnato MPP (CD90-CD45RA-). (G) Indice degli eventi ordinati, qui rappresentati per la loro colorazione combinata di coloranti cellulari e (H) l'espressione dei marcatori di superficie CD90 e CD45RA. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Analisi citometrica a flusso dopo coltura cellulare
I dati in Figura 2 sono rappresentativi delle HSC del sangue del cordone ombelicale umano, tenute in coltura per 72 ore, in presenza di citochine multiple in grado di supportare una serie di progenitori e precursori mieloidi. I pannelli da 2A a 2D rappresentano il gating necessario per stabilire la parentela di ciascuna delle singole cellule, mentre i pannelli da 2E a 2G consentono la fenotipizzazione cellulare. La ridotta presenza di deputati nella figura è probabilmente la conseguenza delle condizioni colturali utilizzate per questo esperimento rappresentativo (figura 2F). L'uso di diverse citochine e condizioni di coltura altera la percentuale relativa di ciascun sottoinsieme, in modo simile alla selezione di diverse cellule di partenza per l'esperimento.
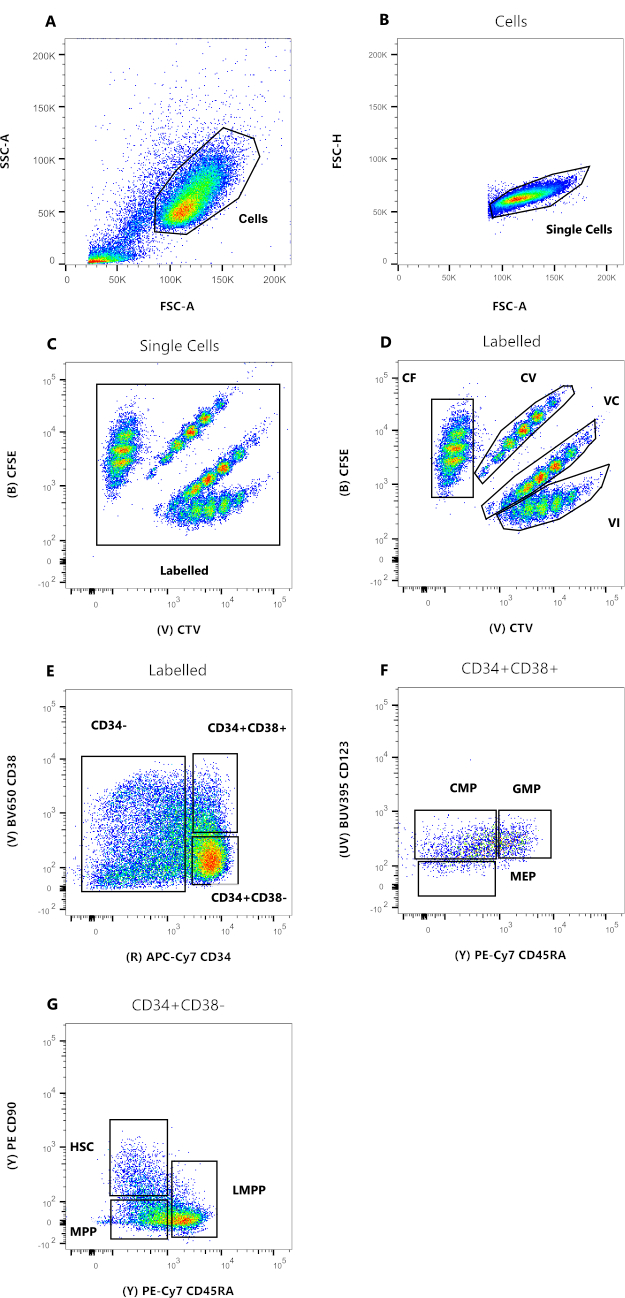
Figura 2: Strategia di gating per l'analisi della citometria a flusso. (A) FSC-A contro SSC-A, per escludere detriti e cellule contaminanti. (B) FSC-A contro FSC-H, per escludere doppiette e grumi di cellule. (C) CTV versus CFSE, il gate Labeled permette di escludere qualsiasi evento auto-fluorescente che potrebbe influenzare la risoluzione dei dati. (D) CTV contro CFSE. È estremamente importante controllare rigorosamente le quattro popolazioni, in base alle diluizioni del colorante a divisione cellulare. (E) CD34 versus CD38, per distinguere tra precursori impegnati (CD34-), progenitori ristretti (HPC) (CD34+CD38+) e progenitori immaturi (CD34+CD38-). (F) CD45RA versus CD123, per distinguere tre tipi di progenitori ristretti: CMP (CD123+CD45RA-), MEP (CD123-CD45RA-) e GMP (CD123+CD45RA+). (G) CD45RA rispetto a CD90, dal CD34+CD38-, per identificare HSC, LMPP e MPP. Fare clic qui per visualizzare una versione più grande di questa figura.
Le fasi di definizione e assegnazione dei picchi (Figura 3 e Figura 4) sono aspetti cruciali del protocollo e richiedono la definizione di porte rigorose. Per la definizione del picco (Figura 3), sono necessari almeno 1.000 eventi per un'identificazione affidabile. In questo senso, potrebbe essere utile isolare più cellule durante la fase di selezione delle cellule per i pozzi "Bulk". La Figura 4 descrive quattro esempi di pozzi singoli contenenti più famiglie. Questa figura chiarisce l'importanza del gating Figure 2D e Figure 3, in particolare per l'identificazione di ogni famiglia e di ogni picco. La Figura 4A illustra un esempio semplice, poiché tutte le celle nel gate CF sono molto vicine tra loro e possono essere facilmente assegnate a un singolo picco. La Figura 4C mostra un altro esempio di famiglia distribuita univocamente su due picchi ben separati, come è chiaramente visualizzato nell'istogramma della Figura 4D. La figura 4E,G rivela l'importanza di un gating rigoroso basato su un gran numero di eventi; Entrambi mostrano pochi eventi vicini, ma al di fuori dei cancelli della combinazione di coloranti. Tali eventi potrebbero essere erroneamente inclusi nelle porte VI e CF, basandosi esclusivamente sull'analisi del singolo pozzo. Infine, la Figura 4F,H mostra due diversi esempi di famiglie distribuite su più picchi, con un esempio di due picchi di intensità simili (Figura 4F) e uno con due picchi di intensità disuguali (Figura 4H).
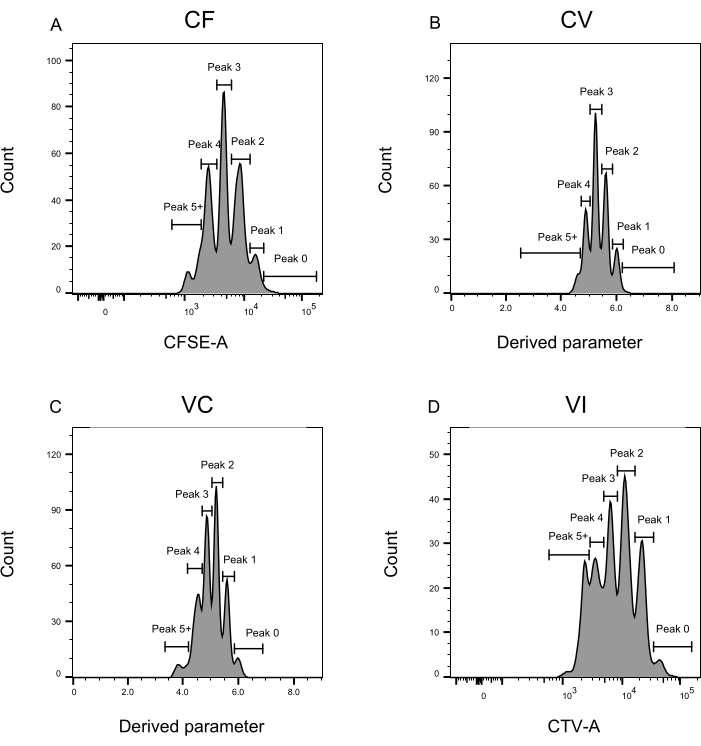
Figura 3: Definizione dei picchi per l'analisi della citometria a flusso. (A-D) I picchi dovrebbero essere definiti registrando almeno 500 eventi, per assicurare una buona rappresentazione per ogni singolo picco. (A) Istogramma per l'intensità CFSE-A. Si possono identificare diversi picchi, ognuno corrispondente a una diversa popolazione di cellule in divisione. (B,C) Istogrammi per l'intensità del parametro derivato, che rappresentano rispettivamente la miscela CFSE-CTV, CV (B) e VC (C). (D) Istogramma per l'intensità del CTV-A. Fare clic qui per visualizzare una versione ingrandita di questa figura.
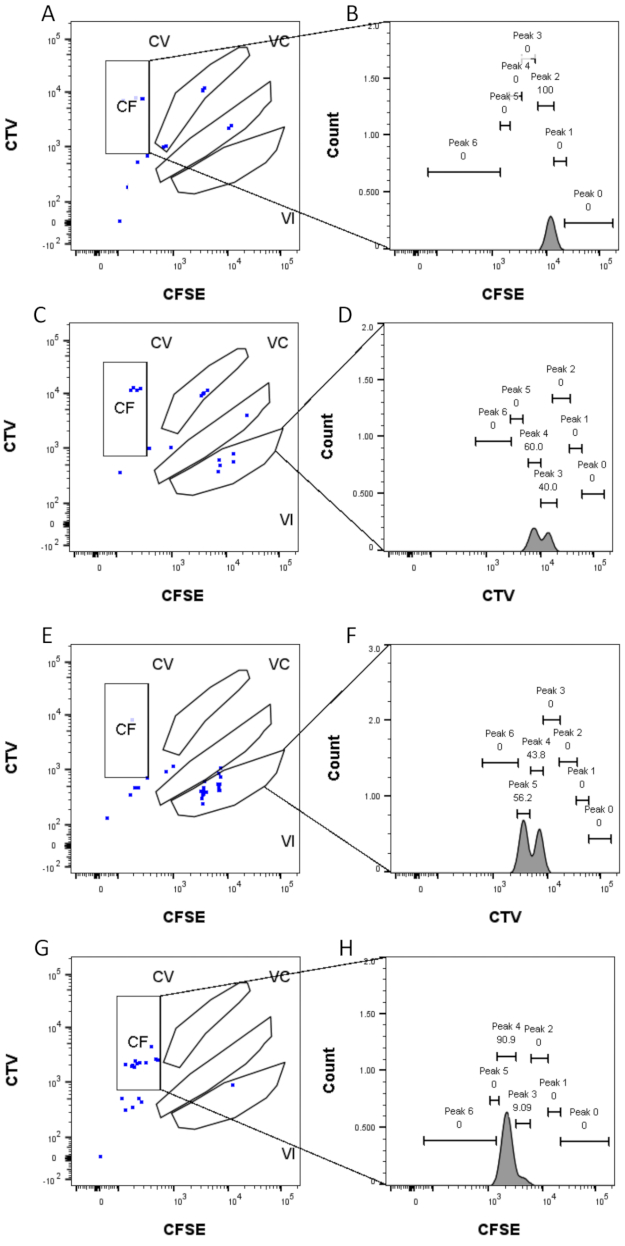
Figura 4: Assegnazione dei picchi . (A,B) Un solo picco può essere rilevato per questo pozzo, nel cancello CF. (C,D) Due picchi di intensità quasi uguale possono essere rilevati in questo pozzo, nella porta VI. Le cime sono ben risolte. (E,F) Due picchi di intensità comparabile possono essere rilevati in questo pozzo, nella porta VI. Sono stati considerati solo gli eventi nel cancello, in base alla strategia impostata utilizzando i pozzi di massa. (G-H) Due picchi di intensità disuguale possono essere rilevati in questo pozzo, nel gate CF. Fare clic qui per visualizzare una versione più grande di questa figura.
Rappresentazione dei dati e test statistici
La figura 5 mostra diversi tipi di rappresentazione dei dati di due esperimenti separati, entrambi eseguiti dopo 72 ore di coltura cellulare. HSC e MPP sono stati coltivati in due diversi terreni di coltura cellulare, che dovrebbero alterare la divisione cellulare e le proprietà di differenziazione. Questi supporti sono denominati "Diff" (Differenziazione)32 e "GT"33; il primo promuove la differenziazione mieloide ed eritroide, in quanto contiene eritropoietina (EPO) e fattore stimolante le colonie granulo-monocitiche (GM-CSF), mentre il secondo è stato sviluppato nel contesto di studi clinici di terapia genica, con l'obiettivo di mantenere e amplificare un'alta percentuale di HSPC. La figura 5A è una mappa di calore rappresentativa per la condizione "Diff", che rappresenta una varietà di famiglie cellulari, sia nei destini delle cellule che nelle divisioni. In questa mappa di calore, ogni riga rappresenta una singola famiglia, ogni quadrato una singola cella e le colonne raggruppano tutte le celle che si trovano nella stessa generazione (ad esempio, le celle della generazione 2 sono divise almeno due volte). È possibile distinguere famiglie altamente omogenee, composte da un singolo tipo di cellula e che mostrano lo stesso numero di divisioni (ad esempio, famiglia #63), e famiglie eterogenee, inclusi tre tipi di cellule nell'arco di due generazioni (ad esempio, famiglia #84). Poiché il tasso di recupero cellulare per questa analisi è di circa il 70%, le famiglie complete, che sono definite avendo tutte le loro cellule recuperate in generazioni possibilmente diverse (ad esempio, una famiglia di una cellula nella generazione 1 e due cellule nella generazione 2), sono raramente osservate (mostrando un hashtag accanto al loro numero ID nella Figura 5A). Ci sono molteplici spiegazioni che spiegano il rilevamento incompleto, che potrebbe essere tecnico (problema di colorazione, perdita di cellule dovuta al protocollo) o biologico (morte cellulare e / o apoptosi). Le limitazioni tecniche possono essere superate utilizzando un analizzatore progettato per ridurre il volume morto associato al singolo campione ed eseguendo la colorazione cellulare direttamente nella piastra di coltura cellulare per ridurre il pipettaggio del volume. Al contrario, i metodi ortogonali per determinare la quantità di morte cellulare (ad esempio, tramite esperimenti di imaging di cellule vive) possono aiutare a distinguere i fattori tecnici e biologici che determinano una rilevazione incompleta.
La figura 5Bi mostra come visualizzare l'effetto della condizione di coltura sulla composizione del tipo di cellula, come se si fosse eseguito un test di massa. Qui, la condizione Diff promuove un numero maggiore di destini e una percentuale più elevata di cellule CD34 + (definite come tutti i tipi di cellule tranne CD34-). Gli intervalli di confidenza vengono calcolati nello script tramite bootstrap di base, con 250.000 set di dati bootstrap34. Vale la pena notare che tutti gli altri istogrammi nella Figura 5 visualizzano intervalli di confidenza calcolati allo stesso modo. La tabella 5 riassume tutte le informazioni sul numero di famiglie e sul numero di celle in ogni generazione.
La figura 5Bii rappresenta graficamente l'output dei test statistici eseguiti nello script "2_bar_plot". Una descrizione formale del quadro statistico è disponibile26. In breve, questo quadro consente di testare le ipotesi statistiche assumendo che le cellule della stessa famiglia siano dipendenti (un'ipotesi che è di per sé verificabile), contrariamente alle statistiche classiche che richiederebbero indipendenza tra tutte le cellule osservate. Nel caso specifico presentato in figura, il test statistico mette in discussione l'ipotesi che le scelte di destino cellulare delle MPP, misurate come le frequenze dei diversi tipi cellulari presenti nella coltura, siano indipendenti dalle condizioni di coltura cellulare utilizzate. In primo luogo, la statistica G-test viene utilizzata per valutare la discrepanza tra le frequenze del tipo di cellula da diversi supporti cellulari (per l'esempio in Bii, questa statistica è rappresentata con la barra rossa). Quindi, viene eseguita una randomizzazione dei dati tramite permutazione, scambiando intere famiglie di cellule tra le due condizioni di coltura cellulare. Questo per preservare la dipendenza tra le cellule legate alla famiglia, mantenendo il numero di famiglie in ciascun set coerente con i dati originali. La statistica del G-test è calcolata dal set di dati randomizzati. I valori blu rappresentati in 5Bii sono la statistica G-test per 250.000 permutazioni. Infine, il valore p viene calcolato per valutare la misura in cui il set di dati originale si discosta dalla distribuzione di quelli permutati. Nell'esempio, la statistica originale si discosta in gran parte dalla distribuzione, risultando in un piccolo valore p e quindi respingendo l'ipotesi che il destino cellulare delle MPP sia indipendente dalle condizioni di coltura.
La figura 5C rappresenta la percentuale di famiglie cellulari per generazione massima, per esplorare come le diverse condizioni cambiano la divisione cellulare per famiglia di cellule. Questo grafico dei dati mostra che a 72 ore, le cellule coltivate nella condizione Diff completano un numero maggiore di divisioni rispetto alle cellule nella condizione GT. Rappresentato è il numero massimo di generazioni per ogni famiglia, quindi una famiglia che visualizza celle nelle generazioni 1 e 2 è considerata come generazione 2. Lo stesso quadro statistico utilizzato per la Figura 5B può essere utilizzato per testare statisticamente l'indipendenza tra divisione cellulare e condizione di coltura.
La Figura 5D esplora il tipo di simmetria/asimmetria della prima divisione per i diversi tipi di antenati (HSC o MPP). Per le famiglie cellulari complete della generazione 1 - l'unica generazione in cui è possibile stabilire definitivamente le due cellule figlie come cellule sorelle - possono essere definiti quattro diversi tipi di simmetria/asimmetria: l'etichetta "Sym Undiff" descrive le famiglie in cui entrambe le figlie mantengono il fenotipo della cellula di origine. "Sym Diff" significa che entrambe le figlie hanno lo stesso fenotipo, ed è diverso dalla cellula di origine. "Asym Undiff" significa che una figlia conserva solo il fenotipo della cellula di origine. Infine, "Asym Diff" descrive famiglie in cui entrambe le figlie hanno fenotipi diversi e nessuno di loro è uguale alla cellula di origine. Per ottenere potere statistico nella valutazione di questi destini simmetrici / asimmetrici, è auspicabile eseguire l'analisi MultiGen nei primi punti temporali, al fine di osservare più famiglie la cui progenie si trova nella generazione 1.
Infine, la Figura 5E rappresenta le percentuali dei tipi di celle in funzione del numero di divisioni, per ottenere informazioni sulla progressione del modello di differenziazione tra le divisioni. Ad esempio, i dati visualizzati nella figura suggeriscono che le cellule progrediscono allo stato CD34- , con oltre il 50% delle cellule rilevate in questa classe dopo solo tre divisioni. Inoltre, è possibile dedurre che le MPP non favoriscono la divisione di auto-rinnovamento, in quanto una piccola percentuale di cellule mantiene il fenotipo originale. Alcune di queste conclusioni possono quindi essere verificate utilizzando il quadro statistico presentato nelle figure precedenti.
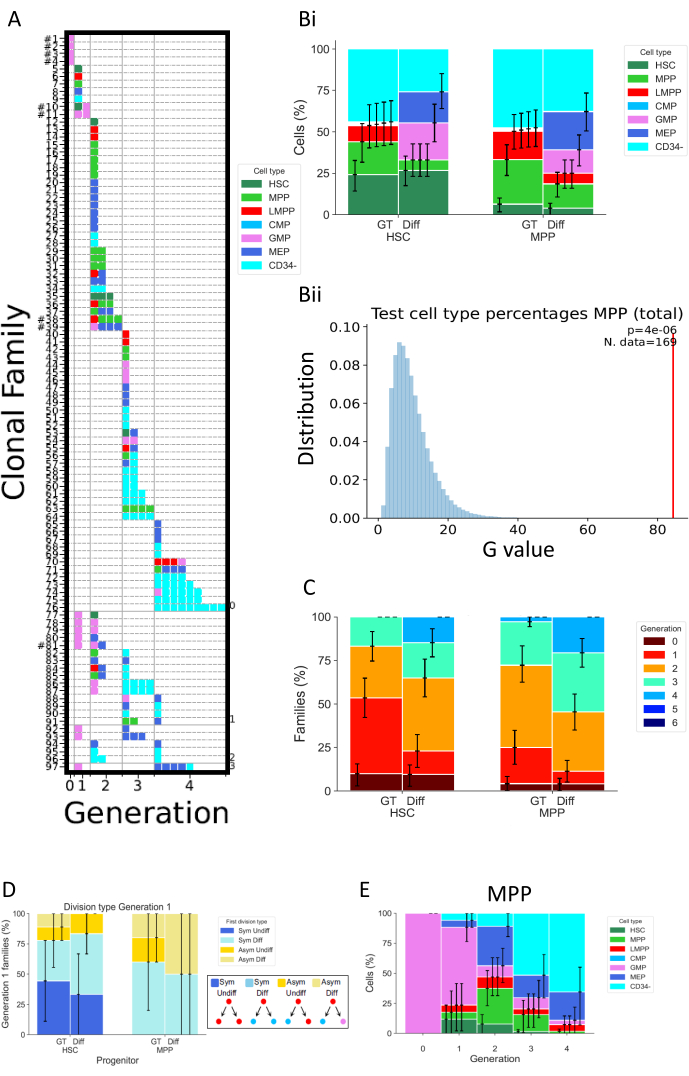
Figura 5: Esempio di rappresentazione dei dati per un esperimento di 72 ore utilizzando HSPC con sangue del cordone ombelicale. (A) Mappe di calore per un set di dati selezionato (HSC, nel mezzo "Diff", dopo 72 ore di coltura). I grafici rappresentano tutte le singole cellule (quadrati) in base alla loro parentela (righe), al numero di divisioni eseguite (colonne, chiamate generazione) e al fenotipo (colori). (Bi) Istogramma che confronta le proporzioni dei tipi cellulari delle progenie cellulari di HSC e MPP, tra la condizione GT e la condizione Diff. (Bii) Il grafico rappresenta i test statistici eseguiti nello script "2_bar_plot" per MPP a 72h di coltura, confrontando tra i cocktail di citochine "Diff" e "GT". Il valore sperimentale viene visualizzato in rosso e i valori generati tramite 250.000 permutazioni in blu. Il valore p. del G-test è indicato nell'angolo in alto a destra con il numero di famiglie utilizzate per il test. (C) Istogramma che confronta la percentuale di famiglie (314 famiglie in totale) in ciascuna generazione (codificata a colori), per HSC e MPP per condizione di coltura. Gli intervalli di confidenza vengono calcolati con 250.000 set di dati bootstrap. (D) Istogramma che rappresenta il tipo di simmetria/asimmetria tra il destino delle cellule figlie per le famiglie con due cellule della generazione 1: Sym Undiff (entrambe le figlie conservano il fenotipo della cellula di origine), Sym Diff (entrambe le figlie hanno lo stesso fenotipo, ed è diverso dalla cellula di origine), Asym Undiff (solo una figlia conserva il fenotipo della cellula di origine), e Asym Diff (entrambe le figlie hanno fenotipi diversi e nessuno di loro assomiglia alla cellula di origine). (E) Istogrammi del contributo dei tipi cellulari classificati per generazione per MPP coltivati con il cocktail "Diff"; n = 204 cellule e 97 famiglie. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 5: Descrizione del numero di famiglie e cellule analizzate per ciascuna condizione sperimentale (cellula di origine e terreno di coltura cellulare). Clicca qui per scaricare questa tabella.
File supplementare 1: Fare clic qui per scaricare questo file.
File supplementare 2: Fare clic qui per scaricare questo file.
File supplementare 3: Fare clic qui per scaricare questo file.
File supplementare 4: Fare clic qui per scaricare questo file.
Discussione
Il test MultiGen è un test ad alto rendimento, facile da eseguire e poco costoso, che è stato determinante per studiare i linfociti 23,24,35 e le cellule ematopoietiche murine26,27. Qui, presentiamo un nuovo sviluppo dell'approccio che consente di decifrare ex vivo la fase iniziale dell'impegno umano HSPC, a livello di singola cellula utilizzando colture a breve termine (Figura 6). I sistemi di coltura ex vivo a singola cellula sono tipicamente utilizzati per valutare il destino a lungo termine delle HSPC in cellule mature, ma alcuni destini si verificano prima di altri36, potenzialmente influenzando l'analisi verso un minor numero di destini. Inoltre, questi sistemi culturali di solito mancano di informazioni sulle divisioni durante l'impegno del destino. È stato dimostrato che i primi passi di impegno si verificano già all'inizio della cultura, a volte senza divisione26,37, rendendo la cultura a breve termine e la divisione di monitoraggio essenziali per studiare l'impegno precoce del destino. Seguendo simultaneamente il destino, la divisione e la parentela, questo test consente di comprendere il ruolo della prima divisione e la decisione del destino nelle HSPC umane. Utilizzando il test, è possibile dedurre dopo quante divisioni si verifica il processo di impegno, l'equilibrio tra auto-rinnovamento e differenziazione per quei primi progenitori e come tali proprietà vengono ereditate attraverso le generazioni. Per quanto ne sappiamo, questo è l'unico test che consente questo tipo di misurazioni per HSPC umani, a risoluzione singola cellulare. Inoltre, utilizzando diverse combinazioni di coloranti a divisione cellulare, abbiamo aumentato il throughput dell'analisi, rendendo questo test uno strumento prezioso per generare rapidamente set di dati di grandi dimensioni. Le combinazioni di coloranti consentono di seguire diverse famiglie negli stessi pozzetti, aumentando il numero di cellule disponibili per l'analisi in coltura a breve termine. Il numero di combinazioni potrebbe potenzialmente essere aumentato ancora di più, attraverso l'aggiunta di altri coloranti (ad esempio, colorante giallo) o modificando il rapporto tra CFSE e CTV. Tuttavia, questo riduce il numero di altri parametri che possono essere analizzati.
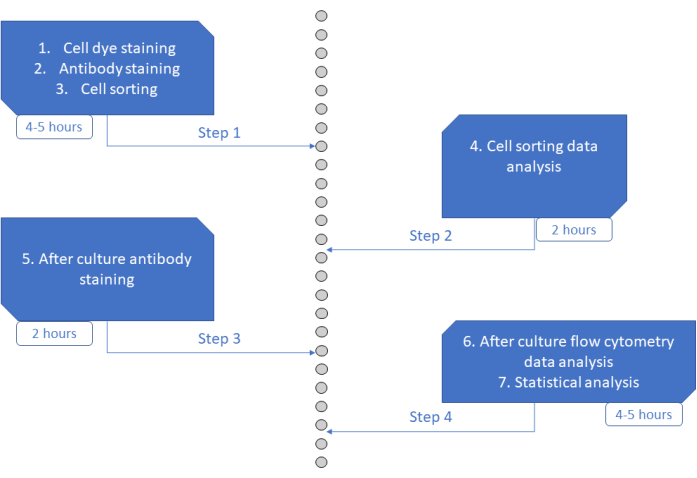
Figura 6: Rappresentazione schematica del protocollo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Per eseguire l'analisi con successo, a causa dell'elevato numero di pozzetti e del numero ridotto di cellule da analizzare, è necessario eseguire l'analisi della citometria a flusso su un analizzatore dotato di un lettore di piastre. La nuova generazione di analizzatori da banco è particolarmente adatta a questo test, poiché la maggior parte di essi ha un volume morto più piccolo per ridurre la percentuale di perdita cellulare. Questo a sua volta garantisce una maggiore efficienza nel recupero della totalità di ogni pozzo, spingendo un'efficienza stimata nell'intervallo 70%26. La stima della perdita cellulare durante l'acquisizione della citometria a flusso è fondamentale per l'analisi di ogni singola famiglia. Ad esempio, assumendo che non ci sia morte cellulare e contando il numero di divisioni, è possibile stimare il numero di cellule per ogni famiglia. Tuttavia, è auspicabile eseguire alcuni esperimenti di conferma, in particolare nella stima della morte cellulare nelle condizioni di coltura testate e nella misurazione del tasso di recupero sperimentalmente utilizzando un numero definito di cellule.
Uno dei passaggi cruciali di questo protocollo è l'assegnazione del picco. Come già accennato, una distribuzione dei picchi di buona qualità dipende fortemente dall'isolamento di picchi molto stretti nell'ordinamento cellulare. Tuttavia, è ancora difficile assegnare il numero corretto di divisioni basate unicamente sulla distribuzione. Poiché l'ordinamento cellulare e l'analisi della citometria a flusso vengono eseguiti su due macchine diverse, non è possibile confrontare direttamente l'intensità di ciascun segnale, quindi potrebbe essere difficile sapere se il primo picco osservato all'estremità destra dell'istogramma è il picco 0 o il picco 1. A questo proposito, poche soluzioni sono possibili; Un modo è quello di eseguire un esperimento ortogonale per misurare con precisione il numero di divisioni eseguite da queste cellule (ad esempio, l'imaging di cellule vive). Un'altra possibilità è quella di contare semplicemente il numero di cellule nel pozzo sotto un microscopio a campo luminoso invertito, prima di eseguire l'analisi della citometria a flusso. Questo dedurrà un numero medio di divisioni (supponendo che non ci sia morte cellulare). Infine, una soluzione post-hoc per l'assegnazione dei picchi è il rilevamento di un numero insolito di "famiglie impossibili"; Queste famiglie sono composte da un numero maggiore del possibile di cellule per generazione (ad esempio, cinque cellule nella generazione 2, o due celle nella generazione 1 e una cella nella generazione 2). La possibilità di escludere le famiglie impossibili è codificata nella fase di analisi statistica e contrassegna la famiglia impossibile. Se il verificarsi di questi errori è troppo elevato, è ragionevole supporre che l'assegnazione del picco debba essere rivista.
In questo protocollo, abbiamo incluso alcuni esempi di rappresentazione e analisi dei dati per il test, poiché questo è diventato un passo essenziale nella generazione e nell'interpretazione di grandi set di dati38. Il primo esempio è la mappa di calore che mostra la totalità di tutte le cellule analizzate, organizzate per famiglia. Questo è uno strumento efficace per esplorare le proprietà generali dei dati e le potenziali conclusioni: le famiglie sono composte da più tipi di cellule o tendono ad essere omogenee nella composizione? Le famiglie sono distribuite su più generazioni o si dividono per lo più lo stesso numero di volte? Questa analisi esplorativa deve poi essere integrata da grafici più specifici e da test statistici. Può essere utilizzato per valutare quantitativamente l'impegno del destino simmetrico e asimmetrico, la differenziazione senza divisione, l'equilibrio tra auto-rinnovamento e differenziazione e il numero di divisioni per un determinato destino di impegno. È fondamentale, durante la pianificazione sperimentale, impostare la lunghezza della coltura cellulare in base al tipo di domanda posta; Ad esempio, per le prime due domande (equilibrio simmetrico/asimmetrico e differenziazione senza divisione), la pianificazione di passaggi culturali molto brevi consente l'isolamento di un gran numero di famiglie che hanno eseguito solo una o nessuna divisione26. Al contrario, esperimenti più lunghi consentono l'esplorazione del numero di divisioni richieste per uno specifico impegno cellulare, poiché campionano famiglie in diversi stadi di differenziazione. Tuttavia, questo metodo non è progettato per colture a lungo termine (2-3 settimane), poiché la diluizione del colorante cellulare non è in grado di tracciare con precisione più di sette o otto divisioni22. Di conseguenza, questo strumento è per lo più adatto a studiare l'impegno precoce dei progenitori ematopoietici e non è progettato per trarre conclusioni robuste sulle proprietà di differenziazione a lungo termine di queste cellule.
Il quadro statistico è stato sviluppato specificamente per l'analisi di questo tipo di dati e basato sul concetto di permutazioni26. Ciò si è reso necessario a causa dell'osservazione di una dipendenza familiare sulla distribuzione del tipo di cellula e sul numero di divisioni eseguite. In altre parole, le cellule che fanno parte della stessa famiglia hanno anche maggiori probabilità di mostrare fenotipi simili e dividersi lo stesso numero di volte. Sebbene un'analisi approfondita esuli dall'ambito di questo lavoro, la serie di test statistici forniti dovrebbe essere sufficiente per valutare condizioni diverse.
In conclusione, questo protocollo costituisce un valido strumento per valutare la dinamica cellulare delle cellule staminali e progenitrici ematopoietiche ex vivo, in modo rapido ed economico. Grazie alla sua flessibilità e versatilità per quanto riguarda il punto temporale, le condizioni di coltura e il tipo di HSPC analizzati, consente di testare una varietà di condizioni sperimentali. Come test basato sulla citometria a flusso, può essere implementato nella maggior parte dei laboratori e non richiede ampie conoscenze preliminari, rendendolo un buon candidato per screening ed esperimenti pilota.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi rilevante per questo lavoro. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'interpretazione dei dati o nella decisione di presentare il lavoro per la pubblicazione.
Riconoscimenti
Vorremmo ringraziare i membri dell'Institut Curie Flow Facility per il loro aiuto nella creazione degli esperimenti di citometria a flusso. Vogliamo anche riconoscere i contributi degli altri membri del Team Perié, durante molteplici discussioni. Ringraziamo la Dott.ssa Julia Marchingo e il Prof. Phil Hodgkin (Walter e Eliza Hall Institute of Medical Research) per aver condiviso il loro protocollo di multiplexing dei coloranti a divisione cellulare sui linfociti. Ringraziamo la biobanca del sangue del cordone ombelicale dell'ospedale Saint Louis per aver fornito le risorse biologiche necessarie per lo sviluppo di questo protocollo. Lo studio è stato sostenuto da una sovvenzione ATIP-Avenir del CNRS e della Fondazione Bettencourt-Schueller (a L.P.), sovvenzioni dal Labex CelTisPhyBio (ANR-10-LBX-0038) (a L.P. e A.D.), Idex Paris-Science-Lettres Program (ANR-10-IDEX-0001-02 PSL) (a L.P.), il Canceropole INCA Emergence (2021-1-EMERG-54b-ICR-1, a L.P.) e la sovvenzione ITMO MIIC (21CM044, a L.P.). Oltre ai finanziamenti del Consiglio europeo della ricerca (CER) nell'ambito del programma di ricerca e innovazione Horizon 2020 dell'Unione europea ERC StG 758170-Microbar (to L.P.), A.D. è stato supportato da una borsa di studio della Fondation de France.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
Riferimenti
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084(2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041(2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381(2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287(2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540(2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. Testing statistical hypotheses. , Springer. New York. 784(2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624(2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151(2013).
- Davison, A. C., Hinkley, D. V. Bootstrap Methods and their Application. , Cambridge University Press. (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116(2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898(2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon