Method Article
通过流式细胞术 同时 评估造血干细胞和祖细胞的亲缘关系、分裂数和表型
摘要
这里介绍的是一种基于流式细胞术的技术,可以同时测量细胞分裂次数、表面细胞表型和细胞亲缘关系。可以使用基于排列的框架对这些属性进行统计测试。
摘要
很少有技术可以同时评估同一细胞的表型和命运。目前用于表征表型的大多数协议虽然能够生成大型数据集,但需要破坏感兴趣的细胞,从而无法评估其功能命运。因此,很难描述造血等异质性生物分化系统。在细胞分裂追踪染料的基础上,我们进一步开发了一种方案,以同时确定许多单个造血祖细胞的亲属关系、分裂数和分化状态。该协议允许评估从各种生物来源分离的小鼠和人类造血祖细胞的 离体 分化潜力。此外,由于它基于流式细胞术和有限数量的试剂,因此它可以以相对便宜的方式在单细胞水平上快速生成大量数据。我们还提供用于单细胞分析的分析管道,并结合强大的统计框架。由于该协议允许在单细胞水平上连接细胞分裂和分化,因此可用于定量评估对称和不对称命运承诺,自我更新和分化之间的平衡以及给定承诺命运的分裂次数。总之,该协议可用于实验设计,旨在从单细胞角度揭示造血祖细胞之间的生物学差异。
引言
过去十年的特点是细胞和分子生物学的单细胞方法在全球范围内传播。继单细胞基因组学1,2的步骤之后,如今可以研究单个细胞的许多成分(例如,DNA,RNA,蛋白质),并且每年都有新的单细胞组学技术涌现。这些技术揭示了免疫学、神经生物学、肿瘤学等领域的新旧问题,包括使用人类和模型生物细胞3。通过强调单个细胞之间的差异,单细胞组学促使定义了一种新的造血模型,该模型以造血干细胞和祖细胞(HSPC)的异质性为中心,并摆脱了离散同质群体的经典模型4,5。
所有组学技术的少数缺点之一是目标细胞的破坏,排除了评估其功能的可能性。相反,其他单细胞方法,如单细胞移植测定和谱系示踪技术,通过评估体内单个细胞的命运来读取祖先细胞的功能6,7。谱系追踪技术涉及用可遗传的遗传7或荧光标记8,9标记感兴趣的细胞,从而可以同时跟踪多个单细胞的命运。然而,起始细胞的表征通常仅限于有限数量的参数,例如通过流式细胞术10评估的几种表面蛋白的表达。此外,单细胞谱系示踪技术需要费力地检测细胞标记,通常通过DNA/RNA测序或成像。最后一点尤其限制了可以在单个实验中测试的条件数量。
另一类用于研究单细胞功能的方法是单HSPC的离体细胞培养系统。 这些金标准测定易于执行,涉及将单个细胞分选到 96 孔细胞培养容器中,并在培养后表征细胞后代表型,通常通过流式细胞术或形态学分析。这些测定主要用于表征HSPC长期分化为成熟细胞,通常在培养2-3周后11,12。或者,它们已被用于尝试维持和扩增离体HSPCs13,14,15,16,17,18,有望为人类干细胞移植带来医疗益处19。最后,它们已被用于使用短期培养20研究HSPC的早期承诺,其中该培养物中产生的细胞数量少是主要的限制因素。这些不同类型的离体测定的一个缺点是它们只能部分反映体内复杂性;尽管如此,它们仍然是研究人类HSPC分化的罕见方法之一。
现有单细胞方法(单细胞组学、谱系追踪和 离体 培养)中缺少的一个信息是准确检测细胞分裂,这是研究HSPC动力学21时要考虑的基本参数。通过流式细胞术 评估 分裂次数的一种简单方法是使用可溶性"蛋白质染料",如5-(和6)-羧基荧光素二乙酸琥珀酰亚胺酯(CFSE)22。这些分裂染料扩散在染色细胞的细胞质内,并稀释一半并在每次细胞分裂时传递给两个子细胞,允许计数多达10次分裂。结合几种分裂染料,可以在同一孔中播种多个单独的祖细胞,因为每种单独的染料都允许分离不同的后代。这就是使用细胞染料进行多重克隆和分裂跟踪的原理,该染料最初引入鼠淋巴细胞23,24。
在这里,我们介绍了用于小鼠和人类HSPC的MultiGen测定的开发。它允许同时测试许多单细胞的分化、分裂和 离体亲缘关系的特性。这种高通量、易于执行且价格低廉的测定方法允许同时测量细胞表型、进行的分裂次数以及与孔中其他细胞的细胞亲缘关系和克隆关系。它可以用来定量评估对称和不对称的命运承诺,自我更新和分化之间的平衡,以及给定承诺命运所需的划分数量。该方案需要荧光活化细胞分选仪(FACS)和带酶标仪的流式细胞仪,以及进行细胞培养所需的设备。除了执行人HSPC测定的技术协议外,我们还提供详细的分析框架,包括评估与细胞家族25概念相关的细胞特性所需的统计测试。该协议已成功用于描述小鼠HSPC隔室26,27。
以下方案使用富含磁性的CD34 + 细胞作为起始材料28。通过这种方式,可以有效地染色和分离来自不同血液来源(例如,脐带血、骨髓、外周血)的人HSPC。重要的是不要丢弃CD34- 级分,因为它将用作设置不同类型的实验对照的协议的一部分。上述细胞数量和体积可以根据实验工作流程和必要性放大或缩小。同样,该方案可以适用于不同类型的祖细胞的研究,只需修改用于细胞分选和流式细胞术步骤的抗体即可。
研究方案
对于以下方案,使用去识别化的脐带血作为HSPC来源,并根据圣路易医院脐带血生物库(授权AC-2016-2759)和赫尔辛基宣言定义的指南进行采集。
注意:在开始之前,请确保此协议所需的所有试剂和设备都可用,如 材料表中 所列和协议中提到的。除非明确说明,否则请新鲜准备相关试剂,不要储存。
1. 细胞染料染色
注意:本节介绍用CFSE和紫色染料(CTV)细胞分裂染料的四种组合进行染色。同时处理所有试管,即使不添加细胞染料溶液。所有步骤均在无菌条件下进行,以允许进行后续细胞培养步骤。所需时间:约100分钟
- 根据磁性分选方案处理脐带血单元29.确保有两种级分可用:较大的CD34- 级分和较小的CD34+ 级分。以300 x g 离心两个管5分钟。在不干扰沉淀的情况下吸出上清液。
- 对于 CD34+ 级分,将其重悬于 1 mL 不含胎牛血清 (FBS) 的 Dulbecco 改良鹰培养基 (DMEM) 中。使用血细胞计数器计数细胞;细胞密度不应高于 3 x 106 个 细胞/mL。如果是这种情况,请相应地调整音量。对于CD34- 级分,重悬于不带FBS的DMEM中,并将体积调节至最大6 x 106 个细胞/mL。
- 将 250 μL CD34+ 级分分装到四个 15 mL 聚丙烯管中。标记试管如下:CD34 + / CF(CFSE_only),CD34 + / CV(CFSE_high CTV_low),CD34 + / VC(CFSE_low CTV_high)和CD34 + / VI(CTV_high)。将 250 μL CD34- 级分分到另外四个 15 mL 聚丙烯管中。按如下方式标记试管:CD34-/ CF(CFSE_only),CD34-/ CV(CFSE_high CTV_low),CD34-/ VC(CFSE_low CTV_high)和CD34-/ VI(CTV_high)。CD34-级分中的剩余细胞可以丢弃。
- 准备两个 CFSE 解决方案,分别命名为 CFSE_high 和 CFSE_low。对于CFSE_high (10 μM),将 1.1 mL 不含 FBS 的 DMEM 与 2.2 μL CFSE 储备液 (5 mM) 溶液混合。对于CFSE_low (5 μM),混合 550 μL 不含 FBS 的 DMEM 和 0.55 μL CFSE 储备液 (5 mM)。
- 向 CF 和 CV 管中加入 250 μL CFSE_high溶液,向 VC 管中加入 250 μL CFSE_low溶液,在 VI 管中加入 250 μL 不含 FBS 的 DMEM。为确保细胞悬液和细胞染料的有效混合,请将试管倾斜近 90 度,然后将 CFSE 溶液沉积在管壁上。然后,垂直握住试管以混合两种溶液,并移液三到四次,以确保CFSE溶液与重悬细胞快速混合。在37°C下孵育8分钟。
- 孵育后,加入 5 mL DMEM + 10% FBS。将试管在37°C下保持5分钟。
- 以300 x g 离心管5分钟。在不干扰沉淀的情况下通过抽吸 除去 上清液,并用 5 mL 磷酸盐缓冲盐水 1x/乙二胺四乙酸 (PBS 1x/EDTA) 洗涤沉淀。以300 x g 再次旋转5分钟。在不干扰沉淀的情况下弃去上清液,并将细胞沉淀重悬于 250 μL 1x PBS / EDTA 中。
- 准备两个 CTV 解决方案,分别名为 CTV_high 和 CTV_low。对于CTV_high (10 μM),混合 1.1 mL PBS 1x/EDTA 和 2.2 μL CTV 储备液 (5 mM)。对于CTV_low (5 μM),将 550 μL PBS 1x/EDTA 与 0.55 μL CTV 原液 (5 mM) 混合。
- 向VC和VI管中加入250 μL CTV_high溶液,向CV管中加入250 μL CTV_low溶液,向CF管中加入250 μL 1x PBS / EDTA。使用与步骤 1.5 中所述相同的技术。在37°C下孵育8分钟。
- 孵育后,加入 5 mL DMEM + 10% FBS。在37°C下保持5分钟。
- 以300 x g 离心管5分钟,弃去上清液而不干扰沉淀,然后用5mL的1x PBS / EDTA洗涤沉淀。以300 x g 再次旋转5分钟。
- 在不干扰沉淀的情况下弃去上清液,并将CD34- 级分重悬于1x PBS / EDTA中,终浓度为1.5 x 106 个细胞/ mL。将 CD34+ 级分重悬于 40 μL 染色缓冲液中,并将细胞转移到 1.5 mL 管中。
2. 抗体染色
注意:抗体染色可根据实验需要定制。只有CD34+ 级分进行抗体染色;CD34- 级分用作细胞分裂染料组合(CV、VC、CF 和 VI 级分)的单染色对照。以下组合专为检测四种类型的 HSPC 而量身定制:造血干细胞 (HSC)、多能祖细胞 (MPP)、淋巴引发的多能祖细胞 (LMPP) 和造血祖细胞 (HPC)12。然而,给出了造血干细胞和MPP的鉴定。所需时间:75分钟
- 使用补偿珠准备用于表面染色的单次染色。以 1:1 的比例混合阴性磁珠和免疫球蛋白 G (IgG) 磁珠,总体积相当于 20 μL x 表面标志物的数量(例如,如果染色组合包含 6 种抗体,则为 120 μL)。
- 将 20 μL 磁珠分分配到单独的 1.5 mL 管中,用于每个标记物。在相应管中加入对应于每种抗体稀释因子的体积(例如,如果稀释因子为 1:20,则添加 1 μL)。
- 为了染色CD34 +细胞,根据表1制备抗体12的预混液。将抗体混合到单个 0.5 mL 管中。将抗体预混液中的 7 μL 添加到四种 CD34+ 条件中的每一种。
- 将补偿珠和CD34 + 样品在4°C孵育至少30分钟。
注意:孵育时间必须适应用于染色的抗体的技术细节。 - 在孵育期间,准备用于分选的 96 孔圆底板,使用多通道移液器向每个孔中加入 100 μL 细胞培养基。
注意:将孔 H8-H12 留空。 - 标记5 mL聚丙烯管,用于表面染色对照(5,使用珠子),细胞分裂染料对照(4,使用CD34- 级分)和CD34 + 样品(4)。
- 孵育结束时,用1 mL染色缓冲液洗涤细胞和珠子。将总体积转移到 5 mL 聚丙烯管中。以300× g离心管5分钟,然后在不干扰沉淀的情况下吸出上清液。
- 将细胞重悬于染色缓冲液中,磁珠和CD34+ 细胞各使用约500 μL,CD34- 管各使用1 mL。
表1:用于制备用于细胞分选实验的抗体预混液的模板。请按此下载此表格。
3. 细胞分选
注意:排序的单元格编号可能因可用单元格总数而异。在协议中,为每个控件提供了最小单元数。所需时间(单板):100分钟
- 打开模板实验或设置新实验。创建一个试样和多个试管,每个条件一个。
- 设置图 1 中详述的门控策略,创建六个点 图。首先,在 FSC-A/SSC-A 点图上可视化细胞,然后双击 多边形门控工具 以选择具有低侧散射的群体(图 1A)。在下面的点图(FSC-A/FSC-H)中,右键单击 该图 ,然后通过单击从下拉菜单中选择门"单元格"。使用相同的 门控工具 在两个轴之间的对角线上选择紧密的群体(图1B)。
- 在第三个点图(APC 与 FSH-H)中,显示群体"单细胞"并针对 APC 谱系 (Lin) 的表达进行阴性细胞门控(图 1C)。在第四个图(CFSE 与 CTV)中,显示群体"Lin-"并创建四个单独的门,每个染料组合一个(图 1D)。
注意:这些门必须紧密,以便仅选择一小部分均匀染色的细胞。 - 使用第五和第六个图(APC-Cy7 与 BV650 和 PE-Cy7 与 PE)来确定感兴趣的祖细胞。在第五个图中慷慨地门控CD34 + CD38-群体和CD34 + CD38 +(图1E)。然后,在第六个图中选择CD34 + CD38-群体,并根据图1F绘制三个门。
- 运行包含补偿珠的单个染色管,单击" 采集 "按钮。从 参数 下拉菜单中调整光电倍增管 (PMT) 电压,特别是对于细胞分裂染料(在双指数刻度上介于 104 和 105 之间)。
- 使用"补偿"选项卡根据用于排序的面板优化 补偿 矩阵。在珠子门中记录至少 5,000 个事件,单击 "记录 "按钮。
- 运行CD34- 馏分并再次检查补偿矩阵。在单细胞门中 记录 至少 10,000 个事件。
- 运行CD34 + 级分,在单细胞门中记录至少5,000个事件。调整每种染料组合的浇口,设置紧密的浇口以选择均匀的群体(图1D)。同样,调整用于选择 HSC 和 MPP 的门控。
- 分析完成并记录所有试管后,在执行标准 Aria 校准以在 96 孔板上进行分类后,将板插入适当的支架中。建议冷却板。
- 使用实验分选布局,根据表2中所示的方案制备板分选模板。名为"CD34-"的孔包含5,000-10,000个细胞,在CF / CV / VC / VI门上分类。"散装"孔包含至少500个细胞,在门CD34 + CD38-上分选。最后,单细胞孔每个孔的每个细胞分裂染料组合仅包含一个事件,因此每个孔总共包含四个事件。
注意:"批量"种群可以适应特定祖先的子集;不要对少于 500 个单元格进行分类。 - 对于分选,请按顺序进行,完成每个细胞分裂染料组合,然后再进行下一个。例如,从在产量纯度模式下分选CD34-CF开始。单击获取按钮,然后单击排序按钮。
- 在CD34- 分选结束时,插入CF CD34+ 管。获取,然后单击排序按钮,确保已勾选 0/ 16/0 作为纯度等级。最后,以单细胞纯度对感兴趣的细胞进行排序,每孔一个 细胞 ,确保勾选 索引排序 选项。
- 移至以下细胞分裂染料组合,重复相同的顺序。作为参考, 表2 提供了分类板的示例。
注意:索引排序功能为每个排序条件生成单独的文件。 - 排序结束时,将文件导出为 .fcs 3.0 文件。将细胞放入37°C,5%CO2 培养箱中。根据实验设计,将细胞培养多天,至少24小时26。
表2:用于细胞分选96孔板的模板,基于连续流式细胞术分析的具体要求。请按此下载此表格。
4. 细胞分选数据分析
注意:为了验证细胞分选的质量,在进一步操作之前,必须进行FACS数据分析。此步骤的主要输出是生成一个电子表格,其中包含每个已排序的单个单元格的标记强度。
- 在分析软件中上传 .fcs 3.0 文件。
- 使用实际分选前记录的单个染色文件验证细胞分选期间使用的补偿设置。
- 使用与不同批量对应的文件设置修订后的门控策略。将这些门复制并粘贴到索引排序文件上。
- 检查索引排序的单元格是否落在设置门中。如果有一些排序的单元格被错误地设通,可以通过导出索引排序期间记录的板坐标来识别它们,并在稍后的分析中将其删除。
- 将 索引排序文件中的事件导出为补偿参数。将它们导出为.csv文件,勾选 "比例值" 和 "补偿参数"选项。这些文件应导出到名为 "导出的文件"的文件夹中。
- 使用 补充文件 1 中的脚本将所有文件合并到一个.csv文件中。使用函数"setwd"设置正确的路径。此脚本的输出是一个电子表格,其中包含所有不同的门控事件和所有参数的相对强度。
5.培养后抗体染色
注意:在无菌条件下执行协议的这一部分;几种试剂与前面的步骤共享,需要保持无菌。对于流式细胞术分析,请使用带酶标仪的流式细胞仪。这允许直接在组织培养板中进行染色,通过限制移液和离心量将细胞损失降至最低。使用补偿珠制备表面标记单色染色,但孔 A1-A4 除外,它们代表 CF/CV/VC/VI 颜色的单染色,并且已经存在于 96 孔板中。根据细胞染料分类的大块群体有助于设置分裂次数和一般门控的门控策略。所需时间:120分钟
- 在开始方案之前,通过在倒置显微镜下检查板来标记包含至少一个细胞的孔。此步骤可以优化用于染色的抗体量并加快该过程。
- 制备抗体预混液,按 表3。由于移液量很大,该表考虑了移液引起的技术错误,包括额外的5%体积。表中描述的抗体可以表征来自人脐带血样本的一系列HSPC12。
- 将板以300 x g 离心5分钟。快速倒置罩下的板和纸巾上,以除去上清液。
- 向孔 A1-A4 中加入 8 μL 染色缓冲液。向其他孔中加入 8 μL 混合物。
- 以 1:1 的比例混合负磁珠和 IgG 补偿磁珠,总体积相当于 120 μL。 每个标记物在一个 1.5 mL 管中发送 20 μL。加入与稀释因子相对应的抗体体积(例如,如果稀释因子为 1:20,则添加 1 μL)。
注意:根据用于染色的标记物数量调整总体积(例如,如果染色组合包含五个抗体,则为 100 μL)。 - 将板和单染色补偿对照在+ 4°C孵育至少30分钟。
注意:孵育时间必须适应用于染色的抗体的技术细节。 - 用 1 mL 染色缓冲液洗涤珠子。将总体积转移到先前标记的 5 mL 聚丙烯管中。将试管以300× g离心5分钟,然后通过抽吸 除去 上清液。
- 使用多通道移液器每孔加入 100 μL 染色缓冲液,洗涤板中的细胞。将板以300× g 离心5分钟,然后在引擎盖下和纸巾上快速倒置板,以除去上清液。
- 使用多通道移液器将细胞重新悬浮在 85 μL 染色缓冲液中。
- 在流式细胞仪(采集模式)上开始分析,使用专用模板并单击 自定义。该定制模板考虑了96孔圆底板的技术特征,特别是每个孔的尺寸(直径,深度和厚度)。探头必须到达孔的底部,因此请将其设置在孔A1和H12的正中心。
- 从软件建议的列表中选择感兴趣的 荧光团 后,按照表2的板模板设置板 设置 ,校正包含至少一个细胞的孔数。
- 选择 100 μL 作为 采集体积限制。勾选 搅拌 选项。将 采集速率 设置为最大 1 μL/s,因为较低的速度会提高每孔分析的总体积。
- 向H8-H12孔中添加适当的清洁和洗涤溶液。 表2 中的模板明确将H8-H12孔留空,因为流式细胞仪需要在分析结束时运行一系列洗涤条件。
注意:此步骤适用于所用流式细胞仪的具体情况。 - 在图和门部分中,首先使用 FSC-A/SSC-A 散点图,然后使用 FSC-H/FSC-A 散点图设置单单元门。为每个感兴趣的标记创建 直方图 。
- 确认设置后,继续" 分析 "部分。首先分析单次染色, 记录 不少于5,000个事件(最佳范围:5,000-15,000个事件),包括补偿珠和CD34染色部分。如果需要,请调整电压。
- 记录完单次染色后,即可开始实际采集,单击 采集 功能。
表3:用于流式细胞术实验的抗体预混液,专门用于鉴定人脐带血中的HSPC。请按此下载此表格。
6. 培养后流式细胞术数据分析
注意:所描述的数据分析特定于 材料表中提到的软件。主要输出是生成一个电子表格,其中包含每个分析细胞的表面标记强度、分裂次数和亲属关系的信息。协议的这一部分包括一个用 R 编写的脚本,这是此工作流生成最终分析电子表格所必需的。
- 将流式细胞仪中的文件导出为 .fcs 文件。将它们上传到分析软件,将它们分组为"单染色"、"散装"和"单细胞"。
- 使用单个染色文件准备补偿矩阵,并通过 拖放将其应用于其他两组。
注意:如果使用自动补偿工具,请在继续操作之前手动检查质量。 - 要获得具有代表性的门控,请在单个文件中连接不同的体孔。此步骤会快速突出显示两种颜色是否重叠(通常为 CV 和 VC)或其他异常,因此需要排除。单击连接 群体 选项后,从"参数"菜单中选择所有 未补偿的参数 ,然后单击 连接。
- 将级联文件上传到工作区,然后通过拖放应用补偿矩阵。
- 使用串联文件准备 图 2 中定义的门控策略。在单单元门中,使用 CFSE 和 CTV 在散点图上显示事件。创建第一个称为标记的门,包括所有四种颜色并排除可能的自发荧光(图2C)。然后,分别控制每种颜色。
- 用CV和VC标记的细胞需要一个转换值,考虑到颜色是CFSE和CTV信号的结果。因此,两个协调信号在对数刻度上旋转45°,以允许分度稀释平行于x轴进行。此转换值是手动派生的,单击"工具",然后单击" 派生参数"。将以下公式粘贴到 公式 框中:

注意:公式26 假设 CFSE 和 CTV 是参数 03 和 17。 - 要正确可视化这个名为派生参数的新参数,请设置一个范围为 ~3-7 的线性轴,单击轴参数选项并选择自定义轴。
- 将门控作为直方图分别应用于每种颜色:对于 CF 和 VI,分别在 x 轴上设置 CFSE-A 和 CTV-A 。对于 CV 和 VC,在 x 轴上设置新的 派生参数 。设置对应于每个峰的门,如图 3所示。
- 将门控应用于每个单独的单细胞孔。确保将派生参数添加到每个分析孔中。手动验证每个孔的每个色门,以检测错误分配给给定峰的事件。门控示例如图 4 所示。
- 分析完成后,所有孔都经过验证,选择至少包含一个细胞的所有CF/CV/VC/VI门。将它们 导出 为.csv文件,勾选"比例值"和"补偿参数"选项。这些文件导出到名为"导出的文件"的文件夹中。
- 使用 补充文件 1 中的 R 脚本将所有文件合并到一个.csv中。请记住使用函数"setwd"设置正确的路径。此脚本的输出是一个电子表格,其中包含所有不同的门控事件和所有参数的相对强度。
- 打开电子表格并重命名每个参数的列,例如,使用以下名称:CFSE、CTV、CD90、CD123、CD45RA、CD34、CD38。这些名称将用于标识门控阈值,以正确分配给每个单元其身份。
- 添加名为"井"、"条件"、"颜色"、"生成"、"Original_cell"和"Culture_time"的六列。这些变量是通过实验定义的变量,是从每一行推断出来的:
export_A10 CD34 + PBS_CV_Peak 1.csv.1 = A10(良好)、CD34+ (Original_cell)、PBS(条件)、CV(颜色)、Peak_1(生成)。 - 导出大块孔以确定门控的阈值:将感兴趣的补偿群体(例如,CD34 + CD38-)导出为.csv文件,勾选"刻度值"和"补偿参数"选项。将这些文件导出到名为"导出的文件"的文件夹中。
- 要查找 CD38 的阈值,请确定此参数的最大数值。相反,要找到 CD34 的阈值,请确定此参数的最小数值。对所有感兴趣的参数重复此过程。
注意:对于协议中提出的分析,标记CD45RA用于鉴定CD34 + CD38-门中的LMPP和CD34 + CD38 +门中的CMP / GMP。这意味着需要为此标记提取两个不同的阈值。 - 将阈值复制并粘贴到名为"gating_matrix"的 excel 文件中。该文件根据 表4进行组织,并允许分析多个独立实验。使用此方案精确命名每一列非常重要:XXYYMMDD_xxh,其中 XX 代表运算符的两个首字母,YY 代表年份的最后两个数字,MM 代表月份,DD 代表日期,xx 代表分析时间点。
表4:统计分析前用于细胞命运分配的门控矩阵。 CD45h是指HPC子集门控的CD45RA强度,而CD45l是指CD34 + CD38- 子集的CD45RA强度。 请按此下载此表格。
7. 统计分析
注意:对生成的数据的统计测试涉及一个定制的分析管道,使用编程语言 Python(补充文件 2、补充文件 3 和补充文件 4)进行编码。该脚本分为三个块:第一个块用于处理电子表格,第二个块用于生成用于数据可视化的热图,最后一个块用于生成多个直方图以分析和测试微分和除法属性。
- 从块"0_process_data"(补充文件 2)开始,确保在脚本中正确定义了gating_matrix和数据电子表格路径。
- 定义"cell_cols"字典,为每个单元格分配相关的单元格命运。在特定情况下,命运是HSC,MPP,LMPP,普通髓系祖细胞(CMP),颗粒单核细胞祖细胞(GMP),巨核细胞 - 红系祖细胞(MEPs)和CD34-。
- 使用从大容量孔定义的阈值(步骤6.16),定义"cell_class_exp_time"函数。必须在列命名中保持一致,以正确定义这些阈值,使用与步骤 6.12 中定义每个列相同的名称。
- 根据流式细胞术分析期间检测到的阈值,在脚本中使用一系列"if-else"语句定义细胞表型。
注意:通过修改这些语句以适应其他标记组合,可以显示不同的表型。 - 使用函数"cond_rule"指定实验特定条件(例如,不同的实验处理)。对于提供的数据集,条件名为"GT"和"Diff"。描述用于培养细胞的两种不同的细胞培养基。此信息将由块"1_dot_plot"(补充文件 3)用于绘制热图。
- 在块"2_bar_plot"(补充文件4)中,定义字典"class_dct",包括感兴趣的离散细胞命运。对于提供的数据集,感兴趣的单元格命运与"cell_cols"字典的描述相同。
- 定义"conds"(条件),"or_cells"(原始单元格),"sym_labs"(对称标签)和"时间"(实验时间点)。这些是重申绘图所需的过滤器。"conds"再次采用"cond_rule"中定义的条件,"or_cells"是HSC和MPP,"sym_labs"描述划分的类型。
- 在块"2_bar_plot"中,可以绘制已发展到除法 6 的单元格。
注意:提供的数据集仅包含最多为 4 的单元格,因此会弹出一条错误消息,但这不会阻止脚本工作。 - 脚本生成的图形可以在名为"figures"的文件夹中以pdf文件的形式检索。名为"Test"的文件表示对相应直方图执行的不同统计测试。
结果
FACS 分拣
该协议中提出的分选门控策略基于广泛接受的策略12,30,31。对于图1所示的门控策略,起始材料是先前通过CD34+磁富集纯化的脐带血祖细胞,这解释了谱系阳性细胞的百分比可以忽略不计。必须对四种细胞内染料组合(例如图中的CTV)使用紧密门,以便在以下分析中提高峰的分辨率并门控正确的细胞群(图1D)。在图中所示的情况下,门选择最大且定义更好的人口。根据我们的经验,每种细胞分裂染料组合存在多个紧密的群体并不代表生物学差异。相反,它可能表明a)非最佳染色程序,或b)起始细胞池中的大异质性(特别是在大小上)。从脐带血或其他复杂的生物来源(例如骨髓抽吸物、外周血)开始检测时,这并不意外。如果栅极定义不严格,则不同染料组合的渐进稀释会导致后期峰合并,特别是对于CV和VC条件(图2D)。次优设门的另一个负面后果是细胞培养后无法有效区分不同的峰,因为异质起始群体会导致浅峰。
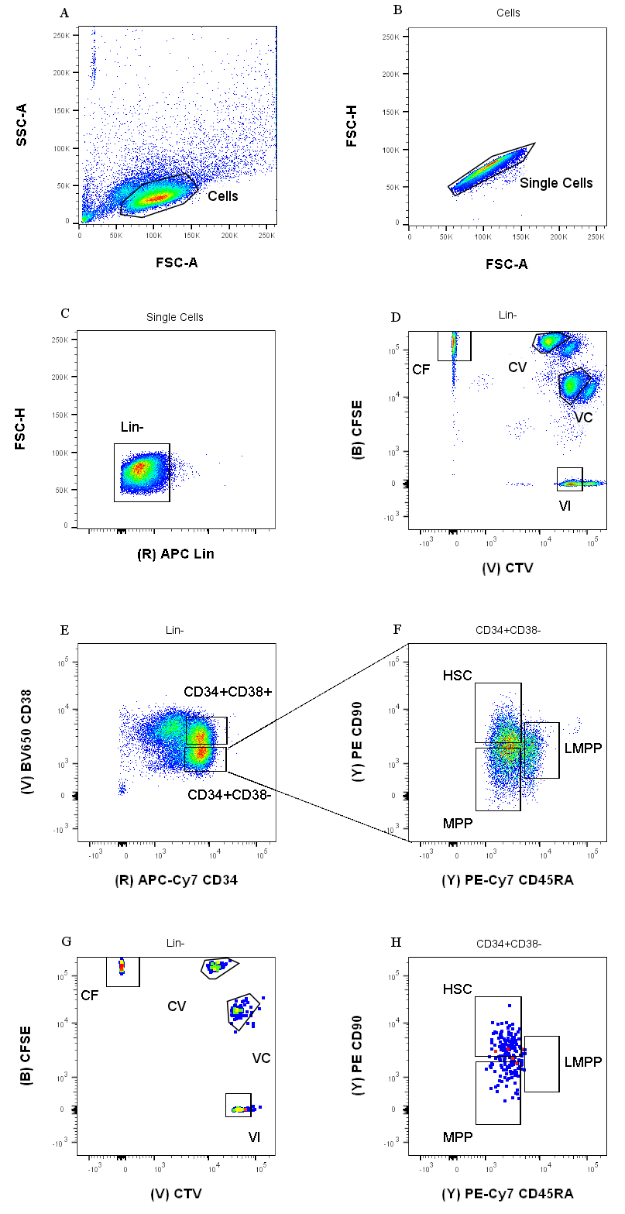
图 1:细胞分选的门控策略。 (A)FSC-A与SSC-A,以排除碎片和污染细胞。(B)FSC-A与FSC-H,以排除双峰和细胞团块。(C)Lin与FSC-H,以排除Lin+细胞。(D)CTV与CFSE,以单声鉴定用染料组合CF,CV,VC和VI染色的细胞。大门应该足够严格,以包括同质人口。(E)CD34与CD38,将受限祖细胞CD34 + CD38 +(也称为HPC)与多能区室CD34 + CD38-分开。(F)CD45RA与CD90,来自CD34 + CD38-群体,以分离富集在HSC(CD90 + CD45RA-),LMPP(CD90中期CD45RA +)和更坚定的MPP(CD90-CD45RA-)中最未成熟的祖细胞。(G)索引排序事件,此处表示其细胞染料组合染色和(H)表面标志物CD90和CD45RA的表达。请点击此处查看此图的大图。
细胞培养后的流式细胞术分析
图2中的数据是人脐带血HSC的代表,在能够支持一系列髓系祖细胞和前体的多种细胞因子存在的情况下,在培养物中保持72小时。图2A至2D代表建立每个单个细胞亲属关系所需的门控,而图2E至2G允许细胞表型。图中MEP的存在减少可能是用于该代表性实验的培养条件的结果(图2F)。使用不同的细胞因子和培养条件会改变每个亚群的相对百分比,类似于为实验选择不同的起始细胞。
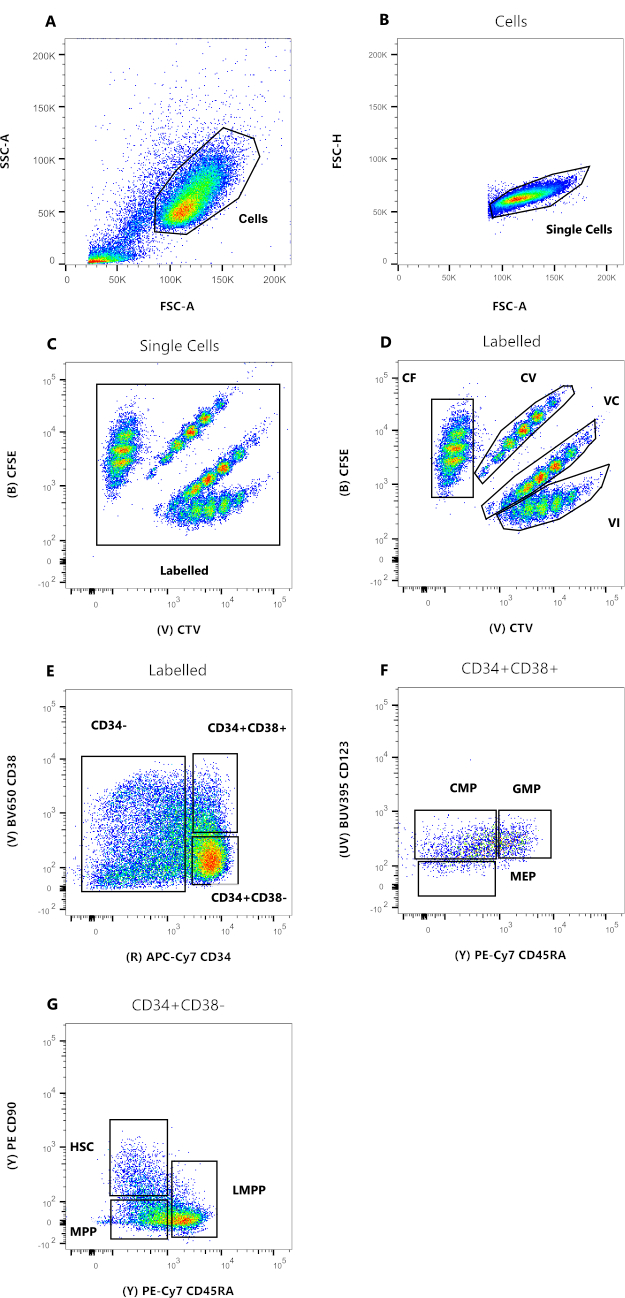
图 2:流式细胞术分析的设门策略。 (A) FSC-A与SSC-A,以排除碎片和污染细胞。(B)FSC-A与FSC-H,以排除双峰和细胞团块。(C)CTV与CFSE相比,门标记允许排除任何可能影响数据分辨率的自动荧光事件。(D) CTV与CFSE。根据细胞分裂染料稀释度严格门禁四个群体非常重要。(E)CD34与CD38,以区分承诺的前体(CD34-),限制祖细胞(HPC)(CD34 + CD38 +)和未成熟祖细胞(CD34 + CD38-)。(F)CD45RA与CD123,以区分三种类型的限制祖细胞:CMP(CD123 + CD45RA-),MEP(CD123-CD45RA-)和GMP(CD123 + CD45RA+)。(G)CD45RA与CD90,来自CD34 + CD38-,以识别HSC,LMPP和MPP。 请点击此处查看此图的大图。
峰定义和分配步骤(图3和图4)是协议的关键方面,需要定义严格的门。对于峰定义(图3),至少需要1,000个事件才能进行可靠的鉴定。从这个意义上说,在"散装"孔的细胞分选步骤中分离更多细胞可能是有益的。图4描述了包含多个族的单个孔的四个示例。该图阐明了图2D和图3门控的重要性,特别是对于识别每个系列和每个峰。图4A说明了一个简单的示例,因为栅极CF中的所有电极彼此非常接近,可以很容易地分配给单个峰。图4C显示了另一个家族单分布在两个分离良好的峰上的例子,如图4D的直方图中清楚地显示了它。图4E,G揭示了基于大量事件的严格门控的重要性;它们都显示很少的事件接近,但在染料组合门之外。这些事件可能被错误地包含在仅基于单孔分析的VI和CF门中。最后,图4F,H显示了分布在多个峰上的两个不同的家族示例,其中一个示例是两个相似的强度峰(图4F),另一个示例是两个不等强度的峰值(图4H)。
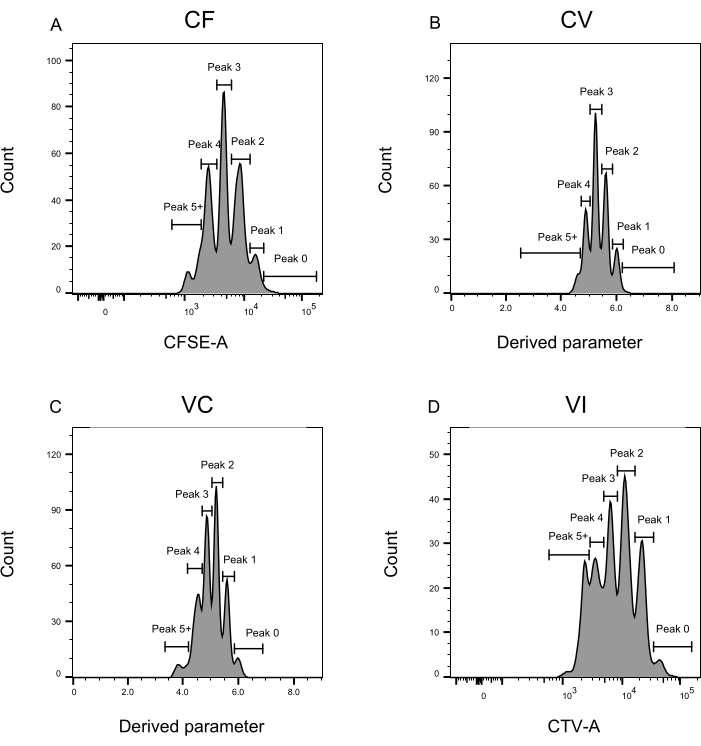
图3:流式细胞术分析的峰定义。 (A-D)峰的定义应记录至少500个事件,以确保每个峰都能得到良好的表示。(A) CFSE-A强度的直方图。可以识别几个峰,每个峰对应于不同的分裂细胞群。(乙,丙)派生参数强度的直方图,分别表示 CFSE-CTV 混合物、CV (B) 和 VC (C)。(D) CTV-A强度的直方图。请点击此处查看此图的大图。
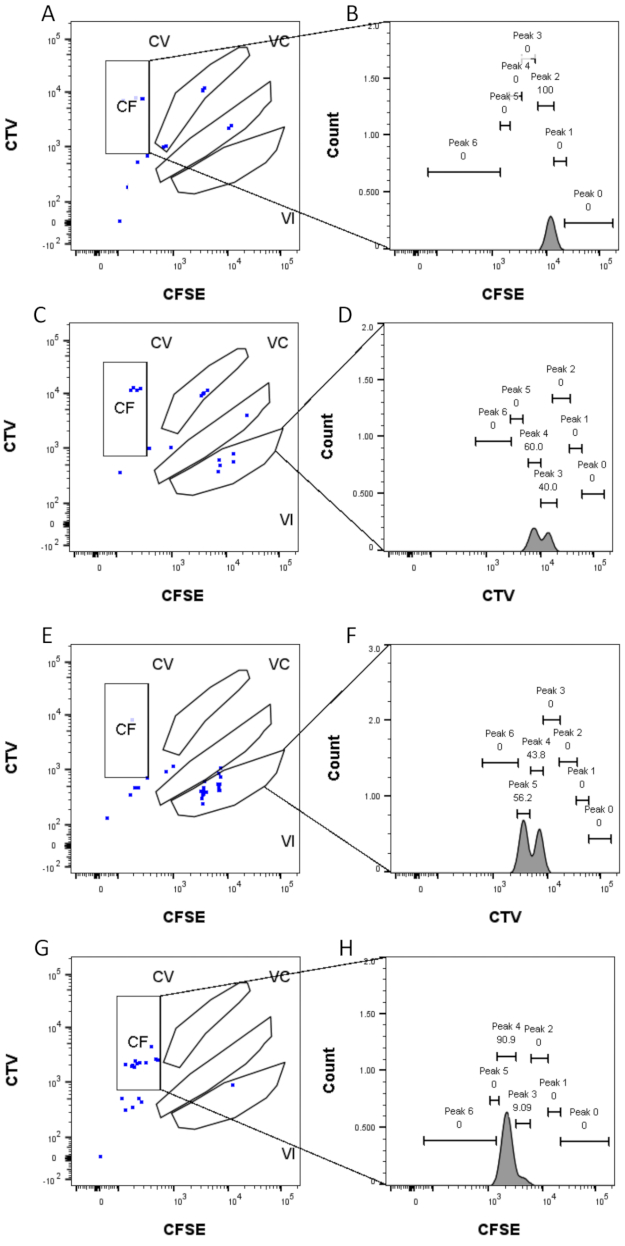
图4:峰分配 。 (A,B)在CF门中只能检测到该孔的一个峰。(中,四)在VI门的这个井中可以检测到两个强度几乎相等的峰。峰被很好地解析。(中、女)在VI门的这个井中可以检测到两个强度相当的峰值。根据使用大块井设置的策略,仅考虑了闸门中的事件。(G-H)在该孔中,在栅极CF中可以检测到两个强度不等的峰值。 请点击此处查看此图的大图。
数据表示和统计测试
图5显示了两个独立实验的不同类型的数据表示,均在细胞培养72小时后进行。HSC和MPP已经在两种不同的细胞培养基中培养,应该改变细胞分裂和分化特性。这些介质被命名为"差异"(差异)32 和"GT"33;第一种促进骨髓和红系分化,因为它含有促红细胞生成素(EPO)和粒单核细胞集落刺激因子(GM-CSF),而第二种是在基因治疗临床试验的背景下开发的,目的是维持和扩增高比例的HSPC。 图 5A 是条件"Diff"的代表性热图,代表各种细胞家族, 无论是细胞命运还是分裂。在此热图中,每行代表一个单独的家庭,每个正方形代表一个单独的单元格,并且列对同一代中的所有单元格进行分组(例如,第 2 代中的单元格至少划分两次)。可以区分高度同质的家族,由单一细胞类型组成并显示相同数量的分裂(例如,家族#63)和异质家族,包括两代的三种细胞类型(例如,家族#84)。由于该分析的细胞回收率约为70%,因此很少观察到完整的家族,这些家族的定义是使其所有细胞在可能不同的世代中恢复(例如,第1代的一个细胞家族和第2代的两个细胞家族)( 在图5A中在其ID号旁边显示一个主题标签)。有多种解释可以解释不完整的检测,这可能是技术性的(染色问题,由于协议引起的细胞损失)或生物学(细胞死亡和/或细胞凋亡)。使用旨在减少与单个样品相关的死体积的分析仪,以及直接在细胞培养板中进行细胞染色以减少移液体积,可以克服技术限制。相反,确定细胞死亡量的正交方法(例如, 通过活细胞成像实验)可以帮助区分导致检测不完整的技术和生物学因素。
图5Bi 显示了如何可视化培养条件对细胞类型组成的影响,就像进行了批量测定一样。在这里,Diff条件促进更多的命运,以及更高百分比的CD34 + 细胞(定义为除CD34-以外的所有细胞类型)。置信区间在脚本中通过基本引导 计算,包含 250,000 个引导数据集34。值得注意的是,图 5 中的所有其他直方 图 都显示以相同方式计算的置信区间。 表5 概括了有关每代家族数量和细胞数量的所有信息。
图5Bii 以图形方式表示在脚本"2_bar_plot"中执行的统计测试的输出。统计框架的正式说明见26.简而言之,该框架支持统计假设检验,同时假设来自同一家族的细胞是依赖的(该假设本身是可检验的),这与需要所有观察到的细胞之间独立的经典统计相反。在图中所示的特定情况下,统计测试挑战了以下假设:MPP的细胞命运选择(以培养物中存在的不同细胞类型的频率来衡量)与所使用的细胞培养条件无关。首先,G检验统计量用于评估来自不同细胞培养基的细胞类型频率之间的差异(对于 Bii中的示例,该统计量用红色条表示)。然后, 通过排列对 数据进行随机化,在两种细胞培养条件之间交换整个细胞家族。这是为了保持家族相关细胞之间的依赖性,同时保持每个集合中的家族数量与原始数据一致。G 检验统计量是根据随机数据集计算的。 5Bii 中表示的蓝色值是 250,000 个排列的 G 检验统计量。最后,计算 p 值以评估原始数据集偏离排列数据集分布的程度。在该示例中,原始统计量在很大程度上偏离了分布,导致 p值较小,从而拒绝了MPP的细胞命运与培养条件无关的假设。
图5C 表示每最大世代的细胞家族百分比,以探索不同条件如何改变每个细胞家族的细胞分裂。该数据图显示,在72小时时,在Diff条件下培养的细胞比GT条件下的细胞完成更多的分裂次数。表示的是每个家族的最大世代数,因此在第 1 代和第 2 代中显示细胞的一个家族被视为第 2 代。 用于图5B 的相同统计框架可用于统计测试细胞分裂和培养条件之间的独立性。
图5D 探讨了不同祖先类型(HSC或MPP)的第一级的对称/不对称类型。对于第 1 代的完整细胞家族 - 唯一可以明确将两个子细胞确定为姊妹细胞的一代 - 可以定义四种不同类型的对称/不对称:标签"Sym Undiff"描述了两个女儿都保留起源细胞表型的家族。"Sym Diff"意味着两个女儿具有相同的表型,并且与起源细胞不同。"Asym Undiff"意味着一个女儿只保留起源细胞的表型。最后,"Asym Diff"描述了两个女儿具有不同表型的家庭,并且它们都与起源细胞不同。为了在评估这些对称/不对称命运中获得统计能力,需要在早期时间点进行多代分析,以便观察更多后代在第 1 代发现的家庭。
最后, 图5E 表示细胞类型的百分比与分裂次数的函数关系,以深入了解跨分裂的分化模式进展。例如,图中显示的数据表明细胞进展到CD34- 状态,仅经过三次分裂后,超过50%的检测到的细胞处于该类。此外,可以推断MPPs不赞成自我更新分裂,因为一小部分细胞保留了原始表型。然后可以使用前面图中提供的统计框架来检验其中一些结论。
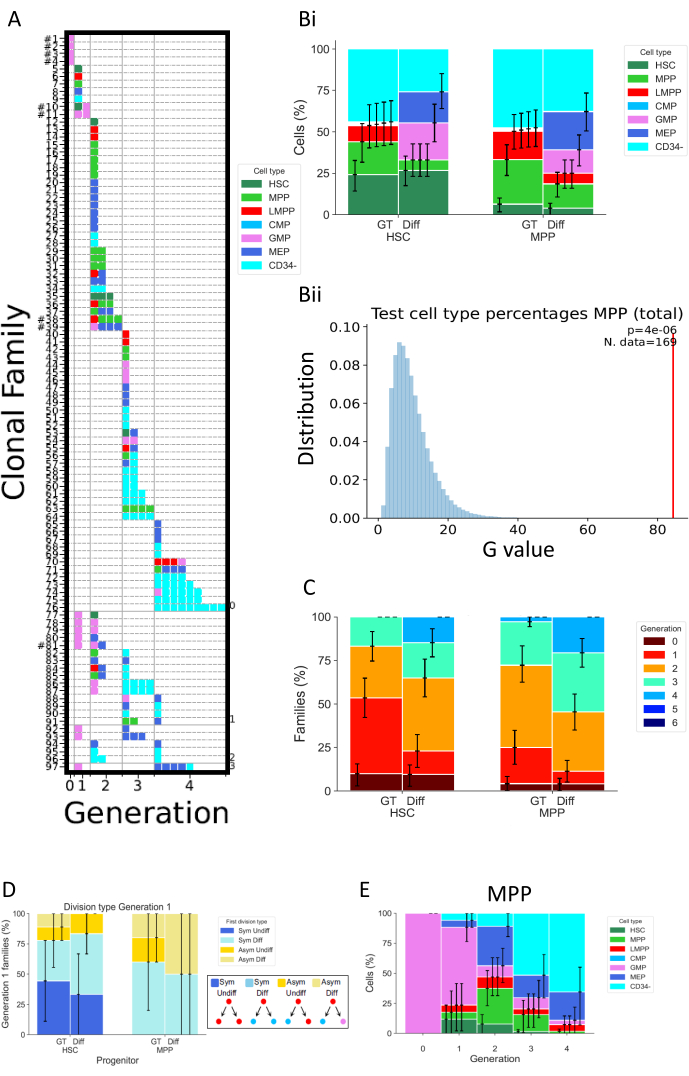
图5:使用脐带血HSPC进行的一项72小时实验的数据表示示例。 (A)选定数据集的热图(HSC,在"Diff"培养基中,培养72小时后)。这些图根据其亲属关系(行)、执行的划分次数(列,称为生成)和表型(颜色)表示所有单个细胞(正方形)。(二)比较条件GT和条件Diff之间的HSC和MPP细胞后代细胞类型比例的直方图(Bii)该图表示在培养72小时时在"2_bar_plot"脚本中对MPP进行的统计测试,比较了"Diff"和"GT"细胞因子混合物。实验值显示为红色,通过 250,000 次排列 生成的 值显示为蓝色。G 检验的 p. 值在右上角表示,并表示用于检验的族数。(C)直方图比较了每个培养条件下HSC和MPPs的每代(颜色编码)中家族(总共314个家庭)的百分比。置信区间是使用 250,000 个自举数据集计算的。(D)直方图表示第1代中具有两个细胞的家庭的子细胞命运之间的对称/不对称类型:Sym Undiff(两个女儿都保留起源细胞的表型),Sym Diff(两个女儿具有相同的表型,并且与起源细胞不同),Asym Undiff(只有一个子保留起源细胞的表型), 和Asym Diff(两个女儿具有不同的表型,并且它们都不像起源细胞)。(E)用"Diff"鸡尾酒培养的MPP每代分类的细胞类型贡献的直方图;n = 204 个细胞和 97 个家族。 请点击此处查看此图的大图。
表5:每个实验条件(起源细胞和细胞培养基)分析的家族和细胞数量的描述。请按此下载此表格。
补充文件1:请点击此处下载此文件。
补充文件2:请点击此处下载此文件。
补充文件3:请点击此处下载此文件。
补充文件4:请点击此处下载此文件。
讨论
MultiGen 检测是一种高通量、易于执行且价格低廉的检测方法,有助于研究淋巴细胞 23、24、35 和鼠造血细胞26,27。在这里,我们介绍了该方法的新发展,该方法允许使用短期培养在单细胞水平上破译人类HSPC承诺的早期阶段(图6)。单细胞离体培养系统通常用于评估HSPC进入成熟细胞的长期命运,但有些命运比其他命运发生得更早36,这可能使分析偏向于更少的命运。此外,这些文化系统通常会在命运承诺期间错过有关分裂的信息。第一个承诺步骤早在文化开始时就已经发生,有时没有划分26,37,这使得短期文化和跟踪分裂对于研究早期命运承诺至关重要。通过同时跟踪命运,分裂和亲属关系,该测定可以了解第一次分裂和命运决定在人类HSPC中的作用。 使用该测定法,可以推断承诺过程发生多少次分裂,这些早期祖先的自我更新和分化之间的平衡,以及这些属性如何代代相传。据我们所知,这是唯一允许以单细胞分辨率对人类HSPC进行这些类型测量的测定。此外,使用不同的细胞分裂染料组合,我们提高了分析的通量,使该测定成为快速生成大型数据集的宝贵工具。染料组合允许跟踪同一孔中的多个家族,从而增加了可用于短期培养分析的细胞数量。通过添加其他染料(例如,黄色染料)或修改CFSE和CTV的比例,组合的数量可能会进一步增加。但是,这减少了可以分析的其他参数的数量。
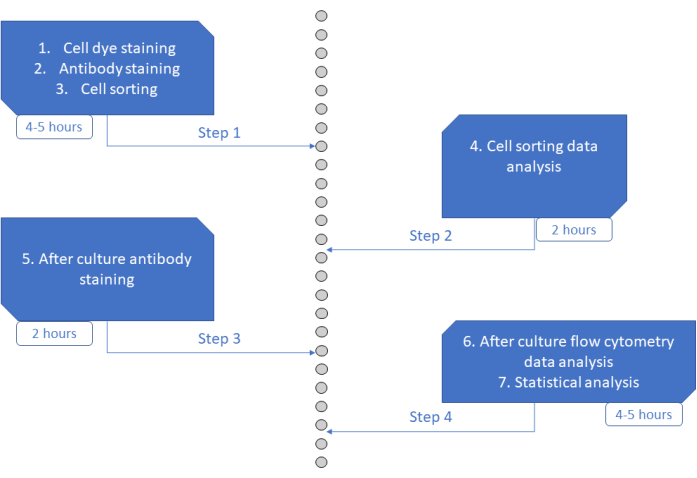
图 6:协议的示意图。 请单击此处查看此图的大图。
为了成功进行分析,由于孔数量多且要分析的细胞数量减少,有必要在配备酶标仪的分析仪上运行流式细胞术分析。新一代台式分析仪特别适用于这种测定,因为它们中的大多数具有较小的死体积,以减少细胞损失的百分比。这反过来又保证了回收整口井的更高效率,促使效率估计在70%范围内26。估计流式细胞术采集过程中的细胞损失对于每个家族的分析至关重要。例如,假设没有细胞死亡并计算分裂次数,则可以估计每个家庭的细胞数量。然而,希望进行一些验证性实验,特别是在测试的培养条件下估计细胞死亡和使用定义数量的细胞进行实验测量回收率。
该协议的关键步骤之一是峰值分配。如前所述,高质量的峰分布在很大程度上取决于细胞分选时非常窄的峰的分离。然而,仍然很难根据分布情况分配正确数量的分区。由于细胞分选和流式细胞术分析是在两台不同的机器上进行的,因此无法直接比较每个信号的强度,因此可能很难知道在直方图右端观察到的第一个峰是峰0还是峰1。在这方面,几乎没有什么解决办法是可能的。一种方法是进行正交实验以准确测量这些细胞进行的分裂次数(例如,活细胞成像)。另一种可能性是在运行流式细胞术分析之前,简单地在倒置明场显微镜下计数孔中的细胞数量。这将推断出平均分裂次数(假设没有细胞死亡)。最后,峰值分配的事后解决方案是检测异常数量的"不可能的家族";这些家族由每代可能数量的细胞组成(例如,第 2 代的五个细胞,或第 1 代的两个细胞和第 2 代的一个细胞)。排除不可能族的可能性在统计分析步骤中编码,并标记不可能族。如果这些误差的发生率太高,则可以合理地假设需要修改峰值分配。
在该协议中,我们包括了一些用于测定的数据表示和分析示例,因为这已成为生成和解释大型数据集的重要步骤38。第一个例子是热图,显示所有分析细胞的总数,按家庭组织。这是探索数据的一般属性和潜在结论的有效工具:家族是由多种细胞类型组成的,还是它们在组成上趋于同质?家庭是分散在多代人中,还是他们大多分裂的次数相同?然后,这种探索性分析需要辅以更具体的绘图和统计测试。它可以用来定量评估对称和不对称的命运承诺、无分裂的分化、自我更新和分化之间的平衡,以及给定承诺命运的分裂次数。在实验计划期间,根据所问问题的类型设置细胞培养长度至关重要;例如,对于前两个问题(对称/不对称平衡和无分裂的分化),规划非常短的培养步骤可以隔离大量仅进行一次或根本没有进行分裂的家族26。相反,更长的实验允许探索特定细胞承诺所需的分裂次数,因为它们对处于不同分化阶段的家族进行采样。然而,该方法不是为长期培养(2-3周)而设计的,因为细胞染料稀释不能准确地跟踪超过7或8个分裂22。因此,该工具主要适用于研究造血祖细胞的早期承诺,而不是对这些细胞的长期分化特性做出可靠的结论。
统计框架是专门为分析这类数据而制定的,并基于排列的概念26。这是必要的,因为观察到家族对细胞类型分布和所进行的分裂次数的依赖性。换句话说,属于同一家族的细胞也更有可能表现出相似的表型并分裂相同的次数。虽然深入分析超出了这项工作的范围,但在评估不同条件时,提供的一组统计测试应该足够了。
总之,该协议构成了以快速和廉价的方式评估造血干和祖细胞离 体细胞的细胞动力学的宝贵工具。由于其在时间点、培养条件和分析的 HSPC 类型方面的灵活性和多功能性,它允许测试各种实验条件。作为一种基于流式细胞术的测定,它可以在大多数实验室中实施,并且不需要广泛的先验知识,使其成为筛选和试点实验的良好候选者。
披露声明
作者声明与本作品没有利益冲突。资助者在研究设计、数据收集和解释或提交作品发表的决定中没有任何作用。
致谢
我们要感谢居里研究所流动设施的成员在建立流式细胞术实验方面的帮助。我们还要感谢佩里团队其他成员在多次讨论中的贡献。我们感谢Julia Marchingo博士和Phil Hodgkin教授(Walter end Eliza Hall医学研究所)分享他们在淋巴细胞上多路复用细胞分裂染料的方案。我们感谢圣路易斯医院脐带血生物库为制定该协议提供必要的生物资源。该研究得到了CNRS和Bettencourt-Schueller基金会(L.P.)的ATIP-Avenir资助, Labex CelTisPhyBio (ANR-10-LBX-0038)(L.P.和A.D.),Idex Paris-Science-Lettres计划(ANR-10-IDEX-0001-02 PSL)(L.P.),Canceropole INCA出现(2021-1-EMERG-54b-ICR-1,L.P.)和ITMO MIIC资助(21CM044,L.P.)的资助。除了欧洲研究理事会(ERC)在欧盟地平线2020研究和创新计划ERC StG 758170-Microbar(至LP)下的资金外,AD还得到了法国基金会的奖学金支持。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
参考文献
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084 (2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041 (2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381 (2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287 (2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540 (2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. . Testing statistical hypotheses. , 784 (2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624 (2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Davison, A. C., Hinkley, D. V. . Bootstrap Methods and their Application. , (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116 (2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898 (2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。