Method Article
フローサイトメトリー による 造血幹細胞と前駆細胞の血縁関係、分裂数、表現型の同時評価
要約
ここでは、細胞分裂の数、表面細胞の表現型、および細胞の親族関係を同時に測定できるフローサイトメトリーベースの技術を紹介します。これらのプロパティは、順列ベースのフレームワークを使用して統計的にテストできます。
要約
同じ細胞の表現型と運命を同時に評価できる技術はほとんどありません。表現型を特徴付けるために使用されている現在のプロトコルのほとんどは、大規模なデータセットを生成することはできますが、目的の細胞の破壊を必要とし、その機能的運命を評価することは不可能です。したがって、造血のような不均一な生物学的分化システムは説明が困難です。細胞分裂追跡色素に基づいて、我々はさらに、多くの単一造血前駆細胞の親族関係、分裂数、および分化状態を同時に決定するためのプロトコルを開発しました。このプロトコルは、様々な生物学的供給源から単離されたマウスおよびヒト造血前駆細胞の ex vivo 分化能の評価を可能にする。さらに、フローサイトメトリーと限られた数の試薬に基づいているため、比較的安価な方法で、シングルセルレベルで大量のデータを迅速に生成できます。また、堅牢な統計フレームワークと組み合わせたシングルセル解析用の分析パイプラインも提供しています。このプロトコルは、単一細胞レベルでの細胞分裂と分化のリンクを可能にするため、対称的および非対称的な運命コミットメント、自己複製と分化のバランス、および特定のコミットメント運命の分裂数を定量的に評価するために使用できます。全体として、このプロトコルは、単一細胞の観点から、造血前駆細胞間の生物学的差異を解明することを目的とした実験デザインに使用できます。
概要
過去10年間は、細胞生物学および分子生物学への単一細胞アプローチの世界的な普及によって特徴づけられました。シングルセルゲノミクス1,2のステップに続いて、今日では、毎年急成長している新しいシングルセルオミクス技術を使用して、単一細胞の多くの成分(DNA、RNA、タンパク質など)を研究することが可能です。これらの技術は、ヒト細胞とモデル生物細胞の両方を使用して、免疫学、神経生物学、腫瘍学などの分野の新旧の質問に光を当てました3。個々の細胞間の違いを強調することにより、シングルセルオミクスは、造血幹細胞と前駆細胞(HSPC)の不均一性を中心に、離散的な均質集団の古典的なモデルから離れて、造血の新しいモデルの定義を促しました4,5。
すべてのオミクス技術のいくつかの欠点の1つは、目的の細胞が破壊され、その機能を評価する可能性を妨げることです。逆に、単一細胞移植アッセイおよび系統追跡技術などの他の単一細胞法は、in vivoで個々の細胞の運命を評価することによって祖先細胞の機能性の読み出しを提供する6,7。系統追跡技術では、目的の細胞を遺伝性遺伝子7または蛍光標識8,9で標識し、複数の単一細胞の運命を同時に追跡できます。しかしながら、出発細胞の特性評価は、典型的には、フローサイトメトリー10によって評価されたいくつかの表面タンパク質の発現など、限られた数のパラメータに制限される。さらに、シングルセル系譜追跡技術では、通常、DNA/RNAシーケンシングまたはイメージングを介して、細胞標識の面倒な検出が必要です。この最後の点は、特に1回の実験でテストできる条件の数を制限します。
単一細胞の機能性を研究するために使用される別のクラスの方法は、単一HSPCのex vivo細胞培養システムである。 実行が容易なこれらのゴールドスタンダードアッセイでは、個々の細胞を96ウェルの細胞培養容器にソーティングし、培養後に、通常はフローサイトメトリーまたは形態素解析によって細胞子孫の表現型を特徴付けます。これらのアッセイは、主にHSPCの成熟細胞への長期分化、典型的には培養2〜3週間後に特徴付けるために使用されてきた11,12。あるいは、それらは、ヒト幹細胞移植に対する医学的利益を約束して、ex vivo HSPCs13、14、15、16、17、18を維持および拡大しようとするために使用されている19。最後に、それらは短期培養20を使用してHSPCの早期コミットメントを研究するために使用されており、この培養で生成される細胞数が少ないことが主な制限要因です。これらの異なる種類のex vivoアッセイの1つの欠点は、それらがin vivoの複雑さを部分的にしか反映していないことです。それでも、それらはヒトHSPC分化を研究するためのまれな方法の1つです。
既存のシングルセル法(シングルセルオミクス、系統追跡、ex vivo培養)から欠落している情報の1つは、HSPCダイナミクスを研究する際に考慮すべき重要なパラメーターである細胞分裂の正確な検出です21。フローサイトメトリーで分割数を評価する簡単な方法は、5-(および6)-カルボキシフルオレセインジアセテートスクシンイミジルエステル(CFSE)22などの可溶性「タンパク質色素」を使用することです。これらの分裂色素は染色された細胞の細胞質内に拡散し、半分に希釈され、細胞分裂ごとに2つの娘細胞に渡され、最大10の分裂を列挙することができます。いくつかの分割色素を組み合わせることで、複数の個体前駆細胞を同じウェルに播種することができ、それぞれの個体色素が異なる子孫の分離を可能にするようにする。これは、マウスリンパ球に最初に導入されたマルチプレックスクローンおよび分裂追跡のための細胞色素の使用の背後にある原理です23,24。
ここでは、マウスおよびヒトのHSPCで使用するためのMultiGenアッセイの開発を紹介します。これにより、多くの単一細胞を同時に試験して、分化、分裂、および親族関係の特性をex vivoでテストできます。このハイスループットで、実行が容易で、安価なアッセイにより、細胞の表現型、実行された分裂数、およびウェル内の他の細胞との細胞の親族関係とクローン関係をすべて同時に測定できます。対称的および非対称的な運命のコミットメント、自己複製と分化のバランス、および特定のコミットメントの運命に必要な分割の数を定量的に評価するために使用できます。このプロトコルには、蛍光活性化セルソーター(FACS)とプレートリーダー付きフローサイトメーターに加えて、細胞培養に必要な機器が必要です。ヒトHSPCでのアッセイを実行するための技術プロトコルに加えて、細胞ファミリー25の概念に関連する細胞特性を評価するために必要な統計的テストを含む詳細な分析フレームワークも提供します。このプロトコルは、マウスHSPCコンパートメント26,27を記述するためにすでに正常に使用されています。
以下のプロトコルは、磁気的に富化されたCD34+ 細胞を出発物質28として使用する。このようにして、異なる血液源(例えば、臍帯血、骨髄、末梢血)からヒトHSPCを効率的に染色および単離することができる。CD34- 画分は、異なるタイプの実験対照を設定するためのプロトコルの一部として使用されるため、廃棄しないことが重要です。上記の細胞量と体積は、実験ワークフローと必要性に応じてスケールアップまたはスケールダウンできます。同様に、このプロトコルは、細胞ソーティングおよびフローサイトメトリーのステップに使用される抗体を改変するだけで、異なるタイプの前駆細胞の研究に適合させることができます。
プロトコル
以下のプロトコルでは、匿名化された臍帯血をHSPCソースとして使用し、サンルイ病院臍帯血バイオバンク(承認AC-2016-2759)およびヘルシンキ宣言によって定義されたガイドラインに従って収集されました。
注意: 開始する前に、 材料の表 に記載され、プロトコルに記載されているように、このプロトコルに必要なすべての試薬と機器が利用可能であることを確認してください。関連する試薬を新鮮に準備し、明示的に言及されていない限り、保管しないでください。
1. 細胞色素染色
注:このセクションでは、CFSEとバイオレット染料(CTV)細胞分裂染料の4つの組み合わせによる染色について説明します。細胞色素溶液を添加しなくても、すべてのチューブを同時に処理します。全ての工程は、以下の細胞培養工程を可能にするために無菌条件下で行われる。所要時間:約100分
- 磁気選別プロトコル29に従って臍帯血ユニットを処理する。大きなCD34- 画分と小さいCD34+ 画分の2つの画分が利用可能であることを確認してください。両方のチューブを300 x gで5分間回転させます。ペレットを乱すことなく上清を吸引する。
- CD34+ 画分については、ウシ胎児血清(FBS)を含まないダルベッコ改変イーグル培地(DMEM)1 mLに再懸濁します。血球計算盤を使用して細胞をカウントします。細胞密度は、3 x 106 細胞/ mLを超えてはなりません。この場合は、それに応じて音量を調整してください。CD34- 画分については、FBSなしでDMEMに再懸濁し、容量を最大6 x 106 細胞/ mLに調整します。
- 250 μLのCD34+画分を4本の15 mLポリプロピレンチューブに分注します。チューブに次のようにラベルを付けます:CD34 + / CF(CFSE_only)、CD34 + / CV(CFSE_high CTV_low)、CD34 + / VC(CFSE_low CTV_high)、およびCD34 + / VI(CTV_high)。250 μLのCD34-画分を別の4本の15 mLポリプロピレンチューブに分注します。チューブに次のようにラベルを付けます:CD34-/ CF(CFSE_only)、CD34-/ CV(CFSE_high CTV_low)、CD34-/ VC(CFSE_low CTV_high)、およびCD34-/ VI(CTV_high)。CD34-画分由来の残りの細胞は廃棄することができる。
- CFSE_high と CFSE_low という名前の 2 つの CFSE ソリューションを準備します。CFSE_high(10 μM)の場合、FBSなしのDMEM1.1 mLとCFSEストック(5 mM)溶液2.2 μLを混合します。CFSE_low (5 μM) の場合は、FBS なしの DMEM 550 μL と CFSE ストック (5 mM) 溶液 0.55 μL を混合します。
- CFチューブとCVチューブに250 μLのCFSE_high溶液、VCチューブに250 μLのCFSE_low溶液、FBSなしのDMEM250 μLをVIチューブに加えます。細胞懸濁液と細胞色素を効率的に混合するには、チューブをほぼ90度傾け、CFSE溶液をチューブ壁に堆積させます。次に、チューブを垂直に保持して2つの溶液を混合し、ピペットを3〜4回使用して、CFSE溶液と再懸濁された細胞との迅速な混合を確保します。37°Cで正確に8分間インキュベートします。
- インキュベーション後、5 mLのDMEM + 10%FBSを加えます。チューブを37°Cで5分間保ちます。
- チューブを300 x gで5分間回転させます。ペレットを乱すことなく吸引 によって 上清を除去し、5 mLのリン酸緩衝生理食塩水1x /エチレンジアミン四酢酸(PBS 1x / EDTA)でペレットを洗浄します。300 x gで5分間再び回転します。ペレットを乱すことなく上清を廃棄し、細胞ペレットを250 μLの1x PBS / EDTAに再懸濁します。
- CTV_high と CTV_low という名前の 2 つの CTV ソリューションを準備します。CTV_high(10 μM)の場合は、1.1 mLのPBS 1x/EDTAと2.2 μLのCTVストック(5 mM)を混合します。CTV_low (5 μM) の場合、550 μL の PBS 1x/EDTA を 0.55 μL の CTV ストック (5 mM) と混合します。
- 250 μLのCTV_high溶液をVCおよびVIチューブに、250 μLのCTV_low溶液をCVチューブに、250 μLの1x PBS / EDTAをCFチューブに追加します。手順 1.5 で説明したのと同じ手法を使用します。37°Cで正確に8分間インキュベートします。
- インキュベーション後、5 mLのDMEM + 10%FBSを加えます。37°Cで5分間保ちます。
- チューブを300 x gで5分間回転させ、ペレットを乱すことなく上清を廃棄してから、5 mLの1x PBS / EDTAでペレットを洗浄します。300 x gで5分間再び回転します。
- ペレットを乱すことなく上清を廃棄し、CD34- 画分を1x PBS / EDTAに再懸濁して、最終濃度1.5 x 106 細胞/mLにします。CD34+ 画分を40 μLの染色バッファーに再懸濁し、細胞を1.5 mLチューブに移します。
2. 抗体染色
注:抗体染色は、実験のニーズに応じてカスタマイズできます。CD34+ 画分のみが抗体染色を受けます。CD34- 画分は、細胞分裂色素の組み合わせ(CV、VC、CF、およびVI画分)の単一染色コントロールとして使用されます。以下のパネルは、造血幹細胞(HSC)、多能性前駆細胞(MPP)、リンパ質プライミング多能性前駆細胞(LMPP)、造血前駆細胞(HPC)の4種類のHSPCを検出するように調整されています12。ただし、HSCとMPPの識別が提示されています。所要時間:75分
- 補正ビーズを使用して、表面染色用の単一染色を準備します。陰性ビーズと免疫グロブリンG(IgG)ビーズを1:1の比率で混合し、総容量は20 μL×表面マーカーの数(例えば、染色パネルに6つの抗体が含まれている場合は120 μL)に相当する量にします。
- マーカーごとに20 μLのビーズを個別の1.5 mLチューブに送ります。対応するチューブ内の各抗体の希釈倍率に対応する容量を追加します(たとえば、希釈倍率が1:20の場合は、1 μLを追加します)。
- CD34+細胞を染色するために、表1に基づいて抗体12のマスターミックスを調製します。抗体を単一の0.5 mLチューブに混合します。抗体マスターミックスから7 μLを4つのCD34+条件のそれぞれに追加します。
- 補正ビーズとCD34+ サンプルを4°Cで少なくとも30分間インキュベートします。
注:インキュベーション時間は、染色に使用される抗体の技術的な詳細に適合させる必要があります。 - インキュベーション中に、マルチチャンネルピペットを使用して各ウェルに100 μLの細胞培養培地を加え、ソーティングに使用する96ウェルの丸底プレートを準備します。
注意: ウェルH8-H12は空のままにします。 - 表面染色コントロール(5、ビーズを使用)、細胞分裂色素コントロール(4、CD34- 画分を使用)、およびCD34+ サンプル(4)用の5 mLポリプロピレンチューブを標識します。
- インキュベーションの最後に、細胞とビーズを1 mLの染色バッファーで洗浄します。全容量を5 mLポリプロピレンチューブに移します。チューブを300 x gで5分間遠心分離し、ペレットを乱すことなく上清を吸引します。
- ビーズとCD34+ 細胞にそれぞれ約500 μL、CD34- チューブに1 mLを使用して、細胞を染色バッファーに再懸濁します。
表1:セルソーティング実験用の抗体マスターミックスを調製するためのテンプレート。この表をダウンロードするには、ここをクリックしてください。
3.セルソーティング
注 : 並べ替えられるセル番号は、使用可能なセルの合計数によって異なる場合があります。プロトコルでは、各コントロールの最小セル番号が提供されます。所要時間(1枚の場合):100分
- テンプレート実験を開くか、新しい実験を設定します。1 つの試験片と複数のチューブを、各条件ごとに 1 つずつ作成します。
- 図1で詳述したゲーティング戦略を設定し、6つのドットプロット 図を作成します。まず、FSC-A/SSC-Aドットプロットでセルを視覚化し、 ポリゴンゲーティングツール をダブルクリックして、側方散乱の低い母集団を選択します(図1A)。次のドットプロット(FSC-A / FSC-H)で、 プロット を右クリックし、ドロップダウンメニューからゲート「セル」をクリックして選択します。同じ ゲーティングツールを使用して 、2つの軸間の対角線上のタイトな母集団を選択します(図1B)。
- 3番目のドットプロット(APC対FSH-H)で、母集団「単一細胞」を表示し、APC系統(Lin)の発現に対して陰性の細胞をゲートします(図1C)。4番目のプロット(CFSE対CTV)で、母集団「Lin-」を表示し、色素の組み合わせごとに1つずつ、4つの分離ゲートを作成します(図1D)。
注:均質に染色された細胞のごく一部のみを選択するには、これらのゲートをしっかりとする必要があります。 - 5番目と6番目のプロット(APC-Cy7対BV650およびPE-Cy7対PE)を使用して、目的の前駆細胞を特定します。5番目のプロットのCD34 + CD38-集団とCD34 + CD38+を寛大にゲートします(図1E)。次に、6番目のプロットでCD34+CD38-集団を選択し、図1Fに従って3つのゲートを描画します。
- 補正ビーズを含む単一の染色チューブを実行し、[ 取得 ]ボタンをクリックします。 [パラメーター ]ドロップダウンメニューから、特に細胞分裂色素(2指数スケールで104 から105 の間)の光電子増倍管(PMT)電圧を調整します。
- [ 補正 ] タブを使用して、並べ替えに使用するパネルに応じて補正マトリックスを調整します。ビーズゲートに少なくとも5,000のイベントを記録し、[ 記録 ]ボタンをクリックします。
- CD34- 分数を実行し、補正行列を再度確認します。単一セル ゲートで少なくとも 10,000 イベントを 記録 します。
- CD34+ フラクションを実行し、シングルセルゲートで少なくとも5,000のイベントを記録します。色素の組み合わせごとにゲートを調整し、タイトなゲートを設定して均質な集団を選択します(図1D)。同様に、HSC と MPP を選択するためのゲーティングを調整します。
- 分析が完了し、すべてのチューブが記録されたら、96ウェルプレートでソーティングするための標準Ariaキャリブレーションを実行した後、プレートを適切なホルダーに挿入します。プレートを冷却することをお勧めします。
- 実験ソートレイアウトを使用して、表2に示すスキームに従ってプレートソーティングテンプレートを準備します。「CD34-」と名付けられたウェルには、CF/CV/VC/VIゲートでソートされた5,000〜10,000個の細胞が含まれています。「バルク」ウェルには、ゲートCD34 + CD38-でソートされた少なくとも500個の細胞が含まれています。最後に、単一細胞ウェルには、ウェルごとの細胞分裂色素の組み合わせごとに1つのイベントしか含まれていないため、ウェルあたり合計4つのイベントが含まれます。
注:「バルク」集団は、特定の祖先のサブセットに適合させることができます。500 個未満のセルを並べ替えないでください。 - 選別は順番に進み、すべての細胞分裂色素の組み合わせを完了してから次のものに移ります。例えば、CD34- CFを 収率 純度モードで選別することから始めます。取得ボタンをクリックしてから、並べ替えボタンをクリックします。
- CD34- ソーティングの最後に、CF CD34+ チューブを挿入します。取得し、並べ替えボタンをクリックして、純度グレードとして0/ 16/0 にチェックマークを付けていることを確認します。最後に、目的のセルをウェルごとに1セルずつ単一 セル の純度でソートし、[ インデックスソート ]オプションにチェックマークを付けます。
- 以下の細胞分裂色素の組み合わせに移り、同じ順序を繰り返す。参考として、 表2 は選別されたプレートの例を提供する。
注: インデックスソート機能は、ソートされた条件ごとに個別のファイルを生成します。 - 並べ替えの最後に、ファイルを .fcs 3.0 ファイルとしてエクスポートします。細胞を37°C、5%CO2 インキュベーターに入れる。細胞は、実験計画に従って、少なくとも24時間26日間培養される。
表2:連続フローサイトメトリー分析のための特定の要件に基づく、セルソーティング96ウェルプレートのテンプレート。この表をダウンロードするには、ここをクリックしてください。
4. セルソーティングデータ解析
注:セルソーティングの品質を検証するには、先に進む前にFACSデータ分析が必要です。この手順の主な出力は、並べ替えられた個々のセルのマーカー強度を含むスプレッドシートの生成です。
- 解析ソフトウェアで .fcs 3.0 ファイルをアップロードします。
- 実際のソーティングの前に記録された単一の染色ファイルを使用して、セルソーティング中に使用された補正設定を確認します。
- 異なるバルクに対応するファイルを使用して、改訂されたゲーティング戦略を設定します。これらのゲートをコピーして、インデックスソートファイルに貼り付けます。
- インデックスソートされたセルが設定されたゲートに落ちたことを確認します。誤ってゲートされたソートされたセルがある場合は、インデックスソート中に記録されたプレート座標をエクスポートすることで識別し、分析の後半で削除できます。
- インデックスソートファイルからイベントを補正パラメータとしてエクスポートします。それらを.csvファイルとしてエクスポートし、「スケール値」と「補正されたパラメータ」のオプションにチェックマークを付けます。これらのファイルは、「エクスポートされたファイル」という名前のフォルダーにエクスポートする必要があります。
- 補足ファイル 1 のスクリプトを使用して、すべてのファイルを 1 つの .csv ファイルに結合します。関数 "setwd"で正しいパスを設定します。このスクリプトの出力は、すべての異なるゲート イベントとすべてのパラメーターの相対強度を含むスプレッドシートです。
5. 培養後抗体染色
注意: プロトコルのこの部分は無菌状態で実行してください。いくつかの試薬は前のステップと共有されており、無菌状態を維持する必要があります。フローサイトメトリー分析には、プレートリーダー付きのフローサイトメーターを使用します。これにより、組織培養プレート内で直接染色を行うことができ、ピペッティングおよびスピニングの量を制限することにより細胞損失を最小限に抑えることができる。CF/CV/VC/VI カラーの単一染色を表し、96ウェルプレートにすでに存在するウェルA1〜A4を除き、補正ビーズを使用して表面マーカー単色染色を準備します。細胞色素に従ってソートされたバルク集団は、分裂数と一般的なゲーティングのゲーティング戦略を設定するのに役立ちます。所要時間:120分
- プロトコルを開始する前に、倒立顕微鏡でプレートをチェックして、少なくとも1つのセルを含むウェルに印を付けます。このステップにより、染色に使用される抗体の量を最適化し、手順をスピードアップできます。
- 抗体マスターミックスを調製し、 表3に従って。かなりの量のピペッティングがあるため、この表では、追加の5%容量を含む、ピペッティングによる技術的エラーを考慮しています。表に記載される抗体は、ヒト臍帯血試料12からのHSPCの範囲を特徴付けることを可能にする。
- プレートを300 x gで5分間遠心分離します。フードの下とペーパータオルの上にプレートをすばやく反転させて、上清を取り除きます。
- 8 μLの染色バッファーをウェルA1-A4に加えます。8 μLの混合物を他のウェルに加えます。
- ネガティブビーズとIgG補正ビーズを1:1の比率で混合し、総容量120 μLに相当する量にします。 各マーカーごとに1.5 mLチューブに20 μLを送ります。希釈倍率に対応する抗体量を追加します(例:希釈倍率が1:20の場合は、1 μLを追加します)。
注:総容量を染色に使用するマーカーの数に合わせて調整します(例:染色パネルに5つの抗体が含まれている場合は100 μL)。 - プレートと単一染色補正コントロールを+4°Cで少なくとも30分間インキュベートします。
注:インキュベーション時間は、染色に使用される抗体の技術的な詳細に合わせて調整する必要があります。 - ビーズを1 mLの染色バッファーで洗浄します。前述した5 mLのポリプロピレンチューブに全容量を移します。チューブを300 x gで5分間遠心分離し、吸引 によって 上清を除去します。
- マルチチャンネルピペットを使用して、ウェルあたり100 μLの染色バッファーを加えてプレート内の細胞を洗浄します。プレートを300 x g で5分間遠心分離し、フードの下とペーパータオルの上でプレートをすばやく反転させて、上清を除去します。
- マルチチャンネルピペットを使用して、85 μLの染色バッファーに細胞を再懸濁します。
- フローサイトメーター(取得モード)で、専用のテンプレートを使用して カスタムをクリックして分析を開始します。このカスタマイズされたテンプレートは、96ウェル丸底プレートの技術的特徴、特に各ウェルの寸法(直径、深さ、厚さ)を考慮に入れています。プローブは井戸の底に到達する必要があるため、井戸A1とH12の正確な中心に置きます。
- ソフトウェアによって提案されたリストから目的の 蛍光色素 を選択した後、表2のプレートテンプレートに従って プレートセットアップ を設定し、少なくとも1つのセルを含むウェルの数を補正します。
- 取得容量の上限として100 μLを選択します。攪拌オプションにチェックマークを付けます。取得速度を最大1 μL/sに設定し、低速化するとウェルあたりの総分析量が向上します。
- 適切な洗浄および洗浄液をウェルH8-H12に追加します。 表2 のテンプレートは、フローサイトメーターが分析の最後にさまざまな洗浄条件を実行する必要があるため、ウェルH8-H12を空のままにします。
注:このステップは、使用するフローサイトメーターの詳細に適合しています。 - プロットとゲートのセクションで、最初にFSC-A/SSC-A散布図を使用して単一セルゲートを設定し、次にFSC-H/FSC-A散布図を使用します。対象のマーカーごとに ヒストグラム を作成します。
- 設定を確認したら、[ 分析 ]セクションに進みます。最初に単一染色を分析し、補正ビーズとCD34染色画分の両方について、5,000イベント以上(最適範囲:5,000〜15,000イベント) を記録 します。必要に応じて電圧を調整します。
- 単一の染色がすべて記録されたら、取得機能をクリックして実際の 取得 を開始できます。
表3:フローサイトメトリー実験、特にヒト臍帯血からのHSPCの同定のための抗体マスターミックス。この表をダウンロードするには、ここをクリックしてください。
6. 培養後のフローサイトメトリーデータ解析
メモ: 説明されているデータ分析は、 材料表に記載されているソフトウェアに固有のものです。主な出力は、分析された各セルごとの表面マーカー強度、分割数、および親族関係の情報を含むスプレッドシートの生成です。プロトコルのこの部分には、最終的な分析スプレッドシートを生成するためにこのワークフローに必要な、Rで記述されたスクリプトが含まれています。
- フローサイトメーターからファイルを.fcsファイルとしてエクスポートします。それらを解析ソフトウェアにアップロードし、「単一染色」、「バルク」、「シングルセル」としてグループ化します。
- 単一の染色ファイルを使用して補正マトリックスを準備し、 ドラッグアンドドロップで他の2つのグループに適用します。
注意: 自動補正ツールを使用する場合は、先に進む前に手で品質を確認してください。 - 代表的なゲーティングを作成するには、異なるバルクウェルを1つのファイルに連結します。この手順では、2 つの色が重なっているかどうか (通常は CV と VC)、またはその他の異常が強調表示されるため、除外する必要があります。 母集団の連結 オプションをクリックした後、「パラメータ」メニューからすべての 補正されていないパラメータ を選択し、 連結をクリックします。
- 連結されたファイルをワークスペースにアップロードし、ドラッグアンドドロップで補正マトリックスを適用します。
- 連結されたファイルを使用して、 図 2 で定義したゲーティング戦略を準備します。単一セル ゲートで、CFSE と CTV を使用して散布図にイベントを表示します。Labeledという最初のゲートを作成し、4色すべてを含み、可能な自己蛍光を除外します(図2C)。次に、各色を個別にゲートします。
- CVおよびVCで標識されたセルは、色がCFSEおよびCTV信号の結果であることを考慮して、変換された値を必要とする。したがって、2つの調整された信号は対数スケールで45°回転し、分割希釈をx軸と平行に進めることができます。この変換された値は、[ツール]、[ パラメーターの作成] の順にクリックして手動で取得されます。次の数式を 数式 ボックスに貼り付けます。

メモ: 式26 では、CFSE と CTV がパラメータ 03 と 17 であることを前提としています。 - [派生パラメーター] という名前のこの新しいパラメーターを正しく視覚化するには、~3-7 の範囲の直線軸を設定し、[軸] パラメーター オプションをクリックして [ 軸のカスタマイズ] を選択します。
- ヒストグラムプロットとして各色に個別にゲーティングを適用します:CFとVIの場合、それぞれx軸に CFSE-A と CTV-A を設定します。CV および VC の場合は、新しく 派生したパラメータ を X 軸に設定します。 図3に示すように、各ピークに対応するゲートを設定します。
- 個々の単一セルウェルにゲーティングを適用します。分析されたすべてのウェルに派生パラメータを追加してください。各ウェルの各カラーゲートを手動で検証して、特定のピークに誤って割り当てられているイベントを検出します。ゲーティングの例を 図 4 に示します。
- 解析が完了し、すべてのウェルが検証されたら、少なくとも1つのセルを含むすべてのCF/CV/VC/VIゲートを選択します。それらを.csvファイルとして エクスポート し、「スケール値」と「補正されたパラメータ」のオプションにチェックマークを付けます。これらのファイルは、「エクスポートされたファイル」という名前のフォルダーにエクスポートされます。
- 補足ファイル 1 の R スクリプトを使用して、すべてのファイルを 1 つの.csvに結合します。関数 "setwd"で正しいパスを設定することを忘れないでください。このスクリプトの出力は、すべての異なるゲート イベントとすべてのパラメーターの相対強度を含むスプレッドシートです。
- スプレッドシートを開き、CFSE、CTV、CD90、CD123、CD45RA、CD34、CD38 などの名前を使用して、各パラメーターの列の名前を変更します。これらの名前は、各セルに ID を正しく割り当てるためのゲーティングしきい値を識別するために使用されます。
- "Well"、"Condition"、"Color"、"Generation"、"Original_cell"、および "Culture_time" という名前の 6 つの列を追加します。これらの変数は実験的に定義された変数であり、各行から推論されます。
export_A10 CD34 + PBS_CV_Peak 1.csv.1 = A10 (ウェル)、CD34+( Original_cell)、PBS(状態)、CV(色)、Peak_1(生成)。 - バルクウェルをエクスポートしてゲーティングのしきい値を特定します:補償された対象母集団(CD34 + CD38-など)を.csvファイルとしてエクスポートし、「スケール値」と「補正されたパラメータ」オプションにチェックマークを付けます。これらのファイルを「エクスポートされたファイル」という名前のフォルダーにエクスポートします。
- CD38 のしきい値を見つけるには、このパラメーターの最大数値を特定します。逆に、CD34のしきい値を見つけるには、このパラメーターの最小数値を特定します。目的のすべてのパラメータに対してこのプロセスを繰り返します。
注:プロトコルに示されている分析では、マーカーCD45RAを使用して、CD34 + CD38-ゲートのLMPPとCD34 + CD38 +ゲートのCMP / GMPを識別します。これは、このマーカーに対して 2 つの異なるしきい値を抽出する必要があることを意味します。 - しきい値をコピーして「gating_matrix」というExcelファイルに貼り付けます。このファイルは 表4に従って編成されており、複数の独立した実験の分析を可能にします。XXYYMMDD_xxh、XXは演算子の2つのイニシャル、YYは年の最後の2つの数字、MMは月、DDは日、xxは分析時点を表します。
表4:統計解析前の細胞運命割り当てのゲーティングマトリックス。 CD45hはHPCサブセットゲーティングのCD45RAの強度を指し、CD45lはCD34+CD38- サブセットのCD45RAの強度を指します。 この表をダウンロードするには、ここをクリックしてください。
7.統計分析
注: 生成されたデータの統計テストには、プログラミング言語 Python (補足ファイル 2、補足ファイル 3、および補足ファイル 4) を使用してコーディングされたカスタムメイドの分析パイプラインが含まれます。スクリプトは、スプレッドシートを処理するための最初のブロック、データ視覚化用のヒートマップを生成するための2番目のブロック、および差別化と分割のプロパティを分析およびテストするための複数のヒストグラムを生成する最後のブロックの3つのブロックで構成されています。
- ブロック「0_process_data」(補足ファイル2)から開始して、gating_matrixとデータスプレッドシートのパスがスクリプトで正しく定義されていることを確認します。
- 「cell_cols」辞書を定義して、関連するセルの運命を各セルに割り当てます。特定のケースでは、運命はHSC、MPP、LMPP、一般的な骨髄系前駆細胞(CMP)、顆粒単球性前駆細胞(GMP)、巨核球性赤血球前駆細胞(MEP)、およびCD34-です。
- バルクウェルから定義された閾値(ステップ6.16)を使用して、「cell_class_exp_time」関数を定義します。手順 6.12 で各列を定義するのに使用したのと同じ名前を使用して、これらのしきい値を正しく定義するには、列の名前付けに一貫性を持たせることが不可欠です。
- 細胞表現型は、フローサイトメトリー分析中に検出された閾値に基づいて、一連の「if-else」ステートメントを使用してスクリプトで定義されます。
注:他のマーカーの組み合わせに対応するようにこれらのステートメントを変更することにより、さまざまな表現型を表示できます。 - 関数「cond_rule」を使用して、実験固有の条件を指定します(たとえば、異なる実験的処理)。指定されたデータセットの場合、条件には "GT" と "Diff" という名前が付けられます。細胞の培養に使用される2つの異なる細胞培養培地について説明します。この情報は、ヒートマップをプロットするためにブロック「1_dot_plot」(補足ファイル3)によって使用されます。
- ブロック「2_bar_plot」(補足ファイル4)で、関心のある離散セルの運命を含む辞書「class_dct」を定義します。提供されたデータセットの場合、関心のあるセルの運命は、「cell_cols」辞書で説明されているものと同じです。
- "conds" (条件)、"or_cells" (元のセル)、"sym_labs" (対称ラベル)、および "時間" (実験時点) を定義します。これらは、プロットに必要なフィルターを繰り返しています。「conds」は「cond_rule」で定義された条件を再度取り、「or_cells」はHSCとMPPであり、「sym_labs」は分割の種類を表します。
- ブロック「2_bar_plot」では、分裂6まで進行した細胞をプロットすることが可能です。
注:提供されるデータセットにはディビジョン4までのセルしか含まれていないため、エラーメッセージが表示されますが、スクリプトの動作を妨げることはありません。 - スクリプトによって生成された図は、「figures」という名前のフォルダにpdfファイルとして取得できます。「Test」という名前のファイルは、対応するヒストグラムに対して実行されるさまざまな統計的検定を表します。
結果
FACS ソート
このプロトコルで提示されたソートゲーティング戦略は、広く受け入れられている戦略12、30、31に基づいている。図1に示すゲーティング戦略では、出発物質はCD34+磁気濃縮によって以前に精製された臍帯血前駆細胞であり、これは系統陽性細胞のごくわずかな割合を説明しています。4つの細胞内色素の組み合わせ(図のCTVなど)にはタイトなゲートを使用し、次の分析中にピークの分解能を向上させ、正しい細胞集団をゲートすることが不可欠です(図1D)。図に表示されているケースでは、ゲートは最大かつより明確に定義された母集団を選択します。細胞分裂色素の組み合わせごとに複数の近い集団が存在することは、私たちの経験では、生物学的な違いを表すものではありません。代わりに、a)最適ではない染色手順、またはb)細胞の開始プールにおける大きな不均一性(特にサイズ)を示している可能性があります。これは、臍帯血または他の複雑な生物学的供給源(例えば、骨髄穿刺、末梢血)から開始する場合、予想外ではない。ゲートが厳密に定義されていない場合、異なる色素の組み合わせを徐々に希釈すると、特に条件CVとVCに対して、後のピークがマージされる可能性があります(図2D)。次善ゲーティングの別の悪影響は、不均一な開始集団が浅いピークにつながる可能性があるため、細胞培養後に異なるピークを効率的に区別できないことです。
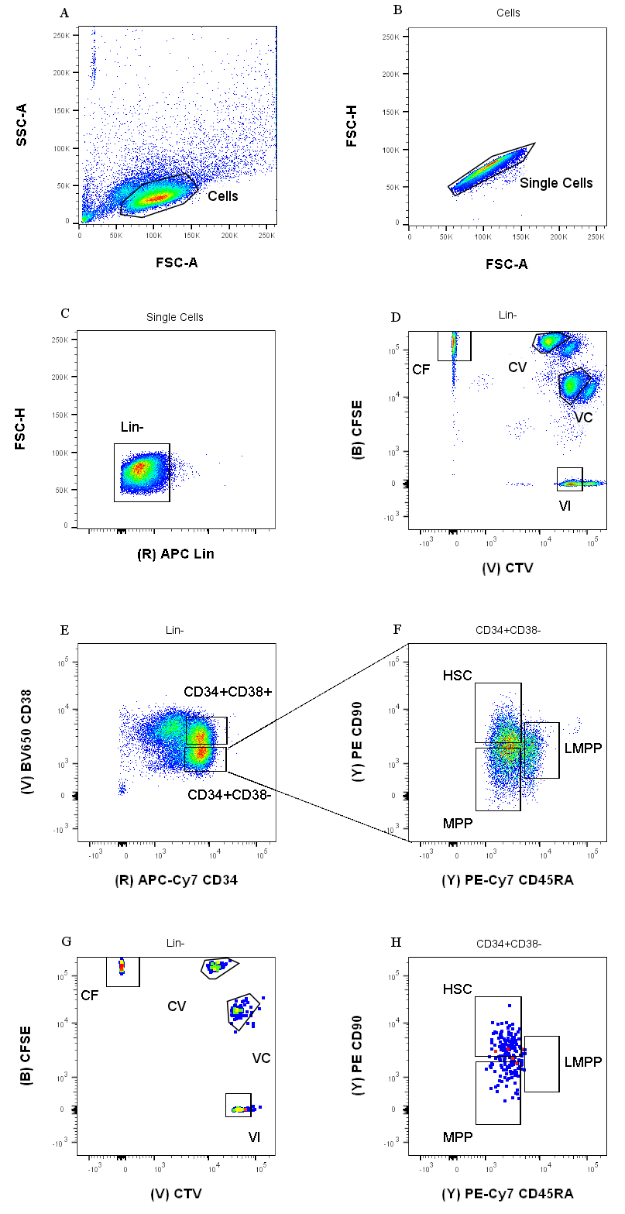
図1:セルソーティングのためのゲーティング戦略。 (A)FSC-A対SSC-A、デブリおよび汚染細胞を除外する。(b)FSC-A対FSC-H、ダブレットおよび細胞凝集塊を除外する。(c)Lin対FSC-Hが、Lin+である細胞を除外する。(d)CTV対CFSEを、色素組合せCF、CV、VC、およびVIで染色した細胞を一義的に同定する。ゲートは、均質な人口を含めるのに十分厳密でなければなりません。(e)CD34対CD38を、CD34+CD38−の多能性区画から制限された前駆細胞CD34+CD38+(HPCsとも呼ばれる)から分離する。(f)CD45RA対CD90は、CD34+CD38-集団から、造血幹細胞に富む最も未熟な前駆細胞(CD90+CD45RA−)、LMPP(CD90中期CD45RA+)、およびよりコミットされたMPP(CD90−CD45RA−)の間で分離する。(G)それらの細胞色素組合せ染色および(H)表面マーカーCD90およびCD45RAの発現についてここに表されるソートされた事象のインデックス。この図の拡大版を表示するには、ここをクリックしてください。
細胞培養後のフローサイトメトリー解析
図2のデータは、さまざまな骨髄系前駆細胞および前駆体をサポートできる複数のサイトカインの存在下で72時間培養したヒト臍帯血HSCの代表です。パネル2A〜2Dは、個々の細胞の各々の親族関係を確立するために必要なゲーティングを表し、一方、パネル2E〜2Gは、細胞表現型形成を可能にする。図中のMEPsの存在の減少は、おそらくこの代表的な実験に使用された培養条件の結果です(図2F)。異なるサイトカインおよび培養条件を使用して、実験のために異なる開始細胞を選択するのと同様に、各サブセットの相対的なパーセンテージを変化させる。
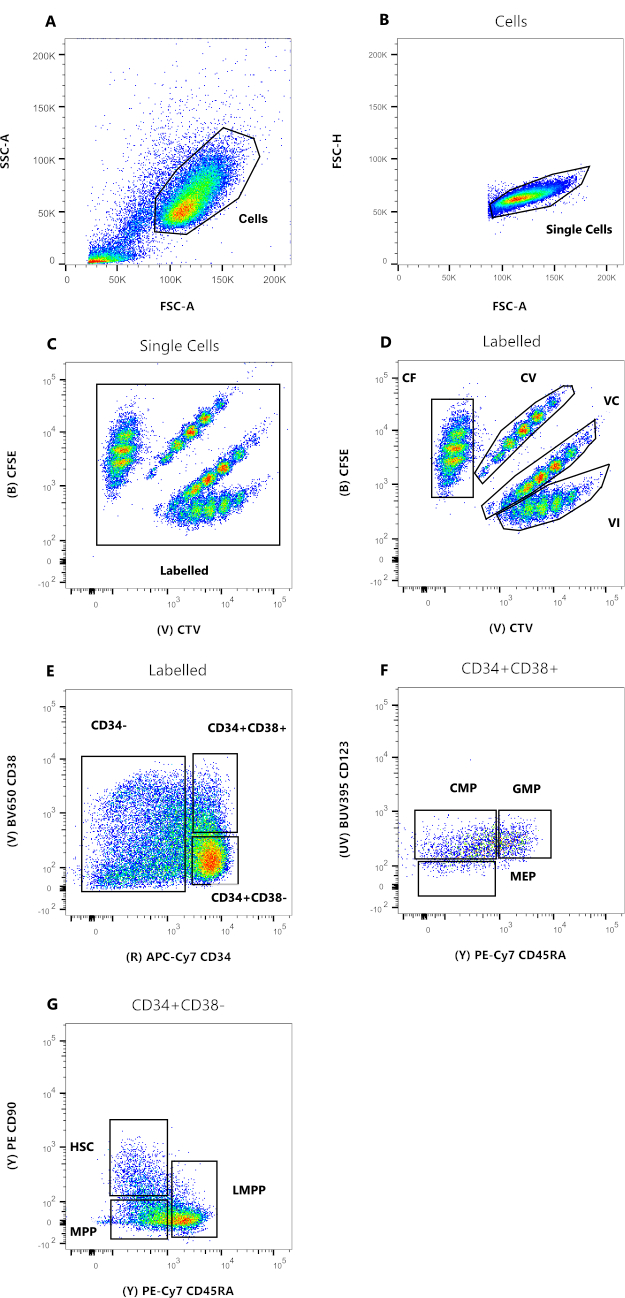
図2:フローサイトメトリー解析のためのゲーティング戦略。 (a)FSC-A対SSC-A、デブリおよび汚染細胞を排除する。(b)FSC-A対FSC-H、ダブレットおよび細胞凝集塊を除外する。(C)CTV対CFSE、ゲートラベルにより、データ分解能に影響を与える可能性のある自動蛍光イベントを除外できます。(D) CTVとCFSEの比較。細胞分裂色素希釈に基づいて、4つの集団を厳密にゲートすることが非常に重要です。(e)CD34対CD38、コミットされた前駆体(CD34-)、制限された前駆細胞(HPC)(CD34+CD38+)、および未熟な前駆細胞(CD34+CD38-)を区別する。(F)CD45RA対CD123、CMP(CD123+CD45RA−)、MEP(CD123−CD45RA−)、およびGMP(CD123+CD45RA+)の3種類の制限前駆細胞を区別する。(G)CD45RA対CD90、CD34+CD38-から、HSC、LMPP、およびMPPを同定する。 この図の拡大版を表示するには、ここをクリックしてください。
ピークの定義と割り当ての手順(図3および図4)はプロトコルの重要な側面であり、厳密なゲートの定義が必要です。ピーク定義(図3)では、信頼性の高い同定のために少なくとも1,000イベントが必要です。この意味で、「バルク」ウェルの細胞選別ステップ中により多くの細胞を単離することが有益である可能性があります。図4は、複数のファミリーを含む単一ウェルの4つの例を示しています。この図は、図2Dと図3のゲーティングの重要性、特に各ファミリと各ピークの識別にとっての重要性を明確にしています。図4Aは、ゲートCF内のすべてのセルが互いに非常に近く、単一のピークに容易に割り当てることができるため、簡単な例を示しています。図4Cは、図4Dのヒストグラムに明確に示されているように、2つのよく離れたピークに一義的に分布するファミリーの別の例を示しています。図4E,Gは、多数のイベントに基づく厳密なゲーティングの重要性を明らかにしています。どちらも近いイベントはほとんど表示されませんが、染料の組み合わせゲートの外側にあります。これらのイベントは、シングルウェル分析のみに基づいて、VIゲートとCFゲートに誤って含まれる可能性があります。最後に、図4F、Hは、複数のピークに広がるファミリーの2つの異なる例を示しており、1つは2つの同様の強度ピークの例(図4F)と1つは2つの等しくない強度ピーク(図4H)を示しています。
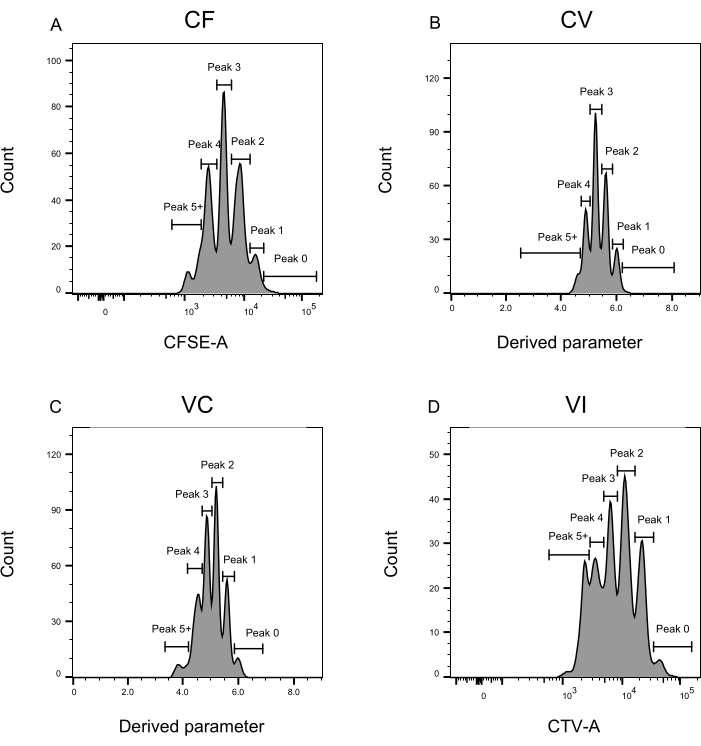
図3:フローサイトメトリー解析のピーク定義。 (A-D) ピークは、個々のピークごとに適切な表現を保証するために、少なくとも500のイベントを登録するように定義する必要があります。(A) CFSE-A 強度のヒストグラム。いくつかのピークを同定することができ、それぞれが分裂細胞の異なる集団に対応する。(B,C)導出されたパラメータの強度についてのヒストグラムは、CFSE−CTV混合物、CV(B)およびVC(C)をそれぞれ表す。(D)CTV-A強度のヒストグラム。この図の拡大版を表示するには、ここをクリックしてください。
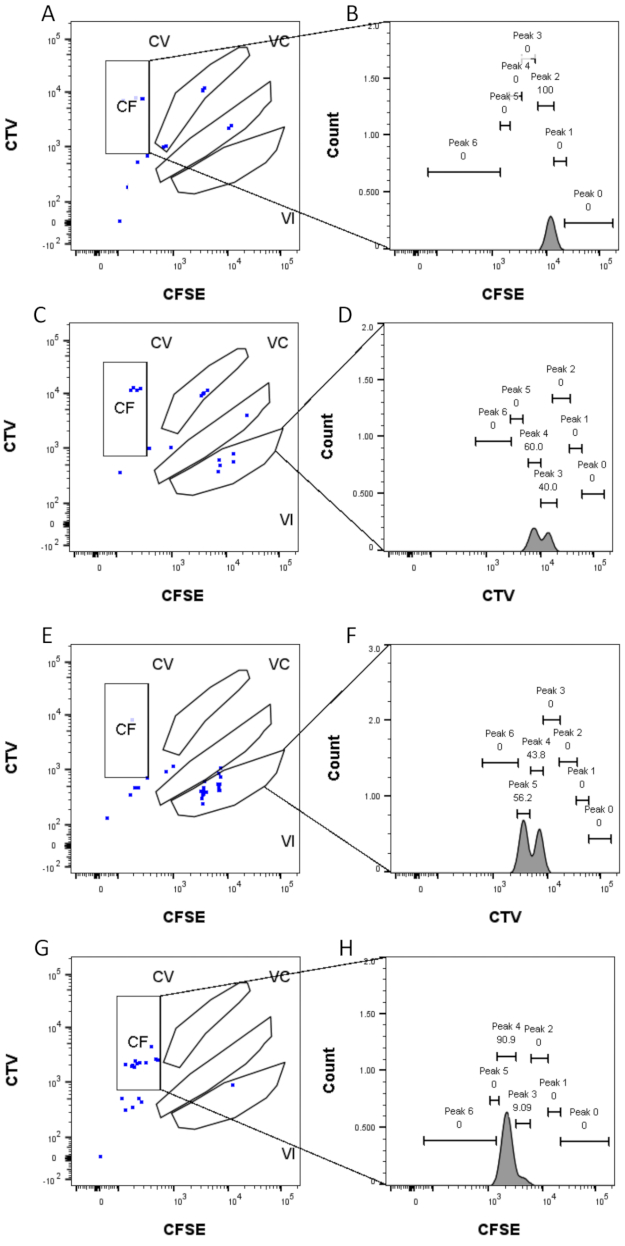
図4:ピーク割り当て 。 (A,B) このウェルでは、CFゲートで1つのピークしか検出できません。(C,D)ほぼ等しい強度の2つのピークが、VIゲートのこのウェルで検出できます。ピークはよく解決されています。(E,F)同等の強度の2つのピークは、VIゲートのこのウェルで検出できます。バルク井戸を使用して設定された戦略に基づいて、ゲート内のイベントのみが考慮されています。(G-H)強度が等しくない2つのピークが、このウェルのゲートCFで検出できます。 この図の拡大版を表示するには、ここをクリックしてください。
データ表現と統計的検定
図5は、細胞培養の72時間後に行われた2つの別々の実験の異なるタイプのデータ表現を示す。HSCとMPPは、細胞分裂と分化の特性を変化させると思われる2つの異なる細胞培養培地で培養されています。これらのメディアは "Diff" (Differentiation)32 および "GT" 33 という名前が付けられています。1つ目は、エリスロポエチン(EPO)と顆粒単球コロニー刺激因子(GM-CSF)を含むため、骨髄系と赤血球の分化を促進し、2つ目は遺伝子治療の臨床試験の文脈で開発されており、HSPCの高い割合を維持および増幅することを目的としています。 図5A は、条件「Diff」の代表的なヒートマップであり、様々な細胞ファミリーを表し、 細胞の運命と分裂の両方において。このヒートマップでは、各行は個々のファミリを表し、各正方形は個々のセルを表し、列は同じ世代のすべてのセルをグループ化しています(たとえば、第2世代のセルは少なくとも2回分割されています)。単一の細胞型で構成され、同じ数の分裂を示す非常に均質なファミリー(例:ファミリー#63)と、2世代にわたる3つの細胞タイプを含む不均一なファミリー(例:ファミリー#84)を区別することができます。この分析の細胞回収率は約70%であるため、すべての細胞が異なる世代で回収されることによって定義される完全なファミリー(たとえば、第1世代の1つの細胞のファミリーと第2世代の2つの細胞のファミリー)はほとんど観察されません( 図5AのID番号の横にハッシュタグを表示)。不完全な検出を説明する複数の説明があり、技術的(染色の問題、プロトコルによる細胞損失)または生物学的(細胞死および/またはアポトーシス)である可能性があります。技術的な制限は、個々のサンプルに関連するデッドボリュームを減少させるように設計されたアナライザーを使用し、細胞培養プレート内で直接細胞染色を実行して容量ピペッティングを減らすことによって克服できます。逆に、細胞死の量を決定するための直交的な方法(例えば、生細胞イメージング実験 を介して)は、不完全な検出をもたらす技術的および生物学的要因を区別するのに役立つ。
図5Bはバルク アッセイを実施したかのように、細胞型組成物に対する培養条件の影響を可視化する方法を示す。ここで、Diff条件は、より多くの運命を促進し、CD34+ 細胞(CD34-を除くすべての細胞型として定義される)の割合が高い。信頼区間は、基本的なブートストラップ を介してスクリプトで計算され、250,000のブートストラップデータセットがあります34。 図5 の他のすべてのヒストグラムは、同じ方法で計算された信頼区間を示していることに注意してください。 表5 は、各世代のファミリー数とセル数に関するすべての情報を要約したものです。
図5Bii は、スクリプト「2_bar_plot」で実行された統計的検定の出力をグラフィカルに表しています。統計的枠組みの正式な説明が利用可能です26。簡単に言うと、このフレームワークは、観察されたすべての細胞間の独立性を必要とする古典的な統計とは対照的に、同じファミリーの細胞が依存していると仮定しながら、統計的仮説検定を可能にします(それ自体がテスト可能な仮定)。図に示されている特定のケースでは、統計的検定は、培養中に存在するさまざまな細胞タイプの頻度として測定されるMPPの細胞運命の選択が、使用される細胞培養条件とは無関係であるという仮説に挑戦します。まず、G検定統計量を使用して、異なる細胞培地からの細胞タイプ頻度間の不一致を評価します( Biiの例では、この統計量は赤いバーで表されます)。次に、データのランダム化が順列 によって 実行され、2つの細胞培養条件間で細胞のファミリー全体が交換されます。これは、各セット内のファミリー数を元のデータと一致しながら、ファミリー関連セル間の依存性を維持するためです。G検定統計量は、ランダム化されたデータセットから計算されます。 5Bii で表される青色の値は、250,000順列のG検定統計量です。最後に、元のデータセットが置換されたデータセットの分布からどの程度逸脱しているかを評価するために、 p 値が計算されます。この例では、元の統計量は分布から大きく逸脱しているため、 p値が小さくなり、MPPの細胞運命は培養条件とは無関係であるという仮説が棄却されます。
図5C は、最大世代当たりの細胞ファミリーの割合を表し、異なる条件が細胞ファミリー当たりの細胞分裂をどのように変化させるかを探る。このデータプロットは、72時間で、Diff条件で培養された細胞がGT条件の細胞よりも多くの分裂を完了することを示しています。表されるのは各ファミリごとの最大世代数であるため、世代 1 と 2 のセルを表示する 1 つのファミリは、世代 2 と見なされます。 図5B に用いたのと同じ統計的枠組みを使用して、細胞分裂と培養条件との間の独立性を統計的に検定することができる。
図5D は、さまざまな祖先タイプ(HSCまたはMPP)の最初の分割の対称性/非対称性のタイプを調べています。2つの娘細胞を姉妹細胞として決定的に確立できる唯一の世代である第1世代の完全な細胞ファミリーについては、4つの異なるタイプの対称性/非対称性を定義することができます:「Sym Undiff」というラベルは、両方の娘が起源細胞の表現型を保持するファミリーを表します。「Sym Diff」とは、両方の娘が同じ表現型を持ち、起源の細胞とは異なることを意味します。「Asym Undiff」とは、1人の娘が起源細胞の表現型のみを保持することを意味します。最後に、「Asym Diff」は、両方の娘が異なる表現型を持ち、それらのどれも起源の細胞と同じではない家族を説明します。これらの対称/非対称運命を評価する際に統計的検出力を得るには、第1世代に子孫が見られるより多くの家族を観察するために、早い時点でMultiGen分析を実行することが望ましい。
最後に、 図5E は、分裂数の関数としての細胞型の割合を表し、分裂間の分化パターンの進行に関する洞察を得る。たとえば、図に表示されているデータは、細胞がCD34- 状態に進行し、検出された細胞の50%以上がこのクラスでわずか3回の分裂後に進行することを示唆しています。さらに、MPPは、細胞のごく一部が元の表現型を保持するため、自己複製分裂を好まないと推測することが可能です。これらの結論のいくつかは、前の図に示されている統計的枠組みを使用してテストできます。
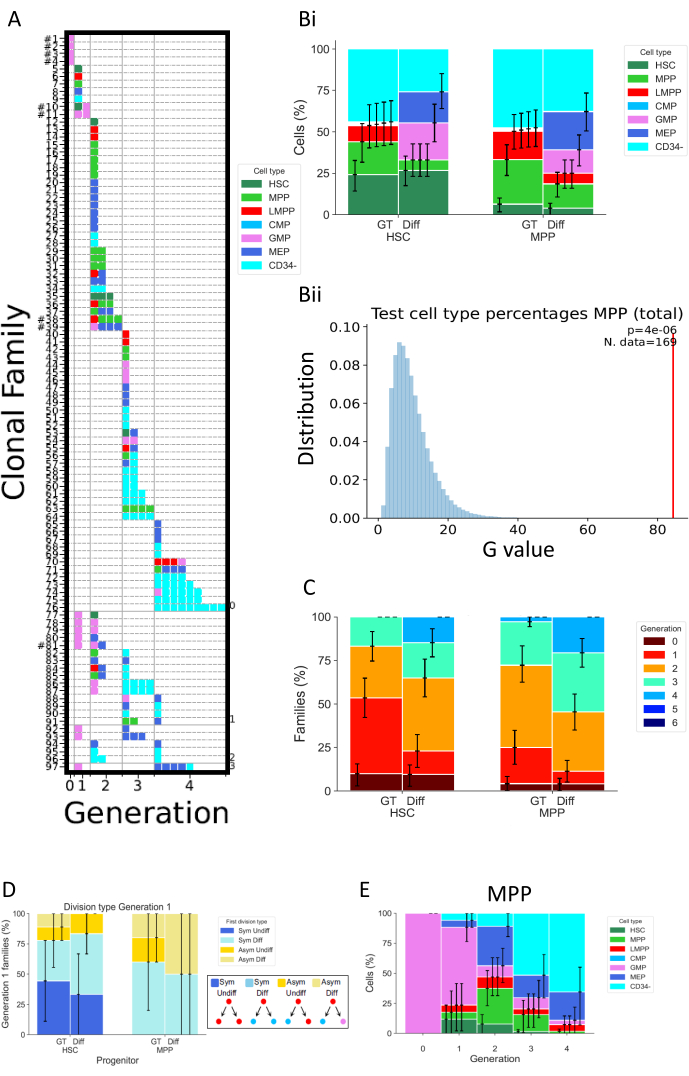
図5:臍帯血HSPCを使用した1つの72時間実験のデータ表現の例。 (A)選択したデータセットのヒートマップ(HSC、「差分」培地、培養72時間後)。プロットは、親族関係(行)、実行された分割数(列、生成と呼ばれる)、および表現型(色)に従って、すべての個々のセル(正方形)を表します。(バイ)条件GTと条件Diffの間で、HSCとMPPの細胞子孫の細胞型の比率を比較するヒストグラム(Bii)グラフは、培養72時間でMPPの「2_bar_plot」スクリプトで実行された統計的テストを表し、「Diff」サイトカインカクテルと「GT」を比較します。実験値は赤で表示され、250,000順列 によって 生成された値は青で表示されます。G検定の p. 値は、検定に使用されたファミリの数とともに右上隅に表示されます。(C)培養条件ごとのHSCとMPPについて、各世代(合計314家族)の家族の割合(合計314家族)を比較したヒストグラム。信頼区間は、250,000個のブートストラップされたデータセットで計算されます。(D)第1世代に2つの細胞を持つファミリーの娘細胞の運命間の対称性/非対称性のタイプを表すヒストグラム:Sym Undiff(両方の娘が起源細胞の表現型を保持する)、Sym Diff(両方の娘が同じ表現型を持ち、起源の細胞とは異なる)、Asym Undiff(1つの娘だけが起源細胞の表現型を保持する)、 とAsym Diff(両方の娘は異なる表現型を持っており、それらのどれも起源の細胞に似ていません)。(E)「Diff」カクテルで培養したMPPについて、世代ごとに分類された細胞タイプの寄与のヒストグラム。n = 204個の細胞と97個のファミリー。 この図の拡大版を表示するには、ここをクリックしてください。
表5:各実験条件ごとに分析したファミリーおよび細胞数(由来細胞および細胞培養培地)の説明。この表をダウンロードするには、ここをクリックしてください。
補足ファイル1:このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
MultiGenアッセイは、リンパ球23,24,35およびマウス造血細胞26,27の研究に役立ってきた、ハイスループットで実行が容易で安価なアッセイです。ここでは、ヒトHSPCコミットメントの初期段階を、短期間培養を用いて単一細胞レベルでex vivoで解読できるアプローチの新しい開発を紹介します(図6)。単一細胞ex vivo培養システムは、通常、成熟細胞へのHSPCの長期的な運命を評価するために使用されますが、一部の運命は他の運命よりも早く発生し36、分析がより少ない運命に偏る可能性があります。さらに、これらの文化システムは通常、運命のコミットメント中に分裂に関する情報を見逃しています。最初のコミットメントステップは、文化の開始時に早くも発生し、時には分割26,37なしで発生することが示されており、早期の運命のコミットメントを研究するには、短期的な文化と追跡部門が不可欠です。運命、分裂、親族関係を同時に追跡することにより、このアッセイは、ヒトHSPCにおける最初の分裂と運命決定の役割を理解することを可能にします。 アッセイを使用すると、コミットメントプロセスがいくつの分裂後に発生するか、それらの初期祖先の自己複製と分化のバランス、およびそれらの特性が世代間でどのように受け継がれるかを推測することができます。私たちの知る限り、これはヒトHSPCのこれらのタイプの測定を単一細胞分解能で可能にする唯一のアッセイです。さらに、細胞分裂色素のさまざまな組み合わせを使用して、分析のスループットを向上させ、このアッセイを大規模なデータセットを迅速に生成するための貴重なツールにしました。色素の組み合わせにより、同じウェル内の複数のファミリーを追跡できるため、短期培養での分析に利用できる細胞の数が増えます。他の色素(黄色色素など)を添加したり、CFSEとCTVの比率を変更したりすることで、組み合わせの数をさらに増やすことができます。ただし、これにより、分析できる他のパラメータの数が減ります。
図6:プロトコルの概略図。 この図の拡大版を表示するには、ここをクリックしてください。
分析を成功させるには、ウェルの数が多く、分析する細胞の数が少ないため、プレートリーダーを備えた分析装置でフローサイトメトリー分析を実行する必要があります。新世代のベンチアナライザーは、細胞損失の割合を減らすためにデッドボリュームが小さいため、このアッセイに特に適しています。これにより、各井戸全体を回収する際のより高い効率が保証され、70%の範囲で推定される効率が促されます26。フローサイトメトリー取得中の細胞損失を推定することは、個々のファミリーの解析に不可欠です。例えば、細胞死がないと仮定して分裂数をカウントし、各科当たりの細胞数を推定することができる。それにもかかわらず、特に試験された培養条件での細胞死の推定および定義された数の細胞を用いて実験的に回収率を測定する場合、いくつかの確認実験を実行することが望ましい。
このプロトコルの重要なステップの1つは、ピーク割り当てです。すでに述べたように、良質のピーク分布は、細胞選別時の非常に狭いピークの単離に強く依存します。それにもかかわらず、分布に基づいて正しい分割数を割り当てることは依然として困難です。セルソーティングとフローサイトメトリー解析は2つの異なるマシンで行われるため、各シグナルの強度を直接比較することはできないため、ヒストグラムの右端に観察された最初のピークがピーク0なのかピーク1なのかを知ることは難しい場合があります。この点で、可能な解決策はほとんどありません。1つの方法は、これらの細胞によって行われる分裂の数を正確に測定するために直交実験を行うことである(例えば、生細胞イメージング)。別の可能性は、フローサイトメトリー分析を実行する前に、倒立明視野顕微鏡下でウェル内の細胞数を単純にカウントすることです。これにより、平均分裂数が推測されます(細胞死がないと仮定します)。最後に、ピーク割り当ての事後ソリューションは、異常な数の「不可能なファミリ」の検出です。これらのファミリーは、世代当たりの細胞数が可能な限り多い(例えば、第2世代に5つの細胞、または第1世代に2つの細胞と第2世代に1つの細胞)で構成される。不可能なファミリーを除外する可能性は、統計分析ステップでコード化され、不可能なファミリーにフラグが立てられます。これらのエラーの発生が高すぎる場合は、ピーク割り当てを修正する必要があると考えるのが妥当です。
このプロトコルでは、大規模なデータセットの生成と解釈において不可欠なステップとなっているため、アッセイのためのデータ表現と分析のいくつかの例を含めました38。最初の例は、分析されたすべてのセルの全体を示すヒートマップで、ファミリごとに整理されています。これは、データの一般的な特性と潜在的な結論を調査するための効率的なツールです:ファミリーは複数の細胞タイプによって構成されていますか、それとも組成が均一である傾向がありますか?家族は複数の世代に分散していますか、それともほとんど同じ回数に分かれていますか?この探索的分析は、より具体的なプロットと統計的検定で補完する必要があります。対称的および非対称的な運命コミットメント、分割なしの分化、自己複製と分化のバランス、および特定のコミットメント運命の分割数を定量的に評価するために使用できます。実験計画では、質問の種類に応じて細胞培養長を設定することが基本です。たとえば、最初の 2 つの質問 (対称/非対称バランスと分割なしの分化) では、非常に短い培養ステップを計画すると、分割を 1 つだけ実行したか、まったく実行していない多数のファミリを分離できます26。逆に、より長い実験では、分化のさまざまな段階でファミリーをサンプリングするため、特定の細胞コミットメントに必要な分裂数を調べることができます。それにもかかわらず、この方法は、細胞色素希釈が7つまたは8つ以上の分裂を正確に追跡することができないので、長期培養(2〜3週間)用に設計されていない22。結果として、このツールは造血前駆細胞の早期関与を研究するためにほとんど適合されており、これらの細胞の長期的な分化特性について確固たる結論を出すようには設計されていません。
統計的枠組みは、このタイプのデータの分析のために特別に開発され、順列26の概念に基づいています。これは、細胞型分布および実施された分裂数に対する家族依存性の観察のために必要であった。言い換えれば、同じファミリーの一部である細胞は、同様の表現型を示し、同じ回数分裂する可能性も高くなります。詳細な分析はこの作業の範囲を超えていますが、さまざまな条件を評価するには、提供されている一連の統計的検定で十分です。
結論として、このプロトコルは、造血幹および前駆細胞の細胞動態を ex vivoで迅速かつ安価な方法で評価するための貴重なツールを構成します。分析するHSPCの種類、培養条件、およびタイプに関する柔軟性と汎用性により、さまざまな実験条件を試験することができます。フローサイトメトリーベースのアッセイとして、ほとんどのラボで実装でき、広範な事前知識を必要としないため、スクリーニングやパイロット実験に適しています。
開示事項
著者は、この作業に関連する利益相反を宣言しません。資金提供者は、研究デザイン、データ収集と解釈、または出版のために作品を提出する決定において何の役割も果たしていませんでした。
謝辞
フローサイトメトリー実験のセットアップにご協力いただいたキュリーフローファシリティ研究所のメンバーに感謝します。また、複数の議論の中で、チームペリエの他のメンバーの貢献に感謝したいと思います。ジュリア・マルキンゴ博士とフィル・ホジキン教授(ウォルターエンドエリザホール医学研究所)がリンパ球上の細胞分裂色素のマルチプレックスのプロトコルを共有してくれたことに感謝します。このプロトコルの開発に必要な生物学的資源を提供してくれたセントルイス病院の臍帯血バイオバンクに感謝します。この研究は、CNRSおよびBettencourt-Schueller FoundationからのATIP-Avenir助成金(L.P.へ)、 Labex CelTisPhyBio (ANR-10-LBX-0038)(L.P.およびA.D.へ)、Idex Paris-Science-Lettres Program(ANR-10-IDEX-0001-02 PSL)(L.P.へ)、Canceropole INCA Emergeation(2021-1-EMERG-54b-ICR-1、L.P.へ)、ITMO MIIC助成金(21CM044、L.P.へ)によって支援された。欧州連合のホライズン2020研究およびイノベーションプログラムERC StG 758170-Microbar(LPへ)の下での欧州研究会議(ERC)からの資金提供に加えて、ADはフランス財団からのフェローシップによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
参考文献
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084(2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041(2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381(2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287(2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540(2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. Testing statistical hypotheses. , Springer. New York. 784(2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624(2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151(2013).
- Davison, A. C., Hinkley, D. V. Bootstrap Methods and their Application. , Cambridge University Press. (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116(2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898(2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved