Method Article
Avaliação Simultânea de Parentesco, Número de Divisão e Fenótipo por Citometria de Fluxo para Células-Tronco Hematopoéticas e Progenitoras
Neste Artigo
Resumo
Apresentamos aqui uma técnica baseada em citometria de fluxo que permite medir simultaneamente o número de divisões celulares, o fenótipo celular de superfície e o parentesco celular. Essas propriedades podem ser testadas estatisticamente usando uma estrutura baseada em permutação.
Resumo
Poucas técnicas podem avaliar fenótipo e destino para uma mesma célula simultaneamente. A maioria dos protocolos atuais utilizados para caracterizar o fenótipo, embora capaz de gerar grandes conjuntos de dados, necessita da destruição da célula de interesse, impossibilitando a avaliação de seu destino funcional. Sistemas diferenciadores biológicos heterogêneos, como a hematopoiese, são, portanto, difíceis de descrever. Com base em corantes de rastreamento de divisão celular, desenvolvemos um protocolo para determinar simultaneamente o parentesco, o número de divisão e o status de diferenciação para muitos progenitores hematopoiéticos únicos. Este protocolo permite avaliar o potencial de diferenciação ex vivo de progenitores hematopoéticos murinos e humanos, isolados de diversas fontes biológicas. Além disso, por ser baseado em citometria de fluxo e um número limitado de reagentes, pode gerar rapidamente uma grande quantidade de dados, em nível unicelular, de maneira relativamente barata. Também fornecemos o pipeline analítico para análise de célula única, combinado com uma estrutura estatística robusta. Como esse protocolo permite a ligação da divisão e diferenciação celular no nível de célula única, ele pode ser usado para avaliar quantitativamente o comprometimento do destino simétrico e assimétrico, o equilíbrio entre auto-renovação e diferenciação e o número de divisões para um determinado destino de compromisso. Em conjunto, este protocolo pode ser utilizado em delineamentos experimentais com o objetivo de desvendar as diferenças biológicas entre progenitores hematopoéticos, a partir de uma perspectiva unicelular.
Introdução
A última década foi marcada pela disseminação mundial de abordagens unicelulares para biologia celular e molecular. Seguindo os passos da genômica de célula única1,2, hoje em dia é possível estudar muitos componentes de uma única célula (por exemplo, DNA, RNA, proteínas), com novas técnicas de célula única -ômicas surgindo a cada ano. Essas técnicas têm lançado luz sobre velhas e novas questões para os campos da imunologia, neurobiologia, oncologia e outros, tanto utilizando células humanas quanto de organismos modelo3. Ao destacar as diferenças entre as células individuais, a ômica unicelular motivou a definição de um novo modelo de hematopoese, centrado na heterogeneidade das células-tronco hematopoéticas e progenitoras (HSPCs) e afastando-se do modelo clássico de populações discretas homogêneas 4,5.
Uma das poucas desvantagens de todas as técnicas -ômicas é a destruição da célula de interesse, impossibilitando a possibilidade de avaliar sua funcionalidade. Por outro lado, outros métodos de célula única, como o ensaio de transplante de célula única e tecnologias de rastreamento de linhagem, fornecem uma leitura da funcionalidade da célula ancestral avaliando o destino de células individuais in vivo 6,7. As tecnologias de rastreamento de linhagens envolvem a marcação da célula de interesse com uma etiqueta genética hereditária7 ou fluorescente8,9, permitindo que o destino de várias células individuais seja seguido ao mesmo tempo. No entanto, a caracterização das células iniciais é tipicamente limitada a um número restrito de parâmetros, como a expressão de algumas proteínas de superfície avaliada por citometria de fluxo10. Além disso, as tecnologias de rastreamento de linhagem de célula única requerem detecção trabalhosa da marca celular, tipicamente via sequenciamento de DNA/RNA ou imagem. Este último ponto, em particular, limita o número de condições que podem ser testadas em um único experimento.
Outra classe de métodos que são usados para estudar a funcionalidade de células únicas são sistemas de cultura de células ex vivo de HSPCs individuais. Fáceis de executar, esses ensaios padrão-ouro envolvem a classificação de células individuais em vasos de cultura celular de 96 poços e, após a cultura, caracterizando o fenótipo de progênie celular, tipicamente por citometria de fluxo ou análise morfológica. Esses ensaios têm sido usados principalmente para caracterizar a diferenciação a longo prazo de HSPCs em células maduras, tipicamente após 2-3 semanas de cultura11,12. Alternativamente, têm sido utilizados para tentar manter e expandir os HSPCs ex vivo 13,14,15,16,17,18, com a promessa de benefício médico para o transplante de células-tronco humanas 19. Por fim, têm sido utilizados para estudar o comprometimento precoce de HSPCs utilizando cultura de curta duração20, sendo o baixo número de células geradas nessa cultura o principal fator limitante. Uma desvantagem desses diferentes tipos de ensaios ex vivo é que eles refletem apenas parcialmente a complexidade in vivo; ainda assim, eles são uma das raras maneiras de estudar a diferenciação humana HSPC.
Uma informação ausente dos métodos unicelulares existentes (célula única-ômica, rastreamento de linhagem e cultura ex vivo) é a detecção precisa de divisões celulares, um parâmetro essencial a ser considerado ao estudar a dinâmica do HSPC21. Uma maneira simples de avaliar o número de divisões por citometria de fluxo é o uso de "corantes proteicos" solúveis, como o éster succinimidílico de diacetato de 5-(e 6)-carboxifluoresceína (CFSE)22. Esses corantes de divisão difundem-se dentro do citoplasma das células coradas, diluem-se pela metade e passam para as duas células-filhas a cada divisão celular, permitindo enumerar até 10 divisões. Combinando vários corantes de divisão, é possível semear vários progenitores individuais no mesmo poço, pois cada corante individual permite a separação dos diferentes descendentes. Este é o princípio por trás do uso de corantes celulares para multiplex, clonal e division-tracking, que foi introduzido pela primeira vez para linfócitos murinos23,24.
Aqui, apresentamos o desenvolvimento do ensaio MultiGen para uso com HSPCs murinos e humanos. Ele permite o teste de muitas células individuais simultaneamente para suas propriedades de diferenciação, divisão e parentesco ex vivo. Este ensaio de alto rendimento, fácil de executar e barato permite medir o fenótipo celular, o número de divisões realizadas, o parentesco celular e a relação clonal com as outras células do poço, tudo ao mesmo tempo. Ele pode ser usado para avaliar quantitativamente o compromisso de destino simétrico e assimétrico, o equilíbrio entre auto-renovação e diferenciação e o número de divisões necessárias para um determinado destino de compromisso. O protocolo requer um classificador de células ativado por fluorescência (FACS) e um citômetro de fluxo com leitor de placas, além do equipamento necessário para a realização da cultura celular. Além do protocolo técnico para execução do ensaio em HSPCs humanos, também fornecemos o quadro detalhado de análise, incluindo os testes estatísticos necessários para avaliar as propriedades celulares relacionadas ao conceito de família celular25. Esse protocolo já foi utilizado com sucesso para descrever o compartimento murino da HSPC26,27.
O protocolo a seguir utiliza como material de partida células CD34+ enriquecidas magneticamente28. Dessa forma, é possível corar e isolar eficientemente os HSPCs humanos de diferentes fontes de sangue (por exemplo, sangue do cordão umbilical, medula óssea, sangue periférico). É importante não descartar a fração CD34- , pois ela será utilizada como parte do protocolo para definir diferentes tipos de controles experimentais. As quantidades e volumes de células mencionados podem ser ampliados ou reduzidos, de acordo com o fluxo de trabalho e as necessidades experimentais. Da mesma forma, o protocolo pode ser adaptado para o estudo de diferentes tipos de progenitores, simplesmente modificando os anticorpos utilizados para as etapas de triagem celular e citometria de fluxo.
Protocolo
Para o protocolo a seguir, utilizou-se como fonte de HSPC o sangue de cordão umbilical desidentificado e coletado de acordo com as diretrizes definidas pelo biobanco de sangue de cordão umbilical do Hospital Saint-Louis (autorização AC-2016-2759) e com a Declaração de Helsinque.
NOTA: Antes de iniciar, certifique-se de que todos os reagentes e equipamentos necessários para este protocolo estejam disponíveis, conforme listado na Tabela de Materiais e mencionado no protocolo. Preparar os reagentes relevantes frescos e não armazená-los, a menos que explicitamente mencionado.
1. Coloração do corante celular
NOTA: Esta seção descreve a coloração com quatro combinações de corantes de divisão celular CFSE e corante violeta (CTV). Processe todos os tubos simultaneamente, mesmo que nenhuma solução de corante celular seja adicionada. Todas as etapas são realizadas em condições estéreis para permitir a seguinte etapa de cultura celular. Tempo necessário: aproximadamente 100 min.
- Processar a unidade de sangue de cordão umbilical de acordo com um protocolo de classificação magnética29. Certifique-se de que duas frações estejam disponíveis: uma fração CD34- grande e uma fração CD34+ menor. Gire ambos os tubos por 5 min a 300 x g. Aspirar o sobrenadante sem perturbar o pellet.
- Para a fração CD34+ , ressuspendê-la em 1 mL de meio Dulbecco modificado de Eagle (DMEM) sem soro fetal bovino (SFB). Conte as células usando um hemocitômetro; a densidade celular não deve ser superior a 3 x 106 células/mL. Se este for o caso, adapte o volume de acordo. Para a fração CD34- , ressuspender em DMEM sem FBS e ajustar o volume para um máximo de 6 x 106 células/mL.
- Alíquota 250 μL da fração CD34+ em quatro tubos de polipropileno de 15 mL. Rotule os tubos da seguinte forma: CD34+/CF (CFSE_only), CD34+/CV (CFSE_high CTV_low), CD34+/VC (CFSE_low CTV_high) e CD34+/VI (CTV_high). Alíquota 250 μL da fração CD34- em mais quatro tubos de polipropileno de 15 mL. Rotule os tubos da seguinte forma: CD34-/CF (CFSE_only), CD34-/CV (CFSE_high CTV_low), CD34-/VC (CFSE_low CTV_high) e CD34-/VI (CTV_high). As células remanescentes da fração CD34- podem ser descartadas.
- Prepare duas soluções CFSE, denominadas CFSE_high e CFSE_low. Para CFSE_high (10 μM), misturar 1,1 mL de DMEM sem FBS com 2,2 μL de solução estoque de CFSE (5 mM). Para CFSE_low (5 μM), misturar 550 μL de DMEM sem FBS e 0,55 μL de solução estoque de CFSE (5 mM).
- Adicionar 250 μL da solução de CFSE_high aos tubos de FC e CV, 250 μL da solução de CFSE_low aos tubos de VC e 250 μL de DMEM sem FBS ao tubo VI. Para garantir uma mistura eficiente de suspensão celular e corante celular, incline o tubo em quase 90 graus e deposite as soluções CFSE na parede do tubo. Em seguida, segure o tubo verticalmente para misturar as duas soluções e pipete três ou quatro vezes para garantir uma mistura rápida das soluções CFSE com as células ressuspensas. Incubar a 37 °C durante precisamente 8 min.
- Após a incubação, adicionar 5 mL de DMEM + 10% de SFB. Manter os tubos a 37 °C durante 5 min.
- Gire os tubos por 5 min a 300 x g. Remover o sobrenadante por aspiração sem perturbar o pellet e lavar o pellet com 5 mL de solução salina tamponada com fosfato 1x/ácido etilenodiaminotetracético (PBS 1x/EDTA). Gire novamente por 5 min a 300 x g. Eliminar o sobrenadante sem perturbar o pellet e ressuspender o pellet celular em 250 μL de 1x PBS/EDTA.
- Prepare duas soluções de CTV, denominadas CTV_high e CTV_low. Para CTV_high (10 μM), misturar 1,1 mL de PBS 1x/EDTA e 2,2 μL de CTV (5 mM). Para CTV_low (5 μM), misturar 550 μL de PBS 1x/EDTA com 0,55 μL de CTV (5 mM).
- Adicionar 250 μL da solução CTV_high aos tubos VC e VI, 250 μL da solução CTV_low ao tubo CV e 250 μL de 1x PBS/EDTA ao tubo CF. Use a mesma técnica descrita na etapa 1.5. Incubar a 37 °C durante precisamente 8 min.
- Após a incubação, adicionar 5 mL de DMEM + 10% de SFB. Manter a 37 °C durante 5 min.
- Gire os tubos por 5 min a 300 x g, descarte o sobrenadante sem perturbar o pellet e, em seguida, lave o pellet com 5 mL de 1x PBS/EDTA. Gire novamente por 5 min a 300 x g.
- Eliminar o sobrenadante sem perturbar o pellet e ressuspender as fracções CD34- em 1x PBS/EDTA para uma concentração final de 1,5 x 106 células/ml. Ressuspender as frações CD34+ em 40 μL de tampão corante e transferir as células para tubos de 1,5 mL.
2. Coloração de anticorpos
NOTA: A coloração de anticorpos pode ser personalizada de acordo com as necessidades experimentais. Apenas as frações CD34+ sofrem coloração de anticorpos; as frações CD34- são usadas como um único controle de coloração para as combinações de corantes de divisão celular (frações CV, VC, CF e VI). O painel a seguir é adaptado para a detecção de quatro tipos de HSPCs: células-tronco hematopoéticas (CTHs), progenitores multipotentes (MPPs), progenitores multipotentes com priming linfoide (LMPPs) e células progenitoras hematopoéticas (HPCs)12. No entanto, a identificação de HSCs e MPPs é apresentada. Tempo necessário: 75 min.
- Preparar a coloração única para coloração superficial, utilizando esferas de compensação. Misture esferas negativas e contas de imunoglobulina G (IgG) em uma proporção de 1:1, para um volume total equivalente a 20 μL x o número de marcadores de superfície (por exemplo, 120 μL se o painel de coloração contiver seis anticorpos).
- Despachar 20 μL de contas em tubos individuais de 1,5 ml para cada marcador. Adicione o volume correspondente ao fator de diluição para cada anticorpo no tubo correspondente (por exemplo, se o fator de diluição for 1:20, adicione 1 μL).
- Para corar as células CD34+ , preparar uma mistura mestre de anticorpos12, com base na Tabela 1. Misture os anticorpos em um único tubo de 0,5 mL. Adicionar 7 μL da mistura mestra de anticorpos a cada uma das quatro condições CD34+.
- Incubar as esferas de compensação e as amostras CD34+ a 4°C por pelo menos 30 min.
NOTA: O tempo de incubação deve ser adaptado aos detalhes técnicos dos anticorpos utilizados para a coloração. - Durante a incubação, prepare a placa de fundo redondo de 96 poços a ser usada para a classificação, adicionando 100 μL de meio de cultura celular a cada poço usando uma pipeta multicanal.
NOTA: Deixe os poços H8-H12 vazios. - Rotular tubos de polipropileno de 5 mL para os controles de coloração de superfície (5, usando contas), os controles de corantes de divisão celular (4, usando as frações CD34- ) e as amostras de CD34+ (4).
- Ao final da incubação, lavar as células e contas com 1 mL de tampão corante. Transferir o volume total para os tubos de polipropileno de 5 mL. Centrifugar os tubos por 5 min a 300 x g, em seguida, aspirar o sobrenadante sem perturbar o pellet.
- Ressuspender as células em tampão corante, utilizando aproximadamente 500 μL cada para as esferas e células CD34+ , e 1 mL para os tubos CD34- .
Tabela 1: Modelo para preparar o mastermix de anticorpos para um experimento de classificação celular. Clique aqui para baixar esta tabela.
3. Classificação de células
Observação : os números de célula classificados podem variar de acordo com a quantidade total de células disponíveis. No protocolo, um número mínimo de célula para cada controle é fornecido. Tempo necessário (para uma única placa): 100 min.
- Abra o experimento de modelo ou defina um novo experimento. Crie uma única amostra e vários tubos, um por cada condição.
- Defina a estratégia de fechamento detalhada na Figura 1, criando seis diagramas de gráfico de pontos. Primeiro, visualize as células em um gráfico de pontos FSC-A/SSC-A e clique duas vezes na ferramenta de limitação de polígonos para selecionar uma população com baixa dispersão lateral (Figura 1A). No gráfico de pontos a seguir (FSC-A/FSC-H), clique com o botão direito do mouse no gráfico e selecione o portão "Células" no menu suspenso clicando nele. Use a mesma ferramenta de limitação para selecionar uma população apertada na diagonal entre os dois eixos (Figura 1B).
- No terceiro dot plot (APC vs. FSH-H), exiba a população "Single Cells" e gate as células negativas para a expressão da Linhagem APC (Lin) (Figura 1C). No quarto gráfico (CFSE vs. CTV), exiba a população "Lin-" e crie quatro portas separadas, uma para cada combinação de corantes (Figura 1D).
NOTA: Estas portas devem ser apertadas, para selecionar apenas uma pequena fração de células homogeneamente coradas. - Use o quinto e sexto gráfico (APC-Cy7 vs. BV650 e PE-Cy7 vs. PE) para identificar os progenitores de interesse. Generosamente a população CD34+CD38- e a população CD34+CD38+ na quinta parcela (Figura 1E). Em seguida, selecione a população CD34+CD38- na sexta parcela e desenhe três portas, de acordo com a Figura 1F.
- Execute os tubos de coloração simples contendo as contas de compensação, clicando no botão Adquirir . Ajuste as tensões do tubo fotomultiplicador (PMT) no menu suspenso Parâmetros , particularmente para os corantes de divisão celular (entre 104 e 105 em uma escala biexponencial).
- Refine a matriz de remuneração de acordo com o painel usado para classificação, usando a guia Compensação . Registre pelo menos 5.000 eventos no portão de contas, clicando no botão Gravar .
- Execute as frações CD34- e verifique a matriz de compensação novamente. Registre pelo menos 10.000 eventos no portão de célula única.
- Execute as frações CD34+ , gravando pelo menos 5.000 eventos no portão de célula única. Ajuste o portão para cada combinação de corantes, definindo um portão apertado para selecionar uma população homogênea (Figura 1D). Da mesma forma, ajuste o limite para selecionar HSCs e MPPs.
- Uma vez concluída a análise e registrados todos os tubos, insira a placa no suporte apropriado, após realizar a calibração padrão Aria para triagem em placas de 96 poços. Recomenda-se o resfriamento da placa.
- Preparar o molde de classificação de placas de acordo com o esquema apresentado na Tabela 2, utilizando o layout de classificação de experimentos. Os poços denominados "CD34-" contêm de 5.000 a 10.000 células, classificadas na porta CF/CV/VC/VI. Os poços "Bulk" contêm pelo menos 500 células, classificadas no portão CD34+CD38-. Finalmente, os poços unicelulares contêm apenas um evento por combinação de corante de divisão celular por poço, portanto, quatro eventos por poço no total.
NOTA: As populações "Bulk" podem ser adaptadas a um subconjunto específico de progenitores; Não classifique menos de 500 células. - Para a classificação, prossiga em ordem, completando cada combinação de corante de divisão celular antes de passar para a próxima. Por exemplo, comece classificando o CD34-CF, no modo de pureza de rendimento. Clique no botão adquirir e, em seguida, no botão de classificação.
- No final da classificação CD34- , insira o tubo CF CD34+ . Adquira e, em seguida, clique no botão de classificação, certificando-se de ter marcado 0/ 16/0 como grau de pureza. Finalmente, classifique as células de interesse, uma célula por poço, em pureza de célula única, certificando-se de marcar a opção Classificação de índice .
- Passe para a seguinte combinação de corantes de divisão celular, repetindo a mesma ordem. Como referência, a Tabela 2 fornece um exemplo de uma placa classificada.
Observação : A função de classificação de índice gera arquivos individuais para cada condição classificada. - No final da classificação, exporte os arquivos como arquivos .fcs 3.0. Coloque as células numa incubadora a 37 °C, 5% CO2 . As células são cultivadas por vários dias, de acordo com o desenho experimental, por pelo menos 24 h26.
Tabela 2: Molde para uma placa de classificação celular de 96 poços, com base nos requisitos específicos para a análise sucessiva de citometria de fluxo. Clique aqui para baixar esta tabela.
4. Análise de dados de classificação de células
NOTA: Para validar a qualidade da classificação de células, a análise de dados FACS é necessária antes de prosseguir. A principal saída desta etapa é a geração de uma planilha contendo as intensidades de marcadores de cada célula individual classificada.
- Carregue os arquivos .fcs 3.0 no software de análise.
- Verifique a configuração de compensação usada durante a classificação de células, usando os arquivos de coloração única gravados antes da classificação real.
- Defina a estratégia de fechamento revisada usando os arquivos correspondentes ao volume diferente. Copie e cole essas portas nos arquivos de classificação de índice.
- Verifique se as células classificadas pelo índice caíram na porta definida. Se houver algumas células classificadas que foram canceladas incorretamente, elas podem ser identificadas exportando as coordenadas da placa registradas durante a classificação do índice e removidas posteriormente na análise.
- Exporte o evento dos arquivos de classificação de índice como parâmetros compensados. Exporte-os como arquivos .csv, marcando as opções "valores de escala" e "parâmetros compensados". Esses arquivos devem ser exportados em uma pasta chamada "Arquivos exportados".
- Combine todos os arquivos em um único arquivo .csv, usando o script no Arquivo Suplementar 1. Defina o caminho certo com a função "setwd". A saída desse script é uma planilha contendo todos os eventos fechados diferentes e as intensidades relativas para todos os parâmetros.
5. Após a cultura de anticorpo
OBS: Realizar esta parte do protocolo em condições estéreis; Vários reagentes são compartilhados com os passos anteriores, e precisam permanecer estéreis. Para a análise por citometria de fluxo, utilizar citômetro de fluxo com leitor de placas. Isso permite realizar a coloração diretamente na placa de cultura de tecidos, reduzindo ao mínimo a perda celular por limitar a quantidade de pipetagem e fiação. Preparar a coloração de cor única do marcador de superfície usando as esferas de compensação, exceto para os poços A1-A4, que representam a coloração única para as cores CF/CV/VC/VI e já estão presentes na placa de 96 poços. As populações em massa ordenadas de acordo com o corante celular ajudam a definir a estratégia de gating para o número de divisões e o gating geral. Tempo necessário: 120 min.
- Antes de iniciar o protocolo, marque os poços que contêm pelo menos uma célula, verificando a placa em um microscópio invertido. Essa etapa permite otimizar a quantidade de anticorpo utilizada para a coloração e agiliza o procedimento.
- Preparar o mastermix de anticorpos, conforme Tabela 3. Como há uma quantidade significativa de pipetagem, a tabela considera o erro técnico devido à pipetagem, incluindo um volume extra de 5%. Os anticorpos descritos na tabela permitem caracterizar uma variedade de HSPCs de amostras de sangue de cordão umbilical humano12.
- Centrifugar a placa por 5 min a 300 x g. Inverta rapidamente a placa sob o capô e sobre um papel toalha, para remover o sobrenadante.
- Adicionar 8 μL de tampão corante aos poços A1-A4. Adicionar 8 μL da mistura aos outros poços.
- Misture as esferas negativas e as esferas de compensação de IgG na proporção de 1:1, para um volume total equivalente a 120 μL. Despachar 20 μL em um tubo de 1,5 mL por cada marcador. Adicione o volume de anticorpos correspondente ao fator de diluição (por exemplo, se o fator de diluição for 1:20, adicione 1 μL).
NOTA: Adaptar o volume total ao número de marcadores usados para a coloração (por exemplo, 100 μL se o painel de coloração contiver cinco anticorpos). - Incubar a placa e os controlos de compensação de coloração simples a +4 °C, durante, pelo menos, 30 minutos.
NOTA: O tempo de incubação deve ser adaptado aos detalhes técnicos dos anticorpos utilizados para a coloração. - Lave as esferas com 1 mL de tampão corante. Transferir o volume total para os tubos de polipropileno de 5 mL previamente marcados. Centrifugar os tubos por 5 min a 300 x g e, em seguida, remover o sobrenadante por aspiração.
- Lave as células na placa adicionando 100 μL de tampão de coloração por poço usando uma pipeta multicanal. Centrifugar a placa a 300 x g por 5 min, em seguida, inverter rapidamente a placa sob o capô e sobre um papel toalha, para remover o sobrenadante.
- Ressuspender as células em 85 μL de tampão corante, utilizando uma pipeta multicanal.
- Inicie a análise no citômetro de fluxo (modo de aquisição), utilizando o template dedicado e clicando em custom. Este modelo personalizado leva em consideração as características técnicas da placa de fundo redondo de 96 poços, particularmente as dimensões de cada poço (diâmetro, profundidade e espessura). A sonda deve alcançar o fundo do poço, por isso coloque-a no centro exato dos poços A1 e H12.
- Após selecionar os fluoróforos de interesse da lista proposta pelo software, defina o setup da placa seguindo o gabarito de placa da Tabela 2, corrigido para o número de poços contendo pelo menos uma célula.
- Selecione 100 μL como limite de volume de aquisição. Marque a opção de agitação . Ajuste a taxa de aquisição para 1 μL/s max, pois a velocidade mais baixa melhora o volume total analisado por poço.
- Adicione as soluções de limpeza e lavagem adequadas aos poços H8-H12. O molde da Tabela 2 deixa especificamente os poços H8-H12 vazios, pois o citômetro de fluxo precisa executar uma série de condições de lavagem ao final da análise.
NOTA: Esta etapa é adaptada às especificidades do citômetro de fluxo utilizado. - Na seção de parcelas e portas, primeiro defina o portão de célula única, usando o gráfico de dispersão FSC-A/SSC-A e, em seguida, o gráfico de dispersão FSC-H/FSC-A. Crie um histograma para cada marcador de interesse.
- Depois que as configurações forem confirmadas, vá para a seção Análise . Analise primeiro a coloração única, registrando nada menos que 5.000 eventos (faixa ótima: 5.000-15.000 eventos), tanto para as esferas de compensação quanto para as frações coradas com CD34. Ajuste as tensões, se necessário.
- Uma vez que as manchas individuais são todas registradas, é possível iniciar a aquisição real, clicando na função Aquisição .
Tabela 3: Mastermix de anticorpos para um experimento de citometria de fluxo, especificamente para a identificação de HSPCs de sangue de cordão umbilical humano. Clique aqui para baixar esta tabela.
6. Análise dos dados de citometria de fluxo pós-cultura
NOTA: A análise de dados descrita é específica para o software mencionado na Tabela de Materiais. A principal saída é a geração de uma planilha contendo informações de intensidade de marcadores de superfície, número de divisões e parentesco por cada célula analisada. Incluído nesta parte do protocolo está um script escrito em R, necessário a este fluxo de trabalho para gerar a planilha de análise final.
- Exporte arquivos do citômetro de fluxo como arquivos .fcs. Carregue-os no software de análise, agrupando-os como "coloração única", "volume" e "célula única".
- Prepare uma matriz de compensação usando os arquivos de coloração única e aplique-a aos outros dois grupos arrastando e soltando.
NOTA: Se uma ferramenta de compensação automática for usada, verifique a qualidade manualmente antes de prosseguir. - Para ter um gating representativo, concatene os diferentes poços a granel em um único arquivo. Esta etapa destaca rapidamente se duas cores estão sobrepostas (normalmente CV e VC) ou outras anomalias e, portanto, precisam ser excluídas. Depois de clicar na opção concatenar populações , selecione todos os parâmetros não compensados no menu "parâmetros" e, em seguida, clique em concatenar.
- Carregue o arquivo concatenado no espaço de trabalho e, em seguida, aplique a matriz de compensação por meio de arrastar e soltar.
- Prepare a estratégia de fechamento definida na Figura 2 usando o arquivo concatenado. No portão de célula única, exiba os eventos em um gráfico de dispersão com CFSE e CTV. Crie uma primeira porta chamada Labeled, incluindo todas as quatro cores e excluindo possíveis fluorescências automáticas (Figura 2C). Em seguida, portão cada cor individualmente.
- Células marcadas com CV e VC necessitam de um valor transformado, considerando que a cor é o resultado dos sinais CFSE e CTV. Os dois sinais coordenados são, portanto, girados em uma escala logarítmica de 45°, para permitir que a diluição da divisão prossiga em paralelo ao eixo x. Esse valor transformado é derivado manualmente, clicando em Ferramentas e, em seguida, em Derivar Parâmetro. Cole a seguinte fórmula na caixa de fórmula :

NOTA: A equação26 assume que CFSE e CTV são parâmetros 03 e 17. - Para visualizar corretamente esse novo parâmetro chamado Parâmetro Derivado, defina um eixo linear que varia de ~3 a 7, clicando na opção de parâmetro Eixo e selecionando Personalizar Eixo.
- Aplique o gating a cada cor individualmente como um gráfico de histograma: para CF e VI, defina CFSE-A e CTV-A no eixo x, respectivamente. Para CV e VC, defina o novo parâmetro derivado no eixo x. Defina as portas correspondentes a cada pico, conforme mostrado na Figura 3.
- Aplique o gating em cada poço individual de célula única. Certifique-se de adicionar o parâmetro derivado a cada poço analisado. Verifique manualmente cada porta de cor para cada poço, para detectar eventos que estão atribuídos incorretamente a um determinado pico. Exemplos de gating são mostrados na Figura 4.
- Depois que a análise for concluída e todos os poços tiverem sido verificados, selecione todas as portas CF/CV/VC/VI que contenham pelo menos uma célula. Exporte-os como arquivos .csv, marcando as opções "valores de escala" e "parâmetros compensados". Esses arquivos são exportados em uma pasta chamada "Arquivos exportados".
- Combine todos os arquivos em um único .csv, usando o script R no Arquivo Suplementar 1. Lembre-se de definir o caminho certo com a função "setwd". A saída desse script é uma planilha contendo todos os diferentes eventos fechados e as intensidades relativas para todos os parâmetros.
- Abra a planilha e renomeie as colunas para cada parâmetro, por exemplo, usando os seguintes nomes: CFSE, CTV, CD90, CD123, CD45RA, CD34, CD38. Esses nomes serão usados para identificar o limite de limite para atribuir corretamente a cada célula sua identidade.
- Adicione seis colunas chamadas "Bem", "Condição", "Cor", "Geração", "Original_cell" e "Culture_time". Essas variáveis são as definidas experimentalmente e são inferidas a partir de cada linha:
export_A10 CD34+ PBS_CV_Peak 1.csv.1 = A10 (poço), CD34+ (Original_cell), PBS (Condição), CV (Cor), Peak_1 (Geração). - Exportar os poços graneleiros para identificar os valores-limite para o confinamento: exportar a população compensada de interesse (por exemplo, CD34+CD38-) como arquivos .csv, marcando as opções "valores de escala" e "parâmetros compensados". Exporte esses arquivos em uma pasta chamada "Arquivos exportados".
- Para encontrar o limiar para CD38, identifique o maior valor numérico para esse parâmetro. Por outro lado, para encontrar o limiar para CD34, identifique o menor valor numérico para esse parâmetro. Repita esse processo para todos os parâmetros de interesse.
OBS: Para a análise apresentada no protocolo, o marcador CD45RA é utilizado tanto para identificar PPMV na porta CD34+CD38- quanto PMF/BPF na porta CD34+CD38+. Isso significa que dois valores limiares diferentes precisam ser extraídos para esse marcador. - Copie e cole os valores de limite em um arquivo do Excel chamado "gating_matrix". Esse arquivo está organizado de acordo com a Tabela 4 e permite a análise de múltiplos experimentos independentes. É muito importante nomear cada coluna exatamente com este esquema: XXYYMMDD_xxh, onde XX representa as duas iniciais do operador, YY os dois últimos números do ano, MM do mês, DD do dia e xx do ponto de tempo de análise.
Tabela 4: Matriz de gating para a atribuição do destino celular, antes da análise estatística. O CD45h refere-se à intensidade de CD45RA para o subgrupo HPC gating, enquanto CD45l refere-se à intensidade de CD45RA para os subgrupos CD34+CD38- . Clique aqui para baixar esta tabela.
7. Análise estatística
NOTA: O teste estatístico dos dados gerados envolve um pipeline de análise personalizado, codificado usando a linguagem de programação Python (Arquivo Suplementar 2, Arquivo Suplementar 3 e Arquivo Suplementar 4). O script é organizado em três blocos: o primeiro para processar a planilha, o segundo bloco para gerar o mapa de calor para visualização dos dados e o último bloco para gerar múltiplos histogramas para analisar e testar propriedades de diferenciação e divisão.
- A partir do bloco "0_process_data" (Arquivo Suplementar 2), verifique se o gating_matrix e os caminhos da planilha de dados estão definidos corretamente no script.
- Defina o dicionário "cell_cols", para atribuir os destinos de célula relevantes a cada célula. No caso específico, os destinos são HSCs, MPPs, LMPPs, progenitores mieloides comuns (CMPs), progenitores granulo-monocíticos (GMPs), progenitores megacariocítico-eritroides (MEPs) e CD34-.
- Usando os valores limite definidos a partir dos poços de granel (passo 6.16), defina a função "cell_class_exp_time". É essencial ser consistente na nomeação de colunas, para definir corretamente esses limites, usando o mesmo nome usado para definir cada coluna na etapa 6.12.
- Os fenótipos celulares são definidos no script usando uma série de instruções "if-else", com base nos limiares detectados durante a análise por citometria de fluxo.
Observação : fenótipos diferentes podem ser exibidos modificando essas instruções para acomodar outras combinações de marcadores. - Especificar as condições experimentais específicas, usando a função "cond_rule" (por exemplo, diferentes tratamentos experimentais). Para o conjunto de dados fornecido, as condições são denominadas "GT" e "Diff". Descreva os dois diferentes meios de cultura celular usados para cultivar as células. Essas informações serão usadas pelo bloco "1_dot_plot" (Arquivo Suplementar 3) para plotar o mapa de calor.
- No bloco "2_bar_plot" (Arquivo Suplementar 4), defina o dicionário "class_dct", incluindo os destinos celulares discretos de interesse. Para o conjunto de dados fornecido, os destinos celulares de interesse são os mesmos descritos para o dicionário "cell_cols".
- Defina "conds" (condições), "or_cells" (célula original), "sym_labs" (rótulos de simetria) e "times" (o ponto de tempo experimental). São filtros reiterativos necessários para a plotagem. "conds" tomam as condições definidas em "cond_rule" novamente, "or_cells" são HSCs e MPPs, e "sym_labs" descrevem o tipo de divisões.
- No bloco "2_bar_plot", é possível plotar células que progrediram até a divisão 6.
Observação : O conjunto de dados fornecido inclui apenas células até a divisão 4, portanto, uma mensagem de erro aparece, mas isso não impede que o script funcione. - As figuras geradas pelo script podem ser recuperadas na pasta denominada "figuras" como arquivos pdf. Os arquivos denominados "Test" representam os diferentes testes estatísticos realizados para o histograma correspondente.
Resultados
Classificação FACS
As estratégias de classificação apresentadas neste protocolo são baseadas em estratégias amplamente aceitas 12,30,31. Para a estratégia de gating apresentada na Figura 1, o material de partida são progenitores de sangue de cordão umbilical previamente purificados via enriquecimento magnético CD34+, o que explica a porcentagem insignificante de células positivas para linhagem. É essencial usar portas apertadas para as quatro combinações de corantes intracelulares (por exemplo, o CTV na figura), para melhorar a resolução dos picos durante a análise a seguir e para portar a população celular correta (Figura 1D). No caso exibido na figura, os portões selecionam para a população maior e mais bem definida. A presença de populações múltiplas e próximas para cada combinação de corantes de divisão celular não é, em nossa experiência, representativa de diferenças biológicas. Em vez disso, poderia indicar a) um procedimento de coloração não ótima, ou b) uma grande heterogeneidade (especialmente em tamanho) no pool inicial de células. Isso não é inesperado quando se começa a partir de sangue do cordão umbilical ou outras fontes biológicas complexas (por exemplo, aspirados de medula óssea, sangue periférico). Se a comporta não for bem definida, a diluição progressiva das diferentes combinações de corantes pode levar à fusão dos picos posteriores, especificamente para as condições CV e VC (Figura 2D). Outra consequência negativa de um confinamento subótimo é a incapacidade de distinguir eficientemente diferentes picos após a cultura celular, já que uma população inicial heterogênea pode levar a picos rasos.
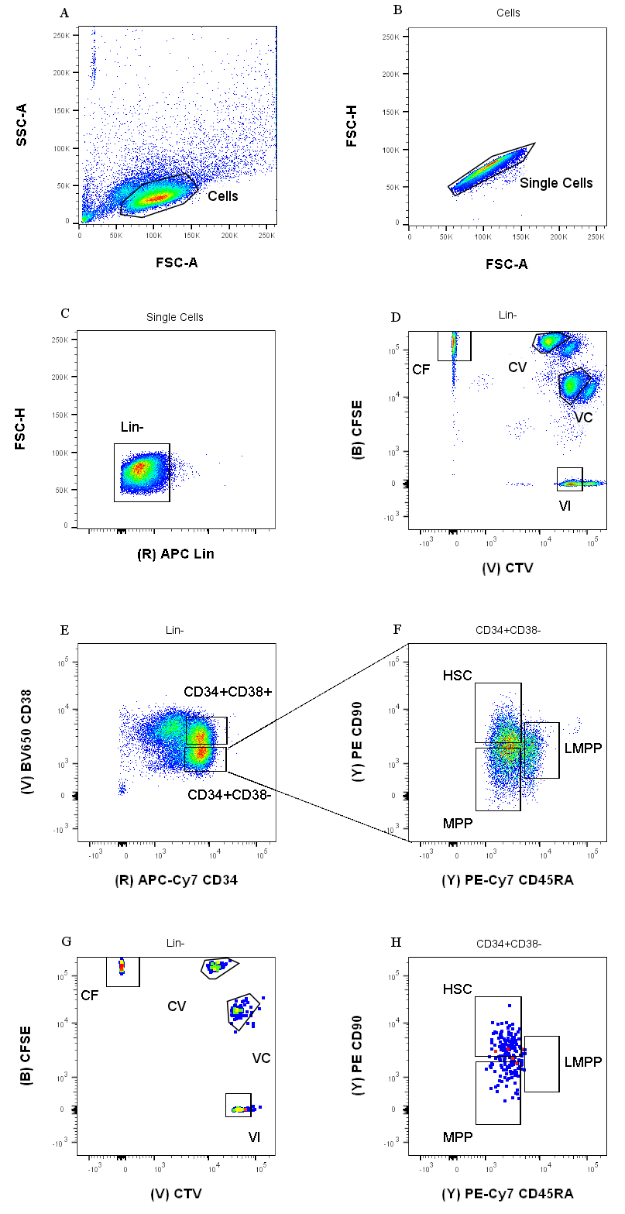
Figura 1: Estratégia de Gating para classificação celular. (A) FSC-A versus SSC-A, para excluir detritos e células contaminantes. (B) FSC-A versus FSC-H, para excluir duplos e aglomerados celulares. (C) Lin versus FSC-H, para excluir células que são Lin+. (D) CTV versus CFSE, para identificar univocamente as células coradas com as combinações de corantes CF, CV, VC e VI. Os portões devem ser rigorosos o suficiente para incluir uma população homogênea. (E) CD34 versus CD38, para separar os progenitores restritos CD34+CD38+ (também chamados de HPCs) do compartimento multipotente CD34+CD38-. (F) CD45RA versus CD90, da população CD34+CD38-, para separar entre os progenitores mais imaturos enriquecidos no HSC (CD90+CD45RA-), no LMPP (CD90midCD45RA+) e no MPP mais comprometido (CD90-CD45RA-). (G) Eventos classificados por índice, representados aqui pela coloração da combinação de corantes celulares e (H) pela expressão dos marcadores de superfície CD90 e CD45RA. Clique aqui para ver uma versão maior desta figura.
Análise por citometria de fluxo após cultura celular
Os dados da Figura 2 são representativos das CTHs do sangue do cordão umbilical humano, mantidas em cultura por 72 h, na presença de múltiplas citocinas capazes de suportar uma variedade de progenitores e precursores mieloides. Os painéis 2A a 2D representam o limite necessário para estabelecer o parentesco de cada uma das células individuais, enquanto os painéis 2E a 2G permitem a fenotipagem celular. A presença reduzida de PEMs na figura é provavelmente consequência das condições de cultura utilizadas para esse experimento representativo (Figura 2F). O uso de diferentes citocinas e condições de cultura altera a porcentagem relativa de cada subgrupo, da mesma forma que seleciona diferentes células iniciais para o experimento.
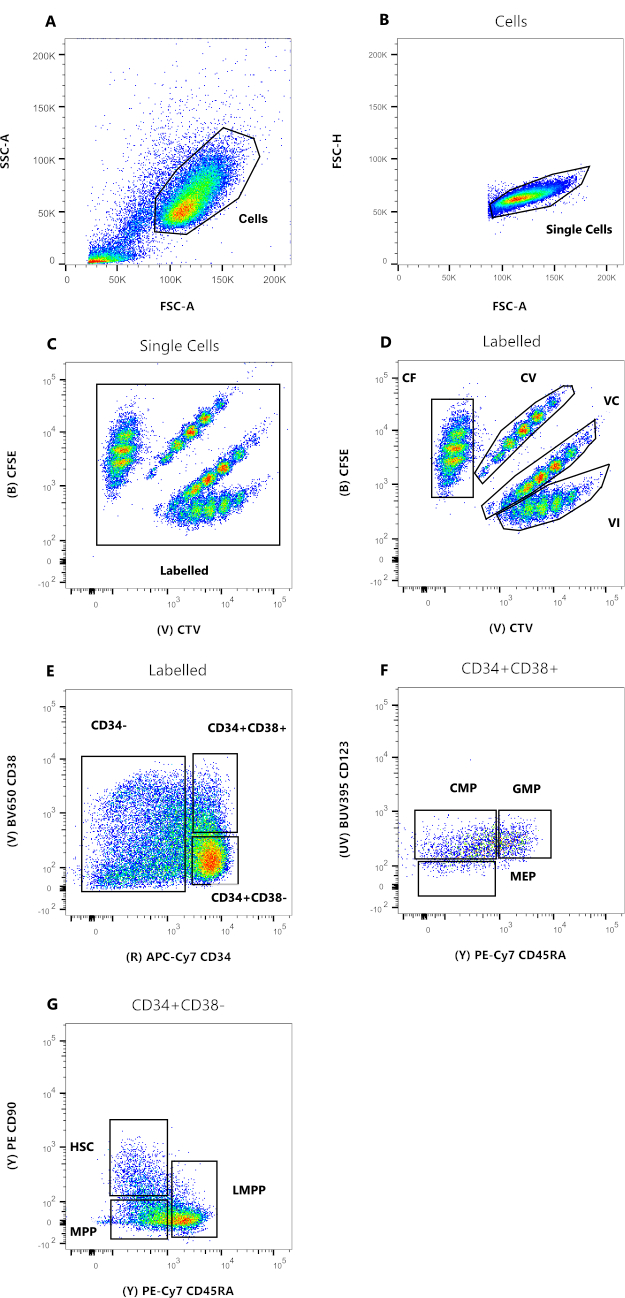
Figura 2: Estratégia de Gating para análise por citometria de fluxo. (A) FSC-A versus SSC-A, para excluir detritos e células contaminantes. (B) FSC-A versus FSC-H, para excluir duplos e aglomerados celulares. (C) CTV versus CFSE, o gate Labeled permite excluir qualquer evento autofluorescente que possa afetar a resolução dos dados. (D) CTV versus CFSE. É extremamente importante controlar rigorosamente as quatro populações, com base nas diluições do corante de divisão celular. (E) CD34 versus CD38, para distinguir entre precursores comprometidos (CD34-), progenitores restritos (HPC) (CD34+CD38+) e progenitores imaturos (CD34+CD38-). (F) CD45RA versus CD123, para distinguir três tipos de progenitores restritos: CMP (CD123+CD45RA-), PEmáx (CD123-CD45RA-) e GMP (CD123+CD45RA+). (G) CD45RA versus CD90, a partir do CD34+CD38-, para identificar HSCs, LMPPs e MPPs. Clique aqui para ver uma versão maior desta figura.
As etapas de definição e atribuição de picos (Figura 3 e Figura 4) são aspectos cruciais do protocolo e requerem a definição de portões rígidos. Para a definição do pico (Figura 3), são necessários pelo menos 1.000 eventos para uma identificação confiável. Nesse sentido, poderia ser benéfico isolar mais células durante a etapa de classificação celular para os poços "Bulk". A Figura 4 descreve quatro exemplos de poços únicos contendo múltiplas famílias. Esta figura esclarece a importância do gating Figura 2D e Figura 3, principalmente para a identificação de cada família e de cada pico. A Figura 4A ilustra um exemplo simples, pois todas as células no portão CF estão muito próximas umas das outras e podem ser facilmente atribuídas a um único pico. A Figura 4C mostra outro exemplo de família distribuída de forma unívoca em dois picos bem separados, como é claramente mostrado no histograma da Figura 4D. A Figura 4E,G revela a importância do confinamento rigoroso com base em um grande número de eventos; ambos exibem poucos eventos que estão próximos, mas fora dos portões de combinação de corantes. Esses eventos poderiam ser incluídos incorretamente nas comportas VI e CF, com base exclusivamente na análise de poço único. Finalmente, a Figura 4F,H mostra dois exemplos diferentes de famílias espalhadas em múltiplos picos, com um exemplo de dois picos de intensidade semelhantes (Figura 4F) e outro com dois picos de intensidade desiguais (Figura 4H).
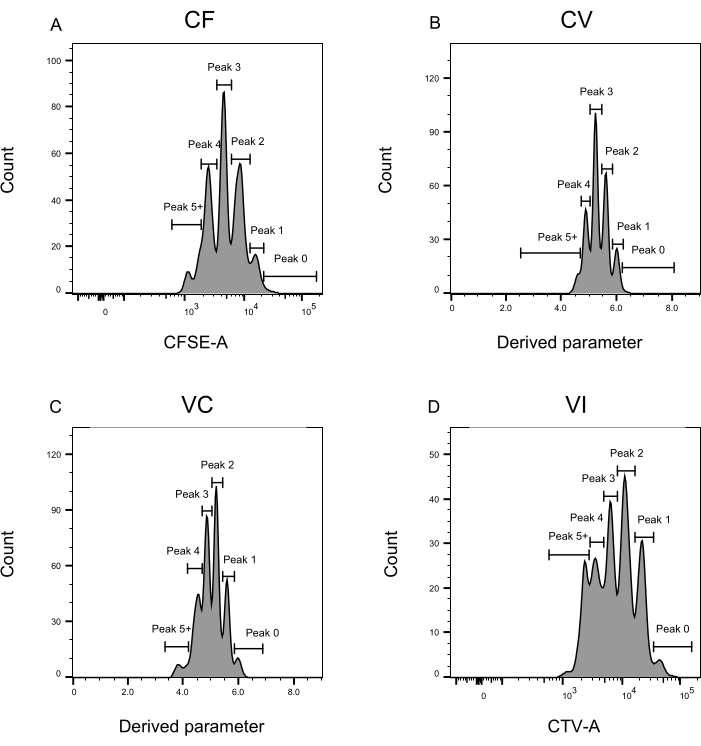
Figura 3: Definição do pico para a análise da citometria de fluxo. (A-D) Os picos devem ser definidos registrando pelo menos 500 eventos, para garantir uma boa representação para cada pico individual. (A) Histograma da intensidade CFSE-A. Vários picos podem ser identificados, cada um correspondendo a uma população diferente de células em divisão. (B,C) Histogramas para a intensidade do parâmetro derivado, representando a mistura CFSE-CTV, CV (B) e VC (C), respectivamente. (D) Histograma da intensidade do CTV-A. Clique aqui para ver uma versão maior desta figura.
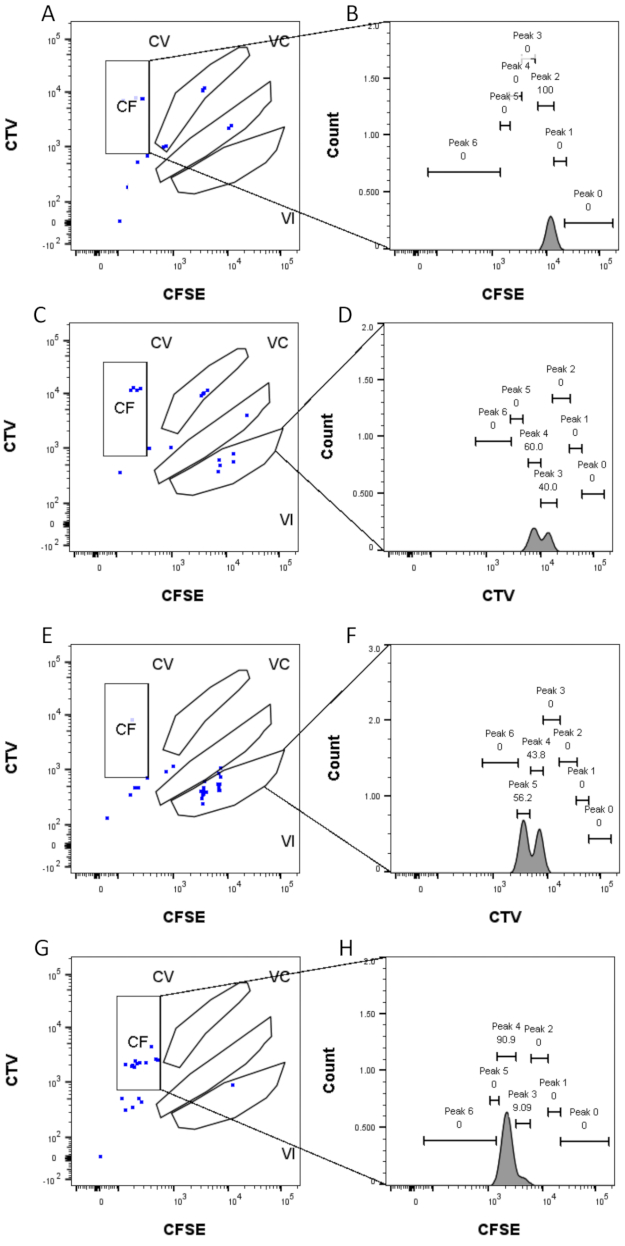
Figura 4: Atribuição de picos . (A,B) Um pico só pode ser detectado para este poço, no portão CF. (C,D) Dois picos de intensidade quase igual podem ser detectados neste poço, no portão VI. Os picos estão bem resolvidos. (E,F) Dois picos de intensidade comparável podem ser detectados neste poço, no portão VI. Apenas os eventos no portão foram considerados, com base na estratégia definida usando os poços de granel. (G-H) Dois picos de intensidade desigual podem ser detectados neste poço, no portão CF. Por favor, clique aqui para ver uma versão maior desta figura.
Representação de dados e testes estatísticos
A Figura 5 mostra diferentes tipos de representação de dados de dois experimentos separados, ambos realizados após 72 h de cultura celular. HSCs e MPPs foram cultivadas em dois diferentes meios de cultura celular, supostamente alterando as propriedades de divisão e diferenciação celular. Essas mídias são denominadas "Diff" (Diferenciação)32 e "GT"33; o primeiro promove diferenciação mieloide e eritroide, pois contém eritropoetina (EPO) e fator estimulador de colônias granulomonocíticas (GM-CSF), enquanto o segundo foi desenvolvido no contexto de ensaios clínicos de terapia gênica, com o objetivo de manter e amplificar uma alta porcentagem de HSPCs. A Figura 5A é um mapa de calor representativo para a condição "Diff", representando uma variedade de famílias celulares, tanto nos destinos celulares quanto nas divisões. Neste mapa de calor, cada linha representa uma família individual, cada quadrado uma célula individual, e as colunas estão agrupando todas as células que estão na mesma geração (por exemplo, células na geração 2 divididas pelo menos duas vezes). É possível distinguir famílias altamente homogêneas, compostas por um único tipo celular e exibindo o mesmo número de divisões (por exemplo, família #63), e famílias heterogêneas, incluindo três tipos celulares ao longo de duas gerações (por exemplo, família #84). Como a taxa de recuperação celular para esta análise é de aproximadamente 70%, famílias completas, que são definidas por terem todas as suas células recuperadas em gerações possivelmente diferentes (por exemplo, uma família de uma célula na geração 1 e duas células na geração 2), raramente são observadas (exibindo uma hashtag ao lado de seu número de identificação na Figura 5A). A detecção incompleta é múltipla, que pode ser técnica (problema de coloração, perda celular devido ao protocolo) ou biológica (morte celular e/ou apoptose). Limitações técnicas podem ser superadas usando um analisador projetado para reduzir o volume morto associado à amostra individual e realizando a coloração celular diretamente na placa de cultura celular para reduzir a pipetagem de volume. Por outro lado, métodos ortogonais para determinar a quantidade de morte celular (por exemplo, por meio de experimentos de imagem de células vivas) podem ajudar a distinguir os fatores técnicos e biológicos que resultam em detecção incompleta.
A Figura 5Bi mostra como visualizar o efeito da condição de cultura sobre a composição do tipo celular, como se tivesse realizado um ensaio em massa. Aqui, a condição Diff promove um maior número de destinos, e uma maior porcentagem de células CD34+ (definidas como todos os tipos de células, exceto CD34-). Os intervalos de confiança são calculados no script via bootstrap básico, com 250.000 conjuntos de dados bootstrapped34. Vale ressaltar que todos os outros histogramas da Figura 5 apresentam intervalos de confiança calculados da mesma forma. A Tabela 5 recapitula todas as informações sobre o número de famílias e número de células em cada geração.
A Figura 5Bii representa graficamente a saída do teste estatístico realizado no script "2_bar_plot". Está disponível uma descrição formal do quadro estatístico26. Em resumo, essa estrutura permite testar hipóteses estatísticas ao assumir que células da mesma família são dependentes (uma suposição que é por si só testável), ao contrário da estatística clássica que exigiria independência entre todas as células observadas. No caso específico apresentado na figura, o teste estatístico desafia a hipótese de que as escolhas de destino celular das MPPs, medidas como as frequências dos diferentes tipos celulares presentes na cultura, são independentes das condições de cultura celular utilizadas. Primeiro, a estatística do teste G é usada para avaliar a discrepância entre as frequências do tipo celular de diferentes meios celulares (por exemplo, em Bii, essa estatística é representada com a barra vermelha). Em seguida, é realizada uma randomização dos dados via permutação, trocando famílias inteiras de células entre as duas condições de cultura celular. Isso é para preservar a dependência entre células relacionadas à família, mantendo o número de famílias em cada conjunto consistente com os dados originais. A estatística do teste G é calculada a partir do conjunto de dados randomizados. Os valores de azul representados em 5Bii são a estatística do teste G para 250.000 permutações. Finalmente, o valor de p é calculado para avaliar até que ponto o conjunto de dados original se desvia da distribuição dos permutados. No exemplo, a estatística original se desvia em grande parte da distribuição, resultando em um pequeno valor de p e, portanto, rejeitando a hipótese de que o destino celular das MPPs é independente das condições de cultura.
A Figura 5C representa a porcentagem de famílias de células por geração máxima, para explorar como diferentes condições alteram a divisão celular por família de células. Este gráfico de dados mostra que, em 72 h, as células cultivadas na condição Diff completam um número maior de divisões do que as células na condição GT. Representado é o número máximo de gerações por cada família, de modo que uma família que exibe células nas gerações 1 e 2 é considerada como geração 2. O mesmo arcabouço estatístico utilizado para a Figura 5B pode ser utilizado para testar estatisticamente a independência entre divisão celular e condição de cultura.
A Figura 5D explora o tipo de simetria/assimetria da primeira divisão para os diferentes tipos de ancestrais (HSCs ou MPPs). Para as famílias celulares completas da geração 1 - a única geração em que é possível estabelecer definitivamente as duas células-filhas como células irmãs - quatro tipos diferentes de simetria/assimetria podem ser definidos: o rótulo "Sym Undiff" descreve famílias onde ambas as filhas mantêm o fenótipo da célula de origem. "Sym Diff" significa que ambas as filhas têm o mesmo fenótipo, e é diferente da célula de origem. "Asym Undiff" significa que uma filha só retém o fenótipo da célula de origem. Finalmente, "Asym Diff" descreve famílias onde ambas as filhas têm fenótipos diferentes, e nenhum deles é igual à célula de origem. Para ganhar poder estatístico na avaliação desses destinos simétricos/assimétricos, é desejável realizar a análise MultiGen em momentos iniciais, a fim de observar mais famílias cujos descendentes são encontrados na geração 1.
Finalmente, a Figura 5E representa as porcentagens de tipos celulares em função do número de divisões, para obter informações sobre a progressão do padrão de diferenciação entre as divisões. Por exemplo, os dados exibidos na figura sugerem que as células progridem para o estado CD34- , com mais de 50% das células detectadas nessa classe após apenas três divisões. Além disso, é possível inferir que as MPPs não favorecem a divisão de autorrenovação, pois uma pequena porcentagem de células mantém o fenótipo original. Algumas dessas conclusões podem então ser testadas usando o quadro estatístico apresentado nas figuras anteriores.
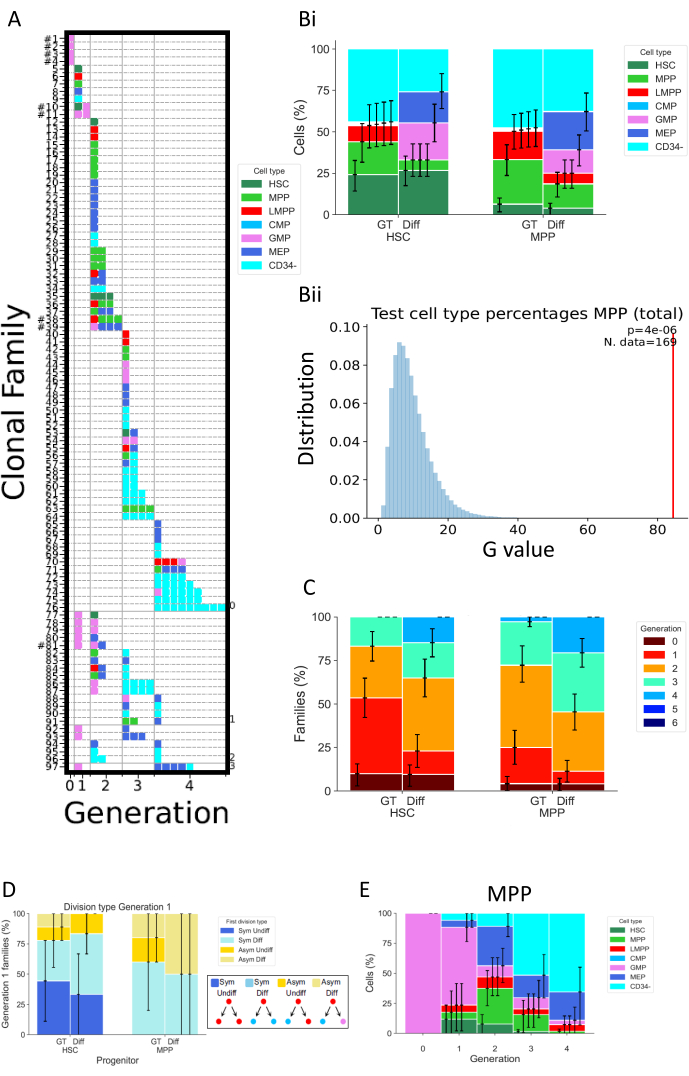
Figura 5: Exemplo de representação de dados para um experimento de 72 h usando HSPCs de sangue do cordão umbilical. (A) Mapas de calor para um conjunto de dados selecionado (HSC, em meio "Diff", após 72 h de cultura). Os gráficos representam todas as células individuais (quadrados) de acordo com seu parentesco (linhas), número de divisões realizadas (colunas, chamadas de geração) e fenótipo (cores). (Bi) Histograma comparando proporções dos tipos celulares das progênies celulares de HSCs e MPPs, entre a condição GT e a condição Diff (Bii) O gráfico representa os testes estatísticos realizados no script "2_bar_plot" para MPPs em 72h de cultura, comparando entre os coquetéis de citocinas "Diff" e "GT". O valor experimental é exibido em vermelho, e os valores gerados através de 250.000 permutações em azul. O valor de p do teste G é indicado no canto superior direito com o número de famílias utilizadas para o teste. (C) Histograma comparando o percentual de famílias (314 famílias no total) em cada geração (codificado por cores), para HSCs e MPPs por condição de cultura. Os intervalos de confiança são calculados com 250.000 conjuntos de dados bootstrap. (D) Histograma que representa o tipo de simetria/assimetria entre o destino das células filhas para as famílias com duas células na geração 1: Sym Undiff (ambas as filhas mantêm o fenótipo da célula de origem), Sym Diff (ambas as filhas têm o mesmo fenótipo, e é diferente da célula de origem), Asym Undiff (apenas uma filha retém o fenótipo da célula de origem), e Asym Diff (ambas as filhas têm fenótipos diferentes e nenhum deles se assemelha à célula de origem). (E) Histogramas da contribuição dos tipos celulares classificados por geração para MPPs cultivadas com o coquetel "Diff"; n = 204 células e 97 famílias. Clique aqui para ver uma versão maior desta figura.
Tabela 5: Descrição do número de famílias e células analisadas por cada condição experimental (célula de origem e meio de cultura celular). Clique aqui para baixar esta tabela.
Arquivo suplementar 1: Clique aqui para baixar este arquivo.
Arquivo suplementar 2: Clique aqui para baixar este arquivo.
Arquivo suplementar 3: Clique aqui para baixar este arquivo.
Arquivo suplementar 4: Clique aqui para baixar este arquivo.
Discussão
O ensaio MultiGen é um ensaio de alto rendimento, fácil execução e baixo custo, que tem sido fundamental para o estudo de linfócitos23,24,35 e células hematopoéticas murinas 26,27. Aqui, apresentamos um novo desenvolvimento da abordagem que permite decifrar ex vivo a fase inicial do comprometimento humano do HSPC, em nível unicelular, usando cultura de curto prazo (Figura 6). Sistemas de cultura ex vivo de célula única são tipicamente usados para avaliar o destino a longo prazo de HSPCs em células maduras, mas alguns destinos ocorrem mais cedo do que outros36, potencialmente enviesando a análise para menos destinos. Além disso, esses sistemas de cultura geralmente perdem informações sobre divisões durante o compromisso do destino. Os primeiros passos do comprometimento têm se mostrado precoces no início da cultura, às vezes sem divisão26,37, tornando a cultura de curto prazo e a divisão de rastreamento essenciais para estudar o comprometimento precoce do destino. Ao acompanhar simultaneamente o destino, a divisão e o parentesco, este ensaio permite compreender o papel da primeira divisão e a decisão do destino nos HSPCs humanos. Usando o ensaio, é possível inferir após quantas divisões o processo de comprometimento ocorre, o equilíbrio entre auto-renovação e diferenciação para esses progenitores iniciais e como essas propriedades são herdadas ao longo das gerações. Até onde sabemos, este é o único ensaio que permite esses tipos de medidas para HSPCs humanos, com resolução de célula única. Além disso, usando diferentes combinações de corantes de divisão celular, aumentamos o rendimento da análise, tornando este ensaio uma ferramenta valiosa para gerar grandes conjuntos de dados rapidamente. As combinações de corantes permitem acompanhar várias famílias nos mesmos poços, aumentando o número de células disponíveis para análise em cultura de curta duração. O número de combinações poderia ser potencialmente aumentado ainda mais, através da adição de outros corantes (por exemplo, corante amarelo) ou modificando a proporção de CFSE e CTV. No entanto, isso reduz o número de outros parâmetros que podem ser analisados.
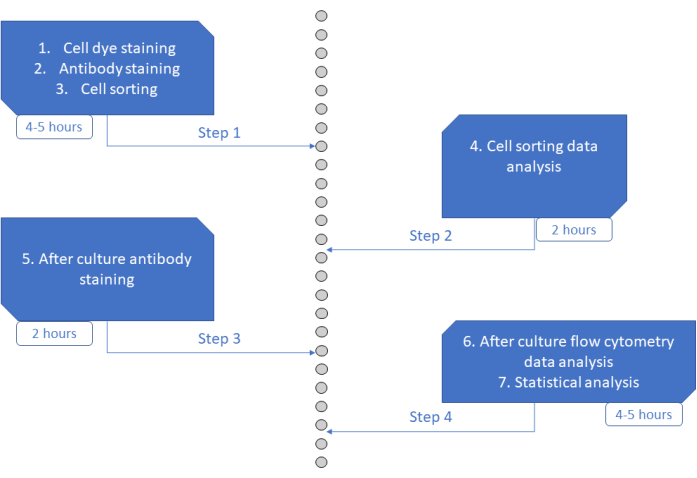
Figura 6: Representação esquemática do protocolo. Clique aqui para ver uma versão maior desta figura.
Para realizar a análise com sucesso, devido ao grande número de poços e ao número reduzido de células a serem analisadas, é necessário executar a análise por citometria de fluxo em um analisador equipado com um leitor de placas. A nova geração de analisadores de bancada é particularmente adaptada a este ensaio, pois a maioria deles tem um volume morto menor para reduzir a porcentagem de perda celular. Isso, por sua vez, garante uma maior eficiência na recuperação da totalidade de cada poço, levando a uma eficiência estimada na faixa de 70%26. Estimar a perda celular durante a aquisição por citometria de fluxo é crucial para a análise de cada família individual. Por exemplo, supondo que não haja morte celular e contando o número de divisões, é possível estimar o número de células por cada família. No entanto, é desejável realizar alguns experimentos confirmatórios, particularmente na estimativa de morte celular nas condições de cultura testadas e medir a taxa de recuperação experimentalmente usando um número definido de células.
Uma das etapas cruciais desse protocolo é a atribuição de pico. Como já mencionado, uma boa distribuição de picos de qualidade é fortemente dependente do isolamento de picos muito estreitos na triagem celular. No entanto, ainda é difícil atribuir o número correto de divisões com base exclusivamente na distribuição. Como a triagem celular e a análise por citometria de fluxo são realizadas em dois equipamentos diferentes, não é possível comparar diretamente a intensidade de cada sinal, de modo que pode ser difícil saber se o primeiro pico observado na extremidade direita do histograma é o pico 0 ou o pico 1. Nesse sentido, poucas soluções são possíveis; Uma maneira é realizar um experimento ortogonal para medir com precisão o número de divisões realizadas por essas células (por exemplo, imagens de células vivas). Outra possibilidade é simplesmente contar o número de células no poço sob um microscópio de campo claro invertido, antes de executar a análise de citometria de fluxo. Isso irá inferir um número médio de divisões (supondo que não haja morte celular). Finalmente, uma solução post-hoc para a atribuição de pico é a detecção de um número incomum de "famílias impossíveis"; Essas famílias são compostas por um número maior do que o possível de células por geração (por exemplo, cinco células na geração 2, ou duas células na geração 1 e uma célula na geração 2). A possibilidade de excluir famílias impossíveis é codificada na etapa de análise estatística e sinaliza a família impossível. Se a ocorrência desses erros for muito alta, é razoável supor que a atribuição de pico precise ser revista.
Nesse protocolo, incluímos alguns exemplos de representação e análise de dados para o ensaio, uma vez que este se tornou uma etapa essencial na geração e interpretação de grandes conjuntos de dados38. O primeiro exemplo é o mapa de calor que mostra a totalidade de todas as células analisadas, organizadas por família. Esta é uma ferramenta eficiente para explorar as propriedades gerais dos dados e possíveis conclusões: as famílias são compostas por múltiplos tipos celulares ou tendem a ser homogêneas em sua composição? As famílias estão espalhadas por várias gerações ou dividem-se, na sua maioria, o mesmo número de vezes? Essa análise exploratória precisa ser complementada com parcelas mais específicas e testes estatísticos. Ele pode ser usado para avaliar quantitativamente o compromisso de destino simétrico e assimétrico, a diferenciação sem divisão, o equilíbrio entre auto-renovação e diferenciação e o número de divisões para um determinado destino de compromisso. É fundamental, durante o planejamento experimental, definir o comprimento da cultura celular de acordo com o tipo de pergunta feita; Por exemplo, para as duas primeiras questões (equilíbrio simétrico/assimétrico e diferenciação sem divisão), o planejamento de etapas muito curtas permite o isolamento de um grande número de famílias que realizaram apenas uma ou nenhuma divisão26. Por outro lado, experimentos mais longos permitem a exploração do número de divisões necessárias para um comprometimento celular específico, pois amostram famílias em diferentes estágios de diferenciação. No entanto, esse método não é projetado para culturas de longo prazo (2-3 semanas), pois a diluição do corante celular não é capaz de rastrear com precisão mais de sete ou oito divisões22. Como consequência, esta ferramenta é principalmente adaptada para estudar o comprometimento precoce de progenitores hematopoiéticos, e não é projetada para tirar conclusões robustas sobre as propriedades de diferenciação a longo prazo dessas células.
O arcabouço estatístico foi desenvolvido especificamente para a análise desse tipo de dado e baseado no conceito depermutações26. Isso foi necessário devido à observação de uma dependência familiar da distribuição do tipo celular e do número de divisões realizadas. Em outras palavras, células que fazem parte da mesma família também são mais propensas a exibir fenótipos semelhantes e dividir o mesmo número de vezes. Embora uma análise aprofundada esteja além do escopo deste trabalho, o conjunto de testes estatísticos fornecido deve ser suficiente para avaliar diferentes condições.
Em conclusão, este protocolo constitui uma ferramenta valiosa para avaliar a dinâmica celular de células-tronco hematopoéticas e progenitoras ex vivo, de forma rápida e de baixo custo. Devido à sua flexibilidade e versatilidade em relação ao ponto de tempo, condições de cultura e tipo de HSPCs analisados, permite testar uma variedade de condições experimentais. Como um ensaio baseado em citometria de fluxo, pode ser implementado na maioria dos laboratórios, e não requer conhecimento prévio extensivo, tornando-se um bom candidato para triagens e experimentos piloto.
Divulgações
Os autores declaram a inexistência de conflitos de interesse relevantes para este trabalho. Os financiadores não tiveram nenhum papel no desenho do estudo, na coleta e interpretação dos dados ou na decisão de submeter o trabalho para publicação.
Agradecimentos
Gostaríamos de agradecer aos membros do Institut Curie Flow Facility por sua ajuda na montagem dos experimentos de citometria de fluxo. Queremos também agradecer as contribuições dos demais membros da Equipe Perié, durante múltiplas discussões. Agradecemos à Dra. Julia Marchingo e ao Prof. Phil Hodgkin (Walter End Eliza Hall Institute of Medical Research) por compartilharem seu protocolo de multiplexação de corantes de divisão celular em linfócitos. Agradecemos ao biobanco de sangue de cordão umbilical do hospital Saint Louis por fornecer os recursos biológicos necessários para o desenvolvimento deste protocolo. O estudo foi apoiado por uma bolsa ATIP-Avenir do CNRS e da Fundação Bettencourt-Schueller (para L.P.), subsídios do Labex CelTisPhyBio (ANR-10-LBX-0038) (para L.P. e A.D.), Idex Paris-Science-Lettres Program (ANR-10-IDEX-0001-02 PSL) (para L.P.), o Canceropole INCA Emergence (2021-1-EMERG-54b-ICR-1, para L.P.) e o subsídio ITMO MIIC (21CM044, para L.P.). Além do financiamento do Conselho Europeu de Investigação (ERC) no âmbito do programa de investigação e inovação Horizonte 2020 da União Europeia ERC StG 758170-Microbar (para L.P.), A.D. foi apoiado por uma bolsa da Fondation de France.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL polypropylene microcentrifuge tubes | vWR | 87003-294 | |
| 15-mL polypropylene tubes | vWR | 734-0451 | |
| 50-mL polypropylene tubes | vWR | 734-0448 | |
| 96-well U-bottom culture plate | Falcon | 353077 | |
| Anti-human Lin APC | Thermo Fisher | 22-7776-72 | Dilution 1/40 |
| ARIA III | BD | Can be replaced with any FACS sorter able to sort individual cells in 96-wells plate | |
| Carboxyfluorescein succinimidyl ester (CFSE) | Life Technologies | C34570 | |
| Cell Trace Violet (CTV) | Life Technologies | C34571 | |
| Compensation beads | BD | 552843 | |
| Dulbecco’s modified Eagle medium (DMEM) | Life Technologies | 11320033 | |
| Ethylenediaminetetraacetic acid (EDTA) | Thermo Scientific | J62948-36 | Prepare a solution 0.5 M, in sterilised water |
| FC block Fc1.3216 | BD | 564220 | Dilution 1/50 |
| Fetal Bovine Serum (FBS) | Dutscher | S1900-500C | Batch S00CH |
| FlowJo v10.8.1 | BD | ||
| Mouse anti-human CD10 PerCP-5.5, clone HI10a | Biolegend | 312216 | Dilution 1/20 |
| Mouse anti-human CD123 BUV395, clone 7G3 | BD | 564195 | Dilution 1/15 |
| Mouse anti-human CD34 APC-Cy7, clone 581 | Biolegend | 343513 | Dilution 1/40 |
| Mouse anti-human CD38 BV650, clone HB7 | Biolegend | 356620 | Dilution 1/40 |
| Mouse anti-human CD45RA AF700, clone HI100 | BD | 560673 | Dilution 1/20 |
| Mouse anti-human CD45RA PE-Cy7, clone HI100 | BD | 560675 | Dilution 1/20 |
| Mouse anti-human CD90 PE, clone 5E10 | Biolegend | 328110 | Dilution 1/20 |
| Phosphate Buffered Saline (PBS) 1X | Life Technologies | 10010001 | |
| Python | |||
| R | |||
| Sterile 12x75 mm conical polypropylene tubes | Falcon | ||
| ZE5 | Biorad | Can be replaced with any flow cytometry analyzer equipped with a plate reader | |
| Laboratory prepared | |||
| Cell culture media | Depends from the specific experiment. Prepare fresh daily and store at +4 °C until use | ||
| DMEM + 10% FBS | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 50 mL of FBS to 450 mL DMEM | ||
| PBS 1X + EDTA 0.1% | Can be stored in sterile conditions, at room temperature, up to 1 year. To prepare 500 mL, add 3.42 mL of EDTA 0.5 M to 500 mL PBS 1X | ||
| Staining buffer | Can be stored in sterile conditions, at +4 °C up to 1 year. To prepare 500 mL, add 2 mL of EDTA 0.5 M and 1 mL FBS to 500 mL PBS 1X |
Referências
- Ginhoux, F., Yalin, A., Dutertre, C. A., Amit, I. Single-cell immunology: Past, present, and future. Immunity. 55 (3), 393-404 (2022).
- Ke, M., Elshenawy, B., Sheldon, H., Arora, A., Buffa, F. M. Single cell RNA-sequencing: A powerful yet still challenging technology to study cellular heterogeneity. Bioessays. 44 (11), 2200084 (2022).
- Regev, A., et al. The human cell atlas. Elife. 6, 27041 (2017).
- Laurenti, E., Göttgens, B. From haematopoietic stem cells to complex differentiation landscapes. Nature. 553 (7689), 418-426 (2018).
- Haas, S., Trumpp, A., Milsom, M. D. Causes and consequences of hematopoietic stem cell heterogeneity. Cell Stem Cell. 22 (5), 627-638 (2018).
- Loughran, S. J., Haas, S., Wilkinson, A. C., Klein, A. M., Brand, M. Lineage commitment of hematopoietic stem cells and progenitors: insights from recent single cell and lineage tracing technologies. Experimental Hematology. 88, 1-6 (2020).
- Perié, L., Duffy, K. R. Retracing the in vivo haematopoietic tree using single-cell methods. FEBS Letters. 590 (22), 4068-4083 (2016).
- Yu, V. W. C., et al. Epigenetic memory underlies cell-autonomous heterogeneous behavior of hematopoietic stem cells. Cell. 167 (5), 1310-1322 (2016).
- Ganuza, M., et al. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nature Cell Biology. 19 (10), 1153-1163 (2017).
- Naik, S. H., Schumacher, T. N., Perié, L. Cellular barcoding: A technical appraisal. Experimental Hematology. 42 (8), 598-608 (2014).
- Quek, L., et al. Genetically distinct leukemic stem cells in human CD34 − acute myeloid leukemia are arrested at a hemopoietic precursor-like stage. The Journal of Experimental Medicine. 213 (8), 1513-1535 (2016).
- Karamitros, D., et al. Single-cell analysis reveals the continuum of human lympho-myeloid progenitor cells. Nature Immunology. 19 (1), 85-97 (2018).
- Boitano, A. E., et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science. 329 (5997), 1345-1348 (2010).
- Delaney, C., et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nature Medicine. 16 (2), 232-236 (2010).
- Fares, I., et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science. 345 (6203), 1509-1512 (2014).
- Guo, B., Huang, X., Lee, M. R., Lee, S. A., Broxmeyer, H. E. Antagonism of PPAR-γ 3 signaling expands human hematopoietic stem and progenitor cells by enhancing glycolysis. Nature Medicine. 24 (3), 360-367 (2018).
- Vannini, N., et al. The NAD-booster nicotinamide riboside potently stimulates hematopoiesis through increased mitochondrial clearance. Cell Stem Cell. 24 (3), 405-418 (2019).
- Gupta, R., et al. Nov/CCN3 enhances cord blood engraftment by rapidly recruiting latent human stem cell activity. Cell Stem Cell. 26 (4), 527-541 (2020).
- Horwitz, M. E., et al. Omidubicel vs standard myeloablative umbilical cord blood transplantation: results of a phase 3 randomized study. Blood. 138 (16), 1429-1440 (2021).
- Weinreb, C., Rodriguez-Fraticelli, A., Camargo, F. D., Klein, A. M. Lineage tracing on transcriptional landscapes links state to fate during differentiation. Science. 367 (6479), 3381 (2020).
- Loeffler, D., Schroeder, T. Understanding cell fate control by continuous single-cell quantification. Blood. 133 (13), 1406-1414 (2019).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. Journal of Visualized Experiments. (70), e4287 (2012).
- Marchingo, J. M., et al. T-cell stimuli independently sum to regulate an inherited clonal division fate. Nature Communications. 7, 13540 (2016).
- Horton, M. B., et al. Multiplexed division tracking dyes for proliferation-based clonal lineage tracing. Journal of Immunology. 201 (3), 1097-1103 (2018).
- Lehmann, E. L., Romano, J. P., Casella, G. . Testing statistical hypotheses. , 784 (2005).
- Tak, T., et al. HSPCs display within-family homogeneity in differentiation and proliferation despite population heterogeneity. Elife. 10, 360624 (2021).
- Sommerkamp, P., et al. Mouse multipotent progenitor 5 cells are located at the interphase between hematopoietic stem and progenitor cells. Blood. 137 (23), 3218-3224 (2021).
- Kato, K., Radbruch, A. Isolation and characterization of CD34+ hematopoietic stem cells from human peripheral blood by high-gradient magnetic cell sorting. Cytometry. 14 (4), 384-392 (1993).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Doulatov, S., et al. Revised map of the human progenitor hierarchy shows the origin of macrophages and dendritic cells in early lymphoid development. Nature Immunology. 11 (7), 585-593 (2010).
- Goardon, N., et al. Coexistence of LMPP-like and GMP-like leukemia stem cells in acute myeloid leukemia. Cancer Cell. 19 (1), 138-152 (2011).
- Laurenti, E., et al. CDK6 levels regulate quiescence exit in human hematopoietic stem cells. Cell Stem Cell. 16 (3), 302-313 (2015).
- Aiuti, A., et al. Lentiviral hematopoietic stem cell gene therapy in patients with Wiskott-Aldrich syndrome. Science. 341 (6148), 1233151 (2013).
- Davison, A. C., Hinkley, D. V. . Bootstrap Methods and their Application. , (1997).
- Horton, M. B., et al. Lineage tracing reveals B cell antibody class switching is stochastic, cell-autonomous, and tuneable. Immunity. 55 (10), 1843-1855 (2022).
- Notta, F., et al. Distinct routes of lineage development reshape the human blood hierarchy across ontogeny. Science. 351 (6269), 2116 (2016).
- Grinenko, T., et al. Hematopoietic stem cells can differentiate into restricted myeloid progenitors before cell division in mice. Nature Communications. 9 (1), 1898 (2018).
- Saeys, Y., Van Gassen, S., Lambrecht, B. N. Computational flow cytometry: Helping to make sense of high-dimensional immunology data. Nature Reviews Immunology. 16 (7), 449-462 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados