A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
القياس في الوقت الحقيقي لملف الطاقة الحيوية للميتوكوندريا للعدلات
In This Article
Summary
نصف بروتوكولات متدرجة تقيس تنفس الميتوكوندريا للفأر والعدلات البشرية وخلايا HL60 باستخدام محلل التدفق الأيضي خارج الخلية.
Abstract
العدلات هي خط الدفاع الأول والكريات البيض الأكثر وفرة في البشر. تؤدي هذه الخلايا المستجيبة وظائف مثل البلعمة والانفجار التأكسدي ، وتخلق مصائد العدلات خارج الخلية (NETs) لإزالة الميكروبات. تتحدى رؤى جديدة حول الأنشطة الأيضية للعدلات المفهوم المبكر بأنها تعتمد بشكل أساسي على تحلل السكر. يمكن أن يكشف القياس الدقيق للأنشطة الأيضية عن المتطلبات الأيضية المختلفة للعدلات ، بما في ذلك دورة حمض الكربوكسيل (TCA) (المعروفة أيضا باسم دورة كريبس) ، والفسفرة التأكسدية (OXPHOS) ، ومسار فوسفات البنتوز (PPP) ، وأكسدة الأحماض الدهنية (FAO) في ظل الظروف الفسيولوجية وفي حالات المرض. تصف هذه الورقة بروتوكولا خطوة بخطوة ومتطلبات مسبقة لقياس معدل استهلاك الأكسجين (OCR) كمؤشر على تنفس الميتوكوندريا على العدلات المشتقة من نخاع عظم الفأر ، والعدلات المشتقة من دم الإنسان ، وخط خلية HL60 الشبيه بالعدلات ، باستخدام تحليل التدفق الأيضي على محلل التدفق الأيضي خارج الخلية. يمكن استخدام هذه الطريقة لتحديد وظائف الميتوكوندريا للعدلات في ظل الظروف العادية والمرضية.
Introduction
تلعب الميتوكوندريا دورا رئيسيا في الطاقة الحيوية للخلايا ، والتي تولد أدينوسين ثلاثي الفوسفات (ATP) عن طريق الفسفرة التأكسدية (OXPHOS). بالإضافة إلى ذلك ، يمتد دور الميتوكوندريا إلى توليد وإزالة السموم من أنواع الأكسجين التفاعلية ، وتنظيم الكالسيوم في مصفوفة السيتوبلازم والميتوكوندريا ، والتوليف الخلوي ، والهدم ، ونقل المستقلبات داخل الخلية1. يعد تنفس الميتوكوندريا ضروريا في جميع الخلايا ، حيث يمكن أن يؤدي اختلالها الوظيفي إلى مشاكل التمثيل الغذائي 2 ، بما في ذلك أمراض القلب والأوعية الدموية3 ومجموعة متنوعة من الأمراض التنكسية العصبية ، مثل التنكس البقعي المرتبط بالعمر4 ، وأمراض باركنسون والزهايمر5 ، ومرض شاركو ماري توث2 أ (CMT2A) 6.
كشفت الدراسات المجهرية الإلكترونية على العدلات أن هناك عددا قليلا نسبيا من الميتوكوندريا7 ، وأنها تعتمد بشكل كبير على تحلل السكر لإنتاج الطاقة لأن معدلات التنفس الميتوكوندريا منخفضة جدا8. ومع ذلك ، فإن الميتوكوندريا ضرورية لوظائف العدلات ، مثل الانجذاب الكيميائي9 وموت الخلايا المبرمج10،11،12. كشفت دراسة سابقة عن وجود شبكة ميتوكوندريا معقدة في العدلات البشرية ذات إمكانات غشائية عالية. يعد فقدان غشاء الميتوكوندريا المحتمل مؤشرا مبكرا على موت الخلايا المبرمجالعدلات 10. أظهرت المعالجة باستخدام غير مقرنة الميتوكوندريا كربونيل سيانيد m-chlorophenyl hydrazone (CCCP) تثبيطا كبيرا في الانجذاب الكيميائي ، إلى جانب تغيير في مورفولوجيا الميتوكوندريا 9,10.
على الرغم من أن مصدر الطاقة الأساسي للعدلات هو تحلل السكر ، إلا أن الميتوكوندريا توفر ATP الذي يبدأ تنشيط العدلات عن طريق تغذية المرحلة الأولى من إشارات البيورينرجيك ، والتي تعزز إشارات Ca2+ ، وتضخم إنتاج ATP الميتوكوندريا ، وتبدأ الاستجابات الوظيفيةللعدلات 13. يؤدي خلل في السلسلة التنفسية للميتوكوندريا إلى الإفراط في إنتاج أنواع الأكسجين التفاعلية السامة (ROS) ويؤدي إلى أضرار مسببة للأمراض14،15،16. NETosis ، وهي عملية تشكيل مصائد العدلات خارج الخلية (NETs) ، هي خاصية مهمة للعدلات تساعدها على محاربة مسببات الأمراض17 وتساهم في العديد من الحالات المرضية ، بما في ذلك السرطان والتخثر واضطرابات المناعة الذاتية18. يساهم أنواع الأكسجين التفاعلية المشتقة من الميتوكوندريا في NETosis19 ، ويمكن أن يكون الحمض النووي للميتوكوندريا مكونا من مكونات NETs18 ، كما أن توازن الميتوكوندريا المتغير يضعف NETosis20،21،22،23،24. علاوة على ذلك ، أثناء التمايز الطبيعي أو النضج ، يتم عكس إعادة برمجة التمثيل الغذائي للعدلات عن طريق الحد من نشاط تحلل السكر ، ويشاركون في تنفس الميتوكوندريا ويحشدون الدهون داخل الخلايا25,26.
يمكن لمحلل التدفق الأيضي خارج الخلية مراقبة وقياس تنفس الميتوكوندريا للخلايا الحية وتحلل السكر باستمرار. يستخدم المحلل خرطوشة مستشعر بتنسيق لوحة 96 بئرا واثنين من الفلوروفور لتحديد تركيز الأكسجين (O2) وتغيرات الأس الهيدروجيني. خرطوشة المستشعر فوق الطبقة الأحادية للخلية أثناء الفحص وتشكل غرفة دقيقة بارتفاع ~ 200 نانومتر. تستخدم حزم الألياف الضوئية في المحلل لإثارة الفلوروفورات واكتشاف تغيرات شدة الفلورسنت. يتم حساب التغييرات في الوقت الفعلي في تركيز O2 ودرجة الحموضة تلقائيا وتظهر كمعدل استهلاك الأكسجين (OCR) ومعدل التحمض خارج الخلية (ECAR). هناك أربعة منافذ على خرطوشة المستشعر تسمح بتحميل ما يصل إلى أربعة مركبات في كل بئر أثناء قياسات الفحص. يركز هذا البروتوكول على تحديد التنفس الميتوكوندريا للفأر والعدلات البشرية ، وكذلك خلايا HL60 الشبيهة بالعدلات ، باستخدام محلل التدفق الأيضي خارج الخلية.
Protocol
تم الحصول على عينات الدم الكامل الهيبارين من متبرعين بشريين أصحاء بعد الحصول على موافقة مستنيرة ، على النحو الذي وافق عليه مجلس المراجعة المؤسسية ل UConn Health وفقا لإعلان هلسنكي. اتبعت جميع التجارب على الحيوانات إرشادات لجنة رعاية واستخدام الحيوانات المؤسسية لصحة UConn (IACUC) ، وتم الحصول على الموافقة على استخدام القوارض من UConn Health IACUC وفقا للمعايير الموضحة في دليل رعاية واستخدام المختبر من المعاهد الوطنية للصحة. تم استخدام ذكور الفئران C57BL / 6 في عمر 6 أسابيع في هذه الدراسة.
1. إعداد لوحة 96 بئرا لفحص التدفق الأيضي خارج الخلية
- يتم تعبئة خرطوشة مستشعر أعلى اللوحة المصممة خصيصا لفحص التدفق الأيضي خارج الخلية. قم بترطيب الخرطوشة عن طريق رفعها بعناية ، وضع 200 ميكرولتر / بئر من وسط المعايرة في كل بئر من اللوحة الأساسية. ضع الخرطوشة فوق اللوحة مع المعايرة في حاضنة خالية من ثاني أكسيد الكربون2 ، مرطبة ، 37 درجة مئوية طوال الليل لترطيبها.
- بناء على نوع الخلية ، استخدم طلاءا محددا للوحة الثقافة لضمان التصاق الخلية. بالنسبة للعدلات البشرية - خلايا HL60 غير المتمايزة والمتمايزة - قم بتغطية الصفيحة المكونة من 96 بئرا بمحلول ملحي معقم مخزن بالفوسفات (PBS) يحتوي على 50 ميكرولتر من 5 ميكروغرام / مل من الجسم المضاد CD18 للفأر المنقى المضاد للإنسان (Clone TS1 / 18) عند 4 درجات مئوية طوال الليل. بالنسبة للعدلات في الفأر ، قم بتغطية الصفيحة المكونة من 96 بئرا ب 25 ميكرولتر من 22.4 ميكروغرام / مل Cell Tak عند درجة الحموضة 8.0 بوصة 0.1 م NaHCO3 في درجة حرارة الغرفة (RT) لمدة 20 دقيقة.
- اغسل الأطباق ب 200 ميكرولتر من برنامج تلفزيوني معقم مرتين.
- أضف وسطا كاملا إلى آبار الزاوية (A1 و A12 و H1 و H12) للوحة زراعة الخلايا (بدون خلايا) لتصحيح الخلفية في ألواح زراعة الخلايا أثناء البذر.
ملاحظة: قد يؤثر التبخر أثناء الطلاء والمعايرة على حجم وسائط المعايرة والتطبيع. استخدم صينية أو حجرة بها منديل معقم مبلل بالماء وضع اللوحة مع المعايرة فوقها لمنع التبخر.
2. تحضير وبذر الخلايا
- إعداد وسيط الفحص
- قم بإعداد وسط الفحص بإضافة 1 مللي مول بيروفات ، 10 مللي متر جلوكوز ، و 2 مللي مول جلوتامين إلى وسط النسر المعدل من Dulbecco (DMEM).
- عزل العدلات الفئران من نخاع العظام
- اعزل العدلات الفأرية عن نخاع العظم باستخدام مجموعة إثراء العدلات بالماوس ، وفقا لتعليمات الشركة المصنعة.
- تخدير الفئران عن طريق حقن الكيتامين داخل الصفاق (125 ملغم / كغم) والزيلازين (12.5 ملغم / كغم) ثم القتل الرحيم للفئران عن طريق خلع عنق الرحم.
- حصاد عظم الفخذ والساق ، كما هو موضح سابقا27. لفترة وجيزة ، قطع الجلد لفضح الساق مع العضلات. قطع مفصل الورك لإزالة الساق من الجسم. ثم قم بإزالة العضلات لجمع عظم الفخذ والساق.
- قطع الأطراف الأصغر من عظم الفخذ والنقش. أمسك أطراف القطع لأسفل ، وضعها في أنبوب طرد مركزي سعة 0.5 مل مع فتحتين مثقوبتين بإبرة حقنة 25 جيجا في القاع ، وضع الأنبوب 0.5 مل في أنبوب طرد مركزي سعة 1.5 مل (الشكل 1 أ). أضف 50 ميكرولتر من برنامج تلفزيوني إلى أنبوب 0.5 مل لمنع جفاف خلايا نخاع العظام.
- جهاز طرد مركزي عند 5900 × جم في RT لمدة 15 ثانية لجمع نخاع العظم في الجزء السفلي من أنبوب 1.5 مل. إعادة تعليق خلايا نخاع العظم مع 1 مل من DMEM. أضف 50 ميكرولتر من مصل الفئران من المجموعة ، واخلطها برفق عن طريق السحب ، وانقل تعليق الخلية إلى أنبوب اختبار زراعة البوليسترين سعة 5 مل.
- أضف 50 ميكرولتر من كوكتيل التخصيب من مجموعة إثراء العدلات بالماوس واحتضانها لمدة 15 دقيقة في RT. أجهزة الطرد المركزي عند 300 × جم في RT لمدة 5 دقائق.
- أعد تعليق الخلايا ب 1 مل من DMEM ، وأضف 50 ميكرولتر من كوكتيل اختيار البيوتين من المجموعة ، واخلطها برفق عن طريق السحب ، واحتضانها لمدة 15 دقيقة في RT.
- أضف 150 ميكرولتر من الجسيمات المغناطيسية الدوامة من المجموعة ، واخلطها برفق عن طريق السحب ، واحتضانها لمدة 10 دقائق في RT.
- أضف ~ 1.3 مل من DMEM ، واخلطه برفق عن طريق السحب ، وضع الأنبوب في المغناطيس لمدة 3 دقائق ، وانقل المادة الطافية التي تحتوي على عدلات الفئران النقية إلى أنبوب اختبار جديد من البوليسترين سعة 5 مل عن طريق قلب الأنبوب الأصلي مع المغناطيس.
- أجهزة الطرد المركزي في 300 × غرام في RT لمدة 5 دقائق. بعد إزالة المادة الطافية عن طريق شفط الفراغ ، أعد تعليق الخلايا ب 1 مل من وسط الفحص.
- عد الخلايا يدويا باستخدام مقياس الدم.
- اضبط كثافة الخلية على 1.1 × 106 خلايا / مل عن طريق إضافة وسط الفحص ، البذور 180 ميكرولتر من تعليق العدلات للفأر (2 × 105 خلايا) لكل بئر في لوحة 96 بئرا المعدة (الخطوات 1.2-1.4) ، وأجهزة الطرد المركزي للوحة عند 300 × جم في RT لمدة 3 دقائق بدون فرامل لضمان الالتصاق صحيح للخلايا الموجودة أسفل اللوحة.
- احتضان اللوحة في حاضنة غير CO2 ، رطبة ، 37 درجة مئوية لمدة 1 ساعة لموازنة الخلايا مسبقا باستخدام وسط الفحص.
ملاحظة: نقاء العدلات أمر بالغ الأهمية للفحص لأنه تحيز محتمل. نقاء عزل العدلات الماوس هو 69.9 ٪ -88.7 ٪ من خلال هذا البروتوكول. هناك طرق أخرى لعزل العدلات من نخاع عظم الفأر ، مثل الطرد المركزي لتدرج الكثافة28. هناك أيضا مجموعات بديلة لعزل العدلات من بائعين آخرين ، بناء على الانتقاء المغناطيسي السلبي باستخدام الأجسام المضادة وحيدة النسيلة ضد المستضدات التي لا يتم التعبير عنها في العدلات.
- عزل العدلات البشرية عن الدم المحيطي
- أضف 8 مل من محلول السكريات إلى أنبوب طرد مركزي سعة 15 مل ، ثم ضع طبقة تزيد عن 4 مل من الدم المحيطي فوق محلول السكريات دون خلط.
- أجهزة الطرد المركزي عند 550 × جم عند 20 درجة مئوية لمدة 30 دقيقة. اجعل الدوار يتباطأ عند 1.
ملاحظة: قد يختلف وقت فصل العدلات بين المتبرعين. إنها 30 دقيقة على الأقل ، وقد تكون هناك حاجة إلى 10-20 دقيقة إضافية إذا لم ينجح فصل العدلات. - لاحظ انفصال البلازما/الصفائح الدموية والخلايا أحادية النواة بعد الطرد المركزي، كما هو موضح في الشكل 1 ب. قم بإزالة السائل الأصفر العلوي بعناية في الأعلى (البلازما والصفائح الدموية) والشريط الغائم العلوي (الخلايا أحادية النواة) دون إزعاج الشريط الغائم السفلي (العدلات) باستخدام ماصة 1 مل.
- اجمع النطاق الغائم السفلي و ~ 3-4 مل من السائل الصافي أدناه في أنبوب طرد مركزي جديد سعة 15 مل يحتوي على 10 مل من PBS.
- أجهزة الطرد المركزي عند 400 × جم عند 20 درجة مئوية لمدة 10 دقائق وإزالة المادة الطافية عن طريق شفط الفراغ.
- أعد تعليق الخلايا ب 5 مل من PBS وأجهزة الطرد المركزي عند 300 × جم عند 20 درجة مئوية لمدة 5 دقائق.
- بعد إزالة المادة الطافية ، أعد تعليق الخلايا ب 1 مل من وسط الفحص.
- عد الخلايا يدويا باستخدام مقياس الدم.
ملاحظة: نظرا لأن كريات الدم الحمراء في الدم لا تحتوي على أي ميتوكوندريا ، فإن تلوث كرات الدم الحمراء لا يؤثر على اختبار إجهاد الميتوكوندريا ويمنع تنشيط / تحضير العدلات29,30. يجب تحليل كريات الدم الحمراء أثناء عد الخلايا للحصول على تركيز دقيق للعدلات. أضف 10 ميكرولتر من معلق الخلية إلى 891 ميكرولتر من الماء منزوع الأيونات لمدة 10-30 ثانية لتحلل كريات الدم الحمراء ، ثم أضف 99 ميكرولتر من 10x PBS لموازنة الضغط التناضحي ، وتجنب تحلل العدلات. - اضبط كثافة الخلية على 2.2 × 106 خلايا / مل عن طريق إضافة وسط الفحص ، والبذور 180 ميكرولتر من العدلات البشرية (~ 4 × 105) لكل بئر في لوحة 96 بئرا المعدة ، وأجهزة الطرد المركزي للوحة عند 300 × جم في RT لمدة 3 دقائق بدون فرامل لضمان التصاق صحيح للخلايا الموجودة أسفل اللوحة.
- احتضان اللوحة في حاضنة غير -CO2 ، رطبة ، 37 درجة مئوية لمدة 1 ساعة لموازنة الخلايا بوسط الفحص.
ملاحظة: نقاء العدلات أمر بالغ الأهمية للفحص لأنه تحيز محتمل. نقاء عزل العدلات البشرية هو 86.6 ٪ -96.8 ٪. هناك طرق أخرى للطرد المركزي المتدرج الكثافة لعزل العدلات من دم الإنسان ، بما في ذلك عزل Percoll بالإضافة إلى مزيج من عزل Ficoll وترسيب ديكستران31.
- زراعة الخلايا HL60 والتمايز الموجه للعدلات
- الحفاظ على خلايا HL60 في معهد روزويل بارك التذكاري (RPMI) -1640 وسط يحتوي على 10٪ مصل بقري جنيني (FBS) ، 100 ميكروغرام / مل بنسلين ، 100 ميكروغرام / مل ستربتومايسين ، و 250 نانوغرام / مل أمفوتريسين ب عند 37 درجة مئوية و 5٪ CO2.
- للتمايز الموجه للعدلات ، حافظ على خلايا HL60 (الخلايا العالقة) في دورق T25 بكثافة 1 × 10 5 خلايا / مل في وسط RPMI-1640 يحتوي على 10٪ FBS ، 100 ميكروغرام / مل بنسلين ، 100 ميكروغرام / مل ستربتومايسين ، 250 نانوغرام / مل أمفوتريسين B ، و 1.3٪ ثنائي ميثيل سلفوكسيد (DMSO) عند 37 درجة مئوية و5 ٪ CO2 لمدة 6 أيام.
- في يوم الفحص ، عد الخلايا يدويا باستخدام مقياس الدم ، أو خلايا HL60 المتمايزة أو غير المتمايزة بالطرد المركزي عند 300 × جم في RT لمدة 5 دقائق ، واغسلها باستخدام DMEM مرة واحدة ، وأعد تعليق الخلايا بوسط الفحص للحصول على كثافة خلية تبلغ 1.39 × 106 خلايا / مل.
- بذر 180 ميكرولتر من خلايا HL60 المتمايزة أو غير المتمايزة (~ 2.5 × 105) لكل بئر في لوحة 96 بئرا المعدة وأجهزة الطرد المركزي للوحة عند 300 × جم في RT لمدة 3 دقائق بدون فرامل لضمان الالتصاق صحيح للخلايا الموجودة أسفل اللوحة.
- احتضان اللوحة في حاضنة غير CO2 ، رطبة ، 37 درجة مئوية لمدة 1 ساعة لموازنة الخلايا مسبقا باستخدام وسط الفحص.
ملاحظة: تأكد من الالتصاق الكامل للخلايا باستخدام المجهر قبل الخطوة التالية.
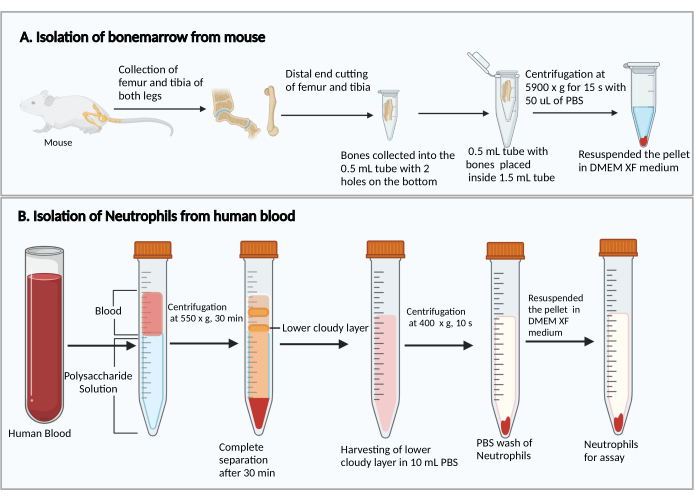
الشكل 1: رسم تخطيطي لعزل خلايا نخاع العظم والعدلات. أ: حصاد خلايا نخاع العظم من فأر، ب: عزل العدلات من دم الإنسان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نوع الخلية | خلايا لكل بئر | المركبات / الكواشف | تركيز حل العمل | حجم الحقن إلى المنافذ | التركيز النهائي في الآبار |
| العدلات الماوس | 2 × 105 | أوليغوميسين | 25 ميكرومتر | 20 ميكرولتر | 2.5 ميكرومتر |
| إف سي بي | 7.5 ميكرومتر | 17.6 ميكرولتر | 0.61 ميكرومتر | ||
| خليط روتينون أنتيمايسين أ | 10 ميكرومتر | 24 ميكرولتر | 1 ميكرومتر | ||
| العدلات البشرية | 4 × 105 | أوليغوميسين | 10 ميكرومتر | 20 ميكرولتر | 1 ميكرومتر |
| إف سي بي | 12.5 ميكرومتر | 22 ميكرولتر | 1.25 ميكرومتر | ||
| خليط روتينون أنتيمايسين أ | 10 ميكرومتر | 24 ميكرولتر | 1 ميكرومتر | ||
| خلايا HL60 غير متمايزة أو متمايزة | 2.5 × 105 | أوليغوميسين | 25 ميكرومتر | 20 ميكرولتر | 2.5 ميكرومتر |
| إف سي بي | 15 ميكرومتر | 22 ميكرولتر | 1.5 ميكرومتر | ||
| خليط روتينون أنتيمايسين أ | 10 ميكرومتر | 24 ميكرولتر | 1 ميكرومتر |
الجدول 1: أرقام الخلايا وتركيزات الكاشف لاختبار إجهاد الميتوكوندريا.
3. تحضير المركبات في مجموعة اختبار إجهاد الميتوكوندريا
- افتح مجموعة اختبار إجهاد الميتوكوندريا وقم بإعداد الكواشف.
ملاحظة: يبين الجدول 1 تركيزات محلول العمل المختلفة ، وحجم الحقن في الآبار ، والتركيزات النهائية في آبار oligomycin ، والكربونيل سيانيد p-trifluoromethoxy phenylhydrazone (FCCP) ، وخليط rotenone / antimycin A المستخدم في العدلات الفئران ، والعدلات البشرية ، وخلايا HL60.- قم بإعداد محلول مخزون oligomycin عن طريق إعادة تكوين oligomycin مع 630 ميكرولتر من وسط الفحص للحصول على محلول مخزون 100 ميكرومتر.
ملاحظة: يوصى باستخدام حل المخزون في نفس اليوم.- قم بإعداد محلول عمل oligomycin لفحوصات خلايا العدلات وخلايا HL60 للفأر عن طريق خلط 630 ميكرولتر من محلول المخزون مع 1890 ميكرولتر من وسط الفحص للحصول على محلول عمل 25 ميكرومتر.
- قم بإعداد محلول عمل oligomycin لمقايسة العدلات البشرية عن طريق خلط 300 ميكرولتر من محلول المخزون مع 2700 ميكرولتر من وسط الفحص للحصول على محلول عمل 10 ميكرومتر.
ملاحظة: إن ارتباط oligomycin بالوحدة الفرعية لصفيحة Fo ل Fo / F1 ATPase (ATP synthase) يمنع عودة البروتونات إلى الميتوكوندريا ويمنع تخليق ATP32. هذا يقلل بشكل كبير من تدفق الإلكترون عبر سلسلة نقل الإلكترون و OCR. ومع ذلك ، لا يتوقف تدفق الإلكترون تماما بسبب تسرب البروتون عبر غشاء الميتوكوندريا الداخلي33.
- قم بإعداد حل مخزون FCCP عن طريق إعادة تكوين FCCP ب 720 ميكرولتر من وسيط الفحص للحصول على محلول مخزون 100 ميكرومتر.
- قم بإعداد حل عملي لمقايسة العدلات في الفأر عن طريق خلط 300 ميكرولتر من محلول المخزون مع 3700 ميكرولتر من وسط الفحص للحصول على محلول عمل 7.5 ميكرومتر.
- قم بإعداد محلول عملي لمقايسة العدلات البشرية عن طريق خلط 375 ميكرولتر من محلول المخزون مع 2625 ميكرولتر من وسط الفحص للحصول على محلول عمل 12.5 ميكرومتر.
- قم بإعداد حل العمل لمقايسة خلية HL60 عن طريق خلط 720 ميكرولتر من محلول المخزون مع 4080 ميكرولتر من وسط الفحص للحصول على محلول عمل 15 ميكرومتر.
ملاحظة: تكشف إضافة FCCP عن السعة القصوى للميتوكوندريا لاستخدام OXPHOS. وهو حمض ضعيف قابل للذوبان في الدهون ومنفذ للميتوكوندريا يؤدي إلى تبديد إمكانات الغشاء عبر الغشاء. يؤدي تفريغ تدرج البروتون عبر الغشاء الداخلي للميتوكوندريا وتحويل تدفق البروتون من Fo / F1 ATP synthase إلى فصل الميتوكوندريا. يزيد تأثير الفصل هذا فجأة من استهلاك الأكسجين في الميتوكوندريا للحفاظ على تدرج البروتون34.
- تحضير محلول مخزون الروتينون / مضاد الميسين A عن طريق إعادة تكوين خليط الروتينون / مضاد الميسين A مع 540 ميكرولتر من وسط الفحص للحصول على محلول مخزون 50 ميكرومتر.
- تحضير روتينون / أنتيمايسين حل عملي لجميع المقايسات عن طريق خلط 540 ميكرولتر من محلول المخزون مع 2160 ميكرولتر من وسط الفحص للحصول على محلول عمل 10 ميكرومتر.
ملاحظة: يمنع روتينون المركب الأول عن طريق تثبيط نقل الإلكترون من مراكز الحديد والكبريت في المجمع الأول إلى يوبيكوينون ، بينما يمنع مضاد الميسين A المركب الثالث من سلسلة نقل الإلكترون ، مما يؤدي إلى حصار OXPHOS مع توليف محدود من ATP35. وبالتالي ، يكشف هذا عن التنفس غير الميتوكوندريا36,37.
- تحضير روتينون / أنتيمايسين حل عملي لجميع المقايسات عن طريق خلط 540 ميكرولتر من محلول المخزون مع 2160 ميكرولتر من وسط الفحص للحصول على محلول عمل 10 ميكرومتر.
- قم بإعداد محلول مخزون oligomycin عن طريق إعادة تكوين oligomycin مع 630 ميكرولتر من وسط الفحص للحصول على محلول مخزون 100 ميكرومتر.
- تحميل الخرطوشة مع الكواشف ؛ تحميل خليط oligomycin و FCCP و rotenone / antimycin A في منافذ A و B و C ، على التوالي ، في خرطوشة الحقن (الشكل 2). استخدم ملحق القالب المتوفر مع الخرطوشة لتسهيل تحميل الكواشف إلى المنافذ. املأ المنافذ غير المستخدمة ب 20 ميكرولتر من وسيط الفحص.
- بالنسبة لفحص العدلات في الفأر ، قم بتحميل 20 ميكرولتر من oligomycin (25 ميكرومتر ؛ يحتوي كل بئر من لوحة 96 بئرا على 180 ميكرولتر من وسط الفحص في البداية ، وبالتالي فإن التركيز النهائي هو 2.5 ميكرومتر) في المنافذ A. قم بتحميل 17.6 ميكرولتر من FCCP (7.5 ميكرومتر ؛ التركيز النهائي: ~ 0.61 ميكرومتر) في المنافذ B. قم بتحميل 24 ميكرولتر من خليط الروتينون / أنتيميسين A (10 ميكرومتر ؛ التركيز النهائي: ~ 1 ميكرومتر) في منافذ C.
- بالنسبة لمقايسة العدلات البشرية ، قم بتحميل 20 ميكرولتر من oligomycin (10 μM ؛ يحتوي كل بئر من لوحة 96 بئرا على 180 ميكرولتر من وسط الفحص في البداية ، وبالتالي فإن التركيز النهائي هو 1 ميكرومتر) في المنافذ A. قم بتحميل 22 ميكرولتر من FCCP (12.5 ميكرومتر ؛ التركيز النهائي: ~ 1.25 ميكرومتر) في المنافذ B. قم بتحميل 24 ميكرولتر من خليط الروتينون / أنتيميسين A (10 ميكرومتر ؛ التركيز النهائي: ~ 1 ميكرومتر) في منافذ C.
- بالنسبة لفحص الخلية HL60 و dHL60 ، قم بتحميل 20 ميكرولتر من oligomycin (25 μM ؛ يحتوي كل بئر من لوحة 96 بئرا على 180 ميكرولتر من وسط الفحص في البداية ، وبالتالي فإن التركيز النهائي هو 2.5 ميكرومتر) في المنافذ A. قم بتحميل 22 ميكرولتر من FCCP (15 ميكرومتر ؛ التركيز النهائي: ~ 1.5 ميكرومتر) في المنافذ B. قم بتحميل 24 ميكرولتر من خليط الروتينون / أنتيميسين A (10 ميكرومتر ؛ التركيز النهائي: ~ 1 ميكرومتر) في منافذ C.
ملاحظة: ماصة محلول الدواء في المنفذ دون لمس الجزء السفلي من المنفذ. لا تنقر على اللوحة بعد التحميل لتجنب التسرب ، حيث يتم الاحتفاظ بالسوائل بواسطة القوى الشعرية. يتم تحميل الآبار الخلفية للوحة الاستزراع والمنافذ الموجودة على خرطوشة المستشعر بوسط فحص أو بنفس منفذ تحميل الكواشف كما هو الحال في آبار العينة لتطبيع تأثير الكواشف على قيم الخلفية. يجب إضافة الكواشف إلى المنافذ المعنية دون رفع الخرطوشة من لوحة المرافق المحتوية على المعايرة لتجنب أي مصيدة هواء. املأ الميناء الأخير لجميع الآبار بالوسط كما هو موضح في الشكل 2.

الشكل 2: خرطوشة مقايسة إجهاد الميتوكوندريا ومنافذ حقنها. تظهر الصورة خرطوشة مقايسة إجهاد الميتوكوندريا وصورة مكبرة توضح تحميل الأدوية / الوسط الفردي إلى المنافذ. اختصار: FCCP = كربونيل سيانيد p-ثلاثي فلورو روميثوكسي فينيل هيدرازون. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تشغيل مقايسة إجهاد الميتوكوندريا
- قم بتشغيل محلل التمثيل الغذائي والكمبيوتر ، وافتح برنامج Wave ، وانقر فوق Heater On لإعداد الجهاز عند 37 درجة مئوية قبل 5 ساعات على الأقل. بعد الوصول إلى درجة الحرارة ، تظهر الزاوية السفلية اليسرى من برنامج الموجة جاهزة.
- افتح قالبا لمجموعة مقايسة إجهاد الميتوكوندريا في البرنامج. انقر فوق تعريف المجموعة في شريط القائمة العلوي.
- قم بإعداد كل تعريف مسبقا بشكل منفصل على الجانب الأيسر ، مثل استراتيجيات الحقن ، والمعالجة المسبقة ، ووسائط الفحص ، وأنواع الخلايا (المواد الحيوية المستخدمة).
- انقر فوق استراتيجيات الحقن على الجانب الأيسر ، ثم انقر فوق إضافة وقم بتسمية حالة الحقن باسم العدلات البشرية / العدلات الفأرية / HL60. حدد المنفذ A-D بالنقر فوق كل وانقر فوق إضافة مركب وأدخل Oligomycin / FCCP / Rotenone Antimycin A مع التركيزات ذات الصلة (الجدول 1).
- انقر فوق المعالجة المسبقة على الجانب الأيسر ، ثم انقر فوق إضافة وقم بتسميتها باسم CD18 و Cell Tak بشكل منفصل. انقر فوق المادة الحيوية المستخدمة على الجانب الأيسر ، ثم انقر فوق إضافة وقم بتسميتها باسم العدلات البشرية ، وعدلات الماوس ، و HL60 / dHL60 بكثافة البذر.
- حدد المجموعات بالنقر فوق إضافة مجموعة (على سبيل المثال ، لمقايسة العدلات البشرية) وبالنقر فوق التعريف الأساسي لها (على سبيل المثال ، استراتيجيات الحقن وفقا للجدول 1 - العدلات البشرية ، والمعالجة المسبقة ك CD18 ، ونوع الخلية كعدلات بشرية).
- انقر فوق خريطة اللوحة في القائمة العلوية لمراقبة جميع المجموعات ، مع تعريفات على الجانب الأيسر وخريطة اللوحة على اليمين. قم بالسحب والإفلات لإضافة كل بئر إلى المجموعة مع الحفاظ على آبار الزوايا الأربعة كخلفية (افتراضي).
- قم بإعداد البروتوكول بالنقر فوق البروتوكول في القائمة العلوية وحدد ثلاث دورات من خليط خط الأساس ، oligomycin ، FCCP ، rotenone ، و antimycin A عن طريق ضبط وقت الخلط على 3 دقائق ، والراحة على أنها 0 دقيقة ، والقياس على أنه 7 دقائق.
- انتقل إلى صفحة تشغيل الفحص ، وقدم معلومات ملخص المشروع للرجوع إليها ، وانقر فوق بدء التشغيل.
- أعط الموقع لحفظ الملفات ، بحيث يتم حفظ جميع النتائج بعد الانتهاء من الفحص.
- بعد التحميل التلقائي للفحص، انتظر حتى يفتح الدرج لوضع خرطوشة المستشعر واللوحة مع 200 ميكرولتر من المعايرة (الخطوة 1.1). اضبط اتجاه الرمز الشريطي للخرطوشة متجها إلى اليمين. قم بتشغيل المعايرة بالنقر فوق أنا جاهز ، والذي يستغرق حوالي 20 دقيقة.
- بعد المعايرة ، انقر فوق فتح درج. استبدل اللوحة باللوحة المصنفة بالخلية وانقر فوق تحميل لوحة الخلية لمتابعة الفحص.
- بعد الانتهاء من الفحص ، يتم حفظ البيانات تلقائيا. انقر فوق عرض النتائج وقم بتصديرها كجدول بيانات أو ملف برنامج تحليل آخر.
- رسم بياني وتحليل البيانات (الشكل 3 والشكل 4).
- احسب معلمات التنفس ، بما في ذلك التنفس القاعدي للميتوكوندريا ، والتنفس المرتبط بتسرب البروتون ، والتنفس المرتبط ب ATP ، والتنفس الأقصى ، والقدرة التنفسية الاحتياطية ، والتنفس غير الميتوكوندريا (الشكل 4 أ)38،39،40،41.
- احسب التنفس القاعدي للميتوكوندريا عن طريق طرح قيمة OCR المقاسة بعد إضافة خليط روتينون / مضاد الميسين A من OCR قبل حقن oligomycin (الشكل 4A ، أ).
- احسب التنفس المرتبط بتسرب البروتون عن طريق طرح قيمة التعرف الضوئي على الحروف بعد حقن خليط الروتينون / أنتيمايسين أ من قيمة التعرف الضوئي على الحروف المقاسة بعد حقن أوليغومايسين (الشكل 4 أ ، ب).
- تقدير التنفس المرتبط بالأدينوسين الثلاثي الفوسفات (ATP) عن طريق حساب الفرق بين التنفس القاعدي للميتوكوندريا والتنفس المرتبط بتسرب البروتونات. اطرح أول قيمة OCR تم قياسها بعد حقن oligomycin من قيمة OCR الأولى قبل حقن oligomycin (الشكل 4A ، c).
- التنفس الأقصى هو أقصى معدل تنفس يمكن أن تحققه الخلية بعد إضافة FCCP. احسب ذلك عن طريق طرح قيمة التعرف الضوئي على الحروف بعد حقن خليط الروتينون / أنتيميسين أ من قيمة التعرف الضوئي على الحروف المقاسة بعد حقن FCCP (الشكل 4 أ ، د).
- تشير سعة الجهاز التنفسي الاحتياطية إلى قدرة الخلية على تلبية الطلب المتزايد على الطاقة من خلال OXPHOS. احسب ذلك بإيجاد الفرق بين التنفس الأقصى والتنفس القاعدي للميتوكوندريا (الشكل 4 أ ، ه).
- التنفس غير الميتوكوندريا هو كمية الأكسجين التي تستهلكها المصادر غير الميتوكوندريا. قم بقياس ذلك بعد إضافة خليط الروتينون / أنتيميسين أ (الشكل 4 أ ، و).
- قم بإجراء التحليل الإحصائي باستخدام اختبار t الخاص بالطالب لمقارنة معلمات التنفس المختلفة لخلايا HL60 غير المتمايزة والمتمايزة. ضع في اعتبارك أن p < 0.05 ذات دلالة إحصائية.
ملاحظة: تعتبر النسخ المتماثلة ذات قيم OCR أو ECAR أقل من الصفر خطأ في تحضير العينة أو الحقن المركب أو القياس. يتم استبعادهم من التحليل المستقبلي.
النتائج
تظهر ديناميكيات OCR التمثيلية التي تشير إلى تغيرات تنفس الميتوكوندريا استجابة لقليل الميسوميسين ، FCCP ، ومزيج روتينون / مضاد الميسين A من عدلات الفئران (الشكل 3 أ) ، والعدلات البشرية (الشكل 3 ب) ، وخلايا HL60 غير المتمايزة والمتمايزة (الشكل 3C). في ج?...
Discussion
الإجراء القياسي الذي يقيس تنفس الميتوكوندريا للعدلات باستخدام محلل التدفق الأيضي خارج الخلية محدود بالعديد من العوامل ، بما في ذلك عدد الخلايا ونمو الخلايا وقابليتها للحياة. يختلف كل تركيز مركب بين نوع ومصدر الخلايا في هذا الفحص. يستخدم Oligomycin و rotenone / antimycin A في الغالب بتركيز مماثل بين معظ...
Disclosures
يعلن أصحاب البلاغ عدم وجود مصلحة مالية متنافسة.
Acknowledgements
نحن نقدر الدكتور أنتوني تي فيلا والدكتورة فيديريكا أغليانوين من قسم علم المناعة في UConn Health لتدريبهما على استخدام محلل التدفق الأيضي خارج الخلية ، والدكتورة لين بودينجتون في قسم علم المناعة في UConn Health لدعمها للأدوات. نعترف بالدكتورة جنيف هارجيس من كلية الطب بجامعة كاليفورنيا في كاليفورنيا لمساعدتها في الكتابة العلمية وتحرير هذه المخطوطة. تم دعم هذا البحث بمنح من المعاهد الوطنية للصحة ، والمعهد الوطني للقلب والرئة والدم (R01HL145454) ، والمعهد الوطني للعلوم الطبية العامة (R35GM147713 و P20GM139763) ، وصندوق بدء التشغيل من UConn Health ، وزمالة إعادة الدخول الوظيفي من الجمعية الأمريكية لعلماء المناعة.
Materials
| Name | Company | Catalog Number | Comments |
| 37 °C non-CO2 incubator | Precision | Economy Model 2EG | Instrument |
| Biorender | Software Application | ||
| Centrifuge | Eppendorf | Model 5810R | Instrument |
| Corning Cell-Tak Cell and Tissue Adhesive | Corning | 102416-100 | Reagent |
| EasySep Magnet | STEMCELL | 18000 | Magnet |
| EasySepMouse Neutrophil Enrichment kit | STEMCELL | 19762A | Reagents |
| Graphpad Prism 9 | Software Application | ||
| Human Serum Albumin Solution (25%) | GeminiBio | 800-120 | Reagents |
| Ketamine (VetaKet) | DAILYMED | NDC 59399-114-10 | Anesthetic |
| PBS | Cytiva | SH30256.01 | Reagents |
| Plate buckets | Eppendorf | UL155 | Accessory |
| PolymorphPrep | PROGEN | 1895 (previous 1114683) | polysaccharide solution |
| Purified mouse anti-human CD18 antibody | Biolegend | 302102 | Clone TS1/18 |
| RPMI 1640 Medium | Gibco | 11-875-093 | Reagents |
| Seahorse metabolic extracellular flux analyzer | Agilent | XFe96 | Instrument |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | mitochondrial stress test Kit |
| Swing-bucket rotor | Eppendorf | A-4-62 | Rotor |
| Vactrap 2 Vacum Trap | Fox Lifesciences | 3052101-FLS | Instrument |
| Wave | Software Application | ||
| XF 1.0 M Glucose Solution | Agilent | 103577-100 | Reagent |
| XF 100 mM Pyruvate Solution | Agilent | 103578-100 | Reagent |
| XF 200 mM Glutamine Solution | Agilent | 103579-100 | Reagent |
| XF DMEM medium | Agilent | 103575-100 | Reagent |
| XFe96 FluxPak | Agilent | 102601-100 | Material |
| Xylazine (AnaSed Injection) | DAILYMED | NDC 59399-110-20 | Anesthetic |
References
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Noguchi, M., Kasahara, A. Mitochondrial dynamics coordinate cell differentiation. Biochemical and Biophysical Research Communications. 500 (1), 59-64 (2018).
- Zhu, L., et al. Correlation between mitochondrial dysfunction, cardiovascular diseases, and traditional Chinese medicine. Evidence-Based Complementary and Alternative Medicine. 2020, e2902136 (2020).
- Kaarniranta, K., et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Progress in Retinal and Eye Research. 79, 100858 (2020).
- Onyango, I. G., Khan, S. M., Bennett, J. P. Mitochondria in the pathophysiology of Alzheimer's and Parkinson's diseases. Frontiers in Bioscience. 22 (5), 854-872 (2017).
- Loiseau, D., et al. Mitochondrial coupling defect in Charcot-Marie-Tooth type 2A disease. Annals of Neurology. 61 (4), 315-323 (2007).
- Zucker-Franklin, D. Electron microscopic studies of human granulocytes: structural variations related to function. Seminars in Hematology. 5 (2), 109-133 (1968).
- Karnovsky, M. L. The metabolism of leukocytes. Seminars in Hematology. 5 (2), 156-165 (1968).
- Bao, Y., et al. mTOR and differential activation of mitochondria orchestrate neutrophil chemotaxis. The Journal of Cell Biology. 210 (7), 1153-1164 (2015).
- Fossati, G., et al. The mitochondrial network of human neutrophils: role in chemotaxis, phagocytosis, respiratory burst activation, and commitment to apoptosis. Journal of Immunology. 170 (4), 1964-1972 (2003).
- Pryde, J. G., Walker, A., Rossi, A. G., Hannah, S., Haslett, C. Temperature-dependent arrest of neutrophil apoptosis. Failure of Bax insertion into mitochondria at 15 degrees C prevents the release of cytochrome c. The Journal of Biological Chemistry. 275 (43), 33574-33584 (2000).
- Maianski, N. A., Mul, F. P. J., van Buul, J. D., Roos, D., Kuijpers, T. W. Granulocyte colony-stimulating factor inhibits the mitochondria-dependent activation of caspase-3 in neutrophils. Blood. 99 (2), 672-679 (2002).
- Bao, Y., et al. Mitochondria regulate neutrophil activation by generating ATP for autocrine purinergic signaling. The Journal of Biological Chemistry. 289 (39), 26794-26803 (2014).
- Chouchani, E. T., et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS. Nature. 515 (7527), 431-435 (2014).
- Hayashi, G., Cortopassi, G. Oxidative stress in inherited mitochondrial diseases. Free Radical Biology and Medicine. 88, 10-17 (2015).
- Mailloux, R. J. An update on mitochondrial reactive oxygen species production. Antioxidants. 9 (6), 472 (2020).
- Abuaita, B. H., et al. The IRE1α stress signaling axis is a key regulator of neutrophil antimicrobial effector function. Journal of Immunology. 207 (1), 210-220 (2021).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nature Medicine. 22 (2), 146-153 (2016).
- Douda, D. N., Khan, M. A., Grasemann, H., Palaniyar, N. SK3 channel and mitochondrial ROS mediate NADPH oxidase-independent NETosis induced by calcium influx. Proceedings of the National Academy of Sciencesa. 112 (9), 2817-2822 (2015).
- Monteith, A. J., et al. Altered mitochondrial homeostasis during systemic lupus erythematosus impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Journal of Immunology. 208 (2), 454-463 (2022).
- Monteith, A. J., Miller, J. M., Beavers, W. N., Juttukonda, L. J., Skaar, E. P. Increased dietary manganese impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Infection and Immunity. 90 (3), 0068521 (2022).
- Monteith, A. J., et al. Mitochondrial calcium uniporter affects neutrophil bactericidal activity during Staphylococcus aureus infection. Infection and Immunity. 90 (2), 0055121 (2022).
- Cao, Z., et al. Roles of mitochondria in neutrophils. Frontiers in Immunology. 13, 934444 (2022).
- Papayannopoulos, V., Metzler, K. D., Hakkim, A., Zychlinsky, A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. The Journal of Cell Biology. 191 (3), 677-691 (2010).
- Fan, Z., Ley, K. Developing neutrophils must eat…themselves. Immunity. 47 (3), 393-395 (2017).
- Riffelmacher, T., et al. Autophagy-dependent generation of free fatty acids is critical for normal neutrophil differentiation. Immunity. 47 (3), 466-480 (2017).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), e53936 (2016).
- Swamydas, M., Isolation Lionakis, M. S. purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments. (77), e50586 (2013).
- Gerner, M. C., et al. Packed red blood cells inhibit T-cell activation via ROS-dependent signaling pathways. The Journal of Biological Chemistry. 296, 100487 (2021).
- Zhang, Z. -. W., et al. Red blood cell extrudes nucleus and mitochondria against oxidative stress. IUBMB Life. 63 (7), 560-565 (2011).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111, 1-16 (2015).
- Hearne, A., Chen, H., Monarchino, A., Wiseman, J. S. Oligomycin-induced proton uncoupling. Toxicology In Vitro. 67, 104907 (2020).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-Protocol. 8 (10), e2850 (2018).
- Nath, S. The molecular mechanism of ATP synthesis by F1F0-ATP synthase: a scrutiny of the major possibilities. Advances in Biochemical Engineering/Biotechnology. 74, 65-98 (2002).
- Heinz, S., et al. Mechanistic investigations of the mitochondrial complex I inhibitor rotenone in the context of pharmacological and safety evaluation. Scientific Reports. 7 (1), 45465 (2017).
- Hytti, M., et al. Antimycin A-induced mitochondrial damage causes human RPE cell death despite activation of autophagy. Oxidative Medicine and Cellular Longevity. 2019, 1583656 (2019).
- Malecki, M., Kamrad, S., Ralser, M., Bähler, J. Mitochondrial respiration is required to provide amino acids during fermentative proliferation of fission yeast. EMBO Reports. 21 (11), e50845 (2020).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. The FASEB Journal. 34 (10), 13106-13124 (2020).
- Nicholas, D., et al. Advances in the quantification of mitochondrial function in primary human immune cells through extracellular flux analysis. PLoS One. 12 (2), e0170975 (2017).
- Tur, J., et al. Mitofusin 2 in macrophages links mitochondrial ROS production, cytokine release, phagocytosis, autophagy, and bactericidal activity. Cell Reports. 32 (8), 108079 (2020).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Wettmarshausen, J., Perocchi, F. Assessing calcium-stimulated mitochondrial bioenergetics using the seahorse XF96 analyzer. Methods in Molecular Biology. 1925, 197-222 (2019).
- Forkink, M., et al. Mitochondrial hyperpolarization during chronic complex I inhibition is sustained by low activity of complex II, III, IV and V. Biochimica et Biophysica Acta. 1837 (8), 1247-1256 (2014).
- . Methods for Reducing Cell Growth Edge Effects in Agilent Seahorse XF Cell Culture Microplates Available from: https://www.agilent.com/cs/library/usermanuals/public/user-manual-methods-for-reducing-cell-growth-edge-effect-cell-analysis-5994-0240en-agilent.pdf (2019)
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. Journal of Visualized Experiments. (54), e2899 (2011).
- Normalisation of Seahorse XFe96 metabolic assaysto cell number with Hoechst stain using well-scan mode on the CLARIOstar Plus. BMG Labtech Available from: https://www.bmglabtech.com/cn/normalisation-of-seahorse-xfe96-metabolic-assays-to-cell-number-with-hoechst-stain/ (2020)
- Yetkin-Arik, B., et al. The role of glycolysis and mitochondrial respiration in the formation and functioning of endothelial tip cells during angiogenesis. Scientific Reports. 9 (1), 12608 (2019).
- Jastroch, M., Divakaruni, A. S., Mookerjee, S., Treberg, J. R., Brand, M. D. Mitochondrial proton and electron leaks. Essays in Biochemistry. 47, 53-67 (2010).
- Jandl, R. C., et al. Termination of the respiratory burst in human neutrophils. The Journal of Clinical Investigation. 61 (5), 1176-1185 (1978).
- Azevedo, E. P., et al. A metabolic shift toward pentose phosphate pathway is necessary for amyloid fibril- and phorbol 12-myristate 13-acetate-induced neutrophil extracellular trap (NET) formation. The Journal of Biological Chemistry. 290 (36), 22174-22183 (2015).
- Six, E., et al. AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages. Cell Death & Disease. 6 (8), e1856 (2015).
- Kumar, S., Dikshit, M. Metabolic insight of neutrophils in health and disease. Frontiers in Immunology. 10, 2099 (2019).
- Rodríguez-Espinosa, O., Rojas-Espinosa, O., Moreno-Altamirano, M. M. B., López-Villegas, E. O., Sánchez-García, F. J. Metabolic requirements for neutrophil extracellular traps formation. Immunology. 145 (2), 213-224 (2015).
- Invernizzi, F., et al. Microscale oxygraphy reveals OXPHOS impairment in MRC mutant cells. Mitochondrion. 12 (2), 328-335 (2012).
- Zenaro, E., et al. Neutrophils promote Alzheimer's disease-like pathology and cognitive decline via LFA-1 integrin. Nature Medicine. 21 (8), 880-886 (2015).
- Maianski, N. A., et al. Functional characterization of mitochondria in neutrophils: a role restricted to apoptosis. Cell Death and Differentiation. 11 (2), 143-153 (2004).
- Bergman, O., Ben-Shachar, D. Mitochondrial oxidative phosphorylation system (OXPHOS) deficits in schizophrenia. Canadian Journal of Psychiatry. 61 (8), 457-469 (2016).
- Zhou, W., Qu, J., Xie, S., Sun, Y., Yao, H. Mitochondrial dysfunction in chronic respiratory diseases: implications for the pathogenesis and potential therapeutics. Oxidative Medicine and Cellular Longevity. 2021, 5188306 (2021).
- Hirano, M., Emmanuele, V., Quinzii, C. M. Emerging therapies for mitochondrial diseases. Essays in Biochemistry. 62 (3), 467-481 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved