Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Echtzeitmessung des mitochondrialen bioenergetischen Profils von Neutrophilen
In diesem Artikel
Zusammenfassung
Wir beschreiben schrittweise Protokolle zur Messung der mitochondrialen Atmung von Maus und humanen Neutrophilen und HL60-Zellen mit dem metabolischen extrazellulären Flussanalysator.
Zusammenfassung
Neutrophile Granulozyten sind die erste Verteidigungslinie und die am häufigsten vorkommenden Leukozyten beim Menschen. Diese Effektorzellen führen Funktionen wie Phagozytose und oxidativen Burst aus und erzeugen extrazelluläre Fallen (NETs) für die mikrobielle Clearance. Neue Erkenntnisse über die Stoffwechselaktivitäten von Neutrophilen stellen die frühe Vorstellung, dass sie in erster Linie auf Glykolyse angewiesen sind, in Frage. Durch die präzise Messung der Stoffwechselaktivitäten können unterschiedliche Stoffwechselanforderungen von Neutrophilen aufgedeckt werden, darunter der Tricarbonsäurezyklus (TCA) (auch Krebszyklus genannt), die oxidative Phosphorylierung (OXPHOS), der Pentosephosphatweg (PPP) und die Fettsäureoxidation (FAO) unter physiologischen Bedingungen und in Krankheitszuständen. In diesem Artikel werden ein Schritt-für-Schritt-Protokoll und die Voraussetzungen für die Messung der Sauerstoffverbrauchsrate (OCR) als Indikator für die mitochondriale Atmung an aus dem Knochenmark der Maus, aus menschlichem Blut gewonnenen Neutrophilen und der neutrophilenähnlichen HL60-Zelllinie unter Verwendung der metabolischen Flussanalyse auf einem metabolischen extrazellulären Flussanalysator beschrieben. Diese Methode kann zur Quantifizierung der mitochondrialen Funktionen von Neutrophilen unter normalen und Krankheitsbedingungen verwendet werden.
Einleitung
Mitochondrien spielen eine wichtige Rolle in der Zellbioenergetik, die durch oxidative Phosphorylierung (OXPHOS) Adenosintriphosphat (ATP) erzeugt. Darüber hinaus erstreckt sich die Rolle der Mitochondrien auf die Erzeugung und Entgiftung reaktiver Sauerstoffspezies, die Kalziumregulierung der zytoplasmatischen und mitochondrialen Matrix, die Zellsynthese, den Katabolismus und den Transport von Metaboliten innerhalb der Zelle1. Die mitochondriale Atmung ist in allen Zellen unerlässlich, da ihre Funktionsstörung zu Stoffwechselproblemen 2 führen kann, einschließlich Herz-Kreislauf-Erkrankungen3 und einer Vielzahl neurodegenerativer Erkrankungen wie altersbedingter Makuladegeneration4, Parkinson und Alzheimer5 und Charcot-Marie-Tooth-Krankheit2 A (CMT2A)6.
Elektronenmikroskopische Untersuchungen an neutrophilen Granulozyten ergaben, dass es relativ wenige Mitochondrien gibt7, und sie sind für ihre Energieproduktion stark auf die Glykolyse angewiesen, da die mitochondrialen Atmungsraten sehr niedrig sind8. Mitochondrien sind jedoch entscheidend für neutrophile Funktionen, wie z. B. Chemotaxis9 und Apoptose10,11,12. Eine frühere Studie zeigte ein komplexes mitochondriales Netzwerk in menschlichen Neutrophilen mit hohem Membranpotential. Der Verlust des mitochondrialen Membranpotentials ist ein Frühindikator für die Apoptose neutrophiler Granulozyten10. Die Behandlung mit mitochondrialem Entkoppler Carbonylcyanid m-Chlorphenylhydrazon (CCCP) zeigte eine signifikante Hemmung der Chemotaxis, zusammen mit einer Veränderung der mitochondrialen Morphologie 9,10.
Obwohl die primäre Energiequelle für neutrophile Granulozyten die Glykolyse ist, liefern die Mitochondrien das ATP, das die Aktivierung der neutrophilen Granulozyten einleitet, indem es die erste Phase der purinergen Signalübertragung antreibt, die Ca2+-Signalübertragung verstärkt, die mitochondriale ATP-Produktion verstärkt und die funktionellen Reaktionen der neutrophilen Granulozyten auslöst13. Eine Dysfunktion der mitochondrialen Atmungskette führt zu einer übermäßigen Produktion toxischer reaktiver Sauerstoffspezies (ROS) und zu pathogenen Schäden 14,15,16. Die NETose, d. h. der Prozess der Bildung von extrazellulären Fallen (NETs) für neutrophile Granulozyten, ist eine wichtige Eigenschaft von Neutrophilen, die ihnen hilft, Krankheitserreger zu bekämpfen17 und zu vielen pathologischen Zuständen beiträgt, darunter Krebs, Thrombose und Autoimmunerkrankungen18. Mitochondriale ROS tragen zur NETose19 bei, mitochondriale DNA kann ein Bestandteil von NETs18 sein, und eine veränderte mitochondriale Homöostase beeinträchtigt die NETose 20,21,22,23,24. Darüber hinaus wird während der normalen Differenzierung oder Reifung die metabolische Reprogrammierung der neutrophilen Granulozyten durch die Begrenzung der glykolytischen Aktivität umgekehrt, und sie beteiligen sich an der mitochondrialen Atmung und mobilisieren intrazelluläre Lipide25,26.
Der metabolische extrazelluläre Flussanalysator kann die mitochondriale Atmung und Glykolyse lebender Zellen kontinuierlich überwachen und quantifizieren. Der Analysator verwendet eine 96-Well-Sensorkartusche im Plattenformat und zwei Fluorophore, um die Sauerstoffkonzentration (O2) und pH-Änderungen zu quantifizieren. Die Sensorkartusche befindet sich während des Assays über der Zellmonoschicht und bildet eine ~200 nm hohe Mikrokammer. Die Lichtwellenleiterbündel im Analysator werden verwendet, um die Fluorophore anzuregen und die Änderungen der Fluoreszenzintensität zu detektieren. Änderungen derO2-Konzentration und des pH-Werts in Echtzeit werden automatisch berechnet und als Sauerstoffverbrauchsrate (OCR) und extrazelluläre Versauerungsrate (ECAR) angezeigt. Die Sensorkartusche verfügt über vier Anschlüsse, über die während der Assay-Messungen bis zu vier Verbindungen in jede Vertiefung geladen werden können. Dieses Protokoll konzentriert sich auf die Quantifizierung der mitochondrialen Atmung von Maus und menschlichen Neutrophilen sowie der neutrophilenähnlichen HL60-Zellen mit dem metabolischen extrazellulären Flussanalysator.
Protokoll
Heparinisierte Vollblutproben wurden von gesunden menschlichen Spendern nach Einholung der Einverständniserklärung gewonnen, die vom Institutional Review Board von UConn Health in Übereinstimmung mit der Deklaration von Helsinki genehmigt wurde. Alle Tierversuche folgten den Richtlinien des UConn Health Institutional Animal Care and Use Committee (IACUC), und die Genehmigung für die Verwendung von Nagetieren wurde von der UConn Health IACUC gemäß den Kriterien des Leitfadens für die Pflege und Verwendung von Labortieren der National Institutes of Health eingeholt. In dieser Studie wurden männliche C57BL/6-Mäuse im Alter von 6 Wochen verwendet.
1. Vorbereitung der 96-Well-Platte für den metabolischen extrazellulären Flussassay
- Auf der speziell entwickelten 96-Well-Platte für den metabolischen extrazellulären Flussassay befindet sich eine Sensorkartusche. Hydratisieren Sie die Kartusche, indem Sie sie vorsichtig anheben, und geben Sie 200 μl/Well des Kalibriermediums in jede Vertiefung der darunter liegenden Platte. Legen Sie die Kartusche über die Platte mit dem Kaliber in einen alkoholfreien, befeuchteten Inkubator mit 37 °C über Nacht, um sie mit Feuchtigkeit zu versorgen.
- Verwenden Sie je nach Zelltyp eine spezielle Beschichtung für die Kulturplatte, um die Zellhaftung zu gewährleisten. Für humane neutrophile Granulozyten - undifferenzierte und differenzierte HL60-Zellen - wird die 96-Well-Platte über Nacht bei 4 °C mit steriler phosphatgepufferter Kochsalzlösung (PBS) beschichtet, die 50 μl gereinigten 5 μg/ml gereinigten Maus-Anti-Human-CD18-Antikörper (Klon TS1/18) enthält. Bei neutrophilen Granulozyten der Maus wird die 96-Well-Platte 20 min lang mit 25 μl 22,4 μg/ml Cell Tak bei pH 8,0 in 0,1 M NaHCO3 bei Raumtemperatur (RT) beschichtet.
- Waschen Sie die Platten zweimal mit 200 μl sterilem PBS.
- Geben Sie das komplette Medium in die Eckvertiefungen (A1, A12, H1 und H12) der Zellkulturplatte (ohne Zellen) zur Hintergrundkorrektur in den Zellkulturplatten während der Aussaat.
Anmerkungen: Die Verdunstung während der Beschichtung und Kalibrierung kann das Volumen des Kalibriermediums und die Normalisierung beeinträchtigen. Verwenden Sie ein Tablett oder eine Kammer mit sterilem, wasserbenetztem Gewebe und platzieren Sie die Platte mit dem Kaliber darüber, um eine Verdunstung zu verhindern.
2. Vorbereitung und Aussaat von Zellen
- Herstellung des Assay-Mediums
- Bereiten Sie das Untersuchungsmedium vor, indem Sie 1 mM Pyruvat, 10 mM Glukose und 2 mM Glutamin zu Dulbeccos modifiziertem Eagle-Medium (DMEM) hinzufügen.
- Isolierung von neutrophilen Granulozyten der Maus aus dem Knochenmark
- Isolieren Sie neutrophile Granulozyten von Mäusen aus dem Knochenmark mit dem Mouse Neutrophil Enrichment Kit gemäß den Anweisungen des Herstellers.
- Betäuben Sie die Mäuse durch intraperitoneale (i.p.) Injektion von Ketamin (125 mg/kg) und Xylazin (12,5 mg/kg) und euthanasieren Sie die Mäuse dann durch Zervixluxation.
- Ernten Sie die Oberschenkelknochen und Schienbeine, wie zuvor beschrieben27. Schneiden Sie kurz die Haut ab, um das Bein mit den Muskeln freizulegen. Schneiden Sie das Hüftgelenk ab, um das Bein vom Körper zu entfernen. Entfernen Sie dann die Muskeln, um den Oberschenkelknochen und das Schienbein zu sammeln.
- Schneiden Sie die kleineren Enden der Oberschenkelknochen und Schienbeine ab. Halten Sie die abgeschnittenen Enden nach unten, legen Sie sie in ein 0,5-ml-Zentrifugenröhrchen mit zwei 25-g-Spritzennadellöchern im Boden und setzen Sie das 0,5-ml-Röhrchen in ein 1,5-ml-Zentrifugenröhrchen ein (Abbildung 1A). Geben Sie 50 μl PBS in das 0,5-ml-Röhrchen, um das Austrocknen der Knochenmarkzellen zu verhindern.
- Zentrifugieren Sie 15 s lang bei 5.900 × g RT, um das Knochenmark am Boden des 1,5-ml-Röhrchens zu entnehmen. Resuspendieren Sie die Knochenmarkzellen mit 1 ml DMEM. Fügen Sie 50 μl Rattenserum aus dem Kit hinzu, mischen Sie es vorsichtig durch Pipettieren und übertragen Sie die Zellsuspension in ein 5-ml-Polystyrolkultur-Reagenzglas.
- 50 μl Anreicherungscocktail aus dem Maus-Neutrophilen-Anreicherungskit zugeben und 15 min bei RT inkubieren. 5 min bei 300 × g bei RT zentrifugieren.
- Resuspendieren Sie die Zellen mit 1 ml DMEM, fügen Sie 50 μl Biotin-Selektionscocktail aus dem Kit hinzu, mischen Sie sie vorsichtig durch Pipettieren und inkubieren Sie sie 15 Minuten lang bei RT.
- Fügen Sie 150 μl wirbelnde Magnetpartikel aus dem Kit hinzu, mischen Sie sie vorsichtig durch Pipettieren und inkubieren Sie sie 10 Minuten lang bei RT.
- Fügen Sie ~1,3 ml DMEM hinzu, mischen Sie vorsichtig durch Pipettieren, legen Sie das Röhrchen für 3 Minuten in den Magneten und übertragen Sie den Überstand mit gereinigten Mausneutrophilen in ein neues 5-ml-Polystyrolkultur-Reagenzglas, indem Sie das ursprüngliche Röhrchen zusammen mit dem Magneten umdrehen.
- Bei 300 × g bei RT 5 min zentrifugieren. Nachdem der Überstand durch Vakuumaspiration entfernt wurde, resuspendieren Sie die Zellen mit 1 ml Assaymedium.
- Zählen Sie die Zellen manuell mit einem Hämozytometer.
- Stellen Sie die Zelldichte auf 1,1 × 106 Zellen/ml ein, indem Sie Assay-Medium hinzufügen, 180 μl der neutrophilen Maussuspension (2 × 105 Zellen) pro Vertiefung in die vorbereitete 96-Well-Platte einpflanzen (Schritte 1.2-1.4), und die Platte bei 300 × g bei RT 3 Minuten lang ohne Bremse zentrifugieren, um eine ordnungsgemäße Haftung der Zellen auf dem Boden der Platte zu gewährleisten.
- Inkubieren Sie die Platte 1 Stunde lang in einem befeuchteten Inkubator ohne CO2 -Gehalt bei 37 °C, um die Zellen mit dem Assaymedium auszugleichen.
HINWEIS: Die Reinheit der neutrophilen Granulozyten ist für den Assay von entscheidender Bedeutung, da es sich um eine potenzielle Verzerrung handelt. Die Reinheit der Isolierung der neutrophilen Granulozyten der Maus beträgt 69,9%-88,7% nach diesem Protokoll. Es gibt andere Methoden zur Isolierung von neutrophilen Granulozyten aus dem Knochenmark von Mäusen, wie z. B. die Dichtegradientenzentrifugation28. Es gibt auch alternative Neutrophilen-Isolationskits von anderen Anbietern, die auf der negativen magnetischen Selektion unter Verwendung der monoklonalen Antikörper gegen Antigene basieren, die nicht auf Neutrophilen exprimiert werden.
- Isolierung menschlicher Neutrophiler aus peripherem Blut
- Geben Sie 8 ml Polysaccharidlösung in ein 15-ml-Zentrifugenröhrchen und schichten Sie dann 4 ml peripheres Blut über die Polysaccharidlösung, ohne sie zu mischen.
- Zentrifugieren bei 550 × g bei 20 °C für 30 min. Lassen Sie den Rotor bei 1 abbremsen.
HINWEIS: Die Trennzeit der neutrophilen Granulozyten kann je nach Spender variieren. Sie beträgt mindestens 30 Minuten, und weitere 10-20 Minuten können erforderlich sein, wenn die Neutrophilentrennung nicht erfolgreich ist. - Beobachten Sie die Trennung von Plasma/Thrombozyten und mononukleären Zellen nach der Zentrifugation, wie in Abbildung 1B dargestellt. Entfernen Sie vorsichtig mit einer 1-ml-Pipette die obere gelbe Flüssigkeit (Plasma und Blutplättchen) und die obere trübe Bande (mononukleäre Zellen), ohne die untere trübe Bande (Neutrophile) zu stören.
- Sammeln Sie das untere trübe Band und ~3-4 ml der klaren Flüssigkeit darunter in ein neues 15-ml-Zentrifugenröhrchen, das 10 ml PBS enthält.
- Bei 400 × g bei 20 °C 10 min zentrifugieren und den Überstand durch Vakuumabsaugung entfernen.
- Resuspendieren Sie die Zellen mit 5 ml PBS und zentrifugieren Sie sie bei 300 × g bei 20 °C für 5 min.
- Nachdem Sie den Überstand entfernt haben, resuspendieren Sie die Zellen mit 1 ml Assay-Medium.
- Zählen Sie die Zellen manuell mit einem Hämozytometer.
HINWEIS: Da Erythrozyten im Blut keine Mitochondrien besitzen, hat die Kontamination der Erythrozyten keinen Einfluss auf den mitochondrialen Stresstest-Assay und verhindert die Aktivierung/das Priming neutrophiler Granulozyten29,30. Erythrozyten müssen während der Zellzählung lysiert werden, um eine genaue Neutrophilenkonzentration zu erhalten. Fügen Sie 10 μl der Zellsuspension für 10-30 s zu 891 μl deionisiertem Wasser hinzu, um die Erythrozyten zu lysieren, und fügen Sie dann 99 μl 10x PBS hinzu, um den osmotischen Druck auszugleichen und die Lyse der neutrophilen Granulozyten zu vermeiden. - Stellen Sie die Zelldichte auf 2,2 × 106 Zellen/ml ein, indem Sie Assay-Medium hinzufügen, 180 μl humane Neutrophile (~4 × 105) pro Well in die vorbereitete 96-Well-Platte einpflanzen und die Platte bei 300 × g bei RT 3 Minuten lang ohne Bremse zentrifugieren, um eine ordnungsgemäße Haftung der Zellen auf dem Boden der Platte zu gewährleisten.
- Inkubieren Sie die Platte 1 Stunde lang in einem befeuchteten Inkubator ohne CO2 -Gehalt bei 37 °C, um die Zellen mit dem Assaymedium zu prääquatieren.
HINWEIS: Die Reinheit der neutrophilen Granulozyten ist für den Assay von entscheidender Bedeutung, da es sich um eine potenzielle Verzerrung handelt. Die Reinheit der Isolierung humaner neutrophiler Granulozyten beträgt 86,6 % bis 96,8 %. Es gibt andere Dichtegradientenzentrifugationsmethoden zur Isolierung von Neutrophilen aus menschlichem Blut, einschließlich der Percoll-Isolierung sowie einer Kombination aus Ficoll-Isolierung und Dextransedimentation31.
- HL60-Zellkultur und Neutrophilen-gerichtete Differenzierung
- HL60-Zellen in einem Medium des Roswell Park Memorial Institute (RPMI)-1640 mit 10 % fötalem Kälberserum (FBS), 100 μg/ml Penicillin, 100 μg/ml Streptomycin und 250 ng/ml Amphotericin B bei 37 °C und 5 % CO2 erhalten.
- Für eine auf Neutrophile gerichtete Differenzierung werden die HL60-Zellen (suspendierte Zellen) in einem T25-Kolben mit einer Dichte von 1 × 10 5 Zellen/ml in einem RPMI-1640-Medium mit 10 % FBS, 100 μg/ml Penicillin, 100 μg/ml Streptomycin, 250 ng/ml Amphotericin B und 1,3 % Dimethylsulfoxid (DMSO) bei 37 °C und5 % CO2 für 6 Tage aufbewahrt.
- Zählen Sie am Tag des Assays die Zellen manuell mit dem Hämozytometer, zentrifugieren Sie differenzierte oder undifferenzierte HL60-Zellen bei 300 × g bei RT für 5 min, waschen Sie sie einmal mit DMEM und resuspendieren Sie die Zellen mit dem Assaymedium, um eine Zelldichte von 1,39 × 106 Zellen/ml zu erhalten.
- Säen Sie 180 μl differenzierte oder undifferenzierte HL60-Zellen (~2,5 ×10 5) pro Well in die vorbereitete 96-Well-Platte und zentrifugieren Sie die Platte bei 300 × g bei RT für 3 min ohne Bremse, um eine ordnungsgemäße Haftung der Zellen auf dem Boden der Platte zu gewährleisten.
- Inkubieren Sie die Platte 1 Stunde lang in einem befeuchteten Inkubator ohne CO2 -Gehalt bei 37 °C, um die Zellen mit dem Assaymedium auszugleichen.
HINWEIS: Bestätigen Sie die vollständige Haftung der Zellen mit einem Mikroskop, bevor Sie mit dem nächsten Schritt fortfahren.
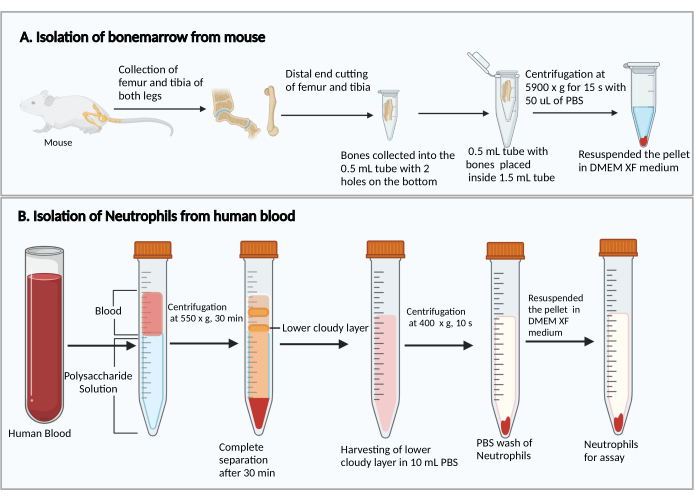
Abbildung 1: Schematische Darstellung der Isolierung von Knochenmarkzellen und Neutrophilen. (A) Entnahme von Knochenmarkzellen aus einer Maus und (B) Isolierung von Neutrophilen aus menschlichem Blut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Zellentyp | Zellen pro Vertiefung | Verbindungen/Reagenzien | Konzentration der Arbeitslösung | Einspritzvolumen zu den Anschlüssen | Endkonzentration in Bohrlöchern |
| Neutrophile Granulozyten der Maus | 2 × 105 | Oligomycin | 25 μM | 20 μL | 2,5 μM |
| FCCP | 7,5 μM | 17,6 μL | 0,61 μM | ||
| Rotenon-Antimycin-A-Gemisch | 10 μM | 24 μL | 1 μM | ||
| Menschliche Neutrophile | 4 × 105 | Oligomycin | 10 μM | 20 μL | 1 μM |
| FCCP | 12,5 μM | 22 μL | 1,25 μM | ||
| Rotenon-Antimycin-A-Gemisch | 10 μM | 24 μL | 1 μM | ||
| Undifferenzierte oder differenzierte HL60-Zellen | 2.5 × 105 | Oligomycin | 25 μM | 20 μL | 2,5 μM |
| FCCP | 15 μM | 22 μL | 1,5 μM | ||
| Rotenon-Antimycin-A-Gemisch | 10 μM | 24 μL | 1 μM |
Tabelle 1: Zellzahlen und Reagenzienkonzentrationen für den mitochondrialen Stresstest.
3. Herstellung von Verbindungen im mitochondrialen Stresstest-Kit
- Öffnen Sie das mitochondriale Stresstest-Kit und bereiten Sie die Reagenzien vor.
HINWEIS: Die unterschiedlichen Konzentrationen der Arbeitslösung, das Injektionsvolumen in die Vertiefungen und die Endkonzentrationen in den Vertiefungen von Oligomycin, Carbonylcyanid-p-Trifluormethoxyphenylhydrazon (FCCP) und Rotenon/Antimycin A-Mischung, die für neutrophile Granulozyten von Mäusen, menschliche Neutrophile und HL60-Zellen verwendet werden, sind in Tabelle 1 aufgeführt.- Oligomycin-Stammlösung durch Rekonstitution von Oligomycin mit 630 μl Assay-Medium herstellen, um eine 100 μM Stammlösung zu erhalten.
Anmerkungen: Es wird empfohlen, die Stammlösung noch am selben Tag zu verwenden.- Oligomycin-Arbeitslösung für Maus-Neutrophilen- und HL60-Zellassays herstellen, indem 630 μl Stammlösung mit 1.890 μl Assaymedium gemischt werden, um eine 25 μM Arbeitslösung zu erhalten.
- Bereiten Sie die Oligomycin-Arbeitslösung für den humanen Neutrophilen-Assay vor, indem Sie 300 μl Stammlösung mit 2.700 μl Assaymedium mischen, um eine 10 μM Arbeitslösung zu erhalten.
HINWEIS: Die Bindung von Oligomycin an die Fo-Grundplatten-Untereinheit der Fo/F1-ATPase (ATP-Synthase) verhindert den Wiedereintritt von Protonen in die Mitochondrien und hemmt die ATP-Synthese32. Dadurch wird der Elektronenfluss durch die Elektronentransportkette und die OCR deutlich reduziert. Der Elektronenfluss stoppt jedoch nicht vollständig, da Protonen durch die innere Mitochondrienmembran33 austreten.
- FCCP-Stammlösung wird durch Rekonstitution von FCCP mit 720 μl Assay-Medium hergestellt, um eine 100-μM-Stammlösung zu erhalten.
- Bereiten Sie die Arbeitslösung für den Maus-Neutrophilen-Assay vor, indem Sie 300 μl Stammlösung mit 3.700 μl Assaymedium mischen, um eine 7,5 μM Arbeitslösung zu erhalten.
- Bereiten Sie die Arbeitslösung für den humanen neutrophilen Assay vor, indem Sie 375 μl Stammlösung mit 2.625 μl Assaymedium mischen, um eine 12,5 μM Arbeitslösung zu erhalten.
- Bereiten Sie die Arbeitslösung für den HL60-Zellassay vor, indem Sie 720 μl Stammlösung mit 4.080 μl Assaymedium mischen, um eine 15 μM Arbeitslösung zu erhalten.
HINWEIS: Die Zugabe von FCCP zeigt die maximale Kapazität der Mitochondrien zur Verwendung von OXPHOS. Es handelt sich um eine fettlösliche, schwache Säure, die für Mitochondrien durchlässig ist und zur Dissipation des Transmembranpotentials führt. Die Entladung des Protonengradienten über die mitochondriale Innenmembran und die Umlenkung des Protonenflusses von der Fo/F1 ATP-Synthase führt zu einer mitochondrialen Entkopplung. Dieser Entkopplungseffekt erhöht abrupt den mitochondrialen Sauerstoffverbrauch, um den Protonengradienten34 zu erhalten.
- Bereiten Sie eine Rotenon/Antimycin-A-Stammlösung vor, indem Sie das Rotenon/Antimycin-A-Gemisch mit 540 μl Assaymedium rekonstituieren, um eine 50-μM-Stammlösung zu erhalten.
- Bereiten Sie Rotenon/Antimycin A als Arbeitslösung für alle Assays vor, indem Sie 540 μl Stammlösung mit 2.160 μl Assaymedium mischen, um eine 10 μM Arbeitslösung zu erhalten.
HINWEIS: Rotenon blockiert Komplex I, indem es den Elektronentransfer von den Eisen-Schwefel-Zentren in Komplex I zu Ubichinon hemmt, während Antimycin A den Komplex III der Elektronentransportkette blockiert, was zu einer Blockade von OXPHOS mit einer begrenzten Synthese von ATP35 führt. Dabei zeigt sich eine nicht-mitochondriale Atmung36,37.
- Bereiten Sie Rotenon/Antimycin A als Arbeitslösung für alle Assays vor, indem Sie 540 μl Stammlösung mit 2.160 μl Assaymedium mischen, um eine 10 μM Arbeitslösung zu erhalten.
- Oligomycin-Stammlösung durch Rekonstitution von Oligomycin mit 630 μl Assay-Medium herstellen, um eine 100 μM Stammlösung zu erhalten.
- Füllen Sie die Kartusche mit Reagenzien. Laden Sie das vorbereitete Oligomycin-, FCCP- und Rotenon/Antimycin-A-Gemisch in die A-, B- bzw. C-Anschlüsse der Patrone für Injektionen (Abbildung 2). Verwenden Sie den zusammen mit der Kartusche erhältlichen Schabloneneinsatz, um das Laden von Reagenzien in die Anschlüsse zu erleichtern. Füllen Sie die unbenutzten Anschlüsse mit 20 μl Assay-Medium.
- Für den Maus-Neutrophilen-Assay werden 20 μl Oligomycin (25 μM; jede Vertiefung der 96-Well-Platte enthält zu Beginn 180 μl Assay-Medium, so dass die Endkonzentration 2,5 μM beträgt) in die A-Ports geladen. Laden Sie 17,6 μl FCCP (7,5 μM; Endkonzentration: ~0,61 μM) in die B-Anschlüsse. Laden Sie 24 μl Rotenon/Antimycin-A-Gemisch (10 μM; Endkonzentration: ~1 μM) in die C-Anschlüsse.
- Für den humanen Neutrophilen-Assay werden 20 μl Oligomycin (10 μM; jede Vertiefung der 96-Well-Platte enthält zu Beginn 180 μl Assay-Medium, so dass die Endkonzentration 1 μM beträgt) in die A-Ports geladen. Laden Sie 22 μl FCCP (12,5 μM; Endkonzentration: ~1,25 μM) in die B-Anschlüsse. Laden Sie 24 μl Rotenon/Antimycin-A-Gemisch (10 μM; Endkonzentration: ~1 μM) in die C-Anschlüsse.
- Für den HL60- und dHL60-Zellassay werden 20 μl Oligomycin (25 μM; jede Vertiefung der 96-Well-Platte enthält zu Beginn 180 μl Assay-Medium, so dass die Endkonzentration 2,5 μM beträgt) in die A-Ports geladen. Laden Sie 22 μl FCCP (15 μM; Endkonzentration: ~1,5 μM) in die B-Anschlüsse. Laden Sie 24 μl Rotenon/Antimycin-A-Gemisch (10 μM; Endkonzentration: ~1 μM) in die C-Anschlüsse.
Anmerkungen: Pipettieren Sie die Arzneimittellösung in den Anschluss, ohne den Boden des Anschlusses zu berühren. Klopfen Sie nach dem Laden nicht auf die Platte, um ein Auslaufen zu vermeiden, da die Flüssigkeiten durch die Kapillarkräfte gehalten werden. Die Hintergrundvertiefungen der Kulturplatte und die Anschlüsse an der Sensorkartusche werden mit Assaymedium oder mit dem gleichen Anschluss für die Beladung von Reagenzien wie in den Probenvertiefungen beladen, um den Einfluss der Reagenzien auf die Hintergrundwerte zu normalisieren. Die Reagenzien müssen in die entsprechenden Anschlüsse eingefüllt werden, ohne die Kartusche von der kaliberhaltigen Gebrauchsplatte abzuheben, um einen Lufteinschluss zu vermeiden. Füllen Sie die letzte Öffnung aller Vertiefungen mit dem Medium, wie in Abbildung 2 gezeigt.

Abbildung 2: Die mitochondriale Stress-Assay-Kartusche und ihre Injektionsanschlüsse. Das Bild zeigt die Kartusche des mitochondrialen Stress-Assays und ein vergrößertes Bild, das die Beladung der einzelnen Medikamente/des Mediums an den Anschlüssen zeigt. Abkürzung: FCCP = Carbonylcyanid p-Trifluormethoxyphenylhydrazon. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Ausführen des mitochondrialen Stress-Assays
- Schalten Sie den Stoffwechselanalysator und den Computer ein, öffnen Sie die Wave-Software und klicken Sie auf Heizung ein , um das Gerät mindestens 5 Stunden im Voraus auf 37 °C einzustellen. Nach Erreichen der Temperatur wird in der unteren linken Ecke der Wellensoftware Ready angezeigt.
- Öffnen Sie eine Vorlage für das mitochondriale Stress-Assay-Kit in der Software. Klicken Sie in der oberen Menüleiste auf Gruppendefinition .
- Richten Sie jede Definition auf der linken Seite separat ein, z. B. Injektionsstrategien, Vorbehandlungen, Assay-Medien und (verwendetes Biomaterial) Zelltypen.
- Klicken Sie auf der linken Seite auf Injektionsstrategien , dann auf Hinzufügen und benennen Sie die Injektionsbedingung als Humane Neutrophile/Mausneutrophile/HL60. Wählen Sie die Anschlüsse A-D aus, indem Sie auf die einzelnen Anschlüsse klicken, klicken Sie auf Verbindung hinzufügen und geben Sie Oligomycin/FCCP/Rotenon Antimycin A mit den entsprechenden Konzentrationen ein (Tabelle 1).
- Klicken Sie auf der linken Seite auf Vorbehandlung, dann auf Hinzufügen und benennen Sie sie separat als CD18 und Cell Tak. Klicken Sie auf das verwendete Biomaterial auf der linken Seite, klicken Sie dann auf Hinzufügen und benennen Sie es als Humane Neutrophile, Maus-Neutrophile und HL60/dHL60 mit Seedingdichte.
- Definieren Sie die Gruppen, indem Sie auf Gruppe hinzufügen klicken (z. B. für den humanen Neutrophilen-Assay) und auf die zugrunde liegende Definition klicken (z. B. Injektionsstrategien gemäß Tabelle 1 - Humane Neutrophile, Vorbehandlung als CD18 und Zelltyp als Humane Neutrophile).
- Richten Sie das Protokoll ein, indem Sie im oberen Menü auf Protokoll klicken, und definieren Sie drei Zyklen von Baseline-, Oligomycin-, FCCP-, Rotenon- und Antimycin-A-Mischungen, indem Sie die Zeit auf Mischen auf 3 min, Ruhe auf 0 min und Messung auf 7 min einstellen.
- Gehen Sie zur Seite Run Assay , geben Sie die Projektzusammenfassungsinformationen als Referenz an und klicken Sie auf Run starten.
- Geben Sie den Speicherort für die Dateien an, damit alle Ergebnisse nach Abschluss des Assays gespeichert werden.
- Warten Sie nach dem automatischen Laden des Assays, bis sich das Fach geöffnet hat, um die Sensorkartusche und die Platte mit 200 μl Kaliber zu platzieren (Schritt 1.1). Stellen Sie die Patronen-Barcode-Richtung nach rechts ein. Führen Sie die Kalibrierung durch, indem Sie auf Ich bin bereit klicken, was ungefähr 20 Minuten dauert.
- Klicken Sie nach der Kalibrierung auf Fach öffnen. Ersetzen Sie die Platte durch die zellbesiedelte Platte und klicken Sie auf Wägezellenplatte , um mit dem Assay fortzufahren.
- Nach Abschluss des Assays werden die Daten automatisch gespeichert. Klicken Sie auf Ergebnisse anzeigen und exportieren Sie sie als Tabellenkalkulation oder eine andere Analysesoftware.
- Stellen Sie die Daten grafisch dar und analysieren Sie sie (Abbildung 3 und Abbildung 4).
- Berechnen Sie die Atmungsparameter, einschließlich der basalen mitochondrialen Atmung, der protonenleckgekoppelten Atmung, der ATP-gekoppelten Atmung, der maximalen Atmung, der freien Atemkapazität und der nicht-mitochondrialen Atmung (Abbildung 4A)38,39,40,41.
- Berechnen Sie die basale mitochondriale Atmung, indem Sie den OCR-Wert, der nach Zugabe von Rotenon/Antimycin-A-Gemisch gemessen wurde, von der OCR vor der Injektion von Oligomycin subtrahieren (Abbildung 4A, a).
- Berechnen Sie die protonenleckgekoppelte Atmung, indem Sie den OCR-Wert nach der Injektion des Rotenon/Antimycin-A-Gemisches von dem OCR-Wert abziehen, der nach der Oligomycin-Injektion gemessen wurde (Abbildung 4A,b).
- Schätzen Sie die ATP-gekoppelte Atmung, indem Sie die Differenz zwischen der basalen mitochondrialen Atmung und der protonenleckgekoppelten Atmung berechnen. Subtrahieren Sie den ersten OCR-Wert, der nach der Oligomycin-Injektion gemessen wurde, vom ersten OCR-Wert vor der Oligomycin-Injektion (Abbildung 4A,c).
- Die maximale Atmung ist die maximale Atmungsrate, die eine Zelle nach Zugabe von FCCP erreichen kann. Berechnen Sie dies, indem Sie den OCR-Wert nach der Injektion eines Rotenon-/Antimycin-A-Gemisches von dem OCR-Wert subtrahieren, der nach der FCCP-Injektion gemessen wurde (Abbildung 4A, d).
- Die freie Atmungskapazität bezieht sich auf die Kapazität einer Zelle, den höheren Energiebedarf durch OXPHOS zu decken. Berechnen Sie dies, indem Sie die Differenz zwischen der maximalen Atmung und der basalen mitochondrialen Atmung ermitteln (Abbildung 4A, e).
- Die nicht-mitochondriale Atmung ist die Menge an Sauerstoff, die von nicht-mitochondrialen Quellen verbraucht wird. Messen Sie dies nach der Zugabe von Rotenon/Antimycin-A-Gemisch (Abbildung 4A,f).
- Führen Sie eine statistische Analyse mit dem Student-t-Test durch, um verschiedene Atmungsparameter von undifferenzierten und differenzierten HL60-Zellen zu vergleichen. Betrachten Sie p < 0,05 als statistisch signifikant.
HINWEIS: Replikate mit OCR- oder ECAR-Werten unter Null gelten als Fehler bei der Probenvorbereitung, der Compound-Injektion oder der Messung. Sie sind von zukünftigen Analysen ausgeschlossen.
Ergebnisse
Es wird eine repräsentative OCR-Dynamik gezeigt, die auf die mitochondrialen Atmungsänderungen als Reaktion auf Oligomycin, FCCP und Rotenon/Antimycin A-Mischung aus neutrophilen Granulozyten der Maus (Abbildung 3A), humanen Neutrophilen (Abbildung 3B) und undifferenzierten und differenzierten HL60-Zellen (Abbildung 3C) hinweist. In allen Zellen senkt die Behandlung mit Oligomycin den OCR-Wert, indem der Protonenkanal der ATP-Synt...
Diskussion
Das Standardverfahren, das die mitochondriale Atmung von Neutrophilen mit dem metabolischen extrazellulären Flussanalysator misst, ist durch viele Faktoren begrenzt, darunter Zellzahl, Zellwachstum und Lebensfähigkeit. Die jeweilige Substanzkonzentration variiert je nach Art und Quelle der Zellen in diesem Assay. Oligomycin und Rotenon/Antimycin A werden bei den meisten Zelltypen meist in ähnlicher Konzentration eingesetzt. Da die FCCP-induzierte maximale Atemfrequenz jedoch zwischen verschiedenen Zellen variiert, is...
Offenlegungen
Die Autoren erklären kein konkurrierendes finanzielles Interesse.
Danksagungen
Wir danken Dr. Anthony T. Vella und Dr. Federica Aglianoin von der Abteilung für Immunologie an der UConn Health für ihre Ausbildung im Umgang mit dem metabolischen extrazellulären Flussanalysator und Dr. Lynn Puddington von der Abteilung für Immunologie an der UConn Health für ihre Unterstützung der Instrumente. Wir danken Dr. Geneva Hargis von der UConn School of Medicine für ihre Hilfe beim wissenschaftlichen Schreiben und Lektorat dieses Manuskripts. Diese Forschung wurde durch Zuschüsse der National Institutes of Health, des National Heart, Lung, and Blood Institute (R01HL145454), des National Institute of General Medical Sciences (R35GM147713 und P20GM139763), eines Start-up-Fonds von UConn Health und eines Career Re-Entry Fellowship der American Association of Immunologists unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 37 °C non-CO2 incubator | Precision | Economy Model 2EG | Instrument |
| Biorender | Software Application | ||
| Centrifuge | Eppendorf | Model 5810R | Instrument |
| Corning Cell-Tak Cell and Tissue Adhesive | Corning | 102416-100 | Reagent |
| EasySep Magnet | STEMCELL | 18000 | Magnet |
| EasySepMouse Neutrophil Enrichment kit | STEMCELL | 19762A | Reagents |
| Graphpad Prism 9 | Software Application | ||
| Human Serum Albumin Solution (25%) | GeminiBio | 800-120 | Reagents |
| Ketamine (VetaKet) | DAILYMED | NDC 59399-114-10 | Anesthetic |
| PBS | Cytiva | SH30256.01 | Reagents |
| Plate buckets | Eppendorf | UL155 | Accessory |
| PolymorphPrep | PROGEN | 1895 (previous 1114683) | polysaccharide solution |
| Purified mouse anti-human CD18 antibody | Biolegend | 302102 | Clone TS1/18 |
| RPMI 1640 Medium | Gibco | 11-875-093 | Reagents |
| Seahorse metabolic extracellular flux analyzer | Agilent | XFe96 | Instrument |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | mitochondrial stress test Kit |
| Swing-bucket rotor | Eppendorf | A-4-62 | Rotor |
| Vactrap 2 Vacum Trap | Fox Lifesciences | 3052101-FLS | Instrument |
| Wave | Software Application | ||
| XF 1.0 M Glucose Solution | Agilent | 103577-100 | Reagent |
| XF 100 mM Pyruvate Solution | Agilent | 103578-100 | Reagent |
| XF 200 mM Glutamine Solution | Agilent | 103579-100 | Reagent |
| XF DMEM medium | Agilent | 103575-100 | Reagent |
| XFe96 FluxPak | Agilent | 102601-100 | Material |
| Xylazine (AnaSed Injection) | DAILYMED | NDC 59399-110-20 | Anesthetic |
Referenzen
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Noguchi, M., Kasahara, A. Mitochondrial dynamics coordinate cell differentiation. Biochemical and Biophysical Research Communications. 500 (1), 59-64 (2018).
- Zhu, L., et al. Correlation between mitochondrial dysfunction, cardiovascular diseases, and traditional Chinese medicine. Evidence-Based Complementary and Alternative Medicine. 2020, e2902136 (2020).
- Kaarniranta, K., et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Progress in Retinal and Eye Research. 79, 100858 (2020).
- Onyango, I. G., Khan, S. M., Bennett, J. P. Mitochondria in the pathophysiology of Alzheimer's and Parkinson's diseases. Frontiers in Bioscience. 22 (5), 854-872 (2017).
- Loiseau, D., et al. Mitochondrial coupling defect in Charcot-Marie-Tooth type 2A disease. Annals of Neurology. 61 (4), 315-323 (2007).
- Zucker-Franklin, D. Electron microscopic studies of human granulocytes: structural variations related to function. Seminars in Hematology. 5 (2), 109-133 (1968).
- Karnovsky, M. L. The metabolism of leukocytes. Seminars in Hematology. 5 (2), 156-165 (1968).
- Bao, Y., et al. mTOR and differential activation of mitochondria orchestrate neutrophil chemotaxis. The Journal of Cell Biology. 210 (7), 1153-1164 (2015).
- Fossati, G., et al. The mitochondrial network of human neutrophils: role in chemotaxis, phagocytosis, respiratory burst activation, and commitment to apoptosis. Journal of Immunology. 170 (4), 1964-1972 (2003).
- Pryde, J. G., Walker, A., Rossi, A. G., Hannah, S., Haslett, C. Temperature-dependent arrest of neutrophil apoptosis. Failure of Bax insertion into mitochondria at 15 degrees C prevents the release of cytochrome c. The Journal of Biological Chemistry. 275 (43), 33574-33584 (2000).
- Maianski, N. A., Mul, F. P. J., van Buul, J. D., Roos, D., Kuijpers, T. W. Granulocyte colony-stimulating factor inhibits the mitochondria-dependent activation of caspase-3 in neutrophils. Blood. 99 (2), 672-679 (2002).
- Bao, Y., et al. Mitochondria regulate neutrophil activation by generating ATP for autocrine purinergic signaling. The Journal of Biological Chemistry. 289 (39), 26794-26803 (2014).
- Chouchani, E. T., et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS. Nature. 515 (7527), 431-435 (2014).
- Hayashi, G., Cortopassi, G. Oxidative stress in inherited mitochondrial diseases. Free Radical Biology and Medicine. 88, 10-17 (2015).
- Mailloux, R. J. An update on mitochondrial reactive oxygen species production. Antioxidants. 9 (6), 472 (2020).
- Abuaita, B. H., et al. The IRE1α stress signaling axis is a key regulator of neutrophil antimicrobial effector function. Journal of Immunology. 207 (1), 210-220 (2021).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nature Medicine. 22 (2), 146-153 (2016).
- Douda, D. N., Khan, M. A., Grasemann, H., Palaniyar, N. SK3 channel and mitochondrial ROS mediate NADPH oxidase-independent NETosis induced by calcium influx. Proceedings of the National Academy of Sciencesa. 112 (9), 2817-2822 (2015).
- Monteith, A. J., et al. Altered mitochondrial homeostasis during systemic lupus erythematosus impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Journal of Immunology. 208 (2), 454-463 (2022).
- Monteith, A. J., Miller, J. M., Beavers, W. N., Juttukonda, L. J., Skaar, E. P. Increased dietary manganese impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Infection and Immunity. 90 (3), 0068521 (2022).
- Monteith, A. J., et al. Mitochondrial calcium uniporter affects neutrophil bactericidal activity during Staphylococcus aureus infection. Infection and Immunity. 90 (2), 0055121 (2022).
- Cao, Z., et al. Roles of mitochondria in neutrophils. Frontiers in Immunology. 13, 934444 (2022).
- Papayannopoulos, V., Metzler, K. D., Hakkim, A., Zychlinsky, A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. The Journal of Cell Biology. 191 (3), 677-691 (2010).
- Fan, Z., Ley, K. Developing neutrophils must eat…themselves. Immunity. 47 (3), 393-395 (2017).
- Riffelmacher, T., et al. Autophagy-dependent generation of free fatty acids is critical for normal neutrophil differentiation. Immunity. 47 (3), 466-480 (2017).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), e53936 (2016).
- Swamydas, M., Isolation Lionakis, M. S. purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments. (77), e50586 (2013).
- Gerner, M. C., et al. Packed red blood cells inhibit T-cell activation via ROS-dependent signaling pathways. The Journal of Biological Chemistry. 296, 100487 (2021).
- Zhang, Z. -. W., et al. Red blood cell extrudes nucleus and mitochondria against oxidative stress. IUBMB Life. 63 (7), 560-565 (2011).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111, 1-16 (2015).
- Hearne, A., Chen, H., Monarchino, A., Wiseman, J. S. Oligomycin-induced proton uncoupling. Toxicology In Vitro. 67, 104907 (2020).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-Protocol. 8 (10), e2850 (2018).
- Nath, S. The molecular mechanism of ATP synthesis by F1F0-ATP synthase: a scrutiny of the major possibilities. Advances in Biochemical Engineering/Biotechnology. 74, 65-98 (2002).
- Heinz, S., et al. Mechanistic investigations of the mitochondrial complex I inhibitor rotenone in the context of pharmacological and safety evaluation. Scientific Reports. 7 (1), 45465 (2017).
- Hytti, M., et al. Antimycin A-induced mitochondrial damage causes human RPE cell death despite activation of autophagy. Oxidative Medicine and Cellular Longevity. 2019, 1583656 (2019).
- Malecki, M., Kamrad, S., Ralser, M., Bähler, J. Mitochondrial respiration is required to provide amino acids during fermentative proliferation of fission yeast. EMBO Reports. 21 (11), e50845 (2020).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. The FASEB Journal. 34 (10), 13106-13124 (2020).
- Nicholas, D., et al. Advances in the quantification of mitochondrial function in primary human immune cells through extracellular flux analysis. PLoS One. 12 (2), e0170975 (2017).
- Tur, J., et al. Mitofusin 2 in macrophages links mitochondrial ROS production, cytokine release, phagocytosis, autophagy, and bactericidal activity. Cell Reports. 32 (8), 108079 (2020).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Wettmarshausen, J., Perocchi, F. Assessing calcium-stimulated mitochondrial bioenergetics using the seahorse XF96 analyzer. Methods in Molecular Biology. 1925, 197-222 (2019).
- Forkink, M., et al. Mitochondrial hyperpolarization during chronic complex I inhibition is sustained by low activity of complex II, III, IV and V. Biochimica et Biophysica Acta. 1837 (8), 1247-1256 (2014).
- . Methods for Reducing Cell Growth Edge Effects in Agilent Seahorse XF Cell Culture Microplates Available from: https://www.agilent.com/cs/library/usermanuals/public/user-manual-methods-for-reducing-cell-growth-edge-effect-cell-analysis-5994-0240en-agilent.pdf (2019)
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. Journal of Visualized Experiments. (54), e2899 (2011).
- Normalisation of Seahorse XFe96 metabolic assaysto cell number with Hoechst stain using well-scan mode on the CLARIOstar Plus. BMG Labtech Available from: https://www.bmglabtech.com/cn/normalisation-of-seahorse-xfe96-metabolic-assays-to-cell-number-with-hoechst-stain/ (2020)
- Yetkin-Arik, B., et al. The role of glycolysis and mitochondrial respiration in the formation and functioning of endothelial tip cells during angiogenesis. Scientific Reports. 9 (1), 12608 (2019).
- Jastroch, M., Divakaruni, A. S., Mookerjee, S., Treberg, J. R., Brand, M. D. Mitochondrial proton and electron leaks. Essays in Biochemistry. 47, 53-67 (2010).
- Jandl, R. C., et al. Termination of the respiratory burst in human neutrophils. The Journal of Clinical Investigation. 61 (5), 1176-1185 (1978).
- Azevedo, E. P., et al. A metabolic shift toward pentose phosphate pathway is necessary for amyloid fibril- and phorbol 12-myristate 13-acetate-induced neutrophil extracellular trap (NET) formation. The Journal of Biological Chemistry. 290 (36), 22174-22183 (2015).
- Six, E., et al. AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages. Cell Death & Disease. 6 (8), e1856 (2015).
- Kumar, S., Dikshit, M. Metabolic insight of neutrophils in health and disease. Frontiers in Immunology. 10, 2099 (2019).
- Rodríguez-Espinosa, O., Rojas-Espinosa, O., Moreno-Altamirano, M. M. B., López-Villegas, E. O., Sánchez-García, F. J. Metabolic requirements for neutrophil extracellular traps formation. Immunology. 145 (2), 213-224 (2015).
- Invernizzi, F., et al. Microscale oxygraphy reveals OXPHOS impairment in MRC mutant cells. Mitochondrion. 12 (2), 328-335 (2012).
- Zenaro, E., et al. Neutrophils promote Alzheimer's disease-like pathology and cognitive decline via LFA-1 integrin. Nature Medicine. 21 (8), 880-886 (2015).
- Maianski, N. A., et al. Functional characterization of mitochondria in neutrophils: a role restricted to apoptosis. Cell Death and Differentiation. 11 (2), 143-153 (2004).
- Bergman, O., Ben-Shachar, D. Mitochondrial oxidative phosphorylation system (OXPHOS) deficits in schizophrenia. Canadian Journal of Psychiatry. 61 (8), 457-469 (2016).
- Zhou, W., Qu, J., Xie, S., Sun, Y., Yao, H. Mitochondrial dysfunction in chronic respiratory diseases: implications for the pathogenesis and potential therapeutics. Oxidative Medicine and Cellular Longevity. 2021, 5188306 (2021).
- Hirano, M., Emmanuele, V., Quinzii, C. M. Emerging therapies for mitochondrial diseases. Essays in Biochemistry. 62 (3), 467-481 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten