JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
호중구의 미토콘드리아 생물에너지 프로파일의 실시간 측정
요약
대사 세포외 플럭스 분석기를 사용하여 마우스와 인간 호중구 및 HL60 세포의 미토콘드리아 호흡을 측정하는 단계적 프로토콜을 설명합니다.
초록
호중구는 인간의 첫 번째 방어선이자 가장 풍부한 백혈구입니다. 이러한 이펙터 세포는 식균 작용 및 산화 버스트와 같은 기능을 수행하고 미생물 제거를 위한 호중구 세포외 트랩(NET)을 생성합니다. 호중구의 대사 활동에 대한 새로운 통찰력은 호중구가 주로 해당과정에 의존한다는 초기 개념에 도전합니다. 대사 활동의 정확한 측정은 트리카르복실산(TCA) 회로(크렙스 회로라고도 함), 산화적 인산화(OXPHOS), 오탄당 인산염 경로(PPP) 및 지방산 산화(FAO)를 포함하여 호중구의 다양한 대사 요구 사항을 밝힐 수 있습니다. 이 논문은 대사 세포외 플럭스 분석기에서 대사 플럭스 분석을 사용하여 마우스 골수 유래 호중구, 인간 혈액 유래 호중구 및 호중구 유사 HL60 세포주에서 미토콘드리아 호흡의 지표로 산소 소비율(OCR)을 측정하기 위한 단계별 프로토콜 및 사전 요구 사항을 설명합니다. 이 방법은 정상 및 질병 조건 하에서 호중구의 미토콘드리아 기능을 정량화하는 데 사용할 수 있습니다.
서문
미토콘드리아는 산화적 인산화(OXPHOS)에 의해 아데노신 삼인산(ATP)을 생성하는 세포 생물 에너지학에서 중요한 역할을 합니다. 이 외에도 미토콘드리아의 역할은 활성 산소 종의 생성 및 해독, 세포질 및 미토콘드리아 기질 칼슘 조절, 세포 합성, 이화 작용 및 세포 내 대사 산물의 수송으로 확장됩니다1. 미토콘드리아 호흡은 모든 세포에 필수적인데, 그 기능 장애는 심혈관 질환3과 연령 관련 황반변성4, 파킨슨병 및 알츠하이머병5, 샤르코-마리-투스병2 A(CMT2A)6와 같은 다양한 신경퇴행성 질환을 포함한 대사 문제2를 유발할 수 있기 때문이다.
호중구에 대한 전자 현미경 연구에 따르면 미토콘드리아는 상대적으로 적으며7 미토콘드리아는 미토콘드리아 호흡률이 매우 낮기 때문에 에너지 생산을 위해 해당과정에 크게 의존하고 있다8. 그러나 미토콘드리아는 화학주성9 및 세포자멸사10,11,12와 같은 호중구 기능에 중요합니다. 이전 연구에서는 높은 막 전위를 가진 인간 호중구에서 복잡한 미토콘드리아 네트워크를 밝혀냈습니다. 미토콘드리아 막의 전위 손실은 호중구 세포자멸사의 초기 지표이다10. 미토콘드리아 언커플러 카르보닐 시안화물 m-클로로페닐 히드라존(CCCP)을 사용한 치료는 미토콘드리아 형태의 변화와 함께 화학주성에서 상당한 억제를 보여주었습니다 9,10.
호중구의 주요 에너지원은 해당과정이지만, 미토콘드리아는 퓨린성 신호전달의 첫 번째 단계에 연료를 공급하여 호중구 활성화를 시작하는 ATP를 제공하며, 이는 Ca2+ 신호전달을 증가시키고, 미토콘드리아 ATP 생산을 증폭시키며, 호중구 기능적 반응을 개시한다13. 미토콘드리아 호흡 사슬의 기능 장애는 독성 활성 산소 종 (ROS)의 과도한 생산을 초래하고 병원성 손상을 초래합니다14,15,16. 호중구 세포외 트랩(NET)을 형성하는 과정인 NETosis는 호중구가 병원체에 대항하는 데 도움이 되는 중요한 특성이며17 암, 혈전증, 자가면역 질환18을 포함한 많은 병리학적 상태에 기여한다. 미토콘드리아 유래 ROS는 NETosis19에 기여하고, 미토콘드리아 DNA는 NETs18의 구성 요소가 될 수 있으며, 변경된 미토콘드리아 항상성은 NETosis 20,21,22,23,24를 손상시킵니다. 또한, 정상적인 분화 또는 성숙 동안, 호중구 대사 재 프로그래밍은 해당 작용 활성을 제한함으로써 역전되고, 미토콘드리아 호흡에 관여하고 세포 내 지질을 동원한다25,26.
대사 세포외 플럭스 분석기는 살아있는 세포 미토콘드리아 호흡 및 해당 과정을 지속적으로 모니터링하고 정량화할 수 있습니다. 분석기는 96웰 플레이트 형식 센서 카트리지와 2개의 형광단을 사용하여 산소(O2) 농도 및 pH 변화를 정량화합니다. 센서 카트리지는 분석 중에 세포 단층 위에 있으며 ~200nm 높이의 마이크로 챔버를 형성합니다. 분석기의 광섬유 다발은 형광단을 여기시키고 형광 강도 변화를 감지하는 데 사용됩니다. O2 농도 및 pH의 실시간 변화는 자동으로 계산되어 산소 소비율(OCR) 및 세포외 산성화율(ECAR)로 표시됩니다. 센서 카트리지에는 분석 측정 중에 각 웰에 최대 4개의 화합물을 로드할 수 있는 4개의 포트가 있습니다. 이 프로토콜은 대사 세포외 플럭스 분석기를 사용하여 마우스 및 인간 호중구와 호중구 유사 HL60 세포의 미토콘드리아 호흡을 정량화하는 데 중점을 둡니다.
프로토콜
헤파린화된 전혈 샘플은 헬싱키 선언에 따라 UConn Health의 기관 검토 위원회(Institutional Review Board of UConn Health)의 승인을 받은 정보에 입각한 동의를 얻은 후 건강한 인간 기증자로부터 얻었습니다. 모든 동물 실험은 UConn Health Institutional Animal Care and Use Committee(IACUC) 가이드라인을 따랐으며, 설치류 사용에 대한 승인은 미국 국립보건원(National Institutes of Health)의 Guide for the Care and Use of Laboratory Animals에 요약된 기준에 따라 UConn Health IACUC로부터 획득되었습니다. 6주령의 수컷 C57BL/6 마우스를 본 연구에 사용하였다.
1. 대사세포외 플럭스 분석을 위한 96-웰 플레이트의 제조
- 센서 카트리지는 대사 세포외 플럭스 분석을 위해 특별히 설계된 96웰 플레이트 위에 포장되어 있습니다. 카트리지를 조심스럽게 들어 올려 수화하고 200μL/웰의 교정 배지를 기본 플레이트의 각 웰에 넣습니다. 카트리지를 보정제가 있는 플레이트 위에 놓고 비CO2, 가습, 37°C 인큐베이터에서 밤새 수화시킨다.
- 세포 유형에 따라 세포 부착을 보장하기 위해 배양 플레이트에 특정 코팅을 사용하십시오. 인간 호중구의 경우-미분화 및 분화된 HL60 세포-50μL의 5μL의 정제된 마우스 항-인간 CD18 항체(Clone TS1/18)를 함유한 멸균 인산염 완충 식염수(PBS)로 96웰 플레이트를 4°C에서 밤새 코팅합니다. 마우스 호중구의 경우 실온(RT)에서 0.1M NaHCO3 중 pH 8.0에서 25μL의 22.4μg/mL Cell Tak 25μL로 20웰 플레이트를 코팅합니다.
- 플레이트를 200 μL의 멸균 PBS로 2회 세척한다.
- 파종하는 동안 세포 배양 플레이트의 배경 보정을 위해 세포 배양 플레이트(세포 없음)의 모서리 웰(A1, A12, H1 및 H12)에 완전한 배지를 추가합니다.
알림: 코팅 및 교정 중 증발은 교정 매체의 부피와 정규화에 영향을 미칠 수 있습니다. 멸균된 물에 젖은 티슈가 있는 트레이 또는 챔버를 사용하고 증발을 방지하기 위해 보정제가 있는 플레이트를 그 위에 놓습니다.
2. 세포의 준비 및 파종
- 분석 배지의 제조
- Dulbecco의 변형 된 Eagle 배지 (DMEM)에 1 mM 피루 베이트, 10 mM 포도당 및 2 mM 글루타민을 첨가하여 분석 배지를 준비합니다.
- 골수에서 마우스 호중구의 분리
- 제조업체의 지침에 따라 Mouse Neutrophil Enrichment Kit를 사용하여 골수에서 마우스 호중구를 분리합니다.
- 케타민(125mg/kg)과 자일라진(12.5mg/kg)을 복강내(ip) 주사하여 마우스를 마취한 다음 자궁경부 탈구로 마우스를 안락사시킵니다.
- 앞에서 설명한 대로 대퇴골과 경골을 수확합니다27. 간단히 피부를 잘라 근육과 다리가 노출되도록 합니다. 몸에서 다리를 제거하기 위해 고관절을 자릅니다. 그런 다음 근육을 제거하여 대퇴골과 경골을 수집합니다.
- 대퇴골과 경골의 작은 끝을 자릅니다. 절단된 끝을 아래로 잡고 바닥에 25G 주사기 바늘 구멍 2개가 있는 0.5mL 원심분리기 튜브에 넣고 0.5mL 튜브를 1.5mL 원심분리기 튜브에 넣습니다(그림 1A). 골수 세포의 건조를 방지하기 위해 50 μL의 PBS를 0.5 mL 튜브에 첨가한다.
- RT에서 5,900 × g 에서 15초 동안 원심분리하여 1.5mL 튜브 바닥에서 골수를 수집합니다. 1mL의 DMEM으로 골수 세포를 재현탁합니다. 키트에서 50μL의 쥐 혈청을 추가하고 피펫팅으로 부드럽게 혼합한 다음 세포 현탁액을 5mL 폴리스티렌 배양 시험관에 옮깁니다.
- Mouse Neutrophil Enrichment Kit에서 농축 칵테일 50μL를 추가하고 RT에서 15분 동안 배양합니다. RT에서 300× g 에서 5분 동안 원심분리합니다.
- 1mL의 DMEM으로 세포를 다시 현탁하고, 키트에서 50μL의 비오틴 선택 칵테일을 추가하고, 피펫팅으로 부드럽게 혼합하고, RT에서 15분 동안 배양합니다.
- 키트에서 150μL의 와류형 자성 입자를 추가하고 피펫팅으로 부드럽게 혼합한 다음 RT에서 10분 동안 배양합니다.
- ~1.3mL의 DMEM을 추가하고 피펫팅으로 부드럽게 혼합하고 튜브를 자석에 3분 동안 넣고 자석과 함께 원래 튜브를 뒤집어 정제된 마우스 호중구가 포함된 상청액을 새로운 5mL 폴리스티렌 배양 시험관으로 옮깁니다.
- RT에서 300 × g 에서 5 분 동안 원심 분리기. 진공 흡인에 의해 상층액을 제거한 후, 1 mL의 분석 배지로 세포를 재현탁한다.
- 혈구계를 사용하여 수동으로 세포 수를 세십시오.
- 분석 배지, 마우스 호중구 현탁액(2 × 10 5 세포)의 시드 180 μL를 준비된 96웰 플레이트에 첨가하여 세포 밀도를 1.1 ×10 6 cells/mL로 조정하고, 플레이트를 브레이크 없이 RT에서 300×g에서 3분 동안 원심분리하여 플레이트 바닥에 세포가 적절하게 부착되도록 합니다.
- 플레이트를CO2가 아닌 가습된 37°C 인큐베이터에서 1시간 동안 인큐베이션하여 세포를 분석 배지와 미리 평형화시켰다.
참고: 호중구의 순도는 잠재적인 편향이기 때문에 분석에 매우 중요합니다. 마우스 호중구 분리의 순도는 이 프로토콜에 의해 69.9%-88.7%입니다. 마우스 골수로부터 호중구를 분리하는 다른 방법들, 예를 들어 밀도 구배 원심분리(density gradient centrifugation)도 있다 28. 호중구에서 발현되지 않는 항원에 대한 단클론 항체를 사용하는 음성 자기 선택을 기반으로 하는 다른 공급업체의 대체 호중구 분리 키트도 있습니다.
- 말초 혈액에서 인간 호중구의 분리
- 8mL의 다당류 용액을 15mL 원심분리기 튜브에 넣은 다음 혼합하지 않고 다당류 용액 위에 4mL의 말초 혈액을 겹칩니다.
- 20°C에서 550× g 에서 30분 동안 원심분리합니다. 로터를 1에서 감속시킵니다.
참고: 호중구 분리 시간은 기증자마다 다를 수 있습니다. 최소 30분이며 호중구 분리에 실패할 경우 추가로 10-20분이 필요할 수 있습니다. - 그림 1B와 같이 원심분리 후 혈장/혈소판과 단핵구의 분리를 관찰합니다. 1mL 피펫을 사용하여 상단의 상단 노란색 액체(혈장 및 혈소판)와 상단 흐림 밴드(단핵 세포)를 방해하지 않고 하단 흐림 밴드(호중구)를 조심스럽게 제거합니다.
- 아래쪽 흐린 띠와 아래의 맑은 액체 ~3-4mL를 PBS 15mL가 들어 있는 새 10mL 원심분리기 튜브에 수집합니다.
- 20°C에서 400 × g 에서 10분 동안 원심분리하고 진공 흡인하여 상층액을 제거하였다.
- 세포를 5mL의 PBS로 재현탁하고 20°C에서 300× g 에서 5분 동안 원심분리합니다.
- 상층액을 제거한 후 1mL의 분석 배지로 세포를 재현탁합니다.
- 혈구계를 사용하여 수동으로 세포 수를 세십시오.
참고: 혈액 내 적혈구에는 미토콘드리아가 없기 때문에 적혈구 오염은 미토콘드리아 스트레스 테스트 분석에 영향을 미치지 않으며 호중구 활성화/프라이밍을 방지합니다29,30. 정확한 호중구 농도를 얻기 위해 세포 계수 중에 적혈구를 용해해야 합니다. 10 μL의 세포 현탁액을 891 μL의 탈이온수에 10-30 초 동안 첨가하여 적혈구를 용해시킨 다음 99 μL의 10x PBS를 첨가하여 삼투압의 균형을 맞추고 호중구의 용해를 피합니다. - 분석 배지, 웰당 인간 호중구(~4 × 105)의 180μL를 준비된 96웰 플레이트에 추가하여 세포 밀도를 2.2 ×10 6 cells/mL로 조정하고, 플레이트를 브레이크 없이 RT에서 300×g에서 3분 동안 원심분리하여 플레이트 바닥에 세포가 적절하게 부착되도록 합니다.
- 플레이트를 비-CO2, 가습, 37°C 인큐베이터에서 1시간 동안 인큐베이션하여 세포를 분석 배지와 미리 평형화시켰다.
참고: 호중구의 순도는 잠재적인 편향이기 때문에 분석에 매우 중요합니다. 인간 호중구 분리의 순도는 86.6%-96.8%입니다. 인간 혈액으로부터 호중구를 분리하기 위한 다른 밀도 구배 원심분리 방법도 있는데, 여기에는 퍼콜 분리(Percoll isolation)와 피콜(Ficoll) 분리와 덱스트란 침전(dextran sedimentation)의 조합이 포함된다31.
- HL60 세포 배양 및 호중구 유도 분화
- HL60 세포를 37°C 및 5%CO2에서 10% 소 태아 혈청(FBS), 100μg/mL 페니실린, 100μg/mL 스트렙토마이신 및 250ng/mL 암포테리신 B를 포함하는 로스웰 파크 기념 연구소(RPMI)-1640 배지에 유지합니다.
- 호중구 유도 분화를 위해 10% FBS, 100μg/mL 페니실린, 100μg/mL 스트렙토마이신, 250ng/mL 암포테리신 B, 1.3% 디메틸설폭사이드(DMSO)를 포함하는 RPMI-1640 배지에서 T25 플라×스크에 있는 HL60 세포(부유 세포)를 37°C 및 5%CO2에서 6일 동안 유지합니다.
- 분석 당일, 혈구계를 사용하여 수동으로 세포를 세고, 분화 또는 미분화 HL60 세포를 RT에서 300 × g 에서 5 분 동안 원심 분리하고, DMEM으로 한 번 세척하고, 분석 배지로 세포를 재현탁하여 1.39 ×10 6 cells/mL의 세포 밀도를 얻습니다.
- 웰당 분화 또는 미분화 HL60 세포(~2.5 × 105)의 180μL를 준비된 96웰 플레이트에 시드하고 플레이트를 RT에서 3분 동안 3분 동안 RT에서 300× g 으로 원심분리하여 플레이트 바닥에 있는 세포의 적절한 부착을 보장합니다.
- 플레이트를CO2가 아닌 가습된 37°C 인큐베이터에서 1시간 동안 인큐베이션하여 세포를 분석 배지와 미리 평형화시켰다.
참고: 다음 단계 전에 현미경을 사용하여 세포의 완전한 접착을 확인합니다.
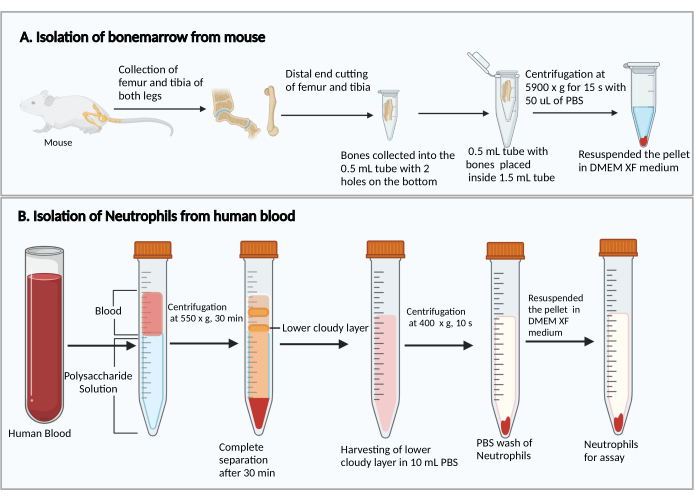
그림 1: 골수 세포와 호중구의 분리 개략도. (A) 마우스에서 골수 세포를 채취하고, (B) 인간 혈액에서 호중구를 분리합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 세포 유형 | 웰당 세포 수 | 화합물/시약 | 작업 용액 농도 | 포트에 대한 주입 볼륨 | 우물의 최종 농도 |
| 마우스 호중구 | 2 × 105 | 올리고마이신 | 25 마이크로미터 | 20 마이크로리터 | 2.5 마이크로미터 |
| 증권 시세 표시기 | 7.5 마이크로미터 | 17.6 마이크로리터 | 0.61 마이크로미터 | ||
| 로테논 안티마이신 A 혼합물 | 10 마이크로미터 | 24 마이크로리터 | 1 마이크로미터 | ||
| 인간 호중구 | 4 × 105 | 올리고마이신 | 10 마이크로미터 | 20 마이크로리터 | 1 마이크로미터 |
| 증권 시세 표시기 | 12.5 마이크로미터 | 22 마이크로리터 | 1.25 마이크로미터 | ||
| 로테논 안티마이신 A 혼합물 | 10 마이크로미터 | 24 마이크로리터 | 1 마이크로미터 | ||
| 미분화 또는 분화 HL60 세포 | 2.5 × 105 | 올리고마이신 | 25 마이크로미터 | 20 마이크로리터 | 2.5 마이크로미터 |
| 증권 시세 표시기 | 15 마이크로미터 | 22 마이크로리터 | 1.5 마이크로미터 | ||
| 로테논 안티마이신 A 혼합물 | 10 마이크로미터 | 24 마이크로리터 | 1 마이크로미터 |
표 1: 미토콘드리아 스트레스 테스트를 위한 세포 수 및 시약 농도.
3. 미토콘드리아 스트레스 테스트 키트에 화합물 준비
- 미토콘드리아 스트레스 테스트 키트를 열고 시약을 준비합니다.
참고: 마우스 호중구, 인간 호중구 및 HL60 세포에 사용되는 올리고마이신, 카르보닐시안화물 p-트리플루오로메톡시 페닐히드라존(FCCP) 및 로테논/안티마이신 A 혼합물의 웰에서 다양한 작동 용액 농도, 웰 내 주입 부피 및 최종 농도가 표 1에 나와 있습니다.- 630μL의 분석 배지로 올리고마이신을 재구성하여 올리고마이신 원액을 준비하여 100μM 원액을 얻습니다.
알림: 원액은 당일 사용하는 것이 좋습니다.- 630μL의 원액과 1,890μL의 분석 배지를 혼합하여 마우스 호중구 및 HL60 세포 분석을 위한 올리고마이신 작업 용액을 준비하여 25μM 작업 용액을 얻습니다.
- 300μL의 원액과 2,700μL의 분석 배지를 혼합하여 인간 호중구 분석을 위한 올리고마이신 작업 용액을 준비하여 10μM 작업 용액을 얻습니다.
참고: Fo/F1 ATPase(ATP 합성효소)의 Fo 기저판 서브유닛에 대한 올리고마이신의 결합은 양성자가 미토콘드리아로 재진입하는 것을 방지하고 ATP 합성을 억제합니다32. 이것은 전자 수송 사슬과 OCR을 통한 전자 흐름을 크게 감소시킵니다. 그러나, 전자 흐름은 내부 미토콘드리아 막(33)을 가로지르는 양성자 누출로 인해 완전히 멈추지 않는다.
- 720μL의 분석 배지로 FCCP를 재구성하여 100μM 원액을 수득하여 FCCP 원액을 준비합니다.
- 300μL의 원액과 3,700μL의 분석 배지를 혼합하여 마우스 호중구 분석을 위한 작업 용액을 준비하여 7.5μM 작업 용액을 얻습니다.
- 375 μL의 저장 용액과 2,625 μL의 분석 배지를 혼합하여 12.5 μM 작업 용액을 얻어 인간 호중구 분석을위한 작업 용액을 준비합니다.
- 720μL의 원액과 4,080μL의 분석 배지를 혼합하여 15μM 작업 용액을 얻어 HL60 세포 분석을 위한 작업 용액을 준비합니다.
참고: FCCP를 추가하면 OXPHOS를 사용할 수 있는 미토콘드리아의 최대 용량이 나타납니다. 미토콘드리아에 지용성, 약산성 투과성으로 막횡단 전위의 소산을 초래한다. 미토콘드리아 내막을 가로질러 양성자 구배를 방출하고 Fo/F1 ATP 합성효소에서 양성자 플럭스를 전환하면 미토콘드리아 분리가 발생합니다. 이 분리 효과는 양성자 구배34를 보존하기 위해 미토콘드리아 산소 소비를 갑자기 증가시킵니다.
- 로테논/안티마이신 A 혼합물을 540μL의 분석 배지와 재구성하여 로테논/안티마이신 A 원액을 준비하여 50μM 원액을 얻습니다.
- 540μL의 원액과 2,160μL의 분석 배지를 혼합하여 10μM 작업 용액을 얻어 모든 분석에 대한 로테논/안티마이신 A 작업 용액을 준비합니다.
참고: 로테논은 복합체 I의 철-황 중심에서 유비퀴논으로의 전자 전달을 억제하여 복합체 I을 차단하는 반면, 안티마이신 A는 전자 수송 사슬의 복합체 III를 차단하여 ATP35의 제한된 합성으로 OXPHOS를 차단합니다. 이로써, 이것은 비-미토콘드리아 호흡을 나타낸다36,37.
- 540μL의 원액과 2,160μL의 분석 배지를 혼합하여 10μM 작업 용액을 얻어 모든 분석에 대한 로테논/안티마이신 A 작업 용액을 준비합니다.
- 630μL의 분석 배지로 올리고마이신을 재구성하여 올리고마이신 원액을 준비하여 100μM 원액을 얻습니다.
- 카트리지에 시약을 로드합니다. 준비된 올리고마이신, FCCP 및 로테논/안티마이신 A 혼합물을 주입용 카트리지의 A, B 및 C 포트에 각각 로드합니다(그림 2). 카트리지와 함께 사용할 수 있는 템플릿 삽입물을 사용하여 포트에 시약을 쉽게 로드할 수 있습니다. 사용하지 않는 포트를 20μL의 분석 배지로 채웁니다.
- 마우스 호중구 분석의 경우 20μL의 올리고마이신(25μM, 96웰 플레이트의 각 웰은 처음에 180μL의 분석 배지를 가지므로 최종 농도는 2.5μM임)을 A 포트에 로드합니다. 17.6μL의 FCCP(7.5μM, 최종 농도: ~0.61μM)를 B 포트에 로드합니다. 24μL의 로테논/안티마이신 A 혼합물(10μM, 최종 농도: ~1μM)을 C 포트에 로드합니다.
- 인간 호중구 분석의 경우 20μL의 올리고마이신(10μM, 96웰 플레이트의 각 웰은 처음에 180μL의 분석 배지를 가지므로 최종 농도는 1μM임)을 A 포트에 로드합니다. 22μL의 FCCP(12.5μM, 최종 농도: ~1.25μM)를 B 포트에 로드합니다. 24μL의 로테논/안티마이신 A 혼합물(10μM, 최종 농도: ~1μM)을 C 포트에 로드합니다.
- HL60 및 dHL60 세포 분석의 경우 20μL의 올리고마이신(25μM, 96웰 플레이트의 각 웰은 처음에 180μL의 분석 배지를 가지므로 최종 농도는 2.5μM)을 A 포트에 로드합니다. 22μL의 FCCP(15μM, 최종 농도: ~1.5μM)를 B 포트에 로드합니다. 24μL의 로테논/안티마이신 A 혼합물(10μM, 최종 농도: ~1μM)을 C 포트에 로드합니다.
참고: 포트 바닥을 건드리지 않고 포트의 약물 용액을 피펫팅합니다. 액체가 모세관력에 의해 유지되므로 누출을 방지하기 위해 적재 후 플레이트를 두드리지 마십시오. 배양 플레이트의 백그라운드 웰과 센서 카트리지의 포트에는 분석 배지 또는 샘플 웰에서와 동일한 시약 로딩 포트가 로드되어 배경 값에 대한 시약의 영향을 정규화합니다. 시약은 공기 트랩을 피하기 위해 교정제가 포함된 유틸리티 플레이트에서 카트리지를 들어 올리지 않고 각 포트에 추가해야 합니다. 그림 2와 같이 모든 웰의 마지막 포트를 매체로 채웁니다.

그림 2: 미토콘드리아 스트레스 분석 카트리지 및 주입 포트. 이미지는 미토콘드리아 스트레스 분석의 카트리지와 포트에 개별 약물/배지를 로드하는 것을 보여주는 확대 이미지를 보여줍니다. 약어: FCCP = 카르보닐시안화물 p-트리플루오로메톡시 페닐히드라존. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 미토콘드리아 스트레스 분석 실행
- 대사 분석기와 컴퓨터의 전원을 켜고 Wave 소프트웨어를 연 다음 히터 켜기 를 클릭하여 최소 37시간 전에 5°C에서 기계를 설정합니다. 온도에 도달하면 웨이브 소프트웨어의 왼쪽 하단 모서리에 준비가 표시됩니다.
- 소프트웨어에서 미토콘드리아 스트레스 분석 키트에 대한 템플릿을 엽니다. 상단 메뉴 표시줄에서 Group Definition(그룹 정의 )을 클릭합니다.
- 주입 전략, 전처리, 분석 배지 및 (생체 재료 사용) 세포 유형과 같은 각 정의를 왼쪽에 별도로 사전 설정합니다.
- 왼쪽의 주입 전략을 클릭한 다음 추가를 클릭하고 주입 조건의 이름을 인간 호중구/마우스 호중구/HL60으로 지정합니다. 각각을 클릭하여 포트 A-D를 선택하고 화합물 추가를 클릭하고 각 농도와 함께 올리고마이신/FCCP/로테논 안티마이신 A를 입력합니다(표 1).
- 왼쪽의 전처리를 클릭한 다음 추가를 클릭하고 별도로 CD18 및 Cell Tak으로 이름을 지정합니다. 왼쪽에 사용된 생체 재료를 클릭한 다음 추가를 클릭하고 이름을 인간 호중구, 마우스 호중구 및 시딩 밀도가 있는 HL60/dHL60으로 지정합니다.
- 그룹 추가(예: 인간 호중구 분석의 경우)를 클릭하고 그 기반이 되는 정의(예: 표 1에 따른 주입 전략 - 인간 호중구, CD18로 전처리 및 인간 호중구로서의 세포 유형)를 클릭하여 그룹을 정의합니다.
- 상단 메뉴에서 플레이트 맵을 클릭하면 왼쪽에는 정의가 있고 오른쪽에는 플레이트 맵이 있는 모든 그룹을 관찰할 수 있습니다. 끌어서 놓아 각 웰을 그룹에 추가하고 네 개의 모서리 웰을 배경 (기본값)으로 유지합니다.
- 상단 메뉴에서 프로토콜을 클릭하여 프로토콜을 설정하고 시간을 혼합 을 3분, 휴식 은 0분, 측정 은 7분으로 설정하여 기준선, 올리고마이신, FCCP, 로테논 및 안티마이신 A 혼합물의 세 주기를 정의합니다.
- Run Assay 페이지로 이동하여 참조용 프로젝트 요약 정보를 제공하고 Start Run(실행 시작)을 클릭합니다.
- 분석 완료 후 모든 결과가 저장되도록 파일을 저장할 위치를 지정합니다.
- 분석을 자동으로 로드한 후 트레이가 열릴 때까지 기다렸다가 센서 카트리지와 플레이트에 200μL의 보정제를 넣습니다(1.1단계). 카트리지 바코드 방향을 오른쪽으로 설정합니다. I'm ready(준비됨)를 클릭하여 보정을 실행하며, 이 작업에는 약 20분이 소요됩니다.
- 보정 후 트레이 열기를 클릭합니다. 플레이트를 셀 시드 플레이트로 교체하고 Load Cell Plate 를 클릭하여 분석을 계속합니다.
- 분석 완료 후 데이터가 자동으로 저장됩니다. 결과 보기를 클릭하고 스프레드시트 또는 기타 분석 소프트웨어 파일로 내보냅니다.
- 데이터를 그래프로 표시하고 분석합니다(그림 3 및 그림 4).
- 기초 미토콘드리아 호흡, 양성자 누출 관련 호흡, ATP 연결 호흡, 최대 호흡, 예비 호흡 용량 및 비 미토콘드리아 호흡을 포함한 호흡 매개 변수를 계산합니다 (그림 4A) 38,39,40,41.
- 올리고마이신을 주입하기 전에 OCR에서 로테논/안티마이신 A 혼합물을 첨가한 후 측정된 OCR 값을 빼서 기초 미토콘드리아 호흡을 계산합니다(그림 4A, a).
- 올리고마이신 주입 후 측정된 OCR 값에서 로테논/안티마이신 A 혼합물 주입 후 OCR 값을 빼서 양성자 누출 연관 호흡을 계산합니다(그림 4A,b).
- 기저 미토콘드리아 호흡과 양성자 누출 연결 호흡의 차이를 계산하여 ATP 연결 호흡을 추정합니다. 올리고마이신 주입 전 첫 번째 OCR 값에서 올리고마이신 주입 후 측정된 첫 번째 OCR 값을 뺍니다(그림 4A,c).
- 최대 호흡은 FCCP를 추가한 후 세포가 달성할 수 있는 최대 호흡수입니다. FCCP 주입 후 측정된 OCR 값에서 로테논/안티마이신 A 혼합물 주입 후 OCR 값을 빼서 계산합니다(그림 4A,d).
- 예비 호흡 용량은 OXPHOS를 통해 더 높은 에너지 수요를 충족하기 위한 세포의 용량을 나타냅니다. 최대 호흡과 기초 미토콘드리아 호흡의 차이를 찾아 계산하십시오 (그림 4A, e).
- 비미토콘드리아 호흡은 비미토콘드리아 공급원이 소비하는 산소의 양입니다. 로테논/안티마이신 A 혼합물을 첨가한 후 이를 측정합니다(그림 4A,f).
- 미분화 및 분화된 HL60 세포의 다양한 호흡 매개변수를 비교하기 위해 Student's t-test를 사용하여 통계 분석을 수행합니다. p < 0.05가 통계적으로 유의하다고 생각하십시오.
참고: OCR 또는 ECAR 값이 0 미만인 반복실험은 샘플 준비, 화합물 주입 또는 측정에서 오류로 간주됩니다. 향후 분석에서 제외됩니다.
결과
마우스 호중구(도 3A), 인간 호중구(도 3B) 및 미분화 및 분화된 HL60 세포(도 3C)의 혼합물의 올리고마이신, FCCP 및 로테논/안티마이신 A에 대한 반응으로 미토콘드리아 호흡 변화를 나타내는 대표적인 OCR 동역학이 도시된다. 모든 세포에서, 올리고마이신 처리는 ATP 합성효소의 양성자 채널을 억제함으로써 OCR 값을 감소시키고; FCCP 치...
토론
대사 세포외 플럭스 분석기를 사용하여 호중구의 미토콘드리아 호흡을 측정하는 표준 절차는 세포 수, 세포 성장 및 생존력을 포함한 많은 요인에 의해 제한됩니다. 각 화합물 농도는 이 분석에서 세포의 유형과 공급원에 따라 다릅니다. 올리고마이신과 로테논/안티마이신 A는 대부분의 세포 유형에서 비슷한 농도로 주로 사용됩니다. 그러나, FCCP에 의해 유도된 최대 호흡수는 상이한 세포들 사?...
공개
저자는 경쟁적인 재정적 이익을 선언하지 않습니다.
감사의 말
대사 세포외 플럭스 분석기 사용에 대한 교육을 제공한 UConn Health 면역학과의 Anthony T. Vella 박사와 Federica Aglianoin 박사, 기기를 지원해 주신 UConn Health 면역학과의 Lynn Puddington 박사에게 감사드립니다. 이 원고의 과학적 저술 및 편집에 도움을 준 UConn School of Medicine의 Geneva Hargis 박사에게 감사드립니다. 이 연구는 국립 보건원 (National Institutes of Health), 국립 심장, 폐 및 혈액 연구소 (National Heart, Lung, and Blood Institute, R01HL145454), 국립 일반 의학 연구소 (National Institute of General Medical Sciences, R35GM147713 and P20GM139763), UConn Health의 창업 기금 및 미국 면역 학자 협회 (American Association of Immunologists)의 경력 재진입 펠로우쉽.
자료
| Name | Company | Catalog Number | Comments |
| 37 °C non-CO2 incubator | Precision | Economy Model 2EG | Instrument |
| Biorender | Software Application | ||
| Centrifuge | Eppendorf | Model 5810R | Instrument |
| Corning Cell-Tak Cell and Tissue Adhesive | Corning | 102416-100 | Reagent |
| EasySep Magnet | STEMCELL | 18000 | Magnet |
| EasySepMouse Neutrophil Enrichment kit | STEMCELL | 19762A | Reagents |
| Graphpad Prism 9 | Software Application | ||
| Human Serum Albumin Solution (25%) | GeminiBio | 800-120 | Reagents |
| Ketamine (VetaKet) | DAILYMED | NDC 59399-114-10 | Anesthetic |
| PBS | Cytiva | SH30256.01 | Reagents |
| Plate buckets | Eppendorf | UL155 | Accessory |
| PolymorphPrep | PROGEN | 1895 (previous 1114683) | polysaccharide solution |
| Purified mouse anti-human CD18 antibody | Biolegend | 302102 | Clone TS1/18 |
| RPMI 1640 Medium | Gibco | 11-875-093 | Reagents |
| Seahorse metabolic extracellular flux analyzer | Agilent | XFe96 | Instrument |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | mitochondrial stress test Kit |
| Swing-bucket rotor | Eppendorf | A-4-62 | Rotor |
| Vactrap 2 Vacum Trap | Fox Lifesciences | 3052101-FLS | Instrument |
| Wave | Software Application | ||
| XF 1.0 M Glucose Solution | Agilent | 103577-100 | Reagent |
| XF 100 mM Pyruvate Solution | Agilent | 103578-100 | Reagent |
| XF 200 mM Glutamine Solution | Agilent | 103579-100 | Reagent |
| XF DMEM medium | Agilent | 103575-100 | Reagent |
| XFe96 FluxPak | Agilent | 102601-100 | Material |
| Xylazine (AnaSed Injection) | DAILYMED | NDC 59399-110-20 | Anesthetic |
참고문헌
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Noguchi, M., Kasahara, A. Mitochondrial dynamics coordinate cell differentiation. Biochemical and Biophysical Research Communications. 500 (1), 59-64 (2018).
- Zhu, L., et al. Correlation between mitochondrial dysfunction, cardiovascular diseases, and traditional Chinese medicine. Evidence-Based Complementary and Alternative Medicine. 2020, e2902136 (2020).
- Kaarniranta, K., et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Progress in Retinal and Eye Research. 79, 100858 (2020).
- Onyango, I. G., Khan, S. M., Bennett, J. P. Mitochondria in the pathophysiology of Alzheimer's and Parkinson's diseases. Frontiers in Bioscience. 22 (5), 854-872 (2017).
- Loiseau, D., et al. Mitochondrial coupling defect in Charcot-Marie-Tooth type 2A disease. Annals of Neurology. 61 (4), 315-323 (2007).
- Zucker-Franklin, D. Electron microscopic studies of human granulocytes: structural variations related to function. Seminars in Hematology. 5 (2), 109-133 (1968).
- Karnovsky, M. L. The metabolism of leukocytes. Seminars in Hematology. 5 (2), 156-165 (1968).
- Bao, Y., et al. mTOR and differential activation of mitochondria orchestrate neutrophil chemotaxis. The Journal of Cell Biology. 210 (7), 1153-1164 (2015).
- Fossati, G., et al. The mitochondrial network of human neutrophils: role in chemotaxis, phagocytosis, respiratory burst activation, and commitment to apoptosis. Journal of Immunology. 170 (4), 1964-1972 (2003).
- Pryde, J. G., Walker, A., Rossi, A. G., Hannah, S., Haslett, C. Temperature-dependent arrest of neutrophil apoptosis. Failure of Bax insertion into mitochondria at 15 degrees C prevents the release of cytochrome c. The Journal of Biological Chemistry. 275 (43), 33574-33584 (2000).
- Maianski, N. A., Mul, F. P. J., van Buul, J. D., Roos, D., Kuijpers, T. W. Granulocyte colony-stimulating factor inhibits the mitochondria-dependent activation of caspase-3 in neutrophils. Blood. 99 (2), 672-679 (2002).
- Bao, Y., et al. Mitochondria regulate neutrophil activation by generating ATP for autocrine purinergic signaling. The Journal of Biological Chemistry. 289 (39), 26794-26803 (2014).
- Chouchani, E. T., et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS. Nature. 515 (7527), 431-435 (2014).
- Hayashi, G., Cortopassi, G. Oxidative stress in inherited mitochondrial diseases. Free Radical Biology and Medicine. 88, 10-17 (2015).
- Mailloux, R. J. An update on mitochondrial reactive oxygen species production. Antioxidants. 9 (6), 472 (2020).
- Abuaita, B. H., et al. The IRE1α stress signaling axis is a key regulator of neutrophil antimicrobial effector function. Journal of Immunology. 207 (1), 210-220 (2021).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nature Medicine. 22 (2), 146-153 (2016).
- Douda, D. N., Khan, M. A., Grasemann, H., Palaniyar, N. SK3 channel and mitochondrial ROS mediate NADPH oxidase-independent NETosis induced by calcium influx. Proceedings of the National Academy of Sciencesa. 112 (9), 2817-2822 (2015).
- Monteith, A. J., et al. Altered mitochondrial homeostasis during systemic lupus erythematosus impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Journal of Immunology. 208 (2), 454-463 (2022).
- Monteith, A. J., Miller, J. M., Beavers, W. N., Juttukonda, L. J., Skaar, E. P. Increased dietary manganese impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Infection and Immunity. 90 (3), 0068521 (2022).
- Monteith, A. J., et al. Mitochondrial calcium uniporter affects neutrophil bactericidal activity during Staphylococcus aureus infection. Infection and Immunity. 90 (2), 0055121 (2022).
- Cao, Z., et al. Roles of mitochondria in neutrophils. Frontiers in Immunology. 13, 934444 (2022).
- Papayannopoulos, V., Metzler, K. D., Hakkim, A., Zychlinsky, A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. The Journal of Cell Biology. 191 (3), 677-691 (2010).
- Fan, Z., Ley, K. Developing neutrophils must eat…themselves. Immunity. 47 (3), 393-395 (2017).
- Riffelmacher, T., et al. Autophagy-dependent generation of free fatty acids is critical for normal neutrophil differentiation. Immunity. 47 (3), 466-480 (2017).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), e53936 (2016).
- Swamydas, M., Isolation Lionakis, M. S. purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments. (77), e50586 (2013).
- Gerner, M. C., et al. Packed red blood cells inhibit T-cell activation via ROS-dependent signaling pathways. The Journal of Biological Chemistry. 296, 100487 (2021).
- Zhang, Z. -. W., et al. Red blood cell extrudes nucleus and mitochondria against oxidative stress. IUBMB Life. 63 (7), 560-565 (2011).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111, 1-16 (2015).
- Hearne, A., Chen, H., Monarchino, A., Wiseman, J. S. Oligomycin-induced proton uncoupling. Toxicology In Vitro. 67, 104907 (2020).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-Protocol. 8 (10), e2850 (2018).
- Nath, S. The molecular mechanism of ATP synthesis by F1F0-ATP synthase: a scrutiny of the major possibilities. Advances in Biochemical Engineering/Biotechnology. 74, 65-98 (2002).
- Heinz, S., et al. Mechanistic investigations of the mitochondrial complex I inhibitor rotenone in the context of pharmacological and safety evaluation. Scientific Reports. 7 (1), 45465 (2017).
- Hytti, M., et al. Antimycin A-induced mitochondrial damage causes human RPE cell death despite activation of autophagy. Oxidative Medicine and Cellular Longevity. 2019, 1583656 (2019).
- Malecki, M., Kamrad, S., Ralser, M., Bähler, J. Mitochondrial respiration is required to provide amino acids during fermentative proliferation of fission yeast. EMBO Reports. 21 (11), e50845 (2020).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. The FASEB Journal. 34 (10), 13106-13124 (2020).
- Nicholas, D., et al. Advances in the quantification of mitochondrial function in primary human immune cells through extracellular flux analysis. PLoS One. 12 (2), e0170975 (2017).
- Tur, J., et al. Mitofusin 2 in macrophages links mitochondrial ROS production, cytokine release, phagocytosis, autophagy, and bactericidal activity. Cell Reports. 32 (8), 108079 (2020).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Wettmarshausen, J., Perocchi, F. Assessing calcium-stimulated mitochondrial bioenergetics using the seahorse XF96 analyzer. Methods in Molecular Biology. 1925, 197-222 (2019).
- Forkink, M., et al. Mitochondrial hyperpolarization during chronic complex I inhibition is sustained by low activity of complex II, III, IV and V. Biochimica et Biophysica Acta. 1837 (8), 1247-1256 (2014).
- . Methods for Reducing Cell Growth Edge Effects in Agilent Seahorse XF Cell Culture Microplates Available from: https://www.agilent.com/cs/library/usermanuals/public/user-manual-methods-for-reducing-cell-growth-edge-effect-cell-analysis-5994-0240en-agilent.pdf (2019)
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. Journal of Visualized Experiments. (54), e2899 (2011).
- Normalisation of Seahorse XFe96 metabolic assaysto cell number with Hoechst stain using well-scan mode on the CLARIOstar Plus. BMG Labtech Available from: https://www.bmglabtech.com/cn/normalisation-of-seahorse-xfe96-metabolic-assays-to-cell-number-with-hoechst-stain/ (2020)
- Yetkin-Arik, B., et al. The role of glycolysis and mitochondrial respiration in the formation and functioning of endothelial tip cells during angiogenesis. Scientific Reports. 9 (1), 12608 (2019).
- Jastroch, M., Divakaruni, A. S., Mookerjee, S., Treberg, J. R., Brand, M. D. Mitochondrial proton and electron leaks. Essays in Biochemistry. 47, 53-67 (2010).
- Jandl, R. C., et al. Termination of the respiratory burst in human neutrophils. The Journal of Clinical Investigation. 61 (5), 1176-1185 (1978).
- Azevedo, E. P., et al. A metabolic shift toward pentose phosphate pathway is necessary for amyloid fibril- and phorbol 12-myristate 13-acetate-induced neutrophil extracellular trap (NET) formation. The Journal of Biological Chemistry. 290 (36), 22174-22183 (2015).
- Six, E., et al. AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages. Cell Death & Disease. 6 (8), e1856 (2015).
- Kumar, S., Dikshit, M. Metabolic insight of neutrophils in health and disease. Frontiers in Immunology. 10, 2099 (2019).
- Rodríguez-Espinosa, O., Rojas-Espinosa, O., Moreno-Altamirano, M. M. B., López-Villegas, E. O., Sánchez-García, F. J. Metabolic requirements for neutrophil extracellular traps formation. Immunology. 145 (2), 213-224 (2015).
- Invernizzi, F., et al. Microscale oxygraphy reveals OXPHOS impairment in MRC mutant cells. Mitochondrion. 12 (2), 328-335 (2012).
- Zenaro, E., et al. Neutrophils promote Alzheimer's disease-like pathology and cognitive decline via LFA-1 integrin. Nature Medicine. 21 (8), 880-886 (2015).
- Maianski, N. A., et al. Functional characterization of mitochondria in neutrophils: a role restricted to apoptosis. Cell Death and Differentiation. 11 (2), 143-153 (2004).
- Bergman, O., Ben-Shachar, D. Mitochondrial oxidative phosphorylation system (OXPHOS) deficits in schizophrenia. Canadian Journal of Psychiatry. 61 (8), 457-469 (2016).
- Zhou, W., Qu, J., Xie, S., Sun, Y., Yao, H. Mitochondrial dysfunction in chronic respiratory diseases: implications for the pathogenesis and potential therapeutics. Oxidative Medicine and Cellular Longevity. 2021, 5188306 (2021).
- Hirano, M., Emmanuele, V., Quinzii, C. M. Emerging therapies for mitochondrial diseases. Essays in Biochemistry. 62 (3), 467-481 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유