A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידה בזמן אמת של הפרופיל הביו-אנרגטי המיטוכונדריאלי של נויטרופילים
In This Article
Summary
אנו מתארים פרוטוקולים הדרגתיים המודדים את הנשימה המיטוכונדריאלית של נויטרופילים עכבריים ואנושיים ותאי HL60 באמצעות מנתח שטף חוץ-תאי מטבולי.
Abstract
נויטרופילים הם קו ההגנה הראשון והלויקוציטים הנפוצים ביותר בבני אדם. תאים משפיעים אלה מבצעים פונקציות כגון פגוציטוזה ופרץ חמצוני, ויוצרים מלכודות נויטרופילים חוץ-תאיות (NETs) לסילוק מיקרוביאלי. תובנות חדשות על הפעילות המטבולית של נויטרופילים מאתגרות את הרעיון המוקדם שהם מסתמכים בעיקר על גליקוליזה. מדידה מדויקת של פעילויות מטבוליות יכולה לחשוף דרישות מטבוליות שונות של נויטרופילים, כולל מחזור חומצה טריקרבוקסילית (TCA) (הידוע גם בשם מחזור קרבס), זרחן חמצוני (OXPHOS), מסלול פוספט פנטוז (PPP) וחמצון חומצות שומן (FAO) בתנאים פיזיולוגיים ובמצבי מחלה. מאמר זה מתאר פרוטוקול שלב אחר שלב ודרישות מוקדמות למדידת קצב צריכת חמצן (OCR) כאינדיקטור לנשימה מיטוכונדריאלית על נויטרופילים שמקורם במח עצם של עכבר, נויטרופילים שמקורם בדם אנושי וקו תאים דמוי נויטרופילים מסוג HL60, תוך שימוש בניתוח שטף מטבולי על מנתח שטף חוץ-תאי מטבולי. שיטה זו יכולה לשמש לכימות התפקודים המיטוכונדריאליים של נויטרופילים בתנאים נורמליים ומחלות.
Introduction
מיטוכונדריה ממלאים תפקיד מרכזי בביו-אנרגטיקה של תאים, אשר מייצרת אדנוזין טריפוספט (ATP) על-ידי זרחן חמצוני (OXPHOS). בנוסף לכך, תפקיד המיטוכונדריה משתרע על יצירה וניקוי רעלים של מיני חמצן תגובתי, ויסות סידן ציטופלזמי ומיטוכונדריאלי, סינתזה תאית, קטבוליזם והובלת מטבוליטים בתוך התא1. נשימה מיטוכונדריאלית חיונית בכל התאים, שכן תפקוד לקוי שלהם יכול לגרום לבעיות מטבוליות 2, כולל מחלות לב וכלי דם3 ומגוון רחב של מחלות נוירודגנרטיביות, כגון ניוון מקולרי הקשור לגיל4, פרקינסון ואלצהיימר5, ומחלת שארקו-מארי-שן2 A (CMT2A)6.
מחקרים מיקרוסקופיים אלקטרונים על נויטרופילים גילו שיש יחסית מעט מיטוכונדריה7, והם מסתמכים במידה רבה על גליקוליזה לייצור האנרגיה שלהם מכיוון שקצב הנשימה של המיטוכונדריה נמוך מאוד8. עם זאת, מיטוכונדריה חיוניים לתפקודי נויטרופילים, כגון כימוטקסיס9 ואפופטוזיס10,11,12. מחקר קודם חשף רשת מיטוכונדריאלית מורכבת בנויטרופילים אנושיים עם פוטנציאל ממברנה גבוה. אובדן פוטנציאלי של קרום המיטוכונדריה הוא אינדיקטור מוקדם לאפופטוזיסנויטרופילים 10. טיפול במצמד מיטוכונדריאלי קרבוניל ציאניד m-כלורופניל הידרזון (CCCP) הראה עיכוב משמעותי בכימוטקסיס, יחד עם שינוי במורפולוגיה המיטוכונדריאלית 9,10.
למרות שמקור האנרגיה העיקרי לנויטרופילים הוא גליקוליזה, מיטוכונדריה מספקים את ה-ATP שמתחיל את הפעלת הנויטרופילים על ידי תדלוק השלב הראשון של איתות פורינרגי, אשר מגביר את איתות Ca2+, מגביר את ייצור ה-ATP במיטוכונדריה ויוזם תגובות תפקודיות של נויטרופילים13. תפקוד לקוי של שרשרת הנשימה המיטוכונדריאלית גורם לייצור יתר של מיני חמצן תגובתי רעיל (ROS) ומוביל לנזקים פתוגניים14,15,16. NETosis, שהוא תהליך של יצירת מלכודות נויטרופילים חוץ-תאיות (NETs), הוא תכונה קריטית של נויטרופילים המסייעת להם להילחם בפתוגנים17 ותורמת למצבים פתולוגיים רבים, כולל סרטן, פקקת והפרעות אוטואימוניות18. ROS שמקורו במיטוכונדריה תורם ל-NETosis19, DNA מיטוכונדריאלי יכול להיות מרכיב של NETosis18, והומאוסטזיס מיטוכונדריאלי שונה פוגע ב-NETosis 20,21,22,23,24. יתר על כן, במהלך התמיינות או הבשלה נורמלית, תכנות מחדש מטבולי של נויטרופילים מתהפך על ידי הגבלת הפעילות הגליקוליטית, והם עוסקים בנשימה מיטוכונדריאלית ומגייסים שומנים תוך תאיים25,26.
מנתח השטף החוץ-תאי המטבולי יכול לנטר ולכמת ברציפות נשימה מיטוכונדריאלית של תאים חיים וגליקוליזה. המנתח משתמש במחסנית חיישן בפורמט צלחת 96 בארות ובשני פלואורופורים כדי לכמת את ריכוז החמצן (O2) ואת שינויי ה- pH. מחסנית החיישן נמצאת מעל חד-שכבת התא במהלך הבדיקה ויוצרת מיקרו-תא בגובה ~200 ננומטר. חבילות הסיבים האופטיים באנלייזר משמשות כדי לעורר את הפלואורופורים ולזהות את השינויים בעוצמת הפלואורסצנט. שינויים בזמן אמת בריכוז O2 וב- pH מחושבים באופן אוטומטי ומוצגים כקצב צריכת חמצן (OCR) וקצב החמצה חוץ-תאי (ECAR). ישנן ארבע יציאות במחסנית החיישן המאפשרות טעינה של עד ארבע תרכובות לכל באר במהלך מדידות הבדיקה. פרוטוקול זה מתמקד בכימות הנשימה המיטוכונדריאלית של נויטרופילים עכבריים ואנושיים, כמו גם תאי HL60 דמויי נויטרופילים, באמצעות מנתח שטף חוץ-תאי מטבולי.
Protocol
דגימות דם מלא הופרינו נלקחו מתורמים אנושיים בריאים לאחר קבלת הסכמה מדעת, כפי שאושר על ידי מועצת הביקורת המוסדית של UConn Health בהתאם להצהרת הלסינקי. כל הניסויים בבעלי חיים בוצעו בהתאם להנחיות הוועדה לטיפול ושימוש בבעלי חיים מוסדיים של UConn Health (IACUC), והאישור לשימוש במכרסמים התקבל מה-UConn Health IACUC בהתאם לקריטריונים המפורטים במדריך לטיפול ושימוש בחיות מעבדה של המכונים הלאומיים לבריאות. במחקר זה נעשה שימוש בעכברי C57BL/6 זכרים בגיל 6 שבועות.
1. הכנת צלחת 96 בארות לבדיקת שטף חוץ תאי מטבולי
- מחסנית חיישן ארוזה על גבי צלחת 96 בארות שתוכננה במיוחד עבור בדיקת שטף חוץ-תאי מטבולי. יש לחות למחסנית על ידי הרמתה בזהירות, והכנס 200 μL/well של מדיום כיול לכל באר של הצלחת שמתחתיה. הניחו את המחסנית מעל הצלחת עם כיול באינקובטור ללא CO2, לח, 37°C למשך הלילה כדי להתייבש.
- בהתאם לסוג התא, השתמש בציפוי ספציפי לצלחת התרבית כדי להבטיח הידבקות התא. עבור נויטרופילים אנושיים - תאי HL60 בלתי ממוינים ומובחנים - מצפים את הצלחת בת 96 הבארות במי מלח סטריליים חוצצים פוספט (PBS) המכילה 50 μL של 5 מיקרוגרם / מ"ל עכבר מטוהר נגד נוגדן CD18 אנטי אנושי (Clone TS1/18) ב 4 ° C למשך הלילה. עבור נויטרופילים של עכברים, צפו את הצלחת בעלת 96 הקידוחים ב-25 μL של 22.4 מיקרוגרם/מ"ל Cell Tak ב-pH 8.0 אינץ' 0.1 M NaHCO3 בטמפרטורת החדר (RT) למשך 20 דקות.
- לשטוף את הצלחות עם 200 μL של PBS סטרילי פעמיים.
- הוסף תווך שלם לבארות הפינתיות (A1, A12, H1 ו- H12) של לוח תרבית התא (ללא תאים) לתיקון רקע בלוחות תרבית התא בעת הזריעה.
הערה: אידוי במהלך ציפוי וכיול עלול להשפיע על נפח מדיית הכיול והנורמליזציה. השתמשו במגש או בתא עם רקמה סטרילית רטובה במים והניחו את הצלחת עם הכיוור מעליה כדי למנוע אידוי.
2. הכנה וזריעה של תאים
- הכנת מדיום בדיקה
- הכן מדיום בדיקה על ידי הוספת 1 mM פירובט, 10 mM גלוקוז, ו 2 mM גלוטמין למדיום הנשר המעובד של Dulbecco (DMEM).
- בידוד נויטרופילים של עכבר ממח עצם
- בודד נויטרופילים של עכבר ממח עצם באמצעות ערכת העשרת נויטרופילים של עכבר, בהתאם להוראות היצרן.
- מרדימים את העכברים על ידי הזרקה תוך צפקית (כלומר הזרקה של קטמין (125 מ"ג/ק"ג) וקסילזין (12.5 מ"ג/ק"ג) ולאחר מכן מרדימים את העכברים על ידי נקע צוואר הרחם.
- קצור את עצם הירך ואת tibias, כפי שתואר קודם27. בקצרה, לחתוך את העור כדי לחשוף את הרגל עם השרירים. חתכו את מפרק הירך כדי להסיר את הרגל מהגוף. לאחר מכן, להסיר את השרירים כדי לאסוף את עצם הירך ואת השוקה.
- חותכים את הקצוות הקטנים יותר של עצם הירך והטיביאס. החזקת הקצוות החתוכים כלפי מטה, הניחו אותם בצינור צנטריפוגה של 0.5 מ"ל עם שני חורים מנוקבים במחט מזרק 25 G בתחתית, והכניסו את הצינור בנפח 0.5 מ"ל לתוך צינור צנטריפוגה של 1.5 מ"ל (איור 1A). הוסף 50 μL של PBS לתוך צינור 0.5 מ"ל כדי למנוע התייבשות של תאי מח עצם.
- צנטריפוגה בעוצמה של 5,900 × גרם ב-RT למשך 15 שניות כדי לאסוף את מח העצם בתחתית צינור ה-1.5 מ"ל. להשעות מחדש את תאי מח העצם עם 1 מ"ל של DMEM. מוסיפים 50 μL של סרום חולדות מהערכה, מערבבים בעדינות על ידי פיפטינג, ומעבירים את תרחיף התאים למבחנה בתרבית פוליסטירן 5 מ"ל.
- הוסיפו 50 מיקרוליטר קוקטייל העשרה מערכת העשרת הנויטרופילים של העכבר ודגרו במשך 15 דקות ב-RT. צנטריפוגה ב-300 × גרם ב-RT למשך 5 דקות.
- להשהות מחדש את התאים עם 1 מ"ל DMEM, להוסיף 50 μL של קוקטייל בחירת ביוטין מהערכה, לערבב בעדינות על ידי pipetting, ולדגור במשך 15 דקות ב RT.
- הוסיפו 150 μL של חלקיקים מגנטיים מערבולות מהערכה, ערבבו בעדינות על ידי פיפטינג ודגרו במשך 10 דקות ב-RT.
- הוסף ~ 1.3 מ"ל DMEM, ערבב בעדינות על ידי פיפטינג, מקם את הצינור במגנט למשך 3 דקות, והעבר את הסופרנאטנט המכיל נויטרופילים מטוהרים של עכבר למבחנה חדשה של תרבית פוליסטירן 5 מ"ל על ידי היפוך הצינור המקורי יחד עם המגנט.
- צנטריפוגה ב 300 × גרם ב RT במשך 5 דקות. לאחר הסרת supernatant על ידי שאיפת ואקום, להשעות מחדש את התאים עם 1 מ"ל של מדיום המבחן.
- לספור את התאים באופן ידני באמצעות hemocytometer.
- התאם את צפיפות התא ל 1.1 × 106 תאים / מ"ל על ידי הוספת מדיום בדיקה, זרע 180 μL של תרחיף נויטרופילים העכבר (2 × 105 תאים) לכל באר לתוך צלחת 96 בארות מוכן (שלבים 1.2-1.4), וצנטריפוגה את הצלחת ב 300 × גרם ב RT במשך 3 דקות ללא בלימה כדי להבטיח היצמדות נאותה של התאים בתחתית הצלחת.
- לדגור את הצלחת באינקובטור שאינו CO2, לח, 37 מעלות צלזיוס למשך שעה אחת כדי לאזן מראש את התאים עם מדיום הבדיקה.
הערה: טוהר הנויטרופילים הוא קריטי לבדיקה מכיוון שזו הטיה פוטנציאלית. טוהר בידוד הנויטרופילים בעכבר הוא 69.9%-88.7% לפי פרוטוקול זה. ישנן שיטות אחרות לבידוד נויטרופילים ממח עצם העכבר, כגון צנטריפוגה הדרגתיתצפיפות 28. קיימות גם ערכות בידוד נויטרופילים חלופיות מספקים אחרים, המבוססות על הברירה המגנטית השלילית באמצעות נוגדנים חד-שבטיים כנגד אנטיגנים שאינם באים לידי ביטוי בנויטרופילים.
- בידוד נויטרופילים אנושיים מדם היקפי
- הוסף 8 מ"ל של תמיסת פוליסכריד לתוך צינור צנטריפוגה 15 מ"ל, ולאחר מכן שכבה מעל 4 מ"ל של דם היקפי על גבי תמיסת פוליסכריד ללא ערבוב.
- צנטריפוגה ב-550 × גרם ב-20°C למשך 30 דקות. הפוך את הרוטור להאט ב 1.
הערה: זמן הפרדת הנויטרופילים עשוי להשתנות בין תורמים. זה מינימום של 30 דקות, ו 10-20 דקות נוספות עשוי להיות נחוץ אם ההפרדה נויטרופילים נכשלת. - התבוננו בהפרדה של פלזמה/טסיות דם ותאים חד-גרעיניים לאחר הצנטריפוגה, כפי שמוצג באיור 1B. הסר בזהירות את הנוזל הצהוב העליון (פלזמה וטסיות דם) ואת הרצועה העכורה העליונה (תאים חד-גרעיניים) מבלי להפריע לרצועה העכורה התחתונה (נויטרופילים) באמצעות פיפטה של 1 מ"ל.
- אסוף את הרצועה העכורה התחתונה ו~ 3-4 מ"ל של הנוזל השקוף למטה לתוך צינור צנטריפוגה חדש של 15 מ"ל המכיל 10 מ"ל של PBS.
- צנטריפוגה ב 400 × גרם ב 20 ° C למשך 10 דקות ולהסיר את supernatant על ידי שאיפת ואקום.
- להשעות מחדש את התאים עם 5 מ"ל של PBS וצנטריפוגה ב 300 × גרם ב 20 ° C במשך 5 דקות.
- לאחר הסרת supernatant, להשעות מחדש את התאים עם 1 מ"ל של מדיום המבחן.
- לספור את התאים באופן ידני באמצעות hemocytometer.
הערה: מאחר שלאריתרוציטים בדם אין מיטוכונדריה, זיהום אריתרוציטים אינו משפיע על בדיקת המאמץ המיטוכונדריאלי ומונע הפעלת נויטרופילים / פריימינג29,30. אריתרוציטים צריכים להיות lysed במהלך ספירת תאים כדי לקבל ריכוז נויטרופילים מדויק. הוסף 10 μL של תרחיף התא ל 891 μL של מים deionized עבור 10-30 s כדי lyse את אריתרוציטים, ולאחר מכן להוסיף 99 μL של 10x PBS כדי לאזן את הלחץ אוסמוטי, הימנעות ליזה של נויטרופילים. - התאם את צפיפות התא ל 2.2 × 106 תאים / מ"ל על ידי הוספת מדיום בדיקה, זרע 180 μL של נויטרופילים אנושיים (~ 4 × 105) לכל באר לתוך צלחת 96 באר מוכן, וצנטריפוגה את הצלחת ב 300 × גרם ב RT במשך 3 דקות ללא בלימה כדי להבטיח היצמדות נאותה של התאים בתחתית הצלחת.
- לדגור על הצלחת באינקובטור שאינו CO2, לח, 37 מעלות צלזיוס למשך שעה אחת כדי לאזן מראש את התאים עם מדיום הבדיקה.
הערה: טוהר הנויטרופילים הוא קריטי לבדיקה מכיוון שזו הטיה פוטנציאלית. טוהר בידוד הנויטרופילים האנושיים הוא 86.6%-96.8%. ישנן שיטות אחרות לבידוד נויטרופילים מדם אנושי, כולל בידוד פרקול וכן שילוב של בידוד פיקול ושקיעת דקסטרן31.
- תרבית תאים HL60 והתמיינות מכוונת נויטרופילים
- שמור על תאי HL60 במכון הזיכרון רוזוול פארק (RPMI)-1640 בינוני המכיל 10% סרום בקר עוברי (FBS), 100 מיקרוגרם / מ"ל פניצילין, 100 מיקרוגרם / מ"ל סטרפטומיצין, ו 250 ננוגרם / מ"ל אמפוטריצין B ב 37 ° C ו 5% CO2.
- עבור התמיינות מכוונת נויטרופילים, לשמור על תאי HL60 (תאים מרחפים) בבקבוק T25 בצפיפות של 1 × 105 תאים/מ"ל בתווך RPMI-1640 המכיל 10% FBS, 100 מיקרוגרם/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 250 ננוגרם/מ"ל אמפוטריצין B, ו-1.3% דימתיל סולפוקסיד (DMSO) ב-37°C ו-5% CO2 למשך 6 ימים.
- ביום הבדיקה, ספרו את התאים באופן ידני באמצעות המוציטומטר, תאי HL60 ממוינים או לא ממוינים ב- 300 × גרם ב- RT למשך 5 דקות, שטפו עם DMEM פעם אחת, והשעו מחדש את התאים עם מדיום הבדיקה כדי לקבל צפיפות תאים של 1.39 × 106 תאים / מ"ל.
- זרע 180 μL של תאי HL60 ממוינים או לא ממוינים (~ 2.5 × 105) לכל באר לתוך צלחת מוכן 96 בארות צנטריפוגה הצלחת ב 300 × גרם ב RT במשך 3 דקות ללא בלימה כדי להבטיח היצמדות נאותה של התאים בתחתית הצלחת.
- לדגור את הצלחת באינקובטור שאינו CO2, לח, 37 מעלות צלזיוס למשך שעה אחת כדי לאזן מראש את התאים עם מדיום הבדיקה.
הערה: אשר את ההיצמדות המלאה של תאים באמצעות מיקרוסקופ לפני השלב הבא.
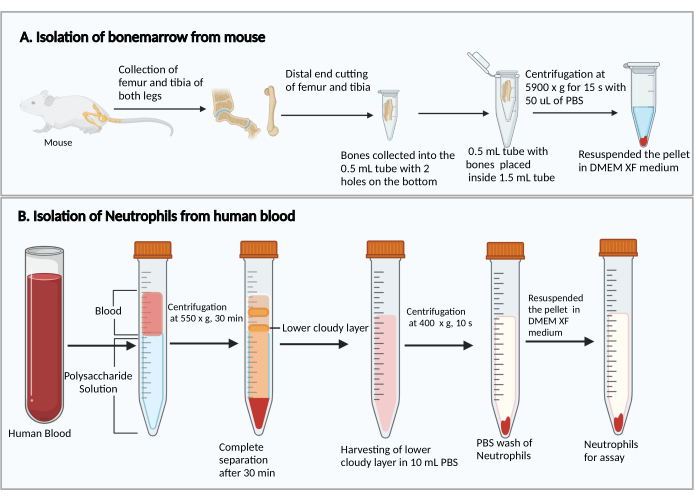
איור 1: תרשים סכמטי של בידוד תאי מח עצם ונויטרופילים. (A) קצירת תאי מח עצם מעכבר ו-(B) בידוד נויטרופילים מדם אנושי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| סוג תא | תאים לכל באר | תרכובות/ריאגנטים | ריכוז פתרון עבודה | נפח הזרקה ליציאות | ריכוז סופי בבארות |
| נויטרופילים של עכברים | 2 × 105 | אוליגומיצין | 25 מיקרומטר | 20 מיקרוליטר | 2.5 מיקרומטר |
| FCCP | 7.5 מיקרומטר | 17.6 מיקרוליטר | 0.61 מיקרומטר | ||
| תערובת רוטנון אנטימיצין A | 10 מיקרומטר | 24 מיקרוליטר | 1 מיקרומטר | ||
| נויטרופילים אנושיים | 4 × 105 | אוליגומיצין | 10 מיקרומטר | 20 מיקרוליטר | 1 מיקרומטר |
| FCCP | 12.5 מיקרומטר | 22 מיקרוליטר | 1.25 מיקרומטר | ||
| תערובת רוטנון אנטימיצין A | 10 מיקרומטר | 24 מיקרוליטר | 1 מיקרומטר | ||
| תאי HL60 לא ממוינים או ממוינים | 2.5 × 105 | אוליגומיצין | 25 מיקרומטר | 20 מיקרוליטר | 2.5 מיקרומטר |
| FCCP | 15 מיקרומטר | 22 מיקרוליטר | 1.5 מיקרומטר | ||
| תערובת רוטנון אנטימיצין A | 10 מיקרומטר | 24 מיקרוליטר | 1 מיקרומטר |
טבלה 1: מספרי תאים וריכוזי מגיבים עבור מבחן המאמץ המיטוכונדריאלי.
3. הכנת תרכובות בערכה לבדיקת מאמץ מיטוכונדריאלי
- פתחו את ערכת בדיקת המאמץ המיטוכונדריאלי והכינו את הריאגנטים.
הערה: ריכוזי תמיסות העבודה השונות, נפח ההזרקה לבארות והריכוזים הסופיים בבארות של אוליגומיצין, קרבוניל-ציאניד p-טריפלואורומתוקסי פנילהידראזון (FCCP) ורוטנון/אנטימיצין תערובת המשמשת לנויטרופילים של עכברים, נויטרופילים אנושיים ותאי HL60 מוצגים בטבלה 1.- הכן תמיסת מלאי אוליגומיצין על ידי בנייה מחדש של אוליגומיצין עם 630 מיקרוליטר של מדיום בדיקה כדי להשיג תמיסת מלאי של 100 מיקרומטר.
הערה: מומלץ להשתמש בפתרון המלאי באותו היום.- הכן פתרון עבודה אוליגומיצין עבור נויטרופילים עכבר ובדיקות תאים HL60 על ידי ערבוב 630 μL של תמיסת מלאי עם 1,890 μL של מדיום הבדיקה כדי לקבל פתרון עבודה 25 מיקרומטר.
- הכן פתרון עבודה אוליגומיצין לבדיקת נויטרופילים אנושיים על ידי ערבוב 300 מיקרוליטר של תמיסת מלאי עם 2,700 מיקרוליטר של מדיום בדיקה כדי לקבל פתרון עבודה של 10 מיקרומטר.
הערה: קשירת אוליגומיצין לתת-יחידת לוחית הבסיס Fo של Fo/F1 ATPase (ATP synthase) מונעת כניסה חוזרת של פרוטונים למיטוכונדריה ומעכבת סינתזת ATP32. זה מפחית באופן משמעותי את זרימת האלקטרונים דרך שרשרת הובלת האלקטרונים ואת OCR. עם זאת, זרימת האלקטרונים אינה נפסקת לחלוטין עקב דליפת פרוטונים על פני הממברנה המיטוכונדריאלית הפנימית33.
- הכן את פתרון מלאי FCCP על ידי בנייה מחדש של FCCP עם 720 μL של מדיום בדיקה כדי להשיג פתרון מלאי של 100 מיקרומטר.
- הכן פתרון עבודה לבדיקת נויטרופילים בעכבר על ידי ערבוב 300 μL של תמיסת מלאי עם 3,700 μL של מדיום הבדיקה כדי לקבל פתרון עבודה של 7.5 מיקרומטר.
- הכן פתרון עבודה לבדיקת נויטרופילים אנושיים על ידי ערבוב 375 μL של תמיסת מלאי עם 2,625 μL של מדיום הבדיקה כדי לקבל פתרון עבודה של 12.5 מיקרומטר.
- הכן פתרון עבודה לבדיקת תא HL60 על ידי ערבוב 720 מיקרוליטר של תמיסת מלאי עם 4,080 מיקרוליטר של מדיום בדיקה כדי לקבל פתרון עבודה של 15 מיקרומטר.
הערה: התוספת של FCCP חושפת את הקיבולת המרבית של המיטוכונדריה לשימוש ב-OXPHOS. זוהי חומצה חלשה המסיסה בשומנים, החדירה למיטוכונדריה וגורמת לפיזור הפוטנציאל הטרנסממברנלי. פריקת שיפוע הפרוטון על פני הממברנה הפנימית של המיטוכונדריה והסטת שטף הפרוטון מסינתאז Fo/F1 ATP גורמת לפירוק צימוד מיטוכונדריאלי. אפקט ניתוק הצימוד הזה מגדיל בפתאומיות את צריכת החמצן במיטוכונדריה כדי לשמר את שיפועהפרוטון 34.
- הכינו רוטנון/אנטימיצין תמיסת מלאי על ידי הרכבה מחדש של תערובת רוטנון/אנטימיצין A עם 540 מיקרוליטר של מדיום בדיקה לקבלת תמיסת ציר של 50 מיקרומטר.
- הכינו רוטנון/אנטימיצין פתרון עבודה לכל הבדיקות על ידי ערבוב 540 מיקרוליטר של תמיסת מלאי עם 2,160 מיקרוליטר של מדיום בדיקה לקבלת פתרון עבודה של 10 מיקרומטר.
הערה: רוטנון חוסם את קומפלקס I על ידי עיכוב מעבר אלקטרונים ממרכזי ברזל-גופרית בקומפלקס I ליוביקינון, בעוד אנטימיצין A חוסם קומפלקס III של שרשרת הובלת האלקטרונים, מה שמוביל לחסימה של OXPHOS עם סינתזה מוגבלת של ATP35. בכך, זה מגלה נשימה לא מיטוכונדריאלית36,37.
- הכינו רוטנון/אנטימיצין פתרון עבודה לכל הבדיקות על ידי ערבוב 540 מיקרוליטר של תמיסת מלאי עם 2,160 מיקרוליטר של מדיום בדיקה לקבלת פתרון עבודה של 10 מיקרומטר.
- הכן תמיסת מלאי אוליגומיצין על ידי בנייה מחדש של אוליגומיצין עם 630 מיקרוליטר של מדיום בדיקה כדי להשיג תמיסת מלאי של 100 מיקרומטר.
- טען את המחסנית עם ריאגנטים; טען תערובת מוכנה של אוליגומיצין, FCCP ורוטנון/אנטימיצין A לתוך יציאות A, B ו-C, בהתאמה, במחסנית לצורך הזרקות (איור 2). השתמש בעלון התבנית הזמין יחד עם המחסנית כדי להקל על טעינת ריאגנטים ליציאות. מלא את היציאות שאינן בשימוש ב- 20 μL של מדיום בדיקה.
- עבור בדיקת נויטרופילים בעכבר, טען 20 μL של אוליגומיצין (25 μM; כל באר של צלחת 96 באר יש 180 μL של תווך הבדיקה בהתחלה, ולכן הריכוז הסופי הוא 2.5 μM) לתוך יציאות A. טען 17.6 μL של FCCP (7.5 μM; ריכוז סופי: ~0.61 μM) לתוך יציאות B. טען 24 μL של תערובת רוטנון/אנטימיצין A (10 μM; ריכוז סופי: ~1 μM) לתוך יציאות C.
- עבור בדיקת נויטרופילים אנושיים, עומס 20 μL של אוליגומיצין (10 μM; כל באר של צלחת 96 באר יש 180 μL של תווך הבדיקה בהתחלה, ולכן הריכוז הסופי הוא 1 μM) לתוך יציאות A. טען 22 μL של FCCP (12.5 μM; ריכוז סופי: ~1.25 μM) לתוך יציאות B. טען 24 μL של תערובת רוטנון/אנטימיצין A (10 μM; ריכוז סופי: ~1 μM) לתוך יציאות C.
- עבור בדיקת תאים HL60 ו- dHL60, עומס 20 μL של אוליגומיצין (25 מיקרומטר; כל באר של צלחת 96 באר יש 180 μL של תווך הבדיקה בהתחלה, ולכן הריכוז הסופי הוא 2.5 μM) לתוך יציאות A. טען 22 μL של FCCP (15 μM; ריכוז סופי: ~1.5 μM) לתוך יציאות B. טען 24 μL של תערובת רוטנון/אנטימיצין A (10 μM; ריכוז סופי: ~1 μM) לתוך יציאות C.
הערה: פיפטה תמיסת התרופה בנמל מבלי לגעת בתחתית הנמל. אין להקיש על הצלחת לאחר הטעינה כדי למנוע דליפה, מכיוון שהנוזלים מוחזקים על ידי כוחות הנימים. בארות הרקע של צלחת התרבות והיציאות במחסנית החיישן נטענות במדיום הבדיקה או באותה יציאה של טעינת ריאגנטים כמו בבארות הדגימה כדי לנרמל את השפעת הריאגנטים על ערכי הרקע. יש להוסיף את הריאגנטים ליציאות המתאימות מבלי להרים את המחסנית מלוח השירות המכיל כיול כדי למנוע מלכודת אוויר. מלאו את הנמל האחרון של כל הבארות בתווך כפי שמוצג באיור 2.

איור 2: מחסנית בדיקת המאמץ של המיטוכונדריה ויציאות ההזרקה שלה. התמונה מציגה את המחסנית של בדיקת הלחץ המיטוכונדריאלי ותמונה מוגדלת המציגה את הטעינה של תרופות בודדות/מדיום ליציאות. קיצור: FCCP = carbonylcyanide p-trifluoromethoxy phenylhydrazone. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ביצוע בדיקת הלחץ המיטוכונדריאלי
- הפעל את המנתח המטבולי ואת המחשב, פתח את תוכנת Wave ולחץ על Heater On כדי להגדיר את המכונה ב 37 ° C לפחות 5 שעות מראש. לאחר ההגעה לטמפרטורה, הפינה השמאלית התחתונה של תוכנת הגל נראית מוכנה.
- פתח תבנית עבור ערכת בדיקת המאמץ המיטוכונדריאלי בתוכנה. לחץ על הגדרת קבוצה בשורת התפריטים העליונה.
- הגדירו מראש בנפרד כל הגדרה בצד שמאל, כגון אסטרטגיות הזרקה, טיפולים מקדימים, מדיית בדיקה וסוגי תאים (ביו-חומריים בשימוש).
- לחץ על אסטרטגיות הזרקה בצד שמאל, ולאחר מכן לחץ על הוסף ותן שם למצב ההזרקה כנויטרופילים אנושיים/נויטרופילים של עכבר/HL60. בחר יציאה A-D על ידי לחיצה על כל אחד מהם ולחץ על הוסף תרכובת והזן אוליגומיצין/FCCP/רוטנון אנטימיצין A עם הריכוזים המתאימים (טבלה 1).
- לחץ על טיפול מקדים בצד שמאל, ולאחר מכן לחץ על הוסף ותן להם שם כ- CD18 ו - Cell Tak בנפרד. לחץ על החומר הביולוגי המשמש בצד שמאל, ולאחר מכן לחץ על הוסף ותן להם שם כנויטרופילים אנושיים, נויטרופילים של עכבר ו- HL60 /dHL60 עם צפיפות זריעה.
- הגדר את הקבוצות על ידי לחיצה על הוסף קבוצה (למשל, עבור בדיקת נויטרופילים אנושיים) ועל ידי לחיצה על ההגדרה העומדת בבסיסה (למשל, אסטרטגיות הזרקה לפי טבלה 1 - נויטרופילים אנושיים, טיפול מקדים כ- CD18, וסוג התא כנויטרופילים אנושיים).
- לחץ על מפת לוחות בתפריט העליון כדי לצפות בכל הקבוצות, עם הגדרות בצד שמאל ומפת הלוחות בצד ימין. גרור ושחרר כדי להוסיף כל באר לקבוצה תוך שמירה על ארבע הבארות הפינתיות כרקע (ברירת מחדל).
- הגדר את הפרוטוקול על ידי לחיצה על פרוטוקול בתפריט העליון והגדר שלושה מחזורים של תערובת בסיסית, אוליגומיצין, FCCP, רוטנון ואנטימיצין A על ידי הגדרת הזמן לערבוב כ- 3 דקות, מנוחה כ- 0 דקות ומדידה כ- 7 דקות.
- עבור אל הדף Run Assay , ספק את מידע סיכום הפרוייקט לעיון, ולחץ על Start Run.
- תן את המיקום לשמירת הקבצים, כך שכל התוצאות יישמרו לאחר השלמת הבדיקה.
- לאחר טעינה אוטומטית של הבדיקה, המתן עד שהמגש ייפתח כדי למקם את מחסנית החיישן ואת הצלחת עם 200 μL של כיול (שלב 1.1). הגדר את כיוון ברקוד המחסנית הפונה ימינה. הפעל את הכיול על ידי לחיצה על אני מוכן, פעולה שאורכת כ-20 דקות.
- לאחר הכיול, לחץ על פתח מגש. החלף את הצלחת בצלחת זרע התא ולחץ על טען צלחת תא כדי להמשיך את הבדיקה.
- לאחר השלמת הבדיקה, הנתונים נשמרים באופן אוטומטי. לחץ על הצג תוצאות וייצא אותו כגיליון אלקטרוני או כקובץ תוכנת ניתוח אחר.
- גרף ונתח את הנתונים (איור 3 ואיור 4).
- חישוב פרמטרים של נשימה, כולל נשימה מיטוכונדריאלית בסיסית, נשימה המקושרת לדליפה של פרוטון, נשימה מקושרת ATP, נשימה מרבית, קיבולת נשימה רזרביות ונשימה לא מיטוכונדריאלית (איור 4A)38,39,40,41.
- חשב את הנשימה המיטוכונדריאלית הבסיסית על-ידי הפחתת ערך זיהוי התווים האופטי (OCR) שנמדד לאחר הוספת תערובת רוטנון/אנטימיצין A מה-OCR לפני הזרקת אוליגומיצין (איור 4A, a).
- חשב את הנשימה המקושרת לדליפה של פרוטון על-ידי הפחתת ערך זיהוי התווים האופטי (OCR) לאחר הזרקת תערובת רוטנון/אנטימיצין A מערך זיהוי תווים אופטי (OCR) שנמדד לאחר הזרקת אוליגומיצין (איור 4A,b).
- הערך את הנשימה המקושרת ל- ATP על ידי חישוב ההבדל בין הנשימה המיטוכונדריאלית הבסיסית לבין נשימה הקשורה לדליפת פרוטון. הפחת את הערך הראשון של זיהוי תווים אופטי (OCR) שנמדד לאחר הזרקת אוליגומיצין מערך זיהוי התווים האופטי (OCR) הראשון לפני הזרקת אוליגומיצין (איור 4A,c).
- נשימה מקסימלית היא קצב הנשימה המקסימלי שתא יכול להשיג לאחר הוספת FCCP. חשב זאת על-ידי הפחתת ערך זיהוי התווים האופטי (OCR) לאחר הזרקת תערובת רוטנון/אנטימיצין A מערך זיהוי התווים האופטי (OCR) שנמדד לאחר הזרקת FCCP (איור 4A,d).
- קיבולת נשימה רזרביות מתייחסת ליכולת של התא לענות על דרישת האנרגיה הגבוהה יותר באמצעות OXPHOS. חשבו זאת על-ידי מציאת ההבדל בין נשימה מקסימלית לנשימה מיטוכונדריאלית בסיסית (איור 4A, e).
- נשימה לא-מיטוכונדריאלית היא כמות החמצן הנצרכת על-ידי מקורות שאינם מיטוכונדריאליים. מדדו זאת לאחר הוספת תערובת רוטנון/אנטימיצין A (איור 4A,f).
- בצע ניתוח סטטיסטי באמצעות מבחן t של התלמיד כדי להשוות פרמטרים שונים של נשימה של תאי HL60 לא ממוינים וממוינים. ניקח בחשבון את p < 0.05 כמובהק סטטיסטית.
הערה: עותקים משוכפלים עם ערכי OCR או ECAR נמוכים מאפס נחשבים לשגיאה בהכנת הדגימה, בהזרקת התרכובת או במדידה. הם אינם נכללים בניתוח עתידי.
תוצאות
דינמיקה מייצגת של זיהוי תווים אופטי (OCR) מוצגת המצביעה על שינויים בנשימה המיטוכונדריאלית בתגובה לאוליגומיצין, FCCP ורוטנון/אנטימיצין תערובת של נויטרופילים של עכברים (איור 3A), נויטרופילים אנושיים (איור 3B) ותאי HL60 לא ממוינים וממוינים (איור 3C). בכ...
Discussion
ההליך הסטנדרטי המודד את הנשימה המיטוכונדריאלית של נויטרופילים באמצעות מנתח שטף חוץ-תאי מטבולי מוגבל על ידי גורמים רבים, כולל מספר תאים, גדילת תאים וכדאיות. כל ריכוז תרכובת משתנה בין סוג ומקור התאים בבדיקה זו. אוליגומיצין ורוטנון/אנטימיצין A משמשים בעיקר בריכוז דומה בקרב רוב סוגי התאים. עם...
Disclosures
המחברים מצהירים כי אין אינטרס כלכלי מתחרה.
Acknowledgements
אנו מודים לד"ר אנתוני ט. ולה ולד"ר פדריקה אגליאנואין מהמחלקה לאימונולוגיה ב- UConn Health על הכשרתם בשימוש במנתח שטף חוץ-תאי מטבולי, ולד"ר לין פודינגטון מהמחלקה לאימונולוגיה ב- UConn Health על תמיכתה במכשירים. אנו מודים לד"ר ז'נבה הרגיס מבית הספר לרפואה של UConn על עזרתה בכתיבה מדעית ובעריכה של כתב יד זה. מחקר זה נתמך על ידי מענקים מהמכונים הלאומיים לבריאות, המכון הלאומי ללב, ריאות ודם (R01HL145454), המכון הלאומי למדעי הרפואה הכלליים (R35GM147713 ו- P20GM139763), קרן סטארט-אפ מ- UConn Health, ומלגת כניסה מחדש לקריירה מהאיגוד האמריקאי לאימונולוגים.
Materials
| Name | Company | Catalog Number | Comments |
| 37 °C non-CO2 incubator | Precision | Economy Model 2EG | Instrument |
| Biorender | Software Application | ||
| Centrifuge | Eppendorf | Model 5810R | Instrument |
| Corning Cell-Tak Cell and Tissue Adhesive | Corning | 102416-100 | Reagent |
| EasySep Magnet | STEMCELL | 18000 | Magnet |
| EasySepMouse Neutrophil Enrichment kit | STEMCELL | 19762A | Reagents |
| Graphpad Prism 9 | Software Application | ||
| Human Serum Albumin Solution (25%) | GeminiBio | 800-120 | Reagents |
| Ketamine (VetaKet) | DAILYMED | NDC 59399-114-10 | Anesthetic |
| PBS | Cytiva | SH30256.01 | Reagents |
| Plate buckets | Eppendorf | UL155 | Accessory |
| PolymorphPrep | PROGEN | 1895 (previous 1114683) | polysaccharide solution |
| Purified mouse anti-human CD18 antibody | Biolegend | 302102 | Clone TS1/18 |
| RPMI 1640 Medium | Gibco | 11-875-093 | Reagents |
| Seahorse metabolic extracellular flux analyzer | Agilent | XFe96 | Instrument |
| Seahorse XF Cell Mito Stress Test Kit | Agilent | 103015-100 | mitochondrial stress test Kit |
| Swing-bucket rotor | Eppendorf | A-4-62 | Rotor |
| Vactrap 2 Vacum Trap | Fox Lifesciences | 3052101-FLS | Instrument |
| Wave | Software Application | ||
| XF 1.0 M Glucose Solution | Agilent | 103577-100 | Reagent |
| XF 100 mM Pyruvate Solution | Agilent | 103578-100 | Reagent |
| XF 200 mM Glutamine Solution | Agilent | 103579-100 | Reagent |
| XF DMEM medium | Agilent | 103575-100 | Reagent |
| XFe96 FluxPak | Agilent | 102601-100 | Material |
| Xylazine (AnaSed Injection) | DAILYMED | NDC 59399-110-20 | Anesthetic |
References
- Demine, S., Renard, P., Arnould, T. Mitochondrial uncoupling: a key controller of biological processes in physiology and diseases. Cells. 8 (8), 795 (2019).
- Noguchi, M., Kasahara, A. Mitochondrial dynamics coordinate cell differentiation. Biochemical and Biophysical Research Communications. 500 (1), 59-64 (2018).
- Zhu, L., et al. Correlation between mitochondrial dysfunction, cardiovascular diseases, and traditional Chinese medicine. Evidence-Based Complementary and Alternative Medicine. 2020, e2902136 (2020).
- Kaarniranta, K., et al. Mechanisms of mitochondrial dysfunction and their impact on age-related macular degeneration. Progress in Retinal and Eye Research. 79, 100858 (2020).
- Onyango, I. G., Khan, S. M., Bennett, J. P. Mitochondria in the pathophysiology of Alzheimer's and Parkinson's diseases. Frontiers in Bioscience. 22 (5), 854-872 (2017).
- Loiseau, D., et al. Mitochondrial coupling defect in Charcot-Marie-Tooth type 2A disease. Annals of Neurology. 61 (4), 315-323 (2007).
- Zucker-Franklin, D. Electron microscopic studies of human granulocytes: structural variations related to function. Seminars in Hematology. 5 (2), 109-133 (1968).
- Karnovsky, M. L. The metabolism of leukocytes. Seminars in Hematology. 5 (2), 156-165 (1968).
- Bao, Y., et al. mTOR and differential activation of mitochondria orchestrate neutrophil chemotaxis. The Journal of Cell Biology. 210 (7), 1153-1164 (2015).
- Fossati, G., et al. The mitochondrial network of human neutrophils: role in chemotaxis, phagocytosis, respiratory burst activation, and commitment to apoptosis. Journal of Immunology. 170 (4), 1964-1972 (2003).
- Pryde, J. G., Walker, A., Rossi, A. G., Hannah, S., Haslett, C. Temperature-dependent arrest of neutrophil apoptosis. Failure of Bax insertion into mitochondria at 15 degrees C prevents the release of cytochrome c. The Journal of Biological Chemistry. 275 (43), 33574-33584 (2000).
- Maianski, N. A., Mul, F. P. J., van Buul, J. D., Roos, D., Kuijpers, T. W. Granulocyte colony-stimulating factor inhibits the mitochondria-dependent activation of caspase-3 in neutrophils. Blood. 99 (2), 672-679 (2002).
- Bao, Y., et al. Mitochondria regulate neutrophil activation by generating ATP for autocrine purinergic signaling. The Journal of Biological Chemistry. 289 (39), 26794-26803 (2014).
- Chouchani, E. T., et al. Ischaemic accumulation of succinate controls reperfusion injury through mitochondrial ROS. Nature. 515 (7527), 431-435 (2014).
- Hayashi, G., Cortopassi, G. Oxidative stress in inherited mitochondrial diseases. Free Radical Biology and Medicine. 88, 10-17 (2015).
- Mailloux, R. J. An update on mitochondrial reactive oxygen species production. Antioxidants. 9 (6), 472 (2020).
- Abuaita, B. H., et al. The IRE1α stress signaling axis is a key regulator of neutrophil antimicrobial effector function. Journal of Immunology. 207 (1), 210-220 (2021).
- Lood, C., et al. Neutrophil extracellular traps enriched in oxidized mitochondrial DNA are interferogenic and contribute to lupus-like disease. Nature Medicine. 22 (2), 146-153 (2016).
- Douda, D. N., Khan, M. A., Grasemann, H., Palaniyar, N. SK3 channel and mitochondrial ROS mediate NADPH oxidase-independent NETosis induced by calcium influx. Proceedings of the National Academy of Sciencesa. 112 (9), 2817-2822 (2015).
- Monteith, A. J., et al. Altered mitochondrial homeostasis during systemic lupus erythematosus impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Journal of Immunology. 208 (2), 454-463 (2022).
- Monteith, A. J., Miller, J. M., Beavers, W. N., Juttukonda, L. J., Skaar, E. P. Increased dietary manganese impairs neutrophil extracellular trap formation rendering neutrophils ineffective at combating Staphylococcus aureus. Infection and Immunity. 90 (3), 0068521 (2022).
- Monteith, A. J., et al. Mitochondrial calcium uniporter affects neutrophil bactericidal activity during Staphylococcus aureus infection. Infection and Immunity. 90 (2), 0055121 (2022).
- Cao, Z., et al. Roles of mitochondria in neutrophils. Frontiers in Immunology. 13, 934444 (2022).
- Papayannopoulos, V., Metzler, K. D., Hakkim, A., Zychlinsky, A. Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps. The Journal of Cell Biology. 191 (3), 677-691 (2010).
- Fan, Z., Ley, K. Developing neutrophils must eat…themselves. Immunity. 47 (3), 393-395 (2017).
- Riffelmacher, T., et al. Autophagy-dependent generation of free fatty acids is critical for normal neutrophil differentiation. Immunity. 47 (3), 466-480 (2017).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. Journal of Visualized Experiments. (110), e53936 (2016).
- Swamydas, M., Isolation Lionakis, M. S. purification and labeling of mouse bone marrow neutrophils for functional studies and adoptive transfer experiments. Journal of Visualized Experiments. (77), e50586 (2013).
- Gerner, M. C., et al. Packed red blood cells inhibit T-cell activation via ROS-dependent signaling pathways. The Journal of Biological Chemistry. 296, 100487 (2021).
- Zhang, Z. -. W., et al. Red blood cell extrudes nucleus and mitochondria against oxidative stress. IUBMB Life. 63 (7), 560-565 (2011).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111, 1-16 (2015).
- Hearne, A., Chen, H., Monarchino, A., Wiseman, J. S. Oligomycin-induced proton uncoupling. Toxicology In Vitro. 67, 104907 (2020).
- Plitzko, B., Loesgen, S. Measurement of oxygen consumption rate (OCR) and extracellular acidification rate (ECAR) in culture cells for assessment of the energy metabolism. Bio-Protocol. 8 (10), e2850 (2018).
- Nath, S. The molecular mechanism of ATP synthesis by F1F0-ATP synthase: a scrutiny of the major possibilities. Advances in Biochemical Engineering/Biotechnology. 74, 65-98 (2002).
- Heinz, S., et al. Mechanistic investigations of the mitochondrial complex I inhibitor rotenone in the context of pharmacological and safety evaluation. Scientific Reports. 7 (1), 45465 (2017).
- Hytti, M., et al. Antimycin A-induced mitochondrial damage causes human RPE cell death despite activation of autophagy. Oxidative Medicine and Cellular Longevity. 2019, 1583656 (2019).
- Malecki, M., Kamrad, S., Ralser, M., Bähler, J. Mitochondrial respiration is required to provide amino acids during fermentative proliferation of fission yeast. EMBO Reports. 21 (11), e50845 (2020).
- Divakaruni, A. S., Paradyse, A., Ferrick, D. A., Murphy, A. N., Jastroch, M. Analysis and interpretation of microplate-based oxygen consumption and pH data. Methods in Enzymology. 547, 309-354 (2014).
- Marchetti, P., Fovez, Q., Germain, N., Khamari, R., Kluza, J. Mitochondrial spare respiratory capacity: Mechanisms, regulation, and significance in non-transformed and cancer cells. The FASEB Journal. 34 (10), 13106-13124 (2020).
- Nicholas, D., et al. Advances in the quantification of mitochondrial function in primary human immune cells through extracellular flux analysis. PLoS One. 12 (2), e0170975 (2017).
- Tur, J., et al. Mitofusin 2 in macrophages links mitochondrial ROS production, cytokine release, phagocytosis, autophagy, and bactericidal activity. Cell Reports. 32 (8), 108079 (2020).
- Benz, R., McLaughlin, S. The molecular mechanism of action of the proton ionophore FCCP (carbonylcyanide p-trifluoromethoxyphenylhydrazone). Biophysical Journal. 41 (3), 381-398 (1983).
- Wettmarshausen, J., Perocchi, F. Assessing calcium-stimulated mitochondrial bioenergetics using the seahorse XF96 analyzer. Methods in Molecular Biology. 1925, 197-222 (2019).
- Forkink, M., et al. Mitochondrial hyperpolarization during chronic complex I inhibition is sustained by low activity of complex II, III, IV and V. Biochimica et Biophysica Acta. 1837 (8), 1247-1256 (2014).
- . Methods for Reducing Cell Growth Edge Effects in Agilent Seahorse XF Cell Culture Microplates Available from: https://www.agilent.com/cs/library/usermanuals/public/user-manual-methods-for-reducing-cell-growth-edge-effect-cell-analysis-5994-0240en-agilent.pdf (2019)
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Wu, D., Yotnda, P. Induction and testing of hypoxia in cell culture. Journal of Visualized Experiments. (54), e2899 (2011).
- Normalisation of Seahorse XFe96 metabolic assaysto cell number with Hoechst stain using well-scan mode on the CLARIOstar Plus. BMG Labtech Available from: https://www.bmglabtech.com/cn/normalisation-of-seahorse-xfe96-metabolic-assays-to-cell-number-with-hoechst-stain/ (2020)
- Yetkin-Arik, B., et al. The role of glycolysis and mitochondrial respiration in the formation and functioning of endothelial tip cells during angiogenesis. Scientific Reports. 9 (1), 12608 (2019).
- Jastroch, M., Divakaruni, A. S., Mookerjee, S., Treberg, J. R., Brand, M. D. Mitochondrial proton and electron leaks. Essays in Biochemistry. 47, 53-67 (2010).
- Jandl, R. C., et al. Termination of the respiratory burst in human neutrophils. The Journal of Clinical Investigation. 61 (5), 1176-1185 (1978).
- Azevedo, E. P., et al. A metabolic shift toward pentose phosphate pathway is necessary for amyloid fibril- and phorbol 12-myristate 13-acetate-induced neutrophil extracellular trap (NET) formation. The Journal of Biological Chemistry. 290 (36), 22174-22183 (2015).
- Six, E., et al. AK2 deficiency compromises the mitochondrial energy metabolism required for differentiation of human neutrophil and lymphoid lineages. Cell Death & Disease. 6 (8), e1856 (2015).
- Kumar, S., Dikshit, M. Metabolic insight of neutrophils in health and disease. Frontiers in Immunology. 10, 2099 (2019).
- Rodríguez-Espinosa, O., Rojas-Espinosa, O., Moreno-Altamirano, M. M. B., López-Villegas, E. O., Sánchez-García, F. J. Metabolic requirements for neutrophil extracellular traps formation. Immunology. 145 (2), 213-224 (2015).
- Invernizzi, F., et al. Microscale oxygraphy reveals OXPHOS impairment in MRC mutant cells. Mitochondrion. 12 (2), 328-335 (2012).
- Zenaro, E., et al. Neutrophils promote Alzheimer's disease-like pathology and cognitive decline via LFA-1 integrin. Nature Medicine. 21 (8), 880-886 (2015).
- Maianski, N. A., et al. Functional characterization of mitochondria in neutrophils: a role restricted to apoptosis. Cell Death and Differentiation. 11 (2), 143-153 (2004).
- Bergman, O., Ben-Shachar, D. Mitochondrial oxidative phosphorylation system (OXPHOS) deficits in schizophrenia. Canadian Journal of Psychiatry. 61 (8), 457-469 (2016).
- Zhou, W., Qu, J., Xie, S., Sun, Y., Yao, H. Mitochondrial dysfunction in chronic respiratory diseases: implications for the pathogenesis and potential therapeutics. Oxidative Medicine and Cellular Longevity. 2021, 5188306 (2021).
- Hirano, M., Emmanuele, V., Quinzii, C. M. Emerging therapies for mitochondrial diseases. Essays in Biochemistry. 62 (3), 467-481 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved