A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحسين تعداد بوغ العصوية الرقيقة وتحليل التسمية في قياس التدفق الخلوي
In This Article
Summary
يركز هذا البروتوكول على استخدام قياس التدفق الخلوي وعد الخرز لتحديد الجراثيم البكتيرية الموسومة ببروميد الإيثيديوم. هذه الطريقة فعالة أيضا لتحليل الاقتران التساهمي للبروتينات على سطح الجراثيم السليمة.
Abstract
وقد تم بالفعل اقتراح جراثيم Bacillus subtilis لمختلف تطبيقات التكنولوجيا الحيوية والمناعة. ومع ذلك ، هناك حاجة متزايدة لتطوير منهجيات تعمل على تحسين الكشف عن المستضدات التي تجمد على سطح الجراثيم جنبا إلى جنب مع قياسها الكمي. تم اقتراح التحليلات القائمة على قياس التدفق الخلوي سابقا كنهج سريعة وموثوقة ومحددة للكشف عن الخلايا الموسومة من B. subtilis. هنا ، نقترح استخدام قياس التدفق الخلوي لتقييم كفاءة عرض الجسم المضاد الفلوري (FA) على سطح البوغ وتحديد عدد الجراثيم باستخدام عد الخرز.
لهذا ، استخدمنا بروميد الإيثيديوم كعلامة للحمض النووي وجسم مضاد يحمل علامة allophycocyanin (APC) ، والذي كان مقترنا بالجراثيم ، كعلامة سطحية. تم إجراء القياس الكمي للجراثيم باستخدام عد الخرز لأن هذه التقنية توضح دقة عالية في الكشف عن الخلايا. تم تحليل الجراثيم الموسومة باستخدام مقياس التدفق الخلوي ، والذي أكد الاقتران. نتيجة لذلك ، ثبت أن وضع العلامات على الحمض النووي يحسن دقة القياس الكمي عن طريق قياس التدفق الخلوي ، للكشف عن الجراثيم النابتة. ولوحظ أن بروميد الإيثيديوم غير قادر على تسمية الجراثيم الخاملة؛ ومع ذلك ، توفر هذه التقنية تحديدا أكثر دقة لعدد الجراثيم التي تحتوي على بروتين فلوري مقترن بسطحها ، مما يساعد في تطوير الدراسات التي تركز على استخدام الجراثيم كمنصة للتكنولوجيا الحيوية في تطبيقات مختلفة.
Introduction
Bacillus subtilis هي بكتيريا إيجابية الجرام على شكل قضيب قادرة على إنتاج جراثيم هادئة عندما لا تسمح الظروف البيئية بنمو الخلايا1. الجراثيم هي أشكال خلايا مستقرة للغاية وتستخدم تلك الخاصة بالعديد من الأنواع ، بما في ذلك B. subtilis ، على نطاق واسع كبروبيوتيك للاستخدام البشري والحيواني2. نظرا لمقاومتها وخصائص سلامتها ، تم اقتراح بوغ B. subtilis ، الذي يعرض بروتينات غير متجانسة ، كمساعد مخاطي ، ونظام توصيل لقاح ، ومنصة تثبيت الإنزيم 3,4.
للحصول على جراثيم من B. subtilis ، من الضروري تعريضها للحرمان من المغذيات باستخدام وسيط ثقافة خاص. بعد الحصول على هذه الجراثيم وتنقيتها ، يجب على المرء تحديدها كميا لتحسين كفاءة الاختبار 5,6. وبالتالي ، يتم تطبيق طرق معينة لتحليل تركيز الجراثيم التي تم الحصول عليها. يمكن استخدام عد الألواح وغرفة Petroff-Hausser ، والمعروفة أيضا باسم غرفة العد. تم تطوير هذا الأخير في الأصل لتحديد تركيز خلايا الدم. ومع ذلك ، فمن الممكن استخدامه في مجال علم الأحياء الدقيقة لعد الأبواغ 7,8. على الرغم من كونها الطريقة القياسية المستخدمة في عد الخلايا ، إلا أن القراءة شاقة لأن هذه الطريقة يدوية تماما وتعتمد دقتها على خبرة المشغل.
تم اقتراح التحليلات القائمة على قياس التدفق الخلوي (FC) سابقا كنهج سريعة وموثوقة ومحددة للكشف عن الخلايا الموسومة ل Bacillus spp. يضمن استخدام حبات عد التدفق الخلوي قابلية التكاثر في عد الخلايا في الفحوصات الروتينية (العدد المطلق للخلايا الليمفاوية CD4 و CD8 T) وفي تطوير الأبحاث التي تتضمن جزيئات يمكن اكتشافها وحسابها باستخدام قياس التدفقالخلوي 9. اقترح جودجافري والشريف استخدام عد الخرز لتحديد كمية FC للجراثيم غير الموسومة10. تم وصف استخدام قياس التدفق الخلوي لرصد التبويض في Bacillus spp. عن طريق وضع علامات على الحمض النووي للجراثيم10،11،12،13. ومع ذلك ، استخدمت دراسة أخرى FC لتقييم كمية البروتينات الموسومة بالفلورسنت على سطح البوغ15.
سعت هذه الدراسة إلى استخدام حبات العد التجارية لضمان معيار من التكاثر فيما يتعلق بحساب الأحداث باستخدام قياس التدفق الخلوي. هنا ، نقترح استخدام عد حبات عد الخلايا في FC لتحسين تعداد الأبواغ وتقييم كفاءة اقتران الأجسام المضادة ذات العلامات الفلورية على سطح البوغ.
Access restricted. Please log in or start a trial to view this content.
Protocol
راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والأدوات والبرامج المستخدمة في هذا البروتوكول.
1. إعداد قياس التدفق الخلوي
- محاذاة المعلمات البصرية لمقياس التدفق الخلوي المقترن بجهاز كمبيوتر
- قم بتسجيل الدخول إلى برنامج Cytometer.
- من مساحة عمل البرنامج، حدد مقياس الخلايا | ابدأ وانتظر بضع دقائق | الوضع النظيف | اجلس السوائل.
ملاحظة: تمت إزالة فقاعات الهواء والعوائق أثناء عملية بدء مقياس الخلايا، قبل الحصول على العينة.
- مراقبة الجودة
- استخدم كاشف مراقبة الجودة لضبط الفولتية لأنابيب المضاعف الضوئي وتقييم حساسيتها.
- تحضير كاشف مراقبة الجودة في أنبوب البوليسترين.
- لتحديد خط الأساس ، قم بإعداد حبات التعليق بإضافة 0.5 مل من المادة المخففة (10 مللي متر PBS المصفى ، الرقم الهيدروجيني 7) و 3 قطرات من الخرز إلى الأنبوب المسمى.
- اخلطي قارورة الخرزة عن طريق الانقلاب اللطيف.
- من مساحة عمل البرنامج، حدد مقياس الخلايا | CST للاتصال بواجهة CST. انتظر بضع دقائق ولاحظ الرسالة مقياس الخلايا مفصول.
- قم بتوصيل أنبوب البوليسترين الذي يحتوي على كاشف مراقبة الجودة بمسبار مقياس التدفق الخلوي.
- استخدم كاشف مراقبة الجودة لضبط الفولتية لأنابيب المضاعف الضوئي وتقييم حساسيتها.
- التحقق من تكوين مقياس الخلايا
- في نافذة ملخص النظام ، تحقق من أن تكوين مقياس الخلايا مناسب للتجربة.
- حدد معرف دفعة خرز الإعداد المقابل للتحقق من أن معرف دفعة خرز الإعداد المحدد يطابق المجموعة الحالية من حبات أبحاث CS&T .
- فحص الأداء
- حدد الخيار التحقق من الأداء وانقر فوق تشغيل.
- عند الانتهاء من فحص الأداء ، سيتم عرض نتائج الأداء. عرض تقرير أداء مقياس الخلايا. انقر فوق "إنهاء" لإكمال فحص الأداء أو قم بإزالة الأنبوب من مقياس الخلايا ومراجعة النتائج في نافذة ملخص النظام .
- لاحظ النتيجة النهائية لتحليل الحساسية المورفومترية والفلورية التي ستظهر في | ملخص النظام | نتيجة أداء مقياس الخلايا | مع الحالة: مرت
2. تحضير الجراثيم
- بعد التبويض ، اشطف الجراثيم 3x بالماء المثلج عالي النقاء عن طريق الطرد المركزي عند 17949 × جم لمدة 10 دقائق.
- أعد تعليق الحبيبات التي تم الحصول عليها من جهاز الطرد المركزي الأخير ب 10 مل من الماء عالي النقاء.
- الأوتوكلاف الجراثيم لمدة 45 دقيقة عند 121 درجة مئوية لتعطيل الخلايا النباتية.
ملاحظة: أظهرت الاختبارات السابقة التي أجرتها مجموعتنا لمقارنة طرق التعطيل المختلفة أن الظروف المذكورة في الخطوة 2.3 قدمت كفاءة عالية ، ولم تظهر أي تكوين مستعمرة في طريقة تحليل الطلاء على وسط أجار LB.
3. القياس الكمي للجراثيم المعقمة باستخدام قياس التدفق الخلوي
- خذ 50 ميكرولتر من جراثيم التعقيم واحتضانها محمية من الضوء مع بروميد الإيثيديوم (EtBr ، 10 مجم / مل مخفف في الماء) بعامل تخفيف 0.05٪ v / v لمدة 30 دقيقة (الشكل 1 أ).
- اغسل الجراثيم 3x بمحلول ملحي مخزن بالفوسفات (PBS) عن طريق الطرد المركزي عند 17949 × جم لمدة 10 دقائق وأعد تعليقه في 1x PBS.
- أضف 10 ميكرولتر من الخرز ، باتباع توصيات الشركة المصنعة للتخفيف.
- حلل العينة باستخدام مقياس التدفق الخلوي كما هو موضح في الخطوة 4.
ملاحظة: من المهم التأكيد على أن الخرزات يجب أن تكون متجانسة قدر الإمكان حيث لوحظت تباينات في الحسابات عندما لم يتم تنفيذ هذه الخطوة بشكل جيد.
4. التحليل باستخدام قياس التدفق الخلوي
- قم بتسجيل الدخول إلى برنامج Cytometer.
- من مساحة عمل البرنامج، حدد مقياس الخلايا | الوضع النظيف | اجلس السوائل.
- اضبط على مساحة العمل لتحديد التحليل في قياس التدفق الخلوي.
- حدد بوابات التحليلات (الشكل 2).
- تحديد استراتيجية البوابات بناء على الخصائص المورفومترية والفلورية للجسيمات بناء على التحكم السلبي (الجراثيم غير المميزة).
- لتحديد مورفومترية الخلية، اختر رسم Dotplot لتحليل معلمات FSC-A على المحور السيني وSSC-A على المحور ص.
- لتحديد التألق ، اختر مخططات FL3 Dotplot على المحور ص باستخدام FL5 على المحور السيني وقم بإنشاء البوابات في أربعة أرباع.
- حدد بوابات التحليلات (الشكل 2).
- استخدم أنبوب بوليسترين متوقف مقاس 12 × 75 مم يحتوي على عينات غير مصنفة ، تم تسميتها مسبقا ب EtBr أحادي اللون ، و APC أحادي اللون ، و EtBr + APC متعدد الألوان.
- امزج الأنبوب برفق شديد يحتوي على التحكم السلبي وأرفقه بمسبار مقياس التدفق الخلوي.
- انقر فوق اكتساب.
- اضبط قوة الليزر بالانتقال إلى مقياس الخلايا | المعلمات | FSC (375) و SSC (275).
- اضبط الحد على (500) مقياس خلوي | العتبة.
- لإزالة التألق الذاتي ، قم بتحليل العينة الخالية من الصبغة التي تحتوي على جراثيم فقط.
- اضبط الفولتية لكاشفات المرشح: FL3 (603) و FL5 (538) للتمييز بين السكان السالبين والإيجاب فيما يتعلق بالتألق المختار في عناصر التحكم. مقياس الخلايا | المعلمات.
- مقياس الخلايا | التعويض | اضبط إزاحة إعداد FL5/FL3 على 1.0.
- بعد قياس التشكل وتحليل الفلورسنت ، قم بتكوين الجهاز لاكتساب 30000 حدث | التجربة | تخطيط التجربة | الاستحواذ |30,000 حدث....
- بعد ضبط المعلمات ، احصل على بيانات للعينات المصنفة والتي تحتوي على حبات في مقياس التدفق الخلوي.
- احسب تركيز البوغ كما هو موضح في تعليمات الشركة المصنعة باستخدام المعادلة (1).
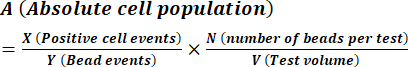 (1)
(1)
ملاحظة: بالنسبة لهذه الدراسة ، تمت مقارنة طريقة القياس الكمي للخرزة بتحليل غرفة العد Petroff-Hausser. بالإضافة إلى ذلك ، تمت مقارنة وضع العلامات على جراثيم التعقيم بوضع العلامات على الجراثيم غير المعقم.
5. تقدير مؤشر اقتران البروتين على سطح بوغ باستخدام قياس التدفق الخلوي
- الحصاد عن طريق الطرد المركزي من 50 ميكرولتر من الجراثيم (103 / ميكرولتر) 17949 × جم لمدة 10 دقائق ثم إعادة التعليق باستخدام 25 ميكرولتر من 1-إيثيل -3- (3-ثنائي ميثيل أمينوبروبيل) كاربوديميد (EDC) (300 مللي مول)).
- احتضان لمدة 15 دقيقة في درجة حرارة الغرفة.
- أضف 25 ميكرولتر من N-hydroxysulfosuccinimide (NHS) (50 mM) إلى معلق البوغ واحتضانه في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل الجراثيم 3x باستخدام 1x PBS عن طريق الطرد المركزي كما هو موضح في الخطوة 5.1.
- أضف البروتين الفلوري واترك العينات طوال الليل عند 15 درجة مئوية.
ملاحظة: كان البروتين الفلوري المستخدم في هذا العمل عبارة عن جسم مضاد ل IL-10 يحمل علامة APC. تم استخدام هذا الجسم المضاد كنموذج للدراسة ، على الرغم من أن تطبيق جزيئات الفلورسنت الأخرى ممكن لأن EDC / NHS يعزز الربط التساهمي بين مجموعات -COOH و -NH2 الموجودة في البروتينات على سطح البوغ. - اغسل الجراثيم حسب الخطوة 5.3.
- أضف 10 ملغم / مل من بروميد الإيثيديوم المخفف في الساعة 1:50 ، ثم اتركيه لمدة ساعة واحدة على الثلج ومحمي من الضوء (الشكل 1 ب).
- اغسل الجراثيم حسب الخطوة 5.3.
- كرر الخطوة 4.
- لتحديد التألق ، قم بتغيير المعلمات FL3 على المحور X و FL5 على المحور Y للمخطط النقط.
- قم بتحليل العينة باستخدام مقياس التدفق الخلوي باستخدام الليزر الأزرق (488 نانومتر) عند FL3 (مرشح 670 LP) والليزر الأحمر (633 نانومتر) في FL5 (مرشح 660/20) ، كما هو موضح في الخطوة 4.
ملاحظة: تم تحليل نفس العينات من أجل التألق المناعي على شرائح تحت المجهر ، في نطاق تكبير يبلغ 1000 × ، وباستخدام المرشحات التالية: FITC 480/30 نانومتر (أخضر) و TRITC 540/25 نانومتر (أحمر).
Access restricted. Please log in or start a trial to view this content.
النتائج
في عينات البوغ المعقمة (AS) ، تم الكشف عن 2 × 103 جراثيم / ميكرولتر و 1 × 103 جراثيم / ميكرولتر باستخدام عد الخرز وطريقة بتروف-هوسر ، على التوالي (الشكل 2).
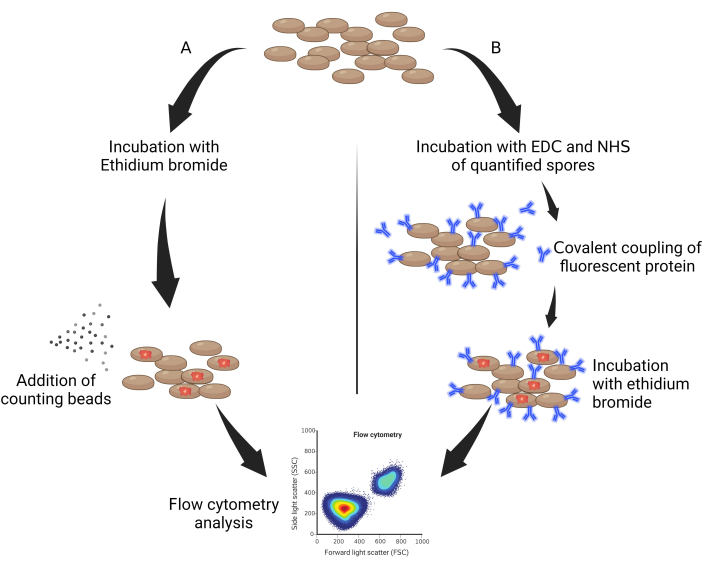
الشكل 1: المخط?...
Access restricted. Please log in or start a trial to view this content.
Discussion
الطرق التقليدية ، مثل عد لوحات المستعمرات ، لا تستغرق وقتا طويلا فحسب ، بل تحتاج أيضا إلى خلايا قابلة للحياة ولا تسمح بقياس كمية الجراثيم المعطلة5. غرفة بتروف-هوسر هي منهجية بديلة ، لكنها تتطلب مجهريا متمرسا لتنفيذها. أثبت قياس التدفق الخلوي أنه بديل مفيد لهذا الغرض.
Access restricted. Please log in or start a trial to view this content.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم تمويل هذه الدراسة جزئيا من قبل Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - قانون المالية 001. Governo do Estado do Amazonas بموارد من Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAM; المجلس الوطني للتنمية العلمية والتكنولوجية (CNPq). يشكر المؤلفون برنامج التطوير التكنولوجي في أدوات الصحة PDTIS-FIOCRUZ على استخدام مرافقه.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
References
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved