このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フローサイトメトリーにおける 枯草菌 胞子の計数と標識解析の改善
要約
このプロトコルは、フローサイトメトリーとカウントビーズを使用して、エチジウムブロマイドで標識された細菌胞子を定量化することに焦点を当てています。この方法は、無傷の胞子の表面におけるタンパク質の共有結合を分析するのにも効率的です。
要約
枯草菌の胞子は、さまざまなバイオテクノロジーおよび免疫学的用途のためにすでに提案されています。しかし、胞子の表面に固定化された抗原の検出とその定量を改善する方法論の開発の必要性が高まっています。フローサイトメトリーベースの解析は、枯草菌の標識細胞を検出するための迅速で信頼性が高く、特異的なアプローチとして以前から提案されてきました。本研究では、フローサイトメトリーを用いて、胞子表面の蛍光抗体(FA)のディスプレイ効率を評価し、カウンティングビーズを用いて胞子の数を定量することを提案します。
このために、DNAマーカーとして臭化エチジウムを使用し、胞子に結合したアロフィコシアニン(APC)標識抗体を表面マーカーとして使用しました。胞子の定量は、細胞の検出において高い精度を示すため、計数ビーズを使用して行われました。標識された胞子をフローサイトメーターを用いて解析し、カップリングを確認しました。その結果、DNA標識により、発芽胞子の検出のためのフローサイトメトリーによる定量精度が向上することが実証されました。エチジウムブロマイドは休眠胞子を標識できないことが観察されました。しかし、この技術は、表面に蛍光タンパク質が結合した胞子の数をより正確に決定できるため、さまざまなアプリケーションにおけるバイオテクノロジープラットフォームとしての胞子の使用に焦点を当てた研究の開発に役立ちます。
概要
枯草菌は棒状のグラム陽性菌で、環境条件が細胞増殖を許さない場合に静止胞子を産生することができます1。胞子は非常に安定した細胞形態であり、枯草菌を含むいくつかの種の胞子は、ヒトおよび動物用のプロバイオティクスとして広く使用されています2。枯草菌の胞子は、その耐性と安全性の特性から、異種タンパク質を示し、粘膜アジュバント、ワクチン送達システム、および酵素固定化プラットフォームとして提案されている3,4。
枯草菌から胞子を得るには、特別な培地を使用して栄養遮断にさらす必要があります。これらの胞子を入手して精製した後、検査効率を向上させるためにそれらを定量化する必要があります5,6。したがって、得られた胞子の濃度を分析するために特定の方法が適用されます。プレートカウンティングと、カウンティングチャンバーとしても知られるペトロフ・ハウザーチャンバーを使用できます。後者はもともと血球の濃度を決定するために開発されました。しかし、胞子計数のための微生物学の分野でそれを使用することは可能です7,8。細胞計数に使用される標準的な方法であるにもかかわらず、この方法は完全に手作業であり、その精度はオペレーターの経験に依存するため、読み取りは面倒です。
フローサイトメトリー(FC)ベースの分析は、バチルス属菌の標識細胞を検出するための迅速で信頼性が高く、特異的なアプローチとして以前に提案されてきました。フローサイトメトリーカウンティングビーズの使用により、ルーチン検査(CD4およびCD8 Tリンパ球の絶対数)での細胞カウント、およびフローサイトメトリーを使用して検出およびカウントできる粒子を含む研究の開発における再現性が保証されています9。GodjafreyとAlsharifは、非標識胞子のFC定量化にカウントビーズの使用を提案しました10。フローサイトメトリーの使用は、バチルス属菌の胞子形成のモニタリングについて説明されています。胞子DNA10,11,12,13を標識する。さらに別の研究では、胞子表面上の蛍光標識タンパク質の量を評価するためにFCが用いられた15。
この研究では、市販のカウンティングビーズを使用して、フローサイトメトリーを使用したイベントカウンティングに関する再現性の基準を確保しようとしました。本研究では、胞子計数を精緻化し、胞子表面上の蛍光標識抗体の結合効率を評価するために、FCでの細胞計数に計数ビーズを使用することを提案します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
このプロトコルで使用されるすべての材料、機器、およびソフトウェアに関連する詳細については、 材料表 を参照してください。
1. フローサイトメトリーの設定
- コンピュータと結合したフローサイトメーターの光学パラメータのアライメント
- Cytometerソフトウェアにログインします。
- ソフトウェアワークスペースから、 Cytometer |起動 して数分待つ |クリーンモード |液体を座らせます。
注:気泡や障害物は、サンプル取得前のサイトメーター開始プロセス中に除去しました。
- 品質管理
- 品質管理試薬を使用して、光電子増倍管の電圧を調整し、感度を評価します。
- ポリスチレンチューブで品質管理試薬を調製します。
- ベースラインを定義するには、0.5 mL の希釈液(10 mM ろ過 PBS、pH 7)と 3 滴のビーズを標識チューブに添加して、懸濁ビーズを調製します。
- ビーズバイアルを穏やかに反転させて混合します。
- ソフトウェアワークスペースから、 Cytometer |CST インターフェイスに接続するための CST。数分待ってから、「 サイトメーターが切断されました」というメッセージを確認します。
- 品質管理試薬の入ったポリスチレンチューブをフローサイトメータープローブに取り付けます。
- 品質管理試薬を使用して、光電子増倍管の電圧を調整し、感度を評価します。
- サイトメーターの構成の検証
- [System Summary]ウィンドウで、サイトメーターの構成が実験に適していることを確認します。
- 対応するセットアップビーズのバッチIDを選択して、選択したセットアップビーズのロットIDがCS&T研究ビーズの現在のロットと一致することを確認します。
- 性能チェック
- 「 パフォーマンスの確認 」オプションを選択し、「 実行」をクリックします。
- 性能チェックが完了すると、性能結果が表示されます。 サイトメーターのパフォーマンスレポートをご覧ください。 Finish をクリックしてパフォーマンスチェックを完了するか、サイトメーターからチューブを取り外して、 System Summary ウィンドウで結果を確認します。
- 形態測定および蛍光感度分析の最終結果を観察します。 | システム概要| サイトメーターの性能結果| ステータス: PASSED
2.胞子の準備
- 胞子形成後、17,949 × g で10分間遠心分離することにより、胞子を超純度氷冷水で3回すすぎます。
- 最後の遠心分離で得られたペレットを10mLの超純水で再懸濁します。
- 栄養細胞の不活化のために121ºCで45分間胞子をオートクレーブします。
注:異なる不活化方法を比較した私たちのグループが実施した以前の試験では、ステップ2.3で述べた条件が高い効率を示し、LB寒天培地のめっき分析法ではコロニー形成がないことを示しました。
3. フローサイトメトリーを用いたオートクレーブ滅菌胞子の定量
- オートクレーブ処理した胞子 50 μL を採取し、臭化エチジウム(EtBr、水で希釈した 10 mg/mL)と希釈係数 0.05% v/v で 30 分間、光から保護してインキュベートします(図 1A)。
- 胞子を1x リン酸緩衝生理食塩水(PBS)で17,949 × g で10分間遠心分離して3回洗浄し、1x PBSに再懸濁します。
- 希釈に関するメーカーの推奨に従って、10 μLのビーズを加えます。
- ステップ4で説明したフローサイトメーターを使用してサンプルを分析します。
注:このステップがうまく実行されなかった場合、計算で不均衡が観察されたため、ビーズはできるだけ均一にピペッティングする必要があることを強調することが重要です。
4. フローサイトメトリーによる解析
- Cytometerソフトウェアにログインします。
- ソフトウェアワークスペースから、 Cytometer |クリーンモード |液体を座らせます。
- ワークスペースに合わせて調整し、フローサイトメトリーでの解析を決定します。
- 解析のゲートを定義します(図 2)。
- ネガティブコントロール(マークされていない胞子)に基づく粒子の形態測定および蛍光特性に基づいてゲーティング戦略を定義します。
- 細胞形態測定を決定するには、x軸にFSC-Aパラメータ、y軸にSSC-Aパラメータの分析にドットプロットグラフィックを選択します。
- 蛍光を決定するには、 X 軸に FL5 を使用して、Y 軸に FL3 ドットプロット プロット を選択し 、4 象限でゲートを作成します。
- 解析のゲートを定義します(図 2)。
- 単色EtBr、単色APC、および多色EtBr+ APCで以前に標識された標識のないサンプルを含む12 x 75 mmストッパー付きポリスチレンチューブを使用します。
- ネガティブコントロールの入ったチューブを非常に穏やかに混合し、フローサイトメータープローブに取り付けます。
- [ 取得] をクリックします。
- レーザーの出力を設定するには、Cytometer |パラメータ |FSC(375)およびSSC(275)。
- 閾値を(500) Cytometer |しきい値。
- 自家蛍光を除去するには、胞子のみを含む無染料サンプルを分析します。
- フィルター検出器の電圧( FL3(603) および FL5(538) )を調整して、コントロールで選択した蛍光に関して陰性および陽性の集団を区別します。 サイトメーター |パラメーター。
- サイトメーター |報酬 |FL5/FL3 設定オフセットを 1.0 に設定します。
- 形態測定と蛍光分析の後、Acquisition 30,000 events |実験 | 実験レイアウト |獲得|30,000イベント....
- パラメータを調整した後、フローサイトメーターで標識され、ビーズを含むサンプルのデータを取得します。
- 式(1)を使用して、製造元の指示に記載されているように胞子濃度を計算します。
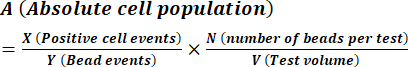 (1)
(1)
注:この研究では、ビーズの定量法をPetroff-Hausser計数チャンバー分析と比較しました。さらに、オートクレーブ処理した胞子の標識を、オートクレーブ処理していない胞子の標識と比較しました。
5. フローサイトメトリーを用いた胞子表面のタンパク質カップリング指数の推定
- 胞子50μL(103/μL)17,949 ×gを10分間遠心分離して回収し、その後、25μLの1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)(300 mM))で再懸濁する。
- 室温で15分間インキュベートします。
- 胞子懸濁液に25 μLの N-ヒドロキシスルホコハク酸イミド(NHS)(50 mM)を加え、室温で30分間インキュベートします。
- ステップ5.1で説明したように、胞子を1x PBSで遠心分離により3回洗浄します。
- 蛍光タンパク質を添加し、サンプルを15°Cで一晩放置します。
注:本研究で使用した蛍光タンパク質は、APC標識抗ヒトIL-10抗体です。この抗体は研究のモデルとして使用されましたが、EDC/NHSは胞子表面のタンパク質に存在する-COOH基と-NH2 基の間の共有結合ライゲーションを促進するため、他の蛍光分子の適用が可能です。 - ステップ5.3に従って胞子を洗います。
- 1:50 に希釈した 10 mg/mL のエチジウムブロマイドを加え、氷上に 1 時間放置し、光から保護します(図 1B)。
- ステップ5.3に従って胞子を洗います。
- 手順 4 を繰り返します。
- 蛍光を測定するには、ドットプロットのX軸のパラメータFL3とY軸のFL5を変更します。
- ステップ4で説明したように、FL3(670 LPフィルター)で青色レーザー(488 nm)とFL5(660/20フィルター)で赤色レーザー(633 nm)を備えたフローサイトメーターを使用してサンプルを分析します。
注:同じサンプルを、FITC 480/30 nm(緑)およびTRITC 540/25 nm(赤)のフィルターを使用して、顕微鏡下で1,000倍の倍率範囲でスライドの免疫蛍光分析を行いました。
Access restricted. Please log in or start a trial to view this content.
結果
オートクレーブ滅菌した胞子(AS)サンプルでは、計数ビーズとPetroff-Hausser法を用いて、それぞれ2 × 103 胞子/μlおよび1 × 103 胞子/μlを検出しました(図2)。
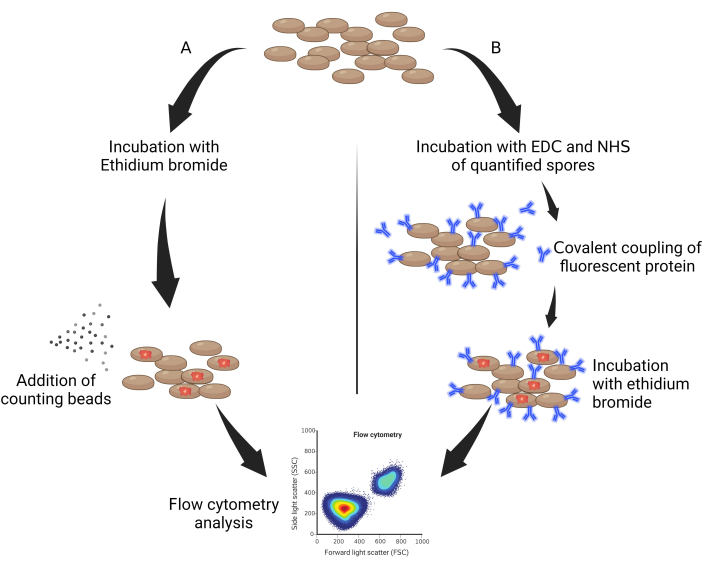
図1:胞子の定量化の一般的なスキーム。(A)EtBrで標...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
コロニーのプレートカウントなどの従来の方法は、時間がかかるだけでなく、生細胞も必要であり、不活化胞子の定量は不可能です5。ペトロフ・ハウザーチャンバーは別の方法論ですが、それを実行するには経験豊富な顕微鏡技師が必要です。フローサイトメトリーは、この目的に有用な代替手段であることが証明されています。
Genovese et
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には開示すべき利益相反はありません。
謝辞
この研究は、Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES)-Finance Code 001 によって部分的に資金提供されました。Governo do Estado do Amazonas Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAMのリソースを使用。Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).著者らは、PDTIS-FIOCRUZの施設を利用したPDTIS-FIOCRUZの技術開発プログラムに感謝する。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
参考文献
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved