Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Amélioration du dénombrement des spores de Bacillus subtilis et de l’analyse des marquages en cytométrie en flux
Dans cet article
Résumé
Ce protocole se concentre sur l’utilisation de la cytométrie en flux et des billes de comptage pour quantifier les spores bactériennes marquées au bromure d’éthidium. La méthode est également efficace pour analyser le couplage covalent des protéines à la surface des spores intactes.
Résumé
Les spores de Bacillus subtilis ont déjà été proposées pour différentes applications biotechnologiques et immunologiques ; Cependant, il est de plus en plus nécessaire de développer des méthodologies qui améliorent la détection des antigènes immobilisés à la surface des spores ainsi que leur quantification. Les analyses basées sur la cytométrie en flux ont déjà été proposées comme des approches rapides, fiables et spécifiques pour détecter les cellules marquées de B. subtilis. Ici, nous proposons l’utilisation de la cytométrie en flux pour évaluer l’efficacité d’affichage d’un anticorps fluorescent (FA) à la surface de la spore et quantifier le nombre de spores à l’aide de billes de comptage.
Pour cela, nous avons utilisé le bromure d’éthidium comme marqueur d’ADN et un anticorps marqué à l’allophycocyanine (APC), qui a été couplé aux spores, comme marqueur de surface. La quantification des spores a été réalisée à l’aide de billes de comptage car cette technique démontre une grande précision dans la détection des cellules. Les spores marquées ont été analysées à l’aide d’un cytomètre en flux, ce qui a confirmé le couplage. En conséquence, il a été démontré que le marquage de l’ADN améliorait la précision de la quantification par cytométrie en flux, pour la détection des spores germées. On a observé que le bromure d’éthidium n’était pas en mesure de marquer les spores dormantes ; Cependant, cette technique permet de déterminer plus précisément le nombre de spores avec des protéines fluorescentes couplées à leur surface, contribuant ainsi au développement d’études axées sur l’utilisation des spores comme plate-forme biotechnologique dans différentes applications.
Introduction
Bacillus subtilis est une bactérie gram-positive en forme de bâtonnet qui est capable de produire des spores au repos lorsque les conditions environnementales ne permettent pas la croissance cellulaire1. Les spores sont des formes cellulaires extrêmement stables et celles de plusieurs espèces, dont B. subtilis, sont largement utilisées comme probiotiques à usage humain et animal2. En raison de ses propriétés de résistance et d’innocuité, la spore de B. subtilis, qui présente des protéines hétérologues, a été proposée comme adjuvant muqueux, système d’administration de vaccins et plate-forme d’immobilisation enzymatique 3,4.
Pour obtenir des spores de B. subtilis, il est nécessaire de l’exposer à une privation de nutriments à l’aide d’un milieu de culture spécial. Après avoir obtenu et purifié ces spores, il faut les quantifier pour améliorer l’efficacité du test 5,6. Ainsi, certaines méthodes sont appliquées pour analyser la concentration des spores obtenues. Il est possible d’utiliser le comptage des plaques et une chambre Petroff-Hausser, également connue sous le nom de chambre de comptage. Ce dernier a été développé à l’origine pour déterminer la concentration des cellules sanguines ; Cependant, il est possible de l’utiliser dans le domaine de la microbiologie pour le comptage des spores 7,8. Bien qu’il s’agisse de la méthode standard utilisée pour le comptage cellulaire, la lecture est laborieuse car cette méthode est entièrement manuelle et sa précision dépend de l’expérience de l’opérateur.
Les analyses basées sur la cytométrie en flux (FC) ont déjà été proposées comme des approches rapides, fiables et spécifiques pour détecter les cellules marquées de Bacillus spp. L’utilisation de billes de comptage de cytométrie en flux a permis de garantir la reproductibilité dans le comptage cellulaire, dans les examens de routine (numération absolue des lymphocytes T CD4 et CD8) et dans le développement de la recherche portant sur des particules susceptibles d’être détectées et comptées par cytométrie en flux9. Godjafrey et Alsharif ont suggéré l’utilisation de billes de comptage pour la quantification de la FC des spores non marquées10. L’utilisation de la cytométrie en flux a été décrite pour le suivi de la sporulation chez Bacillus spp. par marquage de l’ADN des spores 10,11,12,13. Une autre étude a utilisé FC pour évaluer la quantité de protéines marquées par fluorescence à la surface des spores15.
Cette étude visait à utiliser des billes de comptage commerciales pour assurer une norme de reproductibilité en ce qui concerne le comptage d’événements à l’aide de la cytométrie en flux. Dans cet article, nous suggérons l’utilisation de billes de comptage pour le comptage cellulaire dans la FC afin d’affiner le dénombrement des spores et d’évaluer l’efficacité du couplage des anticorps marqués par fluorescence à la surface des spores.
Access restricted. Please log in or start a trial to view this content.
Protocole
Reportez-vous au tableau des matériaux pour plus de détails sur tous les matériaux, instruments et logiciels utilisés dans ce protocole.
1. Réglage de la cytométrie en flux
- Alignement des paramètres optiques d’un cytomètre en flux couplé à un ordinateur
- Connectez-vous au logiciel Cytometer.
- Dans l’espace de travail du logiciel, sélectionnez Cytomètre | Démarrez et attendez quelques minutes | Mode de nettoyage | S’asseoir liquides.
REMARQUE : Les bulles d’air et les obstructions ont été éliminées pendant le processus d’initiation du cytomètre, avant l’acquisition de l’échantillon.
- Contrôle qualité
- Utilisez le réactif de contrôle qualité pour ajuster les tensions des tubes photomultiplicateurs et évaluer leur sensibilité.
- Préparez le réactif de contrôle qualité dans un tube en polystyrène.
- Pour définir la ligne de base, préparez les billes de suspension en ajoutant 0,5 mL de diluant (10 mM de PBS filtré, pH 7) et 3 gouttes de billes dans le tube étiqueté.
- Mélangez le flacon de billes par inversion douce.
- Dans l’espace de travail du logiciel, sélectionnez Cytomètre | CST pour se connecter à l’interface CST. Attendez quelques minutes et observez le cytomètre à message déconnecté.
- Fixez le tube en polystyrène contenant le réactif de contrôle qualité à la sonde du cytomètre en flux.
- Utilisez le réactif de contrôle qualité pour ajuster les tensions des tubes photomultiplicateurs et évaluer leur sensibilité.
- Vérification de la configuration du cytomètre
- Dans la fenêtre Récapitulatif du système , vérifiez que la configuration du cytomètre est adaptée à l’expérience.
- Sélectionnez l’ID de lot de perles de configuration correspondant pour vérifier que l’ID de lot de perles de configuration sélectionné correspond au lot actuel de billes de recherche CS&T.
- Vérification des performances
- Sélectionnez l’option Vérifier les performances et cliquez sur Exécuter.
- Une fois la vérification des performances terminée, les résultats des performances seront affichés. Consultez le rapport sur les performances du cytomètre. Cliquez sur Terminer pour terminer la vérification des performances ou retirez le tube du cytomètre et examinez les résultats dans la fenêtre Résumé du système .
- Observez le résultat final de l’analyse morphométrique et de sensibilité à la fluorescence qui apparaîtra dans le | résumé du système| résultat de la performance du cytomètre| avec l’état : RÉUSSI
2. Préparation des spores
- Après sporulation, rincez les spores 3 fois avec de l’eau glacée ultra-pure par centrifugation à 17 949 × g pendant 10 min.
- Remettre en suspension la pastille obtenue lors de la dernière centrifugation avec 10 mL d’eau ultrapure.
- Autoclaver les spores pendant 45 min à 121 ºC pour l’inactivation des cellules végétatives.
NOTE : Des tests antérieurs effectués par notre groupe comparant différentes méthodes d’inactivation ont démontré que les conditions mentionnées à l’étape 2.3 présentaient une efficacité élevée, ne montrant aucune formation de colonies dans la méthode d’analyse de placage sur le milieu gélosé LB.
3. Quantification des spores autoclavées par cytométrie en flux
- Prélever 50 μL de spores autoclavées et les incuber à l’abri de la lumière avec du bromure d’éthidium (EtBr, 10 mg/mL dilué dans de l’eau) à un facteur de dilution de 0,05 % v/v pendant 30 min (Figure 1A).
- Laver les spores 3 fois avec 1 solution saline tamponnée au phosphate (PBS) par centrifugation à 17 949 × g pendant 10 min et les remettre en suspension dans 1 x PBS.
- Ajouter 10 μL de billes en suivant les recommandations du fabricant pour la dilution.
- Analysez l’échantillon à l’aide d’un cytomètre en flux comme décrit à l’étape 4.
REMARQUE : Il est important de souligner que les billes doivent être pipetées de la manière la plus homogène possible car des disparités ont été observées dans les calculs lorsque cette étape n’a pas été bien exécutée.
4. Analyse par cytométrie en flux
- Connectez-vous au logiciel Cytometer.
- Dans l’espace de travail du logiciel, sélectionnez Cytomètre | Mode de nettoyage | S’asseoir liquides.
- Ajustez à l’espace de travail pour déterminer l’analyse en cytométrie en flux.
- Définissez les portes pour les analyses (Figure 2).
- Définir la stratégie de déclenchement en fonction des caractéristiques morphométriques et de fluorescence des particules en fonction du témoin négatif (spores non marquées).
- Pour déterminer la morphométrie cellulaire, choisissez Dotplot graphic (Graphique en points ) pour l’analyse des paramètres FSC-A sur l’axe des x et SSC-A sur l’axe des y.
- Pour déterminer la fluorescence, choisissez FL3 Dotplot plots sur l’axe des ordonnées à l’aide de FL5 sur l’axe des abscisses et créez les portes dans quatre quadrants.
- Définissez les portes pour les analyses (Figure 2).
- Utilisez un tube en polystyrène bouché de 12 x 75 mm contenant des échantillons non étiquetés, préalablement étiquetés avec de l’EtBr unicolore, de l’APC unicolore et de l’EtBr+ APC multicolore.
- Mélangez très délicatement le tube contenant le témoin négatif et fixez-le à la sonde du cytomètre en flux.
- Cliquez sur Acquérir.
- Réglez la puissance des lasers en accédant à Cytomètre | Paramètres | FSC (375) et SSC (275).
- Réglez le seuil sur (500) Cytomètre | Seuil.
- Pour éliminer l’autofluorescence, analysez l’échantillon sans colorant contenant uniquement des spores.
- Ajustez les tensions des détecteurs de filtres : FL3 (603) et FL5 (538) pour discriminer les populations négatives et positives par rapport à la fluorescence choisie dans les témoins. Cytomètre | Paramètres.
- Cytomètre | Rémunération | Définissez le décalage de configuration FL5/FL3 sur 1,0.
- Après l’analyse morphométrique et fluorescente, configurez l’appareil pour l’acquisition de 30 000 événements | Expérimentez | Mise en page de l’expérience | Acquisition |30 000 événements....
- Après avoir ajusté les paramètres, acquérez des données pour les échantillons qui sont étiquetés et contiennent des billes dans le cytomètre en flux.
- Calculer la concentration de spores telle que décrite dans les instructions du fabricant à l’aide de l’équation (1).
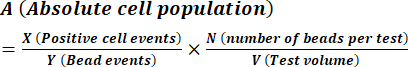 (1)
(1)
NOTE : Pour cette étude, la méthode de quantification des billes a été comparée à l’analyse de la chambre de comptage de Petroff-Hausser. De plus, le marquage des spores autoclavées a été comparé à celui des spores non autoclavées.
5. Estimation de l’indice de couplage protéique à la surface d’une spore par cytométrie en flux
- Prélever par centrifugation 50 μL de spores (103/μL) 17 949 × g pendant 10 min, puis remettre en suspension 25 μL de 1-éthyl-3-(3-diméthylaminopropyl)carbodiimide (EDC) (300 mM)).
- Incuber pendant 15 min à température ambiante.
- Ajouter 25 μL de N-hydroxysulfosuccinimide (NHS) (50 mM) à la suspension de spores et l’incuber à température ambiante pendant 30 minutes.
- Lavez les spores 3x avec 1x PBS par centrifugation comme décrit à l’étape 5.1.
- Ajouter les protéines fluorescentes et laisser les échantillons toute la nuit à 15 °C.
NOTE : La protéine fluorescente utilisée dans ce travail était un anticorps anti-IL-10 humain marqué par APC. Cet anticorps a été utilisé comme modèle pour l’étude, bien que l’application d’autres molécules fluorescentes soit possible puisque l’EDC/NHS favorise une ligature covalente entre les groupes -COOH et -NH2 présents dans les protéines à la surface des spores. - Lavez les spores conformément à l’étape 5.3.
- Ajouter 10 mg/mL de bromure d’éthidium dilué à 1 :50, puis laisser reposer 1 h sur glace et à l’abri de la lumière (figure 1B).
- Lavez les spores conformément à l’étape 5.3.
- Répétez l’étape 4.
- Pour déterminer la fluorescence, modifiez les paramètres FL3 sur l’axe X et FL5 sur l’axe Y du diagramme à points.
- Analysez l’échantillon à l’aide d’un cytomètre en flux avec le laser bleu (488 nm) à FL3 (filtre 670 LP) et le laser rouge (633 nm) en FL5 (filtre 660/20), comme décrit à l’étape 4.
REMARQUE : Les mêmes échantillons ont été analysés pour l’immunofluorescence sur des lames au microscope, à une plage de grossissement de 1 000 x et à l’aide des filtres suivants : FITC 480/30 nm (vert) et TRITC 540/25 nm (rouge).
Access restricted. Please log in or start a trial to view this content.
Résultats
Dans les échantillons de spores autoclavées (SA), 2 × 103 spores/μl et 1 × 103 spores/μl ont été détectées à l’aide de billes de comptage et de la méthode de Petroff-Hausser, respectivement (figure 2).
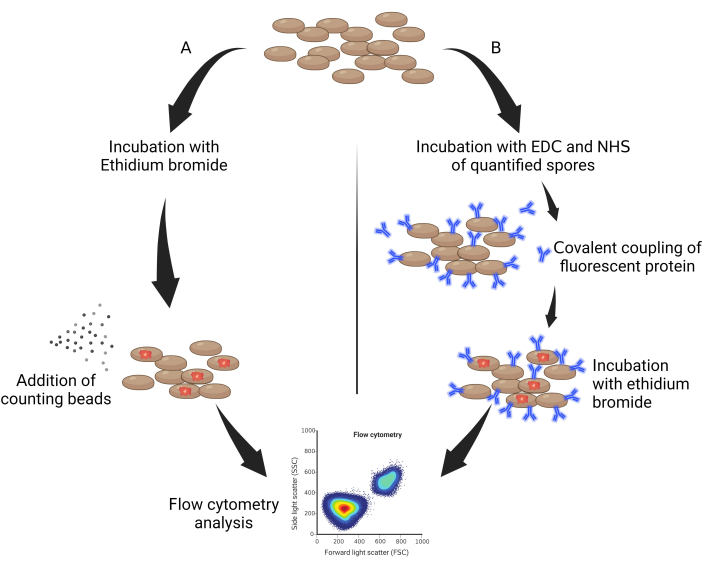
Figure 1 : Schéma général de quantification des spores. (A
Access restricted. Please log in or start a trial to view this content.
Discussion
Les méthodes traditionnelles, telles que le comptage sur plaque des colonies, prennent non seulement du temps, mais nécessitent également des cellules viables et ne permettent pas de quantifier les spores inactivées5. La chambre Petroff-Hausser est une méthodologie alternative, mais elle nécessite un microscopiste expérimenté pour la réaliser. La cytométrie en flux s’est avérée être une alternative utile à cette fin.
Genovese et al.12
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été financée en partie par le Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES) - Code de finances 001 ; Governo do Estado do Amazonas avec des ressources de la Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAM ; Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Les auteurs remercient le Programme de développement technologique des outils pour la santé PDTIS-FIOCRUZ pour l’utilisation de ses installations.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
Références
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon