Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Flow Sitometride Bacillus subtilis Spor Sayımı ve Etiket Analizinin İyileştirilmesi
Bu Makalede
Özet
Bu protokol, etidyum bromür ile etiketlenmiş bakteri sporlarını ölçmek için akış sitometrisinin kullanımına ve boncuk saymaya odaklanır. Yöntem ayrıca, bozulmamış sporların yüzeyindeki proteinlerin kovalent bağlanmasını analiz etmek için de etkilidir.
Özet
Bacillus subtilis'in sporları, farklı biyoteknolojik ve immünolojik uygulamalar için zaten önerilmiştir; Bununla birlikte, sporların yüzeyinde hareketsiz hale getirilen antijenlerin miktar tayinleri ile birlikte tespitini iyileştiren metodolojilerin geliştirilmesine artan bir ihtiyaç vardır. Akış sitometrisine dayalı analizler daha önce B. subtilis'in etiketli hücrelerini tespit etmek için hızlı, güvenilir ve spesifik yaklaşımlar olarak önerilmiştir. Burada, sporun yüzeyindeki bir floresan antikorun (FA) görüntüleme verimliliğini değerlendirmek ve sayma boncukları kullanarak spor sayısını ölçmek için akış sitometrisinin kullanılmasını öneriyoruz.
Bunun için DNA markörü olarak etidyum bromür ve yüzey markörü olarak sporlara bağlı allofikosiyanin (APC) etiketli antikor kullandık. Sporların miktarının belirlenmesi, sayma boncukları kullanılarak gerçekleştirildi, çünkü bu teknik hücrelerin tespitinde yüksek doğruluk gösteriyor. Etiketli sporlar, eşleşmeyi doğrulayan bir akış sitometresi kullanılarak analiz edildi. Sonuç olarak, DNA etiketlemesinin, çimlenmiş sporların tespiti için akış sitometrisi ile miktar tayininin doğruluğunu geliştirdiği gösterilmiştir. Etidyum bromürün hareketsiz sporları etiketleyemediği gözlemlendi; Bununla birlikte, bu teknik, yüzeylerine bağlı floresan proteini ile sporların sayısının daha kesin bir şekilde belirlenmesini sağlar, böylece sporların farklı uygulamalarda biyoteknolojik bir platform olarak kullanımına odaklanan çalışmaların geliştirilmesine yardımcı olur.
Giriş
Bacillus subtilis, çevresel koşullar hücre büyümesine izin vermediğinde hareketsiz sporlar üretebilen, çubuk şeklinde, gram pozitif bir bakteridir1. Sporlar son derece kararlı hücre formlarıdır ve B. subtilis de dahil olmak üzere çeşitli türlerin sporları, insan ve hayvan kullanımı için probiyotik olarak yaygın olarak kullanılmaktadır2. Direnç ve güvenlik özellikleri nedeniyle, heterolog proteinler sergileyen B. subtilis sporu, bir mukozal adjuvan, bir aşı dağıtım sistemi ve bir enzim immobilizasyon platformu olarak önerilmiştir 3,4.
B. subtilis'ten spor elde etmek için, özel bir kültür ortamı kullanarak besin yoksunluğuna maruz bırakmak gerekir. Bu sporları elde ettikten ve saflaştırdıktan sonra, test verimliliğini artırmak için bunları ölçmek gerekir 5,6. Bu nedenle, elde edilen sporların konsantrasyonunu analiz etmek için belirli yöntemler uygulanır. Plaka sayma ve sayma odası olarak da bilinen Petroff-Hausser odası kullanılabilir. İkincisi başlangıçta kan hücrelerinin konsantrasyonunu belirlemek için geliştirilmiştir; Ancak mikrobiyoloji alanında spor sayımı için kullanmak mümkündür 7,8. Hücre sayımı için kullanılan standart yöntem olmasına rağmen, bu yöntem tamamen manuel olduğundan ve doğruluğu operatörün deneyimine bağlı olduğundan okuma zahmetlidir.
Akış sitometrisi tabanlı (FC) analizler daha önce Bacillus spp.'nin etiketli hücrelerini tespit etmek için hızlı, güvenilir ve spesifik yaklaşımlar olarak önerilmiştir. Akış sitometrisi sayım boncuklarının kullanımı, rutin muayenelerde (CD4 ve CD8 T lenfositlerinin mutlak sayımı) hücre sayımında ve akış sitometrisi9 kullanılarak tespit edilebilen ve sayılabilen partikülleri içeren araştırmaların geliştirilmesinde tekrarlanabilirliği garanti etmiştir. Godjafrey ve Alsharif, etiketlenmemiş sporların FC miktar tayini için sayma boncuklarının kullanılmasını önerdi10. Bacillus spp.'de sporülasyonun izlenmesi için akım sitometrisinin kullanımı tanımlanmıştır.spor DNA'sınıetiketleyerek 10,11,12,13. Yine başka bir çalışma, spor yüzeyindeki floresan etiketli proteinlerin miktarını değerlendirmek için FC'yi kullandı15.
Bu çalışma, akış sitometrisi kullanılarak olay sayımına göre bir tekrarlanabilirlik standardı sağlamak için ticari sayma boncuklarını kullanmayı amaçlamıştır. Burada, spor sayımını iyileştirmek ve spor yüzeyindeki floresan etiketli antikorların bağlanma verimliliğini değerlendirmek için FC'de hücre sayımı için sayma boncuklarının kullanılmasını öneriyoruz.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu protokolde kullanılan tüm malzemeler, aletler ve yazılımlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Akış sitometrisi ayarı
- Bir bilgisayara bağlı akış sitometresinin optik parametrelerinin hizalanması
- Sitometre yazılımına giriş yapın.
- Yazılım çalışma alanından Sitometre | Başlatın ve birkaç dakika bekleyin | Temiz mod | Sıvıları oturtun.
NOT: Numune alınmadan önce sitometre başlatma işlemi sırasında hava kabarcıkları ve tıkanıklıklar giderilmiştir.
- Kalite kontrol
- Fotoçoğaltıcı tüplerin voltajlarını ayarlamak ve hassasiyetlerini değerlendirmek için kalite kontrol reaktifini kullanın.
- Kalite kontrol reaktifini bir polistiren tüp içinde hazırlayın.
- Taban çizgisini tanımlamak için, etiketli tüpe 0,5 mL seyreltici (10 mM filtrelenmiş PBS, pH 7) ve 3 damla boncuk ekleyerek süspansiyon boncuklarını hazırlayın.
- Boncuk şişesini hafifçe ters çevirerek karıştırın.
- Yazılım çalışma alanından Sitometre | CST arabirimine bağlanmak için CST. Birkaç dakika bekleyin ve sitometre bağlantısı kesildi mesajını gözlemleyin.
- Kalite kontrol reaktifini içeren polistiren tüpü akış sitometresi probuna takın.
- Fotoçoğaltıcı tüplerin voltajlarını ayarlamak ve hassasiyetlerini değerlendirmek için kalite kontrol reaktifini kullanın.
- Sitometrenin konfigürasyonunun doğrulanması
- Sistem Özeti penceresinde, sitometre yapılandırmasının deney için uygun olup olmadığını kontrol edin.
- Seçilen kurulum boncukları lot kimliğinin mevcut CS&T araştırma boncukları lotu ile eşleştiğini doğrulamak için karşılık gelen kurulum boncukları parti kimliğini seçin.
- Performans kontrolü
- Performansı Kontrol Et seçeneğini seçin ve Çalıştır'a tıklayın.
- Performans kontrolünün tamamlanmasının ardından performans sonuçları görüntülenecektir. Sitometre Performans Raporu'nu görüntüleyin. Performans kontrolünü tamamlamak için Son'a tıklayın veya tüpü sitometreden çıkarın ve Sistem Özeti penceresinde sonuçları gözden geçirin.
- | sistem özeti| sitometre performans sonucu| durumunda görünecek olan morfometrik ve floresan duyarlılık analizinin nihai sonucunu gözlemleyin: GEÇTİ
2. Sporların hazırlanması
- Sporülasyondan sonra, sporları 3x ultra saf buz gibi soğuk suyla 17.949 × g'da 10 dakika santrifüjleyerek durulayın.
- Son santrifüjden elde edilen peleti 10 mL ultra saf su ile tekrar süspanse edin.
- Vejetatif hücrelerin inaktivasyonu için sporları 121 ºC'de 45 dakika otoklavlayın.
NOT: Grubumuz tarafından farklı inaktivasyon yöntemlerini karşılaştırarak yapılan önceki testler, adım 2.3'te belirtilen koşulların, LB agar ortamı üzerindeki kaplama analiz yönteminde koloni oluşumu göstermeyerek yüksek verimlilik sunduğunu göstermiştir.
3. Akış sitometrisi kullanılarak otoklavlanmış sporların miktarının belirlenmesi
- 50 μL otoklavlanmış spor alın ve bunları 30 dakika boyunca% 0.05 v / v'lik bir seyreltme faktöründe etidyum bromür (EtBr, suda seyreltilmiş 10 mg / mL) ile ışıktan korunarak inkübe edin (Şekil 1A).
- Sporları 3x 1x fosfat tamponlu salin (PBS) ile 17.949 × g'da 10 dakika santrifüj ile yıkayın ve 1x PBS'de yeniden süspanse edin.
- Üreticinin seyreltme tavsiyelerine uyarak 10 μL boncuk ekleyin.
- 4. adımda açıklandığı gibi bir akış sitometresi kullanarak numuneyi analiz edin.
NOT: Boncukların mümkün olduğunca homojen bir şekilde pipetlenmesi gerektiğini vurgulamak önemlidir, çünkü bu adım iyi uygulanmadığında hesaplamalarda eşitsizlikler gözlemlenmiştir.
4. Akış sitometrisi kullanarak analiz
- Sitometre yazılımına giriş yapın.
- Yazılım çalışma alanından Sitometre | Temiz mod | Sıvıları oturtun.
- Akış sitometrisinde analizi belirlemek için çalışma alanına ayarlayın.
- Analizler için kapıları tanımlayın (Şekil 2).
- Negatif kontrole (işaretlenmemiş sporlar) dayalı parçacıkların morfometrik ve floresan özelliklerine dayalı geçit stratejisini tanımlayın.
- Hücre morfometrisini belirlemek için, x ekseninde FSC-A parametrelerinin ve y ekseninde SSC-A parametrelerinin analizi için Dotplot grafiğini seçin.
- Floresansı belirlemek için, x ekseninde FL5'i kullanarak y ekseninde FL3 Nokta Grafiği grafiklerini seçin ve kapıları dört çeyrekte oluşturun.
- Analizler için kapıları tanımlayın (Şekil 2).
- Daha önce tek renkli EtBr, tek renkli APC ve çok renkli EtBr+ APC ile etiketlenmiş etiketsiz numuneler içeren 12 x 75 mm tıpalı polistiren tüp kullanın.
- Negatif kontrolü içeren tüpü çok nazikçe karıştırın ve akış sitometresi probuna takın.
- Edin'e tıklayın.
- Sitometreye giderek lazerlerin gücünü ayarlayın | Parametreler | FSC (375) ve SSC (275).
- Eşiği (500) Sitometre olarak ayarlayın | Eşik.
- Otofloresansı gidermek için, yalnızca sporları içeren boyasız numuneyi analiz edin.
- Filtre dedektörlerinin voltajlarını ayarlayın: FL3 (603) ve FL5 (538), kontrollerde seçilen floresansa göre negatif ve pozitif popülasyonları ayırt etmek için. Sitometre | Parametreler.
- Sitometre | Ücretlendirme | FL5/FL3 kurulum ofsetini 1.0 olarak ayarlayın.
- Morfometri ve floresan analizinden sonra, cihazı Edinme 30.000 olay için yapılandırın | Deney | Deney düzeni | Edinme |30.000 etkinlik....
- Parametreleri ayarladıktan sonra, akış sitometresinde etiketlenmiş ve boncuk içeren numuneler için veri alın.
- Denklem (1)'i kullanarak üreticinin talimatlarında açıklandığı gibi spor konsantrasyonunu hesaplayın.
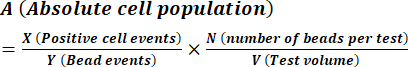 (1)
(1)
NOT: Bu çalışma için boncuk miktar tayini yöntemi Petroff-Hausser sayım odası analizi ile karşılaştırılmıştır. Ek olarak, otoklavlanmış sporların etiketlenmesi, otoklavlanmamış sporların etiketlenmesi ile karşılaştırıldı.
5. Akış sitometrisi kullanılarak bir spor yüzeyindeki protein bağlanma indeksinin tahmini
- 10 dakika boyunca 50 μL sporun (103 / μL) 17.949 × g santrifüjlenmesiyle hasat edin ve ardından 25 μL 1-etil-3- (3-dimetilaminopropil) karbodiimid (EDC) (300 mM) ile yeniden süspanse edin.
- Oda sıcaklığında 15 dakika inkübe edin.
- Spor süspansiyonuna 25 μL N-hidroksisülfosüksinimid (NHS) (50 mM) ekleyin ve oda sıcaklığında 30 dakika inkübe edin.
- Sporları 3x 1x PBS ile adım 5.1'de açıklandığı gibi santrifüjleme ile yıkayın.
- Floresan protein ekleyin ve numuneleri gece boyunca 15 °C'de bırakın.
NOT: Bu çalışmada kullanılan floresan protein, APC etiketli bir anti-insan IL-10 antikoruydu. Bu antikor, çalışma için bir model olarak kullanıldı, ancak EDC / NHS, spor yüzeyindeki proteinlerde bulunan -COOH ve -NH2 grupları arasında kovalent bir ligasyonu teşvik ettiğinden, diğer floresan moleküllerinin uygulanması mümkündür. - Sporları adım 5.3'e göre yıkayın.
- 1:50'de seyreltilmiş 10 mg/mL etidyum bromür ekleyin, ardından buz üzerinde 1 saat bekletin ve ışıktan koruyun (Şekil 1B).
- Sporları adım 5.3'e göre yıkayın.
- 4. adımı tekrarlayın.
- Floresansı belirlemek için, nokta grafiğinin X ekseninde FL3 ve Y ekseninde FL5 parametrelerini değiştirin.
- Numuneyi, adım 4'te açıklandığı gibi FL488'te (3 LP filtre) mavi lazer (670 nm) ve FL633'te (660/20 filtre) kırmızı lazer (4 nm) ile bir akış sitometresi kullanarak analiz edin.
NOT: Aynı numuneler, mikroskop altında, 1.000 x büyütme aralığında ve aşağıdaki filtreler kullanılarak slaytlar üzerinde immünofloresan açısından analiz edildi: FITC 480/30 nm (yeşil) ve TRITC 540/25 nm (kırmızı).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Otoklavlanmış spor (AS) örneklerinde sırasıyla sayım boncukları ve Petroff-Hausser yöntemi kullanılarak 2 × 103 spor/μl ve 1 × 103 spor/μl tespit edildi (Şekil 2).
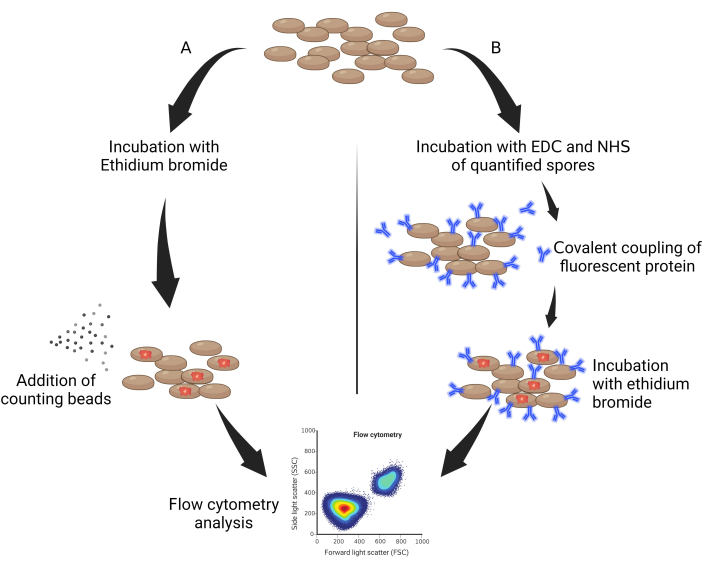
Şekil 1: Sporların miktarının belirlenmesinin genel şeması. (A) EtBr ile etiketlenmiş ...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kolonilerin plaka sayımı gibi geleneksel yöntemler sadece zaman alıcı olmakla kalmaz, aynı zamanda canlı hücrelere ihtiyaç duyar ve inaktive edilmiş sporların miktarının belirlenmesine izin vermez5. Petroff-Hausser odası alternatif bir metodolojidir, ancak bunu gerçekleştirmek için deneyimli bir mikroskopist gerektirir. Akış sitometrisinin bu amaç için yararlı bir alternatif olduğu kanıtlanmıştır.
Genovese ve ark.12 , <...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma kısmen Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES)-Finance Code 001 tarafından finanse edilmiştir; Governo do Estado do Amazonas, Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAM'ın kaynaklarıyla Amazonas; Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Yazarlar, Sağlık Araçlarında Teknolojik Gelişme Programı'na tesislerinin kullanımı için PDTIS-FIOCRUZ'a teşekkür eder.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
Referanslar
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır