需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
枯草芽孢杆菌孢子计数和标记分析在流式细胞术中的改进
摘要
该协议侧重于使用流式细胞术和计数珠来定量用溴化乙锭标记的细菌孢子。该方法还可用于分析完整孢子表面蛋白质的共价偶联。
摘要
枯草芽孢杆菌的孢子已被提议用于不同的生物技术和免疫学应用;然而,越来越需要开发改进固定在孢子表面的抗原及其定量的方法。基于流式细胞术的分析以前已被提出作为检测枯草芽孢杆菌标记细胞的快速、可靠和特异性方法。在此,我们建议使用流式细胞术来评估荧光抗体(FA)在孢子表面的显示效率,并使用计数珠量化孢子的数量。
为此,我们使用溴化乙锭作为 DNA 标记物,并使用与孢子偶联的别藻蓝蛋白 (APC) 标记抗体作为表面标记物。孢子的定量是使用计数珠进行的,因为该技术在细胞检测方面表现出很高的准确性。使用流式细胞仪分析标记的孢子,证实了偶联。结果表明,DNA标记提高了流式细胞术定量的准确性,用于检测萌发的孢子。据观察,溴化乙锭不能标记休眠孢子;然而,该技术可以更精确地测定荧光蛋白与其表面偶联的孢子数量,从而有助于开展专注于在不同应用中使用孢子作为生物技术平台的研究。
引言
枯草芽孢杆菌是一种杆状革兰氏阳性细菌,当环境条件不允许细胞生长时,能够产生静止孢子1。孢子是极其稳定的细胞形式,包括枯草芽孢杆菌在内的几种物种的孢子被广泛用作人类和动物使用的益生菌2。由于其抗性和安全性,枯草芽孢杆菌的孢子显示异源蛋白,已被提议作为粘膜佐剂、疫苗递送系统和酶固定平台 3,4。
为了从枯草芽孢杆菌中获得孢子,有必要使用特殊的培养基将其暴露在营养剥夺中。在获得并纯化这些孢子后,必须对其进行定量以提高测试效率 5,6。因此,应用某些方法来分析所获得的孢子的浓度。可以使用平板计数和 Petroff-Hausser 室(也称为计数室)。后者最初是为了确定血细胞的浓度而开发的;但是,可以在微生物学领域将其用于孢子计数7,8。尽管是用于细胞计数的标准方法,但读取是费力的,因为这种方法完全是手动的,其准确性取决于操作员的经验。
基于流式细胞术 (FC) 的分析先前已被提议作为检测 芽孢杆菌属标记细胞的快速、可靠和特异性方法。使用流式细胞术计数珠保证了常规检查(CD4 和 CD8 T 淋巴细胞的绝对计数)中细胞计数的可重复性,以及涉及能够使用流式细胞术检测和计数的颗粒的研究的发展9。Godjafrey 和 Alsharif 建议使用计数珠子对未标记的孢子进行 FC 定量10。描述了使用流式细胞术监测 芽孢杆菌属 的孢子形成。通过标记孢子DNA 10、11、12、13。另一项研究使用 FC 来评估孢子表面荧光标记蛋白质的数量15。
本研究试图使用商业计数微球来确保使用流式细胞术进行事件计数的可重复性标准。在此,我们建议在FC中使用计数珠进行细胞计数,以优化孢子计数并评估荧光标记抗体在孢子表面的偶联效率。
Access restricted. Please log in or start a trial to view this content.
研究方案
有关本协议中使用的所有材料、仪器和软件的详细信息,请参阅 材料表 。
1. 流式细胞术设置
- 与计算机耦合的流式细胞仪光学参数的对准
- 登录到流式细胞仪软件。
- 在软件工作区中,选择 "流式细胞仪"|"启动 并等待几分钟 |清洁模式 |静置液体。
注意:在样品采集之前,在细胞仪启动过程中去除气泡和障碍物。
- 质量管理
- 使用质控试剂调整光电倍增管的电压并评估其灵敏度。
- 在聚苯乙烯管中制备质量控制试剂。
- 为了确定基线,通过向标记的试管中加入 0.5 mL 稀释剂(10 mM 过滤的 PBS,pH 7)和 3 滴珠来制备悬浮珠。
- 通过轻轻倒置混合珠子瓶。
- 在软件工作区中,选择 "流式细胞仪"|"CST 连接到 CST 接口。等待几分钟,观察 消息 cytometer 断开连接。
- 将装有质控试剂的聚苯乙烯管连接到流式细胞仪探头。
- 使用质控试剂调整光电倍增管的电压并评估其灵敏度。
- 验证流式细胞仪的配置
- 在 "系统摘要" 窗口中,检查流式细胞仪配置是否适合实验。
- 选择相应的设置微球批次 ID,以验证所选的预设微球批次 ID 是否与当前批次的 CS&T 研究微球匹配。
- 性能检查
- 选择" 检查性能 "选项,然后单击 "运行"。
- 完成性能检查后,将显示性能结果。查看 流式细胞仪性能报告。单击 "完成 "以完成性能检查,或从流式细胞仪中取出试管并在" 系统摘要 "窗口中查看结果。
- 观察形态学和荧光灵敏度分析的最终结果,该结果将出现在 | 系统摘要| 流式细胞仪性能结果| 状态为:PASSED
2. 孢子的制备
- 孢子形成后,用超纯冰冷水冲洗孢子3次,以17,949× g 离心10分钟。
- 用 10 mL 超纯水重悬从上次离心中获得的沉淀。
- 将孢子在121ºC下高压灭菌45分钟,以灭活营养细胞。
注:我们小组先前进行的比较不同灭活方法的测试表明,步骤2.3中提到的条件表现出高效率,表明在LB琼脂培养基上的电镀分析方法中没有菌落形成。
3. 使用流式细胞术定量高压灭菌的孢子
- 取50μL高压灭菌的孢子,并用溴化乙锭(EtBr,10mg / mL在水中稀释)以0.05%v / v的稀释因子孵育30分钟(图1A)。
- 用1x磷酸盐缓冲盐水(PBS)洗涤孢子3x,以17,949× g 离心10分钟,并重悬于1x PBS中。
- 加入 10 μL 微珠,按照制造商的稀释建议进行。
- 使用流式细胞仪分析样品,如步骤4所述。
注意:需要强调的是,微珠应尽可能均匀地移液,因为当此步骤执行不充分时,在计算中观察到差异。
4. 使用流式细胞术进行分析
- 登录到流式细胞仪软件。
- 在软件工作区中,选择 "流式细胞仪"|"清洁模式 |静置液体。
- 调整工作区以确定流式细胞术中的分析。
- 定义分析的门(图 2)。
- 根据基于阴性对照(未标记孢子)的颗粒的形态和荧光特性定义门控策略。
- 要确定细胞形态测量,请选择 点图图形 以分析 x 轴上的 FSC-A 参数和 y 轴上的 SSC-A 参数。
- 要确定荧光,请在 y 轴上使用 FL5 在 x 轴上选择 FL3 点图 , 并在四个象限中创建门。
- 定义分析的门(图 2)。
- 使用含有未标记样品的 12 x 75 mm 塞聚苯乙烯管,先前用单色 EtBr、单色 APC 和多色 EtBr+ APC 标记。
- 非常轻柔地混合含有阴性对照的试管,并将其连接到流式细胞仪探头上。
- 点击 获取。
- 通过导航到流式细胞仪 |参数 |FSC (375) 和 SSC (275)。
- 将阈值设置为 (500) 流式细胞仪 |阈值。
- 为了去除自发荧光,分析仅含有孢子的无染料样品。
- 调整滤光片检测器的电压: FL3 (603) 和 FL5 (538), 以根据对照中选择的荧光区分阴性和阳性群体。 流式细胞仪 |参数。
- 流式细胞仪 |薪酬 | 将 FL5/FL3 设置偏移量 设置为 1.0。
- 形态测定和荧光分析后,为采集 30,000 个事件配置设备 |实验 | 实验布局 |收购 |30,000 个事件....
- 调整参数后,在流式细胞仪中获取标记并包含珠子的样品的数据。
- 使用公式(1)按照制造商说明的说明计算孢子浓度。
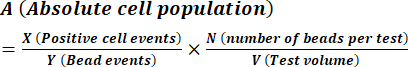 (1)
(1)
注:在本研究中,将磁珠定量方法与Petroff-Hausser计数室分析进行了比较。此外,将高压灭菌孢子的标记与非高压灭菌孢子的标记进行了比较。
5. 使用流式细胞术估计孢子表面的蛋白质偶联指数
- 通过离心 50 μL 孢子 (103/μL) 17,949 × g 收获 10 分钟,然后用 25 μL 1-乙基-3-(3-二甲氨基丙基)碳二亚胺 (EDC) (300 mM) 重悬)。
- 在室温下孵育15分钟。
- 向孢子悬浮液中加入 25 μL N-羟基磺基琥珀酰亚胺 (NHS) (50 mM),并在室温下孵育 30 分钟。
- 如步骤5.1所述,通过离心用1x PBS洗涤孢子3x。
- 加入荧光蛋白,将样品在15°C下放置过夜。
注:本研究中使用的荧光蛋白是APC标记的抗人IL-10抗体。该抗体被用作研究模型,尽管其他荧光分子的应用是可能的,因为 EDC/NHS 促进孢子表面蛋白质中存在的 -COOH 和 -NH2 基团之间的共价连接。 - 按照步骤5.3清洗孢子。
- 加入10mg / mL以1:50稀释的溴化乙锭,然后在冰上放置1小时并避光(图1B)。
- 按照步骤5.3清洗孢子。
- 重复步骤 4。
- 要确定荧光,请更改点图的 X 轴上的参数 FL3 和 Y 轴上的参数 FL5。
- 如步骤4所述,使用流式细胞仪在FL3(670 LP滤光片)处使用蓝色激光(488nm)和FL5(660/20滤光片)处使用红色激光(633nm)分析样品。
注:在显微镜下,在放大倍率为1,000 x的情况下,使用以下滤光片分析相同的样品的免疫荧光:FITC 480/30 nm(绿色)和TRITC 540/25 nm(红色)。
Access restricted. Please log in or start a trial to view this content.
结果
在高压灭菌孢子(AS)样品中,分别使用计数珠和Petroff-Hausser方法检测2×103 个孢子/μl和1×103 个孢子/μl(图2)。
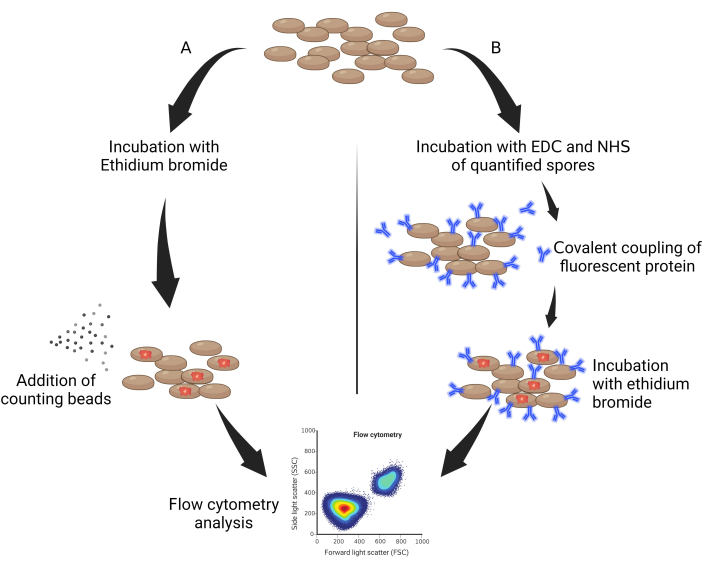
图1:孢子定量的一般方案。(A)用EtBr标记的孢子和(B)双标记的孢子。缩写:EDC...
Access restricted. Please log in or start a trial to view this content.
讨论
传统方法,如菌落平板计数,不仅耗时,而且需要活细胞,并且不允许对灭活孢子进行定量5。Petroff-Hausser 室是一种替代方法,但它需要经验丰富的显微镜学家来执行。流式细胞术已被证明是实现此目的的有用替代方法。
Genovese等人12 描述了使用流式细胞术对 芽孢杆菌 的活细胞和孢子进行定量分析,使用两种核酸标记物和所用设备?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突需要披露。
致谢
这项研究的部分资金来自Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES)-Finance Code 001;Governo do Estado do Amazonas,资源来自Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAM;Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).作者感谢健康工具技术发展计划PDTIS-FIOCRUZ使用其设施。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
参考文献
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。