É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Aprimoramento da Enumeração de Esporos de Bacillus subtilis e Análise de Marcação em Citometria de Fluxo
Neste Artigo
Resumo
Este protocolo enfoca o uso de citometria de fluxo e contagem de esferas para quantificar esporos bacterianos marcados com brometo de etídio. O método também é eficiente para analisar o acoplamento covalente de proteínas na superfície de esporos intactos.
Resumo
Os esporos de Bacillus subtilis já foram propostos para diferentes aplicações biotecnológicas e imunológicas; No entanto, há uma necessidade crescente para o desenvolvimento de metodologias que melhorem a detecção de antígenos imobilizados na superfície de esporos juntamente com sua quantificação. Análises baseadas em citometria de fluxo têm sido previamente propostas como abordagens rápidas, confiáveis e específicas para a detecção de células marcadas de B. subtilis. Neste trabalho, propomos o uso da citometria de fluxo para avaliar a eficiência de exibição de um anticorpo fluorescente (AG) na superfície do esporo e quantificar o número de esporos usando esferas de contagem.
Para isso, utilizamos brometo de etídio como marcador de DNA e um anticorpo marcado com aloficocianina (APC), que foi acoplado aos esporos, como marcador de superfície. A quantificação dos esporos foi realizada por meio da contagem de contas, uma vez que esta técnica demonstra alta acurácia na detecção das células. Os esporos marcados foram analisados por citômetro de fluxo, que confirmou o acoplamento. Como resultado, demonstrou-se que a marcação de DNA melhorou a precisão da quantificação por citometria de fluxo, para a detecção de esporos germinados. Observou-se que o brometo de etídio não foi capaz de marcar esporos dormentes; No entanto, esta técnica fornece uma determinação mais precisa do número de esporos com proteína fluorescente acoplada à sua superfície, auxiliando assim no desenvolvimento de estudos que enfoquem o uso de esporos como plataforma biotecnológica em diferentes aplicações.
Introdução
Bacillus subtilis é uma bactéria gram-positiva, em forma de bastonete, capaz de produzir esporos quiescentes quando as condições ambientais não permitem o crescimento celular1. Os esporos são formas celulares extremamente estáveis e os de várias espécies, incluindo B. subtilis, são amplamente utilizados como probióticos para uso humano e animal2. Devido às suas propriedades de resistência e segurança, o esporo de B. subtilis, que apresenta proteínas heterólogas, tem sido proposto como adjuvante da mucosa, sistema de liberação vacinal e plataforma enzimática 3,4.
Para obter esporos de B. subtilis, é necessário expô-lo à privação de nutrientes usando um meio de cultura especial. Após a obtenção e purificação desses esporos, deve-se quantificá-los para melhorar a eficiência do teste 5,6. Assim, alguns métodos são aplicados para analisar a concentração dos esporos obtidos. A contagem de placas e uma câmara de Petroff-Hausser, também conhecida como câmara de contagem, podem ser usadas. Este último foi originalmente desenvolvido para determinar a concentração de células sanguíneas; entretanto, é possível utilizá-lo no campo da microbiologia para contagem deesporos7,8. Apesar de ser o método padrão utilizado para contagem celular, a leitura é trabalhosa, pois este método é totalmente manual e sua precisão depende da experiência do operador.
Análises baseadas em citometria de fluxo (FC) têm sido previamente propostas como abordagens rápidas, confiáveis e específicas para a detecção de células marcadas de Bacillus spp. O uso de esferas de contagem por citometria de fluxo tem garantido reprodutibilidade na contagem celular em exames de rotina (contagem absoluta de linfócitos T CD4 e CD8) e no desenvolvimento de pesquisas envolvendo partículas passíveis de serem detectadas e contadas por citometria defluxo9. Godjafrey e Alsharif sugeriram o uso de contas de contagem para quantificação de CF de esporos não marcados10. O uso da citometria de fluxo foi descrito para o monitoramento da esporulação em Bacillus spp. através da marcação do DNA dos esporos 10,11,12,13. Outro estudo utilizou a CF para avaliar a quantidade de proteínas marcadas fluorescentemente na superfície dos esporos15.
Este estudo buscou utilizar esferas de contagem comerciais para garantir um padrão de reprodutibilidade em relação à contagem de eventos por citometria de fluxo. Neste trabalho, sugerimos o uso de esferas de contagem para contagem de células em FC para refinar a enumeração de esporos e avaliar a eficiência de acoplamento de anticorpos marcados fluorescentemente na superfície dos esporos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, instrumentos e software usados neste protocolo.
1. Configuração da citometria de fluxo
- Alinhamento dos parâmetros ópticos do citômetro de fluxo acoplado a um computador
- Faça login no software Cytometer.
- No espaço de trabalho do software, selecione Citômetro | Inicie e aguarde alguns minutos | Modo de limpeza | Sente-se fluidos.
OBS: Bolhas de ar e obstruções foram removidas durante o processo de início do citômetro, antes da aquisição da amostra.
- Controle de qualidade
- Use o reagente de controle de qualidade para ajustar as tensões dos tubos fotomultiplicadores e avaliar sua sensibilidade.
- Prepare o reagente de controle de qualidade em um tubo de poliestireno.
- Para definir a linha de base, prepare as esferas de suspensão adicionando 0,5 mL de diluente (PBS filtrado 10 mM, pH 7) e 3 gotas de esferas ao tubo marcado.
- Misture o frasco para injetáveis de contas por inversão suave.
- No espaço de trabalho do software, selecione Citômetro | CST para se conectar à interface CST. Aguarde alguns minutos e observe o citômetro de mensagem desconectado.
- Conecte o tubo de poliestireno contendo o reagente de controle de qualidade à sonda do citômetro de fluxo.
- Use o reagente de controle de qualidade para ajustar as tensões dos tubos fotomultiplicadores e avaliar sua sensibilidade.
- Verificação da configuração do citômetro
- Na janela Resumo do sistema , verifique se a configuração do citômetro é apropriada para o experimento.
- Selecione o ID do lote de contas de configuração correspondente para verificar se o ID do lote de contas de configuração selecionado corresponde ao lote atual de contas de pesquisa CS&T.
- Verificação de desempenho
- Selecione a opção Verificar desempenho e clique em Executar.
- Após a conclusão da verificação de desempenho, os resultados de desempenho serão exibidos. Veja o Relatório de Desempenho do Citômetro. Clique em Concluir para concluir a verificação de desempenho ou remova o tubo do citômetro e revise os resultados na janela Resumo do sistema .
- Observe o resultado final da análise morfométrica e de sensibilidade à fluorescência que aparecerá no | resumo do sistema| resultado do desempenho do citômetro | com o status: APROVADO
2. Preparação dos esporos
- Após a esporulação, enxaguar os esporos 3x com água gelada ultrapura por centrifugação a 17.949 × g por 10 min.
- Ressuspender o pellet obtido da última centrifugação com 10 mL de água ultrapura.
- Autoclave os esporos por 45 min a 121 ºC para inativação das células vegetativas.
OBS: Testes anteriores realizados por nosso grupo comparando diferentes métodos de inativação demonstraram que as condições citadas na etapa 2.3 apresentaram alta eficiência, não apresentando formação de colônias no método de análise de plaqueamento em meio ágar LB.
3. Quantificação de esporos autoclavados por citometria de fluxo
- Tomar 50 μL de esporos autoclavados e incubá-los protegidos da luz com brometo de etídio (EtBr, 10 mg/mL diluído em água) a um fator de diluição de 0,05% v/v por 30 min (Figura 1A).
- Lavar os esporos 3x com 1x solução salina tamponada com fosfato (PBS) por centrifugação a 17.949 × g por 10 min e ressuspender em 1x PBS.
- Adicionar 10 μL de contas, seguindo as recomendações do fabricante para diluição.
- Analise a amostra usando um citômetro de fluxo conforme descrito na etapa 4.
OBS: É importante ressaltar que as contas devem ser pipetadas da forma mais homogênea possível, pois foram observadas disparidades nos cálculos quando esta etapa não foi bem executada.
4. Análise por citometria de fluxo
- Faça login no software Cytometer.
- No espaço de trabalho do software, selecione Citômetro | Modo de limpeza | Sente-se fluidos.
- Ajuste ao espaço de trabalho para determinar a análise em citometria de fluxo.
- Defina as portas para as análises (Figura 2).
- Definir a estratégia de gating com base nas características morfométricas e de fluorescência das partículas com base no controle negativo (esporos não marcados).
- Para determinar a morfometria celular, escolha o gráfico Dotplot para análises dos parâmetros FSC-A no eixo x e SSC-A no eixo y.
- Para determinar a fluorescência, escolha gráficos de plotagem de pontos FL3 no eixo y usando FL5 no eixo x e crie as portas em quatro quadrantes.
- Defina as portas para as análises (Figura 2).
- Use um tubo de poliestireno com tampa de 12 x 75 mm contendo amostras não rotuladas, previamente rotuladas com EtBr, APC de cor única e APC EtBr+ multicolorido.
- Misture o tubo muito suavemente contendo o controle negativo e fixe-o à sonda do citômetro de fluxo.
- Clique em Adquirir.
- Defina a potência dos lasers navegando até o Citômetro | Parâmetros | FSC (375) e SSC (275).
- Defina o limite para (500) Citômetro | Limite.
- Para remover a autofluorescência, analise a amostra livre de corantes contendo apenas esporos.
- Ajustar as tensões dos detectores de filtro: FL3 (603) e FL5 (538) para discriminar populações negativas e positivas em relação à fluorescência escolhida nos controles. Citômetro | Parâmetros.
- Citômetro | Remuneração | Defina o deslocamento de configuração FL5/FL3 para 1.0.
- Após morfometria e análise fluorescente, configure o dispositivo para Aquisição de 30.000 eventos | Experiência | Layout do experimento | Aquisição |30.000 eventos....
- Após o ajuste dos parâmetros, adquira dados para as amostras que são rotuladas e contêm contas no citômetro de fluxo.
- Calcular a concentração de esporos conforme descrito pelas instruções do fabricante utilizando a equação (1).
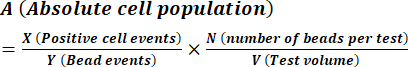 (1º)
(1º)
NOTA: Para este estudo, o método de quantificação de cordões foi comparado com a análise da câmara de contagem de Petroff-Hausser. Além disso, a marcação de esporos autoclavados foi comparada com a marcação de esporos não autoclavados.
5. Estimativa do índice de acoplamento de proteínas na superfície de esporos por citometria de fluxo
- Colher por centrifugação de 50 μL de esporos (103/μL) 17.949 × g por 10 min e, em seguida, ressuspender com 25 μL de 1-etil-3-(3-dimetilaminopropil)carbodiimida (EDC) (300 mM)).
- Incubar durante 15 minutos à temperatura ambiente.
- Adicionar 25 μL de N-hidroxisulfosuccinimida (NHS) (50 mM) à suspensão de esporos e incubá-la à temperatura ambiente durante 30 min.
- Lavar os esporos 3x com 1x PBS por centrifugação conforme descrito no passo 5.1.
- Adicione a proteína fluorescente e deixe as amostras durante a noite a 15 °C.
NOTA: A proteína fluorescente utilizada neste trabalho foi um anticorpo anti-IL-10 humano marcado com APC. Este anticorpo foi utilizado como modelo para estudo, embora a aplicação de outras moléculas fluorescentes seja possível, uma vez que EDC/NHS promovem uma ligação covalente entre os grupos -COOH e -NH2 presentes nas proteínas na superfície dos esporos. - Lavar os esporos de acordo com o passo 5.3.
- Adicionar 10 mg/mL de brometo de etídio diluído a 1:50, deixar por 1 h no gelo e protegido da luz (Figura 1B).
- Lavar os esporos de acordo com o passo 5.3.
- Repita a etapa 4.
- Para determinar a fluorescência, altere os parâmetros FL3 no eixo X e FL5 no eixo Y do diagrama de pontos.
- Analisar a amostra utilizando um citômetro de fluxo com o laser azul (488 nm) em FL3 (filtro 670 LP) e o laser vermelho (633 nm) em FL5 (filtro 660/20), conforme descrito na etapa 4.
OBS: As mesmas amostras foram analisadas para imunofluorescência em lâminas ao microscópio, na faixa de aumento de 1.000 x, e utilizando-se os seguintes filtros: FITC 480/30 nm (verde) e TRITC 540/25 nm (vermelho).
Access restricted. Please log in or start a trial to view this content.
Resultados
Em amostras de esporos autoclavados (AS), 2 × 103 esporos/μl e 1 ×10 3 esporos/μl foram detectados usando contagem de contas e o método de Petroff-Hausser, respectivamente (Figura 2).
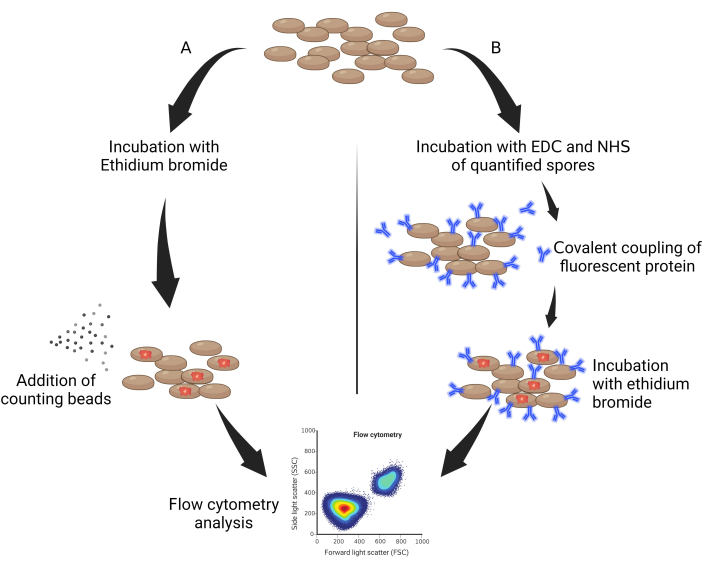
Figura 1: Esquema geral de quantificação dos esporos. (A) Esporos marcados com E...
Access restricted. Please log in or start a trial to view this content.
Discussão
Métodos tradicionais, como a contagem em placas de colônias, não só são demorados, como também necessitam de células viáveis e não permitem a quantificação de esporos inativados5. A câmara de Petroff-Hausser é uma metodologia alternativa, mas requer um microscopista experiente para realizá-la. A citometria de fluxo tem se mostrado uma alternativa útil para esse fim.
Genovese et al.12 descreveram o uso da citometria de fluxo para a ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este estudo foi financiado em parte pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES)-Código 001; Governo do Estado do Amazonas com recursos da Fundação de Amparo à Pesquisa do Estado do Amazonas-FAPEAM; Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Os autores agradecem ao Programa de Desenvolvimento Tecnológico em Ferramentas para a Saúde PDTIS-FIOCRUZ pela utilização de suas instalações.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| (N-hydroxysuccinimide) (NHS) | Sigma | 130672 | |
| Anti-human fluorescent antibody | BioLegend | 501410 | APC anti-human IL-10 |
| Anti-mouse fluorescent antibody | Thermo Scientific | A32723 | Alexa Fluor Plus 488 |
| BD FACSCanto II | BD | Flow cytometer | |
| BD FACSDiva Cytometer Setup & Tracking Beads Kit (use with BD FACSDiva software v 6.x) | BD | 642412 | Quality control reagent |
| BD FACSDiva Software v. 6.1.3 | BD | 643629 | Software |
| Centrifuge MegaFuge 8R | Thermo Scientific | 75007213 | |
| Counting Beads | BD | 340334 | TruCount Tubes |
| Eclipse 80i | Nikon | Fluorescent Microsope | |
| Ethidium Bromide | Ludwig Biotec | ||
| Phosphate buffered saline | Sigma-Aldrich | A4503 | |
| Plastic Microtubes | Eppendorf | ||
| Polystyrene tube | Falcon | 352008 | 5 mL polystyrene tube, 12 x 75 mm, without lid, non-sterile |
Referências
- McKenney, P. T., Driks, A., Eichenberger, P. The Bacillus subtilis endospore: assembly and functions of the multilayered coat. Nature Reviews. Microbiology. 11 (1), 33-44 (2013).
- Cutting, S. M. Bacillus probiotics. Food Microbiology. 28 (2), 214-220 (2011).
- Ricca, E., Baccigalupi, L., Cangiano, G., De Felice, M., Isticato, R. Mucosal vaccine delivery by non-recombinant spores of Bacillus subtilis. Microbial Cell Factories. 13, 115(2014).
- Falahati-Pour, S. K., Lotfi, A. S., Ahmadian, G., Baghizadeh, A. Covalent immobilization of recombinant organophosphorus hydrolase on spores of Bacillus subtilis. Journal of Applied Microbiology. 118 (4), 976-988 (2015).
- Harrold, Z., Hertel, M., Gorman-Lewis, D. Optimizing Bacillus subtilis spore isolation and quantifying spore harvest purity. Journal of Microbiological Methods. 87 (3), 325-329 (2011).
- Nicholson, W. L., Setlow, P. Sporulation, germination and outgrowth. Molecular biological methods for Bacillus. , John Wiley and Sons, Chichester, UK. (1990).
- Mora-Uribe, P., et al. Characterization of the adherence of Clostridium difficile spores: the integrity of the outermost layer affects adherence properties of spores of the epidemic strain R20291 to components of the intestinal mucosa. Frontiers in Cellular and Infection Microbiology. 6, 99(2016).
- Paidhungat, M., Setlow, P. Role of ger proteins in nutrient and nonnutrient triggering of spore germination in Bacillus subtilis. Journal of Bacteriology. 182 (9), 2513-2519 (2000).
- Schnizlein-Bick, C., Spritzler, J., Wilkening, C., Nicholson, J., O'Gorman, M. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Site Investigators and The NIAID DAIDS New Technologies Evaluation Group. Clinical and Diagnostic Laboratory Immunology. 7 (3), 336-343 (2000).
- Rapid enumeration of viable spores by flow cytometry. US Patent. , US20040023319A1 https://patentimages.storage.googleapis.com/fa/3c/dc/9e08d9ecd1b315/US20040023319A1.pdf (2003).
- Karava, M., Bracharz, F., Kabisch, J. Quantification and isolation of Bacillus subtilis spores using cell sorting and automated gating. PLoS ONE. 14 (7), e021989(2019).
- Genovese, M., Poulain, E., Doppler, F., Toussaint, R., Boyer, M. Bacillus spore enumeration using flow cytometry: A proof of concept for probiotic application. Journal of Microbiological Methods. 190, 106336(2021).
- Trunet, C., Ngo, H., Coroller, L. Quantifying permeabilization and activity recovery of Bacillus spores in adverse conditions for growth. Food Microbiology. 81, 115-120 (2019).
- Tehri, N., Kumar, N., Raghu, H., Vashishth, A. Biomarkers of bacterial spore germination. Annals of Microbiology. 68, 513-523 (2018).
- Isticato, R., Ricca, E., Baccigalupi, L. Spore adsorption as a nonrecombinant display system for enzymes and antigens. Journal of Visualized Experiments. 145, e59102(2019).
- Song, M., et al. Killed Bacillus subtilis spores as a mucosal adjuvant for an H5N1 vaccine. Vaccine. 30 (22), 3266-3277 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados