Method Article
غرسة محرك خفيفة الوزن لتسجيلات Tetrode المزمنة في الفئران اليافعة
In This Article
Summary
هنا ، نصف تصميم محرك الأقراص الصغير ، وإجراء الزرع الجراحي ، واستراتيجية التعافي بعد الجراحة التي تسمح بتسجيلات الحقل المزمن والوحدة الواحدة من مناطق الدماغ المتعددة في وقت واحد في الفئران الأحداث والمراهقين عبر نافذة تنموية حرجة من يوم ما بعد الولادة 20 (p20) إلى يوم ما بعد الولادة 60 (p60) وما بعده.
Abstract
يوفر الفيزيولوجيا الكهربية في الجسم الحي نظرة ثاقبة لا مثيل لها في ديناميكيات الدوائر دون المستوى الثاني للدماغ السليم ويمثل طريقة ذات أهمية خاصة لدراسة نماذج الفئران للاضطرابات العصبية والنفسية البشرية. ومع ذلك ، غالبا ما تتطلب هذه الأساليب غرسات جمجمية كبيرة ، والتي لا يمكن استخدامها في الفئران في نقاط زمنية مبكرة من النمو. على هذا النحو ، لم يتم إجراء أي دراسات تقريبا لعلم وظائف الأعضاء في الجسم الحي على الفئران الرضع أو الأحداث التي تتصرف بحرية ، على الرغم من حقيقة أن الفهم الأفضل للتطور العصبي في هذه النافذة الحرجة من المرجح أن يوفر رؤى فريدة حول اضطرابات النمو المعتمدة على العمر مثل التوحد أو الفصام. هنا ، يتم وصف تصميم محرك الأقراص الصغير ، وإجراء الزرع الجراحي ، واستراتيجية التعافي بعد الجراحة التي تسمح بتسجيلات المجال المزمن والوحدة الواحدة من مناطق الدماغ المتعددة في وقت واحد في الفئران مع تقدمهم في العمر من يوم ما بعد الولادة 20 (p20) إلى يوم ما بعد الولادة 60 (p60) وما بعده ، نافذة زمنية تتوافق تقريبا مع الأعمار البشرية من عامين حتى مرحلة البلوغ. يمكن تعديل وتوسيع عدد أقطاب التسجيل ومواقع التسجيل النهائية بسهولة ، مما يسمح بالتحكم التجريبي المرن في المراقبة في الجسم الحي لمناطق الدماغ ذات الصلة بالسلوك أو المرض عبر النمو.
Introduction
يخضع الدماغ لتغييرات واسعة النطاق خلال النوافذ التنموية الحرجة للطفولة والمراهقة1،2،3. تظهر العديد من الأمراض العصبية والنفسية ، بما في ذلك التوحد والفصام ، لأول مرة سلوكيا وبيولوجيا خلال هذه الفترة من نمو دماغ الأحداث والمراهقين4،5،6. في حين أن الكثير معروف فيما يتعلق بالتغيرات الخلوية والمشبكية والجينية التي تحدث عبر التطور المبكر ، إلا أنه لا يعرف سوى القليل نسبيا فيما يتعلق بكيفية تغير العمليات على مستوى الدائرة أو الشبكة خلال هذه النافذة الزمنية. الأهم من ذلك ، أن وظيفة الدماغ على مستوى الدائرة ، والتي تكمن في النهاية وراء السلوكيات المعقدة والذاكرة والإدراك ، هي خاصية ناشئة لا يمكن التنبؤ بها للوظيفة الخلوية والمشبكية7،8،9،10. وبالتالي ، لفهم وظائف الدماغ على مستوى الشبكة بشكل كامل ، من الضروري دراسة النشاط العصبي مباشرة على مستوى الدائرة العصبية السليمة. بالإضافة إلى ذلك ، لتحديد كيفية تغيير نشاط الدماغ طوال تطور الاضطرابات العصبية والنفسية ، من الأهمية بمكان فحص نشاط الشبكة في نموذج مرض صالح خلال النافذة الزمنية المحددة عندما تظهر الأنماط الظاهرية السلوكية للمرض وتتبع التغييرات الملحوظة أثناء استمرارها في مرحلة البلوغ.
يعد الفأر أحد أكثر الكائنات النموذجية العلمية شيوعا وقوة ، مع وجود أعداد كبيرة من السلالات الجينية الفريدة التي تمثل اضطرابات النمو العصبي مع بداية تعتمد على العمر للأنماط الظاهرية السلوكية و / أو ذاكري 11،12،13،14،15،16،17،18،19،20،21. في حين أنه من الصعب ربط النقاط الزمنية التنموية الدقيقة بين أدمغة البشر والفئران ، تشير المقارنات المورفولوجية والسلوكية إلى أن الفئران p20-p21 تمثل الأعمار البشرية من 2-3 سنوات ، وتمثل الفئران p25-p35 الأعمار البشرية من 11-14 سنة ، مع احتمال وصول الفئران إلى المكافئ التنموي لشخص بالغ يبلغ من العمر 20 عاما بواسطة p603 ، 22. وبالتالي ، لفهم كيفية تطور دماغ الأحداث بشكل أفضل وتحديد كيف تصبح الشبكات العصبية للدماغ مختلة وظيفيا في أمراض مثل التوحد أو الفصام ، سيكون من المثالي مراقبة نشاط الدماغ مباشرة في الجسم الحي في الفئران عبر الأعمار من 20 يوما إلى 60 يوما.
ومع ذلك ، فإن التحدي الأساسي في مراقبة نشاط الدماغ عبر التطور المبكر في الفئران هو صغر حجم الفئران اليافعة وضعفها النسبي. عادة ما يتطلب الزرع المزمن للأنقيب الكهربائية ، وهو أمر ضروري للدراسات الطولية لنمو الدماغ ، غلافا كبيرا وضخما لحماية أسلاك القطب الدقيقة ولوحات الواجهة23،24 ، ويجب أن تكون الغرسات متصلة بإحكام بجمجمة الفأر ، وهي أرق وأقل صلابة في الفئران الصغيرة بسبب انخفاض التعظم. وهكذا ، تم إجراء جميع الدراسات تقريبا لفسيولوجيا القوارض في الجسم الحي في الأشخاص البالغين بسبب حجمها النسبي وقوتها وسمك جمجمتها. حتى الآن ، تم إجراء معظم الدراسات التي تستكشف فسيولوجيا دماغ القوارض اليافعة في الجسم الحي في الفئران اليافعة من النوع البري ، مما يحد بالضرورة من القدرة على مراقبة وظائف دماغ الأحداث تجريبيا في نموذج يتصرف بحرية لاضطراب بشري 25،26،27،28،29،30.
تصف هذه المخطوطة السكن الجديد للزرع ، وإجراء الزرع الجراحي ، واستراتيجية التعافي بعد الجراحة لدراسة وظائف الدماغ طويلة المدى (حتى 4 أسابيع أو أكثر) في الجسم الحي للفئران اليافعة عبر نافذة زمنية حرجة من الناحية التنموية (p20 إلى p60 وما بعدها). يسمح إجراء الزرع بالتثبيت الموثوق والدائم للأقطاب الكهربائية على جماجم الفئران اليافعة. علاوة على ذلك ، فإن تصميم محرك الأقراص الصغير خفيف الوزن ، حيث يزن هذا المحرك الصغير ~ 4-6 جم عند تجميعه بالكامل ، وبسبب الحد الأدنى من الموازنة المطلوبة لتعويض وزن الغرسة ، فإنه لا يؤثر على الأداء السلوكي للفئران اليافعة خلال النماذج السلوكية النموذجية.
Protocol
تمت الموافقة على الدراسة الحالية من قبل لجنة رعاية واستخدام الحيوان المؤسسية التابعة للمركز الطبي بجامعة تكساس الجنوبية الغربية (البروتوكول 2015-100867) وتم إجراؤها وفقا لكل من المبادئ التوجيهية المؤسسية والمعهد الوطني للصحة. تم زرع الفئران الذكور والإناث C57 / Bl6 المستخدمة في الدراسة الحالية في p20 (الوزن 8.3-11.1 جم في وقت الزرع).
1. تصميم وبناء محرك الأقراص الصغيرة
- تصميم وطباعة محرك الأقراص الصغير رقميا (الشكل 1)
- قم بتنزيل قوالب طراز محرك الأقراص الصغير (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- تحديد المواقع التجسيمية لمنطقة (مناطق) الدماغ المستهدفة في أطلس تجسيمي مناسب.
- باستخدام برنامج التصميم ثلاثي الأبعاد بمساعدة الكمبيوتر (3D CAD) ، قم بتحميل قالب قنية محرك الأقراص الصغير (الشكل 1B).
- إذا لزم الأمر ، قم بتعديل مواقع إخراج قنية الإخراج على نموذج قنية محرك الأقراص الصغير لاستهداف منطقة (مناطق) الدماغ المطلوبة.
ملاحظة: يجب أن يكون طول كل قذف ثقب قنية 2 مم على الأقل لضمان خروج رباعي القنية من فتحة القنية التي تستهدف الهدف مباشرة. تم تصميم قالب قنية محرك الأقراص الصغير لاستهداف القشرة الحزامية الأمامية بشكل ثنائي (رباعي واحد لكل نصف كرة) ، ومنطقة الحصين CA1 (أربعة رباعيات لكل نصف كرة) ، ومنطقة الحصين CA3 (رباعيان لكل نصف كرة) ، مع رباعي مرجعي واحد لكل نصف كرة موضوعة في المادة البيضاء فوق منطقة الحصين CA1. - إذا لزم الأمر ، قم بتعديل جسم محرك الأقراص الصغير (الشكل 1A) لاستيعاب ملحق لوحة الواجهة الإلكترونية (EIB).
- اطبع جسم محرك الأقراص الصغير والقنية والمخروط والغطاء بدقة عالية على طابعة 3D (من الناحية المثالية بدقة أفضل من 25 ميكرومتر) ، وقم بإعداد المواد المطبوعة وفقا لبروتوكولات الشركة المصنعة. استخدم راتنجات الطابعة ذات الصلابة العالية.
- تجميع البراغي والمرفقات المخصصة (الشكل 2 أ ، ب)
- باستخدام برنامج 3D CAD ، قم بتحميل نماذج المرفقات اللولبية (الشكل 1E).
- اطبع المرفقات اللولبية بدقة عالية على طابعة 3D (من الناحية المثالية بدقة لا تقل عن 25 ميكرومتر) ، وقم بإعداد المواد المطبوعة وفقا لبروتوكولات الشركة المصنعة. استخدم راتنجات الطابعة ذات الصلابة العالية.
- قم بتثبيت المرفقات اللولبية على كل برغي متقدم رباعي (الشكل 1F) (يتم تصنيع البراغي المتقدمة رباعي الرؤوس خصيصا في ورشة الآلات قبل بناء محرك الأقراص الصغير).
- قم بتثبيت مرفقين لولبيين على كل برغي ، أحدهما أعلى والآخر أسفل التلال. تأكد من أن الجزء السفلي من كل ملحق لولبي يلامس التلال. امسك ملحقات المسمار مع هلام cyanoacrylate.
- بمجرد التثبيت ، تأكد من أن ملحقات المسمار لا تتحرك في المحور الطولي للبرغي ولكنها تدور بحرية بأقل مقاومة.
- تجميع جسم محرك الأقراص الصغير (الشكل 2C ، D)
- باستخدام مقص ناعم وحاد ، قم بقطع أنابيب بوليميد كبيرة (القطر الخارجي: 0.2921 مم ، القطر الداخلي: 0.1803 مم) إلى أقسام بطول ~ 6 سم.
- مرر أقسام البوليميد الكبيرة من خلال فتحات الإخراج الموجودة على قنية محرك الأقراص الصغير بحيث يمتد كل أنبوب إلى ما وراء قاع القنية ببضعة ملليمترات.
- باستخدام إبرة نظيفة 30 جم ، قم بتثبيت البوليميد على القنية عن طريق وضع كميات صغيرة من cyanoacrylate السائل. احرص على عدم السماح للسيانواكريلات بالدخول إلى داخل أنبوب البوليميد.
ملاحظة: يمكن أن يؤدي تقطير السائل cyanoacrylate إلى أسفل في القنية من خلال الجزء العلوي من جسم محرك الأقراص إلى تسريع هذه العملية ولكنه سيتطلب إعادة تنظيف ثقوب التوجيه لاحقا باستخدام مثقاب ذو رأس دقيق. - مرر أنابيب البوليميد الكبيرة من أعلى قنية محرك الأقراص الصغير من خلال فتحات البوليميد الكبيرة المناسبة في جسم محرك الأقراص الصغير.
- ادفع ببطء قنية محرك الأقراص الصغير وجسم محرك الأقراص الصغير معا حتى يصبحا متجاورين وتتشابك علامات تبويب مرفق القنية / الجسم. احرص على عدم التواء أو إتلاف أنابيب البوليميد في هذه العملية.
ملاحظة: يجب أن يمر كل أنبوب بوليميد بسلاسة من أسفل القنية إلى خارج الجزء العلوي من جسم محرك الأقراص الصغير. الانحناء الطفيف أمر طبيعي ، لكن الانحناء المفرط لأنبوب البوليميد يمكن أن يشوه رباعي ويمنعه من المرور مباشرة إلى الدماغ. - قم بتثبيت جسم محرك الأقراص الصغير وقنية محرك الأقراص الصغير معا باستخدام cyanoacrylate.
- باستخدام شفرة حلاقة حادة جديدة ، اقطع نهايات أنبوب البوليميد الكبيرة التي تنبثق من قاع فتحات إخراج القنية. تأكد من أن القطع موجود بالضبط في قاعدة القنية ، مما يجعل الأنابيب وقاع القنية يتدفقان مع بعضهما البعض.
- باستخدام مقص حاد ، قم بقطع أنبوب البوليميد الكبير فوق حافة الحافة الداخلية لجسم محرك الأقراص بزاوية ~ 45 درجة.
- تحميل البراغي المخصصة المجمعة (الشكل 2E)
- قم بربط كل برغي مخصص مجمع في الثقوب الخارجية لجسم محرك الأقراص الصغير. تأكد من مرور الدليل اللولبي عبر الفتحة الكبيرة في ملحقات المسمار. تقدم كل برغي بالكامل حتى لا يتقدم أكثر. يوصى بالتشحيم المسبق للبراغي بالزيت المعدني أو شحم المحور.
- باستخدام مقص حاد للغاية ، قم بقطع أنابيب بوليميد صغيرة (القطر الخارجي: 0.1397 مم ، القطر الداخلي: 0.1016) إلى أقسام بطول ~ 4 سم.
- مرر أقسام البوليميد الصغيرة عبر أنبوب بوليميد الكبير المثبت بالفعل في محرك الأقراص الصغير. تأكد من أن أنابيب البولي ميد الصغيرة الزائدة تبرز من أعلى وأسفل كل أنبوب بوليميد كبير.
- قم بتثبيت أنابيب البولي ميد الصغيرة على المرفقات اللولبية عبر cyanoacrylate ، مع الحرص على عدم السماح لأي cyanoacrylate بالدخول إلى أنابيب البولي imide الكبيرة أو الصغيرة.
- باستخدام شفرة حلاقة جديدة وحادة ، اقطع نهايات أنبوب البوليميد الصغيرة التي تنبثق من قاع ثقوب الكانيولا. تأكد من أن القطع موجود بالضبط في قاعدة القنية وأن القطع نظيف ، مع عدم وجود أي شيء يسد فتحة أنبوب البوليميد.
- باستخدام مقص حاد ، قم بقص الجزء العلوي من البوليميد الصغير بضعة ملليمترات فوق الجزء العلوي من ملحق المسمار بزاوية ~ 45 درجة. تأكد من أن القطع نظيف ، مع عدم وجود أي شيء يسد فتحة أنبوب البوليميد.
- تحميل رباعيات
- تحضير tetrodes (~ 6 سم في الطول) باستخدام الطرق الموصوفة سابقا31.
- باستخدام ملقط من السيراميك أو المطاط ، قم بتمرير رباعي بعناية عبر أحد أنابيب البوليميد الصغيرة ، تاركا ~ 2 سم بارزا من أعلى أنبوب البوليميد الصغير.
- قم بتثبيت رباعي الرباعيات في الجزء العلوي من أنبوب بوليميد الصغير عبر سيانواكريلات سائلة ، مع الحرص على عدم تثبيت أنابيب البوليميد الصغيرة والكبيرة معا في هذه العملية.
- اسحب المسمار حتى يقترب من الجزء العلوي من محرك الأقراص.
- أمسك بسلك رباعي البروز من أسفل محرك الأقراص ، وقم بتثبيته برفق عند النقطة التي يخرج فيها من القنية.
- ادفع المسمار بالكامل إلى محرك الأقراص.
- باستخدام مقص حاد جدا ، قم بقطع سلك tetrode فوق التواء مباشرة. تحت المجهر ، تأكد من أن القطع نظيف وأن المعدن من جميع رباعيات رباعي مكشوف.
- اسحب المسمار حتى يتم تثبيت tetrode فقط داخل القنية.
- كرر الخطوات 1.5.2-1.5.8 لجميع البراغي.
- قم بتوصيل بنك الاستثمار الأوروبي بمنصة دعم بنك الاستثمار الأوروبي عبر مسامير المجوهرات الصغيرة.
- قم بتوصيل كل قطب كهربائي لكل رباعي بالمنفذ المناسب في بنك الاستثمار الأوروبي.
- تحضير محرك الأقراص الصغير للجراحة
- صفيحة رباعية كهربائيا لتقليل المعاوقة الكهربائية باستخدام الطرق الموصوفة مسبقا31.
- بعد الطلاء ، تأكد من وضع كل رباعي في القنية بحيث يكون طرف tetrode متدفقا مع قاع كل فتحة قنية.
- حرك مخروط محرك الأقراص الصغير حول محرك الأقراص الصغير المكتمل. قم بتوصيل غطاء محرك الأقراص الصغير بمخروط محرك الأقراص الصغير عن طريق تحريك عمود التثبيت المخروطي في منفذ الغطاء.
- قم بتوجيه المخروط بحيث تمر موصلات بنك الاستثمار الأوروبي بحرية عبر فتحات تمرير اتصال بنك الاستثمار الأوروبي عند إغلاق الغطاء ، وقم بلصق المخروط في مكانه باستخدام cyanoacrylate الموضوعة حول قاعدة المخروط ، مع الحرص على عدم السماح لأي cyanoacrylate بالدخول إلى أي من فتحات إخراج القنية. انزع الغطاء.
- ردم بعناية كل ثقب قنية بزيت معدني معقم لمنع سوائل الجسم من دخول ثقوب البوليميد بعد الزرع الجراحي.
- معطف بعناية قاعدة القنية مع هلام البترول معقمة. سيكون هذا بمثابة حاجز لمنع العوامل الكيميائية (مثل الأسمنت السني) من دخول الدماغ المكشوف أثناء الجراحة.
- قم بوزن محرك الأقراص الصغير المجمع بالكامل والغطاء وأربعة براغي عظمية لتحضير موازنة متساوية الوزن.
- اختياريا ، قبل الجراحة ، قم ببثق tetrodes على مسافة مناسبة للوصول إلى مناطق الدماغ المستهدفة بمجرد تدفق محرك الأقراص مع الجمجمة.
ملاحظة: قبل الزرع الجراحي ، قم بتعقيم الغرسة عن طريق التعقيم بالغاز في أكسيد الإيثيلين (500-1200 مجم / لتر ، 2-4 ساعات). يجب تعقيم جميع مسامير العظام والأدوات الجراحية عن طريق الأوتوكلاف (121 درجة مئوية ، 30 دقيقة).
2. الزرع الجراحي
- تخدير الماوس وتركيبه في الجهاز التجسيمي
- ضع الماوس في صندوق صغير به مساحة كافية للتحرك ، وقم بتخدير الماوس باستخدام 3٪ -4٪ إيزوفلوران.
ملاحظة: يمكن استخدام عوامل مخدرة أخرى ، ولكن يجب توخي الحذر بسبب عمر وحجم ووزن موضوع الفأر اليافع. - بمجرد عدم استجابة الماوس (لا توجد استجابة لقرص الذيل ، معدل تهوية ~ 60 نفسا في الدقيقة) ، قم بإزالته من الصندوق ، وقم بتثبيته بسرعة على جهاز التجسيم.
- بسرعة ، ضع قناع التجسيم على خطم الماوس وحافظ على التخدير بنسبة 1-3٪ إيزوفلوران. ضع أي مسكن للألم معتمد من الطبيب البيطري ، مثل البوبرينورفين ذو الإطلاق المستدام (0.05-0.5 مجم / كجم تحت الجلد) ، أو العوامل المضادة للالتهابات ، مثل كاربروفين (5-10 مجم / كجم تحت الجلد) ، قبل الشق الجراحي الأولي.
- تأمين رأس الماوس بالكامل في الجهاز التجسيمي باستخدام قضبان الأذن. تأكد من أن الجمجمة مستوية وغير متحركة دون الضغط غير الضروري على قنوات أذن الماوس. بسبب التعظم المحدود لعظام جمجمة الأحداث ، من الممكن التسبب في ضرر دائم أثناء تثبيت الرأس.
- ضع الماوس في صندوق صغير به مساحة كافية للتحرك ، وقم بتخدير الماوس باستخدام 3٪ -4٪ إيزوفلوران.
- تحضير الفأر للجراحة وكشف الجمجمة
- حماية عيون الماوس عن طريق وضع كمية صغيرة من هلام المسيل للدموع الاصطناعية على كل عين وتغطية كل عين مع رقعة معقمة من رقائق معدنية.
ملاحظة: ستحافظ الدموع الاصطناعية على رطوبة العينين ، بينما تمنع الرقاقة أي مصدر ضوء من التسبب في ضرر طويل المدى. يفضل استخدام محاليل التمزق الاصطناعية السميكة لأنها يمكن أن تكون أيضا بمثابة حاجز أمام الإدخال غير المقصود للحلول الجراحية الأخرى التي يحتمل أن تكون سامة (الإيثانول ، أكريليك الأسنان ، إلخ) في العينين. - باستخدام مسحات معقمة ذات رؤوس قطنية ، ضعي كريم إزالة الشعر على المنطقة الجراحية لإزالة الشعر من فروة الرأس. احرص على عدم وضع الكريم بالقرب من العينين. بعد إزالة الشعر ، ضع ستارة معقمة على فروة الرأس لتأمين المنطقة الجراحية.
- باستخدام مسحات معقمة ذات رؤوس قطنية ، قم بتنظيف فروة الرأس عن طريق ثلاث غسلات متتالية من محلول البوفيدون واليود (10٪) متبوعا بكحول الأيزوبروبيل (100٪).
- باستخدام مشرط معقم أو مقص ناعم ، قم بإزالة فروة الرأس.
- باستخدام مسحات معقمة ذات رؤوس قطنية ومحاليل معقمة من محلول ملحي (0.9٪ كلوريد الصوديوم) وبيروكسيد الهيدروجين ، قم بتنظيف الجمجمة تماما.
- حدد bregma ، وباستخدام الجهاز التجسيمي ، حدد بعناية مواقع التسجيل المستهدفة على الجمجمة بعلامة دائمة.
- حماية عيون الماوس عن طريق وضع كمية صغيرة من هلام المسيل للدموع الاصطناعية على كل عين وتغطية كل عين مع رقعة معقمة من رقائق معدنية.
- فتح فتحة القنية وربط المراسي العظمية
- قم بإزالة الجمجمة التي تغطي مواقع التسجيل. # بسبب نحافة الجمجمة في هذا العمر ، قم بقطع الجمجمة بشفرة مشرط ؛ هذا يزيل ضرورة استخدام المثقاب ، والذي قد يتلف الجافية الأساسية. حافظ على رطوبة الجافية المكشوفة باستخدام محلول ملحي معقم (0.9٪ كلوريد الصوديوم) أو زيت معدني معقم. لا تقم بإزالة أو ثقب الجافية في هذه المرحلة ، لأنها رقيقة بما فيه الكفاية في الفئران الأحداث لمرور tetrodes في الخطوات المستقبلية.
- حفر بعناية ثقوب تجريبية لأربعة مسامير العظام.
- ضع البراغي العظمية في الأجزاء الجانبية والمنضدية أو الذيلية القصوى من الجمجمة ، حيث يكون العظم أكثر سمكا وتكون مسامير العظام بعيدة بما فيه الكفاية عن غرسة محرك الأقراص الدقيقة. بالنسبة لمسامير العظام ، استخدم مسامير مجوهرات معقمة ودقيقة (على سبيل المثال ، خيط UNM 120 ، رأس 1.5 مم).
- قم بلف برغي عظمي واحد بإحكام بسلك رفيع عالي التوصيل يعمل كأرضية ويتم توصيله ببنك الاستثمار الأوروبي في الخطوة 2.4.6.
- باستخدام شفرة مشرط أو باستخدام مثقاب بعناية ، قم بتسجيل الجمجمة بالقرب من مواقع ثقب المسمار العظمي. التسجيل مهم لتوفير سطح خشن بما فيه الكفاية لربط cyanoacrylate السائل في الخطوة 2.3.5.
- باستخدام مفك براغي معقم ومشبك لولبي معقم ، قم بربط كل برغي عظمي معقم في مكانه ، مع الحرص على عدم اختراق الجافية الأساسية.
- باستخدام إبرة معقمة 30 جم ، ضع cyanoacrylate السائل حول كل برغي عظمي. هذا يثخن الجمجمة بشكل فعال حيث تم ربط مسامير العظام. احرص على عدم السماح لأي سيانواكريلات بالدخول إلى الجافية المكشوفة فوق مواقع التسجيل.
- خفض وتوصيل محرك الأقراص الصغير (الشكل 2G)
- قم بتركيب محرك الأقراص الصغير المكتمل على جهاز التجسيم ليتم إنزاله بعناية على جمجمة الفأر. تأكد من أن قنية محرك الأقراص الصغير ستكون عند الإحداثيات المناسبة عند خفضها.
- اخفض محرك الأقراص الصغير ببطء ، وتحرك فقط في الاتجاه الظهري / البطني. خفض محرك الأقراص الصغير مع تقدم tetrodes بالفعل من ثقوب القنية (الخطوة 1.6.6) من أجل تصور دخولها إلى الدماغ ؛ يمكن لأي حركة وسطية / جانبية أو منضدية / ذيلية عندما تلمس رباعيات الماوس أن تنحني الرباعيات وتتسبب في تفويت وجهتها النهائية.
- بمجرد خفض محرك الأقراص الصغير بالكامل ، تأكد من أن قاعدة القنية تتلامس فقط مع الجمجمة / الجافية. ستكون طبقة الفازلين و / أو الزيت المعدني بمثابة حاجز لتغطية الجافية المكشوفة. إذا لزم الأمر ، أضف هلام البترول المعقم أو شمع العظام المعقم لتغطية الجافية المكشوفة الزائدة.
- أثناء تثبيت محرك الأقراص الصغير في مكانه باستخدام الجهاز التجسيمي ، قم بتغطية الجمجمة بأسمنت الأسنان لتثبيت قاعدة محرك الأقراص الصغير على مسامير العظام المزروعة.
ملاحظة: يجب أن يغلف الأسمنت السني جميع البراغي العظمية بالكامل ويجب أن يغطي حافة تثبيت الأسمنت السني على قنية محرك الأقراص الصغير. - أثناء تثبيت الأسمنت السني ، قم بتشكيله بعناية لمنع الزوايا أو الحواف الحادة التي قد تضر الماوس أو تتلف محرك الأقراص الصغير. تأكد من وجود أسمنت أسنان كاف لتثبيت محرك الأقراص الصغير ، ولكن تخلص من الأسمنت السني المفرط الذي سيضيف وزنا غير ضروري.
- قم بربط السلك الأرضي بعناية من خلال محرك الأقراص الصغير ، وقم بتوصيله بالفتحة المناسبة في بنك الاستثمار الأوروبي.
- بمجرد ضبط الأسمنت السني بالكامل ، افصل محرك الأقراص الصغير بعناية عن الجهاز المجسم. ضع الغطاء على محرك الأقراص الصغير.
- باستخدام مسحة معقمة ذات رؤوس قطنية ومحلول ملحي معقم ، قم بتنظيف الماوس.
- باستخدام مسحة معقمة ذات رؤوس قطنية ، ضع طبقة رقيقة من مرهم مضاد حيوي على أي فروة رأس مكشوفة بالقرب من موقع الزرع.
- قم بإزالة الرقاقة من عيون الماوس.
- قم بإزالة الماوس من جهاز التجسيم ، مع الحرص على دعم الوزن الإضافي لمحرك الأقراص الصغير أثناء نقل الماوس إلى قفص نظيف.
3. التعافي بعد الجراحة
- انتعاش فوري
- قبل الجراحة ، قم بإعداد نظام الموازنة عن طريق توصيل أنبوب PVC بقطر 0.75 ، كما هو موضح في الشكل 2G. يمر ذراع واحد من النظام عبر ثقوب محفورة في غطاء القفص ، ويستقر الذراع الثاني أعلى غطاء القفص ، ويمتد الذراع الثالث فوق القفص وخارجه. الذراع العلوي متوج.
- قم بتوصيل محرك الأقراص الصغير بعناية بنظام الموازنة (الشكل 2G-I) ، واستخدم وزنا موازنا مطابقا لوزن محرك الأقراص الصغير ومسامير العظام. قم بتشغيل خيط قوي أو خيط صيد من موصل متصل ببنك الاستثمار الأوروبي على الأذرع الثلاثة لنظام الموازنة إلى وزن الموازنة ، الذي يتدلى فوق الذراع العلوي.
- تأكد من أن الموازنة متصلة بقوة بمحرك الأقراص الصغير EIB وأن هناك خطا كافيا لمنح الماوس وصولا كاملا إلى القفص بالكامل.
- توفير هلام غني بالمغذيات في القفص جنبا إلى جنب مع تشاو القوارض العادية المبللة لضمان الإماهة والتعافي.
- راقب الفأر حتى يتعافى تماما من التخدير الجراحي.
- الانتعاش على المدى الطويل
- في جميع الأوقات ، عندما لا يتم توصيله بجهاز التسجيل ، تأكد من أن محرك الأقراص الصغير مدعوم بنظام الموازنة. قلل ثقل الموازنة بمرور الوقت ، ولكن لا تقم أبدا بإزالته تماما لتجنب الضغط غير المتوقع على الماوس أو عزم الدوران على مسامير العظام.
- لمنع تلف نظام الزرع والموازنة ، قم بإيواء الماوس دون إمكانية التفاعل المباشر مع الفئران الأخرى طوال مدة التجربة.
- توفير هلام غني بالمغذيات لمدة 3 أيام على الأقل بعد الجراحة ، وعند هذه النقطة سيكون الطعام الصلب وحده كافيا.
- نظرا للمتطلبات العامة لنظام الموازنة ، لا توفر الطعام والماء في شبكة سلكية علوية ؛ ضع الطعام على أرضية القفص ، ووفر الماء من خلال جانب القفص. لمنع التلف ، استبدل الطعام بالكامل يوميا.
- يوميا ، تأكد من أن الماوس لديه حرية الوصول إلى كامل القفص وأن الموازنة متصلة بقوة وقوة بمحرك الأقراص الصغير.
النتائج
تم استخدام البروتوكول الموصوف أعلاه لتسجيل إشارات المجال المحلي المحتملة والوحدات الفردية من مناطق الدماغ المتعددة في وقت واحد في الفئران ، مع إجراء تسجيلات يومية في نفس الفئران من p20 إلى p60. تم الإبلاغ هنا عن تسجيلات فسيولوجية كهربية تمثيلية من فأرين وأنسجة ما بعد التجربة توضح مواقع التسجيل النهائية.
الزرع الجراحي للمحرك الصغير في فئران p20
تم إنشاء محرك أقراص صغير (الشكل 1) (الشكل 2) وزرعه جراحيا في ماوس p20 ، كما هو موضح أعلاه. بعد الجراحة مباشرة ، تم ربط الماوس بنظام الموازنة (الشكل 2G-I) وسمح له بالتعافي. بمجرد أن أصبح الماوس متحركا بالكامل ، تم توصيل محرك الأقراص الصغير بنظام تسجيل الفيزيولوجيا الكهربية في الجسم الحي. تم تعليق الكابلات التي تربط محرك الأقراص الصغير بجهاز التسجيل فوق الماوس. تم الحصول على تسجيلات الفيزيولوجيا الكهربية (32 كيلو هرتز) عبر جميع القنوات لمدة 1 ساعة بينما تصرف الفأر بشكل طبيعي في قفصه المنزلي. بعد التسجيل ، تم فصل الماوس عن نظام التسجيل ، وإعادة توصيله بنظام الموازنة ، وعاد إلى حظيرة الحيوان مع حرية الوصول إلى الماء والشو.
التسجيل اليومي للنشاط العصبي
تم الحصول على تسجيلات الفيزيولوجيا الكهربية يوميا لعدة أسابيع لتمكين المراقبة المزمنة لنفس منطقة الدماغ عبر النوافذ التنموية الحرجة ل p20-p60. يتم عرض عينة من إمكانات الحقل المحلي الخام (LFP) من عبر التسجيلات المزمنة في الشكل 3A ، C. تم الحصول على وحدات مفردة معزولة في وقت واحد من رباعيات متعددة (الشكل 3 ب). تم تحديد الوحدات ذات الأشكال الموجية المتشابهة عبر عدة أيام (الشكل 3B ، الوسط واليمين) ، ولكن نظرا للانجراف المحتمل لقطب التسجيل ، لم يكن من الممكن الادعاء بشكل قاطع أنه تم تحديد نفس الوحدة عبر الأيام. في فأر منفصل تم زرعه في p20 وتم تسجيله يوميا لعدة أسابيع ، تم فحص النشاط العصبي على رباعي يستهدف المنطقة الظهرية CA1. تم تحديد تموجات كبيرة السعة ووحدات مفردة معزولة جيدا في كل يوم من أيام التسجيل (الشكل 4). تشير هذه البيانات إلى أن التسجيلات الفيزيولوجية الكهربية المستقرة وعالية الجودة في الجسم الحي يمكن أن تكون من نفس الفأر عبر التطور المبكر.
التأكيد النسيجي لمواقع التسجيل والتأثير التنموي للزرع المزمن
بعد يوم التسجيل الأخير ، تم تخدير الفأر تماما عن طريق تخدير الأيزوفلوران متبوعا بحقنة قاتلة من الصوديوم البنتوباربيتال ، وتم تمرير تيار عبر أطراف القطب لإنتاج آفات صغيرة في مواقع التسجيل. سمح التقسيم النسيجي بعد التجربة لدماغ الفأر بتصور مواقع التسجيل النهائية (الشكل 5 أ ، ب). في مجموعة منفصلة ، تم زرع ثلاثة ذكور وثلاث إناث من الفئران جراحيا في p20 كما هو موضح أعلاه. تم ترك أعداد متساوية من رفقاء القمامة دون زرع والحفاظ عليها في ظروف سكنية متطابقة. تم التضحية بالفئران في p62 (6 أسابيع بعد الجراحة للمجموعة المزروعة). تم تنظيف الجماجم بعناية ، وتم أخذ قياسات خارجية لمسافة بريجما إلى لامدا (الشكل 5C ، أعلى اليسار) وعرض الجمجمة الأقصى الخارجي عند لامدا (الشكل 5C ، أعلى اليمين). تم إجراء شق على طول خط الوسط من الجمجمة ، وتمت إزالة نصف الجمجمة لاستئصال الدماغ لقياس الكتلة (الشكل 5C ، أسفل اليمين). تم قياس ارتفاع تجويف الجمجمة في bregma من نصف الجمجمة السليم (الشكل 5C ، أسفل اليسار). لم يكن هناك مقياس يختلف اختلافا كبيرا بين الأفواج المزروعة وغير المزروعة (اختبار مجموع رتبة ويلكوكسون) ، مما يشير إلى أن الزرع طويل الأمد ، بدءا من p20 ، ليس له تأثير جسيم على التطور الطبيعي للجمجمة أو حجم الدماغ.

الشكل 1: مكونات محرك الأقراص الصغيرة. عروض ثلاثية الأبعاد لجسم محرك الأقراص الصغير (A) ، (B) القنية ، (C) المخروط ، (D) الغطاء ، (E) الملحقات اللولبية ، و (F) المسمار اللولبي المتقدم. يشار إلى الميزات الهامة لكل مكون. يمكن استخراج تفاصيل القياس من ملفات النموذج المتوفرة في https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: بناء محرك الأقراص الصغير . (A) منظر جانبي و (B) علوي للبرغي المتقدم رباعي الرؤوس مع توصيل ملحقات المسمار العلوي والسفلي. (ج) منظر جانبي و (د) علوي للمحرك الصغير مع توصيل الجسم والقنية وأنبوب بوليميد كبير يمر عبر كل فتحة قنية ومشذب إلى أسفل القنية. ( ه) منظر جانبي للمحرك الصغير مع وجود البراغي وأنابيب البولي ميد الصغيرة في مكانها. يتم قطع قمم أنابيب البوليميد الصغيرة مباشرة قبل تحميل رباعي. (و) محرك ميكرو مكتمل متصل بجهاز التجسيم. تمت إزالة المخروط الواقي الذي يحيط عادة بمحرك الأقراص الصغير لأغراض التصور. لاحظ أن بعض الملحقات اللولبية تمت طباعتها في راتينج أسود لمحرك الأقراص الصغير هذا. (ز) نظام دعم الموازنة. (ح) منظر جانبي و (I) علوي لقفص الماوس مع توصيل نظام دعم الموازنة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
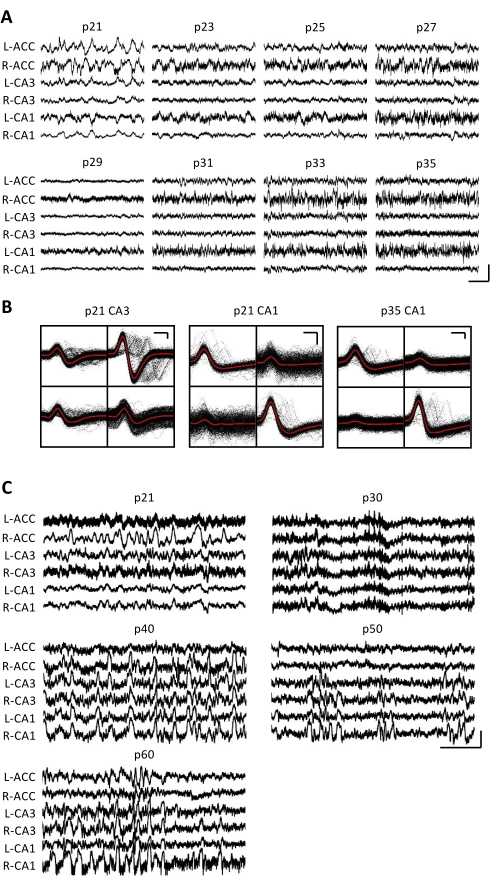
الشكل 3: تسجيلات الفيزيولوجيا الكهربية التمثيلية. تم زرع ماوس p20 بمحرك أقراص صغير كما هو موضح أعلاه. بدءا من p21 وكل يوم بعد ذلك لمدة أسبوعين ، تم توصيل الماوس بجهاز التسجيل ، وتم تسجيل النشاط العصبي لمدة 1 ساعة على الأقل. (أ) تسجيلات إمكانات المجال المحلي الخام (LFP) من الثنائية (L = اليسار ؛ R = يمين) القشرة الحزامية الأمامية (ACC) ، منطقة الحصين CA3 (CA3) ، ومنطقة الحصين CA1 (CA1). تم جمع البيانات كل يوم. للتوضيح ، يتم عرض البيانات من الأيام الفردية فقط. تم أخذ جميع الآثار خلال فترات الجمود في قفص المنزل. شريط المقياس: 1 مللي فولت ، 2 ثانية. (B) وحدات فردية تمثيلية معزولة من منطقة الحصين CA3 (يسار) و CA1 (يمين) للتسجيلات في اللوحة A. تظهر جميع أشكال الموجات الخام على كل قطب كهربائي باللون الأسود ؛ المتوسط باللون الأحمر. شريط المقياس: 50 ميكروفولت ، 0.2 مللي ثانية. (C) تتبع LFP الخام التمثيلي لكل يوم 10 حتى يوم التسجيل النهائي في p60 للماوس الثاني المزروع في p20. تم جمع البيانات كل يوم. للتوضيح ، يتم عرض البيانات فقط من كل يوم 10. تم أخذ جميع الآثار خلال فترات الجمود في قفص المنزل. شريط المقياس: 1 مللي فولت ، 2 ثانية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
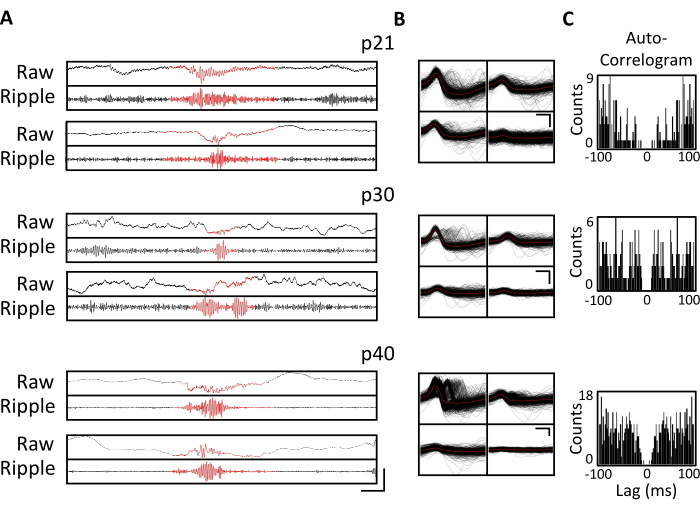
الشكل 4. استقرار التسجيلات المزمنة. تم زرع ماوس p20 بمحرك أقراص صغير ، كما هو موضح أعلاه. بدءا من p21 وبعد ذلك لمدة 4 أسابيع ، تم توصيل الماوس بجهاز التسجيل ، وتم تسجيل النشاط العصبي لمدة 1 ساعة على الأقل. تظهر بيانات من رباعيات تستهدف الحصين الظهري CA1. (أ) LFP الخام (العلوي) والمفلتر بالتموج (السفلي) لأحداث التموج المحددة في p21 و p30 و p40. لتحديد أحداث التموج ، تم ترشيح LFP الخام لتمرير النطاق بين 125 هرتز و 300 هرتز ، وتم تحديد أحداث التموج على أنها زيادات عابرة في قدرة نطاق التموج أكبر من 3 انحرافات معيارية فوق المتوسط. تم تعريف بداية ونهاية كل تموج على أنها النقطة التي عادت فيها قوة نطاق التموج إلى المتوسط. تظهر التموجات المحددة باللون الأحمر. شريط المقياس: 100 مللي ثانية ، من أعلى إلى أسفل: 1000 ميكروفولت ، 140 ميكروفولت ، 1800 ميكروفولت ، 180 ميكروفولت ، 9000 ميكروفولت ، 1200 ميكروفولت ، 10000 ميكروفولت ، 1000 ميكروفولت. (ب) وحدة مفردة تمثيلية من كل يوم من رباعي CA1 المستهدف للتسجيلات في اللوحة أ. تظهر جميع أشكال الموجات الخام على كل قطب كهربائي باللون الأسود ؛ المتوسط باللون الأحمر. شريط المقياس 0.2 مللي ثانية ، من أعلى إلى أسفل: 50 ميكروفولت ، 100 ميكروفولت ، 100 ميكروفولت. (ج) مخطط تلقائي لجميع المسامير للوحدات المفردة في اللوحة باء. توضح هذه البيانات وضع القطب الكهربائي المستقر داخل الطبقة الهرمية الحصين على مدار عدة أسابيع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: الأنسجة التمثيلية وتأثيرها على نمو الجمجمة. تم زرع ماوس p20 بمحرك أقراص صغير ، كما هو موضح أعلاه. بعد يوم التسجيل النهائي على p60 ، تم إنتاج آفات التحليل الكهربائي في مواقع التسجيل ، وتم ترشيح الدماغ بنسبة 4٪ بارافورمالدهيد. لتحديد مواقع التسجيل ، تم إنتاج أقسام 50 ميكرومتر. أ: الآفات في CA1 و CA3 من الحصين. يشير رأس السهم إلى موقع تسجيل CA3 ؛ يشير رأس السهم المزدوج إلى موقع تسجيل CA1. شريط المقياس: 0.5 مم. (ب) الآفات في ACC الثنائية. تشير رؤوس الأسهم إلى مواقع تسجيل ACC. شريط المقياس: 0.5 مم. (C) قياسات حجم الجمجمة وكتلة الدماغ للفئران p62 المزروعة بمحرك صغير عند p20 (رمادي) والقمامة غير المزروعة (بيضاء). يتم الإبلاغ عن القيمة p لاختبار مجموع رتبة ويلكوكسون لكل قياس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
غالبا ما تستخدم التجارب الحديثة التي تستكشف وظيفة الدائرة العصبية في الجسم الحي في القوارض الفيزيولوجيا الكهربية خارج الخلية عبر أقطاب كهربائية مزروعة بشكل دائم لمراقبة نشاط الخلايا العصبية الفردية (أي الوحدات الفردية) أو السكان المحليين (عبر إمكانات المجال المحلي ، LFP) ، ولكن نادرا ما يتم تطبيق هذه الأساليب على الفئران اليافعة بسبب التحديات التقنية. تصف هذه المخطوطة طريقة للحصول على تسجيلات الفيزيولوجيا الكهربية في الجسم الحي في الفئران عبر النوافذ الحرجة من الناحية التنموية من p20 إلى p60 وما بعدها. تتضمن هذه المنهجية عملية تصنيع لطباعة وبناء غرسة محرك أقراص صغيرة ، وإجراء زرع جراحي ، واستراتيجية تعافي ما بعد الجراحة ، وكلها مصممة خصيصا للاستخدام في الفئران اليافعة. كانت هناك عدة اعتبارات مؤثرة في تطوير هذا البروتوكول ، بما في ذلك صغر حجم الفئران اليافعة وضعفها النسبي مقارنة بنظيراتها البالغة ، فضلا عن انخفاض تعظم جمجمة الفأر اليافعة التي يجب ربط محرك الأقراص الصغير بها.
طريقتان أساسيتان تستخدمان بشكل شائع لأداء الفيزيولوجيا الكهربية في الجسم الحي هما صفائف الأقطاب الكهربائية (على سبيل المثال ، رباعي الترودات) ومجسات السيليكون. مجسات السيليكون خفيفة الوزن ، ويمكن أن توفر عددا كبيرا من مواقع التسجيل لكل وحدة وزن ، وقد تم استخدامها سابقا في الفئراناليافعة 25. ومع ذلك ، فإن مجسات السيليكون باهظة الثمن نسبيا لكل وحدة. في المقابل ، يمكن إنشاء محرك الأقراص الصغير الموصوف في هذه المخطوطة باستخدام أقل من 50 دولارا أمريكيا من المواد الخام ، مما يجعله خيارا فعالا من حيث التكلفة للتسجيل في الجسم الحي . بالإضافة إلى ذلك ، يجب في كثير من الأحيان زرع مجسات السيليكون في خطوط ثابتة ، مما يحظر تسجيل مناطق الدماغ المتنوعة مكانيا. في المقابل، يستخدم تصميم محرك الأقراص الصغير الموصوف في هذه المخطوطة رباعيات قابلة للتعديل بشكل مستقل لاستيعاب التسجيلات المتزامنة في ما يصل إلى 16 موقعا مختلفا دون أي قيود تقريبا على العلاقة المكانية بين تلك المواقع. يمكن تعديل تصميم محرك الأقراص الصغير هذا بسهولة للسماح باستهداف مواقع مختلفة عن تلك الموضحة هنا عن طريق تحريك بثق فتحة القنية إلى أي موقع أمامي / خلفي ووسطي / بعيد مرغوب. عند استهداف مناطق الدماغ البديلة ، من المهم ملاحظة أنه في حين أن tetrodes غالبا ما تنتقل بشكل مستقيم ، فمن الممكن أن تنحرف هذه الأسلاك الرفيعة قليلا عند خروجها من قنية محرك الأقراص الصغيرة. وبالتالي ، كلما كانت منطقة الدماغ أصغر أو أكثر بطنية ، كلما كان من الصعب استهداف المنطقة بنجاح باستخدام رباعيات الترودات.
تشبه غرسة محرك الأقراص الصغيرة الموصوفة في هذه المخطوطة بشكل أساسي العديد من تصميمات محركات الأقراص الصغيرة السابقة القائمة على رباعي 23،32،33،34،35 من حيث أن tetrodes الفردية مثبتة على مسامير ، مما يسمح بالتحكم الدقيق في عمق التسجيل لكل رباعي. في حين أن العديد من ميزات تصميم محرك الأقراص الصغير الحالي فريدة من نوعها ، بما في ذلك سهولة استهداف مناطق الدماغ الموزعة مكانيا ، فإن الحداثة الأساسية للمخطوطة الحالية هي وصف الزرع الجراحي واستراتيجيات التعافي بعد الجراحة ، والتي تسمح بإجراء دراسات مزمنة لنشاط الشبكة في الفئران اليافعة التي لا تزال في طور النمو. في الواقع ، يمكن تكييف منهجيات الجراحة والتعافي الموصوفة هنا لدعم عمليات الزرع الأخرى في الفئران اليافعة.
للحفاظ على تسجيل متسق عبر عدة أيام ، يجب تثبيت الأسلاك أو المجسات بشكل صارم على الجمجمة. في حين أن الهيكل العام لجمجمة الفأر يخضع لتغييرات طفيفة فقط بعد p20 ، فإن الجمجمة تتكاثف بشكل كبير بين الأعمار p20 و p4536. في الواقع ، الجمجمة في p20 ليست صلبة بما يكفي لدعم غرسة متصلة دون أن تتضرر. للتغلب على هذا القيد البيولوجي ، يقوم هذا البروتوكول بتكثيف الجمجمة بشكل مصطنع عبر cyanoacrylate أثناء جراحة الزرع. من المحتمل أن يكون الزرع في الفئران الأصغر من p20 ممكنا باستخدام هذه الإستراتيجية ، لكن جمجمة الفأر تخضع لتغييرات كبيرة في الحجم والشكل حتى p2036 تقريبا. وبالتالي ، لا ينصح بالزرع لفترات طويلة في الفئران الأصغر من p20 لأن cyanoacrylate ومسامير العظام الثابتة في الجمجمة التي لا تزال في طور النمو قد تؤثر بشكل كبير على النمو الطبيعي للجمجمة وتطور أنسجة المخ الأساسية. الأهم من ذلك ، في هذه الدراسة ، لم يلاحظ أي تأثير على القياسات الإجمالية للجمجمة أو حجم الدماغ بعد الزرع المزمن بدءا من p20 (الشكل 5C).
خطوة حاسمة في الطريقة الموصوفة في هذه المخطوطة هي استراتيجية التعافي بعد الجراحة. وفقا لهذه الاستراتيجية ، يجب موازنة وزن الغرسة باستمرار مع نضوج الفأر وخضوعه لتطوير الجهاز العضلي والعضلي الهيكلي. في وقت مبكر بعد الزرع ، لا تستطيع الفئران تحمل وزن الغرسة بنجاح دون موازنة ، مما يؤدي إلى سوء التغذية والجفاف حيث لا يستطيع الفأر الوصول بشكل كاف إلى مصادر الغذاء والماء في قفصه. نظام الموازنة سهل وغير مكلف في البناء ، وتافه في التنفيذ ، ويسمح للفئران من أي عمر قابل للزرع باستكشاف كامل قفصهم المنزلي بحرية ، وبالتالي ضمان التغذية الكافية والترطيب. مع تقدم الفئران في العمر ، يمكن تقليل كمية الموازنة حتى يمكن إزالتها بالكامل في الفئران البالغة. ومع ذلك ، يوصى بالاستخدام المستمر لنظام الموازنة طوال مدة التجربة مع ثقل موازن اسمي على الأقل متصل في جميع الأوقات. في حين أن الفأر البالغ قد يكون قادرا على تحمل حجم ووزن محرك الأقراص الصغير بمرور الوقت ، فإن الحركة الطبيعية المستمرة أثناء السلوك الحر دون تحسين ثقل موازن ينتج عزم الدوران وقوة القص على مسامير العظام التي تثبت محرك الأقراص الصغير على الجمجمة ، مما يجعلها عرضة بشكل متزايد للانفصال ، خاصة أثناء التجارب المزمنة الأطول.
هناك قيدان مهمان ملحوظان للدراسة الحالية. أولا ، لتقييم تأثير الزرع في p20 على نمو الجمجمة والدماغ ، تم التضحية بعدة مجموعات من الفئران بعد الزرع المطول (الشكل 5C). في حين أن هذه التحليلات لم تكشف عن أي تأثير كبير للزرع على حجم تجويف الجمجمة أو كتلة الدماغ (الشكل 5C) ، فإن الدراسة الحالية لم تفحص حجم الجمجمة أو كتلة الدماغ في نقاط زمنية متعددة طوال فترة النمو المبكرة ل p20-p60. بينما يوضح العمل السابق أن تطور تجويف الدماغ قد اكتمل بواسطة p2036 ، فمن الممكن أن يؤدي الزرع في هذه النافذة المبكرة إلى تغييرات غير متوقعة يتم تصحيحها أو تعويضها من خلال أعمار البالغين التي تم تقييمها هنا. ثانيا، لم تكن التجارب التي أنتجت بيانات الفيزيولوجيا الكهربية الموضحة في الشكلين 3 و4 مصممة لزيادة إنتاج الخلية إلى أقصى حد. وبالتالي ، في حين أن البيانات المقدمة هنا تظهر تسجيلات مستقرة ومزمنة ووحدات مفردة معزولة جيدا ، فلا ينبغي اعتبارها ممثلة للعائد المحتمل الأقصى لهذا الجهاز.
تظهر العديد من الاضطرابات العصبية والنفسية البشرية خلال فترات النمو المبكر أو عبر فترة المراهقة ، بما في ذلك التوحد والفصام. ومع ذلك ، لا يعرف سوى القليل عن الخلل الوظيفي على مستوى الدائرة الذي قد يكمن وراء هذه الأمراض ، على الرغم من وفرة نماذج الفئران المتاحة. يعد تحديد هذه التغييرات الأولية في الشبكة أمرا بالغ الأهمية لإنشاء استراتيجيات الكشف المبكر ونماذج العلاج. ومع ذلك ، بسبب التحديات التقنية ، لا يزال من غير الواضح كيف تتعطل وظيفة الشبكة عبر التطوير في نماذج الفئران للأمراض العصبية والنفسية. تم تصميم استراتيجية القيادة الصغيرة والتعافي الموصوفة هنا لدعم التحقيقات في تطوير شبكة الدماغ متعددة المناطق في دماغ الفأر ، وبالتالي السماح للباحثين بقياس نمو الدماغ الصحي وكذلك تحديد التغييرات في هذا التطور في نماذج الفئران للمرض.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة R01 NS104829 (B.E.P.) ، R01 MH117149 (L.J.V.) ، و F99NS12053 (L.D.Q.) وجائزة UT Southwestern GSO Endowment Award (R.J.P. و L.D.Q.). يشكر المؤلفون جيني سكاريا (كلية الصيدلة بمركز العلوم الصحية بجامعة تكساس للتكنولوجيا) على المساعدة الفنية والدكتور بريندون واتسون (جامعة ميشيغان) على الاقتراحات المنهجية.
Materials
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
References
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved