Method Article
幼若マウスにおける慢性四尾行記録のための軽量駆動インプラント
要約
ここでは、生後20日目(p20)から生後60日目(p60)以降の重要な発達ウィンドウにわたって、幼若および青年マウスの複数の脳領域からの慢性フィールドおよび単一ユニット記録を同時に可能にするマイクロドライブ設計、外科的移植手順、および術後回復戦略について説明します。
要約
in vivo 電気生理学は、無傷の脳のサブセカンドレベルの回路ダイナミクスに関する比類のない洞察を提供し、ヒト神経精神障害のマウスモデルを研究する上で特に重要な方法を表しています。しかし、そのような方法は、しばしば大きな頭蓋インプラントを必要とし、初期の発達時点でマウスには使用できません。そのため、自由に行動する乳児または幼若マウスでは、この重要なウィンドウで神経学的発達をよりよく理解することで、自閉症や統合失調症などの加齢依存性発達障害に関する独自の洞察が得られる可能性が高いにもかかわらず、 in vivo 生理学の研究は事実上行われていません。ここでは、マイクロドライブ設計、外科的移植手順、および術後の回復戦略について説明し、マウスが生後20日目(p20)から生後60日目(p60)以降、2歳から成人期までの人間の年齢にほぼ対応する時間枠で、複数の脳領域からの慢性フィールドおよび単一ユニットの記録を同時に可能にします。記録電極と最終記録部位の数は簡単に変更および拡張できるため、発生全体にわたる行動または疾患に関連する脳領域の in vivo モニタリングの柔軟な実験制御が可能になります。
概要
脳は、小児期および青年期の重要な発達ウィンドウの間に大規模な変化を経験します1,2,3。自閉症や統合失調症を含む多くの神経疾患や精神疾患は、若年期および青年期の脳発達のこの期間中に行動的および生物学的に最初に現れます4,5,6。発生初期に起こる細胞、シナプス、および遺伝的変化については多くのことが知られていますが、この時間枠全体で回路レベルまたはネットワークレベルのプロセスがどのように変化するかについてはほとんど知られていません。重要なことに、最終的に複雑な行動、記憶、認知の根底にある回路レベルの脳機能は、細胞およびシナプス機能の予測不可能な創発的な特性です7,8,9,10。したがって、ネットワークレベルの脳機能を完全に理解するためには、無傷の神経回路のレベルで神経活動を直接研究する必要があります。さらに、神経精神疾患の進行を通じて脳活動がどのように変化するかを特定するには、疾患の行動表現型が現れる特定の時間ウィンドウ中に有効な疾患モデルでネットワーク活動を調べ、成人期まで持続する観察された変化を追跡することが重要です。
最も一般的で強力な科学的モデル生物の1つはマウスであり、行動および/またはニーモニック表現型の年齢依存的な発症を伴う神経発達障害をモデル化する多数のユニークな遺伝子株を有する11,12,13,14,15,16,17,18,19,20,21 .ヒトとマウスの脳間の正確な発生時点を相関させることは困難であるが、形態学的および行動学的比較は、p20-p21マウスが2〜3歳のヒト年齢を表し、p25-p35マウスが11〜14歳のヒト年齢を表し、マウスがp603までにヒト20歳の成人の発達に相当するものに達する可能性が高いことを示している。22.したがって、若年脳がどのように発達するかをよりよく理解し、自閉症や統合失調症などの疾患で脳の神経ネットワークがどのように機能不全になるかを特定するには、20日から60日齢のマウスのin vivoで脳活動を直接監視することが理想的です。
しかし、マウスの初期発生における脳活動を監視する上での基本的な課題は、幼若マウスのサイズが小さく、相対的に弱いことです。脳発達の縦断的研究に必要な電極の慢性的な移植は、典型的には、微細な電極ワイヤおよびインターフェースボード23,24を保護するために大きくてかさばるハウジングを必要とし、インプラントはマウス頭蓋骨にしっかりと取り付けられていなければならず、これは骨化の減少のために若いマウスではより薄くそして剛性が低い。したがって、in vivoげっ歯類生理学の事実上すべての研究は、それらの相対的なサイズ、強度、および頭蓋骨の厚さのために成人被験者で行われてきました。今日まで、in vivo幼若げっ歯類脳生理学を探索するほとんどの研究は、野生型幼若ラットで行われており、これは、ヒト障害の自由に行動するモデルにおいて幼若脳機能を実験的にモニターする能力を必然的に制限している25,26,27,28,29,30。
この原稿では、発達上重要な時間枠(p20からp60以降)にわたる幼若マウスの長期(最大4週間以上) のin vivo 脳機能を慢性的に研究するための新しいインプラントハウジング、外科的移植手順、および術後の回復戦略について説明しています。移植手順は、幼若マウスの頭蓋骨への電極の信頼性の高い恒久的な固定を可能にする。さらに、このマイクロドライブは完全に組み立てられたときの重量が~4-6gであり、インプラントの重量を相殺するために必要な最小限のカウンターバランスのために、典型的な行動パラダイム中の幼若マウスの行動性能に影響を与えないため、マイクロドライブの設計は軽量です。
プロトコル
本研究は、テキサス大学サウスウェスタン医療センターの施設動物管理および使用委員会(プロトコル2015-100867)によって承認され、施設および国立衛生研究所の両方のガイドラインに準拠して実施されました。本研究で用いたC57/Bl6雄および雌マウスをp20(移植時の体重8.3-11.1g)で移植した。
1. マイクロドライブの設計・施工
- マイクロドライブのデジタル設計と印刷(図1)
- マイクロドライブモデルテンプレート(https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive)をダウンロードします。
- 適切な脳定位固定装置アトラスにおける標的脳領域の定位固定装置の位置を特定する。
- 3次元コンピュータ支援設計(3D CAD)ソフトウェアを使用して、テンプレートマイクロドライブカニューレをロードします(図1B)。
- 必要に応じて、マイクロドライブカニューレモデルの出力カニューレ出力位置を変更して、目的の脳領域をターゲットにします。
注意: 各カニューレ穴の押し出しは、テトロードがターゲットをまっすぐに向けてカニューレ穴から出てくるように、少なくとも2mmの長さにする必要があります。マイクロドライブカニューレテンプレートは、前帯状皮質(半球あたり1つの四辺形)、海馬領域CA1(半球あたり4つの四辺形)、および海馬領域CA3(半球あたり2つの四辺三角形)を両側的に標的とし、半球あたり1つの参照四辺形を海馬領域CA1の上の白質に配置するように設計されています。 - 必要に応じて、電子インターフェースボード(EIB)の取り付けに対応するようにマイクロドライブ本体(図1A)を変更します。
- マイクロドライブ本体、カニューレ、コーン、蓋を3Dプリンター(理想的には25μm以上の解像度)で高解像度で印刷し、メーカーのプロトコルに従って印刷物を準備します。高剛性のプリンター用樹脂を使用してください。
- カスタムネジとアタッチメントの組み立て(図2A、B)
- 3D CADソフトウェアを使用して、ネジ取り付けモデルをロードします(図1E)。
- ネジアタッチメントを3Dプリンター(理想的には少なくとも25μmの解像度)で高解像度で印刷し、メーカーのプロトコルに従って印刷物を準備します。高剛性のプリンター用樹脂を使用してください。
- ネジアタッチメントを各四極前進ネジに取り付けます(図1F)(四極前進ネジは、マイクロドライブ建設前に機械工場でカスタム製造されます)。
- 各ネジに2つのネジアタッチメントを、1つは尾根の上と下に取り付けます。各ネジ取り付けの底部が尾根に接触していることを確認します。スクリューアタッチメントをゲルシアノアクリレートと一緒に保持します。
- 取り付けたら、ネジの取り付けがネジの縦軸で動かず、最小限の抵抗で自由に回転することを確認してください。
- マイクロドライブ本体の組み立て(図2C、D)
- 細くて鋭利なハサミで、大きなポリイミドチューブ(外径0.2921mm、内径0.1803mm)を~6cmの長さに切断します。
- 大きなポリイミド切片をマイクロドライブカニューレの出力穴に通し、各チューブがカニューレの底から数ミリメートル伸びるようにします。
- 清潔な30 Gの針を使用して、少量の液体シアノアクリレートを塗布してポリイミドをカニューレに貼り付けます。シアノアクリレートがポリイミドチューブの内部に入らないように注意してください。
注意: 液体シアノアクリレートをドライブ本体の上部からカニューレに滴下すると、このプロセスを迅速化できますが、後で先端の細かいドリルでガイド穴を再クリアする必要があります。 - マイクロドライブカニューレの上部から大きなポリイミドチューブをマイクロドライブ本体の適切な大きなポリイミド穴に通します。
- マイクロドライブカニューレとマイクロドライブ本体を、隣接してカニューレ/本体取り付けタブがかみ合うまでゆっくりと押し合わせます。その過程でポリイミドチューブをねじったり損傷させたりしないように注意してください。
注意: 各ポリイミドチューブは、カニューレの下部からマイクロドライブ本体の上部をスムーズに通過する必要があります。わずかな曲がりは正常ですが、ポリイミドチューブを過度に曲げると、四極管が歪んで脳にまっすぐ入らなくなる可能性があります。 - マイクロドライブ本体とマイクロドライブカニューレをシアノアクリレートを使用して一緒に取り付けます。
- 新しい鋭利なかみそりの刃を使用して、カニューレ出力穴の底から突き出ている大きなポリイミドチューブの端を切断します。カットがカニューレの基部に正確にあり、チューブとカニューレの底が互いに平らになるようにします。
- 鋭利なハサミを使用して、ドライブボディの内縁の端のすぐ上にある大きなポリイミドチューブを~45°の角度で切断します。
- 組み立てたカスタムネジのロード(図2E)
- 組み立てた各カスタムネジをマイクロドライブ本体の外側の穴にねじ込みます。ネジガイドポストがネジアタッチメントの大きな穴を通過することを確認します。それ以上進まなくなるまで、各ネジを完全に進めます。ネジを鉱油または車軸グリースで事前に潤滑することをお勧めします。
- 非常に鋭利なハサミを用いて、小さなポリイミドチューブ(外径0.1397mm、内径0.1016)を~4cmの長さに切断します。
- 小さなポリイミド切片を、マイクロドライブにすでに取り付けられている大きなポリイミドチューブに通します。余分な小さなポリイミドチューブが各大きなポリイミドチューブの上部と下部から突き出ていることを確認します。
- 小さいポリイミドチューブをシアノアクリレート を介して ネジアタッチメントに取り付け、シアノアクリレートが大小のポリイミドチューブに入らないように注意してください。
- 新しい鋭利なかみそりの刃を使用して、カニューレの穴の底から突き出ている小さなポリイミドチューブの端を切断します。カットがカニューレの基部に正確にあり、カットがきれいで、ポリイミドチューブの穴を塞ぐものがないことを確認してください。
- 鋭利なハサミを使用して、小さなポリイミドの上部をネジ取り付けの上部から数ミリメートル上に~45°の角度で切断します。ポリイミドチューブの穴を塞ぐものが何もなく、カットがきれいであることを確認してください。
- テトロードのロード
- 前述の方法31を使用して、四極管(長さ~6 cm)を準備します。
- 先端がセラミック製またはゴム製の鉗子を使用して、小さなポリイミドチューブの上部から~2 cm突き出た状態で、小さなポリイミドチューブの1つにテトロードを慎重に通します。
- プロセスで大小のポリイミドチューブを一緒に貼り付けないように注意しながら、液体シアノアクリレート を介して 小さなポリイミドチューブの上部にテトロードを貼り付けます。
- ドライブの上部近くになるまでネジを引きます。
- ドライブの下部から突き出ている四極線をつかみ、カニューレから出てくるポイントでそっとねじります。
- ネジをドライブに完全に戻します。
- 非常に鋭いはさみを使用して、キンクのすぐ上の四極線を切断します。顕微鏡下で、切り傷がきれいで、4つの四極管すべての金属が露出していることを確認します。
- 四極管がカニューレ内に固定されるまでネジを引き込みます。
- すべてのネジに対して手順1.5.2〜1.5.8を繰り返します。
- EIBを小さなジュエリーネジ で EIBサポートプラットフォームに取り付けます。
- 各四極管の各電極をEIBの適切なポートに接続します。
- 手術のためのマイクロドライブの準備
- テトロードを電気的にプレートして、前述の方法31を使用して電気インピーダンスを低減する。
- メッキ後、四尾管の先端が各カニューレの穴の底と同じ高さになるように、各四極管がカニューレに収容されていることを確認します。
- 完成したマイクロドライブの周りにマイクロドライブコーンをスライドさせます。コーン取り付けポールを蓋ポートにスライドさせて、マイクロドライブの蓋をマイクロドライブコーンに取り付けます。
- 蓋を閉じたときにEIBコネクタがEIB接続パススルー穴を自由に通過するようにコーンの向きを合わせ、カニューレ出力穴にシアノアクリレートが入らないように注意しながら、コーンのベースの周りにシアノアクリレートを配置してコーンを所定の位置に接着します。蓋を外します。
- 外科的移植後に体液がポリイミド穴に入るのを防ぐために、各カニューレ穴を滅菌ミネラルオイルで慎重に埋め戻します。
- カニューレの基部を滅菌ワセリンで慎重にコーティングします。これは、手術中に化学物質(歯科用セメントなど)が露出した脳に入るのを防ぐための障壁として機能します。
- 完全に組み立てられたマイクロドライブ、蓋、および4本の骨ネジの重量を量って、同じ重量のカウンターバランスを準備します。
- 必要に応じて、手術の前に、ドライブが頭蓋骨と同じ高さになったら、ターゲット脳領域に到達するのに適した距離で四極管を押し出します。
注意: 外科的移植の前に、エチレンオキシド(500-1200 mg / L、2-4時間)でのガス滅菌によってインプラントを滅菌します。 すべての骨ネジと手術器具は、オートクレーブ(121°C、30分)で滅菌する必要があります。
2.外科的移植
- マウスに麻酔をかけ、定位固定装置に装着する
- 移動するのに十分なスペースのある小さな箱にマウスを置き、3%〜4%のイソフルランでマウスを麻酔します。
注:他の麻酔薬も使用できますが、幼若マウス被験者の年齢、サイズ、体重のため注意が必要です。 - マウスが反応しなくなったら(尻尾をつまんでも反応せず、毎分~60回の呼吸で換気)、箱からマウスを取り出し、定位固定装置にすばやく取り付けます。
- すぐに、固定装置用マスクをマウスの鼻の上に置き、麻酔を1〜3%イソフルランに維持します。最初の外科的切開の前に、徐放性ブプレノルフィン(0.05-0.5 mg / kg皮下)などの獣医承認の痛み止め、またはカルプロフェン(5-10 mg / kg皮下)などの抗炎症剤を適用します。.
- イヤーバーを使用して、マウスの頭を定位固定装置に完全に固定します。マウスの外耳道に不必要な圧力をかけずに、頭蓋骨が水平で動かないことを確認します。幼若頭蓋骨の骨化が限られているため、頭部固定中に永久的な損傷を引き起こす可能性があります。
- 移動するのに十分なスペースのある小さな箱にマウスを置き、3%〜4%のイソフルランでマウスを麻酔します。
- 手術のためのマウスの準備と頭蓋骨の露出
- 各目に少量の合成涙液ジェルを置き、オートクレーブ処理されたホイルのパッチで各目を覆うことにより、マウスの目を保護します。
注意: 合成涙は目を湿らせ、ホイルは光源が長期的な損傷を引き起こすのを防ぎます。より厚い合成涙液は、他の潜在的に有毒な外科用溶液(エタノール、歯科用アクリルなど)の眼への不注意な導入に対する障壁としても役立つ可能性があるため、好ましい。 - 滅菌綿の先端の綿棒を使用して、手術部位に脱毛クリームを塗り、頭皮から毛を取り除きます。クリームが目の近くに入らないように注意してください。脱毛後、頭皮に滅菌ドレープを置き、手術部位を固定します。
- 滅菌綿棒を使用して、ポビドンヨード(10%)溶液とそれに続くイソプロピルアルコール(100%)を3回連続して洗浄 して 頭皮を洗浄します。
- 滅菌メスまたは細かいはさみを使用して、頭皮を取り除きます。
- 滅菌綿棒と生理食塩水(0.9%NaCl)と過酸化水素の滅菌溶液を使用して、頭蓋骨を完全に洗浄します。
- ブレグマを識別し、定位固定装置を使用して、頭蓋骨上の目標記録位置に永久マーカーで慎重に印を付けます。
- 各目に少量の合成涙液ジェルを置き、オートクレーブ処理されたホイルのパッチで各目を覆うことにより、マウスの目を保護します。
- カニューレの穴を開けて骨アンカーを取り付ける
- 記録部位に重なっている頭蓋骨を取り除きます。#この年齢の頭蓋骨は薄いため、メスの刃で頭蓋骨を切る。これにより、ドリルを使用する必要がなくなり、下にある硬膜が損傷する可能性があります。滅菌生理食塩水(0.9%NaCl)または滅菌鉱油を塗布して、露出した硬膜を湿らせてください。この段階で硬膜を取り外したり穿刺したりしないでください、幼若マウスではテトロードが将来のステップで通過するのに十分薄いためです。
- 4本の骨ネジ用の下穴を慎重に開けます。
- 骨が最も厚く、骨ネジがマイクロドライブインプラントから十分に離れている頭蓋骨の極端な外側および吻側または尾側に骨ネジを配置します。骨ネジには、滅菌済みのファインジュエリーネジ(UNM 120スレッド、1.5 mmヘッドなど)を使用してください。
- 1本の骨ネジを、アースとして機能し、手順2.4.6でEIBに取り付ける細い高導電性ワイヤでしっかりと巻きます。
- メスの刃を使用するか、ドリルビットを注意深く使用して、骨ねじ穴の位置の近くで頭蓋骨にスコアを付けます。スコアリングは、ステップ2.3.5で液体シアノアクリレートが結合するのに十分な粗い表面を提供するために重要です。
- 滅菌ドライバーと滅菌スクリュークランプを使用して、下にある硬膜に穴を開けないように注意しながら、各滅菌骨ネジを所定の位置にねじ込みます。
- 滅菌済みの30 G針を使用して、各骨ネジの周りに液体シアノアクリレートを配置します。これにより、骨ネジが取り付けられている頭蓋骨が効果的に厚くなります。シアノアクリレートが記録部位の上の露出した硬膜に入らないように注意してください。
- マイクロドライブを下ろして取り付ける(図2G)
- 完成したマイクロドライブを定位固定装置に取り付けて、マウスの頭蓋骨に慎重に降ろします。マイクロドライブカニューレが下がったときに適切な座標にあることを確認してください。
- マイクロドライブをゆっくりと下げ、背側/腹側方向にのみ移動します。テトロデスがすでにカニューレの穴から出ている状態でマイクロドライブを下げます(ステップ1.6.6)脳への侵入を視覚化します。四尾骨がマウスに触れているときの内側/側方または吻側/尾側の動きは、四尾骨を曲げ、最終目的地を逃す可能性があります。
- マイクロドライブが完全に下がったら、カニューレの基部が頭蓋骨/硬膜と接触していることを確認します。ワセリンおよび/または鉱物油の層は、露出した硬膜を覆うためのバリアとして機能します。必要に応じて、滅菌ワセリンまたは滅菌骨ワックスを追加して、余分な露出した硬膜を覆います。
- マイクロドライブを固定装置で所定の位置に保持しながら、頭蓋骨を歯科用セメントでコーティングして、マイクロドライブベースを埋め込まれた骨ネジに固定します。
注意: 歯科用セメントはすべての骨ネジを完全に包み込み、マイクロドライブカニューレの歯科用セメントアンカー棚を覆う必要があります。 - 歯科用セメントが固まる間は、マウスに害を与えたり、マイクロドライブを損傷したりする可能性のある鋭い角やエッジを防ぐために、慎重に形を整えます。マイクロドライブを保持するのに十分な歯科用セメントがあることを確認しますが、不要な重量を追加する余分な歯科用セメントを排除します。
- アース線をマイクロドライブに慎重に通し、EIB の適切なスロットに取り付けます。
- 歯科用セメントが完全に固まったら、マイクロドライブを固定装置から慎重に取り外します。マイクロドライブに蓋をします。
- 滅菌綿棒と滅菌生理食塩水で、マウスを清掃します。
- 滅菌綿の先端を綿棒で、インプラント部位近くの露出した頭皮に抗生物質軟膏の薄層を塗布します。
- マウスの目からホイルを取り除きます。
- マウスを固定装置から取り外し、マウスを清潔なケージに輸送するときにマイクロドライブの追加の重量を支えるように注意します。
3.手術後の回復
- 即時リカバリ
- 手術の前に、 図2Gに示すように、直径0.75のPVCパイプを接続してカウンターバランスシステムを準備します。システムの1つのアームはケージの蓋に開けられた穴を通り、2番目のアームはケージの蓋の上に置かれ、3番目のアームはケージの上から伸びています。一番上の腕にはキャップが付いています。
- マイクロドライブをカウンターバランスシステムに慎重に取り付け(図2G-I)、マイクロドライブとボーンネジの重量と同じカウンターバランスウェイトを使用します。EIBに取り付けられたコネクタから、カウンターバランスシステムの3つのアームを介して、一番上のアームにぶら下がっているカウンターバランスウェイトまで、強力な糸または釣り糸を走らせます。
- カウンターバランスがマイクロドライブEIBにしっかりと接続されており、マウスがケージ全体に完全にアクセスできるように十分な線があることを確認します。
- 水分補給と回復を確実にするために、湿らせた通常のげっ歯類のチャウと一緒にケージに栄養豊富なゲルを提供します。
- 外科的麻酔から完全に回復するまでマウスを監視します。
- 長期的な回復
- 記録装置に接続されていないときは常に、マイクロドライブがカウンターバランスシステムでサポートされていることを確認してください。時間の経過とともにカウンターウェイトを減らしますが、マウスへの予期しないストレスや骨ネジへのトルクを避けるために、カウンターウェイトを完全に取り外さないでください。
- インプラントおよびカウンターバランスシステムの損傷を防ぐために、実験期間中、他のマウスと直接相互作用する可能性なしにマウスを収容してください。
- 手術後少なくとも3日間は栄養豊富なゲルを提供し、その時点で固形食品のみで十分です。
- カウンターバランスシステムのオーバーヘッド要件により、オーバーヘッドワイヤーメッシュに食べ物と水を提供しないでください。ケージの床に食べ物を置き、ケージの側面から水を供給します。腐敗を防ぐために、毎日食品を完全に交換してください。
- 毎日、マウスがケージ全体に自由にアクセスできること、およびカウンターバランスがマイクロドライブに堅牢かつ強力に取り付けられていることを確認してください。
結果
上記のプロトコルは、マウスにおいて複数の脳領域からの局所電界電位信号および単一単位を同時に記録するために使用され、p20からp60までの同じマウスにおいて毎日の記録が行われた。ここで報告されているのは、2匹のマウスからの代表的な電気生理学的記録と、最終的な記録場所を示す実験後の組織学です。
p20マウスへのマイクロドライブの外科的移植
マイクロドライブ(図1)を構築し(図2)、上記のようにp20マウスに外科的に移植した。手術の直後に、マウスをカウンターバランスシステム(図2G−I)に取り付け、回復させた。マウスが完全に可動になると、マイクロドライブを in vivo 電気生理学記録システムに接続しました。マイクロドライブと記録機器を接続するケーブルは、マウスの上に吊り下げられました。電気生理学的記録(32kHz)は、マウスがホームケージ内で自然に行動している間に、すべてのチャネルで1時間取得されました。記録後、マウスは記録システムからプラグを抜かれ、カウンターバランスシステムに再び取り付けられ、水とチャウチャウに自由にアクセスできる状態でビバリウムに戻されました。
神経活動の毎日の記録
電気生理学的記録を数週間毎日取得して、p20-p60の重要な発達ウィンドウ全体で同じ脳領域の慢性モニタリングを可能にしました。慢性記録全体からのサンプル生の局所電界電位(LFP)を 図3A、Cに示します。単離された単一ユニットは、複数のテトロードから同時に得られた(図3B)。類似した波形を持つユニットが複数の日にわたって識別されましたが(図3B、中央および右)、記録電極の電位ドリフトのため、同じユニットが日にわたって識別されていると明確に主張することはできませんでした。p20で移植され、数週間毎日記録された別のマウスにおいて、背部領域CA1を標的とする四極管で神経活動を調べた。大振幅のリップルと十分に絶縁された単一ユニットが、記録の各日に確認されました(図4)。これらのデータは、安定した高品質の in vivo 電気生理学的記録が、発生初期にわたって同じマウスから得られた可能性があることを示しています。
記録部位の組織学的確認と慢性着床の発生影響
最終記録日に続いて、マウスをイソフルラン麻酔 で 完全に麻酔し、続いてペントバルビタールナトリウムを致死的に注射し、電極先端に電流を流して記録部位に小さな病変を生じさせた。実験後のマウス脳の組織学的切片作成により、最終的な記録部位の視覚化が可能になりました(図5A、B)。別のコホートにおいて、3匹の雄および3匹の雌マウスを、上記のようにp20で外科的に移植した。同数の同腹仔が移植されずに放置され、同一の住居条件で維持された。マウスをp62(移植コホートの術後6週間)で屠殺した。頭蓋骨を注意深く洗浄し、ブレグマからラムダまでの距離(図5C、左上)とラムダでの外部最大頭蓋骨幅(図5C、右上)を外部測定しました。頭蓋骨の正中線に沿って切開し、頭蓋骨の半分を切除して、質量測定のために脳を切除しました(図5C、右下)。ブレグマでの頭蓋骨腔の高さは、無傷の頭蓋骨の半分から測定されました(図5C、左下)。移植コホートと非移植コホートの間で有意差はなく(Wilcoxonランクサム検定)、p20から始まる長期移植は頭蓋骨の自然な発達または脳容積に重大な影響を及ぼさないことを示しています。

図1:マイクロドライブのコンポーネント。 (A)マイクロドライブ本体、(B)カニューレ、(C)コーン、(D)蓋、(E)ネジアタッチメント、(F)四極管前進スクリューの3次元レンダリング。各コンポーネントの重要な機能が示されています。測定の詳細は、https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/ で入手可能なモデルファイルから抽出できます。 この図の拡大版を表示するには、ここをクリックしてください。

図2:マイクロドライブ構造 。 (A)上部と下部のネジアタッチメントが接続された四極方向前進ネジの側面図と(B)上面図。(C)側面および(D)本体とカニューレを取り付け、各カニューレ穴を貫通し、カニューレの底部にトリミングした大きなポリイミドチューブを備えたマイクロドライブの上面図。(E)ネジと小さなポリイミドチューブを取り付けたマイクロドライブの側面図。小さなポリイミドチューブの上部は、四極管装填の直前にトリミングされます。(F)固定装置に取り付けられた完成したマイクロドライブ。通常はマイクロドライブを囲む保護コーンは、視覚化のために取り外されています。なお、ネジ留め具の一部は、このマイクロドライブ用に黒色の樹脂で印刷されています。(G)カウンターバランス支援システム。(H)(I)カウンターバランスサポートシステムが取り付けられたマウスケージの側面および上面図。 この図の拡大版を表示するには、ここをクリックしてください。
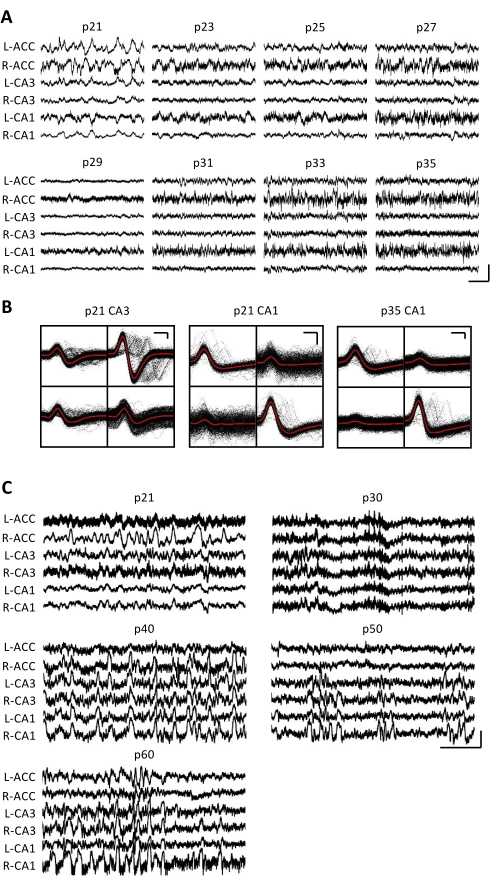
図3:代表的な電気生理学的記録。 p20マウスに、上記のようにマイクロドライブを移植した。p21から開始し、その後2週間毎日、マウスを記録装置に取り付け、神経活動を少なくとも1時間記録した。 (A)両側からの生の局所電界電位(LFP)記録(L =左;R=右)前帯状皮質(ACC)、海馬野CA3(CA3)、海馬野CA1(CA1)。データは毎日収集されました。わかりやすくするために、奇数日のデータのみが表示されます。すべての痕跡は、ホームケージで不動の期間中に撮影されました。スケールバー:1mV、2秒。 (B)海馬野CA3(左)とCA1(右)から分離されたパネル Aの記録のための代表的な単一ユニット。各電極上のすべての生の波形は黒で示されています。平均は赤で表示されています。スケールバー: 50 μV、0.2 ms (C)p20で移植された2匹目のマウスについて、p60での最終記録日までの10日ごとの代表的な生LFPトレース。データは毎日収集されました。わかりやすくするために、10 日ごとのデータのみが表示されます。すべての痕跡は、ホームケージで不動の期間中に撮影されました。スケールバー:1 mV、2秒 この図の拡大版を表示するには、ここをクリックしてください。
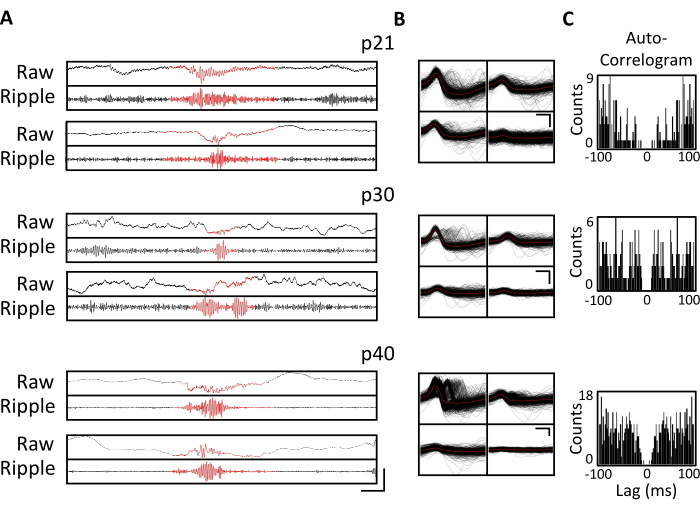
図 4.慢性的な録音の安定性。 p20マウスに、上記のようにマイクロドライブを移植した。p21から開始し、その後4週間、マウスを記録装置に取り付け、神経活動を少なくとも1時間記録した。示されているのは、背側海馬CA1を標的とする四極管からのデータです。(A)p21、p30、およびp40で特定されたリップルイベントの生(上)およびリップルフィルタリング(下)LFP。リップルイベントを特定するために、生のLFPを125Hzから300Hzの間でバンドパスフィルタリングし、リップルイベントは、平均より3標準偏差を超えるリップルバンドパワーの一時的な増加として特定されました。各リップルの開始と終了は、リップルバンドパワーが平均に戻ったポイントとして定義されました。識別された波紋は赤で表示されます。スケールバー: 100 ms, 上から下: 1,000 μV, 140 μV, 1,800 μV, 180 μV, 9,000 μV, 1,200 μV, 10,000 μV, 1,000 μV. (B)パネル Aの記録のためのCA1ターゲット四極管からの毎日の代表的な単一ユニット。各電極上のすべての生の波形は黒で示されています。平均は赤で表示されています。スケールバー 0.2 ms、上から下へ: 50 μV、100 μV、100 μV。 (C) パネル Bの単一ユニットのすべてのスパイクのオートコレログラム。これらのデータは、数週間にわたって海馬錐体層内に安定した電極配置を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図5:代表的な組織学と頭蓋骨の発達への影響。 p20マウスに、上記のようにマイクロドライブを移植した。p60の最終記録日に続いて、記録部位に電解病変が生じ、脳に4%パラホルムアルデヒドが灌流されました。記録部位を特定するために、50μmの切片を作製した。(A)海馬のCA1およびCA3の病変。矢印はCA3記録サイトを示します。二重矢印はCA1記録サイトを示します。スケールバー:0.5ミリメートル。 (B)両側ACCの病変。矢印はACC記録サイトを示します。スケールバー:0.5ミリメートル。 (C)p20でマイクロドライブを移植したp62マウス(灰色)および移植されていない同腹仔(白)の頭蓋骨サイズと脳質量の測定。ウィルコクソン順位和検定の p値は、測定ごとに報告されます。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
げっ歯類のin vivo神経回路機能を探索する現代の実験では、個々のニューロン(すなわち、単一ユニット)または局所集団(局所電界電位、LFPを介して)の活動を監視するために、永久に埋め込まれた電極を介した細胞外電気生理学を利用することが多いが、そのような方法は技術的な課題のために幼若マウスに適用されることはめったにない。この原稿は、p20からp60以降の発達的に重要なウィンドウにわたってマウスのin vivo電気生理学的記録を取得する方法を説明しています。この方法論には、マイクロドライブインプラントの印刷と構築のための製造プロセス、外科的移植手順、および術後の回復戦略が含まれ、これらはすべて幼若マウスでの使用に特化しています。このプロトコルの開発には、成体マウスと比較して幼若マウスのサイズが小さく相対的に弱いこと、マイクロドライブを取り付ける必要のある幼若マウスの頭蓋骨の骨化の減少など、いくつかの考慮事項が影響しました。
in vivo電気生理学を行うために一般的に使用される2つの主要な方法は、電極のアレイ(例えば、四極管)およびシリコンプローブである。シリコンプローブは軽量であり、単位重量当たり多数の記録部位を提供することができ、そして幼若ラットにおいて以前に利用されてきた25。ただし、シリコンプローブはユニットあたり比較的高価です。対照的に、この原稿に記載されているマイクロドライブは、50米ドル未満の原材料を使用して構築できるため、in vivo記録の費用効果の高いオプションになります。さらに、シリコンプローブは固定線に埋め込む必要があることが多く、空間的に多様な脳領域の記録が禁止されています。対照的に、この原稿で説明されているマイクロドライブの設計は、独立して調整可能な四極管を利用して、最大16の異なる場所での同時記録に対応し、それらの場所間の空間的関係を実質的に制限しません。このマイクロドライブの設計は、カニューレ穴の押し出しを任意の前方/後方および内側/遠位の位置に移動することにより、ここで説明したものとは異なる場所をターゲットにできるように簡単に変更できます。別の脳領域をターゲットにする場合、四極管はしばしば直進しますが、これらの細いワイヤーはマイクロドライブカニューレを出るときにわずかにたわむ可能性があることに注意することが重要です。したがって、脳領域が小さくなったり腹側が多いほど、テトロードでその領域をうまく標的にすることはより困難になります。
この原稿に記載されているマイクロドライブインプラントは、個々のテトロードがネジに取り付けられ、各テトロードの記録深さの微調整を可能にするという点で、いくつかの以前のテトロードベースのマイクロドライブ設計23、32、33、34、35と基本的に類似している。現在のマイクロドライブ設計のいくつかの特徴は、空間的に分布した脳領域を標的にすることの容易さなど、独特ですが、現在の原稿の主な目新しさは、外科的移植と術後の回復戦略の説明であり、これにより、まだ発達中の幼若マウスのネットワーク活動の慢性的な研究が可能になります。実際、ここで説明する手術と回復の方法論は、幼若マウスの他のインプラントをサポートするように適応させることができます。
複数日にわたって一貫した記録を維持するには、ワイヤーまたはプローブを頭蓋骨にしっかりと固定する必要があります。マウスの頭蓋骨の全体的な構造はp20以降わずかな変化しか受けませんが、頭蓋骨はp20からp4536歳の間にかなり厚くなります。実際、p20の頭蓋骨は、損傷することなく取り付けられたインプラントを支えるには剛性が不十分です。この生物学的限界を克服するために、このプロトコルは、移植手術中にシアノアクリレート を介して 頭蓋骨を人工的に厚くします。この戦略を用いてp20より若いマウスへの移植は可能である可能性が高いが、マウスの頭蓋骨はおよそp2036までかなりの大きさおよび形状の変化を受ける。したがって、まだ発達中の頭蓋骨のシアノアクリレートと固定骨スクリューは、頭蓋骨の自然な成長とその下にある脳組織の発達に大きな影響を与える可能性があるため、p20未満のマウスに長期間移植することは推奨されません。重要なことに、この研究では、p20から始まる慢性移植後に頭蓋骨または脳サイズの全体的な測定値への影響は観察されませんでした(図5C)。
この原稿に記載されている方法の重要なステップは、手術後の回復戦略です。この戦略によれば、マウスが成熟し、筋肉および筋骨格系の発達を経るにつれて、インプラントの重量は継続的に相殺されるべきである。着床直後、マウスはカウンターバランスなしではインプラントの重量にうまく耐えることができず、マウスがケージ内の食物や水源に適切に到達できないため、栄養失調や脱水症につながります。カウンターバランスシステムは、構築が簡単で安価で、実装が簡単で、あらゆる移植可能な年齢のマウスがホームケージ全体を自由に探索できるため、十分な栄養と水分補給が保証されます。マウスが年をとるにつれて、相殺の量は、成体マウスで完全に除去できるようになるまで減らすことができます。ただし、実験期間中は、少なくとも公称カウンターウェイトを常に取り付けて、カウンターバランスシステムを継続して使用することをお勧めします。成体マウスは時間の経過とともにマイクロドライブのサイズと重量に耐えることができるかもしれませんが、カウンターウェイトを改善しない自由な行動中に自然な動きを続けると、マイクロドライブを頭蓋骨に固定する骨ネジにトルクとせん断力が発生し、特に長時間の慢性実験中に切断される可能性が高まります。
現在の研究では、2つの重要な制限が注目に値します。まず、p20での移植が頭蓋骨と脳の発達に与える影響を評価するために、マウスのいくつかのコホートを長期移植後に屠殺しました(図5C)。これらの解析では、頭蓋骨腔のサイズや脳の質量に対する移植の有意な影響は示されていませんでしたが(図5C)、現在の研究では、p20-p60の初期発達期間を通じて複数の時点で頭蓋骨のサイズや脳質量を調べていませんでした。以前の研究では、脳腔の発達がp2036までに完了することが示されていますが、この初期のウィンドウでの移植は、ここで評価された成人年齢によって修正または補償される予期しない変化をもたらす可能性があります。第二に、図3および図4に示す電気生理学的データを生成した実験は、細胞収量を最大化するように設計されていなかった。したがって、ここに示すデータは、安定した慢性的な記録と十分に絶縁された単一ユニットを示していますが、このデバイスの最大潜在的収量を表すものと見なすべきではありません。
多くの人間の神経学的および精神医学的障害は、自閉症および統合失調症を含む、初期の発達期または青年期に現れる。しかし、利用可能なマウスモデルが多数あるにもかかわらず、これらの疾患の根底にある可能性のある回路レベルの機能障害についてはほとんど知られていません。これらの初期のネットワークの変化を特定することは、早期発見戦略と治療パラダイムを作成するために重要です。しかし、技術的な課題により、神経精神疾患のマウスモデルの開発全体でネットワーク機能がどのように破壊されるかは不明です。ここで説明するマイクロドライブと回復戦略は、マウス脳における多領域脳ネットワーク発達の調査をサポートするように設計されており、したがって、研究者は健康な脳の発達を測定し、マウスの疾患モデルにおけるその発達の変化を特定できます。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、国立衛生研究所R01 NS104829(B.E.P.)、R01 MH117149(L.J.V.)、F99NS12053(L.D.Q.)、およびUT Southwest GSO Endowment Award(R.J.P. および L.D.Q.)の支援を受けました。著者らは、技術支援を提供してくれたJenny Scaria(テキサス工科大学健康科学センター薬学部)と方法論的提案をしてくれたブレンドン・ワトソン博士(ミシガン大学)に感謝している。
資料
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
参考文献
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved