Method Article
Un impianto di azionamento leggero per registrazioni croniche di tetrodi in topi giovani
In questo articolo
Riepilogo
Qui, descriviamo un progetto di micro-drive, una procedura di impianto chirurgico e una strategia di recupero post-operatorio che consentono registrazioni croniche sul campo e singole unità da più regioni del cervello contemporaneamente in topi giovani e adolescenti attraverso una finestra di sviluppo critica dal giorno postnatale 20 (p20) al giorno postnatale 60 (p60) e oltre.
Abstract
L'elettrofisiologia in vivo fornisce una visione senza precedenti della dinamica dei circuiti di livello inferiore al secondo del cervello intatto e rappresenta un metodo di particolare importanza per lo studio di modelli murini di disturbi neuropsichiatrici umani. Tuttavia, tali metodi spesso richiedono grandi impianti cranici, che non possono essere utilizzati nei topi nei primi punti temporali dello sviluppo. Pertanto, praticamente nessuno studio di fisiologia in vivo è stato eseguito in topi neonati o giovani che si comportano liberamente, nonostante il fatto che una migliore comprensione dello sviluppo neurologico in questa finestra critica fornirebbe probabilmente intuizioni uniche sui disturbi dello sviluppo dipendenti dall'età come l'autismo o la schizofrenia. Qui, viene descritto un design micro-drive, una procedura di impianto chirurgico e una strategia di recupero post-operatorio che consentono registrazioni croniche sul campo e su singole unità da più regioni del cervello contemporaneamente nei topi mentre invecchiano dal giorno postnatale 20 (p20) al giorno postnatale 60 (p60) e oltre, una finestra temporale corrispondente approssimativamente all'età umana di 2 anni fino all'età adulta. Il numero di elettrodi di registrazione e siti di registrazione finali può essere facilmente modificato ed espanso, consentendo così un controllo sperimentale flessibile del monitoraggio in vivo delle regioni cerebrali rilevanti per il comportamento o la malattia durante lo sviluppo.
Introduzione
Il cervello subisce cambiamenti su larga scala durante le finestre critiche dello sviluppo dell'infanzia e dell'adolescenza 1,2,3. Molte malattie neurologiche e psichiatriche, tra cui l'autismo e la schizofrenia, si manifestano per la prima volta a livello comportamentale e biologico durante questo periodo di sviluppo cerebrale giovanile e adolescenziale 4,5,6. Mentre si sa molto per quanto riguarda i cambiamenti cellulari, sinaptici e genetici che si verificano durante lo sviluppo iniziale, relativamente poco si sa su come i processi a livello di circuito o di rete cambiano in questa finestra temporale. È importante sottolineare che la funzione cerebrale a livello di circuito, che alla fine è alla base di comportamenti complessi, memoria e cognizione, è una proprietà emergente non prevedibile della funzione cellulare e sinaptica 7,8,9,10. Pertanto, per comprendere appieno la funzione cerebrale a livello di rete, è necessario studiare direttamente l'attività neurale a livello di un circuito neurale intatto. Inoltre, per identificare come l'attività cerebrale è alterata durante la progressione dei disturbi neuropsichiatrici, è fondamentale esaminare l'attività di rete in un modello di malattia valido durante la finestra temporale specifica in cui si manifestano i fenotipi comportamentali della malattia e tracciare i cambiamenti osservati mentre persistono nell'età adulta.
Uno degli organismi modello scientifici più comuni e potenti è il topo, con un gran numero di ceppi genetici unici che modellano i disturbi dello sviluppo neurologico con insorgenza dipendente dall'età dei fenotipi comportamentali e / o mnemonici 11,12,13,14,15,16,17,18,19,20,21 . Mentre è difficile correlare precisi punti temporali di sviluppo tra il cervello degli esseri umani e dei topi, i confronti morfologici e comportamentali indicano che i topi p20-p21 rappresentano l'età umana di 2-3 anni e i topi p25-p35 rappresentano l'età umana di 11-14 anni, con topi che probabilmente raggiungono l'equivalente evolutivo di un adulto umano di 20 anni entro p603, 22. Pertanto, per capire meglio come si sviluppa il cervello giovanile e per identificare come le reti neurali del cervello diventano disfunzionali in malattie come l'autismo o la schizofrenia, sarebbe ideale monitorare direttamente l'attività cerebrale in vivo nei topi di età compresa tra 20 giorni e 60 giorni.
Tuttavia, una sfida fondamentale nel monitoraggio dell'attività cerebrale attraverso lo sviluppo precoce nei topi è la piccola taglia e la relativa debolezza dei topi giovani. L'impianto cronico di elettrodi, necessario per gli studi longitudinali sullo sviluppo del cervello, richiede tipicamente un alloggiamento grande e ingombrante per proteggere i fili sottili degli elettrodi e le schede di interfaccia23,24, e gli impianti devono essere saldamente attaccati al cranio del topo, che è più sottile e meno rigido nei topi giovani a causa della ridotta ossificazione. Pertanto, praticamente tutti gli studi sulla fisiologia dei roditori in vivo sono stati eseguiti in soggetti adulti a causa delle loro dimensioni relative, forza e spessore del cranio. Ad oggi, la maggior parte degli studi che esplorano la fisiologia del cervello dei giovani roditori in vivo sono stati condotti su ratti giovani wild-type, il che limita necessariamente la capacità di monitorare sperimentalmente la funzione cerebrale giovanile in un modello che si comporta liberamente di un disturbo umano 25,26,27,28,29,30.
Questo manoscritto descrive un nuovo alloggiamento implantare, una procedura di impianto chirurgico e una strategia di recupero post-operatorio per studiare cronicamente la funzione cerebrale in vivo a lungo termine (fino a 4 o più settimane) dei topi giovani attraverso una finestra temporale critica per lo sviluppo (da p20 a p60 e oltre). La procedura di impianto consente l'apposizione affidabile e permanente degli elettrodi sui crani dei topi giovani. Inoltre, il design del micro-drive è leggero, poiché questo micro-drive pesa ~ 4-6 g quando è completamente assemblato e, grazie al minimo controbilanciamento richiesto per compensare il peso dell'impianto, non influisce sulle prestazioni comportamentali dei topi giovani durante i tipici paradigmi comportamentali.
Protocollo
Il presente studio è stato approvato dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Texas Southwestern Medical Center (protocollo 2015-100867) ed eseguito in conformità con le linee guida istituzionali e del National Institute of Health. I topi maschi e femmine C57/Bl6 utilizzati nel presente studio sono stati impiantati a p20 (peso 8,3-11,1 g al momento dell'impianto).
1. Progettazione e costruzione di micro-drive
- Progettazione e stampa digitale del micro-drive (Figura 1)
- Scarica i modelli di modello di micro-drive (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- Identificare le posizioni stereotassiche delle regioni cerebrali bersaglio in un atlante stereotassico appropriato.
- Utilizzando il software CAD tridimensionale assistito da computer (CAD 3D), caricare la cannula micro-drive modello (Figura 1B).
- Se necessario, modificare le posizioni di uscita della cannula di uscita sul modello di cannula micro-drive per indirizzare le regioni cerebrali desiderate.
NOTA: Ogni estrusione del foro della cannula deve essere lunga almeno 2 mm per garantire che il tetrodo emerga dal foro della cannula puntando dritto verso il bersaglio. La cannula micro-drive è progettata per colpire bilateralmente la corteccia cingolata anteriore (un tetrodo per emisfero), l'area ippocampale CA1 (quattro tetrodi per emisfero) e l'area ippocampale CA3 (due tetrodi per emisfero), con un tetrodo di riferimento per emisfero posizionato nella sostanza bianca sopra l'area ippocampale CA1. - Se necessario, modificare il corpo del microazionamento (figura 1A) per adattarlo al collegamento della scheda di interfaccia elettronica (BEI).
- Stampa il corpo del micro-drive, la cannula, il cono e il coperchio ad alta risoluzione su una stampante 3D (idealmente con una risoluzione migliore di 25 μm) e prepara i materiali stampati secondo i protocolli del produttore. Utilizzare resine per stampanti ad alta rigidità.
- Assemblaggio delle viti e degli accessori personalizzati (Figura 2A, B)
- Utilizzando un software CAD 3D, caricare i modelli di fissaggio a vite (Figura 1E).
- Stampare gli attacchi a vite ad alta risoluzione su una stampante 3D (idealmente con una risoluzione di almeno 25 μm) e preparare i materiali stampati secondo i protocolli del produttore. Utilizzare resine per stampanti ad alta rigidità.
- Fissare gli attacchi delle viti a ciascuna vite di avanzamento del tetrodo (Figura 1F) (le viti di avanzamento del tetrodo sono prodotte su misura in un'officina meccanica prima della costruzione di microazionamenti).
- Fissare due attacchi a vite su ciascuna vite, uno sopra e uno sotto la cresta. Assicurarsi che la parte inferiore di ciascun attacco a vite contatti la cresta. Tenere insieme gli attacchi a vite con gel cianoacrilato.
- Una volta fissati, assicurarsi che gli attacchi della vite non si muovano nell'asse longitudinale della vite ma ruotino liberamente con una resistenza minima.
- Assemblaggio del corpo del microazionamento (Figura 2C, D)
- Usando forbici sottili e affilate, tagliare grandi tubi di poliimmide (diametro esterno: 0,2921 mm, diametro interno: 0,1803 mm) in sezioni lunghe ~ 6 cm.
- Far passare le grandi sezioni di poliimmide attraverso i fori di uscita sulla cannula micro-drive in modo che ogni tubo si estenda oltre il fondo della cannula di alcuni millimetri.
- Utilizzando un ago pulito da 30 G, applicare la poliimmide alla cannula applicando piccole quantità di cianoacrilato liquido. Fare attenzione a non permettere al cianoacrilato di entrare all'interno del tubo di poliimmide.
NOTA: il gocciolamento di cianoacrilato liquido nella cannula attraverso la parte superiore del corpo dell'unità può accelerare questo processo, ma richiederà la ri-pulizia dei fori di guida in seguito con un trapano a punta fine. - Far passare i grandi tubi di poliimmide dalla parte superiore della cannula micro-drive attraverso gli appositi fori di poliimmide di grandi dimensioni nel corpo del micro-drive.
- Spingere lentamente la cannula micro-drive e il corpo del micro-drive insieme fino a quando non sono adiacenti e le linguette di attacco della cannula/corpo si incastrano. Fare attenzione a non attorcigliare o danneggiare i tubi di poliimmide nel processo.
NOTA: Ogni tubo di poliimmide deve passare dolcemente dal fondo della cannula attraverso la parte superiore del corpo del micro-drive. Una leggera flessione è normale, ma un'eccessiva flessione del tubo di poliimmide può deformare il tetrodo e impedirgli di passare direttamente nel cervello. - Fissare il corpo del micro-drive e la cannula micro-drive insieme usando cianoacrilato.
- Utilizzando una nuova lama affilata, recidere le grandi estremità del tubo di poliimmide che si stanno estrudendo dal fondo dei fori di uscita della cannula. Assicurarsi che il taglio sia esattamente alla base della cannula, facendo sì che i tubi e il fondo della cannula siano a filo l'uno con l'altro.
- Usando forbici affilate, tagliare il grande tubo di poliimmide appena sopra il bordo del bordo interno del corpo dell'unità con un angolo di ~ 45 °.
- Caricamento delle viti personalizzate assemblate (Figura 2E)
- Avvitare ogni vite personalizzata assemblata nei fori esterni del corpo del micro-drive. Assicurarsi che il reggisella della vite passi attraverso il grande foro negli attacchi delle viti. Avanzare completamente ogni vite fino a quando non avanzerà ulteriormente. Si consiglia di pre-lubrificare le viti con olio minerale o grasso per assali.
- Utilizzando forbici estremamente affilate, tagliare piccoli tubi di poliimmide (diametro esterno: 0,1397 mm, diametro interno: 0,1016) in sezioni lunghe ~ 4 cm.
- Far passare le piccole sezioni di poliimmide attraverso il grande tubo di poliimmide già montato nel micro-drive. Assicurarsi che i piccoli tubi in poliimmide in eccesso sporgano dalla parte superiore e inferiore di ciascun tubo di poliimmide di grandi dimensioni.
- Fissare i piccoli tubi di poliimmide agli attacchi delle viti tramite cianoacrilato, facendo attenzione a non far entrare alcun cianoacrilato nei tubi di poliimmide grandi o piccoli.
- Utilizzando una nuova lama affilata, recidere le piccole estremità del tubo di poliimmide che si stanno estrudendo dal fondo dei fori della cannula. Assicurarsi che il taglio sia esattamente alla base della cannula e che il taglio sia pulito, senza che nulla ostruisca il foro del tubo di poliimmide.
- Usando forbici affilate, tagliare la parte superiore della piccola poliimmide a pochi millimetri sopra la parte superiore dell'attacco della vite con un angolo di ~ 45 °. Assicurarsi che il taglio sia pulito, senza che nulla blocchi il foro del tubo di poliimmide.
- Caricamento dei tetrodi
- Preparare i tetrodi (~ 6 cm di lunghezza) utilizzando i metodi precedentemente descritti31.
- Usando una pinza in ceramica o gomma, passare con attenzione un tetrodo attraverso uno dei piccoli tubi di poliimmide, lasciando ~ 2 cm sporgente dalla parte superiore del piccolo tubo di poliimmide.
- Fissare il tetrodo sulla parte superiore del piccolo tubo di poliimmide tramite cianoacrilato liquido, facendo attenzione a non fissare insieme i tubi di poliimmide piccoli e grandi nel processo.
- Ritrarre la vite fino a quando non si trova vicino alla parte superiore dell'unità.
- Afferrare il filo del tetrodo che sporge dalla parte inferiore dell'unità e attorcigliarlo delicatamente nel punto in cui emerge dalla cannula.
- Far avanzare completamente la vite nell'unità.
- Usando forbici molto affilate, tagliare il filo del tetrodo appena sopra il nodo. Al microscopio, assicurarsi che il taglio sia pulito e che il metallo di tutti e quattro i tetrodi sia esposto.
- Ritrarre la vite fino a quando il tetrodo non è appena fissato all'interno della cannula.
- Ripetere i passaggi 1.5.2-1.5.8 per tutte le viti.
- Collegare la BEI alla piattaforma di supporto della BEI tramite piccole viti per gioielli.
- Collegare ciascun elettrodo di ciascun tetrodo alla porta appropriata della BEI.
- Preparazione del micro-drive per l'intervento chirurgico
- Placcare elettricamente i tetrodi per ridurre l'impedenza elettrica utilizzando i metodi precedentemente descritti31.
- Dopo la placcatura, assicurarsi che ogni tetrodo sia alloggiato nella cannula in modo tale che la punta del tetrodo sia a filo con il fondo di ciascun foro della cannula.
- Far scorrere il cono del micro-drive attorno al micro-drive completato. Collegare il coperchio del micro-drive al cono del micro-drive facendo scorrere il palo di attacco del cono nella porta del coperchio.
- Orientare il cono in modo che i connettori BEI passino liberamente attraverso i fori passanti di connessione BEI quando il coperchio è chiuso e incollare il cono in posizione con cianoacrilato posto intorno alla base del cono, facendo attenzione a non far entrare alcun cianoacrilato in nessuno dei fori di uscita della cannula. Rimuovere il coperchio.
- Riempire accuratamente ogni foro della cannula con olio minerale sterile per evitare che i fluidi corporei entrino nei fori di poliimmide dopo l'impianto chirurgico.
- Rivestire accuratamente la base della cannula con vaselina sterile. Questo servirà come barriera per impedire agli agenti chimici (ad esempio, cemento dentale) di entrare nel cervello esposto durante l'intervento chirurgico.
- Pesare il micro-drive, il coperchio e le quattro viti ossee completamente assemblati per preparare un contrappeso di peso uguale.
- Facoltativamente, prima dell'intervento chirurgico, estrudere i tetrodi a una distanza appropriata per raggiungere le regioni cerebrali target una volta che l'unità è a filo con il cranio.
NOTA: Prima dell'impianto chirurgico, sterilizzare l'impianto mediante sterilizzazione a gas in ossido di etilene (500-1200 mg / L, 2-4 ore). Tutte le viti ossee e gli strumenti chirurgici devono essere sterilizzati in autoclave (121°C, 30 minuti).
2. Impianto chirurgico
- Anestetizzare il mouse e montarlo nell'apparato stereotassico
- Posizionare il mouse in una piccola scatola con spazio sufficiente per muoversi e anestetizzare il mouse con isoflurano al 3% -4%.
NOTA: Possono essere utilizzati altri agenti anestetici, ma si deve usare cautela a causa dell'età, delle dimensioni e del peso del soggetto di topo giovane. - Una volta che il mouse non risponde (nessuna risposta al pizzico della coda, una velocità di ventilazione di ~ 60 respiri al minuto), rimuoverlo dalla scatola e montarlo rapidamente sull'apparato stereotassico.
- Rapidamente, posizionare la maschera stereotassica sul muso del topo e mantenere l'anestesia all'1-3% di isoflurano. Applicare qualsiasi sollievo dal dolore approvato per via veterinaria, come buprenorfina a rilascio prolungato (0,05-0,5 mg / kg per via sottocutanea) o agenti antinfiammatori, come il carprofene (5-10 mg / kg sottocutaneo), prima dell'incisione chirurgica iniziale.
- Fissare completamente la testa del mouse nell'apparato stereotassico utilizzando barre auricolari. Assicurati che il cranio sia livellato e immobile senza esercitare una pressione inutile sui canali uditivi del topo. A causa della limitata ossificazione delle ossa del cranio giovanile, è possibile causare danni permanenti durante la fissazione della testa.
- Posizionare il mouse in una piccola scatola con spazio sufficiente per muoversi e anestetizzare il mouse con isoflurano al 3% -4%.
- Preparare il topo per la chirurgia ed esporre il cranio
- Proteggere gli occhi del topo posizionando un piccolo volume di gel lacrimale sintetico su ciascun occhio e coprendo ciascun occhio con un cerotto autoclavato di lamina.
NOTA: Le lacrime sintetiche manterranno gli occhi umidi, mentre la pellicola impedirà a qualsiasi fonte di luce di causare danni a lungo termine. Le soluzioni lacrimaliche sintetiche più spesse sono preferite in quanto possono anche fungere da barriera all'introduzione involontaria di altre soluzioni chirurgiche potenzialmente tossiche (etanolo, acrilico dentale, ecc.) negli occhi. - Utilizzando tamponi sterili con punta di cotone, applicare la crema depilatoria sulla zona chirurgica per rimuovere i peli dal cuoio capelluto. Fare attenzione a non ottenere la crema vicino agli occhi. Dopo aver rimosso i capelli, posizionare un drappo sterile sul cuoio capelluto per fissare l'area chirurgica.
- Utilizzando tamponi sterili con punta di cotone, pulire il cuoio capelluto con tre lavaggi consecutivi di soluzione di iodio povidone (10%) seguiti da alcool isopropilico (100%).
- Usando un bisturi sterile o forbici sottili, rimuovere il cuoio capelluto.
- Utilizzando tamponi sterili con punta di cotone e soluzioni sterili di soluzione salina (0,9% NaCl) e perossido di idrogeno, pulire accuratamente il cranio.
- Identificare il bregma e, utilizzando l'apparato stereotassico, contrassegnare attentamente le posizioni di registrazione target sul cranio con un marcatore permanente.
- Proteggere gli occhi del topo posizionando un piccolo volume di gel lacrimale sintetico su ciascun occhio e coprendo ciascun occhio con un cerotto autoclavato di lamina.
- Apertura del foro della cannula e fissaggio degli ancoraggi ossei
- Rimuovere il teschio sovrapposto ai siti di registrazione. # A causa della magrezza del cranio a questa età, tagliare il cranio con una lama di bisturi; Ciò elimina la necessità di utilizzare un trapano, che potrebbe danneggiare la dura sottostante. Mantenere umida la dura esposta con l'applicazione di soluzione salina sterile (0,9% NaCl) o olio minerale sterile. Non rimuovere o perforare la dura in questa fase, poiché è sufficientemente sottile nei topi giovani per far passare i tetrodi nelle fasi future.
- Praticare con attenzione i fori pilota per quattro viti ossee.
- Posizionare le viti ossee nelle porzioni estreme laterali e rostrali o caudali del cranio, dove l'osso è più spesso e le viti ossee sono sufficientemente lontane dall'impianto micro-drive. Per le viti ossee, utilizzare viti sterili per gioielli fini (ad esempio, filettatura UNM 120, testa da 1,5 mm).
- Avvolgere saldamente una vite ossea con un filo sottile e altamente conduttivo che fungerà da terra e sarà fissato alla BEI nella fase 2.4.6.
- Usando una lama di bisturi o usando con attenzione una punta da trapano, segnare il cranio vicino alle posizioni del foro della vite ossea. Il punteggio è importante per fornire una superficie sufficientemente ruvida da consentire al cianoacrilato liquido di legarsi nella fase 2.3.5.
- Utilizzando un cacciavite sterile e un morsetto sterile, infilare ogni vite ossea sterile in posizione, facendo attenzione a non perforare la dura sottostante.
- Utilizzando un ago sterile da 30 G, posizionare il cianoacrilato liquido attorno a ciascuna vite ossea. Questo ispessisce efficacemente il cranio dove sono state attaccate le viti ossee. Fare attenzione a non permettere a qualsiasi cianoacrilato di entrare nella dura esposta sopra i siti di registrazione.
- Abbassamento e collegamento del microazionamento (Figura 2G)
- Montare il micro-drive completato sull'apparato stereotassico per essere accuratamente abbassato sul cranio del topo. Assicurarsi che la cannula micro-drive si trovi alle coordinate appropriate quando viene abbassata.
- Abbassare lentamente il micro-drive, muovendosi solo nella direzione dorsale/ventrale. Abbassare il micro-drive con i tetrodi già avanzati fuori dai fori della cannula (passo 1.6.6) per visualizzare il loro ingresso nel cervello; Qualsiasi movimento mediale/laterale o rostrale/caudale quando i tetrodi toccano il mouse può piegare i tetrodi e farli perdere la loro destinazione finale.
- Una volta che il micro-drive è completamente abbassato, assicurarsi che la base della cannula entri in contatto con il cranio/dura. Lo strato di vaselina e / o olio minerale servirà come barriera per coprire la dura esposta. Se necessario, aggiungere vaselina sterile o cera ossea sterile per coprire la durata esposta in eccesso.
- Tenendo il micro-drive in posizione con l'apparato stereotassico, rivestire il cranio in cemento dentale per fissare la base del micro-drive alle viti ossee impiantate.
NOTA: Il cemento dentale deve racchiudere completamente tutte le viti ossee e deve coprire la sporgenza di ancoraggio del cemento dentale sulla cannula micro-drive. - Mentre il cemento dentale si incastona, modellalo con cura per evitare spigoli vivi o bordi che potrebbero danneggiare il mouse o danneggiare il micro-drive. Assicurati che ci sia abbastanza cemento dentale per contenere il micro-drive, ma elimina il cemento dentale eccessivo che aggiungerà peso inutile.
- Infilare con attenzione il filo di terra attraverso il microazionamento e collegarlo all'apposito slot sulla BEI.
- Una volta che il cemento dentale è completamente impostato, staccare con cura il micro-drive dall'apparato stereotassico. Posizionare il coperchio sul micro-drive.
- Con un tampone sterile con punta di cotone e soluzione salina sterile, pulire il mouse.
- Con un tampone sterile con punta di cotone, applicare un sottile strato di unguento antibiotico su qualsiasi cuoio capelluto esposto vicino al sito dell'impianto.
- Rimuovere la pellicola dagli occhi del topo.
- Rimuovere il mouse dall'apparato stereotassico, avendo cura di sostenere il peso aggiuntivo del micro-drive mentre il mouse viene trasportato in una gabbia pulita.
3. Recupero post-operatorio
- Recupero immediato
- Prima dell'intervento, preparare il sistema di controbilanciamento collegando un tubo in PVC di 0,75 di diametro, come mostrato nella Figura 2G. Un braccio del sistema passa attraverso i fori praticati nel coperchio della gabbia, il secondo braccio poggia sopra il coperchio della gabbia e il terzo braccio si estende sopra e oltre la gabbia. Il braccio più in alto è tappato.
- Fissare con attenzione il microazionamento al sistema di controbilanciamento (Figura 2G-I) e utilizzare un peso di contrapbilanciamento identico al peso del microazionamento e delle viti ossee. Far scorrere un filo forte o una lenza da un connettore collegato alla BEI sopra i tre bracci del sistema di contrappeso al peso del controbilanciamento, che pende sopra il braccio superiore.
- Assicurarsi che il contrappeso sia saldamente collegato al microazionamento e che vi sia una linea sufficiente per consentire al mouse di accedere completamente all'intera gabbia.
- Fornire gel ricco di sostanze nutritive nella gabbia insieme a roditori normali inumiditi per garantire la reidratazione e il recupero.
- Monitorare il mouse fino a quando non si riprende completamente dall'anestesia chirurgica.
- Recupero a lungo termine
- In ogni momento, quando non è collegato all'apparecchio di controllo, assicurarsi che il microazionamento sia supportato dal sistema di contrappeso. Ridurre il contrappeso nel tempo, ma non rimuoverlo mai del tutto per evitare sollecitazioni impreviste al mouse o alla coppia alle viti ossee.
- Per evitare danni all'impianto e al sistema di controbilanciamento, alloggiare il mouse senza possibilità di interazione diretta con altri topi per tutta la durata dell'esperimento.
- Fornire gel ricco di sostanze nutritive per almeno 3 giorni dopo l'intervento chirurgico, a quel punto il cibo solido da solo sarà sufficiente.
- A causa dei requisiti generali del sistema di controbilanciamento, non fornire cibo e acqua in una rete metallica aerea; Posizionare il cibo sul pavimento della gabbia e fornire acqua attraverso il lato della gabbia. Per evitare il deterioramento, sostituire il cibo interamente ogni giorno.
- Ogni giorno, assicurarsi che il mouse abbia libero accesso all'intera gabbia e che il contrappeso sia saldamente e saldamente fissato al micro-drive.
Risultati
Il protocollo sopra descritto è stato utilizzato per registrare i segnali potenziali del campo locale e singole unità da più aree cerebrali contemporaneamente nei topi, con registrazioni giornaliere condotte negli stessi topi da p20 a p60. Qui sono riportate registrazioni elettrofisiologiche rappresentative di due topi e istologia post-esperimento che dimostrano i luoghi di registrazione finali.
Impianto chirurgico del micro-drive in topi p20
Un micro-drive (Figura 1) è stato costruito (Figura 2) e impiantato chirurgicamente in un mouse p20, come descritto sopra. Immediatamente dopo l'intervento, il topo è stato attaccato al sistema di contrappeso (Figura 2G-I) e lasciato recuperare. Una volta che il mouse era completamente mobile, il micro-drive è stato collegato a un sistema di registrazione elettrofisiologica in vivo. I cavi che collegavano il micro-drive all'apparecchiatura di registrazione erano sospesi sopra il mouse. Le registrazioni elettrofisiologiche (32 kHz) sono state ottenute su tutti i canali per 1 ora mentre il topo si comportava naturalmente nella sua gabbia domestica. Dopo la registrazione, il mouse è stato scollegato dal sistema di registrazione, ricollegato al sistema di contrappeso e restituito al vivaio con libero accesso all'acqua e al chow.
Registrazione giornaliera dell'attività neurale
Le registrazioni elettrofisiologiche sono state ottenute quotidianamente per diverse settimane per consentire il monitoraggio cronico della stessa regione cerebrale attraverso le finestre critiche dello sviluppo di p20-p60. I potenziali di campo locale grezzi (LFP) del campione provenienti da tutte le registrazioni croniche sono mostrati nella Figura 3A,C. Singole unità isolate sono state ottenute simultaneamente da più tetrodi (Figura 3B). Le unità con forme d'onda simili sono state identificate in più giorni (Figura 3B, al centro e a destra), ma a causa della potenziale deriva dell'elettrodo di registrazione, non è stato possibile affermare definitivamente che la stessa unità fosse stata identificata nel corso dei giorni. In un topo separato impiantato a p20 e registrato quotidianamente per diverse settimane, l'attività neurale è stata esaminata su un tetrodo mirato all'area dorsale CA1. Ondulazioni di grande ampiezza e singole unità ben isolate sono state identificate in ogni giorno della registrazione (Figura 4). Questi dati indicano che registrazioni elettrofisiologiche in vivo stabili e di alta qualità potrebbero provenire dallo stesso topo durante lo sviluppo iniziale.
Conferma istologica dei siti di registrazione e impatto sullo sviluppo dell'impianto cronico
Dopo l'ultimo giorno di registrazione, il topo è stato accuratamente anestetizzato tramite anestesia isoflurana seguita da un'iniezione letale di sodio pentobarbital e una corrente è stata fatta passare attraverso le punte degli elettrodi per produrre piccole lesioni nei siti di registrazione. Il sezionamento istologico post-esperimento del cervello del topo ha permesso la visualizzazione dei siti di registrazione finali (Figura 5A,B). In una coorte separata, tre topi maschi e tre femmine sono stati impiantati chirurgicamente a p20 come descritto sopra. Un numero uguale di cucciolate è stato lasciato non impiantato e mantenuto in condizioni abitative identiche. I topi sono stati sacrificati a p62 (6 settimane dopo l'intervento chirurgico per la coorte impiantata). I teschi sono stati accuratamente puliti e sono state prese misure esterne della distanza bregma-lambda (Figura 5C, in alto a sinistra) e della larghezza massima esterna del cranio a lambda (Figura 5C, in alto a destra). È stata praticata un'incisione lungo la linea mediana del cranio e metà del cranio è stata rimossa per asportare il cervello per la misurazione di massa (Figura 5C, in basso a destra). L'altezza della cavità cranica al bregma è stata misurata dalla metà intatta del cranio (Figura 5C, in basso a sinistra). Nessuna misura era significativamente diversa tra le coorti impiantate e non impiantate (test Wilcoxon rank-sum), indicando che l'impianto a lungo termine, a partire da p20, non ha alcun impatto lordo sullo sviluppo naturale del cranio o del volume cerebrale.

Figura 1: Componenti di microazionamenti. Rendering tridimensionali del corpo (A) micro-drive, (B) cannula, (C) cono, (D) coperchio, (E) attacchi a vite e (F) vite di avanzamento del tetrodo. Sono indicate le caratteristiche critiche di ciascun componente. I dettagli di misura possono essere estratti dai file di modello disponibili su https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Costruzione di microazionamenti . (A) Vista laterale e (B) dall'alto della vite di avanzamento del tetrodo con gli attacchi della vite superiore e inferiore collegati. (C) Vista laterale e (D) dall'alto del microazionamento con il corpo e la cannula attaccati e il grande tubo di poliimmide che attraversa ciascun foro della cannula e rifilato sul fondo della cannula. (E) Vista laterale del microazionamento con le viti e i piccoli tubi in poliimmide in posizione. Le parti superiori dei piccoli tubi di poliimmide vengono tagliate immediatamente prima del caricamento del tetrodo. (F) Microazionamento completato collegato all'apparecchio stereotassico. Il cono protettivo che normalmente circonda il micro-drive è stato rimosso a scopo di visualizzazione. Si noti che alcuni degli attacchi a vite sono stati stampati in una resina nera per questo micro-drive. (G) Sistema di supporto del controbilanciamento. (H) Vista laterale e (I) dall'alto di una gabbia per topi con il sistema di supporto del contrappeso collegato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
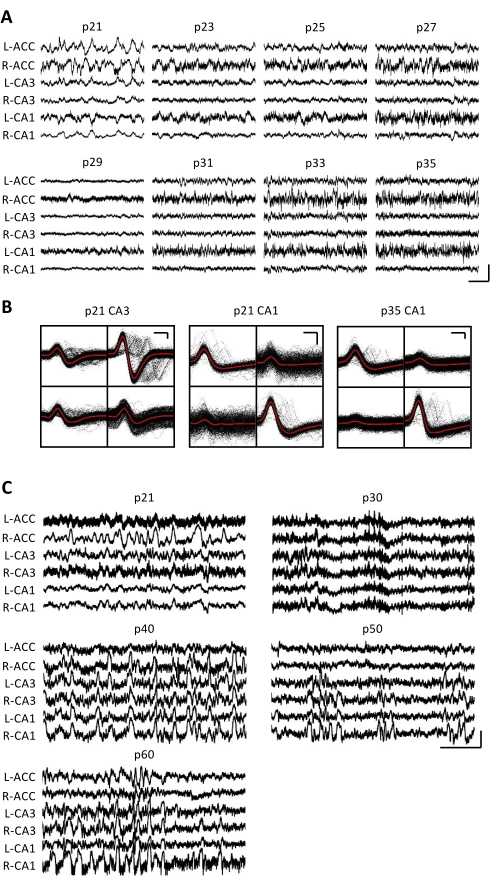
Figura 3: Registrazioni elettrofisiologiche rappresentative. Un mouse p20 è stato impiantato con un micro-drive come descritto sopra. A partire da p21 e ogni giorno successivo per 2 settimane, il topo è stato collegato all'apparato di registrazione e l'attività neurale è stata registrata per almeno 1 ora. (A) Registrazioni del potenziale di campo locale grezzo (LFP) dal bilaterale (L = sinistra; R = destra) corteccia cingolata anteriore (ACC), area ippocampale CA3 (CA3) e area ippocampale CA1 (CA1). I dati sono stati raccolti ogni giorno; Per chiarezza, vengono visualizzati solo i dati dei giorni dispari. Tutte le tracce sono state prese durante i periodi di immobilità nella gabbia domestica. Barra della scala: 1 mV, 2 s. (B) Unità singole rappresentative isolate dall'area ippocampale CA3 (a sinistra) e CA1 (a destra) per le registrazioni nel pannello A. Tutte le forme d'onda grezze su ciascun elettrodo sono mostrate in nero; La media è in rosso. Barra scala: 50 μV, 0,2 ms. (C) Tracce LFP grezze rappresentative per ogni 10° giorno fino al giorno di registrazione finale a p60 per un secondo topo impiantato a p20. I dati sono stati raccolti ogni giorno; Per chiarezza, vengono visualizzati solo i dati di ogni 10 giorni. Tutte le tracce sono state prese durante i periodi di immobilità nella gabbia domestica. Barra scala: 1 mV, 2 s. Fare clic qui per visualizzare una versione ingrandita di questa figura.
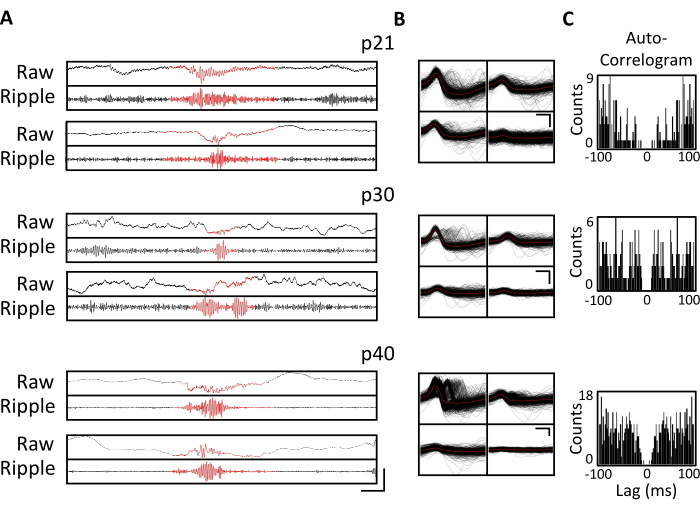
Figura 4. Stabilità delle registrazioni croniche. Un topo p20 è stato impiantato con un micro-drive, come descritto sopra. A partire da p21 e successivamente per 4 settimane, il topo è stato collegato all'apparato di registrazione e l'attività neurale è stata registrata per almeno 1 ora. Sono mostrati i dati dei tetrodi che prendono di mira l'ippocampo dorsale CA1. (A) LFP grezzo (in alto) e filtrato con ondulazione (in basso) per gli eventi di ripple identificati a p21, p30 e p40. Per identificare gli eventi di ripple, l'LFP grezzo è stato filtrato passa-banda tra 125 Hz e 300 Hz e gli eventi di ripple sono stati identificati come aumenti transitori della potenza della banda di ripple superiori a 3 deviazioni standard al di sopra della media. L'inizio e la fine di ogni increspatura sono stati definiti come il punto in cui la potenza della banda di ripple è tornata alla media. Le increspature identificate sono mostrate in rosso. Barra scala: 100 ms, dall'alto verso il basso: 1.000 μV, 140 μV, 1.800 μV, 180 μV, 9.000 μV, 1.200 μV, 10.000 μV, 1.000 μV. (B) Una singola unità rappresentativa di ogni giorno dal tetrodo CA1 per le registrazioni nel pannello A. Tutte le forme d'onda grezze su ciascun elettrodo sono mostrate in nero; La media è in rosso. Barra scala 0,2 ms, dall'alto verso il basso: 50 μV, 100 μV, 100 μV. (C) Autocorrelogramma di tutte le punte per singole unità nel pannello B. Questi dati dimostrano un posizionamento stabile degli elettrodi all'interno dello strato piramidale ippocampale per diverse settimane. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Istologia rappresentativa e impatto sullo sviluppo del cranio. Un topo p20 è stato impiantato con un micro-drive, come descritto sopra. Dopo l'ultimo giorno di registrazione su p60, sono state prodotte lesioni elettrolitiche nei siti di registrazione e il cervello è stato perfuso con paraformaldeide al 4%. Per identificare i siti di registrazione, sono state prodotte sezioni da 50 μm. (A) Lesioni in CA1 e CA3 dell'ippocampo. La punta della freccia indica il sito di registrazione CA3; la doppia freccia indica il sito di registrazione CA1. Barra della scala: 0,5 mm. (B) Lesioni nell'ACC bilaterale. Le punte delle frecce indicano i siti di registrazione ACC. Barra scala: 0,5 mm. (C) Dimensioni del cranio e misurazioni della massa cerebrale di topi p62 impiantati con un micro-drive a p20 (grigio) e compagni di cucciolata non impiantati (bianco). Il valore p del test della somma dei ranghi di Wilcoxon è riportato per ogni misurazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Gli esperimenti moderni che esplorano la funzione del circuito neurale in vivo nei roditori spesso utilizzano l'elettrofisiologia extracellulare tramite elettrodi impiantati in modo permanente per monitorare l'attività dei singoli neuroni (cioè singole unità) o delle popolazioni locali (tramite potenziali di campo locali, LFP), ma tali metodi sono raramente applicati ai topi giovani a causa di sfide tecniche. Questo manoscritto descrive un metodo per ottenere registrazioni elettrofisiologiche in vivo nei topi attraverso le finestre critiche per lo sviluppo da p20 a p60 e oltre. Questa metodologia prevede un processo di produzione per la stampa e la costruzione di un impianto micro-drive, una procedura di impianto chirurgico e una strategia di recupero post-operatorio, tutti specificamente adattati per l'uso nei topi giovani. Diverse considerazioni sono state influenti nello sviluppo di questo protocollo, tra cui le piccole dimensioni e la relativa debolezza dei topi giovani rispetto alle loro controparti adulte, nonché la ridotta ossificazione del cranio di topo giovane su cui il micro-drive doveva essere attaccato.
Due metodi principali comunemente usati per eseguire l'elettrofisiologia in vivo sono array di elettrodi (ad esempio, tetrodi) e sonde al silicio. Le sonde al silicio sono leggere, possono fornire un gran numero di siti di registrazione per unità di peso e sono state precedentemente utilizzate nei ratti giovani25. Tuttavia, le sonde al silicio sono relativamente costose per unità. Al contrario, il micro-drive descritto in questo manoscritto può essere costruito utilizzando meno di $ 50 USD in materie prime, rendendolo un'opzione economica per la registrazione in vivo . Inoltre, le sonde al silicio devono spesso essere impiantate in linee fisse, il che impedisce la registrazione di regioni cerebrali spazialmente diverse. Al contrario, il design del micro-drive descritto in questo manoscritto utilizza tetrodi regolabili in modo indipendente per ospitare registrazioni simultanee in un massimo di 16 luoghi diversi senza praticamente alcuna restrizione sulla relazione spaziale tra tali posizioni. Questo design del micro-drive può essere facilmente modificato per consentire di puntare posizioni diverse da quelle descritte qui spostando le estrusioni del foro della cannula in qualsiasi posizione anteriore/posteriore e mediale/distale desiderata. Quando si prendono di mira aree cerebrali alternative, è importante notare che mentre i tetrodi spesso viaggiano dritti, è possibile che questi fili sottili si devino leggermente mentre escono dalla cannula micro-drive. Pertanto, più piccola o più ventrale è una regione del cervello, più difficile sarà colpire con successo l'area con i tetrodi.
L'impianto di micro-drive descritto in questo manoscritto è fondamentalmente simile a diversi precedenti progetti di micro-drive basati su tetrodi 23,32,33,34,35 in quanto i singoli tetrodi sono fissati a viti, che consentono il controllo fine della profondità di registrazione di ciascun tetrodo. Mentre diverse caratteristiche dell'attuale design del micro-drive sono uniche, inclusa la facilità di targeting delle aree cerebrali spazialmente distribuite, la novità principale dell'attuale manoscritto è la descrizione dell'impianto chirurgico e delle strategie di recupero post-operatorio, che consentono studi cronici sull'attività della rete in topi giovani ancora in via di sviluppo. In effetti, le metodologie chirurgiche e di recupero qui descritte potrebbero essere adattate per supportare altri impianti nei topi giovani.
Per mantenere una registrazione coerente per più giorni, i fili o le sonde devono essere fissati rigidamente al cranio. Mentre la struttura complessiva del cranio di topo subisce solo lievi cambiamenti dopo p20, il cranio si ispessisce considerevolmente tra le età p20 e p4536. In effetti, il cranio a p20 non è sufficientemente rigido per sostenere un impianto attaccato senza essere danneggiato. Per superare questa limitazione biologica, questo protocollo ispessisce artificialmente il cranio tramite cianoacrilato durante l'intervento chirurgico di impianto. L'impianto in topi di età inferiore a p20 è probabilmente possibile utilizzando questa strategia, ma il cranio del topo subisce notevoli cambiamenti di dimensioni e forma fino a circa p2036. Pertanto, l'impianto per periodi prolungati nei topi di età inferiore a p20 non è raccomandato poiché il cianoacrilato e le viti ossee fisse nel cranio ancora in via di sviluppo possono avere un impatto significativo sulla crescita naturale del cranio e sullo sviluppo del tessuto cerebrale sottostante. È importante sottolineare che, in questo studio, non è stato osservato alcun impatto sulle misurazioni macroscopiche del cranio o delle dimensioni del cervello dopo l'impianto cronico a partire da p20 (Figura 5C).
Un passo fondamentale nel metodo descritto in questo manoscritto è la strategia di recupero post-operatorio; Secondo questa strategia, il peso dell'impianto dovrebbe essere continuamente controbilanciato man mano che il topo matura e subisce lo sviluppo muscolare e del sistema muscolo-scheletrico. Subito dopo l'impianto, i topi non sono in grado di sopportare con successo il peso dell'impianto senza il contrappeso, portando a malnutrizione e disidratazione poiché il topo non può raggiungere adeguatamente le fonti di cibo e acqua nella sua gabbia. Il sistema di contrappeso è facile ed economico da costruire, banale da implementare, e consente ai topi di qualsiasi età impiantabile di esplorare liberamente l'intera gabbia domestica, garantendo così un'adeguata nutrizione e idratazione. Man mano che i topi invecchiano, la quantità di contrappeso può essere ridotta fino a quando non può essere completamente rimossa nei topi adulti; Tuttavia, si raccomanda di continuare a utilizzare il sistema di contrappeso per tutta la durata dell'esperimento con almeno un contrappeso nominale attaccato in ogni momento. Mentre un topo adulto può essere in grado di sopportare le dimensioni e il peso del micro-drive nel tempo, il movimento naturale continuato durante il comportamento libero senza contrappeso migliorativo produce coppia e forza di taglio sulle viti ossee che ancorano il micro-drive sul cranio, rendendolo sempre più probabile che si stacchi, specialmente durante esperimenti cronici più lunghi.
Due importanti limitazioni sono degne di nota per lo studio attuale. In primo luogo, per valutare l'impatto dell'impianto a p20 sullo sviluppo del cranio e del cervello, diverse coorti di topi sono state sacrificate dopo un impianto prolungato (Figura 5C). Mentre queste analisi non hanno rivelato alcun impatto significativo dell'impianto sulle dimensioni della cavità cranica o sulla massa cerebrale (Figura 5C), l'attuale studio non ha esaminato le dimensioni del cranio o la massa cerebrale in più punti temporali durante il primo periodo di sviluppo di p20-p60. Mentre il lavoro precedente dimostra che lo sviluppo della cavità cerebrale è completato da p2036, è possibile che l'impianto in questa finestra iniziale possa produrre cambiamenti imprevisti che vengono corretti o compensati dall'età adulta che sono stati valutati qui. In secondo luogo, gli esperimenti che hanno prodotto i dati elettrofisiologici mostrati in Figura 3 e Figura 4 non sono stati progettati per massimizzare la resa cellulare. Pertanto, mentre i dati qui presentati dimostrano registrazioni stabili e croniche e singole unità ben isolate, non dovrebbero essere considerati rappresentativi della resa potenziale massima per questo dispositivo.
Molti disturbi neurologici e psichiatrici umani si manifestano durante i periodi di sviluppo precoce o durante l'adolescenza, tra cui l'autismo e la schizofrenia. Tuttavia, si sa poco per quanto riguarda la disfunzione a livello di circuito che può essere alla base di queste malattie, nonostante la pletora di modelli murini disponibili. L'identificazione di questi cambiamenti iniziali della rete è fondamentale per la creazione di strategie di diagnosi precoce e paradigmi di trattamento. Tuttavia, a causa di sfide tecniche, non è chiaro come la funzione di rete sia interrotta durante lo sviluppo in modelli murini di malattie neuropsichiatriche. La strategia di micro-drive e recupero qui descritta è progettata per supportare le indagini sullo sviluppo di reti cerebrali multiregionali nel cervello del topo e, quindi, consentire ai ricercatori di misurare lo sviluppo sano del cervello e identificare le alterazioni di tale sviluppo nei modelli murini di malattia.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal National Institutes of Health R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) e F99NS12053 (L.D.Q.) e dall'UT Southwestern GSO Endowment Award (R.J.P. e L.D.Q.). Gli autori ringraziano Jenny Scaria (Texas Tech University Health Sciences Center School of Pharmacy) per l'assistenza tecnica e il Dr. Brendon Watson (University of Michigan) per i suggerimenti metodologici.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
Riferimenti
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon