Method Article
一种用于幼年小鼠慢性四极管记录的轻型驱动植入物
摘要
在这里,我们描述了一种微驱动器设计、手术植入程序和术后恢复策略,允许在从出生后第 20 天 (p20) 到出生后第 60 天 (p60) 及以后的关键发育窗口内,同时对幼年和青少年小鼠的多个大脑区域进行慢性野外和单单元记录。
摘要
体内 电生理学为完整大脑的亚二级回路动力学提供了无与伦比的洞察力,并且代表了研究人类神经精神疾病的小鼠模型特别重要的方法。然而,这种方法通常需要大的颅骨植入物,这不能在早期发育时间点用于小鼠。因此,几乎没有在行为自由的婴儿或幼年小鼠中进行 体内生理学 研究,尽管在这个关键窗口更好地了解神经系统发育可能会为自闭症或精神分裂症等年龄依赖性发育障碍提供独特的见解。在这里,描述了微驱动器设计,手术植入程序和术后恢复策略,允许在小鼠从出生后第20天(p20)到出生后第60天(p60)及以后同时从多个大脑区域进行慢性野外和单单元记录,该时间窗口大致对应于人类2岁到成年的年龄。记录电极和最终记录位点的数量可以很容易地修改和扩展,从而允许对发育过程中与行为或疾病相关的大脑区域的 体内 监测进行灵活的实验控制。
引言
在儿童和青少年的关键发育窗口期间,大脑经历了大规模的变化1,2,3。许多神经和精神疾病,包括自闭症和精神分裂症,在青少年大脑发育的这一时期首次在行为和生物学上表现出来4,5,6。虽然人们对早期发育过程中发生的细胞、突触和遗传变化知之甚少,但对电路或网络级过程在整个时间窗口内如何变化知之甚少。重要的是,回路水平的大脑功能,最终是复杂行为,记忆和认知的基础,是细胞和突触功能的不可预测的紧急属性7,8,9,10。因此,为了充分理解网络级的大脑功能,有必要在完整的神经回路水平上直接研究神经活动。此外,为了确定大脑活动在整个神经精神疾病进展过程中如何改变,在疾病的行为表型显现的特定时间窗口期间检查有效疾病模型中的网络活动并跟踪观察到的变化持续到成年期至关重要。
最常见和最强大的科学模式生物之一是小鼠,具有大量独特的遗传菌株,可模拟行为和/或助记表型11,12,13,14,15,16,17,18,19,20,21的年龄依赖性神经发育障碍.虽然将人类和小鼠大脑之间的精确发育时间点相关联具有挑战性,但形态学和行为学比较表明,p20-p21小鼠代表2-3岁的人类年龄,p25-p35小鼠代表11-14岁的人类年龄,小鼠可能达到20岁成年人的发育等效p603,22.因此,为了更好地了解青少年大脑如何发育并确定大脑的神经网络如何在自闭症或精神分裂症等疾病中变得功能失调,理想的做法是直接监测20天至60天龄小鼠体内的大脑活动。
然而,监测小鼠早期发育过程中的大脑活动的一个基本挑战是幼年小鼠的小尺寸和相对虚弱。长期植入电极是大脑发育纵向研究所必需的,通常需要大而笨重的外壳来保护细电极线和接口板23,24,并且植入物必须牢固地附着在小鼠头骨上,由于骨化减少,年轻小鼠的头骨更薄,硬度更低。因此,几乎所有体内啮齿动物生理学研究都是在成年受试者中进行的,因为它们的相对大小、强度和头骨厚度。迄今为止,大多数探索体内幼年啮齿动物大脑生理学的研究都是在野生型幼鼠中进行的,这必然限制了在人类疾病自由行为模型中实验监测幼年大脑功能的能力25,26,27,28,29,30。
本手稿描述了新型植入物外壳、外科植入程序和术后恢复策略,以长期研究幼年小鼠在发育关键时间窗口(p20 至 p60 及以后)的长期(长达 4 周或 更长时间)体内 脑功能。植入程序允许将电极可靠,永久地附着在幼年小鼠的头骨上。此外,微型驱动器设计重量轻,因为该微型驱动器在完全组装时重量为~4-6g,并且由于抵消植入物重量所需的最小平衡,它不会影响幼年小鼠在典型行为范式中的行为表现。
研究方案
本研究已获得德克萨斯大学西南医学中心机构动物护理和使用委员会的批准(协议2015-100867),并符合机构和国家卫生研究院的指导方针。本研究中使用的C57 / Bl6雄性和雌性小鼠以p20(植入时的重量8.3-11.1g)植入。
1. 微驱动设计与施工
- 以数字方式设计和打印微型驱动器(图1)
- 下载微驱动器模型模板 (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive)。
- 在适当的立体定位图谱中识别目标大脑区域的立体定位位置。
- 使用三维计算机辅助设计(3D CAD)软件,加载模板微驱动器套管(图1B)。
- 如有必要,修改微驱动器套管模型上的输出套管输出位置,以针对所需的大脑区域。
注意:每个套管孔挤出应至少 2 毫米长,以确保四极管从套管孔中直接瞄准目标。微驱动套管模板设计用于双侧靶向前扣带皮层(每个半球一个四极)、海马区 CA1(每个半球四个四极管)和海马区 CA3(每个半球两个四极管),每个半球一个参考四极管位于海马区 CA1 上方的白质中。 - 如有必要,修改微驱动器主体(图1A)以适应电子接口板(EIB)的连接。
- 在3D打印机上以高分辨率打印微驱动器主体,套管,锥体和盖子(理想情况下分辨率优于25μm),并根据制造商的协议准备打印材料。使用高刚性的打印机树脂。
- 组装定制螺钉和附件(图 2A、B)
- 使用3D CAD软件,加载螺钉附件模型(图1E)。
- 在3D打印机上以高分辨率打印螺钉附件(理想情况下分辨率至少为25μm),并根据制造商的协议准备打印材料。使用高刚性的打印机树脂。
- 将螺钉附件固定在每个四极加速器推进螺钉上(图1F)(四极加速器推进螺钉是在微驱动器构造之前在机械车间定制制造的)。
- 在每个螺钉上固定两个螺钉附件,一个在脊上方,一个在脊下方。确保每个螺钉附件的底部与脊接触。用凝胶氰基丙烯酸酯将螺钉附件固定在一起。
- 固定后,确保螺钉附件不会在螺钉的纵轴上移动,而是以最小的阻力自由旋转。
- 组装微型驱动器主体(图 2C、D)
- 使用细而锋利的剪刀,将大聚酰亚胺管(外径:0.2921毫米,内径:0.1803毫米)切成~6厘米长的部分。
- 将大的聚酰亚胺部分穿过微驱动套管上的输出孔,使每个管子超出套管底部几毫米。
- 使用干净的 30 G 针头,通过涂抹少量液体氰基丙烯酸酯将聚酰亚胺固定在套管上。注意不要让氰基丙烯酸酯进入聚酰亚胺管内部。
注意: 将液态氰基丙烯酸酯通过驱动体顶部滴入套管可以加快此过程,但稍后需要使用细钻头重新清理导向孔。 - 将大型聚酰亚胺管从微驱动插管的顶部穿过微驱动主体中相应的大聚酰亚胺孔。
- 慢慢地将微驱动器插管和微驱动器主体推到一起,直到它们相邻并且套管/主体附件卡舌互锁。在此过程中注意不要扭结或损坏聚酰亚胺管。
注意:每个聚酰亚胺管应从套管底部平稳地穿过微驱动器主体的顶部。轻微弯曲是正常的,但聚酰亚胺管的过度弯曲会使四极管翘曲并阻止其直接进入大脑。 - 使用氰基丙烯酸酯将微驱动器主体和微型驱动器插管固定在一起。
- 使用新的锋利剃须刀片,切断从套管输出孔底部挤出的大聚酰亚胺管端。确保切口正好在套管的底部,使管子和套管底部彼此齐平。
- 使用锋利的剪刀,以~45°角切割驱动体内缘边缘上方的大聚酰亚胺管。
- 加载组装好的定制螺钉(图2E)
- 将每个组装好的定制螺钉拧入微驱动器主体的外孔中。确保螺钉导轨杆穿过螺钉附件上的大孔。完全推进每个螺钉,直到它不再进一步前进。建议使用矿物油或轴润滑脂对螺钉进行预润滑。
- 使用极其锋利的剪刀,将小聚酰亚胺管(外径:0.1397毫米,内径:0.1016)切成~4厘米长的部分。
- 将小聚酰亚胺部分穿过已安装在微型驱动器中的大型聚酰亚胺管。确保多余的小聚酰亚胺管从每个大聚酰亚胺管的顶部和底部突出。
- 通过氰基丙烯酸酯 将 小聚酰亚胺管固定在螺钉附件上,注意不要让任何氰基丙烯酸酯进入大或小聚酰亚胺管。
- 使用新的锋利剃须刀片,切断从套管孔底部挤出的小聚酰亚胺管端。确保切口正好位于套管的底部,并且切口干净,没有任何东西堵塞聚酰亚胺管孔。
- 使用锋利的剪刀,以~45°角将小聚酰亚胺的顶部以~45°角切开,使其高于螺钉附件顶部几毫米。确保切口干净,没有任何东西堵塞聚酰亚胺管孔。
- 加载四极管
- 使用先前描述的方法制备四极管(~6厘米长)31。
- 使用陶瓷或橡胶尖端的镊子,小心地将四极管穿过一个小聚酰亚胺管,从小聚酰亚胺管的顶部突出~2厘米。
- 通过液态氰基丙烯酸酯 将 四极管固定在小聚酰亚胺管的顶部,注意在此过程中不要将小聚酰亚胺管和大聚酰亚胺管粘在一起。
- 缩回螺钉,直到它靠近驱动器顶部。
- 抓住从驱动器底部突出的四极线,并在它从套管中出现的点轻轻扭结。
- 将螺钉完全推回驱动器。
- 使用非常锋利的剪刀,在扭结上方剪断四极线。在显微镜下,确保切口干净,并且所有四个四极管的金属都暴露在外。
- 缩回螺钉,直到四极管刚好固定在套管内。
- 对所有螺钉重复步骤1.5.2-1.5.8。
- 通过小型珠宝螺钉 将 EIB 连接到 EIB 支持平台。
- 将每个四极管的每个电极连接到EIB上的相应端口。
- 为手术准备微型驱动器
- 使用前面描述的方法31对四极管进行电镀以降低电阻抗。
- 电镀后,确保每个四极管都安置在套管中,使四极管的尖端与每个套管孔的底部齐平。
- 在完成的微型驱动器周围滑动微型驱动器锥体。通过将锥体连接杆滑入盖端口,将微驱动器盖连接到微驱动器锥体。
- 调整锥体的方向,使EIB连接器在盖子关闭时自由通过EIB连接直通孔,并用放置在锥体底部周围的氰基丙烯酸酯将锥体粘合到位,注意不要让任何氰基丙烯酸酯进入任何套管输出孔。取下盖子。
- 用无菌矿物油小心地回填每个套管孔,以防止体液在手术植入后进入聚酰亚胺孔。
- 小心地用无菌凡士林涂在套管的底部。这将作为防止化学试剂(例如牙科水泥)在手术过程中进入暴露的大脑的屏障。
- 称量完全组装好的微型驱动器、盖子和四个骨螺钉,以准备等重的平衡。
- 或者,在手术前,一旦驱动器与颅骨齐平,以适合到达目标大脑区域的距离挤出四极管。
注意:在手术植入之前,通过环氧乙烷气体灭菌(500-1200 mg / L,2-4小时)对植入物进行灭菌。 所有骨螺钉和手术器械应通过高压灭菌器(121°C,30分钟)消毒。
2. 手术植入
- 麻醉鼠标并将其安装在立体定位装置中
- 将小鼠放在具有足够移动空间的小盒子中,并用3%-4%异氟醚麻醉小鼠。
注意:可以使用其他麻醉剂,但由于幼年小鼠受试者的年龄,大小和体重,应谨慎使用。 - 一旦鼠标没有反应(对尾部捏没有反应,通气速率为每分钟~60次呼吸),将其从盒子中取出,并迅速将其安装在立体定位装置上。
- 快速,将立体定位面罩放在小鼠的鼻子上,并将麻醉保持在1-3%异氟醚。在初次手术切口之前,使用任何兽医批准的止痛药,例如缓释丁丙诺啡(0.05-0.5 mg/kg皮下注射)或抗炎药,例如卡洛芬(5-10 mg/kg皮下注射)。
- 使用耳条将鼠标的头部完全固定在立体定位装置中。确保头骨水平且不动,而不会对小鼠的耳道施加不必要的压力。由于幼年颅骨骨化有限,在头部固定过程中可能会造成永久性损伤。
- 将小鼠放在具有足够移动空间的小盒子中,并用3%-4%异氟醚麻醉小鼠。
- 准备小鼠手术并暴露头骨
- 通过在每只眼睛上放置少量合成泪液并用高压灭菌的箔片覆盖每只眼睛来保护小鼠的眼睛。
注意:合成泪液将保持眼睛湿润,而铝箔将防止任何光源造成长期伤害。较厚的合成泪液是优选的,因为它们也可以作为无意中将其他潜在有毒的手术溶液(乙醇,牙科丙烯酸等)引入眼睛的屏障。 - 使用无菌棉签,在手术区域涂抹脱毛霜,以去除头皮上的毛发。注意不要将乳霜靠近眼睛。去除毛发后,在头皮上放置无菌窗帘以固定手术区域。
- 使用无菌棉签,连续三次洗涤聚维酮碘(10%)溶液,然后洗涤异丙醇(100%) ,清洁 头皮。
- 使用无菌手术刀或细剪刀,去除头皮。
- 使用无菌棉签和盐溶液(0.9%NaCl)和过氧化氢的无菌溶液,彻底清洁头骨。
- 识别前膛,并使用立体定位装置,用永久性标记仔细标记颅骨上的目标记录位置。
- 通过在每只眼睛上放置少量合成泪液并用高压灭菌的箔片覆盖每只眼睛来保护小鼠的眼睛。
- 打开套管孔并连接骨锚
- 移除覆盖记录部位的头骨。# 由于这个年龄头骨较薄,用手术刀刀片切割头骨;这消除了使用钻头的必要性,因为钻头可能会损坏底层硬脑膜。使用无菌盐水溶液(0.9%NaCl)或无菌矿物油保持暴露的硬脑膜湿润。在这个阶段不要移除或刺穿硬脑膜,因为它在幼年小鼠中足够薄,可以让四极肌在以后的步骤中通过。
- 小心地钻四个骨螺钉的导向孔。
- 将骨螺钉放置在颅骨的最外侧和嘴部或尾部,那里的骨头最厚,骨螺钉离微驱动植入物足够远。对于骨螺钉,请使用无菌的高级珠宝螺钉(例如,UNM 120 螺纹,1.5 mm 头部)。
- 在步骤2.4.6中,用细的高导电线紧紧缠绕一个骨螺钉,该导线将用作接地并连接到EIB。
- 使用手术刀刀片或小心地使用钻头,在骨螺钉孔位置附近划伤颅骨。划痕对于在步骤2.3.5中为液态氰基丙烯酸酯提供足够粗糙的表面以结合非常重要。
- 使用无菌螺丝刀和无菌螺丝夹,将每个无菌骨螺钉穿入到位,注意不要刺穿下面的硬脑膜。
- 使用无菌30 G针头,将液态氰基丙烯酸酯放在每个骨螺钉周围。这有效地增厚了连接骨螺钉的颅骨。注意不要让任何氰基丙烯酸酯进入记录点上方暴露的硬脑膜。
- 降低并连接微型驱动器(图2G)
- 将完成的微型驱动器安装到立体定位装置上,小心地降低到小鼠头骨上。确保微驱动器插管在降低时将处于适当的坐标。
- 缓慢降低微型驱动器,仅在背侧/腹侧方向移动。降低微型驱动器,四极管已经从套管孔中推进(步骤1.6.6),以可视化它们进入大脑;当四极管接触小鼠时,任何内侧/外侧或嘴部/尾部运动都会弯曲四极管并导致它们错过最终目的地。
- 一旦微型驱动器完全降低,确保套管的底部刚好与头骨/硬脑膜接触。凡士林和/或矿物油层将作为覆盖暴露的硬脑膜的屏障。如有必要,添加无菌凡士林或无菌骨蜡以覆盖多余的暴露硬膜。
- 在使用立体定位装置将微驱动器固定到位的同时,将头骨涂在牙科水泥中,以将微型驱动器底座固定在植入的骨螺钉上。
注意:牙科水泥应完全包裹所有骨螺钉,并应覆盖微型驱动插管上的牙科水泥锚架。 - 在牙科水泥凝固时,请仔细塑造其形状,以防止尖角或边缘可能损坏鼠标或损坏微型驱动器。确保有足够的牙科水泥来固定微型驱动器,但要消除过多的牙科水泥,否则会增加不必要的重量。
- 小心地将地线穿过微型驱动器,并将其连接到 EIB 上的相应插槽。
- 牙科水泥完全凝固后,小心地将微型驱动器与立体定位装置分离。将盖子放在微型驱动器上。
- 用无菌棉签和无菌盐水清洁小鼠。
- 用无菌棉签,在植入部位附近的任何暴露的头皮上涂抹一层薄薄的抗生素软膏。
- 取下鼠标眼睛上的箔纸。
- 将鼠标从立体定位装置中取出,在将鼠标运送到干净的笼子时,注意支撑微型驱动器的额外重量。
3. 术后恢复
- 立即恢复
- 手术前,通过连接直径为0.75英寸的PVC管来准备平衡系统,如图 2G所示。系统的一个臂穿过在笼子盖上钻孔,第二个臂放在笼盖的顶部,第三个臂延伸到笼子的上方和之外。最上面的手臂是盖子的。
- 小心地将微型驱动器连接到平衡系统(图2G-I),并使用与微型驱动器和骨螺钉重量相同的平衡重。从连接到EIB的连接器到平衡系统的三个臂上的平衡重,将坚固的螺纹或钓鱼线连接到悬挂在最顶部臂上的平衡重。
- 确保平衡与微型驱动器EIB牢固连接,并且有足够的线路使鼠标能够完全进入整个笼子。
- 在笼子中提供营养丰富的凝胶以及湿润的正常啮齿动物食物,以确保补液和恢复。
- 监测小鼠,直到它从手术麻醉中完全恢复。
- 长期恢复
- 在任何时候,当未连接到记录设备时,请确保微型驱动器由平衡系统支撑。随着时间的推移减少配重,但切勿完全将其卸下,以避免对鼠标造成意外压力或对骨螺钉产生扭矩。
- 为了防止损坏植入物和平衡系统,在实验期间容纳小鼠,而不可能与其他小鼠直接相互作用。
- 手术后至少 3 天提供营养丰富的凝胶,此时仅靠固体食物就足够了。
- 由于平衡系统的架空要求,请勿在架空金属丝网中提供食物和水;将食物放在笼子地板上,并通过笼子的侧面提供水。为防止变质,请每天完全更换食物。
- 每天,确保鼠标可以自由进入整个笼子,并且平衡牢固地牢固地连接到微型驱动器上。
结果
上述方案用于在小鼠中同时记录来自多个大脑区域的局部场电位信号和单个单元,每天在同一只小鼠中进行p20至p60的记录。这里报道的是来自两只小鼠的代表性电生理记录和实验后组织学,证明了最终记录位置。
将微驱动器手术植入p20小鼠
如上所述,构建微型驱动器(图1)并手术植入p20小鼠(图2)。手术后,立即将鼠标连接到平衡系统(图2G-I)并使其恢复。一旦鼠标完全移动,微型驱动器就入体内电生理学记录系统。将微型驱动器连接到记录设备的电缆悬挂在鼠标上方。在所有通道上获得电生理记录(32kHz)1小时,同时小鼠在其家笼中自然表现。记录后,将鼠标从记录系统上拔下,重新连接到平衡系统,然后返回动物园,自由获取水和食物。
每日记录神经活动
连续数周每天进行电生理记录,以便在p20-p60的关键发育窗口中对同一大脑区域进行长期监测。来自慢性记录的原始局部场电位(LFP)如图 3A,C所示。从多个四极管同时获得分离的单个单元(图3B)。在多天内识别出具有相似波形的单元(图3B,中间和右侧),但由于记录电极的潜在漂移,无法明确声称在几天内识别出相同的单元。在植入p20并每天记录数周的单独小鼠中,在靶向背侧CA1区域的四极管上检查神经活动。在记录的每一天都发现了大幅度波纹和隔离良好的单个单元(图4)。这些数据表明,稳定、高质量的 体内 电生理记录可能来自同一只小鼠的早期发育过程。
记录部位的组织学确认和慢性植入对发育的影响
在最后的记录日之后,通过异氟烷麻醉彻底麻醉小鼠,然后注射戊巴比妥钠,并将电流通过电极尖端以在记录部位产生小病变。小鼠大脑的实验后组织学切片允许最终记录位点的可视化(图5A,B)。在一个单独的队列中,如上所述,在p20处手术植入三只雄性和三只雌性小鼠。相同数量的同窝伴侣未被植入并保持在相同的住房条件下。在p62处死小鼠(植入队列手术后6周)。仔细清洁头骨,并对前膛到λ的距离(图5C,左上)和λ处的外部最大头骨宽度(图5C,右上)进行了外部测量。沿着颅骨中线做一个切口,并切除头骨的一半以切除大脑以进行质量测量(图5C,右下角)。从完整的头骨一半测量前膛颅腔的高度(图5C,左下角)。植入和未植入队列之间没有显着差异(Wilcoxon秩和检验),表明从p20开始的长期植入对颅骨或脑容量的自然发育没有重大影响。

图 1:微驱动器组件。 (A) 微型驱动器主体、(B) 套管、(C) 锥体、(D) 盖子、(E) 螺钉附件和 (F) 四极推进螺钉的三维效果图。标明了每个组件的关键特征。可以从 https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/ 提供的模型文件中提取测量详细信息。 请点击此处查看此图的大图。

图 2:微驱动器结构 。 (A) 连接顶部和底部螺钉附件的四极管推进螺钉的侧视图和 (B) 顶视图。(C) 微型驱动器的侧视图和 (D) 顶视图,连接主体和套管,大型聚酰亚胺管穿过每个套管孔并修剪到套管底部。(E) 微型驱动器的侧视图,螺钉和小聚酰亚胺管就位。小型聚酰亚胺管的顶部在四极管加载前立即修剪。(F)完成的微型驱动器连接到立体定位装置。通常围绕微型驱动器的保护锥已被移除,以便进行可视化。请注意,此微型驱动器的某些螺钉附件是用黑色树脂打印的。(七)制衡保障系统。(八)附有平衡支撑系统的鼠笼的侧视图和 (I) 顶视图。 请点击此处查看此图的大图。
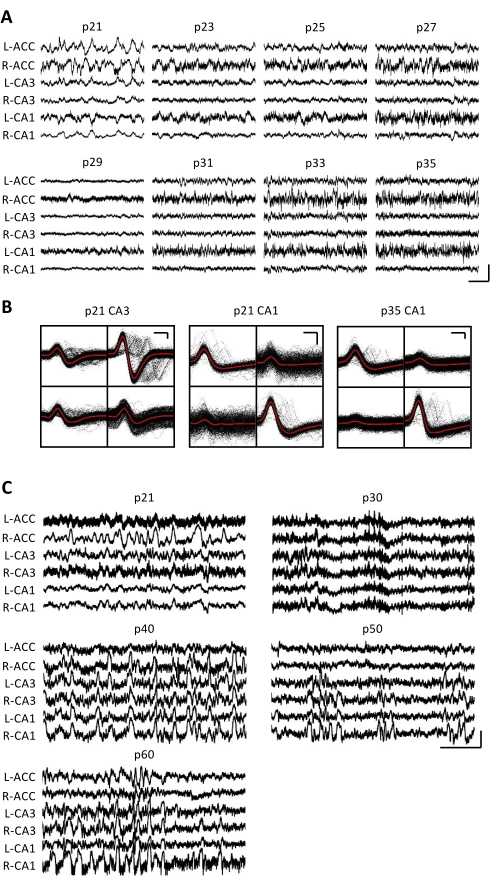
图3:代表性电生理记录。 如上所述,p20小鼠被植入微型驱动器。从p21开始,此后每天2周,将小鼠连接到记录装置上,并记录神经活动至少1小时。 (A)来自双侧的原始局部场电位(LFP)记录(L = 左;R = 右)前扣带皮层 (ACC)、海马区 CA3 (CA3) 和海马区 CA1 (CA1)。每天都在收集数据;为清楚起见,仅显示奇数天的数据。所有痕迹都是在家笼不动期间采集的。比例尺:1 mV,2 s.(B)从海马区CA3(左)和CA1(右)分离的代表性单个单元,用于图 A中的记录。每个电极上的所有原始波形都以黑色显示;平均值为红色。比例尺:50 μV,0.2 ms。 (C) 每 10 天进行一次代表性原始 LFP 迹线,直到在 p60 处植入的第二只小鼠的最终记录日。每天都在收集数据;为清楚起见,仅显示每 10 天的数据。所有的痕迹都是在家笼不动期间采集的。比例尺:1 mV,2 s。 请点击此处查看此图的大图。
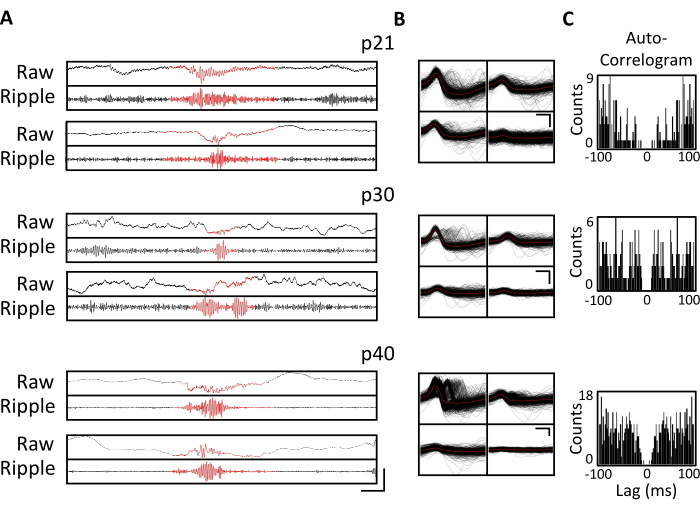
图4.慢性记录的稳定性。 如上所述,p20小鼠被植入微型驱动器。从p21开始,此后4周,将小鼠连接到记录装置上,并记录神经活动至少1小时。显示的是针对背侧海马CA1的四极管的数据。(A) 原始(顶部)和纹波滤波(底部)LFP,用于在 p21、p30 和 p40 处识别纹波事件。为了识别纹波事件,对原始LFP进行了125 Hz至300 Hz之间的带通滤波,并将纹波事件确定为纹波带功率的瞬态增加大于平均值3个标准差。每个纹波的开始和结束被定义为纹波带功率恢复到平均值的点。识别出的涟漪以红色显示。比例尺:100 ms,从上到下:1,000 μV、140 μV、1,800 μV、180 μV、9,000 μV、1,200 μV、10,000 μV、1,000 μV。 (B) 每天来自 CA1 靶向四极管的代表性单个单元,用于面板 A 中的记录。每个电极上的所有原始波形都以黑色显示;平均值为红色。比例尺 0.2 ms,从上到下:50 μV、100 μV、100 μV。 (C) 面板 B 中单个单元的所有尖峰的自相关图。这些数据表明,电极在海马锥体层内放置稳定数周。 请点击此处查看此图的大图。

图5:代表性组织学和对颅骨发育的影响。 如上所述,p20小鼠被植入微型驱动器。在p60上最后的记录日之后,在记录部位产生电解病变,并用4%的多聚甲醛灌注大脑。为了识别记录位点,制作了50μm切片。(A)海马体CA1和CA3的病变。箭头表示 CA3 记录位点;双箭头表示 CA1 记录位点。比例尺:0.5毫米。 (B)双侧ACC病变。箭头表示 ACC 记录站点。比例尺:0.5毫米。 (C)p62小鼠的头骨大小和脑质量测量,p62小鼠植入p20(灰色)和未植入的同窝动物(白色)。对于每个测量值,将报告威尔科克森秩和检验的 p 值。 请点击此处查看此图的大图。
讨论
探索啮齿动物 体内 神经回路功能的现代实验通常通过永久植入的电极 利用 细胞外电生理学来监测单个神经元(即单个单位)或局部种群(通过 局部场电位,LFP)的活动,但由于技术挑战,这种方法很少应用于幼年小鼠。本手稿描述了一种在p20至p60及以后的发育关键窗口 内获得小鼠 体内电生理记录的方法。该方法涉及用于打印和构建微驱动植入物的制造工艺、外科植入程序和术后恢复策略,所有这些都是专门为幼年小鼠量身定制的。在该协议的开发中有几个考虑因素有影响,包括与成年小鼠相比,幼年小鼠的体积小且相对薄弱,以及需要连接微驱动器的幼年小鼠头骨的骨化减少。
通常用于 进行体内 电生理学的两种主要方法是电极阵列(例如四极管)和硅探针。硅探针重量轻,每单位重量可以提供大量的记录位点,并且以前已在幼鼠中使用25。然而,硅探针的单位价格相对昂贵。相比之下,本手稿中描述的微型驱动器可以使用不到 50 美元的原材料构建,使其成为 体内 记录的一种经济高效的选择。此外,硅探针必须经常植入固定线路中,这禁止记录空间不同的大脑区域。相比之下,本手稿中描述的微型驱动器设计利用可独立调节的四极管来适应多达 16 个不同位置的同时录制,对这些位置之间的空间关系几乎没有限制。这种微驱动器设计可以很容易地修改,通过将套管孔挤压移动到任何所需的前/后和内侧/远端位置,允许针对与此处描述的位置不同的位置。当瞄准不同的大脑区域时,重要的是要注意,虽然四极管通常会直线移动,但这些细线在离开微驱动套管时可能会略微偏转。因此,大脑区域的腹侧越小或越大,成功靶向四极管区域的挑战就越大。
本手稿中描述的微驱动器植入物与先前几种基于四极管的微驱动器设计23,32,33,34,35基本相似,因为单个四极管固定在螺钉上,可以精细控制每个四极管的记录深度。虽然当前微驱动器设计的几个功能是独一无二的,包括易于针对空间分布的大脑区域,但当前手稿的主要新颖之处在于描述了手术植入和术后恢复策略,这允许对仍在发育的幼年小鼠的网络活动进行长期研究。事实上,这里描述的手术和恢复方法可以适用于支持幼年小鼠的其他植入物。
为了在多天内保持一致的记录,电线或探头必须牢固地固定在头骨上。虽然小鼠头骨的整体结构在p20之后只经历了微小的变化,但在p20和p4536之间,头骨明显变厚。事实上,p20处的头骨刚性不足,无法支撑附着的植入物而不会损坏。为了克服这种生物学限制,该方案在植入手术期间通过氰基丙烯酸酯 人为 地增厚颅骨。使用这种策略可能植入小于p20的小鼠中,但是小鼠头骨经历了相当大的大小和形状变化,直到大约p2036。因此,不建议在小于p20的小鼠中长时间植入,因为仍在发育的颅骨中的氰基丙烯酸酯和固定骨螺钉可能会显着影响颅骨的自然生长和潜在的脑组织发育。重要的是,在这项研究中,从p20开始的慢性植入后,没有观察到对颅骨或大脑大小的总体测量值的影响(图5C)。
本手稿中描述的方法中的一个关键步骤是术后恢复策略;根据这种策略,随着小鼠的成熟和肌肉和肌肉骨骼系统的发育,植入物的重量应该不断平衡。植入后早期,小鼠在没有平衡的情况下无法成功承受植入物的重量,导致营养不良和脱水,因为小鼠无法充分到达笼子中的食物和水源。平衡系统易于构建且成本低廉,实施起来很简单,并且允许任何植入年龄的小鼠自由探索整个家笼,从而确保足够的营养和水合作用。随着小鼠年龄的增长,平衡量可以减少,直到可以在成年小鼠中完全去除;但是,建议在实验期间继续使用平衡系统,并始终至少连接一个标称配重。虽然成年小鼠可能能够随着时间的推移承受微型驱动器的大小和重量,但在自由行为期间持续的自然运动,没有改善配重,会在将微型驱动器固定在头骨上的骨螺钉上产生扭矩和剪切力,使其越来越容易脱落,尤其是在较长的慢性实验中。
对于目前的研究来说,有两个重要的局限性值得注意。首先,为了评估p20植入对颅骨和大脑发育的影响,在长时间植入后处死了几组小鼠(图5C)。虽然这些分析显示植入对颅腔大小或脑质量没有显着影响(图5C),但目前的研究没有检查p20-p60早期发育期间多个时间点的颅骨大小或脑质量。虽然先前的工作表明,脑腔的发育在p2036之前完成,但在这个早期窗口植入可能会产生意想不到的变化,这些变化被这里评估的成年人纠正或补偿。其次,产生图3和图4所示电生理数据的实验并非旨在最大限度地提高细胞产量。因此,虽然此处提供的数据显示了稳定、慢性记录和良好隔离的单个单元,但它们不应被视为该设备最大潜在产量的代表。
许多人类神经和精神疾病表现在早期发育期间或青春期,包括自闭症和精神分裂症。然而,尽管有大量的小鼠模型可用,但对可能导致这些疾病的回路水平功能障碍知之甚少。识别这些初始网络变化对于创建早期检测策略和治疗范式至关重要。然而,由于技术挑战,目前尚不清楚网络功能如何在神经精神疾病小鼠模型的开发过程中被破坏。这里描述的微驱动和恢复策略旨在支持对小鼠大脑中多区域大脑网络发育的研究,从而使研究人员能够测量健康的大脑发育,并确定小鼠疾病模型中该发育的改变。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了美国国立卫生研究院R01 NS104829(B.E.P.),R01 MH117149(L.J.V.)和F99NS12053(L.D.Q.)以及UT西南GSO捐赠奖(R.J.P.和L.D.Q.)的支持。作者感谢Jenny Scaria(德克萨斯理工大学健康科学中心药学院)的技术援助和Brendon Watson博士(密歇根大学)的方法建议。
材料
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
参考文献
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。