Method Article
Implant d’entraînement léger pour enregistrements de tétrodes chroniques chez des souris juvéniles
Dans cet article
Résumé
Ici, nous décrivons une conception de micro-entraînement, une procédure d’implantation chirurgicale et une stratégie de récupération post-chirurgicale qui permettent des enregistrements chroniques sur le terrain et à une seule unité de plusieurs régions du cerveau simultanément chez des souris juvéniles et adolescentes à travers une fenêtre de développement critique du jour postnatal 20 (p20) au jour postnatal 60 (p60) et au-delà.
Résumé
L’électrophysiologie in vivo fournit un aperçu inégalé de la dynamique des circuits de sous-seconde du cerveau intact et représente une méthode d’une importance particulière pour l’étude de modèles murins de troubles neuropsychiatriques humains. Cependant, de telles méthodes nécessitent souvent de grands implants crâniens, qui ne peuvent pas être utilisés chez la souris au début du développement. En tant que tel, pratiquement aucune étude de physiologie in vivo n’a été réalisée sur des souris nourrissons ou juvéniles se comportant librement, malgré le fait qu’une meilleure compréhension du développement neurologique dans cette fenêtre critique fournirait probablement des informations uniques sur les troubles du développement liés à l’âge tels que l’autisme ou la schizophrénie. Ici, une conception de micro-entraînement, une procédure d’implantation chirurgicale et une stratégie de récupération post-chirurgicale sont décrites qui permettent des enregistrements chroniques sur le terrain et à une seule unité de plusieurs régions du cerveau simultanément chez les souris à mesure qu’elles vieillissent du jour postnatal 20 (p20) au jour postnatal 60 (p60) et au-delà, une fenêtre temporelle correspondant à peu près à l’âge humain de 2 ans à l’âge adulte. Le nombre d’électrodes d’enregistrement et de sites d’enregistrement finaux peut être facilement modifié et étendu, permettant ainsi un contrôle expérimental flexible de la surveillance in vivo des régions cérébrales pertinentes pour le comportement ou la maladie tout au long du développement.
Introduction
Le cerveau subit des changements à grande échelle au cours des fenêtres de développement critiques de l’enfance et de l’adolescence 1,2,3. De nombreuses maladies neurologiques et psychiatriques, y compris l’autisme et la schizophrénie, se manifestent d’abord comportementalement et biologiquement au cours de cette période de développement du cerveau juvénile et adolescent 4,5,6. Bien que l’on en sache beaucoup sur les changements cellulaires, synaptiques et génétiques qui se produisent au début du développement, on en sait relativement peu sur la façon dont les processus au niveau du circuit ou du réseau changent tout au long de cette fenêtre temporelle. Il est important de noter que la fonction cérébrale au niveau du circuit, qui sous-tend finalement les comportements complexes, la mémoire et la cognition, est une propriété émergente non prévisible de la fonction cellulaire et synaptique 7,8,9,10. Ainsi, pour bien comprendre le fonctionnement cérébral au niveau du réseau, il est nécessaire d’étudier directement l’activité neuronale au niveau d’un circuit neuronal intact. En outre, pour identifier comment l’activité cérébrale est modifiée tout au long de la progression des troubles neuropsychiatriques, il est essentiel d’examiner l’activité du réseau dans un modèle de maladie valide pendant la fenêtre temporelle spécifique lorsque les phénotypes comportementaux de la maladie se manifestent et de suivre les changements observés à mesure qu’ils persistent à l’âge adulte.
L’un des organismes modèles scientifiques les plus courants et les plus puissants est la souris, avec un grand nombre de souches génétiques uniques qui modélisent les troubles neurodéveloppementaux avec l’apparition en fonction de l’âge des phénotypes comportementaux et / ou mnémoniques 11,12,13,14,15,16,17,18,19,20,21 . Bien qu’il soit difficile de corréler des points de temps de développement précis entre les cerveaux des humains et des souris, les comparaisons morphologiques et comportementales indiquent que les souris p20-p21 représentent les âges humains de 2-3 ans, et les souris p25-p35 représentent les âges humains de 11-14 ans, les souris atteignant probablement l’équivalent de développement d’un adulte humain de 20 ans par p603, 22. Ainsi, pour mieux comprendre comment le cerveau juvénile se développe et identifier comment les réseaux neuronaux du cerveau deviennent dysfonctionnels dans des maladies comme l’autisme ou la schizophrénie, il serait idéal de surveiller directement l’activité cérébrale in vivo chez des souris âgées de 20 jours à 60 jours.
Cependant, un défi fondamental dans la surveillance de l’activité cérébrale tout au long du développement précoce chez la souris est la petite taille et la faiblesse relative des souris juvéniles. L’implantation chronique d’électrodes, qui est nécessaire pour les études longitudinales du développement du cerveau, nécessite généralement un boîtier volumineux et encombrant pour protéger les fils d’électrodes fins et les cartes d’interface23,24, et les implants doivent être fermement attachés au crâne de souris, qui est plus mince et moins rigide chez les jeunes souris en raison de l’ossification réduite. Ainsi, pratiquement toutes les études sur la physiologie in vivo des rongeurs ont été réalisées chez des sujets adultes en raison de leur taille relative, de leur force et de l’épaisseur du crâne. À ce jour, la plupart des études explorant la physiologie in vivo du cerveau des rongeurs juvéniles ont été réalisées sur des rats juvéniles de type sauvage, ce qui limite nécessairement la capacité de surveiller expérimentalement la fonction cérébrale juvénile dans un modèle de comportement libre d’un trouble humain 25,26,27,28,29,30.
Ce manuscrit décrit un nouveau boîtier implantaire, une procédure d’implantation chirurgicale et une stratégie de récupération post-chirurgicale pour étudier de manière chronique la fonction cérébrale in vivo à long terme (jusqu’à 4 semaines ou plus) de souris juvéniles sur une fenêtre temporelle critique pour le développement (p20 à p60 et au-delà). La procédure d’implantation permet l’apposition fiable et permanente des électrodes sur le crâne de souris juvéniles. De plus, la conception du micro-entraînement est légère, car ce micro-entraînement pèse ~ 4-6 g lorsqu’il est complètement assemblé, et en raison du contrepoids minimal requis pour compenser le poids de l’implant, il n’a pas d’impact sur les performances comportementales des souris juvéniles au cours des paradigmes comportementaux typiques.
Protocole
La présente étude a été approuvée par le comité institutionnel de soin et d’utilisation des animaux du Southwestern Medical Center de l’Université du Texas (protocole 2015-100867) et réalisée conformément aux directives institutionnelles et du National Institute of Health. Les souris mâles et femelles C57/Bl6 utilisées dans la présente étude ont été implantées à p20 (poids 8,3-11,1 g au moment de l’implantation).
1. Conception et construction de micro-entraînements
- Conception et impression numériques du micro-entraînement (Figure 1)
- Téléchargez les modèles de modèles de micro-entraînements (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- Identifier les emplacements stéréotaxiques de la ou des régions cérébrales cibles dans un atlas stéréotaxique approprié.
- À l’aide d’un logiciel de conception assistée par ordinateur (CAO 3D) en trois dimensions, chargez la canule du micro-entraînement modèle (Figure 1B).
- Si nécessaire, modifiez les emplacements de sortie des canules sur le modèle de canule micro-entraînement pour cibler la ou les régions cérébrales souhaitées.
NOTE: Chaque extrusion de trou de canule doit avoir une longueur d’au moins 2 mm pour s’assurer que la tétrode sortira du trou de la canule visant directement la cible. Le modèle de canule micro-entraînement est conçu pour cibler bilatéralement le cortex cingulaire antérieur (une tétrode par hémisphère), la zone hippocampique CA1 (quatre tétrodes par hémisphère) et la zone hippocampique CA3 (deux tétrodes par hémisphère), avec une tétrode de référence par hémisphère positionnée dans la substance blanche au-dessus de la zone de l’hippocampe CA1. - Si nécessaire, modifier le corps du micro-entraînement (Figure 1A) pour l’adapter à la fixation de la carte d’interface électronique (BEI).
- Imprimez le corps du micro-entraînement, la canule, le cône et le couvercle à haute résolution sur une imprimante 3D (idéalement avec une résolution supérieure à 25 μm) et préparez les documents imprimés conformément aux protocoles du fabricant. Utilisez des résines d’imprimante à haute rigidité.
- Assemblage des vis et accessoires personnalisés (Figure 2A, B)
- À l’aide d’un logiciel de CAO 3D, chargez les modèles de fixation à vis (Figure 1E).
- Imprimez les accessoires à vis en haute résolution sur une imprimante 3D (idéalement avec une résolution d’au moins 25 μm) et préparez les documents imprimés selon les protocoles du fabricant. Utilisez des résines d’imprimante à haute rigidité.
- Fixez les attaches de vis à chaque vis d’avancement de tétrode (figure 1F) (les vis d’avancement de tétrode sont fabriquées sur mesure dans un atelier d’usinage avant la construction du microentraînement).
- Fixez deux fixations à vis sur chaque vis, l’une au-dessus et l’autre au-dessous de la crête. Assurez-vous que le bas de chaque fixation de vis entre en contact avec la crête. Tenez les attaches à vis ensemble avec du cyanoacrylate de gel.
- Une fois fixées, assurez-vous que les attaches à vis ne bougent pas dans l’axe longitudinal de la vis mais tournent librement avec une résistance minimale.
- Assemblage du corps du micro-entraînement (Figure 2C, D)
- À l’aide de ciseaux fins et tranchants, couper les grands tubes en polyimide (diamètre extérieur: 0,2921 mm, diamètre intérieur: 0,1803 mm) en sections de ~6 cm de long.
- Passez les grandes sections de polyimide à travers les trous de sortie de la canule micro-entraînement de sorte que chaque tube s’étende de quelques millimètres au-delà du fond de la canule.
- À l’aide d’une aiguille propre de 30 G, fixer le polyimide à la canule en appliquant de petites quantités de cyanoacrylate liquide. Veillez à ne pas laisser le cyanoacrylate pénétrer à l’intérieur du tube en polyimide.
REMARQUE: L’égouttement de cyanoacrylate liquide dans la canule par le haut du corps d’entraînement peut accélérer ce processus, mais nécessitera un nouveau dégagement des trous de guidage plus tard avec une perceuse à pointe fine. - Passez les grands tubes en polyimide du haut de la canule du micro-entraînement à travers les grands trous de polyimide appropriés dans le corps du micro-entraînement.
- Poussez lentement la canule du micro-entraînement et le corps du micro-entraînement ensemble jusqu’à ce qu’ils soient adjacents et que les languettes de fixation de la canule/du corps s’emboîtent. Veillez à ne pas plier ou endommager les tubes en polyimide dans le processus.
REMARQUE: Chaque tube en polyimide doit passer en douceur du bas de la canule vers le haut du corps du micro-entraînement. Une légère flexion est normale, mais une flexion excessive du tube en polyimide peut déformer la tétrode et l’empêcher de passer directement dans le cerveau. - Fixez ensemble le corps du micro-entraînement et la canule du micro-entraînement à l’aide de cyanoacrylate.
- À l’aide d’une nouvelle lame de rasoir tranchante, coupez les grandes extrémités du tube en polyimide qui extrudent du fond des trous de sortie de la canule. Assurez-vous que la coupe est exactement à la base de la canule, en faisant affleurer les tubes et le fond de la canule l’un avec l’autre.
- À l’aide de ciseaux tranchants, coupez le grand tube en polyimide juste au-dessus du bord du bord intérieur du corps d’entraînement à un angle de ~45°.
- Chargement des vis personnalisées assemblées (Figure 2E)
- Vissez chaque vis personnalisée assemblée dans les trous extérieurs du corps du micro-entraînement. Assurez-vous que le poteau de guidage à vis passe à travers le grand trou dans les attaches à vis. Faites avancer chaque vis complètement jusqu’à ce qu’elle n’avance plus loin. Il est recommandé de prélubrifier les vis avec de l’huile minérale ou de la graisse d’essieu.
- À l’aide de ciseaux extrêmement tranchants, coupez de petits tubes en polyimide (diamètre extérieur: 0,1397 mm, diamètre intérieur: 0,1016) en sections de ~4 cm de long.
- Passez les petites sections de polyimide à travers le grand tube en polyimide déjà monté dans le micro-entraînement. Assurez-vous que l’excès de petits tubes en polyimide dépasse du haut et du bas de chaque grand tube en polyimide.
- Fixez les petits tubes en polyimide aux attaches à vis via du cyanoacrylate, en prenant soin de ne laisser aucun cyanoacrylate pénétrer dans les grands ou les petits tubes en polyimide.
- À l’aide d’une nouvelle lame de rasoir tranchante, coupez les petites extrémités du tube en polyimide qui extrudent du fond des trous de canule. Assurez-vous que la coupe est exactement à la base de la canule et que la coupe est propre, sans que rien ne bloque le trou du tube en polyimide.
- À l’aide de ciseaux tranchants, coupez le haut du petit polyimide à quelques millimètres au-dessus du haut de la fixation de vis à un angle de ~45°. Assurez-vous que la coupe est propre, sans que rien ne bloque le trou du tube en polyimide.
- Chargement des tétrodes
- Préparer les tétrodes (~6 cm de longueur) en utilisant les méthodes décrites précédemment31.
- À l’aide de pinces à embout en céramique ou en caoutchouc, passez soigneusement une tétrode à travers l’un des petits tubes en polyimide, en laissant ~2 cm dépasser du haut du petit tube en polyimide.
- Fixez la tétrode sur le dessus du petit tube en polyimide via du cyanoacrylate liquide, en prenant soin de ne pas fixer les petits et grands tubes en polyimide ensemble dans le processus.
- Rétractez la vis jusqu’à ce qu’elle soit près du haut du lecteur.
- Saisissez le fil tétrode qui dépasse du bas du lecteur et pliez-le doucement à l’endroit où il émerge de la canule.
- Replacez complètement la vis dans le lecteur.
- À l’aide de ciseaux très tranchants, coupez le fil tétrode juste au-dessus du pli. Au microscope, assurez-vous que la coupure est propre et que le métal des quatre tétrodes est exposé.
- Rétractez la vis jusqu’à ce que la tétrode soit juste fixée dans la canule.
- Répétez les étapes 1.5.2 à 1.5.8 pour toutes les vis.
- Fixez la BEI à la plate-forme de soutien de la BEI au moyen de petites vis à bijoux.
- Connectez chaque électrode de chaque tétrode au port approprié de la BEI.
- Préparer le micro-entraînement pour la chirurgie
- Plaquer électriquement les tétrodes pour réduire l’impédance électrique en utilisant les méthodes décrites précédemment31.
- Après le placage, assurez-vous que chaque tétrode est logée dans la canule de telle sorte que l’extrémité de la tétrode affleure le fond de chaque trou de canule.
- Faites glisser le cône du micro-entraînement autour du micro-drive terminé. Fixez le couvercle du micro-entraînement au cône du micro-entraînement en faisant glisser le pôle de fixation du cône dans le port du couvercle.
- Orientez le cône de manière à ce que les connecteurs EIB passent librement à travers les trous de passage de la connexion EIB lorsque le couvercle est fermé, et collez le cône en place avec du cyanoacrylate placé autour de la base du cône, en prenant soin de ne laisser aucun cyanoacrylate pénétrer dans l’un des trous de sortie de la canule. Retirez le couvercle.
- Remplissez soigneusement chaque trou de canule avec de l’huile minérale stérile pour empêcher les fluides corporels de pénétrer dans les trous de polyimide après l’implantation chirurgicale.
- Enduisez soigneusement la base de la canule de vaseline stérile. Cela servira de barrière pour empêcher les agents chimiques (par exemple, le ciment dentaire) de pénétrer dans le cerveau exposé pendant la chirurgie.
- Pesez le micro-entraînement, le couvercle et les quatre vis osseuses entièrement assemblés pour préparer un contrepoids de poids égal.
- En option, avant la chirurgie, extrudez les tétrodes à une distance appropriée pour atteindre les régions cérébrales cibles une fois que le lecteur est au ras du crâne.
REMARQUE: Avant l’implantation chirurgicale, stérilisez l’implant par stérilisation au gaz dans de l’oxyde d’éthylène (500-1200 mg / L, 2-4 heures). Toutes les vis osseuses et les instruments chirurgicaux doivent être stérilisés par autoclave (121°C, 30 minutes).
2. Implantation chirurgicale
- Anesthésier la souris et la monter dans l’appareil stéréotaxique
- Placez la souris dans une petite boîte avec suffisamment d’espace pour bouger et anesthésiez la souris avec 3% -4% d’isoflurane.
REMARQUE: D’autres agents anesthésiques peuvent être utilisés, mais la prudence doit être utilisée en raison de l’âge, de la taille et du poids de la souris juvénile. - Une fois que la souris ne répond pas (pas de réponse au pincement de la queue, un taux de ventilation de ~60 respirations par minute), retirez-la de la boîte et montez-la rapidement sur l’appareil stéréotaxique.
- Rapidement, placez le masque stéréotaxique sur le museau de la souris et maintenez l’anesthésie à 1-3% d’isoflurane. Appliquez tout soulagement de la douleur approuvé par un vétérinaire, tel que la buprénorphine à libération prolongée (0,05-0,5 mg / kg sous-cutané), ou des agents anti-inflammatoires, tels que le carprofène (5-10 mg / kg sous-cutané), avant l’incision chirurgicale initiale.
- Fixez complètement la tête de la souris dans l’appareil stéréotaxique à l’aide de barres d’oreille. Assurez-vous que le crâne est plat et immobile sans exercer de pression inutile sur les conduits auditifs de la souris. En raison de l’ossification limitée des os du crâne juvénile, il est possible de causer des dommages permanents lors de la fixation de la tête.
- Placez la souris dans une petite boîte avec suffisamment d’espace pour bouger et anesthésiez la souris avec 3% -4% d’isoflurane.
- Préparer la souris à la chirurgie et exposer le crâne
- Protégez les yeux de la souris en plaçant un petit volume de gel lacrymal synthétique sur chaque œil et en couvrant chaque œil avec une plaque de papier d’aluminium autoclavée.
REMARQUE: Les larmes synthétiques garderont les yeux humides, tandis que la feuille empêchera toute source de lumière de causer des dommages à long terme. Les solutions de larmes synthétiques plus épaisses sont préférées car elles peuvent également servir de barrière à l’introduction accidentelle d’autres solutions chirurgicales potentiellement toxiques (éthanol, acrylique dentaire, etc.) dans les yeux. - À l’aide d’écouvillons stériles à pointe de coton, appliquez de la crème dépilatoire sur la zone chirurgicale pour enlever les poils du cuir chevelu. Veillez à ne pas mettre la crème près des yeux. Après avoir enlevé les cheveux, placez un champ stérile sur le cuir chevelu pour sécuriser la zone chirurgicale.
- À l’aide d’écouvillons stériles à embout de coton, nettoyer le cuir chevelu en lavant trois lavages consécutifs de solution de povidone iodée (10 %) suivie d’alcool isopropylique (100 %).
- À l’aide d’un scalpel stérile ou de ciseaux fins, retirez le cuir chevelu.
- À l’aide d’écouvillons stériles à pointe de coton et de solutions stériles de solution saline (0,9% de NaCl) et de peroxyde d’hydrogène, nettoyez soigneusement le crâne.
- Identifiez le bregma et, à l’aide de l’appareil stéréotaxique, marquez soigneusement les emplacements d’enregistrement de la cible sur le crâne avec un marqueur permanent.
- Protégez les yeux de la souris en plaçant un petit volume de gel lacrymal synthétique sur chaque œil et en couvrant chaque œil avec une plaque de papier d’aluminium autoclavée.
- Ouverture du trou de la canule et fixation des ancrages osseux
- Retirez le crâne recouvrant les sites d’enregistrement. # En raison de la minceur du crâne à cet âge, coupez le crâne avec une lame de scalpel; Cela élimine la nécessité d’utiliser une perceuse, ce qui peut endommager la dura sous-jacente. Gardez la dure-mère exposée humide avec l’application d’une solution saline stérile (0,9% NaCl) ou d’huile minérale stérile. Ne retirez pas ou ne percez pas la dure-mère à ce stade, car elle est suffisamment mince chez les souris juvéniles pour que les tétrodes puissent passer dans les étapes futures.
- Percez soigneusement les trous pilotes pour quatre vis à os.
- Placez les vis osseuses dans les parties latérales extrêmes et rostrales ou caudales du crâne, là où l’os est le plus épais et les vis osseuses suffisamment éloignées de l’implant micro-entraînement. Pour les vis à os, utilisez des vis stériles pour bijoux fins (p. ex., filetage UNM 120, tête de 1,5 mm).
- Enrouler hermétiquement une vis osseuse avec un fil mince et hautement conducteur qui servira de terre et sera fixé à la BEI à l’étape 2.4.6.
- À l’aide d’une lame de scalpel ou d’un foret avec précaution, marquez le crâne près des emplacements des trous de vis en os. La notation est importante pour fournir une surface suffisamment rugueuse pour que le cyanoacrylate liquide puisse se lier à l’étape 2.3.5.
- À l’aide d’un tournevis stérile et d’une pince à vis stérile, enfilez chaque vis à os stérile en place, en prenant soin de ne pas percer la dure-mère sous-jacente.
- À l’aide d’une aiguille stérile de 30 G, placer du cyanoacrylate liquide autour de chaque vis osseuse. Cela épaissit efficacement le crâne où les vis osseuses ont été fixées. Veillez à ne laisser aucun cyanoacrylate pénétrer dans la dure-mère exposée au-dessus des sites d’enregistrement.
- Abaissement et fixation du micro-entraînement (Figure 2G)
- Montez le micro-entraînement terminé sur l’appareil stéréotaxique pour être soigneusement abaissé sur le crâne de la souris. Assurez-vous que la canule du micro-entraînement sera aux coordonnées appropriées lorsqu’elle sera abaissée.
- Abaissez lentement le micro-entraînement, en ne vous déplaçant que dans la direction dorsale / ventrale. Abaisser le micro-entraînement avec les tétrodes déjà avancées hors des trous de canule (étape 1.6.6) afin de visualiser leur entrée dans le cerveau; Tout mouvement médian / latéral ou rostral / caudale lorsque les tétrodes touchent la souris peut plier les tétrodes et leur faire manquer leur destination finale.
- Une fois le micro-entraînement complètement abaissé, assurez-vous que la base de la canule entre en contact avec le crâne / la dure-mère. La couche de vaseline et/ou d’huile minérale servira de barrière pour couvrir la dure-mère exposée. Si nécessaire, ajoutez de la vaseline stérile ou de la cire d’os stérile pour couvrir l’excès de dure-mère exposée.
- Tout en maintenant le micro-entraînement en place avec l’appareil stéréotaxique, enduisez le crâne de ciment dentaire pour fixer la base du micro-entraînement aux vis osseuses implantées.
REMARQUE: Le ciment dentaire doit envelopper entièrement toutes les vis osseuses et doit couvrir le rebord d’ancrage du ciment dentaire sur la canule du micro-entraînement. - Pendant que le ciment dentaire durcit, façonnez-le soigneusement pour éviter les angles vifs ou les bords qui pourraient endommager la souris ou endommager le micro-entraînement. Assurez-vous qu’il y a suffisamment de ciment dentaire pour maintenir le micro-entraînement, mais éliminez l’excès de ciment dentaire qui ajoutera un poids inutile.
- Enfilez soigneusement le fil de terre à travers le micro-entraînement et fixez-le à la fente appropriée de la BEI.
- Une fois que le ciment dentaire est complètement pris, détachez soigneusement le micro-entraînement de l’appareil stéréotaxique. Placez le couvercle sur le micro-entraînement.
- Avec un écouvillon stérile à pointe de coton et une solution saline stérile, nettoyez la souris.
- Avec un écouvillon stérile à pointe de coton, appliquez une fine couche de pommade antibiotique sur tout cuir chevelu exposé près du site de l’implant.
- Retirez la feuille d’aluminium des yeux de la souris.
- Retirez la souris de l’appareil stéréotaxique en prenant soin de supporter le poids supplémentaire du micro-entraînement pendant que la souris est transportée dans une cage propre.
3. Récupération post-opératoire
- Récupération immédiate
- Avant la chirurgie, préparez le système de contrepoids en raccordant un tuyau en PVC de 0,75 de diamètre, comme illustré à la figure 2G. Un bras du système passe à travers des trous percés dans le couvercle de la cage, le deuxième bras repose sur le couvercle de la cage et le troisième bras s’étend au-dessus et au-delà de la cage. Le bras le plus haut est coiffé.
- Fixez délicatement le microentraînement au système de contrepoids (Figure 2G-I) et utilisez un poids de contrepoids identique au poids du microentraînement et des vis osseuses. Faites passer un fil solide ou une ligne de pêche à partir d’un connecteur fixé à la BEI sur les trois bras du système de contrepoids jusqu’au poids de contrepoids, qui pend au-dessus du bras supérieur.
- Assurez-vous que le contrepoids est fortement connecté au micro-entraînement EIB et qu’il y a suffisamment de ligne pour donner à la souris un accès complet à l’intégralité du boîtier.
- Fournir un gel riche en nutriments dans la cage aux côtés d’un chow de rongeur normal humidifié pour assurer la réhydratation et la récupération.
- Surveillez la souris jusqu’à ce qu’elle se rétablisse complètement de l’anesthésie chirurgicale.
- Reprise à long terme
- À tout moment, lorsqu’il n’est pas fixé à l’appareil de contrôle, assurez-vous que le micro-entraînement est pris en charge par le système de contrepoids. Réduisez le contrepoids au fil du temps, mais ne le retirez jamais complètement pour éviter un stress imprévu à la souris ou un couple aux vis osseuses.
- Pour éviter d’endommager l’implant et le système de contrepoids, logez la souris sans possibilité d’interaction directe avec d’autres souris pendant toute la durée de l’expérience.
- Fournir un gel riche en nutriments pendant au moins 3 jours après la chirurgie, après quoi les aliments solides seuls seront suffisants.
- En raison des exigences en matière de frais généraux du système de contrepoids, ne fournissez pas de nourriture et d’eau dans un treillis métallique aérien; Placez la nourriture sur le sol de la cage et fournissez de l’eau par le côté de la cage. Pour éviter la détérioration, remplacez les aliments entièrement tous les jours.
- Au quotidien, assurez-vous que la souris a libre accès à l’intégralité de la cage et que le contrepoids est solidement et fortement attaché au micro-entraînement.
Résultats
Le protocole décrit ci-dessus a été utilisé pour enregistrer simultanément des signaux potentiels de champ local et des unités uniques de plusieurs zones du cerveau chez la souris, avec des enregistrements quotidiens effectués chez les mêmes souris de p20 à p60. Sont rapportés ici des enregistrements électrophysiologiques représentatifs de deux souris et une histologie post-expérience démontrant les emplacements d’enregistrement finaux.
Implantation chirurgicale du micro-drive chez des souris p20
Un micro-entraînement (Figure 1) a été construit (Figure 2) et implanté chirurgicalement dans une souris p20, comme décrit ci-dessus. Immédiatement après l’opération, la souris a été attachée au système de contrepoids (Figure 2G-I) et laissée récupérer. Une fois la souris complètement mobile, le micro-entraînement a été branché sur un système d’enregistrement électrophysiologique in vivo. Les câbles reliant le micro-entraînement à l’appareil d’enregistrement étaient suspendus au-dessus de la souris. Des enregistrements électrophysiologiques (32 kHz) ont été obtenus sur tous les canaux pendant 1 h pendant que la souris se comportait naturellement dans sa cage d’origine. Après l’enregistrement, la souris a été débranchée du système d’enregistrement, rattachée au système de contrepoids et renvoyée au vivarium avec un accès gratuit à l’eau et au chow.
Enregistrement quotidien de l’activité neuronale
Des enregistrements électrophysiologiques ont été obtenus quotidiennement pendant plusieurs semaines pour permettre la surveillance chronique de la même région du cerveau à travers les fenêtres de développement critiques de p20-p60. Les échantillons bruts de potentiels locaux (LFP) provenant des enregistrements chroniques sont présentés à la figure 3A,C. Des unités individuelles isolées ont été obtenues simultanément à partir de plusieurs tétrodes (figure 3B). Des unités avec des formes d’onde similaires ont été identifiées sur plusieurs jours (figure 3B, milieu et droite), mais en raison de la dérive potentielle de l’électrode d’enregistrement, il n’a pas été possible d’affirmer avec certitude que la même unité était identifiée sur plusieurs jours. Chez une souris séparée implantée à p20 et enregistrée quotidiennement pendant plusieurs semaines, l’activité neuronale a été examinée sur une tétrode ciblant la région dorsale CA1. Des ondulations de grande amplitude et des unités individuelles bien isolées ont été identifiées chaque jour de l’enregistrement (figure 4). Ces données indiquent que des enregistrements électrophysiologiques in vivo stables et de haute qualité pourraient provenir de la même souris au début du développement.
Confirmation histologique des sites d’enregistrement et de l’impact sur le développement de l’implantation chronique
Après la dernière journée d’enregistrement, la souris a été soigneusement anesthésiée par anesthésie à l’isoflurane suivie d’une injection létale de pentobarbital sodique, et un courant a été passé à travers les extrémités des électrodes pour produire de petites lésions aux sites d’enregistrement. La coupe histologique post-expérience du cerveau de la souris a permis de visualiser les sites d’enregistrement finaux (Figure 5A,B). Dans une cohorte distincte, trois souris mâles et trois souris femelles ont été implantées chirurgicalement à p20 comme décrit ci-dessus. Un nombre égal de compagnons de portée ont été laissés non implantés et maintenus dans des conditions de logement identiques. Les souris ont été sacrifiées à p62 (6 semaines après la chirurgie pour la cohorte implantée). Les crânes ont été soigneusement nettoyés et des mesures externes ont été prises de la distance bregma-lambda (Figure 5C, en haut à gauche) et de la largeur maximale externe du crâne au lambda (Figure 5C, en haut à droite). Une incision a été faite le long de la ligne médiane du crâne, et la moitié du crâne a été retirée pour exciser le cerveau pour la mesure de la masse (Figure 5C, en bas à droite). La hauteur de la cavité crânienne au niveau du bregma a été mesurée à partir de la moitié du crâne intacte (Figure 5C, en bas à gauche). Aucune mesure n’était significativement différente entre les cohortes implantées et non implantées (test de somme de rang de Wilcoxon), indiquant que l’implantation à long terme, à partir de p20, n’a pas d’impact brut sur le développement naturel du crâne ou du volume cérébral.

Figure 1 : Composants des micro-entraînements. Rendus tridimensionnels du (A) corps du micro-entraînement, (B) canule, (C) cône, (D) couvercle, (E) attaches à vis et (F) vis avançant la tétrode. Les caractéristiques critiques de chaque composant sont indiquées. Les détails de mesure peuvent être extraits des fichiers de modèles disponibles à https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Construction des microentraînements. (A) Vue latérale et (B) vue supérieure de la vis d’avancement de la tétrode avec les attaches de vis supérieure et inférieure connectées. (C) Vue latérale et (D) vue de dessus du microentraînement avec le corps et la canule attachés et le grand tube en polyimide traversant chaque trou de canule et fixé au fond de la canule. (E) Vue latérale du micro-entraînement avec les vis et le petit tube en polyimide en place. Le dessus des petits tubes en polyimide est coupé immédiatement avant le chargement des tétrodes. (F) Micro-entraînement complet fixé à l’appareil stéréotaxique. Le cône de protection qui entourerait normalement le micro-entraînement a été retiré à des fins de visualisation. Notez que certains des accessoires à vis ont été imprimés dans une résine noire pour ce micro-entraînement. G) Système de soutien à contrepoids. (H) Vue latérale et (I) de dessus d’une cage à souris avec le système de support de contrepoids attaché. Veuillez cliquer ici pour voir une version agrandie de cette figure.
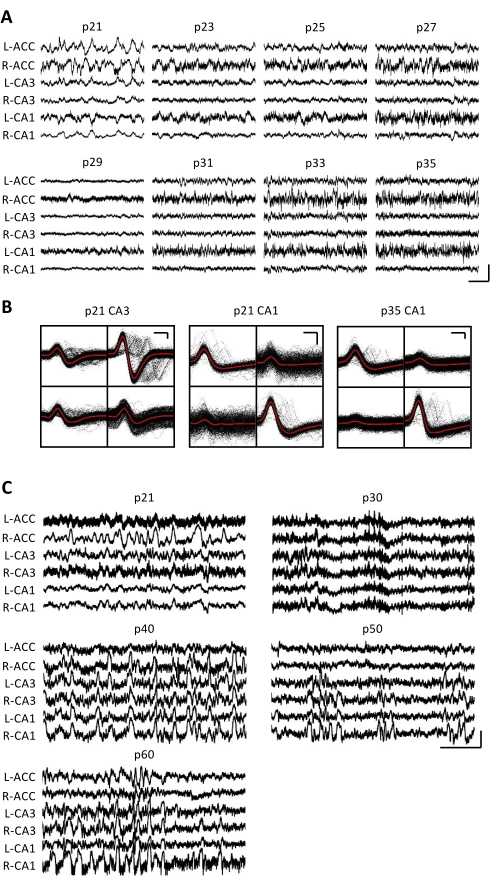
Figure 3 : Enregistrements électrophysiologiques représentatifs. Une souris p20 a été implantée avec un micro-entraînement comme décrit ci-dessus. À partir de p21 et tous les jours par la suite pendant 2 semaines, la souris a été attachée à l’appareil d’enregistrement et l’activité neuronale a été enregistrée pendant au moins 1 h. (A) Enregistrements bruts du potentiel de champ local (LFP) du bilatéral (L = gauche; R = droite) cortex cingulaire antérieur (ACC), aire hippocampique CA3 (CA3) et aire hippocampique CA1 (CA1). Les données étaient recueillies tous les jours; Pour plus de clarté, seules les données des jours impairs sont affichées. Toutes les traces ont été prises pendant les périodes d’immobilité dans la cage familiale. Barre d’échelle: 1 mV, 2 s. (B) Unités individuelles représentatives isolées de la zone de l’hippocampe CA3 (à gauche) et CA1 (à droite) pour les enregistrements du panneau A. Toutes les formes d’onde brutes sur chaque électrode sont montrées en noir; La moyenne est en rouge. Barre d’échelle: 50 μV, 0,2 ms. (C) Traces LFP brutes représentatives tous les 10 jours jusqu’au dernier jour d’enregistrement à p60 pour une deuxième souris implantée à p20. Les données étaient recueillies tous les jours; Pour plus de clarté, seules les données de tous les 10 jours sont affichées. Toutes les traces ont été prises pendant les périodes d’immobilité dans la cage domestique. Barre d’échelle: 1 mV, 2 s. Veuillez cliquer ici pour voir une version agrandie de cette figure.
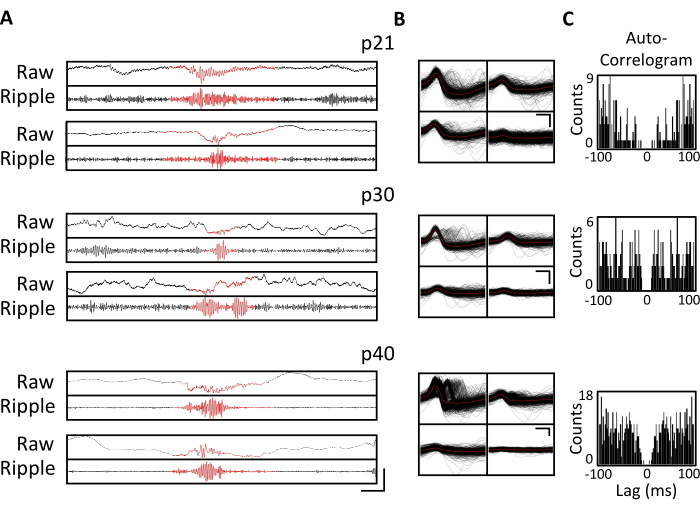
Graphique 4. Stabilité des enregistrements chroniques. Une souris p20 a été implantée avec un micro-entraînement, comme décrit ci-dessus. À partir de p21 et ensuite pendant 4 semaines, la souris a été attachée à l’appareil d’enregistrement et l’activité neuronale a été enregistrée pendant au moins 1 h. Les données des tétrodes ciblant l’hippocampe dorsal CA1 sont présentées. (A) LFP brut (en haut) et filtré par ondulation (en bas) pour les événements d’ondulation identifiés à p21, p30 et p40. Pour identifier les événements d’ondulation, le LFP brut a été filtré passe-bande entre 125 Hz et 300 Hz, et les événements d’ondulation ont été identifiés comme des augmentations transitoires de la puissance de la bande d’ondulation supérieures à 3 écarts-types au-dessus de la moyenne. Le début et la fin de chaque ondulation ont été définis comme le point où la puissance de la bande d’ondulation est revenue à la moyenne. Les ondulations identifiées sont indiquées en rouge. Barre d’échelle : 100 ms, de haut en bas : 1 000 μV, 140 μV, 1 800 μV, 180 μV, 9 000 μV, 1 200 μV, 10 000 μV, 1 000 μV. (B) Une unité unique représentative de chaque jour à partir de la tétrode ciblée CA1 pour les enregistrements dans le panneau A. Toutes les formes d’onde brutes sur chaque électrode sont montrées en noir; La moyenne est en rouge. Barre d’échelle 0,2 ms, de haut en bas: 50 μV, 100 μV, 100 μV. (C) Autocorrelogramme de toutes les pointes pour les unités individuelles du panneau B. Ces données démontrent un placement stable des électrodes dans la couche pyramidale de l’hippocampe sur plusieurs semaines. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Histologie représentative et impact sur le développement du crâne. Une souris p20 a été implantée avec un micro-entraînement, comme décrit ci-dessus. Après la dernière journée d’enregistrement sur p60, des lésions électrolytiques ont été produites sur les sites d’enregistrement et le cerveau a été perfusé avec 4% de paraformaldéhyde. Pour identifier les sites d’enregistrement, des sections de 50 μm ont été produites. (A) Lésions dans CA1 et CA3 de l’hippocampe. La pointe de flèche indique le site d’enregistrement CA3; la double flèche indique le site d’enregistrement CA1. Barre d’échelle: 0,5 mm. (B) Lésions dans le CCA bilatéral. Les pointes de flèches indiquent les sites d’enregistrement ACC. Barre d’échelle: 0,5 mm. (C) Mesures de la taille du crâne et de la masse cérébrale de souris p62 implantées avec un micro-entraînement à p20 (gris) et de compagnons de portée non implantés (blanc). La valeur p du test de somme de rang de Wilcoxon est indiquée pour chaque mesure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les expériences modernes explorant la fonction in vivo des circuits neuronaux chez les rongeurs utilisent souvent l’électrophysiologie extracellulaire via des électrodes implantées de manière permanente pour surveiller l’activité de neurones individuels (c’est-à-dire des unités uniques) ou de populations locales (via des potentiels de champ locaux, LFP), mais de telles méthodes sont rarement appliquées aux souris juvéniles en raison de défis techniques. Ce manuscrit décrit une méthode pour obtenir des enregistrements électrophysiologiques in vivo chez la souris à travers les fenêtres critiques pour le développement de p20 à p60 et au-delà. Cette méthodologie implique un processus de fabrication pour l’impression et la construction d’un implant micro-entraînement, une procédure d’implantation chirurgicale et une stratégie de récupération post-chirurgicale, qui sont tous spécifiquement conçus pour une utilisation chez les souris juvéniles. Plusieurs considérations ont influencé l’élaboration de ce protocole, notamment la petite taille et la faiblesse relative des souris juvéniles par rapport à leurs homologues adultes, ainsi que l’ossification réduite du crâne de souris juvénile sur lequel le micro-entraînement devait être fixé.
Les deux principales méthodes couramment utilisées pour effectuer l’électrophysiologie in vivo sont les réseaux d’électrodes (par exemple, les tétrodes) et les sondes de silicium. Les sondes en silicium sont légères, peuvent fournir un grand nombre de sites d’enregistrement par unité de poids et ont déjà été utilisées chez des rats juvéniles25. Cependant, les sondes en silicium sont relativement chères par unité. En revanche, le micro-entraînement décrit dans ce manuscrit peut être construit en utilisant moins de 50 USD en matières premières, ce qui en fait une option rentable pour l’enregistrement in vivo . De plus, les sondes en silicium doivent souvent être implantées dans des lignes fixes, ce qui interdit l’enregistrement de régions cérébrales spatialement diverses. En revanche, la conception de micro-entraînement décrite dans ce manuscrit utilise des tétrodes réglables indépendamment pour accueillir des enregistrements simultanés dans jusqu’à 16 endroits différents sans pratiquement aucune restriction sur la relation spatiale entre ces emplacements. Cette conception de micro-entraînement peut être facilement modifiée pour permettre de cibler des emplacements différents de ceux décrits ici en déplaçant les extrusions de trous de canule vers n’importe quel emplacement antérieur/postérieur et médial/distal souhaité. Lorsque vous ciblez d’autres zones cérébrales, il est important de noter que même si les tétrodes se déplacent souvent tout droit, il est possible que ces fils minces défligent légèrement lorsqu’ils sortent de la canule du micro-entraînement. Ainsi, plus une région du cerveau est petite ou ventrale, plus il sera difficile de cibler avec succès la zone avec des tétrodes.
L’implant de micro-entraînement décrit dans ce manuscrit est fondamentalement similaire à plusieurs conceptions antérieures de micro-entraînements à base de tétrodes 23,32,33,34,35 en ce sens que les tétrodes individuelles sont fixées à des vis, ce qui permet le contrôle fin de la profondeur d’enregistrement de chaque tétrode. Bien que plusieurs caractéristiques de la conception actuelle du micro-entraînement soient uniques, y compris la facilité de cibler les zones cérébrales distribuées spatialement, la principale nouveauté du présent manuscrit est la description de l’implantation chirurgicale et des stratégies de récupération post-chirurgicales, qui permettent des études chroniques de l’activité du réseau chez les souris juvéniles encore en développement. En effet, les méthodologies de chirurgie et de récupération décrites ici pourraient être adaptées pour soutenir d’autres implants chez les souris juvéniles.
Pour maintenir un enregistrement cohérent sur plusieurs jours, les fils ou les sondes doivent être fixés de manière rigide au crâne. Alors que la structure globale du crâne de souris ne subit que des changements mineurs après p20, le crâne s’épaissit considérablement entre les âges p20 et p4536. En effet, le crâne à p20 est insuffisamment rigide pour supporter un implant fixé sans être endommagé. Pour pallier cette limitation biologique, ce protocole épaissit artificiellement le crâne via du cyanoacrylate lors de la chirurgie d’implantation. L’implantation chez des souris plus jeunes que p20 est probablement possible en utilisant cette stratégie, mais le crâne de souris subit des changements de taille et de forme considérables jusqu’à environ p2036. Ainsi, l’implantation pendant de longues périodes chez des souris de moins de p20 n’est pas recommandée car le cyanoacrylate et les vis osseuses fixes dans le crâne encore en développement peuvent avoir un impact significatif sur la croissance naturelle du crâne et le développement du tissu cérébral sous-jacent. Fait important, dans cette étude, aucun impact sur les mesures brutes du crâne ou de la taille du cerveau n’a été observé après une implantation chronique commençant à p20 (Figure 5C).
Une étape critique de la méthode décrite dans ce manuscrit est la stratégie de récupération post-opératoire; Selon cette stratégie, le poids de l’implant doit être continuellement contrebalancé à mesure que la souris mûrit et subit un développement du système musculaire et musculo-squelettique. Tôt après l’implantation, les souris sont incapables de supporter avec succès le poids de l’implant sans contrepoids, ce qui entraîne une malnutrition et une déshydratation car la souris ne peut pas atteindre correctement les sources de nourriture et d’eau dans sa cage. Le système de contrepoids est facile et peu coûteux à construire, trivial à mettre en œuvre et permet aux souris de tout âge implantable d’explorer librement l’intégralité de leur cage domestique, assurant ainsi une nutrition et une hydratation adéquates. À mesure que les souris vieillissent, la quantité de contrepoids peut être réduite jusqu’à ce qu’elle puisse être entièrement éliminée chez les souris adultes; Cependant, l’utilisation continue du système de contrepoids est recommandée pendant toute la durée de l’expérience avec au moins un contrepoids nominal attaché à tout moment. Alors qu’une souris adulte peut être capable de supporter la taille et le poids du micro-drive au fil du temps, le mouvement naturel continu pendant le comportement libre sans contrepoids améliorant produit un couple et une force de cisaillement sur les vis osseuses qui ancrent le micro-drive sur le crâne, ce qui le rend de plus en plus susceptible de se détacher, en particulier lors d’expériences chroniques plus longues.
Deux limites importantes sont à noter pour la présente étude. Tout d’abord, pour évaluer l’impact de l’implantation à p20 sur le développement du crâne et du cerveau, plusieurs cohortes de souris ont été sacrifiées après une implantation prolongée (Figure 5C). Bien que ces analyses n’aient révélé aucun impact significatif de l’implantation sur la taille de la cavité crânienne ou la masse cérébrale (Figure 5C), la présente étude n’a pas examiné la taille du crâne ou la masse cérébrale à plusieurs moments tout au long de la période de développement précoce de p20-p60. Bien que des travaux antérieurs démontrent que le développement de la cavité cérébrale est terminé à p2036, il est possible que l’implantation à cette fenêtre précoce puisse produire des changements imprévus qui sont corrigés ou compensés par les âges adultes qui ont été évalués ici. Deuxièmement, les expériences qui ont produit les données électrophysiologiques présentées à la figure 3 et à la figure 4 n’ont pas été conçues pour maximiser le rendement cellulaire. Ainsi, bien que les données présentées ici démontrent des enregistrements stables et chroniques et des unités individuelles bien isolées, elles ne doivent pas être considérées comme représentatives du rendement potentiel maximal de ce dispositif.
De nombreux troubles neurologiques et psychiatriques humains se manifestent pendant les périodes de développement précoce ou à l’adolescence, y compris l’autisme et la schizophrénie. Cependant, on sait peu de choses sur le dysfonctionnement au niveau du circuit qui peut sous-tendre ces maladies, malgré la pléthore de modèles murins disponibles. L’identification de ces changements initiaux du réseau est essentielle pour créer des stratégies de détection précoce et des paradigmes de traitement. Pourtant, en raison de défis techniques, on ne sait toujours pas comment la fonction du réseau est perturbée tout au long du développement dans des modèles murins de maladies neuropsychiatriques. La stratégie de microentraînement et de rétablissement décrite ici est conçue pour soutenir les recherches sur le développement du réseau cérébral multirégional dans le cerveau de la souris et, ainsi, permettre aux chercheurs de mesurer le développement sain du cerveau ainsi que d’identifier les altérations de ce développement dans les modèles murins de maladie.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par les National Institutes of Health R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) et F99NS12053 (L.D.Q.) et le UT Southwestern GSO Endowment Award (R.J.P. et L.D.Q.). Les auteurs remercient Jenny Scaria (Texas Tech University Health Sciences Center School of Pharmacy) pour son assistance technique et le Dr Brendon Watson (Université du Michigan) pour ses suggestions méthodologiques.
matériels
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
Références
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon