Method Article
어린 생쥐의 만성 사극 기록을 위한 경량 드라이브 임플란트
요약
여기에서는 출생 후 20일(p20)부터 출생 후 60일(p60) 및 그 이후까지 중요한 발달 기간에 걸쳐 청소년 및 청소년 마우스의 여러 뇌 영역에서 동시에 여러 뇌 영역의 만성 필드 및 단일 단위 기록을 허용하는 마이크로 드라이브 설계, 외과적 이식 절차 및 수술 후 회복 전략에 대해 설명합니다.
초록
생체 내 전기생리학은 온전한 뇌의 초급 회로 역학에 대한 비할 데 없는 통찰력을 제공하며 인간 신경 정신 장애의 마우스 모델을 연구하는 데 특히 중요한 방법을 나타냅니다. 그러나 이러한 방법은 종종 큰 두개골 임플란트를 필요로 하며, 이는 초기 발달 시점에서 마우스에서 사용할 수 없습니다. 따라서 이 중요한 창에서 신경학적 발달에 대한 더 나은 이해가 자폐증이나 정신분열증과 같은 연령 의존적 발달 장애에 대한 고유한 통찰력을 제공할 가능성이 있음에도 불구하고 자유롭게 행동하는 유아 또는 청소년 마우스에서 생체 내 생리학에 대한 연구는 거의 수행되지 않았습니다. 여기에서는 출생 후 20일(p20)부터 출생 후 60일(p60)까지 나이가 들어감에 따라 생쥐에서 동시에 여러 뇌 영역의 만성 필드 및 단일 단위 기록을 허용하는 마이크로 드라이브 설계, 외과적 이식 절차 및 수술 후 회복 전략에 대해 설명합니다. 기록 전극 및 최종 기록 부위의 수는 쉽게 수정하고 확장할 수 있으므로 발달 전반에 걸쳐 행동 또는 질병 관련 뇌 영역의 생체 내 모니터링을 유연하게 실험적으로 제어할 수 있습니다.
서문
뇌는 아동기와 청소년기의 중요한 발달 기간 동안 대규모 변화를 겪습니다 1,2,3. 자폐증과 정신분열증을 포함한 많은 신경학적 및 정신과적 질환은 이 청소년 및 청소년 뇌 발달 기간 동안 행동적, 생물학적으로 처음 나타납니다 4,5,6. 초기 발달 전반에 걸쳐 발생하는 세포, 시냅스 및 유전적 변화에 대해서는 많이 알려져 있지만, 이 기간 동안 회로 또는 네트워크 수준 프로세스가 어떻게 변하는지에 대해서는 비교적 알려진 바가 거의 없습니다. 중요하게도, 궁극적으로 복잡한 행동, 기억 및 인지의 기초가 되는 회로 수준의 뇌 기능은 세포 및 시냅스 기능의 예측할 수 없고 창발적인 특성입니다 7,8,9,10. 따라서 네트워크 수준의 뇌 기능을 완전히 이해하려면 온전한 신경 회로 수준에서 신경 활동을 직접 연구해야 합니다. 또한, 신경 정신 장애의 진행 전반에 걸쳐 뇌 활동이 어떻게 변경되는지 확인하기 위해서는 질병의 행동 표현형이 나타날 때 특정 시간 창 동안 유효한 질병 모델에서 네트워크 활동을 조사하고 관찰된 변화를 추적하는 것이 중요합니다.
가장 흔하고 강력한 과학적 모델 유기체 중 하나는 행동 및/또는 니모닉 표현형의 연령 의존적 발병을 동반한 신경 발달 장애를 모델링하는 많은 수의 고유한 유전적 균주를 가진 마우스입니다 11,12,13,14,15,16,17,18,19,20,21 . 인간과 생쥐의 뇌 사이의 정확한 발달 시점을 연관시키는 것은 어렵지만, 형태학적 및 행동적 비교에 따르면 p20-p21 마우스는 2-3세의 인간 연령을 나타내고 p25-p35 마우스는 11-14세의 인간 연령을 나타내며 마우스는 p603까지 인간 20세 성인과 동등한 발달 상태에 도달할 가능성이 높습니다. 22. 따라서 청소년 뇌가 어떻게 발달하는지 더 잘 이해하고 자폐증이나 정신 분열증과 같은 질병에서 뇌의 신경망이 어떻게 기능 장애를 일으키는지 확인하려면 생후 20 일에서 60 일 사이의 생쥐에서 생체 내 뇌 활동을 직접 모니터링하는 것이 이상적입니다.
그러나 생쥐의 초기 발달 전반에 걸쳐 뇌 활동을 모니터링하는 근본적인 문제는 어린 생쥐의 작은 크기와 상대적 약점입니다. 뇌 발달의 종단적 연구에 필요한 전극의 만성 이식은 전형적으로 미세 전극 와이어들 및 인터페이스 보드(23,24)를 보호하기 위해 크고 부피가 큰 하우징을 필요로 하며, 임플란트는 감소된 골화로 인해 어린 마우스에서 더 얇고 덜 단단한, 마우스 두개골에 단단히 부착되어야 한다. 따라서, 생체 내 설치류 생리학에 대한 거의 모든 연구는 상대적인 크기, 강도 및 두개골 두께로 인해 성인 피험자에서 수행되었습니다. 현재까지, 생체 내 청소년 설치류 뇌 생리학을 탐구하는 대부분의 연구는 야생형 청소년 쥐에서 수행되었으며, 이는 인간 장애 25,26,27,28,29,30의 자유롭게 행동하는 모델에서 청소년 뇌 기능을 실험적으로 모니터링하는 능력을 필연적으로 제한합니다.
이 원고는 발달적으로 중요한 기간(p20에서 p60 이상)에 걸쳐 어린 마우스의 장기(최대 4주 이상) 생체 내 뇌 기능을 만성적으로 연구하기 위한 새로운 임플란트 하우징, 외과적 이식 절차 및 수술 후 회복 전략을 설명합니다. 이식 절차는 어린 생쥐의 두개골에 전극을 안정적이고 영구적으로 부착할 수 있도록 합니다. 또한, 마이크로 드라이브 설계는 완전히 조립되었을 때 무게가 ~4-6g이고 임플란트의 무게를 상쇄하는 데 필요한 최소한의 균형으로 인해 일반적인 행동 패러다임 동안 어린 마우스의 행동 성능에 영향을 미치지 않기 때문에 가볍습니다.
프로토콜
본 연구는 텍사스 대학교 사우스웨스턴 메디컬 센터 기관 동물 관리 및 사용 위원회(프로토콜 2015-100867)의 승인을 받았으며 기관 및 국립 보건원 지침을 모두 준수하여 수행되었습니다. 본 연구에 사용된 C57/Bl6 수컷 및 암컷 마우스를 p20(이식 시 체중 8.3-11.1g)에 이식하였다.
1. 마이크로 드라이브 설계 및 시공
- 마이크로 드라이브를 디지털 방식으로 설계하고 인쇄합니다(그림 1)
- 마이크로 드라이브 모델 템플릿(https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive)을 다운로드합니다.
- 적절한 정위 아틀라스에서 표적 뇌 영역(들)의 정위 위치를 식별합니다.
- 3D CAD(Computer-Aided Design) 소프트웨어를 사용하여 템플릿 마이크로 드라이브 캐뉼라를 로드합니다(그림 1B).
- 필요한 경우 마이크로 드라이브 캐뉼라 모델의 출력 캐뉼라 출력 위치를 수정하여 원하는 뇌 영역을 대상으로 합니다.
알림: 각 캐뉼라 구멍 돌출부는 테트로드가 목표물을 똑바로 겨냥하여 캐뉼라 구멍에서 나올 수 있도록 길이가 최소 2mm 이상이어야 합니다. 마이크로 드라이브 캐뉼라 템플릿은 전방 대상 피질(반구당 1개의 사극), 해마 영역 CA1(반구당 4개의 사극) 및 해마 영역 CA3(반구당 2개의 사극)을 양측으로 표적으로 하도록 설계되었으며, 해마 영역 CA1 위의 백질에 반구당 하나의 기준 사극이 위치합니다. - 필요한 경우 전자 인터페이스 보드(EIB)의 부착을 수용하도록 마이크로 드라이브 본체(그림 1A)를 수정하십시오.
- 마이크로 드라이브 본체, 캐뉼라, 콘 및 덮개를 3D 프린터(이상적으로는 25μm 이상의 해상도)에서 고해상도로 인쇄하고 제조업체의 프로토콜에 따라 인쇄물을 준비합니다. 강성이 높은 프린터 수지를 사용하십시오.
- 맞춤형 나사 및 부착물 조립(그림 2A, B)
- 3D CAD 소프트웨어를 사용하여 나사 부착 모델을 로드합니다(그림 1E).
- 3D 프린터에서 나사 부착물을 고해상도(이상적으로는 최소 25μm의 해상도)로 인쇄하고 제조업체의 프로토콜에 따라 인쇄물을 준비합니다. 강성이 높은 프린터 수지를 사용하십시오.
- 나사 부착물을 각 사극 전진 나사(그림 1F)에 부착합니다(사극 전진 나사는 마이크로 드라이브 구성 전에 기계 공장에서 맞춤 제조됨).
- 각 나사에 두 개의 나사 부착물을 부착합니다(하나는 능선 위와 아래에 있음). 각 나사 부착물의 바닥이 융기 부분에 닿는지 확인하십시오. 나사 부착물을 젤 시아노아크릴레이트와 함께 잡습니다.
- 부착된 나사 부착물이 나사의 세로축에서 움직이지 않고 최소한의 저항으로 자유롭게 회전하는지 확인하십시오.
- 마이크로 드라이브 본체 조립(그림 2C, D)
- 가늘고 날카로운 가위를 사용하여 대형 폴리이미드 튜브(외경: 0.2921mm, 내경: 0.1803mm)를 ~6cm 길이의 단면으로 자릅니다.
- 마이크로 드라이브 캐뉼라의 출력 구멍을 통해 큰 폴리이미드 섹션을 통과시켜 각 튜브가 캐뉼라 바닥을 넘어 몇 밀리미터 연장되도록 합니다.
- 깨끗한 30G 바늘을 사용하여 소량의 액체 시아노아크릴레이트를 도포하여 폴리이미드를 캐뉼라에 부착합니다. 시아노아크릴레이트가 폴리이미드 튜브 내부로 들어가지 않도록 주의하십시오.
알림: 액체 시아노아크릴레이트를 드라이브 본체 상단을 통해 캐뉼라로 떨어뜨리면 이 프로세스를 신속하게 처리할 수 있지만 나중에 끝이 가는 드릴로 가이드 구멍을 다시 청소해야 합니다. - 마이크로 드라이브 캐뉼라 상단에서 마이크로 드라이브 본체의 적절한 대형 폴리이미드 구멍을 통해 대형 폴리이미드 튜브를 통과시킵니다.
- 마이크로 드라이브 캐뉼라와 마이크로 드라이브 본체가 인접하고 캐뉼라/본체 부착 탭이 잠길 때까지 천천히 함께 밉니다. 이 과정에서 폴리이미드 튜브가 꼬이거나 손상되지 않도록 주의하십시오.
알림: 각 폴리이미드 튜브는 캐뉼라 바닥에서 마이크로 드라이브 본체 상단을 통해 부드럽게 통과해야 합니다. 약간 구부러지는 것은 정상이지만 폴리이미드 튜브를 과도하게 구부리면 사극이 휘어져 뇌로 바로 전달되지 않을 수 있습니다. - 시아노아크릴레이트를 사용하여 마이크로 드라이브 본체와 마이크로 드라이브 캐뉼라를 함께 부착합니다.
- 새롭고 날카로운 면도날을 사용하여 캐뉼라 배출 구멍의 바닥에서 돌출되는 큰 폴리이미드 튜브 끝을 절단합니다. 절단이 캐뉼라의 바닥에 정확히 있는지 확인하여 튜브와 캐뉼라 바닥이 서로 같은 높이가 되도록 합니다.
- 날카로운 가위를 사용하여 드라이브 본체의 내부 림 가장자리 바로 위에 있는 대형 폴리이미드 튜브를 ~45° 각도로 자릅니다.
- 조립된 맞춤형 나사 장착(그림 2E)
- 조립된 각 맞춤형 나사를 마이크로 드라이브 본체의 외부 구멍에 나사로 고정합니다. 나사 가이드포스트가 나사 부착물의 큰 구멍을 통과하는지 확인합니다. 더 이상 전진하지 않을 때까지 각 나사를 완전히 전진시킵니다. 나사에 미네랄 오일이나 액슬 그리스를 미리 윤활하는 것이 좋습니다.
- 매우 날카로운 가위를 사용하여 작은 폴리이미드 튜브(외경: 0.1397mm, 내경: 0.1016)를 ~4cm 길이의 섹션으로 자릅니다.
- 마이크로 드라이브에 이미 장착된 대형 폴리이미드 튜브를 통해 작은 폴리이미드 섹션을 통과시킵니다. 과도한 작은 폴리이미드 튜브가 각 대형 폴리이미드 튜브의 상단과 하단에서 돌출되어 있는지 확인하십시오.
- 시아노아크릴레이트를 통해 작은 폴리이미드 튜브를 나사 부착물에 부착하고 시아노아크릴레이트가 크거나 작은 폴리이미드 튜브에 들어가지 않도록 주의합니다.
- 새롭고 날카로운 면도날을 사용하여 캐뉼라 구멍 바닥에서 돌출된 작은 폴리이미드 튜브 끝을 절단합니다. 절단이 캐뉼라 바닥에 정확히 있고 절단이 깨끗한지, 폴리이미드 튜브 구멍을 막지 않는지 확인하십시오.
- 날카로운 가위를 사용하여 작은 폴리이미드의 상단을 나사 부착물 상단에서 몇 밀리미터 위로 ~45° 각도로 자릅니다. 폴리이미드 튜브 구멍을 막지 않고 절단이 깨끗한지 확인하십시오.
- 테트로드
- 앞서 설명한 방법31을 사용하여 테트로드(길이 ~6cm)를 준비합니다.
- 세라믹 또는 고무 팁 집게를 사용하여 작은 폴리이미드 튜브 중 하나를 통해 테트로드를 조심스럽게 통과시키고 작은 폴리이미드 튜브 상단에서 ~2cm 돌출되도록 합니다.
- 액체 시아노아크릴레이트를 통해 작은 폴리이미드 튜브 상단에 테트로드를 부착하고 공정에서 크고 작은 폴리이미드 튜브를 함께 부착하지 않도록 주의하십시오.
- 드라이브 상단 근처에 올 때까지 나사를 조이십시오.
- 드라이브 바닥에서 튀어나온 사극 와이어를 잡고 캐뉼라에서 나오는 지점에서 부드럽게 꼬입니다.
- 나사를 드라이브에 완전히 밀어 넣습니다.
- 매우 날카로운 가위를 사용하여 꼬임 바로 위의 사극 와이어를 자릅니다. 현미경으로 절단이 깨끗하고 4개의 사극 모두의 금속이 노출되어 있는지 확인하십시오.
- 테트로드가 캐뉼라 안에 고정될 때까지 나사를 집어넣습니다.
- 모든 나사에 대해 1.5.2-1.5.8단계를 반복합니다.
- 작은 보석 나사를 통해 EIB를 EIB 지지 플랫폼에 부착합니다.
- 각 테트로드의 각 전극을 EIB의 해당 포트에 연결합니다.
- 수술을 위한 마이크로 드라이브 준비
- 이전에 설명된 방법(31)을 사용하여 전기 임피던스를 줄이기 위해 테트로드를 전기적으로 플레이트합니다.
- 도금 후 각 사극이 사극의 끝이 각 캐뉼라 구멍의 바닥과 같은 높이가 되도록 캐뉼라에 보관되도록 합니다.
- 완성된 마이크로 드라이브 주위로 마이크로 드라이브 콘을 밉니다. 콘 부착 폴을 덮개 포트에 밀어 넣어 마이크로 드라이브 덮개를 마이크로 드라이브 콘에 부착합니다.
- 뚜껑을 닫을 때 EIB 커넥터가 EIB 연결 통과 구멍을 자유롭게 통과하도록 원뿔의 방향을 지정하고 원뿔 바닥 주위에 시아노아크릴레이트를 배치하여 원뿔을 제자리에 붙이고 시아노아크릴레이트가 캐뉼라 출력 구멍에 들어가지 않도록 주의하십시오. 뚜껑을 제거합니다.
- 외과적 이식 후 체액이 폴리이미드 구멍으로 들어가는 것을 방지하기 위해 각 캐뉼라 구멍을 멸균 미네랄 오일로 조심스럽게 다시 채웁니다.
- 캐뉼라 바닥을 멸균 바셀린으로 조심스럽게 코팅하십시오. 이것은 수술 중 화학 물질(예: 치과용 시멘트)이 노출된 뇌에 들어가는 것을 방지하는 장벽 역할을 합니다.
- 완전히 조립된 마이크로 드라이브, 덮개 및 4개의 뼈 나사의 무게를 측정하여 동일한 중량 균형을 준비합니다.
- 선택적으로, 수술 전에, 드라이브가 두개골과 같은 높이가 되면 표적 뇌 영역에 도달하기에 적절한 거리에서 테트로드를 압출합니다.
참고: 외과적 이식 전에 에틸렌 옥사이드(500-1200 mg/L, 2-4시간)의 가스 멸균을 통해 임플란트를 멸균합니다. 모든 뼈 나사와 수술 기구는 오토클레이브(121°C, 30분)를 통해 멸균해야 합니다.
2. 외과 이식
- 마우스를 마취시키고 입체 장치에 장착하는 단계;
- 움직일 수 있는 충분한 공간이 있는 작은 상자에 마우스를 넣고 3%-4% 이소플루란으로 마우스를 마취합니다.
참고: 다른 마취제를 사용할 수 있지만 어린 마우스 피험자의 나이, 크기 및 체중으로 인해 주의하여 사용해야 합니다. - 마우스가 반응하지 않으면(꼬리 꼬집음에 대한 반응 없음, 분당 ~60회 호흡의 환기 속도) 상자에서 마우스를 꺼내 입체 장치에 빠르게 장착합니다.
- 신속하게 정위 마스크를 마우스의 위에 놓고 마취를 1-3% 이소플루란으로 유지합니다. 초기 수술 절개 전에 서방형 부프레노르핀(0.05-0.5 mg/kg 피하) 또는 카르프로펜(5-10 mg/kg 피하)과 같은 항염증제와 같은 수의사가 승인한 통증 완화제를 바르십시오.
- 이어바를 사용하여 입체 장치에 마우스 머리를 완전히 고정합니다. 마우스의 외이도에 불필요한 압력을 가하지 않고 두개골이 평평하고 움직이지 않는지 확인하십시오. 어린 두개골 뼈의 제한된 골화로 인해 머리 고정 중에 영구적 인 손상을 일으킬 수 있습니다.
- 움직일 수 있는 충분한 공간이 있는 작은 상자에 마우스를 넣고 3%-4% 이소플루란으로 마우스를 마취합니다.
- 수술을 위해 마우스를 준비하고 두개골을 노출시킵니다.
- 각 눈에 소량의 합성 눈물 젤을 바르고 고압 증기 멸균 호일 패치로 각 눈을 덮어 마우스의 눈을 보호하십시오.
알림: 합성 눈물은 눈을 촉촉하게 유지하고 호일은 광원이 장기적인 손상을 일으키는 것을 방지합니다. 더 두꺼운 합성 눈물 용액은 잠재적으로 독성이 있는 다른 수술 용액(에탄올, 치과용 아크릴 등)이 눈에 부주의하게 유입되는 것을 막는 장벽 역할을 할 수 있기 때문에 선호됩니다. - 끝이 없는 멸균 면봉을 사용하여 수술 부위에 제모 크림을 바르고 두피에서 털을 제거합니다. 크림이 눈 근처에 닿지 않도록 주의하세요. 제모를 제거한 후 두피에 멸균 드레이프를 씌워 수술 부위를 고정합니다.
- 멸균된 면봉을 사용하여 포비돈 요오드(10%) 용액과 이소프로필 알코올(100%)을 3회 연속 세척 하여 두피를 청소합니다.
- 멸균 메스 또는 미세한 가위를 사용하여 두피를 제거하십시오.
- 멸균 면봉과 식염수 (0.9 % NaCl) 및 과산화수소의 멸균 용액을 사용하여 두개골을 철저히 청소하십시오.
- 브레그마를 식별하고 입체 장치를 사용하여 영구 마커로 두개골의 목표 기록 위치를 조심스럽게 표시하십시오.
- 각 눈에 소량의 합성 눈물 젤을 바르고 고압 증기 멸균 호일 패치로 각 눈을 덮어 마우스의 눈을 보호하십시오.
- 캐뉼라 구멍을 열고 뼈 앵커를 부착합니다
- 녹음 사이트를 덮고 있는 두개골을 제거합니다. # 이 나이에 두개골이 얇기 때문에 메스 칼날로 두개골을 자릅니다. 이렇게 하면 드릴을 사용할 필요가 없어 기본 경막이 손상될 수 있습니다. 멸균 식염수(0.9% NaCl) 또는 멸균 미네랄 오일을 사용하여 노출된 경막을 촉촉하게 유지하십시오. 이 단계에서 경막을 제거하거나 구멍을 뚫지 마십시오., 어린 생쥐에서는 사극이 향후 단계에서 통과할 수 있을 만큼 충분히 얇기 때문입니다.
- 4개의 뼈 나사를 위한 파일럿 구멍을 조심스럽게 뚫습니다.
- 뼈가 가장 두껍고 뼈 나사가 마이크로 드라이브 임플란트에서 충분히 멀리 떨어져 있는 두개골의 극단적인 측면 및 또는 꼬리 부분에 뼈 나사를 놓습니다. 뼈 나사의 경우 멸균된 고급 보석 나사(예: UNM 120 나사산, 1.5mm 헤드)를 사용하십시오.
- 2.4.6단계에서 접지 역할을 하고 EIB에 부착될 가늘고 전도성이 높은 와이어로 하나의 뼈 나사를 단단히 감습니다.
- 메스 날을 사용하거나 드릴 비트를 조심스럽게 사용하여 뼈 나사 구멍 위치 근처에서 두개골에 점수를 매깁니다. 처치는 단계 2.3.5에서 액체 시아노아크릴레이트가 결합할 수 있도록 충분히 거친 표면을 제공하는 것이 중요하다.
- 멸균 스크루 드라이버와 멸균 나사 클램프를 사용하여 각 멸균 뼈 나사를 제자리에 끼우고 기본 경막을 뚫지 않도록주의하십시오.
- 멸균된 30G 바늘을 사용하여 각 뼈 나사 주위에 액체 시아노아크릴레이트를 놓습니다. 이것은 뼈 나사가 부착된 두개골을 효과적으로 두껍게 만듭니다. 시아노아크릴레이트가 녹음 장소 위의 노출된 경막에 들어가지 않도록 주의하십시오.
- 마이크로 드라이브 내리기 및 부착(그림 2G)
- 완성된 마이크로 드라이브를 정체 장치에 장착하여 마우스 두개골 위로 조심스럽게 내립니다. 마이크로 드라이브 캐뉼라를 낮출 때 적절한 좌표에 있는지 확인하십시오.
- 마이크로 드라이브를 등쪽/복부 방향으로만 천천히 내립니다. 사극이 이미 캐뉼라 구멍 밖으로 전진한 상태에서 마이크로 드라이브를 낮추어 뇌로 들어가는 것을 시각화합니다 (1.6.6 단계). 사극이 마우스에 닿을 때 내측/측면 또는 주둥이/꼬리 움직임은 사극을 구부리고 최종 목적지를 놓치게 할 수 있습니다.
- 마이크로 드라이브가 완전히 내려간 후 캐뉼라 바닥이 두개골/경막과 접촉하는지 확인합니다. 바셀린 및/또는 미네랄 오일 층은 노출된 경막을 덮는 장벽 역할을 합니다. 필요한 경우 멸균 바셀린이나 멸균 뼈 왁스를 첨가하여 과도하게 노출된 경막을 덮습니다.
- 마이크로 드라이브를 정위 장치로 제자리에 고정하는 동안 두개골을 치과용 시멘트로 코팅하여 마이크로 드라이브 베이스를 이식된 뼈 나사에 부착합니다.
알림: 치과용 시멘트는 모든 뼈 나사를 완전히 감싸야 하며 마이크로 드라이브 캐뉼라의 치과용 시멘트 앵커 선반을 덮어야 합니다. - 치과용 시멘트가 굳는 동안 마우스를 손상시키거나 마이크로 드라이브를 손상시킬 수 있는 날카로운 모서리나 모서리를 방지하기 위해 조심스럽게 모양을 만듭니다. 마이크로 드라이브를 고정하기에 충분한 치과용 시멘트가 있는지 확인하되 불필요한 무게를 추가하는 과도한 치과용 시멘트는 제거하십시오.
- 접지선을 마이크로 드라이브를 통해 조심스럽게 끼우고 EIB의 해당 슬롯에 연결하십시오.
- 치과용 시멘트가 완전히 세팅되면 정체 장치에서 마이크로 드라이브를 조심스럽게 분리합니다. 마이크로 드라이브의 덮개를 놓습니다.
- 멸균 면봉과 멸균 식염수로 마우스를 청소하십시오.
- 멸균된 면봉으로 임플란트 부위 근처의 노출된 두피에 항생제 연고를 얇게 바릅니다.
- 마우스의 눈에서 호일을 제거합니다.
- 마우스를 정체 장치로부터 제거하고, 마우스가 깨끗한 케이지로 운반될 때 마이크로 드라이브의 추가 중량을 지지하도록 주의한다.
3. 수술 후 회복
- 즉각적인 회복
- 수술 전에 그림 0.75G와 같이 직경 2개의 PVC 파이프를 연결하여 카운터밸런스 시스템을 준비합니다. 시스템의 한쪽 암은 케이지 뚜껑에 뚫린 구멍을 통과하고, 두 번째 암은 케이지 뚜껑 위에 놓이며, 세 번째 암은 케이지 위와 너머로 확장됩니다. 맨 위 팔에는 캡이 달려 있습니다.
- 마이크로 드라이브를 카운터 밸런스 시스템에 조심스럽게 부착하고(그림 2G-I) 마이크로 드라이브 및 뼈 나사의 무게와 동일한 카운터 밸런스 웨이트를 사용합니다. EIB에 부착된 커넥터에서 카운터밸런스 시스템의 세 개 암을 넘어 맨 위 암 위에 매달려 있는 카운터밸런스 추까지 강한 실이나 낚싯줄을 연결합니다.
- 카운터 밸런스가 마이크로 드라이브 EIB에 강력하게 연결되어 있고 마우스가 케이지 전체에 완전히 접근할 수 있도록 충분한 라인이 있는지 확인하십시오.
- 수분 보충과 회복을 보장하기 위해 축축한 일반 설치류 차우와 함께 케이지에 영양이 풍부한 젤을 제공하십시오.
- 외과 마취에서 완전히 회복 될 때까지 마우스를 모니터링하십시오.
- 장기 회복
- 녹음 장비에 부착하지 않은 경우 항상 마이크로 드라이브가 카운터밸런스 시스템에서 지원되는지 확인하십시오. 시간이 지남에 따라 균형추를 줄이되 마우스에 예상치 못한 스트레스가 가해지거나 뼈 나사에 가해지는 토크를 피하기 위해 완전히 제거하지 마십시오.
- 임플란트 및 평형 시스템의 손상을 방지하려면 실험 기간 동안 다른 마우스와 직접 상호 작용할 가능성 없이 마우스를 수용하십시오.
- 수술 후 최소 3일 동안 영양이 풍부한 젤을 제공하며, 이 시점에서는 단단한 음식만으로도 충분합니다.
- 평형 시스템의 오버헤드 요구 사항으로 인해 오버헤드 철망에 음식과 물을 제공하지 마십시오. 케이지 바닥에 음식을 놓고 케이지 측면을 통해 물을 공급하십시오. 부패를 방지하려면 매일 식품을 완전히 교체하십시오.
- 매일 마우스가 케이지 전체에 자유롭게 접근할 수 있고 카운터 밸런스가 마이크로 드라이브에 견고하고 강력하게 부착되어 있는지 확인하십시오.
결과
상술한 프로토콜은 p20에서 p60까지 동일한 마우스에서 수행된 일일 기록과 함께 마우스에서 동시에 여러 뇌 영역의 국소 필드 전위 신호 및 단일 단위를 기록하는 데 사용되었습니다. 여기에 보고된 것은 두 마리의 생쥐의 대표적인 전기생리학적 기록과 최종 기록 위치를 보여주는 실험 후 조직학입니다.
마이크로 드라이브를 p20 마우스에 외과적으로 이식
마이크로 드라이브(그림 1)를 구성하고(그림 2) 위에서 설명한 대로 p20 마우스에 외과적으로 이식했습니다. 수술 직후, 마우스를 카운터밸런스 시스템(도 2G-I)에 부착하고 회복시켰다. 마우스가 완전히 움직이면 마이크로 드라이브를 생체 내 전기 생리학 기록 시스템에 연결했습니다. 마이크로 드라이브를 녹음 장비에 연결하는 케이블이 마우스 위에 매달려 있었습니다. 전기생리학적 기록(32kHz)은 마우스가 홈 케이지에서 자연스럽게 행동하는 동안 1시간 동안 모든 채널에서 얻어졌습니다. 녹음 후 마우스는 녹음 시스템에서 플러그를 뽑고 카운터 밸런스 시스템에 다시 부착 한 다음 물과 차우에 자유롭게 접근 할 수있는 동물 사육장으로 돌아 왔습니다.
신경 활동의 일일 기록
전기 생리학적 기록은 p20-p60의 중요한 발달 창에서 동일한 뇌 영역의 만성 모니터링을 가능하게 하기 위해 몇 주 동안 매일 수집되었습니다. 만성 기록 전반에 걸친 샘플 원시 국소 전위(LFP)는 그림 3A,C에 나와 있습니다. 분리된 단일 유닛은 여러 테트로드에서 동시에 얻어졌습니다(그림 3B). 유사한 파형을 가진 단위가 여러 날에 걸쳐 식별되었지만(그림 3B, 중간 및 오른쪽) 기록 전극의 잠재적인 드리프트로 인해 동일한 단위가 며칠 동안 식별되고 있다고 단정적으로 주장할 수 없었습니다. p20에 이식되고 몇 주 동안 매일 기록된 별도의 마우스에서 등쪽 영역 CA1을 표적으로 하는 사극에서 신경 활동을 조사했습니다. 큰 진폭의 리플과 잘 격리 된 단일 단위가 기록의 각 날에 확인되었습니다 (그림 4). 이러한 데이터는 안정적이고 고품질의 생체 내 전기생리학적 기록이 초기 개발 전반에 걸쳐 동일한 마우스에서 나올 수 있음을 나타냅니다.
기록 부위의 조직학적 확인 및 만성 이식의 발달적 영향
최종 기록일 이후, 마우스는 이소플루란 마취를 통해 완전히 마취된 후 펜토바르비탈 나트륨의 치명적인 주사를 받았고, 전류가 전극 팁을 통과하여 기록 부위에 작은 병변을 생성했습니다. 실험 후 마우스 뇌의 조직학적 절편을 통해 최종 기록 부위를 시각화할 수 있었습니다(그림 5A, B). 별개의 코호트에서, 3마리의 수컷 마우스와 3마리의 암컷 마우스를 상기 기재된 바와 같이 p20에 외과적으로 이식하였다. 동일한 수의 새끼가 이식되지 않은 채로 남아 동일한 주거 조건에서 유지되었습니다. 마우스를 p62(이식된 코호트에 대한 수술 후 6주)에서 희생시켰다. 두개골을 조심스럽게 청소하고 브레그마에서 람다까지의 거리(그림 5C, 왼쪽 상단)와 람다에서 외부 최대 두개골 너비(그림 5C, 오른쪽 상단)를 외부 측정했습니다. 두개골의 정중선을 따라 절개하고 두개골의 절반을 제거하여 질량 측정을 위해 뇌를 절제했습니다(그림 5C, 오른쪽 하단). 브레그마에서 두개골 공동의 높이는 손상되지 않은 두개골 절반에서 측정되었습니다(그림 5C, 왼쪽 하단). 이식된 코호트와 이식되지 않은 코호트 간에 유의미한 차이는 없었으며(Wilcoxon rank-sum test), 이는 p20에서 시작하는 장기 이식이 두개골이나 뇌 부피의 자연적인 발달에 큰 영향을 미치지 않음을 나타냅니다.

그림 1: 마이크로 드라이브 구성 요소 (A) 마이크로 드라이브 본체, (B) 캐뉼라, (C) 원뿔, (D) 뚜껑, (E) 나사 부착물 및 (F) 사극 전진 나사의 3차원 렌더링. 각 구성 요소의 중요한 기능이 표시됩니다. 측정 세부 정보는 https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/ 에서 사용할 수 있는 모델 파일에서 추출할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 마이크로 드라이브 구조 . (A) 측면 및 (B) 상단 및 하단 나사 부착물이 연결된 테트로드 전진 나사의 상단 보기. (C) 본체 및 캐뉼라가 부착된 마이크로 드라이브의 측면 및 (D) 평면도 및 각 캐뉼라 구멍을 통과하고 캐뉼라의 바닥으로 트리밍된 대형 폴리이미드 튜브. (E) 나사와 작은 폴리이미드 튜브가 제자리에 있는 마이크로 드라이브의 측면도. 작은 폴리이미드 튜브의 상단은 사극 로딩 직전에 다듬어집니다. (F) 입체 장치에 부착된 완성된 마이크로 드라이브. 일반적으로 마이크로 드라이브를 둘러싸고 있는 보호 원뿔은 시각화를 위해 제거되었습니다. 일부 나사 부착물은 이 마이크로 드라이브를 위해 검은색 레진으로 인쇄되었습니다. (G) 평형 지원 시스템. (에이치) 측면 및 (I) 카운터밸런스 지지 시스템이 부착된 마우스 케이지의 상단 모습. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
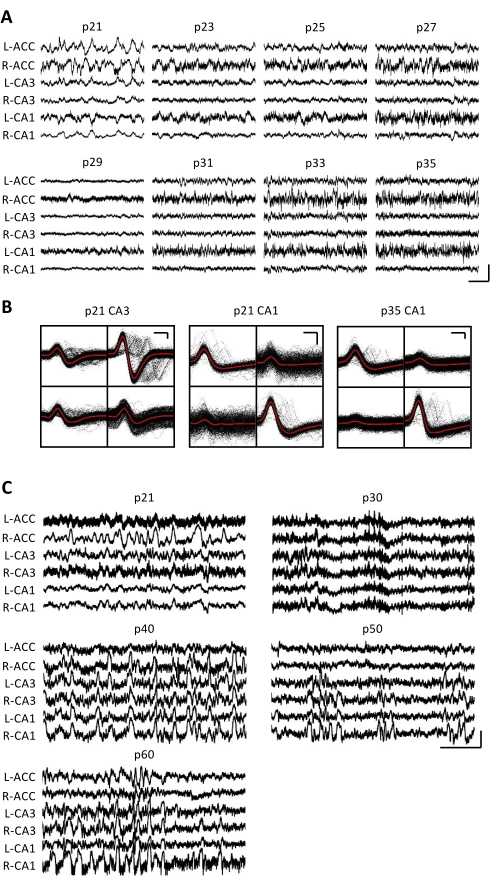
그림 3: 대표적인 전기생리학적 기록. p20 마우스를 상기와 같이 마이크로 드라이브를 이식하였다. p21에서 시작하여 그 후 2주 동안 매일 마우스를 기록 장치에 부착하고 신경 활동을 최소 1시간 동안 기록했습니다. (A) 양측으로부터의 원시 국소 전위(LFP) 기록(L = 왼쪽; R = 오른쪽) 전대상 피질(ACC), 해마 영역 CA3(CA3) 및 해마 영역 CA1(CA1). 데이터는 매일 수집되었습니다. 명확성을 위해 홀수 날의 데이터만 표시됩니다. 모든 흔적은 홈 케이지에서 움직이지 않는 기간 동안 촬영되었습니다. 스케일 바: 1mV, 2초(B) 패널 A의 녹음을 위해 해마 영역 CA3(왼쪽) 및 CA1(오른쪽)에서 분리된 대표적인 단일 단위. 각 전극의 모든 원시 파형은 검은색으로 표시됩니다. 평균은 빨간색입니다. 스케일 바: 50μV, 0.2ms. (C) p20에 이식된 두 번째 마우스에 대해 p60에서 최종 기록일까지 10일마다 대표적인 원시 LFP 추적. 데이터는 매일 수집되었습니다. 명확성을 위해 10일마다 데이터만 표시됩니다. 모든 흔적은 홈 케이지에서 움직이지 않는 기간 동안 촬영되었습니다. 스케일 바: 1 mV, 2 s. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
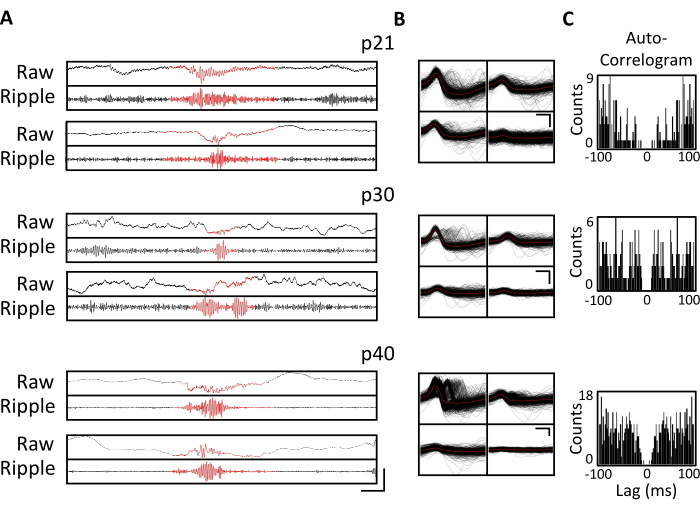
그림 4. 만성 녹음의 안정성. p20 마우스를 상기와 같이 마이크로 드라이브를 이식하였다. p21에서 시작하여 그 후 4주 동안 마우스를 기록 장치에 부착하고 신경 활동을 최소 1시간 동안 기록했습니다. 등쪽 해마 CA1을 표적으로 하는 사극의 데이터가 표시됩니다. (A) p21, p30 및 p40에서 식별된 리플 이벤트에 대한 원시(위) 및 리플 필터링(아래) LFP. 리플 이벤트를 식별하기 위해 원시 LFP는 125Hz와 300Hz 사이에서 대역 통과 필터링되었으며 리플 이벤트는 평균보다 3 표준 편차 큰 리플 대역 전력의 일시적인 증가로 식별되었습니다. 각 리플의 시작과 끝은 리플 대역 전력이 평균으로 돌아온 지점으로 정의되었습니다. 식별된 잔물결은 빨간색으로 표시됩니다. 스케일 바: 100 ms, 위에서 아래로: 1,000 μV, 140 μV, 1,800 μV, 180 μV, 9,000 μV, 1,200 μV, 10,000 μV, 1,000 μV. (B) 패널 A의 녹음을 위한 CA1 표적 사극에서 매일 대표되는 단일 단위. 각 전극의 모든 원시 파형은 검은색으로 표시됩니다. 평균은 빨간색입니다. 스케일 바 0.2 ms, 위에서 아래로: 50 μV, 100 μV, 100 μV. (C) 패널 B의 단일 장치에 대한 모든 스파이크의 자동 대응. 이 데이터는 몇 주에 걸쳐 해마 피라미드 층 내에서 안정적인 전극 배치를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 대표적인 조직학 및 두개골 발달에 미치는 영향. p20 마우스를 상기와 같이 마이크로 드라이브를 이식하였다. p60의 최종 기록일 이후, 기록 부위에서 전해질 병변이 생성되었고, 뇌는 4% 파라포름알데히드로 관류되었다. 기록 부위를 식별하기 위해 50μm 섹션이 생성되었습니다. (A) 해마의 CA1 및 CA3의 병변. 화살촉은 CA3 기록 사이트를 나타냅니다. 이중 화살촉은 CA1 기록 사이트를 나타냅니다. 스케일 바: 0.5mm. (B) 양측 ACC의 병변. 화살촉은 ACC 기록 사이트를 나타냅니다. 스케일 바: 0.5mm. (C) p20(회색)에서 마이크로 드라이브를 이식한 p62 마우스와 이식되지 않은 새끼(흰색)의 두개골 크기 및 뇌량 측정. Wilcoxon 순위합 검정의 p-값이 각 측정값에 대해 보고됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
설치류에서 생체 내 신경 회로 기능을 탐구하는 현대 실험은 종종 영구적으로 이식된 전극을 통해 세포외 전기생리학을 활용하여 개별 뉴런(즉, 단일 단위) 또는 지역 개체군(국소 전위, LFP를 통해)의 활동을 모니터링하지만 이러한 방법은 기술적인 문제로 인해 어린 마우스에 거의 적용되지 않습니다. 이 원고는 p20에서 p60 및 그 이상의 발달적으로 중요한 창에 걸쳐 마우스에서 생체 내 전기생리학적 기록을 얻는 방법을 설명합니다. 이 방법론에는 마이크로 드라이브 임플란트의 인쇄 및 구성을 위한 제조 공정, 외과적 임플란트 절차 및 수술 후 회복 전략이 포함되며, 이 모든 것은 특히 어린 마우스에 사용하도록 맞춤화되었습니다. 이 프로토콜의 개발에는 성인 마우스에 비해 어린 마우스의 작은 크기와 상대적 약점, 마이크로 드라이브를 부착해야 하는 어린 마우스 두개골의 골화 감소를 포함하여 몇 가지 고려 사항이 영향을 미쳤습니다.
생체 내 전기생리학을 수행하기 위해 일반적으로 사용되는 두 가지 주요 방법은 전극(예: 테트로드) 및 실리콘 프로브의 어레이입니다. 실리콘 프로브는 가볍고, 단위 중량 당 많은 수의 기록 부위를 제공할 수 있으며, 이전에 어린 쥐25마리에서 활용되어 왔다. 그러나 실리콘 프로브는 단위당 상대적으로 비쌉니다. 대조적으로, 이 원고에 설명된 마이크로 드라이브는 미화 50달러 미만의 원자재를 사용하여 구성할 수 있으므로 생체 내 기록을 위한 비용 효율적인 옵션입니다. 또한 실리콘 프로브는 종종 고정선에 이식되어야 하므로 공간적으로 다양한 뇌 영역의 기록이 금지됩니다. 대조적으로, 이 원고에 설명된 마이크로 드라이브 설계는 독립적으로 조정 가능한 테트로드를 사용하여 최대 16개의 서로 다른 위치에서 동시 녹음을 수용할 수 있으며 해당 위치 간의 공간적 관계에 대한 거의 제한이 없습니다. 이 마이크로 드라이브 설계는 캐뉼라 구멍 돌출부를 원하는 전방/후방 및 내측/원위 위치로 이동하여 여기에 설명된 것과 다른 위치를 타겟팅할 수 있도록 쉽게 수정할 수 있습니다. 대체 뇌 영역을 목표로 삼을 때 사극이 종종 직선으로 이동하지만 이러한 가는 와이어가 마이크로 드라이브 캐뉼라를 빠져나갈 때 약간 편향될 수 있다는 점에 유의하는 것이 중요합니다. 따라서 뇌 영역이 작거나 복부가 많을수록 사극으로 해당 영역을 성공적으로 표적으로 삼는 것이 더 어려워집니다.
이 원고에 기술된 마이크로-드라이브 임플란트는 개별 테트로드가 나사에 부착되어, 각 테트로드의 기록 깊이를 미세하게 제어할 수 있다는 점에서 이전의 여러 테트로드 기반 마이크로-드라이브 설계들(23,32,33,34,35)과 근본적으로 유사하다. 현재 마이크로 드라이브 설계의 몇 가지 기능은 공간적으로 분산된 뇌 영역을 쉽게 표적으로 삼을 수 있다는 점을 포함하여 독특하지만, 현재 원고의 주요 참신함은 외과적 이식 및 수술 후 회복 전략에 대한 설명으로, 이는 아직 발달 중인 어린 마우스의 네트워크 활동에 대한 만성적인 연구를 가능하게 합니다. 실제로, 여기에 설명된 수술 및 회복 방법론은 어린 생쥐의 다른 임플란트를 지원하도록 조정할 수 있습니다.
여러 날에 걸쳐 일관된 기록을 유지하려면 와이어 또는 프로브를 두개골에 단단히 부착해야 합니다. 쥐 두개골의 전체 구조는 p20 이후에 약간의 변화만 겪지만, 두개골은 p20에서 p45 사이에 상당히 두꺼워집니다36. 실제로 p20의 두개골은 손상 없이 부착된 임플란트를 지지하기에 충분히 단단하지 않습니다. 이러한 생물학적 한계를 극복하기 위해 이 프로토콜은 이식 수술 중에 시아노아크릴레이트를 통해 인위적으로 두개골을 두껍게 만듭니다. 이 전략을 사용하여 p20보다 어린 마우스에 이식하는 것이 가능할 수 있지만 마우스 두개골은 대략 p2036까지 상당한 크기와 모양 변화를 겪습니다. 따라서 p20보다 어린 마우스에 장기간 이식하는 것은 아직 발달 중인 두개골의 시아노아크릴레이트 및 고정 뼈 나사가 두개골의 자연적인 성장과 기본 뇌 조직 발달에 상당한 영향을 미칠 수 있으므로 권장되지 않습니다. 중요하게도, 이 연구에서 p20에서 시작하는 만성 이식 후 두개골 또는 뇌 크기의 총 측정에 미치는 영향이 관찰되지 않았다는 것입니다(그림 5C).
이 원고에 설명된 방법의 중요한 단계는 수술 후 회복 전략입니다. 이 전략에 따르면, 임플란트의 무게는 마우스가 성숙하고 근육 및 근골격계 발달을 겪음에 따라 지속적으로 균형을 이루어야 합니다. 이식 후 초기에 마우스는 균형 없이 임플란트의 무게를 성공적으로 견딜 수 없어 마우스가 케이지의 음식과 수원에 적절하게 도달할 수 없기 때문에 영양실조와 탈수로 이어집니다. 카운터 밸런스 시스템은 구성하기 쉽고 저렴하며 구현하기 쉬우며 이식 가능한 모든 연령의 마우스가 홈 케이지 전체를 자유롭게 탐색할 수 있도록 하여 적절한 영양과 수분 공급을 보장합니다. 생쥐가 나이가 들어감에 따라 성인 생쥐에서 완전히 제거 될 수있을 때까지 균형의 양을 줄일 수 있습니다. 그러나 실험 기간 동안 최소한 공칭 균형추를 항상 부착한 상태에서 카운터밸런스 시스템을 계속 사용하는 것이 좋습니다. 성인 마우스는 시간이 지남에 따라 마이크로 드라이브의 크기와 무게를 견딜 수 있지만, 균형추를 개선하지 않고 자유로운 행동 중에 자연스러운 움직임을 계속하면 마이크로 드라이브를 두개골에 고정하는 뼈 나사에 토크와 전단력이 발생하여 특히 더 긴 만성 실험 중에 분리될 가능성이 높아집니다.
현재 연구에서 주목해야 할 두 가지 중요한 제한 사항이 있습니다. 첫째, p20에서의 이식이 두개골과 뇌 발달에 미치는 영향을 평가하기 위해, 장기간 이식 후 여러 마우스의 코호트를 희생시켰다(그림 5C). 이러한 분석은 이식이 두개골 구멍 크기나 뇌 질량에 미치는 유의미한 영향을 나타내지 않았지만(그림 5C), 현재 연구에서는 p20-p60의 초기 발달 기간 동안 여러 시점에서 두개골 크기나 뇌 질량을 조사하지 않았습니다. 선행 연구에서는 뇌강의 발달이 p2036에 의해 완료됨을 보여주지만, 이 초기 창에서의 이식은 여기에서 평가된 성인 연령에 의해 수정되거나 보상되는 예상치 못한 변화를 일으킬 수 있습니다. 둘째, 도 3 및 도 4 에 도시된 전기생리학적 데이터를 생성한 실험은 세포 수율을 최대화하도록 설계되지 않았다. 따라서 여기에 제시된 데이터는 안정적이고 만성적인 기록과 잘 분리된 단일 장치를 보여주지만 이 장치의 최대 잠재적 수율을 나타내는 것으로 간주해서는 안 됩니다.
많은 인간의 신경 및 정신 장애는 자폐증 및 정신 분열증을 포함하여 초기 발달 기간 또는 청소년기에 걸쳐 나타납니다. 그러나 사용 가능한 마우스 모델이 많음에도 불구하고 이러한 질병의 기초가 될 수 있는 회로 수준 기능 장애에 대해서는 알려진 바가 거의 없습니다. 이러한 초기 네트워크 변화의 식별은 조기 발견 전략 및 치료 패러다임을 만드는 데 중요합니다. 그러나 기술적 문제로 인해 신경 정신 질환의 마우스 모델 개발 전반에 걸쳐 네트워크 기능이 어떻게 중단되는지는 불분명합니다. 여기에 설명된 마이크로 드라이브 및 복구 전략은 마우스 뇌의 다지역 뇌 네트워크 발달에 대한 조사를 지원하도록 설계되었으며, 따라서 연구자들은 건강한 뇌 발달을 측정할 수 있을 뿐만 아니라 마우스 질병 모델에서 해당 발달의 변화를 식별할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 National Institutes of Health R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) 및 F99NS12053 (L.D.Q.) 및 UT Southwestern GSO Endowment Award (RJP 및 LDQ)의 지원을 받았습니다. 저자는 기술 지원에 대해 Jenny Scaria (Texas Tech University Health Sciences Center School of Pharmacy)와 방법 론적 제안에 대해 Brendon Watson 박사 (University of Michigan)에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
참고문헌
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유