Method Article
שתל כונן קל משקל לרישומי טטרוד כרוניים בעכברים צעירים
In This Article
Summary
במאמר זה אנו מתארים תכנון מיקרו-דרייב, הליך השתלה כירורגי ואסטרטגיית התאוששות לאחר ניתוח, המאפשרים הקלטות שדה כרוניות ויחידות בודדות מאזורי מוח מרובים בו זמנית בעכברים צעירים ומתבגרים בחלון התפתחותי קריטי מהיום ה-20 שלאחר הלידה (עמ' 20) ועד היום ה-60 שלאחר הלידה (עמ' 60) ומעבר לכך.
Abstract
אלקטרופיזיולוגיה In vivo מספקת תובנה חסרת תקדים לגבי דינמיקת המעגלים ברמה תת-שנייה של המוח השלם ומייצגת שיטה בעלת חשיבות מיוחדת לחקר מודלים עכבריים של הפרעות נוירופסיכיאטריות אנושיות. עם זאת, שיטות כאלה דורשות לעתים קרובות שתלים גולגולתיים גדולים, אשר לא ניתן להשתמש בהם בעכברים בנקודות זמן התפתחותיות מוקדמות. לפיכך, כמעט ולא בוצעו מחקרים על פיזיולוגיה in vivo בתינוקות או עכברים צעירים המתנהגים בחופשיות, למרות העובדה שהבנה טובה יותר של התפתחות נוירולוגית בחלון קריטי זה עשויה לספק תובנות ייחודיות לגבי הפרעות התפתחותיות תלויות גיל כגון אוטיזם או סכיזופרניה. כאן מתוארים תכנון מיקרו-דרייב, הליך השתלה כירורגית ואסטרטגיית התאוששות לאחר ניתוח המאפשרים הקלטות שדה כרוניות ויחידה אחת מאזורי מוח מרובים בו זמנית בעכברים כשהם מתבגרים מהיום ה-20 שלאחר הלידה (עמ' 20) ועד היום ה-60 שלאחר הלידה (עמ' 60) ומעבר לכך, חלון זמן המתאים בערך לגילאי האדם מגיל שנתיים ועד לבגרות. ניתן לשנות ולהרחיב בקלות את מספר אלקטרודות ההקלטה ואתרי ההקלטה הסופיים, ובכך לאפשר בקרה ניסיונית גמישה של ניטור in vivo של אזורי מוח רלוונטיים להתנהגות או למחלות לאורך ההתפתחות.
Introduction
המוח עובר שינויים בקנה מידה גדול במהלך חלונות ההתפתחות הקריטיים של הילדות וההתבגרות 1,2,3. מחלות נוירולוגיות ופסיכיאטריות רבות, כולל אוטיזם וסכיזופרניה, מתבטאות לראשונה מבחינה התנהגותית וביולוגית בתקופה זו של התפתחות המוח לנוער ולמתבגר 4,5,6. בעוד שהרבה ידוע על השינויים התאיים, הסינפטיים והגנטיים המתרחשים במהלך ההתפתחות המוקדמת, מעט יחסית ידוע על האופן שבו תהליכים ברמת המעגל או הרשת משתנים במהלך חלון זמן זה. חשוב לציין, תפקוד מוחי ברמת המעגל, אשר בסופו של דבר עומד בבסיס התנהגויות מורכבות, זיכרון וקוגניציה, הוא תכונה בלתי צפויה, מתפתחת של תפקוד תאי וסינפטי 7,8,9,10. לכן, כדי להבין באופן מלא את תפקוד המוח ברמת הרשת, יש צורך ללמוד ישירות פעילות עצבית ברמה של מעגל עצבי שלם. בנוסף, כדי לזהות כיצד פעילות המוח משתנה לאורך ההתקדמות של הפרעות נוירופסיכיאטריות, חיוני לבחון את פעילות הרשת במודל מחלה תקף במהלך חלון הזמן הספציפי שבו הפנוטיפים ההתנהגותיים של המחלה באים לידי ביטוי ולעקוב אחר השינויים הנצפים כשהם נמשכים לתוך הבגרות.
אחד מאורגניזמי המודל המדעיים הנפוצים והחזקים ביותר הוא העכבר, בעל מספר רב של זנים גנטיים ייחודיים המדמים הפרעות נוירו-התפתחותיות עם הופעה תלוית גיל של הפנוטיפים ההתנהגותיים ו/או המנמוניים 11,12,13,14,15,16,17,18,19,20,21 . בעוד שמאתגר לקשר בין נקודות זמן התפתחותיות מדויקות בין מוחות של בני אדם ועכברים, השוואות מורפולוגיות והתנהגותיות מצביעות על כך שעכברי p20-p21 מייצגים את הגילאים האנושיים של 2-3 שנים, ועכברי p25-p35 מייצגים את הגילאים האנושיים של 11-14 שנים, כאשר עכברים ככל הנראה מגיעים למקבילה ההתפתחותית של אדם בוגר בן 20 בעמ' 603. 22. לכן, כדי להבין טוב יותר כיצד המוח הצעיר מתפתח ולזהות כיצד הרשתות העצביות של המוח הופכות לבלתי מתפקדות במחלות כמו אוטיזם או סכיזופרניה, יהיה זה אידיאלי לעקוב ישירות אחר פעילות המוח in vivo בעכברים בגילאי 20 יום עד 60 יום.
עם זאת, אתגר בסיסי בניטור פעילות המוח לאורך התפתחות מוקדמת בעכברים הוא גודלם הקטן וחולשתם היחסית של עכברים צעירים. השתלה כרונית של אלקטרודות, הנחוצה למחקרי אורך של התפתחות המוח, דורשת בדרך כלל דיור גדול ומגושם כדי להגן על חוטי האלקטרודות העדינים ולוחות ממשק23,24, והשתלים חייבים להיות מחוברים היטב לגולגולת העכבר, שהיא דקה יותר ופחות נוקשה בעכברים צעירים עקב אוסיפיקציה מופחתת. לפיכך, כמעט כל המחקרים על פיזיולוגיה של מכרסמים in vivo בוצעו בנבדקים בוגרים בשל גודלם היחסי, חוזקם ועובי הגולגולת שלהם. עד כה, רוב המחקרים שחקרו את הפיזיולוגיה של המוח של מכרסמים צעירים בוצעו בחולדות צעירות מסוג בר, מה שבהכרח מגביל את היכולת לעקוב באופן ניסיוני אחר תפקוד המוח הצעיר במודל התנהגות חופשית של הפרעה אנושית 25,26,27,28,29,30.
כתב יד זה מתאר שיכון שתלים חדשני, הליך השתלה כירורגי ואסטרטגיית התאוששות לאחר ניתוח כדי לחקור באופן כרוני את תפקוד המוח in vivo לטווח ארוך (עד 4 שבועות או יותר) של עכברים צעירים על פני חלון זמן קריטי מבחינה התפתחותית (עמ' 20 עד עמ' 60 ואילך). הליך ההשתלה מאפשר הצמדה אמינה וקבועה של האלקטרודות לגולגולות של עכברים צעירים. יתר על כן, עיצוב המיקרו-כונן הוא קל משקל, מכיוון שמיקרו-כונן זה שוקל ~ 4-6 גרם כאשר הוא מורכב במלואו, ובשל האיזון הנגדי המינימלי הנדרש כדי לקזז את משקל השתל, הוא אינו משפיע על הביצועים ההתנהגותיים של עכברים צעירים במהלך פרדיגמות התנהגותיות טיפוסיות.
Protocol
המחקר הנוכחי אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המרכז הרפואי הדרום-מערבי של אוניברסיטת טקסס (פרוטוקול 2015-100867) ובוצע בהתאם להנחיות המוסדיים והמכון הלאומי לבריאות. העכברים הזכרים והנקבות C57/Bl6 ששימשו במחקר הנוכחי הושתלו ב-p20 (משקל 8.3-11.1 גרם בזמן ההשתלה).
1. תכנון ובנייה של מיקרו-כוננים
- עיצוב והדפסה דיגיטליים של המיקרו-כונן (איור 1)
- הורד את תבניות הדגם של כונן המיקרו (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- זהו את המיקומים הסטריאוטקסיים של אזורי המטרה במוח באטלס סטריאוטקסי מתאים.
- באמצעות תוכנת תכנון תלת-ממדית בעזרת מחשב (3D CAD), טען את צינורית המיקרו-כונן של התבנית (איור 1B).
- במידת הצורך, שנה את מיקומי הפלט של צינורית הפלט במודל צינורית המיקרו-כונן כדי לכוון לאזורי המוח הרצויים.
הערה: כל שחול חור צינורית צריך להיות באורך של לפחות 2 מ"מ כדי להבטיח שהטטרוד ייצא מחור הצינורית כשהוא מכוון ישר למטרה. תבנית צינורית המיקרו-כונן מיועדת להתמקד באופן דו-צדדי בפיתול החגורה הקדמי (טטרוד אחד לכל חצי כדור), באזור ההיפוקמפוס CA1 (ארבעה טטרודים לכל חצי כדור) ובאזור ההיפוקמפוס CA3 (שני טטרודים לכל חצי כדור), עם טטרוד ייחוס אחד לכל חצי כדור הממוקם בחומר הלבן מעל אזור ההיפוקמפוס CA1. - במידת הצורך, שנה את גוף המיקרו-כונן (איור 1A) כך שיתאים לחיבור של לוח הממשק האלקטרוני (EIB).
- הדפס את גוף המיקרו-כונן, הצינורית, החרוט והמכסה ברזולוציה גבוהה במדפסת תלת-ממד (רצוי ברזולוציה טובה מ-25 מיקרומטר), והכן את החומרים המודפסים בהתאם לפרוטוקולים של היצרן. השתמש בשרפים של מדפסת עם קשיחות גבוהה.
- הרכבת ברגים ואביזרים מותאמים אישית (איור 2A, B)
- באמצעות תוכנת 3D CAD, טען את מודלי חיבור הבורג (איור 1E).
- הדפס את אביזרי הבורג ברזולוציה גבוהה במדפסת תלת ממד (רצוי ברזולוציה של לפחות 25 מיקרומטר), והכן את החומרים המודפסים בהתאם לפרוטוקולים של היצרן. השתמש בשרפים של מדפסת עם קשיחות גבוהה.
- הצמידו את חיבורי הברגים לכל בורג מקדם טטרוד (איור 1F) (ברגים מקדמי טטרוד מיוצרים בהתאמה אישית בחנות מכונות לפני בניית מיקרו-דרייב).
- הצמידו שני ברגים לכל בורג, עם אחד מעל ואחד מתחת לרכס. ודא שתחתית כל חיבור בורג נוגעת ברכס. החזק את חיבורי הבורג יחד עם ציאנואקרילט ג'ל.
- לאחר ההדבקה, ודא שחיבורי הבורג אינם נעים בציר האורך של הבורג אלא מסתובבים בחופשיות עם התנגדות מינימלית.
- הרכבת גוף המיקרו-כונן (איור 2C, D)
- בעזרת מספריים עדינים וחדים, חותכים צינורות פולימיד גדולים (קוטר חיצוני: 0.2921 מ"מ, קוטר פנימי: 0.1803 מ"מ) למקטעים באורך ~6 ס"מ.
- מעבירים את חלקי הפולימיד הגדולים דרך חורי המוצא בצינורית המיקרו-דרייב, כך שכל צינור משתרע מעבר לתחתית הצינורית בכמה מילימטרים.
- באמצעות מחט נקייה של 30 גרם, הצמד את הפולימיד לצינורית על ידי מריחת כמויות קטנות של ציאנואקרילט נוזלי. היזהר לא לאפשר cyanoacrylate להיכנס לתוך החלק הפנימי של צינור polyimide.
הערה: טפטוף ציאנואקרילט נוזלי לתוך הצינורית דרך החלק העליון של גוף הכונן יכול לזרז תהליך זה, אך ידרוש ניקוי מחדש של חורי המדריך מאוחר יותר עם מקדחה עדינה. - העבירו את צינורות הפולימיד הגדולים מהחלק העליון של צינורית המיקרו-כונן דרך חורי הפולימיד הגדולים המתאימים בגוף המיקרו-כונן.
- דחפו באיטיות את צינורית המיקרו-כונן ואת גוף המיקרו-כונן יחד עד שהם סמוכים וכרטיסיות החיבור של הצינורית/גוף משתלבות. היזהר לא לעקם או לפגוע צינורות polyimide בתהליך.
הערה: כל צינור פולימיד צריך לעבור בצורה חלקה מתחתית הצינורית החוצה דרך החלק העליון של גוף המיקרו-כונן. כיפוף קל הוא נורמלי, אך כיפוף מוגזם של צינור הפולימיד יכול לעקם את הטטרוד ולמנוע ממנו לעבור ישר לתוך המוח. - חברו את גוף המיקרו-כונן ואת צינורית המיקרו-כונן יחד באמצעות ציאנואקרילט.
- בעזרת סכין גילוח חדש וחד, חותכים את קצוות צינור הפולימיד הגדולים הנשפכים מתחתית חורי יציאת הצינורית. ודא כי החתך הוא בדיוק בבסיס הצינורית, מה שהופך את הצינורות ואת תחתית הצינורית סומק אחד עם השני.
- בעזרת מספריים חדים, חותכים את צינור הפולימיד הגדול ממש מעל קצה השפה הפנימית של גוף הכונן בזווית ~ 45 מעלות.
- טעינת הברגים המותאמים אישית שהורכבו (איור 2E)
- הברג כל בורג מותאם אישית שהורכב לתוך החורים החיצוניים של גוף המיקרו-כונן. ודא שעמוד ההנחיה של הבורג עובר דרך החור הגדול בחיבורי הבורג. מקדמים כל בורג באופן מלא עד שהוא לא יתקדם הלאה. מומלץ לשמן מראש את הברגים בשמן מינרלי או בשומן סרן.
- בעזרת מספריים חדים במיוחד, חותכים צינורות פולימיד קטנים (קוטר חיצוני: 0.1397 מ"מ, קוטר פנימי: 0.1016) למקטעים באורך ~4 ס"מ.
- העבירו את חלקי הפולימיד הקטנים דרך צינורות הפולימיד הגדולים שכבר הותקנו במיקרו-כונן. ודא שצינורות פולימיד קטנים עודפים בולטים מהחלק העליון והתחתון של כל צינור פולימיד גדול.
- הצמידו את צינורות הפוליאמיד הקטנים לחיבורי הבורג באמצעות ציאנואקרילט, תוך הקפדה שלא לתת לציאנואקרילט להיכנס לצינורות הפוליאמיד הגדולים או הקטנים.
- בעזרת סכין גילוח חדש וחד, חותכים את קצוות צינור הפולימיד הקטן הנמתח מתחתית חורי הצינורית. ודא כי החתך הוא בדיוק בבסיס הצינורית וכי החתך נקי, ללא שום דבר חוסם את חור צינור polyimide.
- בעזרת מספריים חדים, חותכים את החלק העליון של הפולימיד הקטן כמה מילימטרים מעל החלק העליון של חיבור הבורג בזווית ~ 45 מעלות. ודא שהחתך נקי, ללא שום דבר שחוסם את חור צינור הפולימיד.
- טעינת הטטרודים
- הכינו את הטטרודים (~ 6 ס"מ אורך) בשיטות שתוארו קודם לכן31.
- באמצעות מלקחיים קרמיים או גומי, מעבירים בזהירות טטרוד דרך אחד מצינורות הפולימיד הקטנים, ומשאירים ~ 2 ס"מ בולטים מראש צינור הפולימיד הקטן.
- הצמידו את הטטרודה לחלק העליון של צינור הפולימיד הקטן באמצעות ציאנואקרילט נוזלי, תוך הקפדה שלא להצמיד את צינורות הפולימיד הקטנים והגדולים זה לזה בתהליך.
- משוך את הבורג עד שהוא קרוב לחלק העליון של הכונן.
- תפוס את חוט הטטרוד הבולט מתחתית הכונן, וסובב אותו בעדינות בנקודה שבה הוא יוצא מהצינורית.
- החזירו את הבורג במלואו לכונן.
- באמצעות מספריים חדים מאוד, לחתוך את חוט tetrode ממש מעל פיתול. תחת מיקרוסקופ, ודא כי החתך נקי וכי המתכת של כל ארבעת הטטרודים חשופה.
- משוך את הבורג עד שהטטרוד מאובטח בתוך הצינורית.
- חזור על שלבים 1.5.2-1.5.8 עבור כל הברגים.
- חבר את ה-EIB לפלטפורמת התמיכה של EIB באמצעות ברגי תכשיטים קטנים.
- חבר כל אלקטרודה של כל טטרוד ליציאה המתאימה ב-EIB.
- הכנת המיקרו-דרייב לניתוח
- לוחית חשמלית את הטטרודים כדי להפחית את העכבה החשמלית באמצעות שיטות שתוארו לעיל31.
- לאחר הציפוי, יש לוודא שכל טטרוד שוכן בתוך הצינורית כך שקצה הטטרודה יהיה צמוד לתחתית כל חור צינורית.
- החלק את חרוט כונן המיקרו סביב כונן המיקרו שהושלם. חבר את מכסה כונן המיקרו לקונוס המיקרו-כונן על-ידי החלקת מוט חיבור החרוט לתוך יציאת המכסה.
- כיוון את החרוט כך שמחברי EIB יעברו בחופשיות דרך חורי המעבר של חיבור EIB כאשר המכסה סגור, והדביק את החרוט במקומו עם ציאנואקרילט הממוקם סביב בסיס החרוט, תוך הקפדה שלא לתת לציאנואקרילט להיכנס לאף אחד מחורי יציאת הצינורית. הסירו את המכסה.
- מלאו בזהירות כל חור צינורית בשמן מינרלי סטרילי כדי למנוע מנוזלי גוף להיכנס לחורי הפולימיד לאחר השתלה כירורגית.
- בזהירות לצפות את הבסיס של הצינורית עם ג'ל פטרולאום סטרילי. זה ישמש מחסום למניעת חומרים כימיים (למשל, מלט דנטלי) מלהיכנס למוח החשוף במהלך הניתוח.
- שקלו את המיקרו-דרייב, המכסה וארבעת ברגי העצם המורכבים במלואם כדי להכין משקל נגדי שווה.
- לחלופין, לפני הניתוח, יש לחלץ את הטטרודים למרחק המתאים להגעה לאזורי המטרה במוח ברגע שהכונן סמוק עם הגולגולת.
הערה: לפני השתלה כירורגית, יש לעקר את השתל באמצעות עיקור גז באתילן אוקסיד (500-1200 מ"ג/ליטר, 2-4 שעות). יש לעקר את כל ברגי העצם וכלי הניתוח באמצעות אוטוקלאבה (121°C, 30 דקות).
2. השתלה כירורגית
- הרדמת העכבר והרכבתו במנגנון הסטריאוטקסי
- מניחים את העכבר בקופסה קטנה עם מספיק מקום לזוז, ומרדים את העכבר עם 3%-4% isoflurane.
הערה: ניתן להשתמש בחומרי הרדמה אחרים, אך יש לנקוט משנה זהירות בשל גילו, גודלו ומשקלו של נבדק העכבר הצעיר. - ברגע שהעכבר אינו מגיב (אין תגובה לצביטת זנב, קצב אוורור של ~60 נשימות לדקה), הסר אותו מהקופסה והרכיב אותו במהירות על המנגנון הסטריאוטקסי.
- במהירות, הניחו את המסכה הסטריאוטקסית על חוטמו של העכבר ושמרו על הרדמה באיזופלורן 1-3%. יש למרוח כל שיכוך כאבים שאושר על ידי הווטרינריה, כגון בופרנורפין בשחרור מושהה (0.05-0.5 מ"ג/ק"ג תת עורי), או חומרים אנטי דלקתיים, כגון קרפרופן (5-10 מ"ג/ק"ג תת עורי), לפני החתך הניתוחי הראשוני.
- אבטח באופן מלא את ראש העכבר במנגנון הסטריאוטקסי באמצעות מוטות אוזניים. ודא שהגולגולת ישרה ולא ניידת מבלי להפעיל לחץ מיותר על תעלות האוזן של העכבר. בשל התנודה המוגבלת של עצמות גולגולת צעירות, ניתן לגרום נזק בלתי הפיך במהלך קיבוע הראש.
- מניחים את העכבר בקופסה קטנה עם מספיק מקום לזוז, ומרדים את העכבר עם 3%-4% isoflurane.
- הכנת העכבר לניתוח וחשיפת הגולגולת
- הגן על עיני העכבר על ידי הנחת נפח קטן של ג'ל דמעות סינתטי על כל עין וכיסוי כל עין עם טלאי אוטוקלב של נייר כסף.
הערה: הדמעות הסינתטיות ישמרו על לחות העיניים, בעוד שנייר הכסף ימנע מכל מקור אור לגרום נזק לטווח ארוך. תמיסות דמעות סינתטיות עבות יותר מועדפות מכיוון שהן יכולות לשמש גם כמחסום בפני החדרה לא מכוונת של פתרונות כירורגיים אחרים שעלולים להיות רעילים (אתנול, אקריליק דנטלי וכו ') לתוך העיניים. - בעזרת מקלוני כותנה סטריליים, יש למרוח קרם להסרת שיער על אזור הניתוח כדי להסיר את השיער מהקרקפת. היזהרו לא לקרב את הקרם לעיניים. לאחר הסרת השיער, הניחו וילון סטרילי על הקרקפת כדי לאבטח את אזור הניתוח.
- באמצעות מקלוני צמר גפן סטריליים, נקו את הקרקפת באמצעות שלוש שטיפות רצופות של תמיסת פובידון-יוד (10%) ואחריה איזופרופיל אלכוהול (100%).
- בעזרת אזמל סטרילי או מספריים עדינים, הסירו את הקרקפת.
- באמצעות מקלוני כותנה סטריליים ותמיסות סטריליות של תמיסת מלח (0.9% NaCl) ומי חמצן, יש לנקות היטב את הגולגולת.
- זהה ברגמה, ובאמצעות המנגנון הסטריאוטקסי, סמן בזהירות את מיקומי הקלטת המטרה על הגולגולת עם סמן קבוע.
- הגן על עיני העכבר על ידי הנחת נפח קטן של ג'ל דמעות סינתטי על כל עין וכיסוי כל עין עם טלאי אוטוקלב של נייר כסף.
- פתיחת חור הצינורית וחיבור עוגני העצם
- הסר את הגולגולת המכסה את אתרי ההקלטה. # בשל רזון הגולגולת בגיל זה, חתכו את הגולגולת עם להב אזמל; זה מבטל את הצורך להשתמש במקדחה, שעלולה לפגוע בדורא הבסיסית. שמור על הדורה החשופה לחה בעזרת מריחת תמיסת מלח סטרילית (0.9% NaCl) או שמן מינרלי סטרילי. אין להסיר או לנקב את הדורה בשלב זה, מכיוון שהיא דקה מספיק בעכברים צעירים כדי שהטטרודים יוכלו לעבור דרכה בצעדים עתידיים.
- קדח בזהירות חורי טייס עבור ארבעה ברגי עצם.
- הניחו את ברגי העצם בחלקים הרוחביים והרוסטרליים או הקאודליים הקיצוניים של הגולגולת, היכן שהעצם עבה ביותר וברגי העצם רחוקים מספיק משתל המיקרו-דרייב. עבור ברגי העצם, השתמש בברגי תכשיטים סטריליים ועדינים (למשל, חוט UNM 120, ראש 1.5 מ"מ).
- יש לסובב בחוזקה בורג עצם אחד באמצעות חוט דק בעל מוליכות גבוהה שישמש כהארקה ויחובר ל-EIB בשלב 2.4.6.
- באמצעות להב אזמל או בזהירות באמצעות מקדחה, הניקוד את הגולגולת ליד מיקומי חור בורג העצם. הניקוד חשוב כדי לספק משטח מחוספס מספיק עבור ציאנואקרילט נוזלי להיקשר בשלב 2.3.5.
- בעזרת מברג סטרילי ומהדק בורג סטרילי, משחילים כל בורג עצם סטרילי למקומו, תוך הקפדה שלא לחדור את הדורא שמתחתיו.
- בעזרת מחט סטרילית של 30 גרם, מניחים ציאנואקרילט נוזלי סביב כל בורג עצם. זה למעשה מעבה את הגולגולת שבה ברגי העצם היו מחוברים. יש להקפיד לא לאפשר לציאנואקרילט להיכנס לדורה החשופה מעל אתרי ההקלטה.
- הנמכה וחיבור של כונן המיקרו (איור 2G)
- הרכיבו את כונן המיקרו שהושלם על המנגנון הסטריאוטקסי כדי להוריד בזהירות על גולגולת העכבר. ודא שצינורית המיקרו-כונן תהיה בקואורדינטות המתאימות בעת הורדתה.
- הנמיכו את המיקרו-דרייב לאט, ונעו רק בכיוון הגבי/גחוני. הנמיכו את המיקרו-דרייב עם הטטרודים שכבר התקדמו מתוך חורי הצינורית (שלב 1.6.6) כדי לדמיין את כניסתם למוח; כל תנועה מדיאלית/צידית או רוסטרלית/קאודלית כאשר הטטרודים נוגעים בעכבר יכולה לכופף את הטטרודים ולגרום להם להחמיץ את יעדם הסופי.
- לאחר הורדת המיקרו-כונן במלואה, ודא שבסיס הצינורית רק יוצר מגע עם הגולגולת/דורה. שכבת ג'ל הפטרולאום ו/או השמן המינרלי תשמש מחסום לכיסוי הדורא החשוף. במידת הצורך, הוסיפו וזלין סטרילי או שעוות עצם סטרילית כדי לכסות דורה חשופה עודפת.
- תוך כדי החזקת המיקרו-כונן במקומו עם המנגנון הסטריאוטקסי, צפו את הגולגולת במלט דנטלי כדי להצמיד את בסיס המיקרו-כונן לברגי העצם המושתלים.
הערה: הצמנט הדנטלי צריך לעטוף באופן מלא את כל ברגי העצם וצריך לכסות את אדן העוגן של צמנט השיניים על צינורית המיקרו-דרייב. - בזמן שהמלט הדנטלי שוקע, עצבו אותו בזהירות כדי למנוע פינות או קצוות חדים שעלולים לפגוע בעכבר או לפגוע במיקרו-כונן. ודאו שיש מספיק מלט דנטלי כדי להחזיק את המיקרו-דרייב, אך הימנעו מעודף מלט דנטלי שיוסיף משקל מיותר.
- השחיל בזהירות את חוט הארקה דרך כונן המיקרו, וחבר אותו לחריץ המתאים ב- EIB.
- לאחר שהמלט הדנטלי מוגדר במלואו, נתק בזהירות את המיקרו-כונן מהמנגנון הסטריאוטקסי. הניחו את המכסה על כונן המיקרו.
- בעזרת צמר גפן סטרילי ומלוחים סטריליים, נקו את העכבר.
- בעזרת צמר גפן סטרילי, יש למרוח שכבה דקה של משחה אנטיביוטית על כל קרקפת חשופה בסמוך לאתר השתל.
- הסר את נייר הכסף מעיני העכבר.
- הסר את העכבר מהמנגנון הסטריאוטקסי, תוך הקפדה על תמיכה במשקל הנוסף של כונן המיקרו כאשר העכבר מועבר לכלוב נקי.
3. התאוששות לאחר הניתוח
- החלמה מיידית
- לפני הניתוח, הכינו את מערכת שיווי המשקל על-ידי חיבור צינור PVC בקוטר 0.75 אינץ', כפי שמוצג באיור 2G. זרוע אחת של המערכת עוברת דרך חורים שנקדחו במכסה הכלוב, הזרוע השנייה מונחת על מכסה הכלוב, והזרוע השלישית משתרעת מעל ומעבר לכלוב. הזרוע העליונה מכוסה.
- חברו בזהירות את המיקרו-כונן למערכת האיזון הנגדי (איור 2G-I), והשתמשו במשקל איזון זהה למשקל המיקרו-כונן וברגי העצם. הפעל חוט חזק או קו דיג ממחבר המחובר ל- EIB מעל שלוש הזרועות של מערכת האיזון הנגדי למשקל המאזן, התלוי מעל הזרוע העליונה.
- ודא שהאיזון הנגדי מחובר היטב ל-EIB של מיקרו-כונן ושיש מספיק קו כדי לתת לעכבר גישה מלאה לכל הכלוב.
- ספקו ג'ל עשיר בחומרים מזינים בכלוב לצד צ'או מכרסמים רגיל לח כדי להבטיח התייבשות והתאוששות.
- עקוב אחר העכבר עד שהוא מתאושש לחלוטין מההרדמה הכירורגית.
- התאוששות ארוכת טווח
- בכל עת, כאשר אינו מחובר לציוד ההקלטה, ודא שהמיקרו-כונן נתמך על ידי מערכת האיזון הנגדי. הפחיתו את משקל הנגד לאורך זמן, אך לעולם אל תסירו אותו לחלוטין כדי למנוע לחץ בלתי צפוי על העכבר או מומנט לברגי העצם.
- כדי למנוע נזק לשתל ולמערכת שיווי המשקל, שכן את העכבר ללא אפשרות לאינטראקציה ישירה עם עכברים אחרים למשך הניסוי.
- לספק ג'ל עשיר בחומרים מזינים לפחות 3 ימים לאחר הניתוח, ואז מזון מוצק לבדו יהיה מספיק.
- בשל דרישות התקורה של מערכת האיזון הנגדי, אין לספק מזון ומים ברשת תיל תקורה; הניחו את המזון על רצפת הכלוב, וספקו מים דרך דופן הכלוב. כדי למנוע קלקול, להחליף את המזון לחלוטין מדי יום.
- מדי יום, ודא שלעכבר יש גישה חופשית לכל הכלוב ושאיזון הנגד מחובר חזק וחזק למיקרו-כונן.
תוצאות
הפרוטוקול המתואר לעיל שימש להקלטת אותות פוטנציאליים בשדה מקומי ויחידות בודדות מאזורי מוח מרובים בו זמנית בעכברים, עם הקלטות יומיות שנערכו באותם עכברים מ-p20 עד p60. להלן מדווחים הקלטות אלקטרופיזיולוגיות מייצגות משני עכברים והיסטולוגיה שלאחר הניסוי המדגימות את מיקומי ההקלטה הסופיים.
השתלה כירורגית של המיקרו-דרייב בעכברי p20
מיקרו-כונן (איור 1) נבנה (איור 2) והושתל בניתוח בעכבר p20, כפי שתואר לעיל. מיד לאחר הניתוח, העכבר חובר למערכת שיווי המשקל (איור 2G-I) ואיפשר לו להתאושש. ברגע שהעכבר היה נייד לחלוטין, המיקרו-כונן חובר למערכת הקלטה אלקטרופיזיולוגית in vivo. הכבלים שחיברו את המיקרו-כונן לציוד ההקלטה היו תלויים מעל העכבר. רישומים אלקטרופיזיולוגיים (32 קילוהרץ) התקבלו בכל התעלות במשך שעה אחת בזמן שהעכבר התנהג באופן טבעי בכלוב הביתי שלו. בעקבות ההקלטה נותק העכבר ממערכת ההקלטה, חובר מחדש למערכת האיזון והוחזר לוויבריום עם גישה חופשית למים ולצ'או.
רישום יומי של פעילות עצבית
רישומים אלקטרופיזיולוגיים הושגו מדי יום במשך מספר שבועות כדי לאפשר ניטור כרוני של אותו אזור במוח על פני חלונות ההתפתחות הקריטיים של p20-p60. פוטנציאלי שדה מקומיים גולמיים (LFP) לדוגמה מכל ההקלטות הכרוניות מוצגים באיור 3A,C. יחידות בודדות בודדות התקבלו בו זמנית מטטרודים מרובים (איור 3B). יחידות עם צורות גל דומות זוהו במשך מספר ימים (איור 3B, אמצעי וימני), אולם בשל הסחיפה הפוטנציאלית של אלקטרודת ההקלטה, לא ניתן היה לטעון בוודאות שאותה יחידה זוהתה לאורך ימים. בעכבר נפרד שהושתל ב-p20 ותועד מדי יום במשך מספר שבועות, נבדקה פעילות עצבית על טטרוד המכוון לאזור הגבי CA1. אדוות באמפליטודה גדולה ויחידות בודדות מבודדות היטב זוהו בכל יום של ההקלטה (איור 4). נתונים אלה מצביעים על כך שהקלטות אלקטרופיזיולוגיות יציבות ואיכותיות in vivo יכולות להיות מאותו עכבר לאורך ההתפתחות המוקדמת.
אישור היסטולוגי של אתרי ההקלטה וההשפעה ההתפתחותית של השתלה כרונית
לאחר יום ההקלטה האחרון, העכבר הורדם ביסודיות באמצעות הרדמה איזופלורנית ואחריה זריקה קטלנית של נתרן פנטוברביטל, וזרם הועבר דרך קצות האלקטרודות כדי לייצר נגעים קטנים באתרי ההקלטה. חתך היסטולוגי של מוח העכבר לאחר הניסוי איפשר הדמיה של אתרי ההקלטה הסופיים (איור 5A,B). בקבוצה נפרדת, שלושה עכברים זכרים ושלוש נקבות הושתלו בניתוח ב-p20 כמתואר לעיל. מספר שווה של ליטרמטים נותרו ללא השתלה והוחזקו בתנאי דיור זהים. העכברים הוקרבו בעמ' 62 (6 שבועות לאחר הניתוח עבור הקבוצה המושתלת). הגולגולות נוקו בקפידה, ונלקחו מדידות חיצוניות של מרחק ברגמה ללמדא (איור 5C, למעלה משמאל) ורוחב גולגולת מקסימלי חיצוני בלמדא (איור 5C, למעלה מימין). בוצע חתך לאורך קו האמצע של הגולגולת, וחצי מהגולגולת הוסר כדי להוציא את המוח למדידת מסה (איור 5C, למטה מימין). גובה חלל הגולגולת בברגמה נמדד ממחצית הגולגולת השלמה (איור 5C, למטה משמאל). אף מדד לא היה שונה באופן משמעותי בין הקבוצות המושתלים והלא מושתלים (Wilcoxon rank-sum test), מה שמצביע על כך שלהשתלה ארוכת טווח, החל מ-p20, אין השפעה גסה על ההתפתחות הטבעית של נפח הגולגולת או המוח.

איור 1: רכיבי מיקרו-כונן. עיבודים תלת-ממדיים של (A) גוף המיקרו-כונן, (B) צינורית, (C) חרוט, (D) מכסה, (E) חיבורי בורג, ו-(F) בורג מקדם טטרוד. התכונות הקריטיות של כל רכיב מסומנים. ניתן לחלץ פרטי מדידה מקובצי הדגם הזמינים https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: בניית מיקרו-דרייב . (A) מבט צדדי ו-(B) מבט מלמעלה על בורג מתקדם טטרוד עם חיבורי הבורג העליון והתחתון מחוברים. (C) מבט צדדי ו-(D) עליון של המיקרו-כונן עם הגוף והצינורית מחוברים וצינורית הפוליאמיד הגדולה העוברת דרך כל חור צינורית ונחתכת לתחתית הצינורית. (E) מבט צדדי על המיקרו-כונן עם הברגים וצינורות הפולימיד הקטנים במקומם. החלק העליון של צינורות הפולימיד הקטנים נחתך מיד לפני העמסת טטרוד. (F) מיקרו-כונן שהושלם המחובר למנגנון הסטריאוטקסי. חרוט המגן שבדרך כלל היה מקיף את כונן המיקרו הוסר למטרות הדמיה. שים לב שחלק מחיבורי הברגים הודפסו בשרף שחור עבור מיקרו-כונן זה. (ז) מערכת תמיכה באיזון נגדי. (ח) מבט צדדי ו-(I) עליון של כלוב עכבר עם מערכת תמיכה לאיזון נגדי מחוברת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
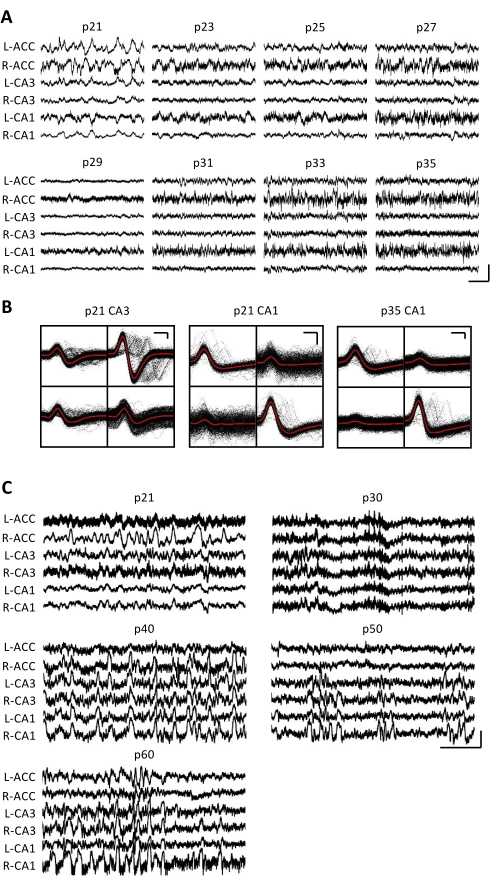
איור 3: רישומים אלקטרופיזיולוגיים מייצגים. עכבר p20 הושתל עם מיקרו-כונן כמתואר לעיל. החל מ-p21 וכל יום לאחר מכן במשך שבועיים, העכבר היה מחובר למכשיר ההקלטה, והפעילות העצבית נרשמה במשך שעה אחת לפחות. (A) הקלטות פוטנציאל שדה מקומי גולמי (LFP) מהדו-צדדי (L = משמאל; R = ימין) פיתול החגורה הקדמי (ACC), אזור ההיפוקמפוס CA3 (CA3) ואזור ההיפוקמפוס CA1 (CA1). הנתונים נאספו מדי יום; לשם הבהרה, מוצגים רק נתונים מימים אי-זוגיים. כל העקבות נלקחו בתקופות של חוסר תנועה בכלוב הביתי. סרגל קנה מידה: 1 mV, 2 s. (B) יחידות בודדות מייצגות שבודדו מאזור ההיפוקמפוס CA3 (משמאל) ו-CA1 (מימין) עבור ההקלטות בלוח A. כל צורות הגל הגולמיות על כל אלקטרודה מוצגות בשחור; הממוצע הוא באדום. סרגל קנה מידה: 50 μV, 0.2 אלפיות השנייה. (C) עקבות LFP גולמיים מייצגים עבור כל יום עשירי עד ליום ההקלטה הסופי בעמ' 60 עבור עכבר שני שהושתל בעמ' 20. הנתונים נאספו מדי יום; לשם הבהרה, מוצגים רק נתונים מכל יום עשירי. כל העקבות נלקחו בתקופות של חוסר תנועה בכלוב הביתי. סרגל קנה מידה: 1 mV, 2 שניות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
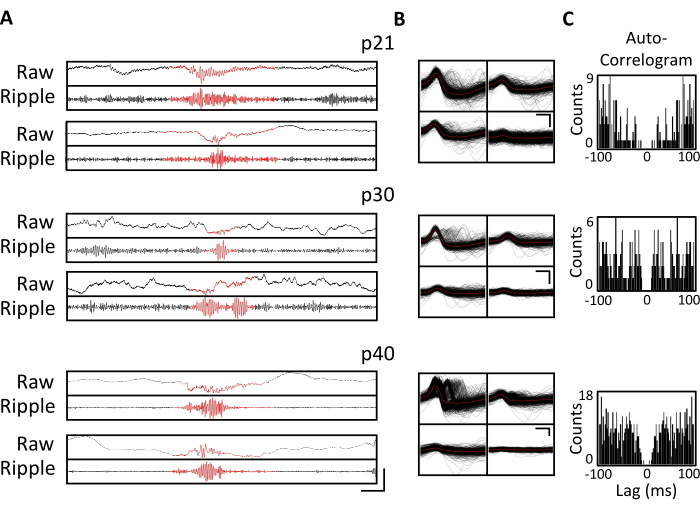
איור 4. יציבות ההקלטות הכרוניות. עכבר p20 הושתל עם מיקרו-כונן, כמתואר לעיל. החל מעמ' 21 ולאחר מכן במשך 4 שבועות, העכבר היה מחובר למכשיר ההקלטה, והפעילות העצבית נרשמה במשך שעה אחת לפחות. מוצגים נתונים מהטטרודים המכוונים ל-CA1 של ההיפוקמפוס הגבי. (A) LFP גולמי (למעלה) ומסונן אדווה (למטה) עבור אירועי אדווה מזוהים בעמ' 21, עמ' 30 ו-p40. כדי לזהות אירועי אדווה, ה-LFP הגולמי סונן בפסים בין 125 הרץ ל-300 הרץ, ואירועי האדוות זוהו כעליות חולפות בעוצמת פס האדווה הגדולה מ-3 סטיות תקן מעל הממוצע. ההתחלה והסוף של כל אדווה הוגדרו כנקודה שבה עוצמת פס האדווה חזרה לממוצע. האדוות המזוהות מוצגות באדום. סרגל קנה מידה: 100 אלפיות השנייה, מלמעלה למטה: 1,000 μV, 140 μV, 1,800 μV, 180 μV, 9,000 μV, 1,200 μV, 10,000 μV, 1,000 μV. (B) יחידה יחידה מייצגת מכל יום מהטטרוד הממוקד CA1 עבור ההקלטות בלוח A. כל צורות הגל הגולמיות על כל אלקטרודה מוצגות בשחור; הממוצע הוא באדום. סרגל קנה מידה 0.2 אלפיות השנייה, מלמעלה למטה: 50 μV, 100 μV, 100 μV. (C) אוטוקורלוגרמה של כל הדוקרנים עבור יחידות בודדות בלוח B. נתונים אלה מראים מיקום אלקטרודות יציב בתוך שכבת הפירמידה של ההיפוקמפוס במשך מספר שבועות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: היסטולוגיה מייצגת והשפעה על התפתחות הגולגולת. עכבר p20 הושתל עם מיקרו-כונן, כמתואר לעיל. לאחר יום ההקלטה האחרון בעמ' 60, נוצרו נגעים אלקטרוליטיים באתרי ההקלטה, והמוח היה מחורר עם 4% פרפורמלדהיד. לצורך זיהוי אתרי ההקלטה הופקו קטעי 50 מיקרומטר. (A) נגעים ב-CA1 וב-CA3 של ההיפוקמפוס. ראש החץ מציין את אתר ההקלטה CA3; ראש החץ הכפול מציין את אתר ההקלטה CA1. סרגל קנה מידה: 0.5 מ"מ. (B) נגעים ב- ACC הדו-צדדי. ראשי החצים מציינים את אתרי ההקלטה של ACC. סרגל קנה מידה: 0.5 מ"מ. (C) גודל גולגולת ומדידות מסת מוח של עכברי p62 שהושתלו עם מיקרו-כונן ב-p20 (אפור) וליטרמטים לא מושתלים (לבן). ערך ה-p של מבחן סכום הדירוג של וילקוקסון מדווח עבור כל מדידה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
ניסויים מודרניים החוקרים את תפקוד המעגל העצבי in vivo במכרסמים משתמשים לעתים קרובות באלקטרופיזיולוגיה חוץ-תאית באמצעות אלקטרודות מושתלות לצמיתות כדי לנטר את פעילותם של נוירונים בודדים (כלומר, יחידות בודדות) או אוכלוסיות מקומיות (באמצעות פוטנציאלי שדה מקומיים, LFP), אך שיטות כאלה מיושמות רק לעתים רחוקות על עכברים צעירים עקב אתגרים טכניים. כתב יד זה מתאר שיטה להשגת רישומים אלקטרופיזיולוגיים in vivo בעכברים לאורך החלונות הקריטיים מבחינה התפתחותית של p20 עד p60 ומעבר לכך. מתודולוגיה זו כוללת תהליך ייצור להדפסה ובנייה של שתל מיקרו-כונן, הליך השתלה כירורגי ואסטרטגיית התאוששות לאחר ניתוח, שכולם מותאמים במיוחד לשימוש בעכברים צעירים. מספר שיקולים השפיעו על פיתוח פרוטוקול זה, כולל גודלם הקטן וחולשתם היחסית של עכברים צעירים בהשוואה לעמיתיהם הבוגרים, כמו גם התנודה המופחתת של גולגולת העכבר הצעיר שאליה היה צורך לחבר את המיקרו-דרייב.
שתי שיטות עיקריות המשמשות בדרך כלל לביצוע אלקטרופיזיולוגיה in vivo הן מערכים של אלקטרודות (למשל, טטרודים) ובדיקות סיליקון. גשושיות סיליקון הן קלות משקל, יכולות לספק מספר רב של אתרי הקלטה ליחידת משקל, ושימשו בעבר בחולדות צעירות25. עם זאת, בדיקות סיליקון יקרות יחסית ליחידה. לעומת זאת, ניתן לבנות את המיקרו-כונן המתואר בכתב יד זה באמצעות פחות מ-50 דולר ארה"ב בחומרי גלם, מה שהופך אותו לאופציה חסכונית להקלטה in vivo . בנוסף, גשושיות סיליקון חייבות לעתים קרובות להיות מושתלות בקווים קבועים, מה שאוסר על רישום של אזורי מוח מגוונים מרחבית. לעומת זאת, עיצוב המיקרו-כונן המתואר בכתב יד זה משתמש בטטרודים הניתנים לכוונון עצמאי כדי להכיל הקלטות בו זמנית בעד 16 מיקומים שונים כמעט ללא הגבלה על הקשר המרחבי בין מיקומים אלה. ניתן לשנות בקלות את עיצוב המיקרו-כונן הזה כדי לאפשר מיקוד למיקומים שונים מאלה המתוארים כאן על ידי הזזת שחול חור הצינורית לכל מיקום קדמי/אחורי ומדיאלי/דיסטלי רצוי. כאשר מתמקדים באזורים חלופיים במוח, חשוב לציין כי בעוד שהטטרודים ינועו לעתים קרובות ישר, ייתכן שהחוטים הדקים האלה יוסטו מעט כשהם יוצאים מצינורית המיקרו-הינע. לכן, ככל שאזור המוח קטן יותר או גחוני יותר, כך יהיה מאתגר יותר לתקוף בהצלחה את האזור עם טטרודים.
שתל המיקרו-כונן המתואר בכתב יד זה דומה ביסודו למספר עיצובים קודמים מבוססי מיקרו-כונן מבוססי טטרוד23,32,33,34,35 בכך שהטטרודים הבודדים מוצמדים לברגים, המאפשרים שליטה עדינה בעומק ההקלטה של כל טטרוד. בעוד שמספר תכונות של תכנון המיקרו-כונן הנוכחי הן ייחודיות, כולל הקלות של התמקדות באזורי מוח מבוזרים מרחבית, החידוש העיקרי של כתב היד הנוכחי הוא תיאור אסטרטגיות השתלה כירורגית והתאוששות לאחר ניתוח, המאפשרות מחקרים כרוניים של פעילות הרשת בעכברים צעירים שעדיין מתפתחים. ואכן, ניתן להתאים את מתודולוגיות הניתוח וההחלמה המתוארות כאן לתמיכה בשתלים אחרים בעכברים צעירים.
כדי לשמור על רישום עקבי לאורך מספר ימים, החוטים או הגשושיות חייבים להיות מודבקים באופן קשיח על הגולגולת. בעוד המבנה הכללי של גולגולת העכבר עובר שינויים קלים בלבד לאחר p20, הגולגולת מתעבה במידה ניכרת בין הגילאים p20 ו p4536. ואכן, הגולגולת בעמ' 20 אינה קשיחה מספיק כדי לתמוך בשתל מחובר מבלי להיפגע. כדי להתגבר על מגבלה ביולוגית זו, פרוטוקול זה מעבה באופן מלאכותי את הגולגולת באמצעות ציאנואקרילט במהלך ניתוח ההשתלה. השתלה בעכברים מתחת ל-p20 אפשרית ככל הנראה באמצעות אסטרטגיה זו, אך גולגולת העכבר עוברת שינויים ניכרים בגודל ובצורה עד p2036 בערך. לפיכך, השתלה ממושכת בעכברים מתחת ל-p20 אינה מומלצת, שכן הציאנואקרילט וברגי העצם הקבועים בגולגולת שעדיין מתפתחת עלולים להשפיע באופן משמעותי על הצמיחה הטבעית של הגולגולת ועל התפתחות רקמת המוח שמתחתיה. חשוב לציין שבמחקר זה לא נצפתה השפעה על המדידות הגסות של גודל הגולגולת או המוח לאחר השתלה כרונית החל מ-p20 (איור 5C).
שלב קריטי בשיטה המתוארת בכתב יד זה הוא אסטרטגיית ההתאוששות לאחר הניתוח; על פי אסטרטגיה זו, משקל השתל צריך להיות מאוזן באופן רציף ככל שהעכבר מתבגר ועובר פיתוח מערכת השרירים והשלד. בשלב מוקדם לאחר ההשתלה, עכברים אינם מסוגלים לשאת בהצלחה את משקל השתל ללא איזון נגדי, מה שמוביל לתת תזונה והתייבשות מכיוון שהעכבר אינו יכול להגיע כראוי למקורות המזון והמים בכלוב שלו. מערכת האיזון קלה וזולה לבנייה, טריוויאלית ליישום, ומאפשרת לעכברים בכל גיל מושתל לחקור בחופשיות את כל הכלוב הביתי שלהם, ובכך להבטיח תזונה נאותה והידרציה. ככל שהעכברים מזדקנים, ניתן להפחית את כמות האיזון הנגדי עד שניתן יהיה להסיר אותו לחלוטין בעכברים בוגרים; עם זאת, המשך השימוש במערכת האיזון הנגדי מומלץ למשך הניסוי עם משקל נגד נומינלי לפחות מחובר בכל עת. בעוד עכבר בוגר עשוי להיות מסוגל לשאת את הגודל והמשקל של המיקרו-כונן לאורך זמן, תנועה טבעית מתמשכת במהלך התנהגות חופשית ללא משקל נגד מקל מייצרת מומנט וכוח גזירה על ברגי העצם שמעגנים את המיקרו-כונן אל הגולגולת, מה שהופך אותה לסיכוי הולך וגובר להתנתק, במיוחד במהלך ניסויים כרוניים ארוכים יותר.
שתי מגבלות חשובות ראויות לציון במחקר הנוכחי. ראשית, כדי להעריך את ההשפעה של השתלה ב-p20 על התפתחות הגולגולת והמוח, כמה קבוצות של עכברים הוקרבו לאחר השתלה ממושכת (איור 5C). בעוד שניתוחים אלה לא גילו השפעה משמעותית של ההשתלה על גודל חלל הגולגולת או מסת המוח (איור 5C), המחקר הנוכחי לא בחן את גודל הגולגולת או מסת המוח בנקודות זמן מרובות לאורך תקופת ההתפתחות המוקדמת של p20-p60. בעוד עבודות קודמות מראות כי התפתחות חלל המוח הושלמה על ידי p2036, ייתכן כי השתלה בחלון מוקדם זה עשויה לייצר שינויים בלתי צפויים אשר מתוקנים או מפוצים על ידי הגילאים הבוגרים שהוערכו כאן. שנית, הניסויים שהפיקו את הנתונים האלקטרופיזיולוגיים שמוצגים באיור 3 ובאיור 4 לא תוכננו למקסם את תפוקת התא. לכן, בעוד הנתונים המוצגים כאן מראים הקלטות יציבות וכרוניות ויחידות בודדות מבודדות היטב, אין לראות בהם כמייצגים את התפוקה הפוטנציאלית המקסימלית עבור מכשיר זה.
הפרעות נוירולוגיות ופסיכיאטריות רבות בבני אדם מתבטאות בתקופות של התפתחות מוקדמת או לאורך גיל ההתבגרות, כולל אוטיזם וסכיזופרניה. עם זאת, מעט ידוע על תפקוד לקוי ברמת המעגל שעשוי לעמוד בבסיס מחלות אלה, למרות שפע דגמי עכברים זמינים. זיהוי השינויים הראשוניים ברשת הוא קריטי ליצירת אסטרטגיות גילוי מוקדם ופרדיגמות טיפול. עם זאת, בשל אתגרים טכניים, עדיין לא ברור כיצד תפקוד הרשת משובש לאורך הפיתוח במודלים עכבריים של מחלות נוירופסיכיאטריות. אסטרטגיית המיקרו-כונן וההתאוששות המתוארת כאן נועדה לתמוך בחקירות של התפתחות רשת מוחית רב-אזורית במוח העכבר, ובכך לאפשר לחוקרים למדוד התפתחות מוחית בריאה כמו גם לזהות שינויים בהתפתחות זו במודלים של מחלות עכבריות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.), ו- F99NS12053 (L.D.Q.) ופרס UT Southwestern GSO Endowment Award (R.J.P. ו- L.D.Q). המחברים מודים לג'ני סקאריה (בית הספר לרוקחות של המרכז למדעי הבריאות באוניברסיטת טקסס טק) על הסיוע הטכני ולד"ר ברנדון ווטסון (אוניברסיטת מישיגן) על הצעות מתודולוגיות.
Materials
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
References
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved