Method Article
Genç farelerde kronik tetrod kayıtları için hafif tahrikli bir implant
Bu Makalede
Özet
Burada, doğum sonrası gün 20'den (p20) doğum sonrası gün 60'a (p60) ve ötesine kadar kritik bir gelişimsel pencerede aynı anda birden fazla beyin bölgesinden kronik alan ve tek üniteli kayıtlara izin veren bir mikro sürücü tasarımı, cerrahi implantasyon prosedürü ve ameliyat sonrası iyileşme stratejisini açıklıyoruz.
Özet
İn vivo elektrofizyoloji, bozulmamış beynin ikinci seviye altı devre dinamiklerine benzersiz bir bakış açısı sağlar ve insan nöropsikiyatrik bozukluklarının fare modellerini incelemek için özel öneme sahip bir yöntemi temsil eder. Bununla birlikte, bu tür yöntemler genellikle erken gelişimsel zaman noktalarında farelerde kullanılamayan büyük kranial implantlar gerektirir. Bu nedenle, bu kritik pencerede nörolojik gelişimin daha iyi anlaşılmasının otizm veya şizofreni gibi yaşa bağlı gelişimsel bozukluklara benzersiz bir bakış açısı sağlayacağı gerçeğine rağmen, serbestçe davranan bebek veya genç farelerde in vivo fizyoloji ile ilgili neredeyse hiçbir çalışma yapılmamıştır. Burada, doğum sonrası gün 20'den (p20) doğum sonrası gün 60'a (p60) ve ötesine kadar yaşlandıkça farelerde aynı anda birden fazla beyin bölgesinden kronik alan ve tek üniteli kayıtlara izin veren bir mikro sürücü tasarımı, cerrahi implantasyon prosedürü ve ameliyat sonrası iyileşme stratejisi açıklanmaktadır. kabaca 2 yaşından yetişkinliğe kadar insan yaşlarına karşılık gelen bir zaman penceresi. Kayıt elektrotlarının ve son kayıt bölgelerinin sayısı kolayca değiştirilebilir ve genişletilebilir, böylece gelişim boyunca davranış veya hastalıkla ilgili beyin bölgelerinin in vivo izlenmesinin esnek deneysel kontrolüne izin verilir.
Giriş
Beyin, çocukluk ve ergenliğin kritik gelişim pencerelerinde büyük ölçekli değişikliklere uğrar 1,2,3. Otizm ve şizofreni de dahil olmak üzere birçok nörolojik ve psikiyatrik hastalık, ilk olarak çocuk ve ergen beyin gelişiminin bu döneminde davranışsal ve biyolojik olarak kendini gösterir 4,5,6. Erken gelişim boyunca meydana gelen hücresel, sinaptik ve genetik değişiklikler hakkında çok şey bilinmesine rağmen, devre veya ağ seviyesindeki süreçlerin bu zaman penceresi boyunca nasıl değiştiği konusunda nispeten az şey bilinmektedir. Daha da önemlisi, nihayetinde karmaşık davranışların, hafızanın ve bilişin altında yatan devre düzeyinde beyin fonksiyonu, hücresel ve sinaptik fonksiyonun öngörülemez, ortaya çıkan bir özelliğidir 7,8,9,10. Bu nedenle, ağ düzeyinde beyin fonksiyonunu tam olarak anlamak için, nöral aktiviteyi sağlam bir sinir devresi seviyesinde doğrudan incelemek gerekir. Ek olarak, nöropsikiyatrik bozuklukların ilerlemesi boyunca beyin aktivitesinin nasıl değiştiğini belirlemek için, hastalığın davranışsal fenotiplerinin ortaya çıktığı spesifik zamansal pencere sırasında ağ aktivitesini geçerli bir hastalık modelinde incelemek ve gözlemlenen değişiklikleri yetişkinliğe kadar devam ettikçe izlemek çok önemlidir.
En yaygın ve güçlü bilimsel model organizmalardan biri, davranışsal ve / veya anımsatıcı fenotiplerin yaşa bağlı başlangıcı ile nörogelişimsel bozuklukları modelleyen çok sayıda benzersiz genetik suşa sahip faredir 11,12,13,14,15,16,17,18,19,20,21 . İnsanların ve farelerin beyinleri arasındaki kesin gelişimsel zaman noktalarını ilişkilendirmek zor olsa da, morfolojik ve davranışsal karşılaştırmalar, p20-p21 farelerinin 2-3 yaş arası insan yaşlarını temsil ettiğini ve p25-p35 farelerinin 11-14 yaş arasındaki insan yaşlarını temsil ettiğini, farelerin muhtemelen 20 yaşındaki bir insan yetişkininin gelişimsel eşdeğerine p603 ile ulaştığını göstermektedir. 22. Bu nedenle, genç beynin nasıl geliştiğini daha iyi anlamak ve beynin sinir ağlarının otizm veya şizofreni gibi hastalıklarda nasıl işlevsiz hale geldiğini belirlemek için, 20 günlük ila 60 günlük yaşlar arasındaki farelerde beyin aktivitesini in vivo olarak doğrudan izlemek ideal olacaktır.
Bununla birlikte, farelerde erken gelişim boyunca beyin aktivitesini izlemede temel bir zorluk, genç farelerin küçük boyutu ve göreceli zayıflığıdır. Beyin gelişiminin uzunlamasına çalışmaları için gerekli olan elektrotların kronik implantasyonu, ince elektrot tellerini ve arayüz kartlarını23,24 korumak için tipik olarak büyük, hacimli bir muhafaza gerektirir ve implantlar, kemikleşmenin azalması nedeniyle genç farelerde daha ince ve daha az sert olan fare kafatasına sıkıca tutturulmalıdır. Bu nedenle, in vivo kemirgen fizyolojisi ile ilgili hemen hemen tüm çalışmalar, göreceli büyüklükleri, güçleri ve kafatası kalınlıkları nedeniyle yetişkin deneklerde gerçekleştirilmiştir. Bugüne kadar, in vivo juvenil kemirgen beyin fizyolojisini araştıran çoğu çalışma, vahşi tip genç sıçanlarda gerçekleştirilmiştir; bu, bir insan bozukluğunun serbestçe davranan bir modelinde genç beyin fonksiyonunu deneysel olarak izleme yeteneğini mutlaka sınırlar 25,26,27,28,29,30.
Bu makalede, gelişimsel olarak kritik bir zaman penceresinde (p20 ila p60 ve ötesi) genç farelerin uzun vadeli (4 veya daha fazla haftaya kadar) in vivo beyin fonksiyonlarını kronik olarak incelemek için yeni implant yuvası, cerrahi implantasyon prosedürü ve ameliyat sonrası iyileşme stratejisi açıklanmaktadır. İmplantasyon prosedürü, elektrotların genç farelerin kafataslarına güvenilir, kalıcı bir şekilde yapıştırılmasını sağlar. Ayrıca, mikro sürücü tasarımı hafiftir, çünkü bu mikro sürücü tamamen monte edildiğinde ~ 4-6 g ağırlığındadır ve implantın ağırlığını dengelemek için gereken minimum dengeleme nedeniyle, tipik davranışsal paradigmalar sırasında genç farelerin davranışsal performansını etkilemez.
Protokol
Bu çalışma, Teksas Üniversitesi Güneybatı Tıp Merkezi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (protokol 2015-100867) tarafından onaylanmış ve hem kurumsal hem de Ulusal Sağlık Enstitüsü kılavuzlarına uygun olarak gerçekleştirilmiştir. Bu çalışmada kullanılan C57 / Bl6 erkek ve dişi fareler p20'ye implante edildi (implantasyon sırasında ağırlık 8.3-11.1 g).
1. Mikro sürücü tasarımı ve yapımı
- Mikro sürücünün dijital olarak tasarlanması ve yazdırılması (Şekil 1)
- Mikro sürücü modeli şablonlarını (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive) indirin.
- Hedef beyin bölgelerinin stereotaksik yerlerini uygun bir stereotaksik atlasta tanımlayın.
- Üç boyutlu bilgisayar destekli tasarım (3D CAD) yazılımını kullanarak, şablon mikro sürücü kanülünü yükleyin (Şekil 1B).
- Gerekirse, istenen beyin bölgelerini hedeflemek için mikro sürücülü kanül modelindeki çıkış kanülü çıkış konumlarını değiştirin.
NOT: Her kanül deliği ekstrüzyonu, tetrodun doğrudan hedefe yönelik kanül deliğinden çıkmasını sağlamak için en az 2 mm uzunluğunda olmalıdır. Mikro sürücülü kanül şablonu, anterior singulat korteksi (yarım küre başına bir tetrod), hipokampal alan CA1'i (yarım küre başına dört tetrod) ve hipokampal alan CA3'ü (yarım küre başına iki tetrod) iki taraflı olarak hedeflemek üzere tasarlanmıştır ve hipokampal alan CA1'in üzerindeki beyaz cevherde yer alan yarım küre başına bir referans tetrod bulunur. - Gerekirse, mikro sürücü gövdesini (Şekil 1A) elektronik arabirim kartının (EIB) bağlanmasına uyacak şekilde değiştirin.
- Mikro sürücü gövdesini, kanülü, koniyi ve kapağı bir 3D yazıcıda yüksek çözünürlükte (ideal olarak 25 μm'den daha iyi bir çözünürlükle) yazdırın ve basılı malzemeleri üreticinin protokollerine göre hazırlayın. Yüksek sertlikte yazıcı reçineleri kullanın.
- Özel vidaların ve ataşmanların montajı (Şekil 2A, B)
- 3B CAD yazılımını kullanarak vidalı bağlantı modellerini yükleyin (Şekil 1E).
- Vida ataşmanlarını bir 3D yazıcıda yüksek çözünürlükte yazdırın (ideal olarak en az 25 μm çözünürlükte) ve basılı malzemeleri üreticinin protokollerine göre hazırlayın. Yüksek sertlikte yazıcı reçineleri kullanın.
- Vida ataşmanlarını her bir tetrod ilerleyen vidaya yapıştırın (Şekil 1F) (tetrod ilerleyen vidalar, mikro tahrik yapımından önce bir makine atölyesinde özel olarak üretilir).
- Her vidaya, biri sırtın üstünde diğeri aşağıda olmak üzere iki vida ataşmanı takın. Her vidalı ataşmanın tabanının sırta temas ettiğinden emin olun. Vida ataşmanlarını jel siyanoakrilat ile birlikte tutun.
- Yapıştırıldıktan sonra, vida ataşmanlarının vidanın uzunlamasına ekseninde hareket etmediğinden, ancak minimum dirençle serbestçe döndüğünden emin olun.
- Mikro sürücü gövdesinin montajı (Şekil 2C, D)
- İnce, keskin makas kullanarak, büyük poliimid boruları (dış çap: 0.2921 mm, iç çap: 0.1803 mm) ~ 6 cm uzunluğunda bölümler halinde kesin.
- Büyük poliimid bölümlerini mikro sürücü kanülü üzerindeki çıkış deliklerinden geçirin, böylece her tüp kanülün tabanının ötesine birkaç milimetre kadar uzanır.
- Temiz bir 30 G iğne kullanarak, az miktarda sıvı siyanoakrilat uygulayarak poliimid'i kanüle yapıştırın. Siyanoakrilatın poliimid tüpün içine girmesine izin vermemeye dikkat edin.
NOT: Sıvı siyanoakrilatın tahrik gövdesinin üst kısmından kanüle damlatılması bu işlemi hızlandırabilir, ancak kılavuz deliklerinin daha sonra ince uçlu bir matkapla yeniden temizlenmesini gerektirecektir. - Büyük poliimid tüplerini mikro sürücü kanülünün üstünden mikro sürücü gövdesindeki uygun büyük poliimid deliklerinden geçirin.
- Mikro sürücü kanülünü ve mikro sürücü gövdesini bitişik olana ve kanül/gövde bağlantı tırnakları birbirine kenetlenene kadar yavaşça birlikte itin. İşlemdeki poliimid tüpleri bükülmemeye veya zarar vermemeye dikkat edin.
NOT: Her bir poliimid tüpü, kanülün altından mikro sürücü gövdesinin üstünden sorunsuz bir şekilde geçmelidir. Hafif bükülme normaldir, ancak poliimid tüpünün aşırı bükülmesi tetrodu çarpıtabilir ve doğrudan beyne geçmesini önleyebilir. - Mikro sürücü gövdesini ve mikro sürücü kanülünü siyanoakrilat kullanarak birbirine yapıştırın.
- Yeni, keskin bir tıraş bıçağı kullanarak, kanül çıkış deliklerinin altından ekstrüzyon yapan büyük poliimid tüp uçlarını kesin. Kesimin tam olarak kanülün tabanında olduğundan emin olun, tüpleri ve kanül tabanını birbiriyle aynı hizada yapın.
- Keskin makas kullanarak, tahrik gövdesinin iç kenarının hemen üstündeki büyük poliimid boruyu ~ 45° açıyla kesin.
- Monte edilmiş özel vidaların takılması (Şekil 2E)
- Montajlı her özel vidayı mikro sürücü gövdesinin dış deliklerine vidalayın. Vidalı kılavuz direğin vidalı ataşmanlardaki büyük delikten geçtiğinden emin olun. Daha fazla ilerlemeyene kadar her vidayı tamamen ilerletin. Vidaların mineral yağ veya aks gresi ile önceden yağlanması önerilir.
- Son derece keskin makas kullanarak, küçük poliimid boruları (dış çap: 0.1397 mm, iç çap: 0.1016) ~ 4 cm uzunluğunda bölümler halinde kesin.
- Küçük poliimid bölümleri, mikro sürücüye zaten monte edilmiş olan büyük poliimid borudan geçirin. Aşırı küçük poliimid borunun, her büyük poliimid tüpün üstünden ve altından çıkıntı yaptığından emin olun.
- Küçük poliimid tüpleri, siyanoakrilat yoluyla vida ataşmanlarına yapıştırın, herhangi bir siyanoakrilatın büyük veya küçük poliimid tüplere girmesine izin vermemeye dikkat edin.
- Yeni, keskin bir tıraş bıçağı kullanarak, kanül deliklerinin dibinden ekstrüzyon yapan küçük poliimid tüp uçlarını kesin. Kesimin tam olarak kanülün tabanında olduğundan ve kesimin temiz olduğundan, poliimid tüp deliğini engelleyen hiçbir şey olmadığından emin olun.
- Keskin makas kullanarak, küçük poliimidin üst kısmını, vida ataşmanının üstünden birkaç milimetre yukarıda ~ 45 ° 'lik bir açıyla kesin. Kesimin temiz olduğundan ve poliimid tüp deliğini hiçbir şeyin engellemediğinden emin olun.
- Tetrodların yüklenmesi
- Tetrodları (~ 6 cm uzunluğunda) daha önce tarif edilen yöntemleri kullanarak hazırlayın31.
- Seramik veya kauçuk uçlu forseps kullanarak, küçük poliimid tüplerinden birinden bir tetrodu dikkatlice geçirin ve küçük poliimid tüpün üstünden ~ 2 cm çıkıntı bırakın.
- Tetrodü, sıvı siyanoakrilat yoluyla küçük poliimid tüpünün üstüne yapıştırın, işlem sırasında küçük ve büyük poliimid tüplerini birbirine yapıştırmamaya dikkat edin.
- Vidayı sürücünün üst kısmına yakın olana kadar geri çekin.
- Sürücünün altından çıkıntı yapan tetrod telini tutun ve kanülden çıktığı noktada yavaşça bükün.
- Vidayı sürücüye tamamen geri itin.
- Çok keskin makas kullanarak, tetrod telini kıvrımın hemen üstünde kesin. Mikroskop altında, kesimin temiz olduğundan ve dört tetrodun metalinin açığa çıktığından emin olun.
- Tetrod kanül içine sabitlenene kadar vidayı geri çekin.
- Tüm vidalar için 1.5.2-1.5.8 adımlarını tekrarlayın.
- AYB'yi küçük mücevher vidalarıyla AYB destek platformuna takın.
- Her tetrodun her elektrodunu AYB üzerindeki uygun porta bağlayın.
- Mikro sürücünün ameliyat için hazırlanması
- Daha önce tarif edilen yöntemleri kullanarak elektriksel empedansı azaltmak için tetrodları elektriksel olarak plakalayın31.
- Kaplamadan sonra, her bir tetrodun kanül içine yerleştirildiğinden emin olun, böylece tetrodun ucu her kanül deliğinin tabanıyla aynı hizada olur.
- Mikro sürücü konisini tamamlanan mikro sürücünün etrafında kaydırın. Koni bağlantı direğini kapak bağlantı noktasına kaydırarak mikro sürücü kapağını mikro sürücü konisine takın.
- Koniyi, kapak kapalıyken EIB konektörlerinin EIB bağlantı geçiş deliklerinden serbestçe geçeceği şekilde yönlendirin ve koniyi, koninin tabanının etrafına yerleştirilmiş siyanoakrilat ile yerine yapıştırın, herhangi bir siyanoakrilatın kanül çıkış deliklerinden herhangi birine girmesine izin vermemeye dikkat edin. Kapağı çıkarın.
- Cerrahi implantasyondan sonra vücut sıvılarının poliimid deliklerine girmesini önlemek için her kanül deliğini steril mineral yağ ile dikkatlice doldurun.
- Kanülün tabanını steril petrol jölesi ile dikkatlice kaplayın. Bu, kimyasal ajanların (örneğin, diş çimentosu) ameliyat sırasında maruz kalan beyne girmesini önlemek için bir bariyer görevi görecektir.
- Eşit ağırlıkta bir denge dengesi hazırlamak için tamamen monte edilmiş mikro sürücüyü, kapağı ve dört kemik vidasını tartın.
- İsteğe bağlı olarak, ameliyattan önce, sürücü kafatası ile aynı hizada olduğunda, tetrodları hedef beyin bölgelerine ulaşmak için uygun bir mesafede ekstrüde edin.
NOT: Cerrahi implantasyondan önce, implantı etilen oksitte (500-1200 mg / L, 2-4 saat) gaz sterilizasyonu yoluyla sterilize edin. Tüm kemik vidaları ve cerrahi aletler otoklav ile sterilize edilmelidir (121°C, 30 dakika).
2. Cerrahi implantasyon
- Fareyi anestezi altına almak ve stereotaksik cihaza monte etmek
- Fareyi hareket ettirmek için yeterli alana sahip küçük bir kutuya yerleştirin ve fareyi% 3 -% 4 izofluran ile uyuşturun.
NOT: Diğer anestezik ajanlar kullanılabilir, ancak yavru fare deneğinin yaşı, boyutu ve ağırlığı nedeniyle dikkatli olunmalıdır. - Fare yanıt vermediğinde (kuyruk sıkışmasına yanıt yok, dakikada ~ 60 nefes havalandırma hızı), kutudan çıkarın ve stereotaksik cihaza hızla monte edin.
- Hızlıca, stereotaksik maskeyi farenin burnunun üzerine yerleştirin ve% 1-3 izofluranda anesteziyi koruyun. İlk cerrahi insizyondan önce, sürekli salınımlı buprenorfin (0.05-0.5 mg / kg deri altı) veya karprofen (5-10 mg / kg deri altı) gibi anti-enflamatuar ajanlar gibi veteriner onaylı herhangi bir ağrı kesici uygulayın.
- Kulaklık çubuklarını kullanarak farenin kafasını stereotaksik aparatına tamamen sabitleyin. Farenin kulak kanallarına gereksiz baskı uygulamadan kafatasının düz ve hareketsiz olduğundan emin olun. Genç kafatası kemiklerinin sınırlı kemikleşmesi nedeniyle, kafa fiksasyonu sırasında kalıcı hasara neden olmak mümkündür.
- Fareyi hareket ettirmek için yeterli alana sahip küçük bir kutuya yerleştirin ve fareyi% 3 -% 4 izofluran ile uyuşturun.
- Fareyi ameliyata hazırlamak ve kafatasını açığa çıkarmak
- Her göze az miktarda sentetik gözyaşı jeli yerleştirerek ve her gözü otoklavlanmış bir folyo yamasıyla kaplayarak farenin gözlerini koruyun.
NOT: Sentetik gözyaşları gözleri nemli tutarken, folyo herhangi bir ışık kaynağının uzun süreli hasara neden olmasını önleyecektir. Daha kalın sentetik gözyaşı solüsyonları, diğer potansiyel olarak toksik cerrahi çözeltilerin (etanol, diş akriliği, vb.) gözlere yanlışlıkla sokulmasına engel teşkil edebileceğinden tercih edilir. - Steril pamuk uçlu çubuklar kullanarak, saçları kafa derisinden çıkarmak için cerrahi bölgeye epilasyon kremi sürün. Kremi gözlerin yanına getirmemeye dikkat edin. Saçı çıkardıktan sonra, cerrahi alanı sabitlemek için kafa derisinin üzerine steril bir örtü yerleştirin.
- Steril pamuk uçlu çubuklar kullanarak, kafa derisini üç ardışık povidon-iyot (% 10) çözeltisi ve ardından izopropil alkol (% 100) ile temizleyin.
- Steril bir neşter veya ince makas kullanarak, kafa derisini çıkarın.
- Steril pamuk uçlu çubuklar ve steril tuzlu su çözeltisi (% 0.9 NaCl) ve hidrojen peroksit çözeltileri kullanarak kafatasını iyice temizleyin.
- Bregma'yı tanımlayın ve stereotaksik aparatı kullanarak, kafatasındaki hedef kayıt yerlerini kalıcı bir işaretleyici ile dikkatlice işaretleyin.
- Her göze az miktarda sentetik gözyaşı jeli yerleştirerek ve her gözü otoklavlanmış bir folyo yamasıyla kaplayarak farenin gözlerini koruyun.
- Kanül deliğinin açılması ve kemik ankrajlarının takılması
- Kayıt bölgelerinin üzerini kaplayan kafatasını çıkarın. # Bu yaşta kafatasının inceliğinden dolayı kafatasını neşter bıçağı ile kesin; Bu, altta yatan duraya zarar verebilecek bir matkap kullanma zorunluluğunu ortadan kaldırır. Steril tuzlu su çözeltisi (% 0.9 NaCl) veya steril mineral yağ uygulamasıyla açıkta kalan durayı nemli tutun. Bu aşamada durayı çıkarmayın veya delmeyin, çünkü genç farelerde tetrodların gelecekteki adımlarda geçmesi için yeterince incedir.
- Dört kemik vidası için pilot delikleri dikkatlice açın.
- Kemik vidalarını, kafatasının kemiğin en kalın olduğu ve kemik vidalarının mikro sürücü implantından yeterince uzakta olduğu aşırı lateral ve rostral veya kaudal kısımlarına yerleştirin. Kemik vidaları için steril, ince mücevher vidaları kullanın (örneğin, UNM 120 dişli, 1,5 mm kafa).
- Bir kemik vidasını, toprak görevi görecek ve adım 2.4.6'da AYB'ye tutturulacak ince, oldukça iletken bir tel ile sıkıca sarın.
- Bir neşter bıçağı kullanarak veya bir matkap ucu kullanarak dikkatlice kafatasını kemik vida deliği konumlarının yakınında puanlayın. Puanlama, sıvı siyanoakrilatın adım 2.3.5'te bağlanması için yeterince pürüzlü bir yüzey sağlamak için önemlidir.
- Steril bir tornavida ve steril vidalı kelepçe kullanarak, her steril kemik vidasını yerine geçirin ve altta yatan durayı delmemeye dikkat edin.
- Steril bir 30 G iğne kullanarak, her kemik vidasının etrafına sıvı siyanoakrilat yerleştirin. Bu, kemik vidalarının takıldığı kafatasını etkili bir şekilde kalınlaştırır. Herhangi bir siyanoakrilatın kayıt bölgelerinin üzerindeki açıkta kalan duraya girmesine izin vermemeye dikkat edin.
- Mikro sürücünün indirilmesi ve takılması (Şekil 2G)
- Tamamlanan mikro sürücüyü, fare kafatasına dikkatlice indirilmek üzere stereotaksik aparata monte edin. Mikro sürücü kanülünün indirildiğinde uygun koordinatlarda olacağından emin olun.
- Mikro sürücüyü yavaşça indirin, sadece dorsal / ventral yönde hareket edin. Beyne girişlerini görselleştirmek için kanül deliklerinden (adım 1.6.6) zaten ilerlemiş olan tetrodlarla mikro sürücüyü indirin; Tetrodlar fareye dokunduğunda herhangi bir medial / lateral veya rostral / kaudal hareket, tetrodları bükebilir ve son hedeflerini kaçırmalarına neden olabilir.
- Mikro sürücü tamamen indirildikten sonra, kanülün tabanının kafatası / dura ile temas ettiğinden emin olun. Petrol jölesi ve / veya mineral yağ tabakası, maruz kalan durayı örtmek için bir bariyer görevi görecektir. Gerekirse, aşırı maruz kalan durayı örtmek için steril petrol jölesi veya steril kemik mumu ekleyin.
- Mikro sürücüyü stereotaksik aparatla yerinde tutarken, mikro sürücü tabanını implante edilmiş kemik vidalarına yapıştırmak için kafatasını diş çimentosu ile kaplayın.
NOT: Diş çimentosu tüm kemik vidalarını tamamen kaplamalı ve mikro tahrik kanülü üzerindeki diş çimentosu ankraj çıkıntısını örtmelidir. - Diş çimentosu ayarlanırken, fareye zarar verebilecek veya mikro sürücüye zarar verebilecek keskin köşeleri veya kenarları önlemek için dikkatlice şekillendirin. Mikro sürücüyü tutmak için yeterli diş çimentosu bulunduğundan emin olun, ancak gereksiz ağırlık ekleyecek aşırı diş çimentosunu ortadan kaldırın.
- Topraklama telini mikro sürücüden dikkatlice geçirin ve AYB üzerindeki uygun yuvaya takın.
- Diş çimentosu tamamen ayarlandıktan sonra, mikro sürücüyü stereotaksik aparattan dikkatlice ayırın. Kapağı mikro sürücüye yerleştirin.
- Steril pamuk uçlu çubuk ve steril salin ile fareyi temizleyin.
- Steril pamuk uçlu çubukla, implant bölgesinin yakınında maruz kalan herhangi bir kafa derisine ince bir antibiyotik merhem tabakası uygulayın.
- Folyoyu farenin gözlerinden çıkarın.
- Fare temiz bir kafese taşınırken mikro sürücünün ek ağırlığını desteklemeye dikkat ederek fareyi stereotaksik cihazdan çıkarın.
3. Ameliyat sonrası iyileşme
- Anında kurtarma
- Ameliyattan önce, Şekil 2G'de gösterildiği gibi 0.75 çapında bir PVC boru bağlayarak karşı denge sistemini hazırlayın. Sistemin bir kolu kafesin kapağına açılan deliklerden geçer, ikinci kol kafes kapağının üstüne dayanır ve üçüncü kol kafesin üstüne ve ötesine uzanır. En üstteki kol kapaklıdır.
- Mikro sürücüyü dikkatlice karşı denge sistemine takın (Şekil 2G-I) ve mikro sürücünün ve kemik vidalarının ağırlığıyla aynı olan bir denge ağırlığı kullanın. Karşı balans sisteminin üç kolu üzerinden AYB'ye bağlı bir konektörden güçlü bir iplik veya olta, en üstteki kolun üzerinde asılı olan karşı balans ağırlığına kadar çalıştırın.
- Karşı dengenin mikro sürücü EIB'ye güçlü bir şekilde bağlı olduğundan ve fareye kafesin tamamına tam erişim sağlamak için yeterli çizgi olduğundan emin olun.
- Rehidrasyon ve iyileşmeyi sağlamak için kafeste nemlendirilmiş normal kemirgen chow ile birlikte besin açısından zengin jel sağlayın.
- Cerrahi anesteziden tamamen iyileşene kadar fareyi izleyin.
- Uzun süreli iyileşme
- Kayıt ekipmanına takılı değilken her zaman, mikro sürücünün karşı denge sistemi tarafından desteklendiğinden emin olun. Zaman içinde karşı ağırlığı azaltın, ancak fareye beklenmedik bir şekilde gerilmesini veya kemik vidalarına tork gelmesini önlemek için asla tamamen çıkarmayın.
- İmplant ve karşı denge sisteminin zarar görmesini önlemek için, deney süresince fareyi diğer farelerle doğrudan etkileşim olasılığı olmadan barındırın.
- Ameliyattan sonra en az 3 gün boyunca besin açısından zengin jel sağlayın, bu noktada tek başına katı yiyecekler yeterli olacaktır.
- Karşı denge sisteminin genel gider gereksinimleri nedeniyle, havai tel örgüde yiyecek ve su sağlamayın; Yiyecekleri kafes zeminine yerleştirin ve kafesin yanından su sağlayın. Bozulmayı önlemek için, yiyecekleri tamamen günlük olarak değiştirin.
- Her gün, farenin kafesin tamamına serbestçe erişebildiğinden ve karşı dengenin mikro sürücüye sağlam ve güçlü bir şekilde takıldığından emin olun.
Sonuçlar
Yukarıda açıklanan protokol, farelerde aynı anda birden fazla beyin bölgesinden yerel alan potansiyel sinyallerini ve tek birimleri kaydetmek için kullanıldı ve aynı farelerde p20'den p60'a kadar günlük kayıtlar yapıldı. Burada iki fareden elde edilen temsili elektrofizyolojik kayıtlar ve son kayıt yerlerini gösteren deney sonrası histoloji bildirilmiştir.
Mikro sürücünün p20 farelere cerrahi implantasyonu
Bir mikro sürücü (Şekil 1) inşa edildi (Şekil 2) ve yukarıda açıklandığı gibi cerrahi olarak bir p20 fareye implante edildi. Ameliyattan hemen sonra, fare karşı denge sistemine bağlandı (Şekil 2G-I) ve iyileşmesine izin verildi. Fare tamamen hareketli olduğunda, mikro sürücü in vivo elektrofizyoloji kayıt sistemine takıldı. Mikro sürücüyü kayıt ekipmanına bağlayan kablolar farenin üzerine asıldı. Elektrofizyolojik kayıtlar (32 kHz) tüm kanallarda 1 saat boyunca elde edilirken, fare ev kafesinde doğal davrandı. Kaydın ardından, fare kayıt sisteminden çıkarıldı, karşı denge sistemine yeniden bağlandı ve suya ve chow'a serbest erişim ile vivaryuma geri döndü.
Nöral aktivitenin günlük kaydı
Elektrofizyolojik kayıtlar, p20-p60'ın kritik gelişimsel pencereleri boyunca aynı beyin bölgesinin kronik olarak izlenmesini sağlamak için birkaç hafta boyunca günlük olarak elde edildi. Kronik kayıtlar boyunca örnek ham yerel alan potansiyelleri (LFP) Şekil 3A, C'de gösterilmiştir. İzole edilmiş tek birimler aynı anda çoklu tetrodlardan elde edildi (Şekil 3B). Benzer dalga formlarına sahip birimler birden fazla gün boyunca tanımlandı (Şekil 3B, orta ve sağ), ancak kayıt elektrodunun potansiyel sürüklenmesi nedeniyle, aynı birimin günler boyunca tanımlandığını kesin olarak iddia etmek mümkün değildi. P20'ye implante edilen ve birkaç hafta boyunca günlük olarak kaydedilen ayrı bir farede, dorsal bölge CA1'i hedefleyen bir tetrod üzerinde nöral aktivite incelendi. Kaydın her gününde büyük genlikli dalgalanmalar ve iyi izole edilmiş tek birimler tanımlanmıştır (Şekil 4). Bu veriler, kararlı, yüksek kaliteli in vivo elektrofizyolojik kayıtların erken gelişim boyunca aynı fareden olabileceğini göstermektedir.
Kayıt bölgelerinin histolojik olarak doğrulanması ve kronik implantasyonun gelişimsel etkisi
Son kayıt gününü takiben, fare izofluran anestezisi ile iyice uyuşturuldu, ardından ölümcül bir pentobarbital sodyum enjeksiyonu yapıldı ve kayıt bölgelerinde küçük lezyonlar üretmek için elektrot uçlarından bir akım geçirildi. Fare beyninin deney sonrası histolojik kesitlenmesi, son kayıt bölgelerinin görselleştirilmesine izin vermiştir (Şekil 5A, B). Ayrı bir kohortta, üç erkek ve üç dişi fare, yukarıda tarif edildiği gibi cerrahi olarak p20'ye implante edildi. Eşit sayıda çöp arkadaşı implante edilmeden bırakıldı ve aynı barınma koşullarında tutuldu. Fareler p62'de kurban edildi (implante edilen kohort için ameliyattan 6 hafta sonra). Kafatasları dikkatlice temizlendi ve lambda'daki bregma-lambda mesafesinin (Şekil 5C, sol üstte) ve lambda'daki dış maksimal kafatası genişliğinin (Şekil 5C, sağ üst) dış ölçümleri alındı. Kafatasının orta çizgisi boyunca bir kesi yapıldı ve kütle ölçümü için beyni eksize etmek için kafatasının yarısı çıkarıldı (Şekil 5C, sağ altta). Bregma'daki kafatası boşluğunun yüksekliği sağlam kafatası yarısından ölçüldü (Şekil 5C, sol altta). İmplante edilmiş ve implante edilmemiş kohortlar arasında hiçbir ölçü anlamlı olarak farklı değildi (Wilcoxon rank-sum testi), p20'den başlayan uzun süreli implantasyonun kafatasının veya beyin hacminin doğal gelişimi üzerinde brüt bir etkisi olmadığını göstermektedir.

Resim 1: Mikro sürücü bileşenleri. (A) mikro sürücü gövdesinin, (B) kanülün, (C) koninin, (D) kapağın, (E) vida ataşmanlarının ve (F) tetrod ilerleyen vidanın üç boyutlu görüntüleri. Her bileşenin kritik özellikleri belirtilmiştir. Ölçüm ayrıntıları, https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/'de bulunan model dosyalarından çıkarılabilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Resim 2: Mikro sürücü yapısı . (A) Yan ve (B) üst ve alt vida ataşmanları bağlı olarak tetrod ilerleyen vidanın üstten görünümü. (C) Gövde ve kanül takılı mikro sürücünün yan ve (D) üstten görünümü ve her kanül deliğinden geçen ve kanülün dibine kesilmiş büyük poliimid boru. (E) Mikro sürücünün vidalar ve küçük poliimid boru ile yandan görünümü. Küçük poliimid tüplerin üst kısımları, tetrod yüklemesinden hemen önce kesilir. (F) Stereotaksik cihaza bağlı tamamlanmış mikro sürücü. Normalde mikro sürücüyü çevreleyen koruyucu koni, görselleştirme amacıyla çıkarılmıştır. Bazı vidalı ataşmanların bu mikro sürücü için siyah bir reçine içinde basıldığını unutmayın. (G) Karşı denge destek sistemi. (H) Yan ve (I) karşı denge destek sistemi takılı bir fare kafesinin üstten görünümü. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
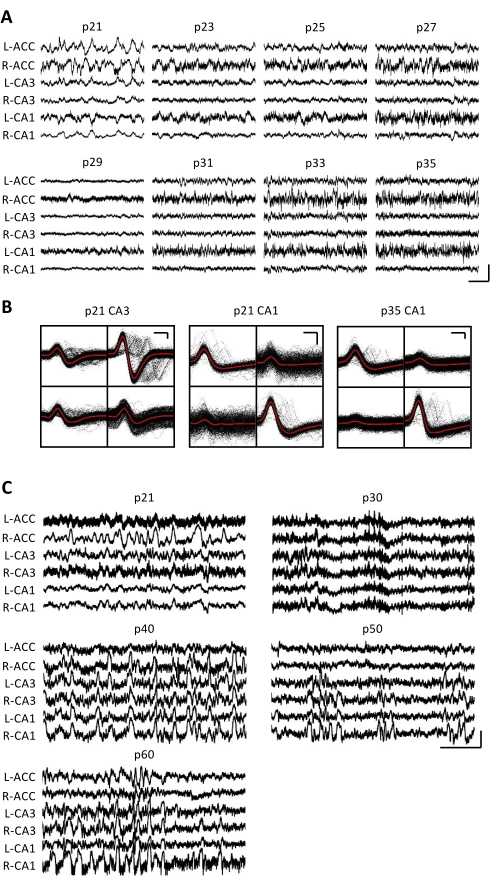
Şekil 3: Temsili elektrofizyolojik kayıtlar. Bir p20 fare, yukarıda açıklandığı gibi bir mikro sürücü ile implante edildi. P21'den başlayarak ve bundan sonraki 2 hafta boyunca her gün, fare kayıt cihazına bağlandı ve nöral aktivite en az 1 saat boyunca kaydedildi. (A) İki taraflı (L = sol; R = sağ) anterior singulat korteks (ACC), hipokampal alan CA3 (CA3) ve hipokampal alan CA1 (CA1). Veriler her gün toplandı; Netleştirmek için, yalnızca tek günlere ait veriler görüntülenir. Tüm izler ev kafesinde hareketsizlik dönemlerinde alındı. Ölçek çubuğu: 1 mV, 2 s. (B) Panel A'daki kayıtlar için hipokampal alan CA3 (solda) ve CA1'den (sağda) izole edilmiş temsili tek birimler. Her elektrot üzerindeki tüm ham dalga formları siyah renkte gösterilir; ortalama kırmızı renktedir. Ölçek çubuğu: 50 μV, 0,2 ms. (C) p20'ye implante edilmiş ikinci bir fare için p60'taki son kayıt gününe kadar her 10. gün için temsili ham LFP izleri. Veriler her gün toplandı; Netleştirmek için, yalnızca her 10. güne ait veriler görüntülenir. Tüm izler ev kafesinde hareketsizlik dönemlerinde alındı. Ölçek çubuğu: 1 mV, 2 sn. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
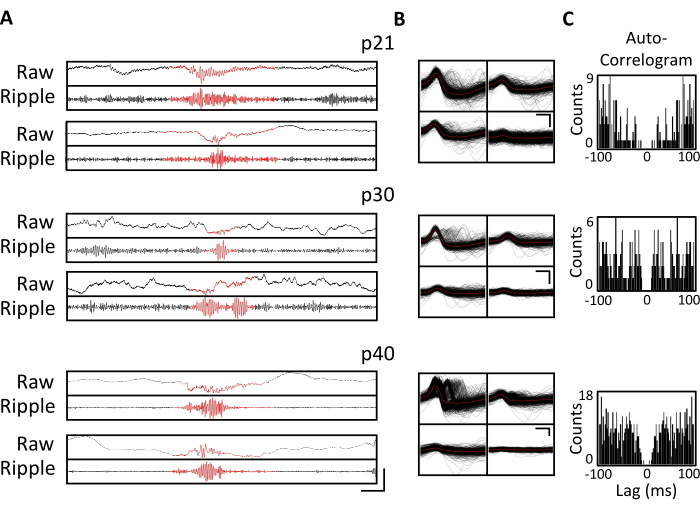
Şekil 4. Kronik kayıtların stabilitesi. Bir p20 fare, yukarıda açıklandığı gibi bir mikro sürücü ile implante edildi. P21'den başlayarak ve daha sonra 4 hafta boyunca, fare kayıt cihazına bağlandı ve nöral aktivite en az 1 saat boyunca kaydedildi. Dorsal hipokampal CA1'i hedef alan tetrodlardan elde edilen veriler gösterilmiştir. (A) p21, p30 ve p40'ta tanımlanan dalgalanma olayları için ham (üstte) ve dalgalanma filtreli (altta) LFP. Dalgalanma olaylarını tanımlamak için, ham LFP 125 Hz ile 300 Hz arasında bant geçişi filtrelendi ve dalgalanma olayları, dalgalanma bandı gücünde ortalamanın üzerinde 3 standart sapmadan daha büyük geçici artışlar olarak tanımlandı. Her dalgalanmanın başlangıcı ve bitişi, dalgalanma bandı gücünün ortalamaya geri döndüğü nokta olarak tanımlandı. Tanımlanan dalgalanmalar kırmızı renkle gösterilir. Ölçek çubuğu: 100 ms, yukarıdan aşağıya: 1.000 μV, 140 μV, 1.800 μV, 180 μV, 9.000 μV, 1.200 μV, 10.000 μV, 1.000 μV. (B) Panel A'daki kayıtlar için CA1 hedefli tetroddan her gün temsili tek bir birim. Her elektrot üzerindeki tüm ham dalga formları siyah renkte gösterilir; ortalama kırmızı renktedir. Ölçek çubuğu 0,2 ms, yukarıdan aşağıya: 50 μV, 100 μV, 100 μV. (C) B panelindeki tek birimler için tüm ani artışların otokorelogramı. Bu veriler, birkaç hafta boyunca hipokampal piramidal tabaka içinde kararlı elektrot yerleşimini göstermektedir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Temsili histoloji ve kafatası gelişimi üzerindeki etkisi. Bir p20 fare, yukarıda açıklandığı gibi bir mikro sürücü ile implante edildi. P60'taki son kayıt gününü takiben, kayıt bölgelerinde elektrolitik lezyonlar üretildi ve beyin% 4 paraformaldehit ile perfüze edildi. Kayıt alanlarını belirlemek için 50 μm kesitler üretildi. (A) Hipokampusun CA1 ve CA3'ündeki lezyonlar. Ok ucu CA3 kayıt sitesini gösterir; çift ok ucu CA1 kayıt sitesini gösterir. Ölçek çubuğu: 0.5 mm. (B) Bilateral AKK'daki lezyonlar. Ok uçları ACC kayıt sitelerini gösterir. Ölçek çubuğu: 0,5 mm. (C) P20'de (gri) bir mikro sürücü ve implante edilmemiş çöp arkadaşları (beyaz) ile implante edilen p62 farelerinin kafatası boyutu ve beyin kütlesi ölçümleri. Wilcoxon rank-sum testinin p-değeri her ölçüm için raporlanır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tartışmalar
Kemirgenlerde in vivo nöral devre fonksiyonunu araştıran modern deneyler, bireysel nöronların (yani, tek birimler) veya yerel popülasyonların (yerel alan potansiyelleri, LFP aracılığıyla) aktivitesini izlemek için kalıcı olarak implante edilmiş elektrotlar aracılığıyla hücre dışı elektrofizyolojiyi sıklıkla kullanır, ancak bu tür yöntemler teknik zorluklar nedeniyle genç farelere nadiren uygulanır. Bu makalede, p20'den p60'a ve ötesine gelişimsel olarak kritik pencerelerde farelerde in vivo elektrofizyolojik kayıtlar elde etmek için bir yöntem açıklanmaktadır. Bu metodoloji, bir mikro sürücü implantının basımı ve yapımı için bir üretim sürecini, cerrahi bir implantasyon prosedürünü ve ameliyat sonrası bir iyileşme stratejisini içerir ve bunların hepsi özellikle genç farelerde kullanılmak üzere uyarlanmıştır. Bu protokolün geliştirilmesinde, genç farelerin yetişkin meslektaşlarına kıyasla küçük boyutları ve göreceli zayıflıklarının yanı sıra, mikro sürücünün takılması gereken yavru fare kafatasının kemikleşmesinin azalması da dahil olmak üzere çeşitli hususlar etkili olmuştur.
İn vivo elektrofizyolojiyi gerçekleştirmek için yaygın olarak kullanılan iki temel yöntem, elektrot dizileri (örneğin, tetrodlar) ve silikon problardır. Silikon problar hafiftir, birim ağırlık başına çok sayıda kayıt alanı sağlayabilir ve daha önce yavru sıçanlarda kullanılmıştır25. Bununla birlikte, silikon problar birim başına nispeten pahalıdır. Buna karşılık, bu makalede açıklanan mikro sürücü, hammaddelerde 50 ABD Doları'ndan daha az kullanılarak inşa edilebilir ve bu da onu in vivo kayıt için uygun maliyetli bir seçenek haline getirir. Ek olarak, silikon problar genellikle mekansal olarak farklı beyin bölgelerinin kaydedilmesini yasaklayan sabit çizgilere implante edilmelidir. Buna karşılık, bu makalede açıklanan mikro sürücü tasarımı, 16 farklı konuma kadar eşzamanlı kayıtları barındırmak için bağımsız olarak ayarlanabilir tetrodlar kullanır ve bu konumlar arasındaki uzamsal ilişki üzerinde neredeyse hiçbir kısıtlama yoktur. Bu mikro sürücü tasarımı, kanül deliği ekstrüzyonlarını istenen herhangi bir anterior/posterior ve medial/distal konuma taşıyarak burada tarif edilenlerden farklı konumların hedeflenmesine izin verecek şekilde kolayca değiştirilebilir. Alternatif beyin bölgelerini hedeflerken, tetrodlar genellikle düz hareket ederken, bu ince tellerin mikro sürücü kanülünden çıktıklarında hafifçe sapmasının mümkün olduğunu not etmek önemlidir. Bu nedenle, bir beyin bölgesi ne kadar küçük veya ventral olursa, bölgeyi tetrodlarla başarılı bir şekilde hedeflemek o kadar zor olacaktır.
Bu makalede açıklanan mikro sürücü implantı, temel olarak, her bir tetrodun kayıt derinliğinin hassas bir şekilde kontrol edilmesini sağlayan vidalara yapıştırılmış tek tek tetrodların vidalara tutturulması bakımından 23,32,33,34,35 önceki birkaç tetrod tabanlı mikro sürücü tasarımına temel olarak benzemektedir. Mevcut mikro sürücü tasarımının çeşitli özellikleri, mekansal olarak dağılmış beyin bölgelerini hedefleme kolaylığı da dahil olmak üzere benzersiz olsa da, mevcut makalenin birincil yeniliği, hala gelişmekte olan genç farelerde ağ aktivitesinin kronik çalışmalarına izin veren cerrahi implantasyon ve ameliyat sonrası iyileşme stratejilerinin tanımıdır. Gerçekten de, burada açıklanan cerrahi ve iyileşme metodolojileri, genç farelerde diğer implantları desteklemek için uyarlanabilir.
Birkaç gün boyunca tutarlı bir kayıt sağlamak için, teller veya problar kafatasına sağlam bir şekilde yapıştırılmalıdır. Fare kafatasının genel yapısı p20'den sonra sadece küçük değişikliklere uğrarken, kafatası p20 ve p4536 yaşları arasında önemli ölçüde kalınlaşır. Gerçekten de, p20'deki kafatası, takılı bir implantı hasar görmeden desteklemek için yeterince sert değildir. Bu biyolojik sınırlamanın üstesinden gelmek için, bu protokol implantasyon ameliyatı sırasında kafatasını siyanoakrilat yoluyla yapay olarak kalınlaştırır. Bu stratejiyi kullanarak p20'den küçük farelerde implantasyon muhtemelen mümkündür, ancak fare kafatası kabaca p2036'ya kadar önemli boyut ve şekil değişikliklerine uğrar. Bu nedenle, p20'den daha genç farelerde uzun süre implantasyon önerilmez, çünkü hala gelişmekte olan kafatasındaki siyanoakrilat ve sabit kemik vidaları, kafatasının doğal büyümesini ve altta yatan beyin dokusu gelişimini önemli ölçüde etkileyebilir. Önemli olarak, bu çalışmada, p20'den başlayan kronik implantasyonu takiben kafatası veya beyin büyüklüğünün brüt ölçümleri üzerinde herhangi bir etki gözlenmemiştir (Şekil 5C).
Bu makalede açıklanan yöntemde kritik bir adım, ameliyat sonrası iyileşme stratejisidir; Bu stratejiye göre, fare olgunlaştıkça ve kas-iskelet sistemi gelişimine maruz kaldıkça implantın ağırlığı sürekli olarak dengelenmelidir. İmplantasyondan hemen sonra, fareler karşı denge olmadan implantın ağırlığını başarılı bir şekilde taşıyamazlar, bu da fare kafesindeki yiyecek ve su kaynaklarına yeterince ulaşamadığı için yetersiz beslenmeye ve dehidrasyona neden olur. Karşı denge sisteminin inşası kolay ve ucuzdur, uygulanması önemsizdir ve implante edilebilir herhangi bir yaştaki farelerin ev kafeslerinin tamamını özgürce keşfetmelerine izin verir, böylece yeterli beslenme ve hidrasyon sağlar. Fareler yaşlandıkça, yetişkin farelerde tamamen çıkarılana kadar karşı denge miktarı azaltılabilir; Bununla birlikte, karşı denge sisteminin sürekli kullanımı, deney süresince her zaman en az nominal bir karşı ağırlık eklenmiş olarak tavsiye edilir. Yetişkin bir fare, zaman içinde mikro sürücünün boyutunu ve ağırlığını taşıyabilse de, iyileştirici bir karşı ağırlık olmadan serbest davranış sırasında devam eden doğal hareket, mikro sürücüyü kafatasına sabitleyen kemik vidaları üzerinde tork ve kesme kuvveti üretir ve bu da özellikle daha uzun kronik deneyler sırasında ayrılma olasılığını artırır.
Mevcut çalışma için iki önemli sınırlama dikkat çekicidir. İlk olarak, p20'de implantasyonun kafatası ve beyin gelişimi üzerindeki etkisini değerlendirmek için, uzun süreli implantasyondan sonra birkaç fare kohortu feda edildi (Şekil 5C). Bu analizler, implantasyonun kafatası boşluğu büyüklüğü veya beyin kütlesi üzerinde anlamlı bir etkisi olmadığını ortaya koysa da (Şekil 5C), mevcut çalışma, kafatası boyutunu veya beyin kütlesini p20-p60'ın erken gelişim dönemi boyunca birden fazla zaman noktasında incelememiştir. Önceki çalışmalar beyin boşluğunun gelişiminin p2036 ile tamamlandığını gösterse de, bu erken penceredeki implantasyonun, burada değerlendirilen yetişkin yaşları tarafından düzeltilen veya telafi edilen beklenmedik değişiklikler üretmesi mümkündür. İkincisi, Şekil 3 ve Şekil 4'te gösterilen elektrofizyolojik verileri üreten deneyler, hücre verimini en üst düzeye çıkarmak için tasarlanmamıştır. Bu nedenle, burada sunulan veriler kararlı, kronik kayıtlar ve iyi izole edilmiş tek üniteler gösterirken, bu cihaz için maksimum potansiyel verimi temsil eden kişiler olarak alınmamalıdır.
Birçok insan nörolojik ve psikiyatrik bozukluğu, otizm ve şizofreni de dahil olmak üzere erken gelişim dönemlerinde veya ergenlik döneminde ortaya çıkar. Bununla birlikte, mevcut fare modellerinin bolluğuna rağmen, bu hastalıkların altında yatan devre seviyesi işlev bozukluğu hakkında çok az şey bilinmektedir. Bu ilk ağ değişikliklerinin tanımlanması, erken teşhis stratejileri ve tedavi paradigmaları oluşturmak için kritik öneme sahiptir. Yine de, teknik zorluklar nedeniyle, nöropsikiyatrik hastalıkların fare modellerinde ağ işlevinin gelişim boyunca nasıl bozulduğu belirsizliğini korumaktadır. Burada açıklanan mikro sürücü ve kurtarma stratejisi, fare beynindeki çok bölgeli beyin ağı gelişimine yönelik araştırmaları desteklemek ve böylece araştırmacıların sağlıklı beyin gelişimini ölçmelerine ve fare hastalık modellerinde bu gelişimdeki değişiklikleri belirlemelerine izin vermek için tasarlanmıştır.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu çalışma Ulusal Sağlık Enstitüleri R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) ve F99NS12053 (L.D.Q.) ve UT Güneybatı GSO Bağış Ödülü (R.J.P. ve L.D.Q.) tarafından desteklenmiştir. Yazarlar, teknik yardım için Jenny Scaria'ya (Texas Tech Üniversitesi Sağlık Bilimleri Merkezi Eczacılık Fakültesi) ve metodolojik öneriler için Dr. Brendon Watson'a (Michigan Üniversitesi) teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
Referanslar
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır