Method Article
Un implante de accionamiento ligero para grabaciones crónicas de tetrodos en ratones jóvenes
En este artículo
Resumen
Aquí, describimos un diseño de micro-impulso, procedimiento de implantación quirúrgica y estrategia de recuperación postoperatoria que permiten grabaciones crónicas de campo y de una sola unidad de múltiples regiones cerebrales simultáneamente en ratones juveniles y adolescentes a través de una ventana crítica de desarrollo desde el día postnatal 20 (p20) hasta el día postnatal 60 (p60) y más allá.
Resumen
La electrofisiología in vivo proporciona una visión sin precedentes de la dinámica del circuito de subsegundo nivel del cerebro intacto y representa un método de particular importancia para estudiar modelos de ratón de trastornos neuropsiquiátricos humanos. Sin embargo, tales métodos a menudo requieren implantes craneales grandes, que no se pueden usar en ratones en puntos de tiempo de desarrollo tempranos. Como tal, prácticamente no se han realizado estudios de fisiología in vivo en ratones bebés o jóvenes que se comportan libremente, a pesar del hecho de que una mejor comprensión del desarrollo neurológico en esta ventana crítica probablemente proporcionaría información única sobre los trastornos del desarrollo dependientes de la edad, como el autismo o la esquizofrenia. Aquí, se describe un diseño de micro-drive, procedimiento de implantación quirúrgica y estrategia de recuperación postoperatoria que permiten grabaciones crónicas de campo y de una sola unidad de múltiples regiones cerebrales simultáneamente en ratones a medida que envejecen desde el día postnatal 20 (p20) hasta el día postnatal 60 (p60) y más allá, una ventana de tiempo que corresponde aproximadamente a las edades humanas de 2 años hasta la edad adulta. El número de electrodos de registro y los sitios de registro final se pueden modificar y ampliar fácilmente, lo que permite un control experimental flexible del monitoreo in vivo de las regiones cerebrales relevantes para el comportamiento o la enfermedad a lo largo del desarrollo.
Introducción
El cerebro sufre cambios a gran escala durante las ventanas críticas del desarrollo de la infancia y la adolescencia 1,2,3. Muchas enfermedades neurológicas y psiquiátricas, incluyendo el autismo y la esquizofrenia, se manifiestan por primera vez conductual y biológicamente durante este período de desarrollo cerebral juvenil y adolescente 4,5,6. Si bien se sabe mucho sobre los cambios celulares, sinápticos y genéticos que ocurren a través del desarrollo temprano, comparativamente se sabe poco sobre cómo cambian los procesos a nivel de circuito o red a lo largo de esta ventana de tiempo. Es importante destacar que la función cerebral a nivel de circuito, que en última instancia subyace a comportamientos complejos, memoria y cognición, es una propiedad emergente no predecible de la función celular y sináptica 7,8,9,10. Por lo tanto, para comprender completamente la función cerebral a nivel de red, es necesario estudiar directamente la actividad neuronal a nivel de un circuito neuronal intacto. Además, para identificar cómo se altera la actividad cerebral a lo largo de la progresión de los trastornos neuropsiquiátricos, es fundamental examinar la actividad de la red en un modelo de enfermedad válido durante la ventana temporal específica cuando se manifiestan los fenotipos conductuales de la enfermedad y rastrear los cambios observados a medida que persisten en la edad adulta.
Uno de los organismos modelo científicos más comunes y poderosos es el ratón, con un gran número de cepas genéticas únicas que modelan trastornos del neurodesarrollo con inicio dependiente de la edad de los fenotipos conductuales y / o mnemotécnicos 11,12,13,14,15,16,17,18,19,20,21 . Si bien es difícil correlacionar puntos de tiempo de desarrollo precisos entre los cerebros de humanos y ratones, las comparaciones morfológicas y de comportamiento indican que los ratones p20-p21 representan las edades humanas de 2-3 años, y los ratones p25-p35 representan las edades humanas de 11-14 años, con ratones que probablemente alcancen el equivalente de desarrollo de un adulto humano de 20 años en p603, 22. Por lo tanto, para comprender mejor cómo se desarrolla el cerebro juvenil e identificar cómo las redes neuronales del cerebro se vuelven disfuncionales en enfermedades como el autismo o la esquizofrenia, sería ideal monitorear directamente la actividad cerebral in vivo en ratones de 20 días a 60 días de edad.
Sin embargo, un desafío fundamental en el monitoreo de la actividad cerebral a través del desarrollo temprano en ratones es el pequeño tamaño y la debilidad relativa de los ratones jóvenes. La implantación crónica de electrodos, que es necesaria para estudios longitudinales del desarrollo cerebral, generalmente requiere una carcasa grande y voluminosa para proteger los cables finos de los electrodos y las placas de interfaz23,24, y los implantes deben estar firmemente unidos al cráneo del ratón, que es más delgado y menos rígido en ratones jóvenes debido a la osificación reducida. Por lo tanto, prácticamente todos los estudios de fisiología de roedores in vivo se han realizado en sujetos adultos debido a su tamaño relativo, fuerza y grosor del cráneo. Hasta la fecha, la mayoría de los estudios que exploran la fisiología cerebral de roedores juveniles in vivo se han realizado en ratas juveniles de tipo salvaje, lo que necesariamente limita la capacidad de monitorear experimentalmente la función cerebral juvenil en un modelo de comportamiento libre de un trastorno humano 25,26,27,28,29,30.
Este manuscrito describe el nuevo alojamiento del implante, un procedimiento de implantación quirúrgica y una estrategia de recuperación posterior a la cirugía para estudiar crónicamente la función cerebral in vivo a largo plazo (hasta 4 o más semanas) de ratones jóvenes a través de una ventana de tiempo crítica para el desarrollo (p20 a p60 y más allá). El procedimiento de implantación permite la fijación fiable y permanente de los electrodos a los cráneos de ratones jóvenes. Además, el diseño de micro-drive es ligero, ya que este micro-drive pesa ~ 4-6 g cuando está completamente ensamblado, y debido al contrapeso mínimo requerido para compensar el peso del implante, no afecta el rendimiento conductual de ratones jóvenes durante los paradigmas de comportamiento típicos.
Protocolo
El presente estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales del Centro Médico Southwestern de la Universidad de Texas (protocolo 2015-100867) y se realizó de conformidad con las pautas institucionales y del Instituto Nacional de Salud. Los ratones machos y hembras C57/Bl6 utilizados en el presente estudio se implantaron en p20 (peso 8,3-11,1 g en el momento de la implantación).
1. Diseño y construcción de micro-accionamientos
- Diseño e impresión digital del microaccionamiento (Figura 1)
- Descargue las plantillas de modelo de micro-drive (https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive).
- Identificar las ubicaciones estereotáxicas de la(s) región(es) del cerebro diana en un atlas estereotáxico apropiado.
- Utilizando el software de diseño tridimensional asistido por computadora (CAD 3D), cargue la cánula de microunidad de plantilla (Figura 1B).
- Si es necesario, modifique las ubicaciones de salida de la cánula de salida en el modelo de cánula de microaccionamiento para apuntar a la(s) región(es) cerebral(es) deseada(s).
NOTA: Cada extrusión del orificio de la cánula debe tener al menos 2 mm de largo para garantizar que el tetrodo emerja del orificio de la cánula apuntando directamente al objetivo. La plantilla de cánula de micro-drive está diseñada para apuntar bilateralmente a la corteza cingulada anterior (un tetrodo por hemisferio), el área del hipocampo CA1 (cuatro tetrodes por hemisferio) y el área del hipocampo CA3 (dos tetrodes por hemisferio), con un tetrodo de referencia por hemisferio posicionado en la sustancia blanca sobre el área del hipocampo CA1. - Si es necesario, modifique el cuerpo del microaccionamiento (Figura 1A) para acomodar la conexión de la placa de interfaz electrónica (EIB).
- Imprima el cuerpo de la unidad de micro-drive, la cánula, el cono y la tapa en alta resolución en una impresora 3D (idealmente con una resolución superior a 25 μm) y prepare los materiales impresos de acuerdo con los protocolos del fabricante. Utilice resinas de impresora con alta rigidez.
- Montaje de los tornillos y accesorios personalizados (Figura 2A, B)
- Con el software CAD 3D, cargue los modelos de fijación de tornillo (Figura 1E).
- Imprima los accesorios de tornillo en alta resolución en una impresora 3D (idealmente con una resolución de al menos 25 μm) y prepare los materiales impresos de acuerdo con los protocolos del fabricante. Utilice resinas de impresora con alta rigidez.
- Fije los accesorios de tornillo a cada tornillo de avance de tetrode (Figura 1F) (los tornillos de avance de tetrodeo se fabrican a medida en un taller de máquinas antes de la construcción de microaccionamientos).
- Fije dos accesorios de tornillo a cada tornillo, con uno arriba y otro debajo de la cresta. Asegúrese de que la parte inferior de cada accesorio de tornillo entre en contacto con la cresta. Sujete los accesorios de tornillo junto con cianoacrilato de gel.
- Una vez fijados, asegúrese de que los accesorios del tornillo no se muevan en el eje longitudinal del tornillo, sino que giren libremente con una resistencia mínima.
- Montaje del cuerpo del microaccionamiento (Figura 2C, D)
- Usando tijeras finas y afiladas, corte tubos grandes de poliimida (diámetro exterior: 0.2921 mm, diámetro interno: 0.1803 mm) en secciones de ~6 cm de largo.
- Pase las secciones grandes de poliimida a través de los orificios de salida en la cánula de microaccionamiento para que cada tubo se extienda más allá de la parte inferior de la cánula unos pocos milímetros.
- Con una aguja limpia de 30 G, fije la poliimida a la cánula aplicando pequeñas cantidades de cianoacrilato líquido. Tenga cuidado de no permitir que el cianoacrilato entre en el interior del tubo de poliimida.
NOTA: El goteo de cianoacrilato líquido hacia abajo en la cánula a través de la parte superior del cuerpo de la unidad puede acelerar este proceso, pero requerirá volver a limpiar los orificios guía más adelante con un taladro de punta fina. - Pase los tubos de poliimida grandes desde la parte superior de la cánula de microaccionamiento a través de los orificios de poliimida grandes apropiados en el cuerpo del microaccionamiento.
- Empuje lentamente la cánula de microaccionamiento y el cuerpo del microaccionamiento juntos hasta que estén adyacentes y las pestañas de fijación de la cánula/cuerpo se entrelazen. Tenga cuidado de no torcer o dañar los tubos de poliimida en el proceso.
NOTA: Cada tubo de poliimida debe pasar suavemente desde la parte inferior de la cánula a través de la parte superior del cuerpo de micro-drive. La flexión leve es normal, pero la flexión excesiva del tubo de poliimida puede deformar el tetrodo y evitar que pase directamente al cerebro. - Fije el cuerpo del microaccionamiento y la cánula del microaccionamiento con cianoacrilato.
- Con una nueva cuchilla de afeitar afilada, corte los grandes extremos del tubo de poliimida que salen de la parte inferior de los orificios de salida de la cánula. Asegúrese de que el corte esté exactamente en la base de la cánula, haciendo que los tubos y la parte inferior de la cánula se enrasen entre sí.
- Con unas tijeras afiladas, corte el tubo grande de poliimida justo por encima del borde del borde interior del cuerpo de la unidad en un ángulo de ~45°.
- Carga de los tornillos personalizados ensamblados (Figura 2E)
- Atornille cada tornillo personalizado ensamblado en los orificios exteriores del cuerpo de la unidad de micro-drive. Asegúrese de que la guía del tornillo pase a través del orificio grande en los accesorios del tornillo. Avance cada tornillo completamente hasta que no avance más. Se recomienda prelubricar los tornillos con aceite mineral o grasa para ejes.
- Usando tijeras extremadamente afiladas, corte pequeños tubos de poliimida (diámetro exterior: 0.1397 mm, diámetro interno: 0.1016) en secciones de ~ 4 cm de largo.
- Pase las pequeñas secciones de poliimida a través del tubo grande de poliimida ya montado en el microaccionamiento. Asegúrese de que el exceso de tubos pequeños de poliimida sobresalga de la parte superior e inferior de cada tubo grande de poliimida.
- Fije los pequeños tubos de poliimida a los accesorios de tornillo a través de cianoacrilato, teniendo cuidado de no dejar que ningún cianoacrilato entre en los tubos de poliimida grandes o pequeños.
- Con una nueva y afilada cuchilla de afeitar, corte los pequeños extremos del tubo de poliimida que están extruyendo de la parte inferior de los orificios de la cánula. Asegúrese de que el corte esté exactamente en la base de la cánula y que el corte esté limpio, sin nada que bloquee el orificio del tubo de poliimida.
- Con unas tijeras afiladas, corte la parte superior de la pequeña poliimida unos milímetros por encima de la parte superior del accesorio del tornillo en un ángulo de ~45°. Asegúrese de que el corte esté limpio, sin nada que bloquee el orificio del tubo de poliimida.
- Cargando los tetrodes
- Preparar los tetrodes (~6 cm de longitud) utilizando los métodos descritos anteriormente31.
- Usando pinzas con punta de cerámica o goma, pase cuidadosamente un tetrodo a través de uno de los pequeños tubos de poliimida, dejando ~2 cm sobresaliendo de la parte superior del tubo pequeño de poliimida.
- Fije el tetrodo a la parte superior del tubo pequeño de poliimida a través de cianoacrilato líquido, teniendo cuidado de no fijar los tubos de poliimida pequeños y grandes juntos en el proceso.
- Retraiga el tornillo hasta que esté cerca de la parte superior de la unidad.
- Agarre el alambre de tetrodo que sobresale de la parte inferior de la unidad y retuerce suavemente en el punto donde emerge de la cánula.
- Vuelva a meter el tornillo completamente en la unidad.
- Con unas tijeras muy afiladas, corta el alambre de tetrodo justo encima de la torcedura. Bajo un microscopio, asegúrese de que el corte esté limpio y que el metal de los cuatro tetrodes esté expuesto.
- Retraiga el tornillo hasta que el tetrodo esté asegurado dentro de la cánula.
- Repita los pasos 1.5.2-1.5.8 para todos los tornillos.
- Acople el BEI a la plataforma de apoyo del BEI mediante pequeños tornillos de joyería.
- Conecte cada electrodo de cada tetrodo al puerto apropiado en el BEI.
- Preparación del micro-drive para la cirugía
- Planchar eléctricamente los tetrodes para reducir la impedancia eléctrica utilizando los métodos descritos anteriormente31.
- Después del chapado, asegúrese de que cada tetrodo esté alojado en la cánula de tal manera que la punta del tetrodo esté al ras con la parte inferior de cada orificio de cánula.
- Deslice el cono de microunidad alrededor de la microunidad completada. Fije la tapa del microaccionamiento al cono del microaccionamiento deslizando el poste de fijación del cono en el puerto de la tapa.
- Oriente el cono de modo que los conectores EIB pasen libremente a través de los orificios de paso de conexión EIB cuando la tapa esté cerrada, y pegue el cono en su lugar con cianoacrilato colocado alrededor de la base del cono, teniendo cuidado de no dejar entrar cianoacrilato en ninguno de los orificios de salida de la cánula. Retire la tapa.
- Rellene cuidadosamente cada orificio de la cánula con aceite mineral estéril para evitar que los fluidos corporales entren en los orificios de poliimida después de la implantación quirúrgica.
- Cubra cuidadosamente la base de la cánula con vaselina estéril. Esto servirá como una barrera para evitar que los agentes químicos (por ejemplo, cemento dental) entren en el cerebro expuesto durante la cirugía.
- Pese el microaccionamiento, la tapa y los cuatro tornillos de hueso completamente ensamblados para preparar un contrapeso de igual peso.
- Opcionalmente, antes de la cirugía, extruya los tetrodes a una distancia que sea apropiada para alcanzar las regiones cerebrales objetivo una vez que la unidad esté al ras del cráneo.
NOTA: Antes de la implantación quirúrgica, esterilizar el implante mediante esterilización por gas en óxido de etileno (500-1200 mg/L, 2-4 horas). Todos los tornillos óseos e instrumentos quirúrgicos deben esterilizarse en autoclave (121°C, 30 minutos).
2. Implantación quirúrgica
- Anestesiar el ratón y montarlo en el aparato estereotáxico
- Coloque el ratón en una caja pequeña con espacio suficiente para moverse, y anestesiar el ratón con 3% -4% de isoflurano.
NOTA: Se pueden usar otros agentes anestésicos, pero se debe tener precaución debido a la edad, el tamaño y el peso del sujeto de ratón juvenil. - Una vez que el ratón no responda (sin respuesta al pellizco de la cola, una frecuencia de ventilación de ~ 60 respiraciones por minuto), retírelo de la caja y móntelo rápidamente en el aparato estereotáxico.
- Rápidamente, coloque la máscara estereotáxica sobre el hocico del ratón y mantenga la anestesia al 1-3% de isoflurano. Aplique cualquier alivio del dolor aprobado por la veterinaria, como buprenorfina de liberación sostenida (0.05-0.5 mg / kg subcutáneo), o agentes antiinflamatorios, como carprofeno (5-10 mg / kg subcutáneo), antes de la incisión quirúrgica inicial.
- Asegure completamente la cabeza del ratón en el aparato estereotáxico con barras para los oídos. Asegúrese de que el cráneo esté nivelado e inmóvil sin ejercer presión innecesaria sobre los canales auditivos del ratón. Debido a la osificación limitada de los huesos del cráneo juveniles, es posible causar daño permanente durante la fijación de la cabeza.
- Coloque el ratón en una caja pequeña con espacio suficiente para moverse, y anestesiar el ratón con 3% -4% de isoflurano.
- Preparar al ratón para la cirugía y exponer el cráneo
- Proteja los ojos del ratón colocando un pequeño volumen de gel lagrimal sintético en cada ojo y cubriendo cada ojo con un parche de papel de aluminio esterilizado en autoclave.
NOTA: Las lágrimas sintéticas mantendrán los ojos húmedos, mientras que la lámina evitará que cualquier fuente de luz cause daños a largo plazo. Se prefieren las soluciones de lágrimas sintéticas más gruesas, ya que también pueden servir como barrera para la introducción inadvertida de otras soluciones quirúrgicas potencialmente tóxicas (etanol, acrílico dental, etc.) en los ojos. - Usando hisopos estériles con punta de algodón, aplique crema depilatoria sobre el área quirúrgica para eliminar el vello del cuero cabelludo. Tenga cuidado de no poner la crema cerca de los ojos. Después de quitar el vello, coloque una cortina estéril sobre el cuero cabelludo para asegurar el área quirúrgica.
- Usando hisopos estériles con punta de algodón, limpie el cuero cabelludo a través de tres lavados consecutivos de solución de povidona yodada (10%) seguida de alcohol isopropílico (100%).
- Con un bisturí estéril o unas tijeras finas, retire el cuero cabelludo.
- Usando hisopos estériles con punta de algodón y soluciones estériles de solución salina (0,9% de NaCl) y peróxido de hidrógeno, limpie a fondo el cráneo.
- Identifique el bregma y, utilizando el aparato estereotáxico, marque cuidadosamente las ubicaciones de registro objetivo en el cráneo con un marcador permanente.
- Proteja los ojos del ratón colocando un pequeño volumen de gel lagrimal sintético en cada ojo y cubriendo cada ojo con un parche de papel de aluminio esterilizado en autoclave.
- Abrir el orificio de la cánula y unir los anclajes óseos
- Retire el cráneo que se superpone a los sitios de grabación. # Debido a la delgadez del cráneo a esta edad, corte el cráneo con una hoja de bisturí; Esto elimina la necesidad de usar un taladro, que puede dañar la duramadre subyacente. Mantenga la duramadre expuesta húmeda con la aplicación de solución salina estéril (NaCl al 0,9%) o aceite mineral estéril. No retire ni perfore la duramadre en esta etapa, ya que es lo suficientemente delgada en ratones jóvenes para que los tetrodes pasen en pasos futuros.
- Perfore cuidadosamente los orificios piloto para cuatro tornillos óseos.
- Coloque los tornillos óseos en las porciones laterales y rostrales o caudales extremas del cráneo, donde el hueso es más grueso y los tornillos óseos están lo suficientemente lejos del implante de micro-drive. Para los tornillos óseos, use tornillos estériles de joyería fina (por ejemplo, rosca UNM 120, cabeza de 1,5 mm).
- Enrolle firmemente un tornillo óseo con un cable delgado y altamente conductor que servirá de toma de tierra y se unirá al BEI en el paso 2.4.6.
- Usando una hoja de bisturí o con cuidado usando una broca, marque el cráneo cerca de las ubicaciones del orificio del tornillo óseo. La puntuación es importante para proporcionar una superficie suficientemente rugosa para que el cianoacrilato líquido se una en el paso 2.3.5.
- Usando un destornillador estéril y una abrazadera de tornillo estéril, enrosque cada tornillo óseo estéril en su lugar, teniendo cuidado de no perforar la duramadre subyacente.
- Con una aguja estéril de 30 G, coloque cianoacrilato líquido alrededor de cada tornillo óseo. Esto engrosa efectivamente el cráneo donde se han unido los tornillos óseos. Tenga cuidado de no permitir que ningún cianoacrilato entre en la duramadre expuesta por encima de los sitios de grabación.
- Bajar y conectar el microaccionamiento (Figura 2G)
- Monte el microaccionamiento completo en el aparato estereotáxico para bajarlo cuidadosamente sobre el cráneo del ratón. Asegúrese de que la cánula de microaccionamiento esté en las coordenadas adecuadas cuando se baje.
- Baje el microaccionamiento lentamente, moviéndose solo en la dirección dorsal/ventral. Baje el micro-drive con los tetrodes ya avanzados fuera de los orificios de la cánula (paso 1.6.6) para visualizar su entrada en el cerebro; Cualquier movimiento medial/lateral o rostral/caudal cuando los tetrodes están tocando el ratón puede doblar los tetrodes y hacer que pierdan su destino final.
- Una vez que el micro-drive esté completamente bajado, asegúrese de que la base de la cánula solo haga contacto con el cráneo / duramadre. La capa de vaselina y/o aceite mineral servirá como barrera para cubrir la duramadre expuesta. Si es necesario, agregue vaselina estéril o cera ósea estéril para cubrir el exceso de duramadre expuesta.
- Mientras mantiene el micro-drive en su lugar con el aparato estereotáxico, cubra el cráneo con cemento dental para fijar la base de micro-drive a los tornillos óseos implantados.
NOTA: El cemento dental debe envolver completamente todos los tornillos óseos y debe cubrir la repisa de anclaje de cemento dental en la cánula de microaccionamiento. - Mientras el cemento dental se fija, dale forma cuidadosamente para evitar esquinas afiladas o bordes que puedan dañar el mouse o dañar el micro-drive. Asegúrese de que haya suficiente cemento dental para sostener el micro-drive, pero elimine el exceso de cemento dental que agregará peso innecesario.
- Enhebra con cuidado el cable de tierra a través del microaccionamiento y conéctelo a la ranura adecuada en el BEI.
- Una vez que el cemento dental esté completamente fraguado, separe cuidadosamente el microaccionamiento del aparato estereotáxico. Coloque la tapa en el micro-drive.
- Con un hisopo estéril con punta de algodón y solución salina estéril, limpie el ratón.
- Con un hisopo estéril con punta de algodón, aplique una capa delgada de ungüento antibiótico en cualquier cuero cabelludo expuesto cerca del sitio del implante.
- Retire la lámina de los ojos del ratón.
- Retire el ratón del aparato estereotáxico, teniendo cuidado de soportar el peso adicional del microaccionamiento a medida que el ratón se transporta a una jaula limpia.
3. Recuperación postoperatoria
- Recuperación inmediata
- Antes de la cirugía, prepare el sistema de contrapeso conectando una tubería de PVC de 0,75 de diámetro, como se muestra en la Figura 2G. Un brazo del sistema pasa a través de orificios perforados en la tapa de la jaula, el segundo brazo descansa sobre la tapa de la jaula y el tercer brazo se extiende por encima y más allá de la jaula. El brazo superior está tapado.
- Fije cuidadosamente el microaccionamiento al sistema de contrapeso (Figura 2G-I) y utilice un peso de contrapeso idéntico al peso del microaccionamiento y los tornillos óseos. Pase un hilo fuerte o una línea de pesca desde un conector conectado al BEI sobre los tres brazos del sistema de contrapeso hasta el peso de contrapeso, que cuelga sobre el brazo superior.
- Asegúrese de que el contrapeso esté fuertemente conectado al EIB de microaccionamiento y de que haya suficiente línea para dar al ratón acceso completo a la totalidad de la jaula.
- Proporcione gel rico en nutrientes en la jaula junto con comida de roedor normal humedecida para garantizar la rehidratación y la recuperación.
- Controle al ratón hasta que se recupere completamente de la anestesia quirúrgica.
- Recuperación a largo plazo
- En todo momento, cuando no esté conectado al aparato de control, asegúrese de que el microaccionamiento sea compatible con el sistema de contrapeso. Reduzca el contrapeso con el tiempo, pero nunca lo retire por completo para evitar tensiones imprevistas en el ratón o torsión en los tornillos óseos.
- Para evitar daños en el implante y el sistema de contrapeso, aloje al ratón sin posibilidad de interacción directa con otros ratones durante la duración del experimento.
- Proporcione gel rico en nutrientes durante al menos 3 días después de la cirugía, momento en el cual los alimentos sólidos por sí solos serán suficientes.
- Debido a los requisitos aéreos del sistema de contrapeso, no proporcione alimentos ni agua en una malla de alambre aéreo; Coloque la comida en el piso de la jaula y proporcione agua a través del costado de la jaula. Para evitar el deterioro, reemplace la comida por completo todos los días.
- Diariamente, asegúrese de que el ratón tenga acceso libre a la totalidad de la jaula y que el contrapeso esté firme y fuertemente unido al microaccionamiento.
Resultados
El protocolo descrito anteriormente se utilizó para registrar señales de potencial de campo local y unidades individuales de múltiples áreas cerebrales simultáneamente en ratones, con registros diarios realizados en los mismos ratones de p20 a p60. Aquí se informan registros electrofisiológicos representativos de dos ratones e histología posterior al experimento que demuestran las ubicaciones finales de registro.
Implantación quirúrgica del micro-drive en ratones p20
Se construyó un microaccionamiento (Figura 1) (Figura 2) y se implantó quirúrgicamente en un ratón p20, como se describió anteriormente. Inmediatamente después de la cirugía, el ratón se conectó al sistema de contrapeso (Figura 2G-I) y se le permitió recuperarse. Una vez que el ratón estaba completamente móvil, el micro-drive se conectó a un sistema de registro de electrofisiología in vivo. Los cables que conectaban el microaccionamiento al equipo de grabación estaban suspendidos sobre el ratón. Se obtuvieron grabaciones electrofisiológicas (32 kHz) en todos los canales durante 1 h mientras el ratón se comportaba naturalmente en su jaula doméstica. Después de la grabación, el ratón se desenchufó del sistema de grabación, se volvió a conectar al sistema de contrapeso y se devolvió al vivero con acceso gratuito al agua y a la comida.
Registro diario de la actividad neuronal
Los registros electrofisiológicos se obtuvieron diariamente durante varias semanas para permitir el monitoreo crónico de la misma región del cerebro a través de las ventanas críticas de desarrollo de p20-p60. En la Figura 3A, C se muestran los potenciales de campo local (LFP) brutos de muestra de los registros crónicos. Se obtuvieron simultáneamente unidades individuales aisladas de múltiples tetrodes (Figura 3B). Se identificaron unidades con formas de onda similares a lo largo de varios días (Figura 3B, centro y derecha), pero debido a la posible deriva del electrodo de registro, no fue posible afirmar definitivamente que la misma unidad se estaba identificando a lo largo de los días. En un ratón separado implantado en p20 y registrado diariamente durante varias semanas, la actividad neuronal se examinó en un tetrodo dirigido al área dorsal CA1. Se identificaron ondulaciones de gran amplitud y unidades individuales bien aisladas en cada día de la grabación (Figura 4). Estos datos indican que las grabaciones electrofisiológicas in vivo estables y de alta calidad podrían provenir del mismo ratón a lo largo del desarrollo temprano.
Confirmación histológica de los sitios de registro y el impacto en el desarrollo de la implantación crónica
Después del último día de grabación, el ratón fue completamente anestesiado mediante anestesia con isoflurano seguido de una inyección letal de pentobarbital sódico, y se pasó una corriente a través de las puntas de los electrodos para producir pequeñas lesiones en los sitios de registro. La sección histológica posterior al experimento del cerebro del ratón permitió la visualización de los sitios de registro final (Figura 5A, B). En una cohorte separada, tres ratones machos y tres hembras fueron implantados quirúrgicamente en p20 como se describió anteriormente. Un número igual de compañeros de camada se dejaron sin implantar y se mantuvieron en condiciones de alojamiento idénticas. Los ratones fueron sacrificados en p62 (6 semanas después de la cirugía para la cohorte implantada). Los cráneos se limpiaron cuidadosamente y se tomaron medidas externas de la distancia de bregma a lambda (Figura 5C, arriba a la izquierda) y el ancho máximo externo del cráneo en lambda (Figura 5C, arriba a la derecha). Se hizo una incisión a lo largo de la línea media del cráneo, y se extrajo la mitad del cráneo para extirpar el cerebro para la medición de masa (Figura 5C, abajo a la derecha). La altura de la cavidad craneal en bregma se midió a partir de la mitad intacta del cráneo (Figura 5C, abajo a la izquierda). Ninguna medida fue significativamente diferente entre las cohortes implantadas y no implantadas (prueba de suma de rangos de Wilcoxon), lo que indica que la implantación a largo plazo, a partir de p20, no tiene un impacto bruto en el desarrollo natural del cráneo o el volumen cerebral.

Figura 1: Componentes de microaccionamiento. Representaciones tridimensionales del (A) cuerpo de microaccionamiento, (B) cánula, (C) cono, (D) tapa, (E) accesorios de tornillo y (F) tornillo de avance de tetrode. Se indican las características críticas de cada componente. Los detalles de medición se pueden extraer de los archivos de modelo disponibles en https://github.com/Brad-E-Pfeiffer/JuvenileMouseMicroDrive/. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Construcción de microaccionamientos . (A) Vista lateral y (B) superior del tornillo de avance tetrodeo con los accesorios de tornillo superior e inferior conectados. (C) Vista lateral y (D) superior del microaccionamiento con el cuerpo y la cánula unidos y el tubo grande de poliimida que atraviesa cada orificio de la cánula y se recorta a la parte inferior de la cánula. (E) Vista lateral del microaccionamiento con los tornillos y el pequeño tubo de poliimida en su lugar. La parte superior de los pequeños tubos de poliimida se recorta inmediatamente antes de la carga del tetrodo. (F) Micro-drive completado conectado al aparato estereotáxico. El cono protector que normalmente rodearía el micro-drive se ha eliminado con fines de visualización. Tenga en cuenta que algunos de los accesorios de tornillo se imprimieron en una resina negra para este micro-drive. (G) Sistema de apoyo de contrapeso. (H) Vista lateral y (I) superior de una jaula para ratón con el sistema de soporte de contrapeso conectado. Haga clic aquí para ver una versión más grande de esta figura.
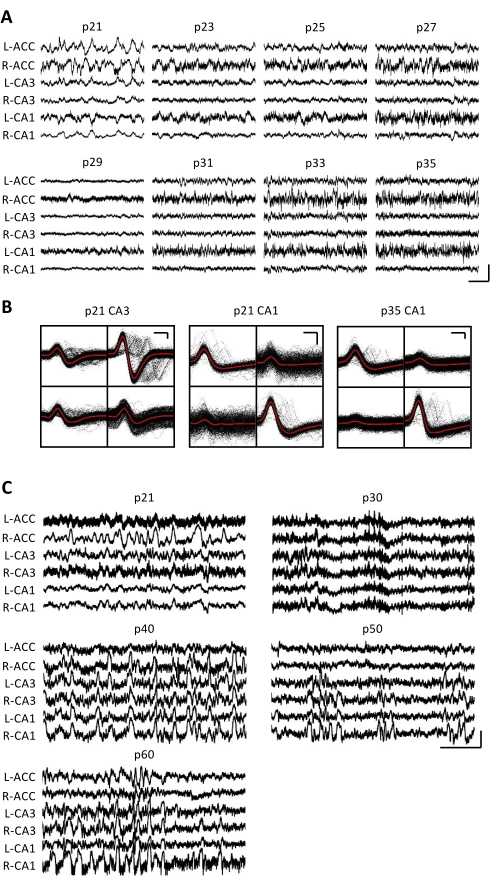
Figura 3: Registros electrofisiológicos representativos. A un ratón p20 se le implantó un micro-drive como se describió anteriormente. A partir de p21 y todos los días a partir de entonces durante 2 semanas, el ratón se conectó al aparato de registro y se registró la actividad neuronal durante al menos 1 h. (A) Registros de potencial de campo local bruto (LFP) del bilateral (L = izquierda; R = derecha) corteza cingulada anterior (ACC), área del hipocampo CA3 (CA3) y área del hipocampo CA1 (CA1). Los datos fueron recolectados todos los días; Para mayor claridad, solo se muestran los datos de los días impares. Todos los rastros fueron tomados durante períodos de inmovilidad en la jaula del hogar. Barra de escala: 1 mV, 2 s. (B) Unidades individuales representativas aisladas del área del hipocampo CA3 (izquierda) y CA1 (derecha) para las grabaciones en el panel A. Todas las formas de onda en bruto en cada electrodo se muestran en negro; El promedio está en rojo. Barra de escala: 50 μV, 0,2 ms. (C) Trazas representativas de LFP en bruto para cada 10º día hasta el último día de grabación en p60 para un segundo ratón implantado en p20. Los datos fueron recolectados todos los días; Para mayor claridad, solo se muestran los datos de cada 10º día. Todos los rastros fueron tomados durante períodos de inmovilidad en la jaula del hogar. Barra de escala: 1 mV, 2 s. Haga clic aquí para ver una versión más grande de esta figura.
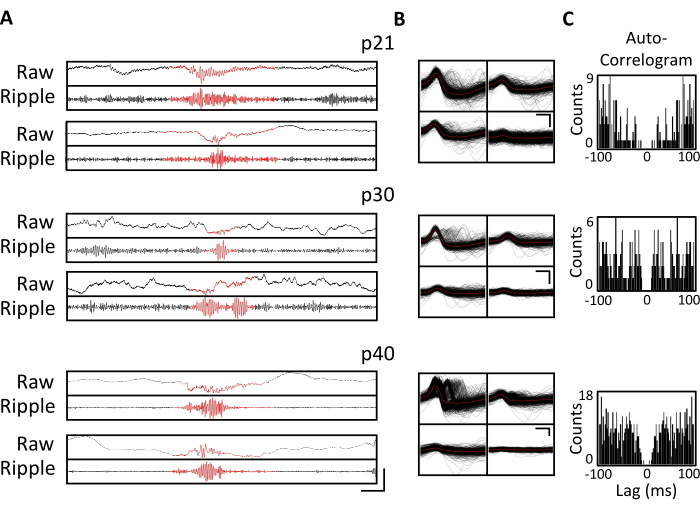
Figura 4. Estabilidad de las grabaciones crónicas. Un ratón p20 fue implantado con un micro-drive, como se describió anteriormente. A partir de p21 y posteriormente durante 4 semanas, el ratón se conectó al aparato de registro y se registró la actividad neuronal durante al menos 1 h. Se muestran datos de los tetrodes dirigidos al hipocampo dorsal CA1. (A) LFP sin procesar (arriba) y filtrado por ondulación (abajo) para eventos de ondulación identificados en p21, p30 y p40. Para identificar eventos de ondulación, el LFP bruto se filtró de paso de banda entre 125 Hz y 300 Hz, y los eventos de ondulación se identificaron como aumentos transitorios en la potencia de la banda de ondulación superiores a 3 desviaciones estándar por encima de la media. El comienzo y el final de cada ondulación se definieron como el punto en que la potencia de la banda de ondulación regresó a la media. Las ondulaciones identificadas se muestran en rojo. Barra de escala: 100 ms, de arriba a abajo: 1.000 μV, 140 μV, 1.800 μV, 180 μV, 9.000 μV, 1.200 μV, 10.000 μV, 1.000 μV. (B) Una sola unidad representativa de cada día del tetrodo dirigido a CA1 para las grabaciones en el panel A. Todas las formas de onda en bruto en cada electrodo se muestran en negro; El promedio está en rojo. Barra de escala 0,2 ms, de arriba a abajo: 50 μV, 100 μV, 100 μV. (C) Autocorrelograma de todos los picos para unidades individuales en el panel B. Estos datos demuestran la colocación estable de electrodos dentro de la capa piramidal del hipocampo durante varias semanas. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Histología representativa e impacto en el desarrollo del cráneo. Un ratón p20 fue implantado con un micro-drive, como se describió anteriormente. Después del último día de grabación en p60, se produjeron lesiones electrolíticas en los sitios de registro, y el cerebro se perfundió con paraformaldehído al 4%. Para identificar los sitios de grabación, se produjeron secciones de 50 μm. (A) Lesiones en CA1 y CA3 del hipocampo. La punta de flecha denota el sitio de grabación CA3; la punta de flecha doble indica el sitio de grabación CA1. Barra de escala: 0,5 mm. (B) Lesiones en el CCA bilateral. Las puntas de flecha denotan los sitios de grabación ACC. Barra de escala: 0,5 mm. (C) Medidas del tamaño del cráneo y la masa cerebral de ratones p62 implantados con un micro-drive en p20 (gris) y compañeros de camada no implantados (blanco). El valor p de la prueba de suma de rangos de Wilcoxon se informa para cada medición. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Los experimentos modernos que exploran la función del circuito neuronal in vivo en roedores a menudo utilizan electrofisiología extracelular a través de electrodos implantados permanentemente para monitorear la actividad de neuronas individuales (es decir, unidades individuales) o poblaciones locales (a través de potenciales de campo local, LFP), pero tales métodos rara vez se aplican a ratones jóvenes debido a desafíos técnicos. Este manuscrito describe un método para obtener registros electrofisiológicos in vivo en ratones a través de las ventanas críticas para el desarrollo de p20 a p60 y más allá. Esta metodología implica un proceso de fabricación para la impresión y construcción de un implante de micro-drive, un procedimiento de implantación quirúrgica y una estrategia de recuperación postoperatoria, todos los cuales están diseñados específicamente para su uso en ratones jóvenes. Varias consideraciones influyeron en el desarrollo de este protocolo, incluido el pequeño tamaño y la debilidad relativa de los ratones jóvenes en comparación con sus contrapartes adultas, así como la osificación reducida del cráneo de ratón juvenil al que se necesitaba unir el microimpulso.
Dos métodos principales comúnmente utilizados para realizar electrofisiología in vivo son matrices de electrodos (por ejemplo, tetrodos) y sondas de silicio. Las sondas de silicio son ligeras, pueden proporcionar un gran número de sitios de registro por unidad de peso y se han utilizado previamente en ratas jóvenes25. Sin embargo, las sondas de silicio son relativamente caras por unidad. En contraste, el micro-drive descrito en este manuscrito se puede construir utilizando menos de $ 50 USD en materias primas, lo que lo convierte en una opción rentable para la grabación in vivo . Además, las sondas de silicio a menudo deben implantarse en líneas fijas, lo que prohíbe el registro de regiones cerebrales espacialmente diversas. En contraste, el diseño de micro-drive descrito en este manuscrito utiliza tetrodes ajustables independientemente para acomodar grabaciones simultáneas en hasta 16 ubicaciones diferentes sin prácticamente ninguna restricción en la relación espacial entre esas ubicaciones. Este diseño de microaccionamiento se puede modificar fácilmente para permitir apuntar a ubicaciones diferentes a las descritas aquí moviendo las extrusiones de orificios de cánula a cualquier ubicación anterior / posterior y medial / distal deseada. Cuando se dirige a áreas cerebrales alternativas, es importante tener en cuenta que, si bien los tetrodes a menudo viajan rectos, es posible que estos cables delgados se desvíen ligeramente a medida que salen de la cánula de micro-drive. Por lo tanto, cuanto más pequeña o más ventral sea una región del cerebro, más difícil será apuntar con éxito al área con tetrodos.
El implante de micro-drive descrito en este manuscrito es fundamentalmente similar a varios diseños anteriores de micro-drive basados en tetrode 23,32,33,34,35 en que los tetrodes individuales están fijados a tornillos, que permiten el control fino de la profundidad de grabación de cada tetrode. Si bien varias características del diseño actual de micro-drive son únicas, incluida la facilidad de dirigirse a áreas cerebrales distribuidas espacialmente, la principal novedad del manuscrito actual es la descripción de la implantación quirúrgica y las estrategias de recuperación postoperatoria, que permiten estudios crónicos de la actividad de la red en ratones juveniles aún en desarrollo. De hecho, las metodologías de cirugía y recuperación descritas aquí podrían adaptarse para soportar otros implantes en ratones jóvenes.
Para mantener un registro consistente durante varios días, los cables o sondas deben fijarse rígidamente al cráneo. Mientras que la estructura general del cráneo del ratón sufre sólo cambios menores después de p20, el cráneo se engrosa considerablemente entre las edades de p20 y p4536. De hecho, el cráneo en p20 no es lo suficientemente rígido como para soportar un implante conectado sin dañarse. Para superar esta limitación biológica, este protocolo engrosa artificialmente el cráneo a través de cianoacrilato durante la cirugía de implantación. La implantación en ratones menores de p20 es probablemente posible utilizando esta estrategia, pero el cráneo del ratón sufre cambios considerables de tamaño y forma hasta aproximadamente p2036. Por lo tanto, no se recomienda la implantación durante períodos prolongados en ratones menores de p20, ya que el cianoacrilato y los tornillos óseos fijos en el cráneo aún en desarrollo pueden afectar significativamente el crecimiento natural del cráneo y el desarrollo del tejido cerebral subyacente. Es importante destacar que, en este estudio, no se observó ningún impacto en las mediciones brutas del tamaño del cráneo o del cerebro después de la implantación crónica a partir de p20 (Figura 5C).
Un paso crítico en el método descrito en este manuscrito es la estrategia de recuperación postoperatoria; De acuerdo con esta estrategia, el peso del implante debe contrarrestarse continuamente a medida que el ratón madura y se somete al desarrollo del sistema muscular y musculoesquelético. Poco después de la implantación, los ratones no pueden soportar con éxito el peso del implante sin el contrapeso, lo que lleva a la desnutrición y la deshidratación, ya que el ratón no puede alcanzar adecuadamente las fuentes de alimentos y agua en su jaula. El sistema de contrapeso es fácil y económico de construir, trivial de implementar, y permite a los ratones de cualquier edad implantable explorar libremente la totalidad de su jaula doméstica, asegurando así una nutrición e hidratación adecuadas. A medida que los ratones envejecen, la cantidad de contrapeso puede reducirse hasta que pueda eliminarse por completo en ratones adultos; Sin embargo, se recomienda el uso continuado del sistema de contrapeso durante la duración del experimento con al menos un contrapeso nominal unido en todo momento. Mientras que un ratón adulto puede ser capaz de soportar el tamaño y el peso del micro-drive con el tiempo, el movimiento natural continuo durante el comportamiento libre sin contrapeso de mejora produce torsión y fuerza de cizallamiento en los tornillos óseos que anclan el micro-drive en el cráneo, lo que hace que sea cada vez más probable que se desprenda, especialmente durante experimentos crónicos más largos.
Dos limitaciones importantes son de destacar para el presente estudio. Primero, para evaluar el impacto de la implantación en p20 en el desarrollo del cráneo y el cerebro, varias cohortes de ratones fueron sacrificadas después de una implantación prolongada (Figura 5C). Si bien estos análisis no revelaron un impacto significativo de la implantación en el tamaño de la cavidad craneal o la masa cerebral (Figura 5C), el estudio actual no examinó el tamaño del cráneo o la masa cerebral en múltiples puntos de tiempo durante el período de desarrollo temprano de p20-p60. Si bien el trabajo previo demuestra que el desarrollo de la cavidad cerebral se completa en p2036, es posible que la implantación en esta ventana temprana pueda producir cambios imprevistos que se corrigen o compensan con las edades adultas que se evaluaron aquí. En segundo lugar, los experimentos que produjeron los datos electrofisiológicos que se muestran en la Figura 3 y la Figura 4 no fueron diseñados para maximizar el rendimiento celular. Por lo tanto, si bien los datos presentados aquí demuestran registros estables y crónicos y unidades individuales bien aisladas, no deben tomarse como representativos del rendimiento potencial máximo para este dispositivo.
Muchos trastornos neurológicos y psiquiátricos humanos se manifiestan durante períodos de desarrollo temprano o durante la adolescencia, incluido el autismo y la esquizofrenia. Sin embargo, se sabe poco sobre la disfunción a nivel de circuito que puede subyacer a estas enfermedades, a pesar de la gran cantidad de modelos de ratón disponibles. La identificación de estos cambios iniciales en la red es fundamental para crear estrategias de detección temprana y paradigmas de tratamiento. Sin embargo, debido a los desafíos técnicos, no está claro cómo se interrumpe la función de la red a través del desarrollo en modelos de ratón de enfermedades neuropsiquiátricas. La estrategia de microimpulso y recuperación descrita aquí está diseñada para apoyar las investigaciones sobre el desarrollo de redes cerebrales multirregionales en el cerebro del ratón y, por lo tanto, permitir a los investigadores medir el desarrollo cerebral saludable, así como identificar alteraciones en ese desarrollo en modelos de enfermedad de ratón.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por los Institutos Nacionales de Salud R01 NS104829 (B.E.P.), R01 MH117149 (L.J.V.) y F99NS12053 (L.D.Q.) y el Premio de Dotación UT SOUTHWESTERN GSO (R.J.P. y L.D.Q.). Los autores agradecen a Jenny Scaria (Facultad de Farmacia del Centro de Ciencias de la Salud de la Universidad Tecnológica de Texas) por su asistencia técnica y al Dr. Brendon Watson (Universidad de Michigan) por sus sugerencias metodológicas.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 V video tracking LEDs | Neuralynx | HS-LED-Red/Green-omni-10V | For use with headstage pre-amplifiers that contain LED sockets for movement tracking purposes |
| 16TT EIB Board | Neuralynx | EIB-36-16TT | Electronic interface board- omnetics connector |
| 16TT headstage pre-amplifier | Neuralynx | HS-36-LED | Omnetics 44 socket signal amplifier between EIB board and tether cable for recording applications; includes connectors for headstage LEDs for movement tracking purposes |
| Baby-Mixter hemostat | FST | 13013-14 | Fine curved hemostat |
| Bone anchor screw | Stoelting | 51457 | Used to attach EIB board to main drive body |
| Burpenorphine | ZooPharm | Lot #BERLAB0.5-221207 | Burpenorphine (0.5 mg/mL) 5mL quantity |
| Cable tether | Neuralynx | HS-36 Litz Tether | Lightweight shielded wire tether for omnetics headstages; length options of 1 m/2 m/3 m/5 m |
| Carprofen/Rimadyl | Bio-Serve | MD150-2 | Post-operative anti-inflammatory agent |
| Clear resin v4 | Formlabs | FLGPGR04 | Liquid resin that is photopolymerized by 3D printer during the 3D printing process |
| Custom (shuttle) screw | Advanced Machining and Tooling, Inc. | Custom | Machined and threaded custom screws |
| Dental acrylic liquid component | Teets denture material | Lot# 329801 | liquid component of denture material (see above) |
| Dental acrylic powder component | Teets denture material | Lot# 583987 | "cold cure" denture material, methyl methacrylate; mixed with liquid component for application to secure recording device in place |
| DietGel Boost | ClearH2O | 72-04-5022 | High calorie dietary supplement for young/recovering mice |
| Digital Lynx 16SX | Neuralynx | DigitalLynx 16SX Base | Main recording apparatus with 16 combo board slots for up to 512 recording channels |
| Dissector scissors- heavy blades | FST | 14082-09 | Various |
| Dumont #5 ceramic coated forceps | FST | 11252-50 | Tetrode handling/threading/pinning |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose assembly use |
| Dumont #5SF forceps | FST | 11252-00 | Multipurpose surgical use |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Various |
| Dumont #7 fine forceps (curved) | FST | 11274-20 | Multipurpose surgical use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Plating/assembly use |
| EIB-36 plating adapter | Neuralynx | EIB-36 plating adapter | Stereotactic accessory for lowering drive onto skull during surgery |
| Euthasol | Virbac | 710101 | Pentobarbital sodium for euthanasia |
| Extra fine Bonn scissors | FST | 14083-38 | Various |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Extra fine graefe forceps | FST | 11150-10 | Small straight serrated forceps |
| Fine hemostats | FST | 13006-12 | Fine hemostats |
| Fine scissors- CeramaCut | FST | 14958-09 | Tetrode cutting |
| Fine scissors- ToughCut | FST | 14058-09 | Various |
| Form 3+ | Formlabs | PKG-F3-P-WS-SVC-BASIC | 3D printer for fabrication of all printed parts/materials; low-force stereolithography 3D printer (LFS) |
| Gel super glue | Loctite | 1363589 | Various steps |
| Graefe forceps | FST | 11049-10 | Small angled serrated forceps |
| Ground wire | A-M Systems | Lot# 582335 | Stainless steel bare wire, .005" diameter, annealed, 100 feet |
| Hair removal gel | Generic | Commercially available | For pre-op removal of hair from top of mouse head |
| Heat gun | Dewalt | D26960K | Tetrode fusion following spinning |
| High temperature cautery kit | FST | 18010-00 | For use with bone wax if applicable |
| Hot bead sterilizer | FST | 18000-45 | Electrical sterilization apparatus for ad hoc instrument sterilization during surgical procedures |
| Isoflurane | Covetrus | 11695067771 | Standard isoflurane liquid anesthsia for use in isoflurane vaporizer to max 5% |
| Isopropyl alcohol 91% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| Jewelry screw (bone screws for juvenile mice) | Component supply co. | MX-000120-02SFL | S/S machine screw #000-120 x 1/8'' filister head, slotted drive |
| LaGrange scissors | FST | 14173-12 | Various |
| Large polyimide tubing | Nordson medical | Lot # 13564 | Polyimide tubing- inner diameter 0.0071"; outer diameter 0.0115"; length 36" |
| Liquid super glue | Loctite | 1365882 | Various steps |
| Micro drill | Foredom | K.1070 | K.1070 high speed rotary micromotor kit; with control box, 3/32" collet, variable speed foot control, handpiece cradle; stereotactically fittable; 100–115 V use |
| Micro drill burr (0.5 mm+) | FST | 19007-05/07/09 | Craniotomy |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | Various steps |
| Mineral oil | Sigma | Pcode 1002076577; M5904-500mL | For use keeping craniotomy holes open |
| Miniature flathead screwdriver | FST | 30051-10 | Insertion/tightening of bone screws |
| Neosporin Triple Antibiotic Ointment | Johnson & Johnson | 512373700 | Antibiotic ointment |
| Omnetics 44 socket nano connector | Neuralynx | Neuralynx part #A70427-801 | NONSTANDARD ITEM- omnetics 44 socket (female) dual row straight leg nano connector with 2 guide pins (male) for use with custom-made counterbalance apparatus |
| Platinum 10% iridium wire | California fine wire | MO# M374710 | Fine recording wire spun into tetrodes for use during recording by use of the terode assembly station and spinner 2.0 (see below); HML NATRL VG BOND COAT; SIZE .0007 X 200FT |
| Platinum black plating solution | Neuralynx | Platinum black plating solution | Plating |
| Polycarbonate cage bottom | Thomas Scientific/Maryland plastics | 1113M35; mfr. No. E0270 | Standard cage bottom; can be fitted with wire mesh apparatus over top that contains chow+water bottle for unimplanted mice |
| Polycarbonate cage top with N10 micro filter | Ancare | N/A | Standard cage top to be modified with PVC pipe for counterbalance apparatus |
| Povidone iodine 10% | Generic | Commercially available | For standard pre-operative sterilization procedure |
| PVC pipe | Charlotte pipe | N/A | 1/2" x 600 PSI schedule 40 white PVC pipe; for use/assembly into counterbalance apparatus during mouse recovery |
| Scalpel blades- #4 | FST | 10060-00 | Incision use |
| Scalpel handle- #4 gross anatomy | FST | 10060-13 | Incision use |
| Self-holding pin and bone screw forceps | FST | 26100-00 | Holder for bone and ground screws while inserting into skull |
| Small EIB pins | Neuralynx | Small EIB pins | Attachment of tetrode wires to EIB board |
| Small polyimide tubing | Nordson medical | Lot # 19102423 | Polyimide tubing- inner diameter 0.004''; outer diameter 0.0044''; length 36" |
| SolidWorks | Dassault Systemes | SolidWorks | 3D CAD program for micro-drive design |
| Spatula and probe | FST | 1090-13 | Applicator for petroleum jelly/mineral oil + optional use for ad hoc tetrode straightening |
| Spring scissors- 8 mm | FST | 15024-10 | Scissors for cranial tissue incisions |
| Spring scissors- 8 mm | FST | 15024-10 | Initial incisions |
| Standard pattern forceps | FST | 11000-12 | Large serrated forceps |
| Surgical scissors- sharp-blunt | FST | 14001-12 | Various |
| Surgical scissors- ToughCut | FST | 14054-13 | Various |
| Tetrode assembly station | Neuralynx | Tetrode assembly station | Tetrode Assembly |
| Tetrode spinner 2.0 | Neuralynx | Tetrode spinner 2.0 | Tetrode Assembly |
| Two-part epoxy | Gorilla brand | 4200102 | Various steps |
Referencias
- Konrad, K., Firk, C., Uhlhaas, P. J. Brain development during adolescence. Deutsches Arzteblatt International. 110 (25), 425-431 (2013).
- Silbereis, J. C., Pochareddy, S., Zhu, Y., Li, M., Sestan, N. The cellular and molecular landscapes of the developing human central nervous system. Neuron. 89 (2), 248-268 (2016).
- Semple, B. D., Blomgren, K., Gimlin, K., Ferriero, D. M., Noble-Haeusslein, L. J. Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species. Progress in Neurobiology. 106-107, 1-16 (2013).
- Volk, L., Chiu, S. -. L., Sharma, K., Huganir, R. L. Glutamate synapses in human cognitive disorders. Annual Review of Neuroscience. 38, 127-149 (2015).
- Lord, C., et al. Autism spectrum disorder. Nature Reviews Disease Primers. 6, 5 (2020).
- McCutcheon, R. A., Reis Marques, T., Howes, O. D. Schizophrenia - An overview. JAMA Psychiatry. 77 (2), 201-210 (2020).
- Hopfield, J. J. Neural networks and physical systems with emergent collective computational abilities. Proceedings of the National Academy of Sciences of the United States of America. 79 (8), 2554-2558 (1982).
- Heeger, D. J. Theory of cortical function. Proceedings of the National Academy of Sciences of the United States of America. 114 (8), 1773-1782 (2017).
- Pouget, A., Dayan, P., Zemel, R. Information processing with population codes. Nature Reviews Neuroscience. 1, 125-132 (2000).
- Averbeck, B. B., Latham, P. E., Pouget, A. Neural correlations, population coding and computation. Nature Reviews Neuroscience. 7 (5), 358-366 (2006).
- Bey, A. L., Jiang, Y. -. H. Overview of mouse models of autism spectrum disorders. Current Protocols in Pharmacology. 66, 1-26 (2014).
- Kazdoba, T. M., et al. Translational mouse models of autism: Advancing toward pharmacological therapeutics. Current Topics in Behavioral Neurosciences. 28, 1-52 (2016).
- Mendoza, M. L., Quigley, L. D., Dunham, T., Volk, L. J. KIBRA regulates activity-induced AMPA receptor expression and synaptic plasticity in an age-dependent manner. iScience. 25 (12), 105623 (2022).
- Bernardet, M., Crusio, W. E. Fmr1 KO mice as a possible model of autistic features. The Scientific World Journal. 6, 1164-1176 (2006).
- Weaving, L. S., Ellaway, C. J., Gécz, J., Christodoulou, J. Rett syndrome: Clinical review and genetic update. Journal of Medical Genetics. 42 (1), 1-7 (2005).
- Krawczyk, M., et al. Hippocampal hyperexcitability in fetal alcohol spectrum disorder: Pathological sharp waves and excitatory/inhibitory synaptic imbalance. Experimental Neurology. 280, 70-79 (2016).
- Jaramillo, T. C., et al. Altered striatal synaptic function and abnormal behaviour in Shank3 exon4-9 deletion mouse model of autism. Autism Research. 9 (3), 350-375 (2016).
- Suh, J., Foster, D. J., Davoudi, H., Wilson, M. A., Tonegawa, S. Impaired hippocampal ripple-associated replay in a mouse model of schizophrenia. Neuron. 80 (2), 484-493 (2013).
- Altimus, C., Harrold, J., Jaaro-Peled, H., Sawa, A., Foster, D. J. Disordered ripples are a common feature of genetically distinct mouse models relevant to schizophrenia. Molecular Neuropsychiatry. 1 (1), 52-59 (2015).
- Marcotte, E. R., Pearson, D. M., Srivastava, L. K. Animal models of schizophrenia: A critical review. Journal of Psychiatry and Neuroscience. 26 (5), 395-410 (2001).
- Makuch, L., et al. Regulation of AMPA receptor function by the human memory-associated gene KIBRA. Neuron. 71 (6), 1022-1029 (2011).
- Dutta, S., Sengupta, P. Men and mice: Relating their ages. Life Sciences. 152, 244-248 (2016).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: Drive fabrication. Journal of Visualized Experiments. (26), e1094 (2009).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Farooq, U., Dragoi, G. Emergence of preconfigured and plastic time-compressed sequences in early postnatal development. Science. 363 (6423), 168-173 (2019).
- Langston, R. F., et al. Development of the spatial representation system in the rat. Science. 328 (5985), 1576-1580 (2010).
- Wills, T. J., Cacucci, F., Burgess, N., O'Keefe, J. Development of the hippocampal cognitive map in preweanling rats. Science. 328 (5985), 1573-1576 (2010).
- Bjerknes, T. L., Moser, E. I., Moser, M. B. Representation of geometric borders in the developing rat. Neuron. 82 (1), 71-78 (2014).
- Bjerknes, T. L., Dagslott, N. C., Moser, E. I., Moser, M. -. B. Path integration in place cells of developing rats. Proceedings of the National Academy of Sciences. 115 (7), E1637-E1646 (2018).
- Jansen, N. A., et al. Impaired θ-γ coupling indicates inhibitory dysfunction and seizure risk in a Dravet syndrome mouse model. Journal of Neuroscience. 41 (3), 524-537 (2021).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: Tetrode assembly. Journal of Visualized Experiments. (26), e1098 (2009).
- Voigts, J., Siegle, J., Pritchett, D. L., Moore, C. I. The flexDrive: An ultra-light implant for optical control and highly parallel chronic recording of neuronal ensembles in freely moving mice. Frontiers in Systems Neuroscience. 7, 8 (2013).
- Voigts, J., Newman, J. P., Wilson, M. A., Harnett, M. T. An easy-to-assemble, robust, and lightweight drive implant for chronic tetrode recordings in freely moving animals. Journal of Neural Engineering. 17 (2), 026044 (2020).
- Guardamagna, M., et al. The Hybrid Drive: A chronic implant device combining tetrode arrays with silicon probes for layer-resolved ensemble electrophysiology in freely moving mice. Journal of Neural Engineering. 19 (3), (2022).
- Yamamoto, J., Wilson, M. A. Large-scale chronically implantable precision motorized microdrive array for freely behaving animals. Journal of Neurophysiology. 100 (4), 2430-2440 (2008).
- Vora, S. R., Camci, E. D., Cox, T. C. Postnatal ontogeny of the cranial base and craniofacial skeleton in male C57BL/6J mice: A reference standard for quantitative analysis. Frontiers in Physiology. 6, 417 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados