A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير المقطعي الضوئي الصوتي والموجات فوق الصوتية وتصوير الأوعية الدموية (PAUSAT) للتصوير غير الجراحي للدماغ بالكامل للسكتة الدماغية الإقفارية
In This Article
Summary
يوضح هذا العمل استخدام منصة تصوير متعددة الوسائط تعتمد على الموجات فوق الصوتية للتصوير غير الجراحي للسكتة الدماغية الإقفارية. يسمح هذا النظام بالقياس الكمي لأكسجة الدم من خلال التصوير الصوتي الضوئي وضعف التروية في الدماغ من خلال تصوير الأوعية الصوتية.
Abstract
تظهر هنا دراسة تجريبية للسكتة الدماغية الإقفارية باستخدام نظام التصوير غير الباضع المطور حديثا والذي يدمج ثلاث تقنيات تصوير قائمة على الصوت: التصوير الصوتي الضوئي والموجات فوق الصوتية والتصوير المقطعي الوعائي (PAUSAT). يساعد الجمع بين هذه الطرق الثلاث في الحصول على التصوير المقطعي الضوئي الصوتي متعدد الأطياف (PAT) لأكسجة الدم في الدماغ ، والتصوير بالموجات فوق الصوتية عالية التردد لأنسجة المخ ، وتصوير الأوعية الصوتية للتروية الدموية الدماغية. تسمح منصة التصوير متعددة الوسائط بدراسة تغيرات التروية الدماغية والأوكسجين في دماغ الفأر بالكامل بعد السكتة الدماغية. تم تقييم نموذجين شائعين للسكتة الدماغية الإقفارية: نموذج انسداد الشريان الدماغي الأوسط الدائم (pMCAO) ونموذج التخثر الضوئي (PT). تم استخدام PAUSAT لتصوير نفس أدمغة الفئران قبل وبعد السكتة الدماغية وتحليل كلا النموذجين كميا للسكتة الدماغية. كان نظام التصوير هذا قادرا على إظهار التغيرات الوعائية في الدماغ بوضوح بعد السكتة الدماغية الإقفارية ، بما في ذلك انخفاض كبير في تروية الدم والأوكسجين في منطقة احتشاء السكتة الدماغية (المماثل) مقارنة بالأنسجة غير المصابة (المقابلة). تم تأكيد النتائج من خلال كل من التصوير بتباين البقع بالليزر وتلطيخ كلوريد ثلاثي فينيل تيترازوليوم (TTC). علاوة على ذلك ، تم قياس حجم احتشاء السكتة الدماغية في كلا النموذجين للسكتة الدماغية والتحقق من صحته بواسطة تلطيخ TTC باعتباره الحقيقة الأرضية. من خلال هذه الدراسة ، أثبتنا أن PAUSAT يمكن أن يكون أداة قوية في الدراسات قبل السريرية غير الباضعة والطولية للسكتة الدماغية.
Introduction
ينقل الدم الأكسجين (عن طريق بروتين الهيموجلوبين) والمواد المغذية الهامة الأخرى إلى الأنسجة في أجسامنا. عندما ينقطع تدفق الدم عبر الأنسجة (نقص التروية) ، يمكن أن يحدث تلف شديد في الأنسجة ، وترجع آثاره المباشرة إلى نقص الأكسجين (نقص الأكسجة). السكتة الدماغية الإقفارية هي نتيجة لانقطاع تدفق الدم إلى منطقة معينة من الدماغ. يمكن أن يحدث تلف الدماغ الناتج عن السكتة الدماغية في غضون دقائق من انسداد الأوعية الدموية ، ويمكن أن يكون له في كثير من الأحيان آثار منهكة ودائمة 1,2. تتمثل إحدى الاستراتيجيات القيمة للغاية لتقييم علم الأمراض الفسيولوجي بعد السكتة الدماغية وتحديد واختبار علاجات جديدة في استخدام نماذج الحيوانات الصغيرة في المختبر. تهدف العلاجات المكتشفة في المختبر إلى ترجمتها إلى الاستخدام السريري وتحسين حياة المرضى. ومع ذلك ، يجب تقييم استخدام الحيوانات في البحوث الطبية الحيوية بعناية وفقا لمبادئ Russell and Burch 3Rs: الاستبدال والتخفيض والصقل3. الهدف من عنصر التخفيض هو تقليل عدد الحيوانات دون المساس بجمع البيانات. مع وضع ذلك في الاعتبار ، فإن القدرة على تقييم تطور الآفة طوليا عبر التصوير غير الباضع تتيح ميزة كبيرة في تقليل عدد الحيوانات المطلوبة ، بالإضافة إلى تعظيم المعلومات التي تم الحصول عليها من كل4.
التصوير المقطعي الضوئي الصوتي (PAT) هو طريقة تصوير هجينة تجمع بين تباين الامتصاص البصري والدقة المكانية للتصوير بالموجات فوق الصوتية5. آلية التصوير من PAT هي على النحو التالي. تضيء نبضة ليزر الإثارة على الهدف الذي يتم تصويره. بافتراض أن الهدف يمتص الضوء عند الطول الموجي لليزر الإثارة، فستزداد درجة حرارته. تؤدي هذه الزيادة السريعة في درجة الحرارة إلى تمدد مرن حراري للهدف. يؤدي التمدد إلى انتشار الموجات فوق الصوتية من الهدف. من خلال اكتشاف الموجات فوق الصوتية في العديد من المواضع ، يمكن استخدام الوقت اللازم لانتشار الموجة من الهدف إلى أجهزة الكشف لإنشاء صورة من خلال خوارزمية إعادة البناء. إن قدرة PAT على اكتشاف الامتصاص البصري في مناطق الأنسجة العميقة تميز PAT عن التصوير بالموجات فوق الصوتية ، والذي يكتشف حدود المعاوقة الصوتية المختلفة للأنسجة5. في الأطياف المرئية والقريبة من الأشعة تحت الحمراء ، فإن الجزيئات الحيوية الأولية عالية الامتصاص المتوفرة بكثرة في الكائنات الحية هي الهيموجلوبين والدهون والميلانين والماء7. أهمية خاصة في دراسة السكتة الدماغية هو الهيموغلوبين. نظرا لأن أوكسي هيموغلوبين وديوكسي هيموغلوبين لهما أطياف امتصاص بصري مختلفة ، يمكن استخدام PAT مع أطوال موجية ليزر متعددة الإثارة لتحديد التركيز النسبي لحالتين من البروتين. هذا يسمح بتشبع الأكسجين من الهيموغلوبين (sO2) ، أو أكسجة الدم ، ليتم قياسها داخل وخارج منطقة الاحتشاء 8,9. هذا مقياس مهم في السكتة الدماغية ، لأنه يمكن أن يشير إلى مستوى الأكسجين في أنسجة المخ التالفة بعد نقص التروية.
تصوير الأوعية الصوتية (AA) هو طريقة تصوير بالموجات فوق الصوتية محسنة بالتباين وهي مفيدة بشكل خاص لتصوير مورفولوجيا الأوعية الدموية في الجسم الحي10. تعتمد الطريقة على استخدام محول طاقة متذبذب ثنائي العنصر (عنصر منخفض التردد وعنصر عالي التردد) جنبا إلى جنب مع الفقاعات الدقيقة التي يتم حقنها في الدورة الدموية لموضوع التصوير. يستخدم عنصر التردد المنخفض لمحول الطاقة للإرسال بتردد رنين الفقاعات الدقيقة (على سبيل المثال ، 2 ميجاهرتز) ، بينما يستخدم عنصر التردد العالي لاستقبال الإشارات التوافقية الفائقة للفقاعات الدقيقة (على سبيل المثال ، 26 ميجاهرتز). عندما تثار الفقاعات الدقيقة بتردد رنين ، يكون لها استجابة غير خطية قوية ، مما يؤدي إلى إنتاج إشارات توافقية فائقة لا تنتجها أنسجة الجسم المحيطة11. من خلال الاستلام بعنصر عالي التردد ، يضمن ذلك اكتشاف إشارات الفقاعات الدقيقة فقط. نظرا لأن الفقاعات الدقيقة تقتصر على الأوعية الدموية ، فإن النتيجة هي صورة وعائية لمورفولوجيا الأوعية الدموية. AA هي طريقة قوية لتصوير السكتة الدماغية الإقفارية ، حيث لا تستطيع الفقاعات الدقيقة التي تتدفق عبر الدورة الدموية التدفق عبر الأوعية المسدودة. هذا يسمح ل AA باكتشاف مناطق الدماغ التي لا تتخلل بسبب السكتة الدماغية ، مما يشير إلى منطقة الاحتشاء.
تعتمد أبحاث السكتة الدماغية الإقفارية قبل السريرية بشكل عام على استخدام علم الأنسجة والاختبارات السلوكية لتقييم موقع السكتة الدماغية وشدتها. تلطيخ كلوريد ثلاثي فينيل تترازوليوم (TTC) هو تحليل نسيجي شائع يستخدم لتحديد حجم احتشاء السكتة الدماغية. ومع ذلك ، لا يمكن استخدامه إلا عند نقطة النهاية ، لأنه يتطلب القتل الرحيم للحيوان12. يمكن استخدام الاختبارات السلوكية لتحديد ضعف الوظيفة الحركية في نقاط زمنية متعددة ، لكنها لا يمكن أن توفر قيما تشريحية أو فسيولوجية كمية13. يوفر التصوير الطبي الحيوي نهجا كميا أكثر لدراسة آثار السكتة الدماغية غير الغازية والطولية9،14،15. ومع ذلك ، يمكن أن تأتي تقنيات التصوير الحالية (مثل التصوير بالرنين المغناطيسي للحيوانات الصغيرة [MRI]) بتكلفة عالية ، أو تكون غير قادرة على توفير معلومات هيكلية ووظيفية متزامنة ، أو لديها عمق اختراق محدود (مثل معظم تقنيات التصوير البصري).
هنا ، نجمع بين التصوير المقطعي الضوئي الصوتي والموجات فوق الصوتية وتصوير الأوعية الدموية (PAUSAT ؛ انظر مخطط النظام في الشكل 1) ، والذي يسمح بمعلومات هيكلية ووظيفية تكميلية عن تروية الدم والأوكسجين بعد السكتة الدماغيةالإقفارية 16. هذان جانبان مهمان في تقييم شدة الإصابة ومراقبة التعافي أو الاستجابة للعلاجات. يمكن أن يؤدي استخدام طرق التصوير المتكاملة هذه إلى زيادة كمية المعلومات التي يحصل عليها كل ، مما يقلل من عدد الحيوانات المطلوبة ويوفر المزيد من المعلومات في دراسة العلاجات المحتملة للسكتة الدماغية.
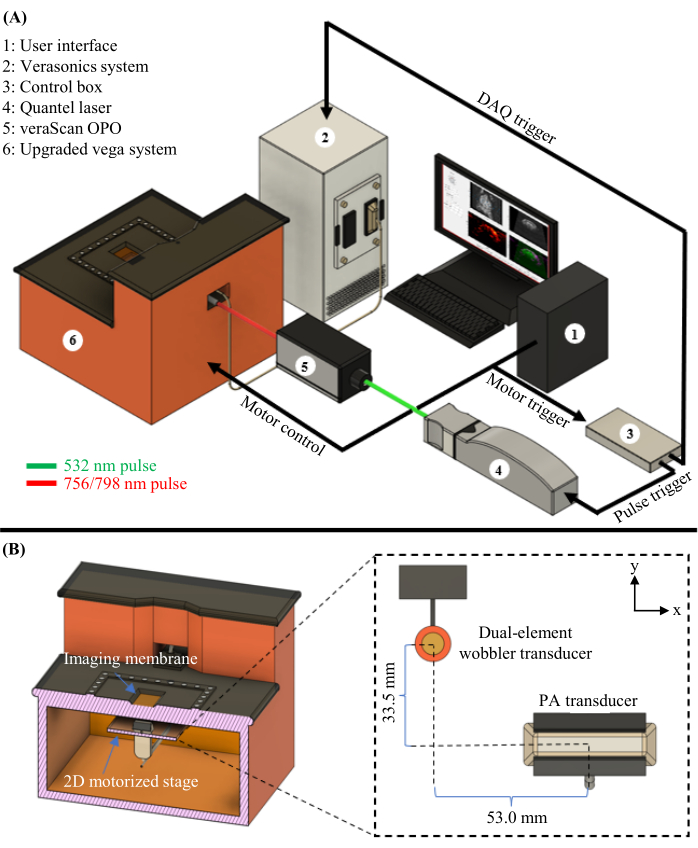
الشكل 1: مخطط PAUSAT. (أ) رسم تخطيطي كامل لنظام PAUSAT ، بما في ذلك الليزر و OPO المستخدم في PAT. (ب) منظر داخلي لنظام PAUSAT ، بما في ذلك محولي طاقة بالموجات فوق الصوتية. يتم استخدام محول الطاقة المتذبذب ثنائي العنصر لكل من الموجات فوق الصوتية في الوضع B و AA ، ويتم استخدام محول طاقة الصفيف الخطي ل PAT. يتم تركيب كلا محولات الطاقة على نفس المرحلة الآلية 2D ، مما يسمح للمسح الضوئي بتوليد بيانات حجمية. وقد عدل هذا الرقم من16. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل لجنة رعاية واستخدام الحيوان في المركز الطبي بجامعة ديوك وتم إجراؤها وفقا لسياسة خدمة الصحة العامة بالولايات المتحدة بشأن الرعاية الإنسانية واستخدام المختبر. تم استخدام ذكور وإناث الفئران C57BL / 6J (انظر جدول المواد) لهذه الدراسات. تم تصوير ما لا يقل عن ثلاثة لكل مجموعة نموذج السكتة الدماغية. انظر الشكل 2 لسير العمل المتبع في هذا البروتوكول.
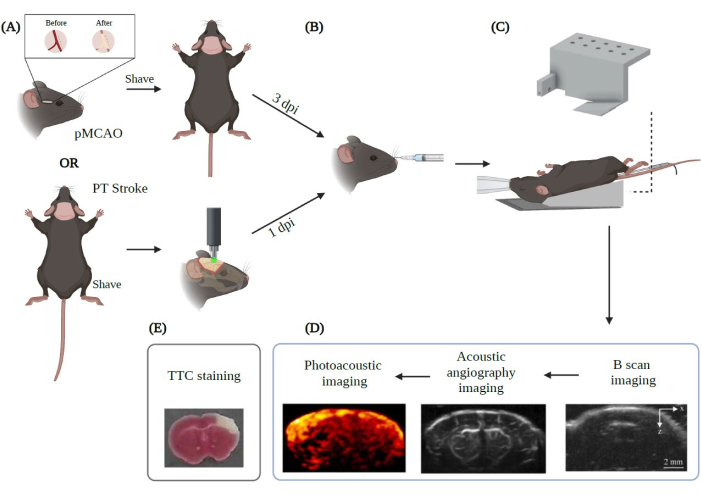
الشكل 2: ملخص الإجراء التجريبي لتصوير PAUSAT المطبق على السكتة الدماغية. تم إنشاؤها باستخدام Biorender.com. يوضح الشكل سير عمل إجراء التصوير بدءا من (A) النموذجين الرئيسيين للسكتة الدماغية (pMCAO و PT stroke). (ب) يجب إجراء الحقن المداري الخلفي للفقاعات الدقيقة قبل وضع الحيوان على غشاء PAUSAT. (ج) يلزم وجود قناع يوفر تخديرا مستمرا ووسادة تدفئة للحفاظ على استقرار درجة حرارة جسم الحيوان في هذا الإعداد. يتم وضع جسم الحيوان على وسادة التدفئة بينما يستقر الرأس على غشاء النظام. (د) ترتيب الحصول على الصورة موضح أيضا في الشكل. (ه) يتم إجراء تلطيخ TTC للتحقق من صحة نتائجنا في هذه الدراسة. إدارة شؤون الإعلام: أيام بعد الإصابة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. تحفيز نموذج ماوس السكتة الدماغية
- انسداد الشريان الدماغي الأوسط الدائم (pMCAO) مع ربط الشريان السباتي المشترك (CCA).
ملاحظة: لفترة وجيزة ، قم بإجراء الربط الدائم لل CCA الأيمن والكي الكهربائي الخلفي للشريان الدماغي الأوسط الأيمن (MCA) 17. يحد هذا الإجراء من تدفق الدم الدماغي في القشرة اليمنى للدماغ ، مما يتسبب في سكتة دماغيةإقفارية 18.- تحفيز التخدير في غرفة الحث باستخدام مزيج استنشاقي من 5.0٪ إيزوفلوران في 30٪ O 2/70٪ N2 حتى فقدان الوعي (معترف به على أنه فقدان منعكس الدواسة).
- تنبيب الحيوان باستخدام قسطرة 20 جرام (جدول المواد) وتوصيله بجهاز التنفس الصناعي التلقائي. اضبط معدل التدفق بناء على وزن جسم الحيوان وحافظ على تخدير الحيوان باستخدام 1.5٪ -2.0٪ إيزوفلوران في 30٪ O 2/70٪ N2.
- باستخدام مصباح تسخين ومسبار مستقيمي متصل بجهاز تحكم في درجة الحرارة ، حافظ على درجة حرارة جسم الحيوان عند 37 درجة مئوية.
- ضع قطرة من مرهم العين المزلق على عيون الماوس.
- ضع الحيوان في وضع ضعيف وقم بإزالة الشعر من منطقة الرقبة باستخدام أداة تشذيب الشعر.
- نظف منطقة الجلد أولا باستخدام قطعة قطن تحتوي على بوفيدون اليود ، ثم باستخدام وسادة معقمة تحتوي على 70٪ من الإيثانول. أداء هذا ثلاث مرات.
- تحقق من عمق التخدير وغياب الألم عن طريق الضغط قليلا على مخلب الحيوان الخلفي.
- قم بعمل شق سهمي 0.8 سم على الخط الأوسط من الرقبة وكشف CCA الأيمن.
- قم بإعداد خياطة لربط CCA عن طريق فصل خياطة الحرير 4-0 إلى خيوط أرق تشكل الخيط الرئيسي. استخدم طول 1.5 سم من أحد مؤشرات الترابط الفرعية لربط CCA بشكل دائم.
ملاحظة: بعد شد العقدة ، قم بإزالة الخيط الزائد عن طريق قطع الامتداد على مسافة 1-2 مم من العقدة. - ضع قطرة من البوبيفاكايين قبل إغلاق الجرح.
- أغلق الشق باستخدام خيوط جراحية حريرية متقطعة 4-0 وضع مرهم مضاد حيوي ثلاثي على السطح لمنع العدوى.
- حرك الماوس لفضح الجانب الجانبي الأيمن من جسم الحيوان.
-
قم بإزالة الشعر في المنطقة الواقعة بين الأذن ومنطقة العين باستخدام أداة تشذيب الشعر.
-
تطهير المنطقة الجراحية باستخدام مسحة القطن مع البوفيدون اليود ، تليها وسادة معقمة مع 70 ٪ من الإيثانول. كرر هذه الخطوة ثلاث مرات.
-
ضع ستارة معقمة لتأمين المنطقة الجراحية. ثم ، قم بعمل شق 0.5 سم بين العين اليمنى وأذن الحيوان ، وفضح المفصل بين الجمجمة والعضلات الصدغية.
- باستخدام حلقة الكي ، قم بكي العضلات لفصلها عن الجمجمة وفضح منطقة MCA.
- قم بحفر نافذة 0.2 مم2 لكشف MCA باستخدام مثقاب كهربائي ، واستخدم الكي الكهربائي على MCA لعرقلة تدفق الدم.
ملاحظة: نبضة واحدة عند كثافة طاقة 80٪ كافية لكي MCA. - باستخدام حقنة 1 مل متصلة بإبرة 27G ، ضع قطرة من bupivacaine (جدول المواد) في موقع الجراحة.
- أغلق شق الجلد باستخدام خيوط أحادية الشعيرات الشفافة المتقطعة 6-0 وضع مرهم مضاد حيوي ثلاثي على السطح لمنع العدوى.
- بعد الانتهاء من الجراحة ، انقل الحيوان إلى حاضنة بدرجة حرارة يتم التحكم فيها (32 درجة مئوية) واسمح للحيوان بالتعافي.
- بعد 2 ساعة ، نقل الحيوان إلى قفص منزله وتوفير الطعام والماء ad libitum.
- السكتة الدماغية الخثارية الضوئية (PT السكتة الدماغية)
ملاحظة: لفترة وجيزة ، يتم تنفيذ السكتة الدماغية PT عن طريق إلقاء الضوء على روز البنغال داخل الأوعية في الدماغ. تدار روز البنغال داخل الصفاق ، وبمجرد توزيعها بشكل جيد في جميع أنحاء الجسم (5 دقائق) ، يتم إضاءتها بواسطة ضوء بارد أخضر ، والذي ينشط روز البنغال لتوليد أنواع الأكسجين التفاعلية (ROS). هذه أنواع الأكسجين التفاعلية تلحق الضرر بغشاء الخلايا البطانية ، مما يخلق الجلطات الدموية داخل المنطقة المضيئة بأكملها ويؤدي إلى اضطراب تدفق الدم الدماغي المحلي19.- تحفيز التخدير في غرفة الحث باستخدام مزيج استنشاقي من 5.0٪ إيزوفلوران في 30٪ O 2/70٪ N2 حتى فقدان الوعي (معترف به على أنه فقدان منعكس الدواسة).
- اضبط الحيوان على إطار مجسم ، مع الحفاظ على تخدير الحيوان باستخدام قناع و 1.5٪ -2.0٪ إيزوفلوران في 30٪ O 2/70٪ N2.
- احتفظ بالحيوان عند 37 درجة مئوية باستخدام سخان إعادة تدوير الماء الساخن ومسبار المستقيم لقياس درجة حرارة جسم الحيوان.
- ضع قطرة من مرهم العين المزلق على عيون الماوس.
- حلق رأس الحيوان باستخدام أداة تشذيب الشعر.
- نظف منطقة فروة الرأس المحلوقة ثلاث مرات ، أولا باستخدام قطعة قطن مع بوفيدون اليود ، ثم باستخدام وسادة معقمة تحتوي على 70٪ من الإيثانول.
- تحقق من عدم وجود ألم عن طريق معسر مخلب الحيوان الخلفي قليلا.
- قم بعمل شق سهمي 1.4 سم على الخط الأوسط من فروة الرأس باستخدام مشرط وكشف الجمجمة.
- باستخدام قلم رصاص حاد ، ضع علامة على 1.5 مم من bregma باتجاه الجانب الأيمن.
- ضع ثقبا دائريا بقطر 2.5 مم متمركزا على علامة 1.5 مم.
ملاحظة: يمكن عمل مربع يحتوي على ثقب دائري باستخدام شريط أسود على الوجهين وعمل فتحة قطرها 2.5 مم في المنتصف باستخدام أداة ثقب واحدة بالحجم المذكور. - ضع الضوء الأخضر البارد على الثقب الدائري ، مع الحفاظ على الفجوة بين الضوء والثقب إلى الحد الأدنى.
- قم بتغطية المنطقة باستخدام ورق الألمنيوم لتجنب انتشار الضوء.
- بمجرد أن يصبح الإعداد جاهزا ، قم بحقن الحيوان داخل الصفاق ب 10 مجم / كجم من روز البنغال (10 مجم / مل في 1x محلول ملحي مخزن بالفوسفات [PBS]) وانتظر لمدة 5 دقائق.
- بعد 5 دقائق ، قم بتشغيل مصدر الضوء البارد (الشدة: 4.25) وحافظ على التعرض لمدة 15 دقيقة.
- بعد ذلك ، أطفئ الضوء البارد وتحقق من السكتة الدماغية إما بالعين المجردة (من المتوقع أن تكون المنطقة أكثر بياضا من المنطقة المحيطة) أو باستخدام أجهزة خارجية لقياس تدفق الدم الدماغي (على سبيل المثال ، باستخدام تصوير تباين البقع بالليزر (جدول المواد ؛ انظر الخطوة 5.1).
- باستخدام حقنة 1 مل متصلة بإبرة 27G ، ضع قطرة من bupivacaine (جدول المواد) في موقع الجراحة.
- أغلق شق الجلد باستخدام خيوط أحادية الشعيرات الشفافة المتقطعة 6-0 ، وضع مرهم مضاد حيوي ثلاثي على السطح لمنع العدوى.
- بعد الانتهاء من الجراحة ، انقل الحيوان إلى حاضنة بدرجة حرارة يتم التحكم فيها (32 درجة مئوية) واسمح للحيوان بالتعافي.
- بعد 2 ساعة ، نقل الحيوان إلى قفص منزله وتوفير الطعام والماء ad libitum.
2. تحضير PAUSAT للتصوير
- قم بتشغيل ليزر 532 نانومتر واتركه لمدة 15 دقيقة للإحماء.
- إعداد منصة التصوير للحيوان المخدر.
- ضع منحدرا مخصصا (الشكل 2C) متصلا بالمرحلة القابلة للتعديل يدويا (جدول المواد) بجانب غشاء التصوير.
- قم بتوصيل حامل أسنان الماوس بأنبوب التنفس المتصل بالمنحدر المخصص وتأمين وسادة تدفئة على سطح المنحدر.
- بعد تسخين الليزر ، تحقق من أن مسار الليزر والاقتران في حزمة الألياف محاذيان جيدا باستخدام بطاقة كاشف الأشعة تحت الحمراء القريبة (جدول المواد) عن طريق وضع البطاقة أمام إدخال حزمة الألياف والتأكد من دخول ضوء الليزر إلى الحزمة.
ملاحظة: اضبط أي مرايا مسار ليزر حسب الضرورة لضمان توسيط إدخال الليزر مع إدخال حزمة الألياف.
3. تحضير الحيوان ل PAUSAT
ملاحظة: يتم تنفيذ PAUSAT 1 يوم بعد جراحة السكتة الدماغية PT أو 3 أيام بعد جراحة pMCAO. يستغرق تحضير PAUSAT للتصوير (الخطوة 2) حوالي 20 دقيقة ويجب أن يتم ذلك مباشرة قبل تحضير الحيوان ل PAUSAT.
- تحفيز التخدير في غرفة الحث باستخدام مزيج استنشاق من 5٪ إيزوفلوران ممزوج ب 30٪ O 2/70٪ N2 حتى فقدان الوعي (معترف به على أنه فقدان منعكس الدواسة).
- نقل الحيوان إلى منصة ساخنة مع حامل الأسنان والقناع ، والحفاظ على التخدير في 1.5 ٪ -2.0 ٪ isoflurane في 30 ٪ O 2/70 ٪ N2.
- استخدم مصباح تسخين ومسبار مستقيمي متصل بجهاز تحكم في درجة الحرارة للحفاظ على درجة حرارة جسم الحيوان عند 37 درجة مئوية.
- تقليم الشعر على الجزء العلوي من رأس الحيوان باستخدام ماكينة حلاقة كهربائية. قم بتضمين المنطقة من بالقرب من العينين إلى خلف الأذنين.
- حلق الشعر الموجود أعلى رأس الحيوان عن طريق وضع كريم تجاري لإزالة الشعر لإزالة الشعر القصير المتبقي تماما. اتركيه على البشرة لمدة 5-6 دقائق ، ثم امسحيه باستخدام قطعة قطن مبللة بالماء للمساعدة في إزالة الكريم بالكامل. كرر حتى يصبح الجلد صافيا من الشعر.
ملاحظة: للتصوير 1 يوم بعد الجراحة, يمكن تنفيذ هذه الخطوات قبل بدء الجراحة; في 1 يوم بعد السكتة الدماغية PT ، يمكن حذفها. عندما يتم إجراء التقاط صورة PAUSAT بعد عدة أيام من الجراحة ، فإن هذه الخطوة مطلوبة للغاية. - بمجرد أن يصبح الحيوان والنظام جاهزين للتصوير ، وقبل نقل الحيوان مباشرة إلى منصة النظام ، قم بحقن محلول 100 ميكرولتر من الفقاعات الدقيقة عند تركيز المخزون (جدول المواد) بأثر رجعي باستخدام إبرة 27 جرام.
ملاحظة: بمجرد أن تكون الفقاعات في الدورة الدموية في مجرى الدم ، هناك قدر محدود من الوقت للتصوير دون فقدان كبير للإشارة (~ 10 دقائق). - ضع قطرة من غسول حماية العين على عيون الماوس.
ملاحظة: لا ينصح باستخدام مواد تشحيم العين حتى يتم إجراء الحقن الحجاجي الخلفي لتجنب وصول المواد الغريبة إلى مجرى دم الحيوان. لذلك ، يجب إجراء تطبيق كريم إزالة الشعر ببطء وبعناية لتجنب الاقتراب الشديد من العينين (ولكن بما يكفي لفضح المنطقة ذات الاهتمام حيث يتوقع حدوث السكتة الدماغية). تتم إزالة كريم الشعر باستخدام قطعة قطن تم غمسها مسبقا في الماء ، مما يمنع الكريم من التنقيط ، مما قد يؤدي إلى تلف العينين.
4. تصوير PAUSAT
ملاحظة: يتم ذلك لتصوير المناطق المعاكسة و ipsi-lateral من الدماغ بعد السكتة الدماغية
- انقل الماوس إلى منصة الصور PAUSAT (جدول المواد) المدمجة ، مع وضع الماوس في وضع ضعيف على المنحدر المخصص (الشكل 2C).
- املأ نافذة التصوير بما يكفي من الماء المقطر على السطح للاقتران الصوتي.
ملاحظة: يوصى باستخدام منحدر اختياري - مطبوع باستخدام طابعة 3D - لمنع جسم الحيوان من البلل أثناء التقاط الصورة وتحسين راحة الحيوان. كما أنه يساعد في الحفاظ على درجة حرارة الجسم مستقرة. علاوة على ذلك ، يمكن توصيل المنحدر بمرحلة يدوية (جدول المواد) لضبط العمق البؤري لمحول الطاقة المتذبذب ثنائي العنصر بالنسبة لرأس الماوس. ملف تصميم المنحدر المخصص متاح عند الطلب للمؤلفين. - ثبت رأس الفأر في حامل السن وتأكد من التخدير المناسب وتدفق الهواء.
- باستخدام مصباح تسخين ومسبار مستقيمي متصل بجهاز تحكم في درجة الحرارة ، حافظ على درجة حرارة جسم الحيوان عند 37 درجة مئوية.
- افتح تطبيق التصوير (جدول المواد) وانتقل إلى الموجات فوق الصوتية في الوضع B.
- استخدم نافذة الموجات فوق الصوتية الحية لضبط رأس الماوس يدويا على الموضع المطلوب.
- استخدم نافذة الموجات فوق الصوتية الحية لضبط ارتفاع المرحلة ، بحيث يكون العمق البؤري لمحول الطاقة (19 مم) في منتصف المنطقة المراد تصويرها تقريبا.
- التصوير بالموجات فوق الصوتية في الوضع B
- اضبط قيمة تردد إرسال الموجات فوق الصوتية في الوضع B (لهذه الدراسات ، استخدم 16 ميجاهرتز).
- أدخل معلومات دليل الحفظ في تطبيق التصوير.
- استخدم الصندوق العائم لتحديد المنطقة المطلوبة لمسح الوضع B للدماغ.
- اضغط على الزر الحصول على ثابت .
- تحقق من نتائج الفحص في التطبيق بمجرد اكتمال الحصول على الصورة للتأكد من تصوير المنطقة المطلوبة.
ملاحظة: تجنب التأخير غير الضروري في الحصول على التصوير في الوضع B لضمان بقاء تركيز عال بما فيه الكفاية من الفقاعات الدقيقة في مجرى الدم ل AA.
- التصوير باستخدام AA
- العودة إلى الحصول على الصور.
- التغيير إلى وضع تصوير الأوعية الصوتية في تطبيق التصوير (جدول المواد).
- أدخل معلمات بروتوكول المسح المطلوب (وأهمها تباعد الإطارات وعدد الإطارات لكل موضع ، والذي تم ضبطه على 0.2 مم و 10 ، على التوالي ، لهذه الدراسات).
- اضغط على الزر الحصول على ثابت .
ملاحظة: يستغرق الحصول على AA وقتا أطول من الموجات فوق الصوتية في الوضع B. - بمجرد اكتمال الفحص ، تحقق من نتائج الفحص ضمن تحليل الصورة للتأكد من أن جودة الصورة كما هو متوقع.
ملاحظة: بالنسبة لوضع AA ، يمكن الحصول على حجم دماغ كامل أكثر تمثيلا عن طريق تكرار مسح ثان على عمق بؤري مختلف داخل الدماغ وإعادة دمج الصور لاحقا مع المعالجة اللاحقة المناسبة (انظر الشكل 3).
- التصوير بالتصوير المقطعي الضوئي الصوتي
- افتح تطبيق المذبذب البارامتري البصري (OPO) (جدول المواد) واضبطه على 756 نانومتر.
ملاحظة: يمكن ل OPOs الخروج بسهولة من المعايرة ، لذلك قبل التجربة ، تأكد من معايرة OPO بشكل صحيح باستخدام مطياف مستقل. - ترجمة محول الصفيف الخطي يدويا إلى الإحداثيات المحددة مسبقا لضمان تسجيل وحدات تخزين المتذبذب ووحدات تخزين الصفيف الخطي تلقائيا.
ملاحظة: من الأهمية بمكان أن يتم إجراء تجربة التسجيل المشترك باستخدام شبكة وهمية مسبقا لتحديد المسافة الدقيقة اللازمة لترجمة المرحلة ، بحيث يتم تسجيل البيانات الناتجة من كلا المحولين بشكل مشترك في 3D. - افتح تطبيق الليزر وقم بتشغيل ليزر 532 نانومتر.
- باستخدام مقياس طاقة الليزر ، قم بقياس طاقة خرج الليزر وتأكد من أنها الطاقة المطلوبة (~ 10 مللي جول لكل نبضة تم استخدامها لهذه الدراسات).
- حدد معلمات المسح الضوئي المطلوبة ل PAT (حجم خطوة 0.4 مم وطول مسح ضوئي 20 مم ومتوسط 10 إطارات لكل موضع).
- افتح برنامج MATLAB لنظام الحصول على بيانات الموجات فوق الصوتية (جدول المواد) واضغط على زر التشغيل .
- احصل على فحص PAT بالضغط على زر ابدأ .
- بمجرد اكتمال الفحص ، افتح برنامج حفظ MATLAB. قم بتغيير اسم الحفظ إلى اسم الملف المطلوب واضغط على زر التشغيل .
- قم بتغيير الطول الموجي OPO إلى 798 نانومتر وكرر الخطوات من 4.10.3 إلى 4.10.8.
ملاحظة: لإجراء دراسة طولية ، يوصى بالسماح للحيوان بالتعافي عن طريق وضعه في حاضنة وتحت الملاحظة لبضع ساعات (باتباع الخطوتين 1.1.18 و 1.1.19). إذا كان التحقق من صحة النتيجة مطلوبا ، فتابع إلى القسم 5 مباشرة بعد تصوير PAUSAT.
- افتح تطبيق المذبذب البارامتري البصري (OPO) (جدول المواد) واضبطه على 756 نانومتر.
5. اختياري: التحقق من صحة النتائج
- التصوير بتباين البقع بالليزر (LSCI).
- تخدير الحيوان باستخدام 1.5٪ -2.0٪ إيزوفلوران في 30٪ O 2/70٪ N2.
- اضبط الحيوان على إطار تجسيمي ، مع الحفاظ على تخدير الحيوان باستخدام قناع والتخدير الاستنشاقي المذكور أعلاه.
- احتفظ بالحيوان عند 37 درجة مئوية باستخدام سخان إعادة تدوير الماء الساخن ومسبار المستقيم لقياس درجة حرارة جسم الحيوان.
- ضع قطرة من غسول حماية العين على عيون الماوس.
- تحقق من عدم وجود ألم عن طريق معسر مخلب الحيوان الخلفي قليلا.
- قم بإزالة الشعر على فروة رأس الحيوان باستخدام أداة تشذيب الشعر.
- تطهير المنطقة الجراحية باستخدام مسحة القطن مع البوفيدون اليود ، تليها وسادة معقمة مع 70 ٪ من الإيثانول. كرر هذه الخطوة ثلاث مرات.
- قم بعمل شق سهمي 1.4 مم على الخط الأوسط من فروة الرأس وكشف الجمجمة. استخدم الملقط لتثبيت فروة الرأس ومنعها من احتلال منطقة الدماغ للمسح.
- ضع بعض قطرات المحلول الملحي على الجمجمة وضع جهاز نظام تباين بقع الليزر (جدول المواد) فوق رأس الحيوان.
- ضمن القائمة " ملف" ، اضبط الجهاز في وضع الاتصال ، الموجود في القائمة الفرعية وضع العمل.
- حدد مجلد تخزين الصور الافتراضي في القائمة ملف والقائمة الفرعية إعدادات الحفظ .
- في قائمة مصدر الضوء ، قم بتوصيل الليزر الموجه ("تشغيل الليزر") والضوء الأبيض ("تشغيل الضوء الأبيض") لتحديد موقع نافذة التصوير في الموضع الصحيح.
- في قائمة الإعداد، حدد إعدادات التكبير، وحرك المؤشر يدويا إلى 2.5، واضغط على Apply (تطبيق) وموافق لحفظ الإعدادات.
- اضبط التركيز عن طريق تحريك شريط التركيز الموجود في القائمة الفرعية العلوية للصفحة الرئيسية يدويا.
- في قائمة الإعداد ، حدد إعداد عتبة اللون الزائف ، واضبط الحد حسب الرغبة ، واضغط على تطبيق وموافق لحفظ الإعدادات.
- في قائمة مصدر الضوء، افصل الليزر الموجه ("إيقاف تشغيل الليزر") والضوء الأبيض ("إطفاء الضوء الأبيض") قبل التقاط الصورة.
- التقط الصورة عن طريق تحديد رمز التشغيل في القائمة الفرعية العلوية للصفحة الرئيسية.
- تلطيخ كلوريد ثلاثي فينيل تترازوليوم (TTC)
- تخدير الحيوان بعمق باستخدام 5٪ إيزوفلوران في 30٪ O 2/70٪ N2.
- بمجرد توقف الحيوان عن التنفس ، قم بقطع رأسه باستخدام مقص حاد.
- إزالة كل الجلد حول الرأس والعضلات في منطقة الرقبة.
- قم بعمل قطع سهمي في الجزء القذالي من الجمجمة حتى يصل إلى العظم الجداري.
- قم بعمل قطع أفقي (~ 5 مم) في الجانب الأيسر والأيمن أسفل الأوعية الدموية. إزالة العظم القذالي من الجمجمة باستخدام ملقط مستقيم.
- قم بعمل قطع (~ 5 مم) في خياطة الجمجمة الأمامية.
- قم بعمل قطع سهمي (~ 10-15 مم) في خط الوسط من الجمجمة - بين نصفي الكرة الأرضية - وتأكد من فصلهما تماما.
- باستخدام مقص منحني بحجم # 7 ، قم بإزالة العظام اليسرى واليمنى الجدارية للجمجمة من المركز إلى الجانبين.
- انقل الدماغ إلى وعاء مملوء ب 5 مل من الثلج البارد 1x PBS واحتفظ به على الثلج لمدة 10 دقائق.
- نقل الدماغ إلى مصفوفة الدماغ الفولاذ المقاوم للصدأ (أقسام 1 مم).
- قسم الدماغ في أقسام إكليلية 1 مم باستخدام شفرات حلاقة يمكن التخلص منها (جدول المواد).
- أمسك الشفرات من جوانبها ، وانقلها إلى حاوية مملوءة بالثلج البارد 1x PBS.
- افصل الأقسام بعناية عن الشفرات واحدة تلو الأخرى.
- انقل شرائح الدماغ إلى طبق بتري قطره 70 مم يحتوي على 5 مل من 2٪ TTC (جدول المواد ، 3) في 1x PBS.
- احتضان لمدة 15 دقيقة في الظلام في درجة حرارة الغرفة (R / T).
- بعد 15 دقيقة ، تخلص من TTC ، واستبدله ب 3 مل من الفورمالين ، واحتضانه في الظلام لمدة 30 دقيقة على الأقل في R / T.
- أخيرا ، انقل شرائح الدماغ إلى فيلم بلاستيكي شفاف وامسح العينات ضوئيا ، بما في ذلك المسطرة في صورة المسح كمرجع للقياسات المستقبلية.
النتائج
تصوير مورفولوجيا الأوعية الدموية في الدماغ
أيولد صورا لمورفولوجيا الأوعية الدموية عن طريق فقاعات دقيقة مثيرة في الدورة الدموية بترددها الرنيني وتلقي الاستجابة التوافقية الفائقة للفقاعات الدقيقة. باستخدام المنحدر المخصص (الشكل 2C) المرفق بمرحلة قابلة للتعديل ?...
Discussion
هناك بعض الجوانب الحيوية لهذه الطريقة التي ، إذا تم إجراؤها بشكل غير صحيح ، يمكن أن تؤدي إلى انخفاض كبير في جودة الصورة والتحليل الكمي. النتيجة الأكثر شيوعا لخطأ المستخدم في صور PAUSAT هي إما نقص الإشارة أو قوة إشارة منخفضة للغاية ، وكلاهما يمكن أن يحدث لأسباب متنوعة. أحد هذه الأسباب هو مشكلة ?...
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح في هذا العمل.
Acknowledgements
يود المؤلفون أن يشكروا الفريق الهندسي في SonoVol Inc. على دعمهم الفني. تم رعاية هذا العمل جزئيا من قبل جائزة العلوم التعاونية لجمعية القلب الأمريكية (18CSA34080277) ، إلى J. Yao و W. Yang. تمنح المعاهد الوطنية للصحة في الولايات المتحدة (NIH) R21EB027981 ، R21 EB027304 ، RF1 NS115581 (مبادرة BRAIN) ، R01 NS111039 ، R01 EB028143 ؛ جائزة CAREER من مؤسسة العلوم الوطنية الأمريكية (NSF) 2144788 ؛ منحة مبادرة تشان زوكربيرج (2020-226178) ، إلى جيه ياو ؛ وتمنح المعاهد الوطنية للصحة R21NS127163 R01NS099590 إلى دبليو يانغ.
Materials
| Name | Company | Catalog Number | Comments |
| 20 GA catheter | BD Insyte Autoguard Winged | 381534 | For mouse intubation |
| 2,3,5-Triphenyltetrazolium chloride | Sigma | T8877 | Necessary for TTC-staining brain for validation |
| 532nm Laser | Quantel | Q-smart 850 | Laser used to pump the OPO for PAT |
| Automatic Ventilator Rovent Jr. | Kent Scientific | RV-JR | To keep mice under anesthesia during surgical procedure |
| Black braided silk 4-0 USP | Surgical Specialties | SP116 | Used for sutures on the neck for pMCAO surgery |
| Bupivacaine | Hospira | 0409-1159-18 | Used prior to closing wounds during surgical procedure |
| C57BL/6 Mice | Jackson Lab | #000664 | Mice used for studying ischemic stroke (2-6 month old male/female) |
| Clear suture | Ethicon | 8606 | Used for closing wound (PT stroke and pMCAO). A clear suture won't interfere with PAT |
| Cold Light LED | Schott | KL 1600 | Needed to create PT stroke |
| Disposable Razor Blade | Accutec Blades | 74-0002 | For sectioning mouse brain |
| Electric drill | JSDA | JD-700 | Used to expose MCA during pMCAO procedure |
| Electrocauterization tool | Wet-Field | Wet-Field Bipolar-RG | Stops blood flow after drilling during pMCAO procedure |
| Hair removal gel | Veet | 8282651 | Used to remove hair from mouse prior to imaging |
| High Temperature Cautery Loop Tip | BOVIE Medical Corporation | REF AA03 | Used to avoid bleeding when separating the temporal muscle from the skull |
| IR Detector Card | Thorlabs | VRC5 | Used to ensure light path is aligned |
| Laser Power Meter | Ophir | StarBright, P/N 7Z01580 | Can be used to calibrate the laser energy prior to imaging |
| Laser Speckle Imaging System | RWD Life Science Co. | RFLSI-III | Can be used to validate stroke surgery success |
| Lubricant Eye Ointment | Soothe | AB31336 | Can be used to avoid drying of the eyes |
| Manually adjustable stage | Thorlabs | L490 | Used with custom ramp for multiple focal depth AA imaging |
| Modified Vega Imaging System | Perkin Elmer | LLA00061 | System containing both B-mode/AA and PAT transducers |
| Optical Parametric Oscillator | Quantel | versaScan-L532 | Allows for tuning of excitation wavelength in a large range |
| Programmable Ultrasound System | Verasonics | Vantage 256 | Used for PAT part of system |
| Rose Bengal | Sigma | 330000 | Necessary to induce PT stroke |
| Suture | LOOK | SP116 | Used for permanent ligation of CCA |
| Temperature Contoller | Physitemp | TCAT-2 | Used to maintain stable body temperature of mice during procedures |
| VesselVue Microbubbles | Perkin Elmer | P-4007001 | Used for acoustic angiography (2.43 × 10^9 microbubbles/mL) |
References
- Durukan, A., Tatlisumak, T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacology Biochemistry and Behavior. 87 (1), 179-197 (2007).
- Vander Worp, H. B., van Gijn, J. Clinical Practice. Acute ischemic stroke. The New England Journal of Medicine. 357 (6), 572-579 (2007).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Hochrainer, K., Yang, W. Stroke proteomics: from discovery to diagnostic and therapeutic applications. Circulation Research. 130 (8), 1145-1166 (2022).
- Wang, L. V., Yao, J. A practical guide to photoacoustic tomography in the life sciences. Nature Methods. 13 (8), 627-638 (2016).
- Aldrich, J. E. Basic physics of ultrasound imaging. Critical Care Medicine. 35 (5), S131-S137 (2007).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37-R61 (2013).
- Li, M., Tang, Y., Yao, J. Photoacoustic tomography of blood oxygenation: a mini review. Photoacoustics. 10, 65-73 (2018).
- Menozzi, L., Yang, W., Feng, W., Yao, J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke. Frontiers in Neuroscience. 16, 1055552 (2022).
- Gessner, R. C., Frederick, C. B., Foster, F. S., Dayton, P. A. Acoustic angiography: a new imaging modality for assessing microvasculature architecture. International Journal of Biomedical Imaging. 2013, 936593 (2013).
- Dayton, P. A., Rychak, J. J. Molecular ultrasound imaging using microbubble contrast agents. Frontiers in Bioscience. 12, 5124-5142 (2007).
- Isayama, K., Pitts, L. H., Nishimura, M. C. Evaluation of 2, 3, 5-triphenyitetrazolium chloride staining to delineate rat brain infarcts. Stroke. 22 (11), 1394-1398 (1991).
- Ruan, J., Yao, Y. Behavioral tests in rodent models of stroke. Brain Hemorrhages. 1 (4), 171-184 (2020).
- Parthasarathy, A. B., Kazmi, S. M. S., Dunn, A. K. Quantitative imaging of ischemic stroke through thinned skull in mice with Multi Exposure Speckle Imaging. Biomedical Optics Express. 1 (1), 246-259 (2010).
- Hingot, V., et al. Early ultrafast ultrasound imaging of cerebral perfusion correlates with ischemic stroke outcomes and responses to treatment in mice. Theranostics. 10 (17), 7480-7491 (2020).
- Menozzi, L., et al. Three-dimensional non-invasive brain imaging of ischemic stroke by integrated photoacoustic, ultrasound and angiographic tomography (PAUSAT). Photoacoustics. 29, 100444 (2022).
- Llovera, G., Roth, S., Plesnila, N., Veltkamp, R., Liesz, A. Modeling stroke in mice: permanent coagulation of the distal middle cerebral artery. Journal of Visualized Experiments. (89), e51729 (2014).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Labat-Gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. Journal of Visualized Experiments. (76), e50370 (2013).
- Matsumoto, Y., et al. Visualising peripheral arterioles and venules through high-resolution and large-area photoacoustic imaging. Scientific Reports. 8 (1), 14930 (2018).
- Xu, Y., Wang, L. V., Ambartsoumian, G., Kuchment, P. Reconstructions in limited-view thermoacoustic tomography. Medical Physics. 31 (4), 724-733 (2004).
- Yal Tang, ., et al. High-fidelity deep functional photoacoustic tomography enhanced by virtual point sources. Photoacoustics. 29, 100450 (2023).
- Zheng, W., Huang, C., Zhang, H., Xia, J. Slit-based photoacoustic tomography with co-planar light illumination and acoustic detection for high-resolution vascular imaging in human using a linear transducer array. Biomedical Engineering Letters. 12 (2), 125-133 (2022).
- Wang, Y., et al. Slit-enabled linear-array photoacoustic tomography with near isotropic spatial resolution in three dimensions. Optics Letters. 41 (1), 127-130 (2016).
- Vu, T., Li, M., Humayun, H., Zhou, Y., Yao, J. A generative adversarial network for artifact removal in photoacoustic computed tomography with a linear-array transducer. Experimental Biology and Medicine. 245 (7), 597-605 (2020).
- Zhang, H., et al. Deep-E: A fully-dense neural network for improving the elevation resolution in linear-array-based photoacoustic tomography. IEEE Transactions on Medical Imaging. 41 (5), 1279-1288 (2022).
- Hauptmann, A., et al. Model-based learning for accelerated, limited-view 3-D photoacoustic tomography. IEEE Transactions on Medical Imaging. 37 (6), 1382-1393 (2018).
- Li, M., et al. Three-dimensional deep-tissue functional and molecular imaging by integrated photoacoustic, ultrasound, and angiographic tomography (PAUSAT). IEEE Transactions on Medical Imaging. 41 (10), 2704-2714 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved