É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fotoacústica, Ultrassonografia e Angiotomografia Integradas (PAUSAT) para Imagem Não Invasiva do Cérebro Inteiro do Acidente Vascular Cerebral Isquêmico
Neste Artigo
Resumo
Este trabalho demonstra o uso de uma plataforma multimodal de imagem baseada em ultrassom para imagens não invasivas de acidente vascular cerebral isquêmico. Este sistema permite a quantificação da oxigenação sanguínea através de imagens fotoacústicas e a perfusão prejudicada no cérebro através da angiografia acústica.
Resumo
Apresentamos aqui um estudo experimental de AVC isquêmico usando nosso recém-desenvolvido sistema de imagem não invasivo que integra três tecnologias de imagem baseadas em acústica: fotoacústica, ultrassom e angiotomografia angiográfica (PAUSAT). A combinação dessas três modalidades ajuda a adquirir tomografia fotoacústica (TAP) multiespectral da oxigenação sanguínea cerebral, ultrassom de alta frequência do tecido cerebral e angiografia acústica da perfusão sanguínea cerebral. A plataforma de imagem multimodal permite o estudo das alterações de perfusão e oxigenação cerebral em todo o cérebro de camundongos após o AVC. Dois modelos de acidente vascular cerebral isquêmico comumente utilizados foram avaliados: o modelo de oclusão permanente da artéria cerebral média (pMCAO) e o modelo fototrombótico (TP). O PAUSAT foi usado para obter imagens dos mesmos cérebros de camundongos antes e depois de um AVC e analisar quantitativamente ambos os modelos de AVC. Esse sistema de imagem foi capaz de mostrar claramente as alterações vasculares cerebrais após o AVC isquêmico, incluindo redução significativa da perfusão sanguínea e da oxigenação na região do infarto do AVC (ipsilateral) em comparação com o tecido não lesado (contralateral). Os resultados foram confirmados por meio de imagens de contraste speckle a laser e pela coloração de cloreto de trifeniltetrazólio (TTC). Além disso, o volume de infarto sistólico em ambos os modelos de AVC foi medido e validado pela coloração TTC como a verdade fundamental. Através deste estudo, demonstramos que o PAUSAT pode ser uma ferramenta poderosa em estudos pré-clínicos não invasivos e longitudinais de acidente vascular cerebral isquêmico.
Introdução
O sangue transporta oxigênio (através da proteína da hemoglobina) e outros nutrientes importantes para os tecidos do nosso corpo. Quando o fluxo de sangue através dos tecidos é interrompido (isquemia), danos graves aos tecidos podem ocorrer, cujos efeitos mais imediatos são devidos à falta de oxigênio (hipóxia). O acidente vascular cerebral isquêmico é o resultado da interrupção do fluxo sanguíneo para uma determinada região do cérebro. O dano cerebral resultante de um acidente vascular cerebral isquêmico pode ocorrer em poucos minutos após o bloqueio do vaso e, muitas vezes, pode ter efeitos debilitantes e duradouros 1,2. Uma estratégia de grande valor para avaliar a fisiopatologia após AVC isquêmico e identificar e testar novos tratamentos é o uso de modelos de pequenos animais em laboratório. Os tratamentos descobertos em laboratório visam ser traduzidos para uso clínico e melhorar a vida dos pacientes. No entanto, o uso de animais em pesquisas biomédicas precisa ser cuidadosamente avaliado de acordo com os princípios dos 3Rs de Russell e Burch: substituição, redução e refinamento3. O objetivo do componente de redução é reduzir o número de animais sem comprometer a coleta de dados. Com isso em mente, a possibilidade de avaliar longitudinalmente a evolução da lesão por meio de imagens não invasivas permite uma grande vantagem na redução do número de animais necessários, bem como na maximização das informações obtidas de cadaanimal4.
A tomografia fotoacústica (TAP) é uma modalidade de imagem híbrida que combina contraste de absorção óptica com imagem de ultrassom de resoluçãoespacial5. O mecanismo de imagem do PAT é o seguinte. Um pulso de laser de excitação é iluminado no alvo que está sendo fotografado. Supondo que o alvo absorva luz no comprimento de onda do laser de excitação, ele aumentará de temperatura. Este rápido aumento da temperatura resulta em uma expansão termoelástica do alvo. A expansão faz com que uma onda de ultrassom se propague para fora do alvo. Ao detectar a onda de ultrassom em muitas posições, o tempo necessário para que a onda se propague do alvo para os detectores pode ser usado para criar uma imagem através de um algoritmo de reconstrução. A capacidade do PAT em detectar absorção óptica em regiões teciduais profundas diferencia o PAT do ultrassom, que detecta limites de diferentes impedâncias acústicas dostecidos5. Nos espectros do visível e do infravermelho próximo, as principais biomoléculas altamente absorventes e abundantes nos organismos são a hemoglobina, os lipídios, a melanina e a água7. De particular interesse no estudo do acidente vascular cerebral é a hemoglobina. Como a oxihemoglobina e a desoxihemoglobina têm espectros ópticos de absorção diferentes, o PAT pode ser usado com comprimentos de onda de laser de excitação múltipla para determinar a concentração relativa dos dois estados da proteína. Isso permite quantificar a saturação de oxigênio da hemoglobina (sO2), ou oxigenação sanguínea, dentro e fora da região do infarto 8,9. Esta é uma medida importante no AVC isquêmico, pois pode indicar o nível de oxigênio no tecido cerebral danificado após isquemia.
A angiografia acústica (AA) é um método de imagem ultrassonográfico com contraste que é particularmente útil para obter imagens da morfologia da vasculatura in vivo10. O método baseia-se no uso de um transdutor wobbler de elemento duplo (um elemento de baixa frequência e um elemento de alta frequência) em conjunto com microbolhas injetadas no sistema circulatório do sujeito da imagem. O elemento de baixa frequência do transdutor é usado para transmitir na frequência ressonante das microbolhas (por exemplo, 2 MHz), enquanto o elemento de alta frequência é usado para receber os sinais super harmônicos das microbolhas (por exemplo, 26 MHz). Quando excitadas em uma frequência ressonante, as microbolhas têm uma forte resposta não linear, resultando na produção de sinais superharmônicos que os tecidos corporais circundantes não produzem11. Ao receber com um elemento de alta frequência, isso garante que apenas os sinais de microbolhas sejam detectados. Como as microbolhas estão confinadas aos vasos sanguíneos, o resultado é uma imagem angiográfica da morfologia dos vasos sanguíneos. O AA é um método poderoso para a obtenção de imagens de acidente vascular cerebral isquêmico, pois as microbolhas que fluem através do sistema circulatório não são capazes de fluir através dos vasos bloqueados. Isso permite que o AA detecte regiões do cérebro que não são perfundidas devido ao AVC isquêmico, o que indica a região do infarto.
A pesquisa pré-clínica do AVC isquêmico geralmente se baseia no uso de histologia e testes comportamentais para avaliar a localização e a gravidade do AVC. A coloração com cloreto de trifeniltetrazólio (TTC) é uma análise histológica comum usada para determinar o volume do infarto sistólico. No entanto, só pode ser utilizada em um ponto final, pois requer a eutanásiado animal 12. Testes comportamentais podem ser usados para determinar o comprometimento da função motora em múltiplos momentos, mas não podem fornecer valores anatômicos ou fisiológicos quantitativos13. A imagem biomédica fornece uma abordagem mais quantitativa para estudar os efeitos do AVC isquêmico de forma não invasiva e longitudinal 9,14,15. No entanto, as tecnologias de imagem existentes (como a ressonância magnética [RM] de pequenos animais) podem ter um alto custo, ser incapazes de fornecer informações estruturais e funcionais simultâneas ou ter profundidade de penetração limitada (como a maioria das técnicas de imagem óptica).
Aqui, combinamos fotoacústica, ultrassonografia e angiotomografia (PAUSAT; ver diagrama do sistema na Figura 1), que permite informações estruturais e funcionais complementares da perfusão e oxigenação sanguínea após acidente vascular cerebral isquêmico16. Esses são dois aspectos importantes na avaliação da gravidade da lesão e no monitoramento da recuperação ou resposta aos tratamentos. O uso desses métodos integrados de imagem pode aumentar a quantidade de informações obtidas por cada animal, reduzindo o número de animais necessários e fornecendo mais informações no estudo de possíveis tratamentos para AVC isquêmico.
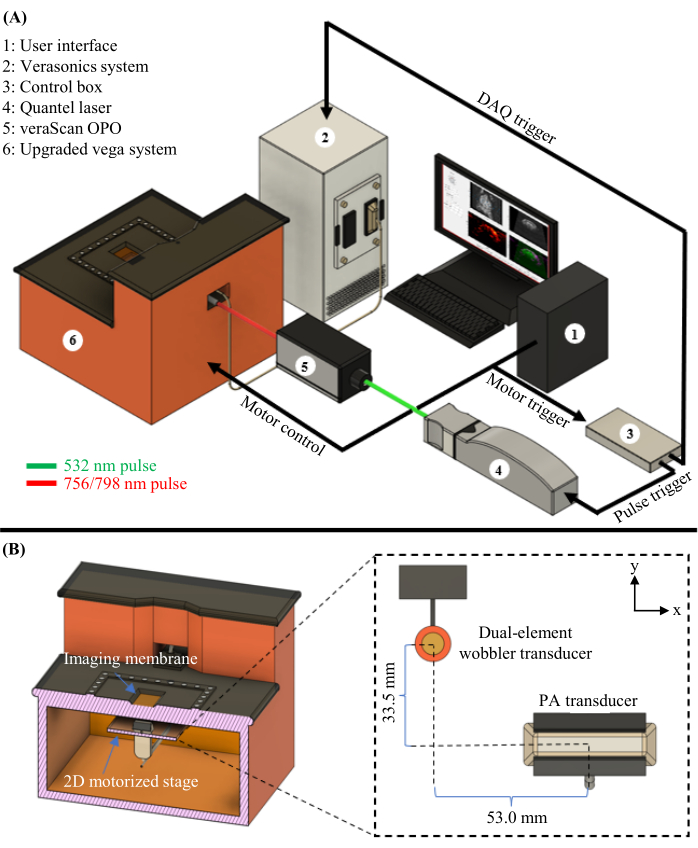
Figura 1: Diagrama PAUSOT. (A) Esquema completo do sistema PAUSOT, incluindo o laser e o OPO utilizados para PAT. (B) Vista interna do sistema PAUSAT, incluindo dois transdutores de ultrassom. O transdutor wobbler de elemento duplo é usado para ultrassom modo B e AA, e o transdutor de arranjo linear é usado para PAT. Ambos os transdutores são montados no mesmo estágio motorizado 2D, permitindo a varredura para gerar dados volumétricos. Este número foi modificado de16. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os procedimentos com animais foram aprovados pelo Comitê de Cuidados e Uso de Animais do Duke University Medical Center e foram conduzidos de acordo com a Política de Cuidados Humanizados e Uso de Animais de Laboratório do Serviço de Saúde Pública dos Estados Unidos. Camundongos C57BL/6J machos e fêmeas (ver Tabela de Materiais) foram usados para esses estudos. Um mínimo de três animais foram fotografados por grupo modelo de AVC. Consulte a Figura 2 para obter o fluxo de trabalho seguido neste protocolo.
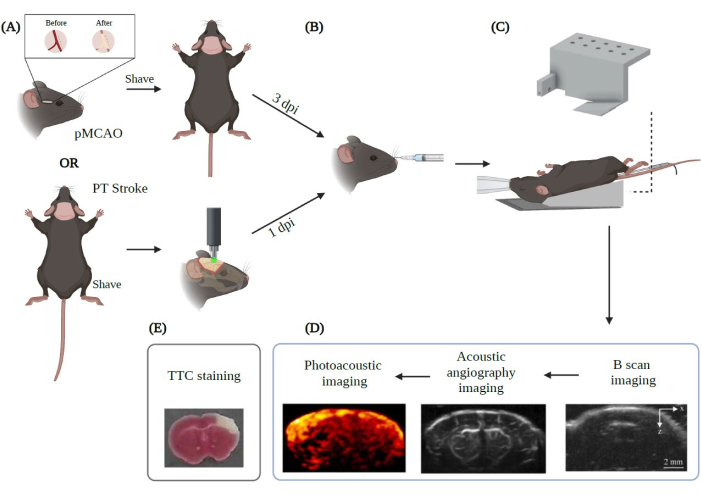
Figura 2: Resumo do procedimento experimental de imagem PAUSAT aplicado ao acidente vascular cerebral. Criado com Biorender.com. A figura mostra o fluxo de trabalho do procedimento de imagem a partir de (A) os dois principais modelos de AVC (pMCAO e TP). (B) Uma injeção retro-orbital das microbolhas deve ser realizada antes do posicionamento do animal na membrana PAUSAT. (C) Uma máscara que forneça anestesia contínua e uma almofada de aquecimento para manter a temperatura corporal do animal estável são necessárias nesta instalação. O corpo do animal é colocado na almofada de aquecimento enquanto a cabeça repousa sobre a membrana do sistema. (D) A ordem de aquisição das imagens também é apresentada na figura. (E) A coloração TTC é realizada para validar nossos resultados neste estudo. IPS: dias pós-lesão. Clique aqui para ver uma versão maior desta figura.
1. Induzindo o modelo de mouse de curso
- Oclusão permanente da artéria cerebral média (OAp) com ligadura da artéria carótida comum (ACC).
OBS: Resumidamente, realizar ligadura permanente da ACC direita e posterior eletrocauterização da artéria cerebral média (ACM) direita17. Esse procedimento limita o fluxo sanguíneo cerebral no córtex direito do cérebro, causando um acidente vascular cerebral isquêmico18.- Induzir anestesia em câmara de indução com mistura inalatória de isoflurano a 5,0% em 30% O 2/70% N2 até perda de consciência (reconhecida como perda do reflexo pedal).
- Intubar o animal com cateter de 20 G (Tabela de Materiais) e conectá-lo a um ventilador automático. Definir o fluxo com base no peso corporal do animal e mantê-lo anestesiado com isoflurano a 1,5%-2,0% em 30% Ø2/70%N2.
- Usando uma lâmpada de aquecimento e uma sonda retal conectada a um dispositivo controlador de temperatura, mantenha a temperatura corporal do animal em 37 °C.
- Coloque uma gota de pomada lubrificante nos olhos do rato.
- Coloque o animal em decúbito dorsal e retire os pelos da região do pescoço usando um aparador de pelos.
- Limpe a área da pele usando primeiro um cotonete com iodopovidona e, em seguida, usando uma almofada estéril com etanol 70%. Realize isso três vezes.
- Verificar a profundidade da anestesia e a ausência de dor pinçando levemente a pata posterior do animal.
- Realizar incisão sagital de 0,8 cm na linha média do pescoço e expor a ACC direita.
- Preparar uma sutura para a ligadura CCA dissociando uma sutura de seda 4-0 em fios mais finos que compõem o fio principal. Use um comprimento de 1,5 cm de um dos subroscos para ligar permanentemente o CCA.
NOTA: Depois de apertar o nó, remova o excesso de rosca cortando a extensão a uma distância de 1-2 mm para o nó. - Aplique uma gota de bupivacaína antes de fechar a ferida.
- Feche a incisão usando suturas cirúrgicas de seda 4-0 interrompidas e aplique pomada antibiótica tripla na superfície para prevenir infecção.
- Mova o mouse para expor o lado lateral direito do corpo do animal.
-
Retire os pelos na região entre a orelha e a área dos olhos usando um aparador de cabelo.
-
Desinfetar a área cirúrgica com um cotonete com iodopovidona, seguido de uma almofada estéril com etanol 70%. Repita esta etapa três vezes.
-
Coloque um pano estéril para fixar a área cirúrgica. Em seguida, faça uma incisão de 0,5 cm entre o olho direito e a orelha do animal, expondo a articulação entre o crânio e o músculo temporal.
- Usando uma alça de cautério, cauterizar o músculo para separá-lo do crânio e expor a área da ACM.
- Perfurar uma janela de 0,2 mm2 para expor a ACM usando uma furadeira elétrica e usar eletrocautério na ACM para ocluir o fluxo sanguíneo.
OBS: Um único pulso a 80% de intensidade de potência é suficiente para cauterizar a ACM. - Com seringa de 1mL acoplada a agulha 27G, aplicar uma gota de bupivacaína (Tabela de Materiais) no sítio cirúrgico.
- Fechar a incisão da pele usando pontos monofilamentares transparentes 6-0 interrompidos e aplicar pomada antibiótica tripla na superfície para prevenir infecção.
- Após a conclusão da cirurgia, transferir o animal para uma incubadora com temperatura controlada (32 °C) e permitir que o animal se recupere.
- Após 2 h, transfira o animal para sua gaiola de origem e forneça comida e água ad libitum.
- Acidente vascular cerebral fototrombótico (AVC TP)
NOTA: Resumidamente, o AVC PT é realizado iluminando a Rosa Bengala dentro dos vasos no cérebro. A Rosa Bengala é administrada por via intraperitoneal e, uma vez bem distribuída pelo corpo (5 min), é iluminada por uma luz verde fria, que ativa a Rosa Bengala para gerar espécies reativas de oxigênio (EROs). Essas ERO danificam a membrana das células endoteliais, criando trombos em toda a área iluminada e levando à interrupção do fluxo sanguíneo cerebral local19.- Induzir anestesia em câmara de indução com mistura inalatória de isoflurano a 5,0% em 30% O 2/70% N2 até perda de consciência (reconhecida como perda do reflexo pedal).
- Ajuste o animal a uma armação estereotáxica, mantendo-o anestesiado com máscara e isoflurano a 1,5%-2,0% em 30% O 2/70% N2.
- Manter o animal a 37 °C usando um aquecedor de recirculação de água quente e uma sonda retal para medir a temperatura corporal do animal.
- Coloque uma gota de pomada lubrificante nos olhos do rato.
- Faça a barba da cabeça do animal usando um aparador de pelos.
- Limpe a área do couro cabeludo raspada três vezes, primeiro usando um cotonete com iodopovidona e, em seguida, usando uma almofada estéril com etanol 70%.
- Verificar a ausência de dor pinçando levemente a pata posterior do animal.
- Faça uma incisão sagital de 1,4 cm na linha média do couro cabeludo usando um bisturi e exponha o crânio.
- Usando um lápis afiado, marque a 1,5 mm do bregma em direção ao lado direito.
- Coloque um orifício circular de 2,5 mm de diâmetro centrado na marca de 1,5 mm.
NOTA: Um quadrado contendo um orifício circular pode ser feito usando fita preta de dupla face e fazendo uma abertura de 2,5 mm de diâmetro no centro usando uma ferramenta de perfuração de furo único do tamanho mencionado. - Coloque a luz verde fria no orifício circular, mantendo o espaço entre a luz e o orifício ao mínimo.
- Cubra a área usando papel alumínio para evitar a propagação da luz.
- Uma vez pronto o setup, injetar o animal por via intraperitoneal com 10 mg/kg de Rosa Bengala (10 mg/mL em solução salina tamponada com fosfato [PBS] 1x) e aguardar 5 min.
- Após 5 min, ligue a fonte de luz fria (intensidade: 4,25) e mantenha a exposição por 15 min.
- Em seguida, desligue a luz fria e verifique o curso a olho nu (espera-se que a área seja mais branca do que a área circundante) ou usando dispositivos externos para medir o fluxo sanguíneo cerebral (por exemplo, usando imagens de contraste pontilhado a laser (Tabela de Materiais; ver passo 5.1).
- Com seringa de 1mL acoplada a agulha 27G, aplicar uma gota de bupivacaína (Tabela de Materiais) no sítio cirúrgico.
- Fechar a incisão da pele usando pontos monofilamentares transparentes 6-0 interrompidos e aplicar pomada antibiótica tripla na superfície para prevenir infecção.
- Após a conclusão da cirurgia, transferir o animal para uma incubadora com temperatura controlada (32 °C) e permitir que o animal se recupere.
- Após 2 h, transfira o animal para sua gaiola de origem e forneça comida e água ad libitum.
2. Preparando o PAUSAT para exames de imagem
- Ligue o laser de 532 nm e deixe-o ligado por 15 min para aquecer.
- Preparar a plataforma de imagem para o animal anestesiado.
- Coloque uma rampa personalizada (Figura 2C) conectada ao estágio ajustável manualmente (Tabela de Materiais) ao lado da membrana de imagem.
- Conecte um suporte de dente do mouse com o tubo de respiração conectado à rampa personalizada e fixe uma almofada de aquecimento na superfície da rampa.
- Depois que o laser aquecer, verifique se o caminho do laser e o acoplamento no feixe de fibras estão bem alinhados usando um cartão detector de infravermelho próximo (Tabela de Materiais), colocando o cartão na frente da entrada do feixe de fibras e garantindo que a luz laser entre no feixe.
NOTA: Ajuste quaisquer espelhos de caminho do laser conforme necessário para garantir que a entrada do laser esteja centralizada com a entrada do feixe de fibras.
3. Preparar o animal para o PAUSAT
NOTA: O PAUSAT é realizado 1 dia após a cirurgia de AVC PT ou 3 dias após a cirurgia pMCAO. A preparação do PAUSAT para aquisição de imagens (passo 2) demora cerca de 20 minutos e deve ser feita imediatamente antes de preparar o animal para o PAUSAT.
- Induzir anestesia em câmara de indução utilizando uma mistura inalatória de isoflurano a 5% misturado com 30% O 2/70% N2 até perda de consciência (reconhecida como perda do reflexo pedal).
- Transferir o animal para uma plataforma aquecida com porta-dentes e máscara e manter a anestesia a 1,5%-2,0% de isoflurano em 30% O 2/70% N2.
- Use uma lâmpada de aquecimento e uma sonda retal conectada a um dispositivo controlador de temperatura para manter a temperatura corporal do animal em 37 °C.
- Corte o pelo no topo da cabeça do animal usando um barbeador elétrico. Inclua a região de perto dos olhos até atrás das orelhas.
- Faça a barba no topo da cabeça do animal aplicando um creme depilatório comercial para remover completamente os pelos curtos restantes. Deixe na pele por 5-6 min, em seguida, limpe usando um cotonete embebido em água para ajudar a remover totalmente o creme. Repita até que a pele esteja limpa de pelos.
NOTA: Para exames de imagem 1 dia após a cirurgia, estas etapas podem ser realizadas antes de iniciar a cirurgia; em 1 dia após o AVC TP, eles podem ser omitidos. Quando a aquisição da imagem PAUSAT é realizada vários dias após a cirurgia, esta etapa é criticamente necessária para ser realizada. - Uma vez que o animal e o sistema estejam prontos para a aquisição de imagens, e imediatamente antes de transferir o animal para a plataforma do sistema, injete uma solução de 100 μL de microbolhas na concentração de estoque (Tabela de Materiais) retro-orbitalmente usando uma agulha de 27 G.
NOTA: Uma vez que as bolhas estão em circulação na corrente sanguínea, há uma quantidade limitada de tempo para a imagem sem uma perda significativa de sinal (~10 min). - Coloque uma gota de loção protetora ocular nos olhos do rato.
OBS: Não é recomendado aplicar lubrificante ocular até que seja realizada a injeção retro-orbital para evitar que substâncias estranhas atinjam a corrente sanguínea do animal. Por isso, a aplicação do creme depilatório deve ser realizada de forma lenta e cuidadosa para evitar ficar muito perto dos olhos (mas o suficiente para expor a região de interesse onde o AVC é esperado). A depilação do creme é realizada com um cotonete previamente mergulhado na água, evitando que o creme escorra, o que pode danificar os olhos.
4. Imagem PAUSAT
NOTA: Isso é feito para obter imagens das regiões contra- e ipsi-laterais do cérebro após o acidente vascular cerebral
- Transfira o mouse para a plataforma de imagem integrada PAUSAT (Table of Materials), colocando-o em decúbito dorsal sobre a rampa personalizada (Figura 2C).
- Preencha a janela de imagem com água destilada suficiente na superfície para acoplamento acústico.
NOTA: Uma rampa opcional - impressa usando uma impressora 3D - é recomendada para evitar que o corpo do animal fique molhado durante a aquisição da imagem e melhorar o conforto do animal. Também ajuda a manter uma temperatura corporal estável. Além disso, a rampa pode ser acoplada a um estágio manual (Tabela de Materiais) para ajustar a profundidade focal do transdutor oscilante de elemento duplo em relação à cabeça do mouse. O arquivo de design de rampa personalizado está disponível mediante solicitação aos autores. - Fixe a cabeça do rato no suporte de dentes e garanta a anestesia adequada e o fluxo de ar.
- Usando uma lâmpada de aquecimento e uma sonda retal conectada a um dispositivo controlador de temperatura, mantenha a temperatura corporal do animal em 37 °C.
- Abra o aplicativo de imagem (Tabela de Materiais) e navegue até o ultrassom modo B.
- Use a janela de ultrassom ao vivo para ajustar manualmente a cabeça do mouse para a posição desejada.
- Use a janela de ultrassom ao vivo para ajustar a altura do estágio, de modo que a profundidade focal do transdutor (19 mm) esteja aproximadamente no meio da área a ser fotografada.
- Imagem com ultrassom modo B
- Ajuste o valor da frequência de transmissão do ultrassom no modo B (para esses estudos, use 16 MHz).
- Insira as informações do diretório de salvamento no aplicativo de geração de imagens.
- Use a caixa flutuante para selecionar a região desejada para a varredura em modo B do cérebro.
- Pressione o botão Adquirir estático .
- Verifique os resultados da varredura no aplicativo assim que a aquisição da imagem for concluída para garantir que a região desejada tenha sido fotografada.
NOTA: Evite atrasos desnecessários na aquisição de imagens em modo B para garantir que uma concentração suficientemente alta de microbolhas permaneça na corrente sanguínea para o AA.
- Imagem com AA
- Retorne à aquisição de imagens.
- Mudança para o modo de Angiografia Acústica no aplicativo de imagem (Tabela de Materiais).
- Insira os parâmetros do protocolo de varredura desejado (o mais importante deles é o espaçamento entre quadros e o número de quadros por posição, que foi ajustado para 0,2 mm e 10, respectivamente, para esses estudos).
- Pressione o botão Adquirir estático .
NOTA: A aquisição do AA demora mais do que o ultrassom em modo B. - Depois que a varredura for concluída, verifique os resultados da varredura em Análise de imagem para garantir que a qualidade da imagem esteja conforme o esperado.
NOTA: Para o modo AA, um volume cerebral inteiro mais representativo pode ser adquirido repetindo uma segunda varredura em uma profundidade focal diferente dentro do cérebro e, posteriormente, recombinando as imagens com o pós-processamento adequado (veja a Figura 3).
- Imagem com tomografia fotoacústica
- Abra a aplicação do oscilador paramétrico óptico (OPO) (Tabela de Materiais) e configure-a para 756 nm.
NOTA: OPOs podem facilmente sair da calibração, portanto, antes do experimento, certifique-se de que o OPO seja calibrado corretamente usando um espectrômetro independente. - Converta manualmente o transdutor de matriz linear para as coordenadas determinadas anteriormente para garantir que os volumes de oscilação e os volumes de matriz linear sejam automaticamente co-registrados.
NOTA: É fundamental que um experimento de co-registro usando uma grade fantasma seja feito previamente para determinar a distância exata necessária para traduzir o estágio, de modo que os dados resultantes de ambos os transdutores sejam co-registrados em 3D. - Abra a aplicação do laser e ligue o laser de 532 nm.
- Usando um medidor de potência do laser, meça a energia da saída do laser e certifique-se de que é a energia desejada (~10 mJ por pulso foi usado para esses estudos).
- Selecione os parâmetros de digitalização desejados para o PAT (tamanho do passo de 0,4 mm, comprimento da varredura de 20 mm e média de 10 quadros por posição).
- Abra o programa MATLAB (Tabela de Materiais) do sistema de aquisição de dados de ultrassom e pressione o botão Executar .
- Adquira a verificação PAT pressionando o botão Iniciar .
- Quando a verificação estiver concluída, abra o programa de salvamento do MATLAB. Altere o nome de salvamento para o nome de arquivo desejado e pressione o botão Executar .
- Altere o comprimento de onda OPO para 798 nm e repita as etapas de 4.10.3 para 4.10.8.
NOTA: Para um estudo longitudinal, recomenda-se permitir que o animal se recupere, colocando-o em uma incubadora e sob observação por algumas horas (seguindo os passos 1.1.18 e 1.1.19). Se a validação dos resultados for desejada, continue para a seção 5 imediatamente após a aquisição de imagens PAUSAT.
- Abra a aplicação do oscilador paramétrico óptico (OPO) (Tabela de Materiais) e configure-a para 756 nm.
5. Opcional: Validação dos resultados
- Imagem de contraste pontilhado a laser (LSCI).
- Anestesiar o animal utilizando isoflurano a 1,5%-2,0% em 30% O 2/70% N2.
- Coloque o animal em uma armação estereotáxica, mantendo o animal anestesiado com máscara e a referida anestesia inalatória.
- Manter o animal a 37 °C usando um aquecedor de recirculação de água quente e uma sonda retal para medir a temperatura corporal do animal.
- Coloque uma gota de loção protetora ocular nos olhos do rato.
- Verificar a ausência de dor pinçando levemente a pata posterior do animal.
- Retire os pelos do couro cabeludo do animal usando um aparador de cabelo.
- Desinfetar a área cirúrgica com um cotonete com iodopovidona, seguido de uma almofada estéril com etanol 70%. Repita esta etapa três vezes.
- Faça uma incisão sagital de 1,4 mm na linha média do couro cabeludo e exponha o crânio. Use fórceps para segurar o couro cabeludo e evitar que ele ocupe a área do cérebro para escanear.
- Aplique algumas gotas de soro fisiológico no crânio e coloque o dispositivo de sistema de contraste de manchas a laser (Tabela de Materiais) sobre a cabeça do animal.
- No menu Arquivo , defina o dispositivo no modo Online, contido no submenu Modo de Trabalho.
- Selecione a pasta de armazenamento de imagem padrão no menu Arquivo e no submenu Salvar configurações .
- No menu Fonte de luz, conecte o laser guia ("Laser ligado") e a luz branca ("Luz branca acesa") para localizar a janela de imagem na posição correta.
- No menu Configuração , selecione Configurações de ampliação, mova o cursor manualmente para 2.5 e pressione Aplicar e OK para salvar as configurações.
- Ajuste o foco movendo manualmente a barra de foco localizada no submenu superior da página principal.
- No menu Configuração, selecione Configuração de limite de pseudocor, ajuste o limite conforme desejado e pressione Aplicar e OK para salvar as configurações.
- No menu Fonte de luz, desconecte o laser guia ("Laser desligado") e a luz branca ("Luz branca apagada") antes de capturar a imagem.
- Capture a imagem selecionando o símbolo Reproduzir no submenu superior da página principal.
- Coloração com cloreto de trifeniltetrazólio (TTC)
- Anestesiar profundamente o animal utilizando isoflurano a 5% em 30% O 2/70% N2.
- Assim que o animal parar de respirar, decapite-o com uma tesoura afiada.
- Remova toda a pele ao redor da cabeça e os músculos na área do pescoço.
- Faça um corte sagital na parte occipital do crânio até atingir o osso parietal.
- Faça um corte horizontal (~5 mm) no lado esquerdo e direito abaixo do vaso sanguíneo. Remova o osso occipital do crânio usando pinça reta.
- Faça um corte (~5 mm) na sutura frontonasal do crânio.
- Faça um corte sagital (~10-15 mm) na linha média do crânio - entre os hemisférios - e certifique-se de que eles estejam completamente separados.
- Usando tesouras curvas de tamanho #7, remova os ossos parietais esquerdo e direito do crânio do centro para os lados.
- Transfira o cérebro para um recipiente cheio de 5 mL de 1x PBS gelado e mantenha-o no gelo por 10 min.
- Transfira o cérebro para uma matriz cerebral de aço inoxidável (seções de 1 mm de espessura).
- Corte o cérebro em cortes coronais de 1 mm usando lâminas de barbear descartáveis (Tabela de Materiais).
- Segurando as lâminas ao lado, transfira para um recipiente cheio de 1x PBS gelado.
- Separe cuidadosamente as seções das lâminas, uma a uma.
- Transfira as fatias cerebrais para uma placa de Petri de 70 mm de diâmetro contendo 5 mL de TTC a 2% (Tabela de Materiais, 3) em 1x PBS.
- Incubar durante 15 minutos no escuro à temperatura ambiente (R/T).
- Após 15 min, descartar o TTC, substituí-lo por 3 mL de formalina e incubar no escuro por pelo menos 30 min a R/T.
- Finalmente, transfira as fatias cerebrais para um filme plástico transparente e digitalize as amostras, incluindo uma régua na imagem de varredura como referência para medições futuras.
Resultados
Imagem da morfologia dos vasos sanguíneos no cérebro
O AA gera imagens da morfologia dos vasos sanguíneos excitando microbolhas no sistema circulatório em sua frequência de ressonância e recebendo a resposta super harmônica das microbolhas. Usando a rampa personalizada (Figura 2C) acoplada a um estágio ajustável manualmente, podemos obter imagens do cérebro de camundongos com o modo AA em duas profundidades focais diferentes. Quando regiões mais profundas são ...
Discussão
Existem alguns aspectos vitais desse método que, se feito incorretamente, pode levar a uma diminuição significativa da qualidade da imagem e da análise quantitativa. O resultado mais comum de erro do usuário em imagens PAUSAT é a falta de sinal ou a intensidade do sinal muito baixa, que podem ocorrer por uma variedade de razões. Um desses motivos é um problema com o acoplamento acústico. Grandes bolhas de ar na água ao redor da cabeça do mouse durante a imagem muitas vezes podem bloquear o ultrassom de viajar ...
Divulgações
Os autores declaram a inexistência de conflitos de interesse neste trabalho.
Agradecimentos
Os autores gostariam de agradecer à equipe de engenharia da SonoVol Inc. Este trabalho foi parcialmente patrocinado pelo American Heart Association Collaborative Sciences Award (18CSA34080277), para J. Yao e W. Yang; Os Institutos Nacionais de Saúde dos Estados Unidos (NIH) concedem R21EB027981, R21 EB027304, RF1 NS115581 (BRAIN Initiative), R01 NS111039, R01 EB028143; O prêmio CAREER da National Science Foundation (NSF) dos Estados Unidos 2144788; o Chan Zuckerberg Initiative Grant (2020-226178), a J. Yao; e concede R21NS127163 e R01NS099590 do NIH a W. Yang.
Materiais
| Name | Company | Catalog Number | Comments |
| 20 GA catheter | BD Insyte Autoguard Winged | 381534 | For mouse intubation |
| 2,3,5-Triphenyltetrazolium chloride | Sigma | T8877 | Necessary for TTC-staining brain for validation |
| 532nm Laser | Quantel | Q-smart 850 | Laser used to pump the OPO for PAT |
| Automatic Ventilator Rovent Jr. | Kent Scientific | RV-JR | To keep mice under anesthesia during surgical procedure |
| Black braided silk 4-0 USP | Surgical Specialties | SP116 | Used for sutures on the neck for pMCAO surgery |
| Bupivacaine | Hospira | 0409-1159-18 | Used prior to closing wounds during surgical procedure |
| C57BL/6 Mice | Jackson Lab | #000664 | Mice used for studying ischemic stroke (2-6 month old male/female) |
| Clear suture | Ethicon | 8606 | Used for closing wound (PT stroke and pMCAO). A clear suture won't interfere with PAT |
| Cold Light LED | Schott | KL 1600 | Needed to create PT stroke |
| Disposable Razor Blade | Accutec Blades | 74-0002 | For sectioning mouse brain |
| Electric drill | JSDA | JD-700 | Used to expose MCA during pMCAO procedure |
| Electrocauterization tool | Wet-Field | Wet-Field Bipolar-RG | Stops blood flow after drilling during pMCAO procedure |
| Hair removal gel | Veet | 8282651 | Used to remove hair from mouse prior to imaging |
| High Temperature Cautery Loop Tip | BOVIE Medical Corporation | REF AA03 | Used to avoid bleeding when separating the temporal muscle from the skull |
| IR Detector Card | Thorlabs | VRC5 | Used to ensure light path is aligned |
| Laser Power Meter | Ophir | StarBright, P/N 7Z01580 | Can be used to calibrate the laser energy prior to imaging |
| Laser Speckle Imaging System | RWD Life Science Co. | RFLSI-III | Can be used to validate stroke surgery success |
| Lubricant Eye Ointment | Soothe | AB31336 | Can be used to avoid drying of the eyes |
| Manually adjustable stage | Thorlabs | L490 | Used with custom ramp for multiple focal depth AA imaging |
| Modified Vega Imaging System | Perkin Elmer | LLA00061 | System containing both B-mode/AA and PAT transducers |
| Optical Parametric Oscillator | Quantel | versaScan-L532 | Allows for tuning of excitation wavelength in a large range |
| Programmable Ultrasound System | Verasonics | Vantage 256 | Used for PAT part of system |
| Rose Bengal | Sigma | 330000 | Necessary to induce PT stroke |
| Suture | LOOK | SP116 | Used for permanent ligation of CCA |
| Temperature Contoller | Physitemp | TCAT-2 | Used to maintain stable body temperature of mice during procedures |
| VesselVue Microbubbles | Perkin Elmer | P-4007001 | Used for acoustic angiography (2.43 × 10^9 microbubbles/mL) |
Referências
- Durukan, A., Tatlisumak, T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia. Pharmacology Biochemistry and Behavior. 87 (1), 179-197 (2007).
- Vander Worp, H. B., van Gijn, J. Clinical Practice. Acute ischemic stroke. The New England Journal of Medicine. 357 (6), 572-579 (2007).
- Tannenbaum, J., Bennett, B. T. Russell and Burch's 3Rs then and now: the need for clarity in definition and purpose. Journal of the American Association for Laboratory Animal Science. 54 (2), 120-132 (2015).
- Hochrainer, K., Yang, W. Stroke proteomics: from discovery to diagnostic and therapeutic applications. Circulation Research. 130 (8), 1145-1166 (2022).
- Wang, L. V., Yao, J. A practical guide to photoacoustic tomography in the life sciences. Nature Methods. 13 (8), 627-638 (2016).
- Aldrich, J. E. Basic physics of ultrasound imaging. Critical Care Medicine. 35 (5), S131-S137 (2007).
- Jacques, S. L. Optical properties of biological tissues: a review. Physics in Medicine and Biology. 58 (11), R37-R61 (2013).
- Li, M., Tang, Y., Yao, J. Photoacoustic tomography of blood oxygenation: a mini review. Photoacoustics. 10, 65-73 (2018).
- Menozzi, L., Yang, W., Feng, W., Yao, J. Sound out the impaired perfusion: Photoacoustic imaging in preclinical ischemic stroke. Frontiers in Neuroscience. 16, 1055552 (2022).
- Gessner, R. C., Frederick, C. B., Foster, F. S., Dayton, P. A. Acoustic angiography: a new imaging modality for assessing microvasculature architecture. International Journal of Biomedical Imaging. 2013, 936593 (2013).
- Dayton, P. A., Rychak, J. J. Molecular ultrasound imaging using microbubble contrast agents. Frontiers in Bioscience. 12, 5124-5142 (2007).
- Isayama, K., Pitts, L. H., Nishimura, M. C. Evaluation of 2, 3, 5-triphenyitetrazolium chloride staining to delineate rat brain infarcts. Stroke. 22 (11), 1394-1398 (1991).
- Ruan, J., Yao, Y. Behavioral tests in rodent models of stroke. Brain Hemorrhages. 1 (4), 171-184 (2020).
- Parthasarathy, A. B., Kazmi, S. M. S., Dunn, A. K. Quantitative imaging of ischemic stroke through thinned skull in mice with Multi Exposure Speckle Imaging. Biomedical Optics Express. 1 (1), 246-259 (2010).
- Hingot, V., et al. Early ultrafast ultrasound imaging of cerebral perfusion correlates with ischemic stroke outcomes and responses to treatment in mice. Theranostics. 10 (17), 7480-7491 (2020).
- Menozzi, L., et al. Three-dimensional non-invasive brain imaging of ischemic stroke by integrated photoacoustic, ultrasound and angiographic tomography (PAUSAT). Photoacoustics. 29, 100444 (2022).
- Llovera, G., Roth, S., Plesnila, N., Veltkamp, R., Liesz, A. Modeling stroke in mice: permanent coagulation of the distal middle cerebral artery. Journal of Visualized Experiments. (89), e51729 (2014).
- Trotman-Lucas, M., Kelly, M. E., Janus, J., Fern, R., Gibson, C. L. An alternative surgical approach reduces variability following filament induction of experimental stroke in mice. Disease Models & Mechanisms. 10 (7), 931-938 (2017).
- Labat-Gest, V., Tomasi, S. Photothrombotic ischemia: a minimally invasive and reproducible photochemical cortical lesion model for mouse stroke studies. Journal of Visualized Experiments. (76), e50370 (2013).
- Matsumoto, Y., et al. Visualising peripheral arterioles and venules through high-resolution and large-area photoacoustic imaging. Scientific Reports. 8 (1), 14930 (2018).
- Xu, Y., Wang, L. V., Ambartsoumian, G., Kuchment, P. Reconstructions in limited-view thermoacoustic tomography. Medical Physics. 31 (4), 724-733 (2004).
- Yal Tang, ., et al. High-fidelity deep functional photoacoustic tomography enhanced by virtual point sources. Photoacoustics. 29, 100450 (2023).
- Zheng, W., Huang, C., Zhang, H., Xia, J. Slit-based photoacoustic tomography with co-planar light illumination and acoustic detection for high-resolution vascular imaging in human using a linear transducer array. Biomedical Engineering Letters. 12 (2), 125-133 (2022).
- Wang, Y., et al. Slit-enabled linear-array photoacoustic tomography with near isotropic spatial resolution in three dimensions. Optics Letters. 41 (1), 127-130 (2016).
- Vu, T., Li, M., Humayun, H., Zhou, Y., Yao, J. A generative adversarial network for artifact removal in photoacoustic computed tomography with a linear-array transducer. Experimental Biology and Medicine. 245 (7), 597-605 (2020).
- Zhang, H., et al. Deep-E: A fully-dense neural network for improving the elevation resolution in linear-array-based photoacoustic tomography. IEEE Transactions on Medical Imaging. 41 (5), 1279-1288 (2022).
- Hauptmann, A., et al. Model-based learning for accelerated, limited-view 3-D photoacoustic tomography. IEEE Transactions on Medical Imaging. 37 (6), 1382-1393 (2018).
- Li, M., et al. Three-dimensional deep-tissue functional and molecular imaging by integrated photoacoustic, ultrasound, and angiographic tomography (PAUSAT). IEEE Transactions on Medical Imaging. 41 (10), 2704-2714 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados